一种基于水凝胶包裹单细胞的方法及产品和应用与流程
本发明涉及细胞界面工程技术领域,尤其涉及一种基于水凝胶包裹单细胞的方法及产品和应用。
背景技术:
细胞界面工程是利用细胞表面的各种特性,以生物、化学或物理学方法进行特定修饰、控制、功能化或者改变生物细胞的表面特征,从而改造细胞相应行为和功能的工程技术。
利用细胞界面工程的方法,可以将各种高分子聚合物或者纳米材料在各类细胞表面进行反应组装和包裹。目前已成功实现包裹的生物体有病毒、细菌、真菌、低等植物细胞、动物细胞、甚至多细胞生物。经材料的表面组装包裹后,生物体的表面活性、生物功能及对环境的适应性均发生了有益的改变。
单细胞包裹在许多微生物细胞上已经成功的得以实现,但其极端的反应条件不适合在哺乳动物细胞上进行应用,考虑到包裹后细胞的活性维持,一般采用水凝胶类的生物相容性材料,以及温和的成胶条件,可以实现哺乳动物细胞的单细胞包裹。
目前,研究比较多的主要有两类方法,即物理法和化学法。物理法一般是采用微加工成型技术如微滴形成技术,微流控技术,微模板技术,同轴流电喷射技术等,直接形成包裹有单个细胞的水凝胶微球。化学法则是利用细胞表面丰富的活性基团或通过可插入细胞膜的连接分子在细胞表面引入可反应的其他分子,进行细胞表面的原位成胶反应,形成单个细胞的水凝胶包裹。
哺乳动物细胞经包裹后,由于水凝胶类材料的半渗透特性,可以与环境进行物质交换,维持细胞活性,同时屏蔽外界生物大分子的干扰,从而避免免疫排斥作用,在细胞移植中具有重要意义。
水凝胶类材料根据来源的不同,成胶的方法有很多,相比于物理法和化学法的成胶方式,生物酶法催化形成水凝胶,反应条件更温和,几乎没有毒性,且生物相容性好,有利于在生物医学领域的应用,也得到了越来越多的关注。
另外,随着干细胞技术的发展,材料与干细胞的结合可以解决细胞活性保持,微环境调节,干细胞移植等诸多方面存在的问题,对干细胞的单包裹成为技术和应用的需要,在干细胞培养,干细胞治疗,组织工程,再生医学领域具有重要的价值和意义。
技术实现要素:
本发明提供了一种基于水凝胶包裹单细胞的方法及产品和应用,该方法能够在单个细胞的外周有效包裹水凝胶,实现单细胞的包裹,从而构建一种水凝胶包裹的细胞体系,用于制备细胞药物。
一种基于水凝胶包裹单细胞的方法,包括:
(1)以油酸、乙二胺和聚唾液酸为原料,经两步酰胺化反应,合成得到化合物i;
(2)以所述化合物i和谷氨酰胺转氨酶为原料,经酰胺化反应,得到化合物ii;
(3)取细胞悬浮液,向其中加入化合物ii,进行反应,反应完成后,分离得到表面锚定有化合物ii的细胞体系;
(4)向步骤(3)所述细胞体系中加入类细胞外基质水凝胶溶液,经酰胺化反应后,分离得到表面被水凝胶包裹的单细胞。
谷氨酰胺转氨酶(tg)可以催化含有谷氨酰胺和赖氨酸的材料交联形成水凝胶;将酶分子通过连接分子引入到细胞上,即可进行细胞表面的原位催化反应,形成单细胞的水凝胶包裹。
上述方法的原理示意图如图1所示;四步操作均在室温下进行。其中,化合物i(称为油酸-聚唾液酸,又称锚定分子,简称bam)的结构式,如式(1)所示:
步骤(1)中的两步酰胺化反应过程,如下所示:
其中,edci:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐;hobt:1-羟基苯并三唑;psa:聚唾液酸;tstu:2-琥珀酰亚胺基-1,1,3,3-四甲基脲四氟硼酸酯;se:琥珀酰亚胺酯;psa,se:聚唾液酸-琥珀酰亚胺酯;psa-oleicacid:聚唾液酸-油酸;psa-oleicacid,se:聚唾液酸-油酸-琥珀酰亚胺酯。
具体地,所述化合物i的分子量为40000~50000。
化合物i为生物相容性的细胞表面锚定分子,是模拟细胞膜相关分子的人工合成分子,在整个分子中,油酸链部分类似于细胞膜组分磷脂分子,可以自组装插入细胞膜,聚唾液酸链为连接部分,可以为谷氨酰胺转氨酶或其他功能分子提供连接位点。
步骤(2)中,所述化合物i与谷氨酰胺转氨酶的摩尔比为1:1。该步反应在室温下进行,反应结束后,经超滤、洗涤,得到化合物ii(称为油酸-聚唾液酸-谷氨酰胺转氨酶,又称细胞表面定点催化分子,简称bam-mtg)。
进一步地,所述谷氨酰胺转氨酶来源于链球菌。
作为优选,步骤(3)中,所述反应的时间为10~20min。
步骤(4)中采用的类细胞外基质水凝胶可以为明胶、胶原、peg或纤连蛋白;作为优选,所述的类细胞外基质水凝胶为明胶。
作为优选,步骤(4)中,所述酰胺化反应的时间为20~30min。
谷氨酰胺转氨酶催化明胶分子链交联形成水凝胶的原理,如下所示:
本发明方法不仅能够实现单细胞的水凝胶包裹;实验还发现,对于骨髓间充质干细胞而言,采用上述方法可以使水凝胶包裹后的骨髓间充质干细胞在缺氧缺血清的恶劣环境下维持活性而不凋亡。所以,作为优选,所述的细胞为骨髓间充质干细胞。本发明提供了一种基于水凝胶包裹骨髓间充质干细胞的方法以及表面包裹有水凝胶的骨髓间充质干细胞。
本发明还提供了一种所述方法制备的表面包裹有水凝胶的单细胞。
具体地,所述单细胞为骨髓间充质干细胞。
本发明还提供了所述单细胞在制备细胞药物中的应用;进一步地,提供了所述骨表面包裹有水凝胶的髓间充质干细胞在制备细胞药物中的应用。
进一步地,所述细胞药物为干细胞药物。
与现有技术相比,本发明具有以下有益效果:
(1)本发明方法先以油酸、乙二胺和聚唾液酸为原料制备类细胞磷脂的锚定分子,再在锚定分子上连接谷氨酰胺转氨酶,通过锚定分子将谷氨酰胺转氨酶锚定在细胞表面,并利用谷氨酰胺转氨酶催化形成水凝胶,获得表面被水凝胶包裹的单细胞,该单细胞可用于各类细胞药物的制备。
(2)本发明还发现对骨髓间充质干细胞上述水凝胶包裹,获得的表面被水凝胶包裹的单细胞具有较强的抗逆性,在缺氧缺血清的恶劣环境下能够维持活性而不凋亡,在干细胞的药物制备上具有很大的应用前景。
附图说明
图1为本发明基于水凝胶包裹单细胞的方法的原理示意图。
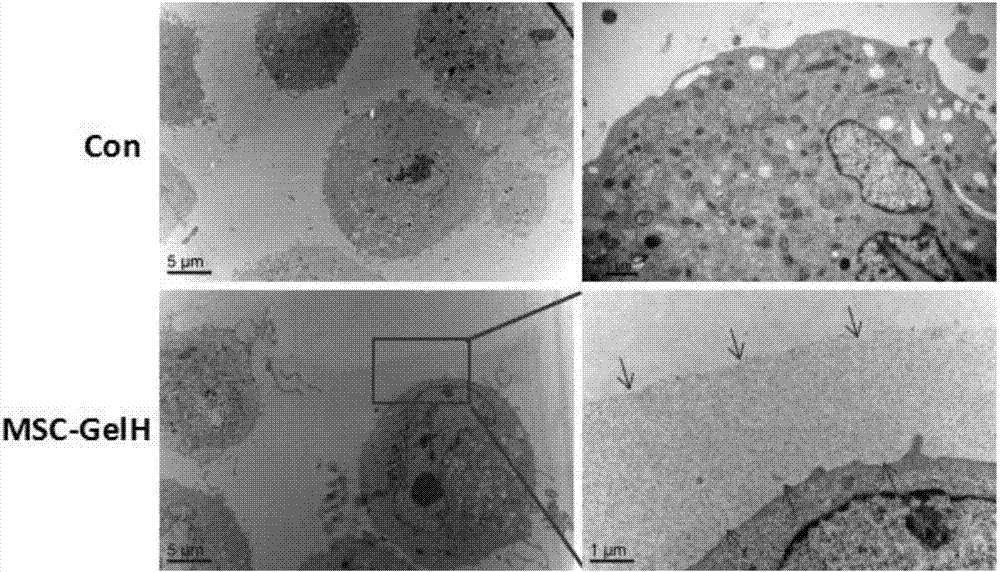
图2为实施例1中明胶水凝胶包裹骨髓间充质干细胞(mscs)的tem显微图;
其中,con为未经明胶水凝胶包裹的细胞表面无絮状物的对照组;msc-gelh为经明胶水凝胶包裹的细胞表面有絮状物的处理组。
图3为实施例1中明胶水凝胶(fitc标记)包裹的贴壁生长的骨髓间充质干细胞(mscs)激光共聚焦显微图(比例尺50μm);
其中,con为未经明胶水凝胶包裹的细胞表面无絮状物的对照组;msc-gelh为经明胶水凝胶包裹的细胞表面有絮状物的处理组;bf为明场下拍的图片,merge为明场和荧光图的叠加图片。
图4为实施例1中明胶水凝胶(fitc标记)包裹的贴壁生长的mscs激光共聚焦z轴扫描图。
图5为实施例2中明胶水凝胶包裹处理的msc细胞培养上清液用于huvec培养的管腔形成图(a)和定量统计图(b);
其中,con为对照组;msc-gelh为处理组。
图6为实施例2中明胶水凝胶包裹处理的msc细胞培养上清液用于心肌细胞在缺氧缺血清条件下培养的细胞凋亡荧光染色图(a)及定量统计图(b);
其中,con为对照组;msc-gelh为处理组。
图7为实施例3中明胶水凝胶包裹的贴壁生长的骨髓间充质干细胞(mscs)增殖能力统计图;
其中,con为对照组;msc-gelh为处理组。
图8为实施例3中明胶水凝胶包裹的骨髓间充质干细胞(mscs)管腔形成图(a)及定量统计图(b);
其中,con为对照组;msc-gelh为处理组。
图9为实施例3中明胶水凝胶包裹处理的骨髓间充质干细胞(mscs)在缺氧缺血清条件下的细胞凋亡荧光染色图(a)及定量统计图(b);
其中,con为对照组;msc-gelh为处理组。
图10为对比例1中侧链修饰酪胺的海藻酸钠水凝胶包裹msc的显微切片透射电镜(tem)图;
其中,箭头指示的细胞表面絮状物即为海藻酸钠水凝胶,con表示细胞表面无絮状物的对照组,msc-algh表示经海藻酸钠水凝胶包裹msc的处理。
图11为对比例1中水凝胶(5-氨基荧光素标记)包裹的贴壁生长的骨髓间充质干细胞(mscs)激光共聚焦显微图(比例尺50μm)。
图12为对比例1中msc单细胞经海藻酸钠水凝胶包裹处理后,在缺氧缺血清条件下培养后的细胞凋亡检测统计图;
其中,a为annexinv凋亡试剂盒检测的细胞流式图;b为细胞凋亡率的统计图;msc表示未经水凝胶包裹msc的处理;msc-algh表示经海藻酸钠水凝胶包裹msc的处理;con为对照组;msc-gelh为处理组。
具体实施方式
以下实施例可以更好地理解本发明,但不限于本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的试验材料,如无特殊说明,均购买自常规生化试剂公司。mscs培养基由dmem低糖培养液加10%胎牛血清配制而成,乳鼠心肌细胞培养基由dmem高糖培养液加10%胎牛血清配制而成,实验所用缓冲液均为购买的瓶装磷酸盐缓冲液(pbs)。
骨髓间充质干细胞(mscs):分离自两周大的sd大鼠骨髓。具体分离方法是:取1~2周大的sd大鼠,麻醉处死后,剥离后肢大腿骨,用pbs反复冲洗骨髓腔,将洗出的混合细胞液离心后,去上清,加入dmem低糖培养基,种板,逐步传代纯化即可。
心肌细胞:分离自1~2天大的sd乳鼠心肌组织。具体分离方法是:取1~3天大的sd乳鼠,酒精浸泡灭菌,取心脏,用pbs清洗两次,吸去杂组织,置于培养皿上,加1ml胶原酶ⅱ(1mg/ml),剪碎心脏组织,置于离心管内,加入6~8ml酶液,37℃,60rpm震荡10分钟,移液枪吹打10次,静置,吸取上清于中和液中,再加6~8ml胶原酶ⅱ,反复6次震荡消化,取上清,1500rpm,10分钟离心去上清,加入dmem高糖培养液置于培养皿中培养1.5~2小时(37℃,5%co2),将心肌细胞液稀释,吸取到用gelatin(明胶,1%w/v)孵育过的孔板中,培养箱中培养(37℃,5%co2)。
下列实施例的附图中,con为未经明胶水凝胶包裹的细胞表面无絮状物的对照组,简称对照组;msc-gelh为经明胶水凝胶包裹的细胞表面有絮状物的处理组,简称处理组。
实施例1
(1)向烧瓶中加入乙二胺(mw=60.1,5g,83.19mmol,1eq),并用thf(四氢呋喃)充分溶解,在氮气保护的条件下,进行冰水浴,再向烧瓶中缓慢加入naoh(mw=40,3.82g,95.66mmol,1.15eq)甲醇溶液,15min后,滴加boc2o(二碳酸二叔丁酯)(mw=218.25,18.15g,83.19mmol,1eq),滴毕,室温反应8h,tcl(薄层层析)检测,反应完全,旋蒸除去溶剂,得粗产品,色谱柱纯化,得纯品boc-乙二胺。
再向烧瓶中加入boc-乙二胺(mw=160.2,5g,31.2mmol,1.5eq)和油酸(mw=282.47,5.87g,20.8mmol,1eq),并用thf充分溶解,再加入edci(mw=155.24,3.87g,24.96mmol,1.2eq),hobt(mw=135.12,3.37g,24.96mmol,1.2eq),在氮气保护的条件下,室温反应4h,tcl检测,反应完全,旋蒸除去溶剂,得粗产品;经色谱柱纯化,得纯品。所得产品重新溶于thf,通入hcl气体,tcl检测,反应完全,旋蒸除去溶剂,真空抽干得n-油酸基乙二胺。
(2)向psa(mw=35000,6g,0.17mmol,1eq)中加入160ml无水dmf(n,n-二甲基甲酰胺),再加入0.25ml三乙胺,在氮气保护的条件下,升温至56℃,滴加tstu(mw=300,5mg,0.0167mmol,0.1eq)dmf溶液,反应8h,停止反应,减压蒸出dmf,加乙醚洗涤;得到聚唾液酸-琥珀酰亚胺酯(psa,se);
向psa,se(mw=35294,5g,0.14mmol,1eq)中加入160ml无水dmf,再加入0.25ml三乙胺,在氮气保护的条件下,加入n-油酸基乙二胺(mw=324.5.45mg,0.0168mmol,0.12eq)dmf溶液,反应8h,停止反应,减压蒸出dmf,加乙醚洗涤;得到psa-油酸;
向psa-油酸(mw=35919,5g,0.142mmol,1eq)中加入160ml无水dmf,再加入0.25ml三乙胺,在氮气保护的条件下,升温至56℃,加入滴加tstu(mw=300,4.26mg,0.0142mmol,0.1eq)dmf溶液,反应8h,停止反应,减压蒸出dmf,加乙醚洗涤,得到聚唾液酸-油酸-琥珀酰亚胺酯(psa-oleicacid,se)。
(3)取合成的分子量为40000~50000的聚唾液酸-油酸-琥珀酰亚胺酯分子,溶于pbs,浓度为0.2mm,与含mtg的pbs溶液混合,bam(聚唾液酸-油酸-琥珀酰亚胺酯)与mtg的摩尔比为1:1,室温反应2小时后超滤(mwco=50000),离心(离心速度为3000g)25min,pbs重悬,超滤离心,如此洗涤两次,最后加pbs溶液,重悬,配制成0.2mm的bam-mtg溶液,4℃冰箱保存,备用。
(4)取培养纯化的sd大鼠骨髓间充质干细胞(msc),用胰酶溶液(0.25%胰酶,0.02%edta)消化后,血球计数板计数,取3×105个细胞,置于ep管中,加入磷酸盐缓冲液(pbs)重悬,再加入合成好的bam-mtg溶液,混匀;bam-mtg分子浓度可以为20~200μm,优化后浓度为100μm,整个反应体系为200μl,37℃条件下反应5~20min,优化后的反应时间为10min;反应完成后,离心,离心速度为1200rpm,离心时间为3min;去掉上清,待用;
(5)取步骤(3)中的离心细胞,加入明胶溶液(明胶溶液浓度优化后为8%),轻轻吹打,重悬细胞,37℃水浴条件下,反应20~40min,优化后的反应时间为30min;反应完成后,快速离心,离心速度为4000rpm,离心时间3min,离心完成后,去掉上清液,加dmem低糖培养基重悬细胞。
(6)将步骤(4)中的细胞悬浮液转移到孔板中,正常培养,得到贴壁的msc。
测定结果:
取步骤(5)中获得的大鼠骨髓间充质干细胞(mscs),经显微切片后,用透射电镜(tem)观察,获得的显微电镜图如图2,明显可以发现mscs单细胞表面包裹的明胶水凝胶层。
按照步骤(6)进行细胞培养,得到细胞外周被明胶水凝胶部分包裹的贴壁的mscs,可见细胞表面包覆的fitc标记的明胶水凝胶,荧光图片如图3,激光共聚焦z轴扫描图如图4。
从tem显微图片和激光共聚焦荧光图片可以证实这种方法的有效性,即通过细胞表面酶分子的原位催化作用,实现了明胶水凝胶对mscs单细胞的包裹,且部分包裹的细胞能够贴壁生长。
实施例2
将实施例1制备得到的水凝胶包裹的贴壁mscs分别进行如下实验:
一、细胞分泌能力实验
1、细胞培养的上清液对人脐静脉内皮细胞(huvec)管腔形成能力的影响
取matrigel(人工基底膜),加入24孔板中,每孔200ul,37℃孵育固化,接种huvec(人脐静脉血管内皮细胞,由浙二医院心血管病干细胞治疗省重点实验室提供),每孔6×104个细胞,加入实施例1中步骤(5)得到的mscs细胞培养上清,以不做处理的mscs培养上清为对照,正常培养4~6小时后,直到管腔形成,在显微镜下观察拍照,统计形成的管腔数量。
结果如图5,定量统计表明,同对照组相比,实验组形成的管腔数量无显著性差异,证明经明胶水凝胶部分包裹处理的贴壁mscs,细胞因子分泌能力基本不受影响。
2、细胞培养的上清液对缺氧环境下心肌细胞抗凋亡能力的影响实验
取实施例1中步骤(6)得到的贴壁状态的水凝胶包裹的mscs(msc-gel),加入含1%胎牛血清的dmem低糖培养基,培养1天后,收集上清,加入从sd乳鼠心脏中分离得到的心肌细胞,进行缺氧共培养(缺氧条件为3%o2,6%co2,91%n2),以正常培养的mscs收集的上清为对照;缺氧培养2天后,去上清,pbs洗涤3次,10%甲醛固定10分钟,pbs洗涤3次,再用0.2%(v/v)triton-100破膜处理10分钟,加入细胞凋亡检测的tunel试剂盒染料试剂,25ul/孔37℃,避光敷育1.5小时后,pbs洗涤3次,加入hoechst33258核染试剂,染色20分钟,荧光显微镜观察,拍照,定量统计凋亡心肌细胞的数目。
荧光图片与定量统计结果如图6,结果表明,实验组的凋亡心肌细胞数量与对照组相比,无显著性差异,证明明胶水凝胶包裹处理mscs,对其旁分泌能力无影响。
以上结果表明,经明胶水凝胶包裹处理后,对贴壁状态下的mscs旁分泌功能不造成影响。
实施例3
将实施例1制备得到的水凝胶包裹的贴壁mscs分别进行如下实验:
1、mscs自身增殖能力检测实验
取水凝胶包裹的mscs种板(96孔板),以正常mscs作对照,细胞数量为1×104/孔,每组5孔平行,培养24小时后,吸去上清,加入培养基和cck8试剂(按cck8试剂盒说明书操作),正常培养4~6小时后,用酶标仪在450nm波长处检测吸光度值,测定650nm波长处吸光度值作为本底。
吸光度定量检测结果如图7的统计图,统计结果表明,实验组与对照组无显著性差异,这个结果证明,经明胶水凝胶包裹处理的mscs增殖能力不受影响。
2、mscs管腔形成能力检测实验
取matrigel,加入24孔板中,每孔200ul,37℃孵育固化后,加入水凝胶包裹的mscs(24孔板),细胞数量为6×104/孔,以正常mscs为对照组,每组4孔平行,正常培养4~6小时后,直到管腔形成,在显微镜下观察拍照,统计形成的管腔数量。
管腔形成图及定量统计结果如图8,明胶水凝胶包裹组与对照组相比,管腔形成
能力没有显著性下降,证明经水凝胶部分包裹的mscs,其管腔形成能力不受影响。
3、缺氧缺血清条件下的mscs自身抗凋亡能力检测实验
取水凝胶包裹的mscs种板(24孔板),细胞数量为1×105/孔,以正常mscs作对照组,每组3孔平行,正常培养1天后,去上清,加入无血清的dmem低糖培养基,缺氧培养(缺氧条件为3%o2,6%co2,91%n2)24小时后,去上清,pbs洗涤3次,用0.2%triton-100溶液破膜处理10分钟,加入tunel试剂(按tunel试剂盒说明书操作),25ul/孔,37℃避光孵育1.5小时,再用pbs洗涤3次,hoechst染料染色30分钟,最后用荧光显微镜拍照,统计凋亡的mscs数目。
荧光图片及统计结果如图9,定量统计结果表明,与未经水凝胶包裹的对照组相比,实验组mscs在缺氧缺血清条件下的细胞凋亡率大大降低,且与对照组有显著性差异,这一结果证明,明胶水凝胶对mscs单细胞的包裹,会促进mscs在恶劣条件下的抗凋亡能力,表明了这一方法在干细胞治疗心肌梗死等领域的应用潜力。
以上结果表明,经明胶水凝胶包裹处理后,对贴壁状态下的mscs增殖能力和管腔形成能力影响不大,而且提高了mscs在恶劣条件下的细胞抗凋亡能力,这一结果也预示着该发明方法在干细胞移植治疗心肌梗死领域的潜在应用价值。
对比例1
本对比例1仍以骨髓间充质干细胞作为包裹对象,但采用的类细胞外基质水凝胶为海藻酸钠,相应催化交联的酶为辣根过氧化物酶分子,即:细胞表面定点催化分子为油酸-聚唾液酸-辣根过氧化物酶,简称bam-hrp,其余步骤与实施例1相同。
测定结果:
取步骤(5)中获得的大鼠骨髓间充质干细胞(mscs),经显微切片后,用透射电镜(tem)观察,获得的显微电镜图如图10。
按照步骤(6)进行细胞培养,得到水凝胶包裹、贴壁生长的msc,可见细胞表面的水凝胶(绿色荧光标记),激光共聚焦荧光图片如图11。
从图10的tem显微图片和图11的激光共聚焦荧光图片可以发现,msc表面成功实现了海藻酸钠水凝胶的包裹,且部分包裹的细胞能够贴壁生长。
msc单细胞经海藻酸钠水凝胶包裹后,抗逆性结果如图12。从细胞流式检测统计结果来看,经海藻酸钠水凝胶包裹处理后的msc抗逆性没有得到提高,且有所恶化,结果呈阴性。
- 还没有人留言评论。精彩留言会获得点赞!