来源于人类干细胞的肝细胞分化方法及肝细胞与流程
本发明涉及一种诱导从人类干细胞向肝细胞的分化的方法及肝细胞。更为详细地涉及一种用于确保从人类多能干细胞(humanpluripotentstemcells)分化出适合于体外(invitro)细胞毒性评价的高收率的肝细胞的分化方法及通过所述方法得到分化的肝细胞。
背景技术:
如果将生物新药开发大致分为两个阶段,则可分为临床前阶段和临床阶段。其中,临床前阶段是在确认候补物质对人的稳定性和效果之前将动物模型或者活细胞作为对象的生物化学实验,并起到减少新药在临床阶段被退出的可能性的作用。但是,在动物模型的情况下存在的问题在于,由于个体间、品种(strain)间以及性别间的变异而难以导出准确的结果。因为所述理由,所以通常使用在人类器官提取的原代培养细胞(primaryculturedcells),并且在对于新药候补物质的肝毒性(hepatotoxicity)评价中也广泛使用原代培养肝细胞(humanprimaryhepatocytes,hphs)。
但是,人类原代培养肝细胞在临床前阶段上使用时也存在很多限制要素,作为所述限制要素包括①有限供给;②承担巨额费用;③各个人种间功能性的不均等;④在体外培养时短时间的肝功能性消失。由此,作为用于代替原代培养肝细胞的方法,将相对易于获取且在生体外容易培养的肝癌细胞株(hepg2)使用于临床前阶段的试验,但是所述肝癌细胞株因为包括细胞色素酶(cypenzymes)、gst酶的肝细胞特异功能性药物代谢酶及包括在肝细胞内负责药物的吸收和排出的abc载体(abctransporters)、slc载体(slctransporters)的主要浆膜载体(plasmamembranetransporters)的表达及活性非常低,所以存在的问题在于,在代替原代培养肝细胞方面相当不足。由此,作为将要代替原代培养肝细胞的其他方案,从包括人类胚胎干细胞(humanembryonicstemcells,hescs)及诱导多能干细胞(inducedpluripotentstemcells,ipscs)的多能干细胞(pluripotentstemcell,pscs)被诱导分化的肝细胞样细胞(hepatocyte-likecells,hlcs)作为临床前阶段的试验材料备受瞩目。
多能干细胞具有可无限增殖的自我更新能力(self-renewalcapacity)及可分化(differentiation)为生体内所有细胞的多能性(pluripotency),因此如果将从多能干细胞被诱导分化的肝细胞利用于肝毒性评价中,则可解决作为原代培养肝细胞的有限的细胞供给的难题。此外,来源于多能干细胞的肝细胞与肝癌细胞株不同地表达肝细胞特异药物代谢酶及主要浆膜载体,因此在新药候补物质的临床前阶段可用作对肝毒性试验良好的材料。
由此,在全世界正在活跃地进行对于从多能干细胞诱导分化高收率的肝细胞的方法的研究开发,由此报导了很多肝细胞诱导分化方法(hey等,stemcells26:894,2008;si-tayeb等,hepatology51:297,2010;hannan等,natprotoc8(2):430,2013)。但是,通过现有的肝细胞诱导分化方法所生产的来源于多能干细胞的肝细胞在表现型(phenotype)方面与成体肝细胞类似,但是因为从作为人类胚胎发生(embryogenesis)的极早期阶段的未分化状态(undifferentiatedstatus)被诱导分化,所以在功能性方面比起成体肝细胞,与胎儿的肝细胞更加相似,实际上作为成体肝细胞的主要功能的药物代谢所需的肝特异性酶活性比肝癌细胞株高,但是比人类原代肝细胞低,作为问题而被报道过。由此,目前为了在临床前阶段的试验中成功地筛选新药及评价肝毒性,迫切需要对于高收率的高功能性肝细胞分化诱导方法的开发。
【先行技术文献】
【非专利文献】
(非专利文献001)1.hey等,stemcells26:894,2008
(非专利文献002)2.si-tayeb等,hepatology51:297,2010
(非专利文献003)3.hannan等,natprotoc8(2):430,2013
技术实现要素:
本发明是为了解决所述问题而提出的,本发明的目的在于,提供一种分化诱导方法,所述分化诱导方法在新药候补物质的临床前阶段可获得适合于肝毒性评价的肝细胞。
如上所述的本发明的目的可通过提供一种来源于人类干细胞的肝细胞分化方法而得到实现,所述来源于人类干细胞的肝细胞分化方法的特征在于,作为肝细胞分化诱导前步骤包括:a步骤,通过三步骤用trypletm选择对人类多能干细胞进行处理,并且只精制高纯度的未分化干细胞;b步骤,用激活素(activin)a及chir99021同时对精制的未分化干细胞进行处理,从而获得内胚层细胞;c步骤,用视黄酸(retinoicacid,ra)对获得的内胚层细胞进行处理,从而获得肝母细胞(hepatoblast);以及d步骤,在使得获得的肝母细胞在用于分化的板上漂浮后,使其附着于可毒性评价的96孔板(wellplate),并用hgf(肝细胞生长因子,hepatocytegrowthfactor)及dex(地塞米松,dexamethasone)进行处理,从而诱导肝细胞。
此外,在b步骤中,为了诱导将诱导为中内胚层细胞的细胞分化为完全内胚层细胞,而可额外用bmp2(骨形态生成蛋白2,bonemorphogeneticprotein2)以及bfgf(碱性成纤维细胞生长因子,basicfibroblastgrowthfactor)进行处理。
并且,在执行c步骤之前,还可包括如下步骤:用bmp4(骨形态生成蛋白4,bonemorphogeneticprotein4)对在b步骤获得的完全内胚层细胞进行处理。
并且,在c步骤中,针对获得的肝母细胞,为了药物毒性实验而利用trypletm选择使得细胞漂浮后,可重新使其附着于96孔板(wellplate)。
最后,本发明还可包括:e步骤,用hgf及dex对通过d步骤获得的肝细胞进行处理,从而使得肝细胞成熟。
另外,本发明的目的可以以其他的类型(category)提供一种通过所述分化方法得到分化的肝细胞来得到实现。
第一,来源于人类多能干细胞的肝细胞在作为新药开发的必不可少的评价阶段的药物毒性及安全性评价中可代替现有技术中所使用的原代培养肝细胞而使用,因此本发明的肝细胞分化方法的效果在于,可适用于通过新的靶向药物挖掘、药理效能研究及安全性研究评价进行的新药开发的全领域。
第二,本发明的效果在于,在新药候补物质的临床前阶段可以从人类多能干细胞以高收率(白蛋白表达肝细胞95%以上)的形式获得高功能性的肝细胞,以便适合于肝毒性评价(试验)。
第三,效果在于,通过本发明的肝细胞分化诱导方法可有效地获得比现有技术多的数量的肝细胞。
第四,效果在于,利用通过本发明获得的高功能性肝细胞来执行临床前阶段的药物毒性评价(试验),从而可获得准确的毒性评价结果。
附图说明
图1a是表示未分化人类多能干细胞培养及肝细胞诱导分化方法的步骤图,
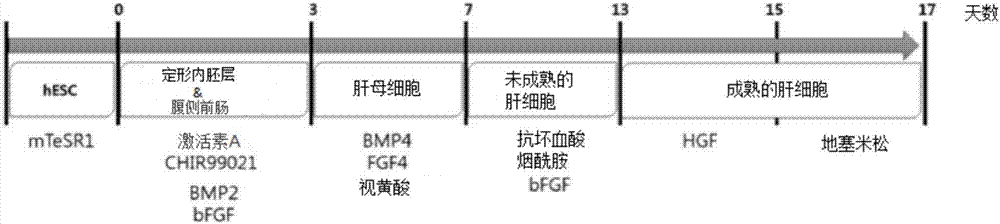
图1b是分阶段地表示利用以高纯度精制的人类未分化多能干细胞来分化诱导为适合于药物毒性评价的成熟肝细胞的过程的模式图,
图2是表示用于在肝细胞诱导分化之前获得高纯度的人类未分化多能干细胞的精制过程中经过继代培养的同时只获得纯粹的未分化干细胞的过程图,
图3是表示通过本发明的肝细胞分化诱导方法所获得的肝细胞的数量的对比图表,
图4a是将最终分化的肝细胞的形态和分化的肝细胞荧光染色为肝细胞特异性标记因子(白蛋白(alb)、甲胎蛋白(afp))的图,
图4b是表示用于对通过本发明的肝细胞分化诱导方法所获得的肝细胞的定量分化收率进行确认的流式细胞分析结果的图,
图5a是表示通过本发明的肝细胞分化诱导方法所获得的肝细胞的成熟程度的图,
图5b是在本发明中通过pas(过碘酸-希夫(periodicacid-schiff))染色来表示最终被分化诱导的第17天肝细胞的糖原合成能力的图。
具体实施方式
以下,参照附图对本发明的优选实施例进行详细说明。应留意,在图中对于相同的构成要素即使表示在不同的图中,也尽可能表示为相同的参照标号及符号。此外,在以下对本发明进行说明时,对于相关的公知功能或者构成的具体说明判断为有可能不必要地模糊本发明的要旨的情况下,省略其详细的说明。
另外,图1a是表示未分化人类多能干细胞培养及肝细胞诱导分化方法的步骤图,为了在肝细胞诱导分化之前获得高纯度的未分化细胞,包括如下过程:将在支持营养细胞中培养中的人类多能干细胞在没有支持营养细胞的培养条件下培养的同时,经过3次的继代培养,从而去除支持营养细胞及一部分被分化的细胞,并且包括从未分化人类多能干细胞向内胚层细胞的分化诱导、向肝母细胞及肝前体细胞的分化诱导以及向最终肝细胞的分化诱导方法。
并且,图1b是分阶段地表示利用以高纯度精制的人类未分化多能干细胞来分化诱导为适合于药物毒性评价的成熟肝细胞的过程的模式图,示出使用于肝细胞诱导分化的分化诱导因子(内胚层诱导因子:激活素(activin)a、chir99021、bmp2、bfgf/肝母细胞诱导因子:bmp4、fgf4视黄酸(rerinoicacid)、抗坏血酸(ascorbicacid)、烟酰胺(nicotinamide)、bfgf/成熟肝细胞诱导因子:hgf、地塞米松(dexamethasone)及各个处理时间。
此外,图2是表示用于在肝细胞诱导分化之前获得高纯度的人类未分化多能干细胞的精制过程中经过继代培养的同时只获得纯粹的未分化干细胞的过程。
本发明的肝细胞分化诱导方法中,作为肝细胞分化诱导前步骤包括如下步骤:a步骤,通过三步骤用trypletm选择对人类多能干细胞进行处理,并且只精制高纯度的未分化干细胞;b步骤,用激活素(activin)a及chir99021同时对所述精制的未分化干细胞进行处理,从而获得内胚层细胞;c步骤,用视黄酸(retinoicacid,ra)对所述获得的内胚层细胞进行处理,从而获得肝母细胞;以及d步骤,在使得所述获得的肝母细胞在用于分化的板上漂浮后,使其附着于可毒性评价的96孔板(wellplate),并用hgf(肝细胞生长因子,hepatocytegrowthfactor)及dex(地塞米松,dexamethasone)进行处理,从而诱导肝细胞。
此外,在所述b步骤中,可包括如下步骤:为了诱导将诱导为中内胚层细胞的细胞分化为完全内胚层细胞,而额外用bmp2(骨形态生成蛋白2,bonemorphogeneticprotein2)以及bfgf(碱性成纤维细胞生长因子,basicfibroblastgrowthfactor)进行处理。
并且,在执行所述c步骤之前,还可包括如下步骤:用bmp4(骨形态生成蛋白4,bonemorphogeneticprotein4)对在所述b步骤获得的完全内胚层细胞进行处理。
并且,在所述c步骤中,针对所述获得的肝母细胞,为了药物毒性实验而利用trypletm选择使得细胞漂浮后,可重新使其附着于96孔板(wellplate)。
另外,本发明还可包括:e步骤,用hgf及dex对通过所述d步骤获得的肝细胞进行处理,从而使得肝细胞成熟。
在本发明的来源于人类干细胞的肝细胞分化方法中,所谓的干细胞指的是在试验管内培养中具有可分化为肝细胞的能力的来源于人类的细胞,优选地,指的是多能干细胞(pluripotentstemcells)或者所述细胞的祖细胞。
在此,所谓的多能干细胞指的是,通过试验管内培养保持未分化状态的几乎可永久或长时间增殖细胞且具有在适当的条件下可分化为三胚层(外胚层、中胚层、内胚层)的所有系谱的细胞的能力的细胞。目前,多能干细胞有从已经作为培养细胞被广泛使用的来源于老鼠、猴子、人类等哺乳动物的早期胚胎中分离的胚胎干细胞(embryonicstemcells,以下简称为“es细胞”)、从胚胎期(embryonicstage)的原始生殖细胞中分离的胚胎生殖细胞(embryonicgermcells,以下简称为“eg细胞”)以及从成体的骨髓中分离的多能干细胞(multipotentadultprogenitorcells,以下简称为“mapc”)。
就本发明的来源于人类干细胞的肝细胞分化方法而言,可以是作为多能干细胞的es细胞、具有与通过各种体细胞的逆分化制作的胚胎干细胞类似的性状的细胞(诱导多能干细胞(inducedpluripotentstemcells),ipsc)、eg细胞,或者mapc的方法,优选地,可以是es细胞,更加优选地,可以是作为人类es细胞的干细胞的分化诱导方法。
此外,在本发明中可利用的细胞并非限定为所述三种,而是包括来源于人类的胚胎或胎儿、脐带血或者成体器官或者骨髓等的成体组织或者血液等的所有多能干细胞。作为具体的例子,可举用5-氮胞啶(5-azacytidine,以下简称为“azc”)等的药剂对根鞘细胞或者表皮细胞进行处理从而获得的干细胞(sharada&zahner,国际公开专利第02/051980号)、用cr3/43抗体对单核细胞进行处理从而获得的干细胞(abuljadayel,curr.med.res.opinion19:355,2003),或者具有与来源于成体内耳细胞的干细胞(li等,naturemed.,advanceonlinepulication)等的es细胞类似的性状的干细胞的例子。在此情况下,所谓的与es细胞类似的性状指的是,可以定义为在es细胞存在特异性的表面(抗原)标记,或表达es细胞特异性的基因,或具有畸胎瘤(teratoma)形成功能或具有嵌合体(chimera)小鼠形成能等的es细胞的特异性的细胞生物学性质。
另外,“营养细胞(feeder)”或者“饲养细胞”是一种与其他类型的细胞共同培养从而提供可生长第二类型的细胞的环境的、为了记述一种类型的细胞而使用的术语。
<未分化(undifferentiated)人类干细胞的培养>
人类胚胎干细胞(hescs)及诱导多能干细胞(hipscs)与支持营养细胞(feederlayer)共同培养从而持续保持未分化。具体地,在由通过用丝裂霉素(mitomycin)-c(10ug/ml)进行处理而细胞分裂被非活性化的小鼠胚胎成纤维细胞(mouseembryonicfibroblasts,mefs)制作的支持营养细胞上培养人类胚胎干细胞,使用于培养的培养基是包括20%血清替代物(knockoutserumreplacement,invitrogenlifetechnologies,usa)、8ng/mlbfgf、1%非必需氨基酸及100mmβ-巯基乙醇(beta-mercaptoethanol)的dmem/f12培养基。将所述细胞在标准条件(37℃、5%co2及饱和湿度)的培养基(incubator)中培养,并且每天执行培养基更换。hescs及ipscs大约每6-8天左右实施1次继代培养,在继代培养时为了保持未分化,将一部分未分化hescs及ipscs转移至包括与所述相同的培养基的新的支持营养细胞,一部分未分化hescs及ipscs为了肝细胞诱导分化而转移到涂覆有基质胶(matrigel)的60mm培养皿,并且利用mtesr1(干细胞技术,stemcelltechnologies)培养基来培养。
如果在60mm培养皿上没有营养支持细胞的状态下培养的hescs及ipscs以培养皿上的80%左右面积形成集落,则培养的hescs及ipscs为了开始肝细胞分化而去除培养基后,用trypletm选择(培养基,invitrogen)处理1分钟并首先去除一部分被分化的细胞。此后,重新用trypletm选择(培养基,invitrogen)处理3分钟并将培养的hescs及ipscs分散为单一细胞后,在1000rpm进行5分钟圆心分离,从而只分离细胞并获取。获取的hescs及ipscs以5x106细胞(cells)涂覆于涂层有基质胶的100mm培养皿后,向mtesr1培养基添加作为蛋白质磷酸化酶抑制剂的10μmy-27632(rock抑制剂),在37℃、5%co2条件的培养基中培养1天后,在不包括y-27632(rock抑制剂)的mtesr1培养基中额外培养1天后,执行肝细胞分化。
<向肝细胞的诱导分化>
在诱导分化肝细胞时,分阶段所需的试剂及处理时间相关的具体内容概括在[表1]。
【表1】
①步骤一:未分化多能干细胞的内胚层细胞及腹侧前肠细胞的分化诱导
在人类形成过程中,包括消化管、肝及肺在内的内部器官形成于内胚层细胞。由此,在生体外分化诱导方法中,为了使得全能性干细胞分化为肝前体细胞及肝细胞,作为其第一个步骤,必需获得高效率的内胚层细胞。由此,在本发明中,作为分化步骤一,诱导了将hescs及ipscs分化为内胚层细胞及腹侧前肠细胞。具体地,针对在100mm培养皿中没有支持营养细胞的状态下培养2天的hescs及ipscs去除mtesr1培养基后,在包括2μmchir99021及100ng/mlaa(激活素a)的rpmi培养基中培养1天。此后,将所述培养液在包括20ng/mlbmp2及5ng/mlbfgf的rpmi培养基中追加分化诱导2天。
②步骤二:向内胚层细胞的肝母细胞(hepatoblasts)及肝前体细胞的分化诱导
将在步骤一获得的内胚层细胞追加培养8天,从而诱导向肝母细胞及肝前体细胞的分化。具体地,为了肝母细胞分化,将被分化诱导的内胚层细胞在包括20ng/mlbmp4及b27辅助剂的rpmi培养基中培养2天后,在包括2μm视黄酸(retinoicacid)及b27辅助剂的dmem培养基中追加分化诱导2天后,为了向肝前体细胞的分化,在dmem培养基上包括1ng/mlbfgf、100μm抗坏血酸(ascorbicacid)及1mm烟酰胺(nicotinamide)的培养基中,追加分化诱导4天。
③步骤三:向最终肝细胞的分化
为了从在步骤二被分化的肝前体细胞中分化最终肝细胞,连续4天在添加有its和b27辅助剂的dmem/f12中添加20ng/mlhgf并诱导分化。在分化结束后,为了形成适合于最终新药开发及药物毒性评价(实验)的平台,用trypletm选择对被分化的肝细胞进行处理并进行单细胞化,并且以1x106细胞(cells)/孔(well)附着于预先涂覆有第一型胶原(collagen)的96孔(well)培养容器后,在添加有its和b27辅助剂的dmem/f12中添加10ng/ml抑癌蛋白m(oncostatinm)、10-6m地塞米松(dexamethasone)并培养6天。针对通过所述方法最终被分化诱导的肝细胞,利用流式细胞分离法来确认作为肝细胞特异性标记的alb、asgpr1、ntcp和mrp1,此外为了评价肝细胞功能性,确认pas、活性度。
<分化分析方法>
免疫荧光染色法
用包括4%pfa(多聚甲醛,paraformaldehyde)的pbs对在96孔板(wellplate)上最终被分化的肝细胞进行处理并在常温下固定20分钟后,用pbs清洗3次。之后,用包括0.3%曲通(triton)x-100/pbs及10%血清的pbs进行处理并阻滞及穿孔,接下来按处理比率对一次抗体进行稀释后,在4℃下反应12~16小时。将同形老鼠1gg或者正常驴子血清用作阴性对照群,在所述阴性对照群未检测到荧光。稀释了alb(1:400)、afp(1:400)的一次抗体。用pbs清洗3次,并且结合fitc(异硫氰酸荧光素,fluoresceinisothiocyanate)或tritc(罗丹明,rhodamine),添加以1:400稀释的二次抗体,在常温下反应1小时30分钟。接下来,使用1μg/mldapi(4',6-二脒基-2-苯基吲哚,4',6-diamidino-2-phenylindole)对细胞核进行了染色。在各个步骤之间用磷酸盐缓冲盐水(phosphate-bufferedsaline,pbs)对细胞和切片进行了清洗。
流式细胞分析
对最终被分化的肝细胞添加trypletm选择并分离为单一细胞后,用4%pfa(多聚甲醛,paraformaldehyde)进行处理并在4℃下固定20分钟。对所述细胞利用在bd公司销售的facs清洗缓冲液来清洗后,分别用作为一次抗体的成熟肝细胞标记(marker)被众所周知的alb、asgpr1、ntcp和mrp1抗体进行处理,并且在4℃下反应30分钟。在3次的清洗过程后,重新将二次抗体分别在4℃下反应30分钟。此后,使用bd-流式细胞仪(facscaliburflowcytometer)(facscalibur,美国)对清洗的细胞进行了分析。按照各个标记进行了3次独立的实验。实验结果是通过flowjo软件进行了分析。alb的情况,通过细胞分离器(facs)确认了分化程度。
pas(过碘酸-希夫,periodicacid-schiff)染色
使得最终被分化的肝细胞用包括4%福尔马林(formalin)和95%乙醇(ethanol)的溶液固定,用pas(过碘酸-希夫,periodicacidschiff)溶液在室温下反应5分钟。用蒸馏水多次清洗后,用希夫(schiff’s)试剂对细胞处理15分钟,在流动的水中清洗5分钟后,使用苏木精(hematoxylin)在室温下染色了90秒钟。通过光学显微镜(卡尔〃蔡司,carlzeiss)检测了细胞内糖原粒子(紫色)。确认到在2d培养的hlcs细胞和3d培养的球状体(spheroid)中都很好地实现了糖原的累积。
反转录pcr及定量pcr
从肝母细胞及最终被分化的肝细胞使用trizol试剂从而从反复露出于生体异物的细胞获得,执行了使用反转录系统(promegacorp.,美国)的反转录过程。pcr增幅条件设定为94℃5分钟,35周期(cycle)(94℃30秒、50-57℃30秒以及72℃30秒)以及72℃10分钟。
rt-pcr分析是通过使用荧光染料pcr预混液(sybrgreenpcrmastermix)(应用生物系统公司(appliedbiosystems),美国)来执行。确认了pcr反应物由包括12.5μl荧光染料pcr预混液(sybrgreenpcrmastermix)、各个0.8μl10mm的引物(primer)、10.4μl蒸馏水以及0.5μl模子cdna的25μl构成,并且在适合于各个引物的条件下增幅。各个基因的相对的表达水平是使用gapdh来进行标准化后进行了测定。在此,使用的引物的序列如[表2]。
【表2】
<分析结果>
图3是表示通过本发明的肝细胞分化诱导方法所获得的肝细胞的数量的对比图表,对从在本申请人的现有申请发明中明示的肝细胞分化诱导方法(第一方案,申请号:第10-2015-0113616号)获得的肝细胞的数量和通过本发明的肝细胞分化诱导方法(第二个方案)获得的肝细胞的数量进行了比较。通过各个肝细胞分化诱导方法最终被分化的共3次相互不同的实验中,对在相同的培养皿面积中获得的肝细胞的数量进行比较后可确认到如下结果:当通过本发明的分化诱导方法分化诱导肝细胞时,与通过本发明人的现有申请中明示的方法所分化诱导的肝细胞相比,肝细胞获得比率约增加了5倍。
此外,图4a是将最终被分化的肝细胞的形态和被分化的肝细胞荧光染色为肝细胞特异性标记因子(白蛋白(alb)、甲胎蛋白(afp))的图,可确认到,通过本发明的肝细胞分化诱导方法,肝细胞有效地从人类多能干细胞中被分化。
并且,图4b是表示用于对通过本发明的肝细胞分化诱导方法所获得的肝细胞的定量分化收率进行确认的流式细胞分析结果的图,表达作为成体肝细胞标记因子的alb及asgpr1的肝细胞为98%以上,表达作为表示肝细胞功能性的标记因子的ntcp的肝细胞为83.7%,表达mrp2的肝细胞为53.5%,由此,可确认到,通过本发明的肝细胞分化诱导方法得到分化的肝细胞为高纯度的高功能性肝细胞。
并且,图5a是表示通过本发明的肝细胞分化诱导方法所获得的肝细胞的成熟程度的图,通过实时聚合酶链反应(real-timepcr)对被分化的肝细胞的rna表达模式进行比较的结果表现为,在肝细胞的最终分化后(第17天),作为未成熟肝细胞的标记因子的afp的表达减少,作为成体肝细胞的标记因子的alb显著增加,并且作为肝细胞的代表性药物代谢酶的cyp3a4也显著增加。
最后,图5b是在本发明中通过pas(过碘酸-希夫(periodicacid-schiff))染色来表示最终被分化诱导的第17天肝细胞的糖原合成能力的图,通过本发明的肝细胞分化方法得到诱导分化的大部分肝细胞是具有糖原合成能力的功能性肝细胞。
总之,本申请的效果在于,与现有技术(包括作为本申请人的已申请发明的申请号:第10-2015-0113616号)相比,可使得肝细胞的获得率增加5倍。具体地,在现有专利中,当用激活素a处理3天时,分化中细胞的消灭较多,但是本发明的效果在于,不仅减少在用激活素a处理1天并利用bmp2和bfgf来诱导内胚层细胞的分化步骤中产生的细胞的消灭,而且提高细胞的增殖,与现有方法中最终获得的肝细胞2x106细胞/t75烧瓶(flask)相比,可获得增加5倍的1x107细胞/t75烧瓶。
以上,虽然参照附图对本发明的技术思想进行了叙述,但是其仅仅是将本发明的最良好的一个实施例以示例的形式进行的说明,并非限定本发明。此外,如果是具有本技术领域的一般知识的技术人员,则任何人在不脱离本发明的技术思想范畴的范围内可进行多种变形及模仿,这是一个明显的事实。
- 还没有人留言评论。精彩留言会获得点赞!