一种生物活性多肽NNQFLPYPYYAKPA及其制备方法和应用与流程
本发明涉及蛋白领域,尤其是涉及一种生物活性多肽nnqflpypyyakpa及其制备方法和应用。
背景技术:
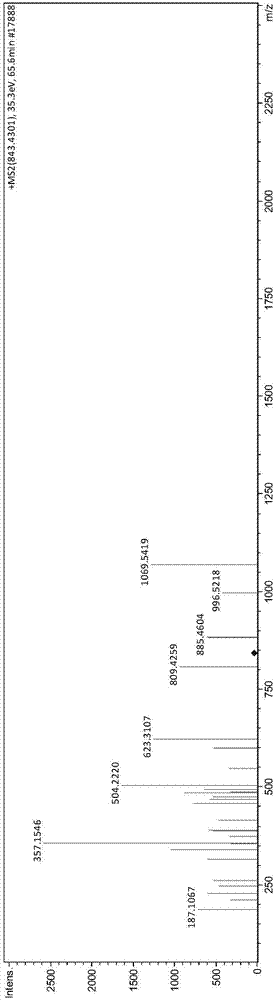
:在牛乳经乳酸菌发酵的过程中,牛乳中的一部分蛋白质被乳酸菌代谢利用,并发生了一系列生理生化反应,使蛋白质变为多肽或者游离的氨基酸,被人体消化吸收或通过小肠上皮细胞的吸收转运直接进入人体的血液循环。在这些多肽中,有一部分具有特殊的生理功能,被称为“生物活性肽”。在天然食物来源中寻找安全的生物活性肽尤为重要。近些年来,人们发现一些食物来源的多肽类物质具有良好的生物活性,如玉米短肽、大豆肽、牛乳多肽等。这些多肽可以通过微生物发酵、消化酶解等多种途径得到,并且大多具有生物活性的多肽是由2~20个氨基酸残基组成,分子量小于6000da,含有一定量的疏水氨基酸、芳香族氨基酸。免疫活性肽是继阿片肽发现后首次从乳中获得并证明其生理活性的一类生物活性多肽。1981年jolles等人首次发现,利用胰蛋白酶水解人乳蛋白,可以得到一个氨基酸序列为val-glu-pro-ile-pro-tyr的六肽,体外实验证明该肽能够增强小鼠腹腔巨噬细胞对绵羊红细胞的吞噬作用。migliore-samour等人发现来自酪蛋白的六肽thr-thr-met-pro-leu-trp能够刺激绵羊血红细胞对小鼠腹膜巨噬细胞的吞噬作用以及增强对于肺炎克雷伯菌的抵抗。李素萍等人用合成的乳源免疫调节肽(pgpipn)饲喂大鼠发现大鼠腹腔巨噬细胞的吞噬作用和红细胞相关的免疫调节功能有显著的增强。研究表明,免疫活性肽不仅能够增强机体免疫力,刺激机体淋巴细胞的增殖,增强巨噬细胞的吞噬功能,促进细胞因子的释放、提高机体抵御外界病原体感染的能力,降低机体发病率,而且不会引起机体的免疫排斥反应。衰老是一个自然现象,且过程常伴有抗氧化水平、器官组织、免疫因子的变化,其中细胞因子发生着复杂的变化,如促炎细胞因子il-6、il-4、tnf-α等呈现增长的趋势,il-6与tnf-a均被认为在老年性疾病的发生过程中扮演重要角色。随着遗传学和分子生物学的发展,生物衰老机理的研究取得了可喜的进展。研究人员通过利用一些模式生物,如小鼠、果蝇和秀丽线虫等的单一基因突变实验,发现有些基因能够显著增加这些生物体的寿命达6倍之多。抗衰老肽作为一种新兴的抗衰老剂,在生理功能方面具有氨基酸所不能比拟的优势,其能对生物体内的酶产生促进或抑制作用,改善对矿物质及其他营养元素的吸收和利用,清除体内自由基,增强机体自身的抗氧化力,以延缓衰老。因此,生物活性肽的营养保健作用已成为国内外学者课题研究的重点。邱隽等人经实验研究发现,乳源性生物活性小肽能有效延长果蝇寿命,延缓其衰老,并且还具有较好的抗氧化作用,推测可能是其中富含琉基肽类。周之辉等发现牛初乳提取物能显著性提高老年人体内血清中sod活力,减少其脂质过氧化物和增强机体抗氧化力,具有一定的抗衰老功能。目前关于生物活性多肽的研究有很多,比如中国专利cn105254738a公布了一种来源于β-酪蛋白的乳源性生物活性多肽delqdkih,中国专利cn105254739a公布了一种来源于αs1-酪蛋白的乳源性生物活性多肽gtqytd,中国专利cn105254740a公布了一种来源于αs2-酪蛋白的乳源性生物活性多肽nqfyqkf。技术实现要素:本发明的目的在于提供一种生物活性多肽nnqflpypyyakpa及其制备方法和应用。本发明的目的可以通过以下技术方案来实现:本发明第一方面,提供一种生物活性多肽nnqflpypyyakpa,其氨基酸序列为asn-asn-gln-phe-leu-pro-tyr-pro-tyr-tyr-ala-lys-pro-ala,如seqidno:1所示。较优的,所述生物活性多肽为乳源性。具体来源于κ-酪蛋白,并且为κ-酪蛋白变体a第73~86位的氨基酸残基。κ-酪蛋白变体a氨基酸序列如seqidno:3所示。κ-酪蛋白的氨基酸序列以及对应的核苷酸序列为既有技术,编码κ-酪蛋白变体a第73~86位氨基酸残基的核苷酸片段能编码成熟的生物活性多肽nnqflpypyyakpa。较优的,所述生物活性多肽具有免疫调节功能和抗衰老功能。本发明第二方面,提供了编码所述生物活性多肽nnqflpypyyakpa的核苷酸片段,其序列为:5’-aataatcaatttctgccatacccatattatgcaaagccagct-3’,如seqidno:2所示。本发明第三方面,提供了所述生物活性多肽nnqflpypyyakpa的制备方法,可以通过基因工程的方法人工合成,可以从乳制品中通过分离纯化的方法直接获得,可以直接通过化学合成制备。本发明第四方面,提供了所述生物活性多肽nnqflpypyyakpa在制备具有免疫调节功能的食品、保健品、药物或化妆品中的应用。本发明第五方面,提供了所述生物活性多肽nnqflpypyyakpa在制备具有抗衰老功能的食品、保健品或药物中的应用。本发明第六方面,提供了所述生物活性多肽nnqflpypyyakpa在制备同时具有免疫调节功能和抗衰老功能的食品、保健品或药物中的应用。具体而言,本发明的生物活性多肽nnqflpypyyakpa可以用于制备减少自由基对皮肤伤害的化妆品、制备具有免疫调节和/或抗衰老的药物;并且由于本发明的生物活性多肽nnqflpypyyakpa通过胃肠道降解后的产物仍旧具有生物活性,因此还可以用于制备酸奶等食品、调节免疫力的保健品,以及口服的用于制备具有免疫调节和/或抗衰老的药物。本发明第七方面,提供了一种免疫调节产品,包括所述生物活性多肽nnqflpypyyakpa或所述生物活性多肽nnqflpypyyakpa的衍生物;所述的免疫调节产品包括免疫调节食品、免疫调节保健品、免疫调节药物或免疫调节化妆品;所述生物活性多肽nnqflpypyyakpa的衍生物,是指在生物活性多肽nnqflpypyyakpa的氨基酸侧链基团上、氨基端或羧基端进行羟基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修饰,得到的多肽衍生物。本发明第八方面,提供了一种抗衰老产品,包括所述生物活性多肽nnqflpypyyakpa或所述生物活性多肽nnqflpypyyakpa的衍生物;所述的抗衰老产品包括抗衰老食品、抗衰老保健品或抗衰老药物;所述生物活性多肽nnqflpypyyakpa的衍生物,是指在生物活性多肽nnqflpypyyakpa的氨基酸侧链基团上、氨基端或羧基端进行羟基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修饰,得到的多肽衍生物。本发明第九方面,提供了一种同时具有免疫调节功能和抗衰老功能的产品,包括所述生物活性多肽nnqflpypyyakpa或所述生物活性多肽nnqflpypyyakpa的衍生物;具有免疫调节功能和抗衰老功能的产品包括食品、保健品或药物;所述生物活性多肽nnqflpypyyakpa的衍生物,是指在生物活性多肽nnqflpypyyakpa的氨基酸侧链基团上、氨基端或羧基端进行羟基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修饰,得到的多肽衍生物。本发明生物活性多肽nnqflpypyyakpa的有益效果为:本发明的乳源性生物活性多肽nnqflpypyyakpa具有较好的调节机体免疫力活性和抗衰老活性;一方面,本发明的生物活性多肽nnqflpypyyakpa能够增强淋巴细胞和巨噬细胞的体外增殖能力,提高机体抵御外界病原体感染的能力,降低机体发病率;另一方面,能够提高体内抗过氧化酶系的活力,增强机体抵抗外源性刺激的功能,从而降低机体老化、衰老和生病的机率,对开发具有免疫调节功能及抗衰老功能的乳制品和保健品具有十分重要的意义。附图说明图1:质量色谱提取图(m/z=843.4302);图2:质荷比为843.4302的片段的二级质谱图;图3:质荷比为843.4302的多肽az、by断裂情况;图4:不同浓度nnqflpypyyakpa对秀丽线虫生殖能力的影响;图5:不同培养条件下线虫在l4期时生长状态;图6:生物活性多肽nnqflpypyyakpa对秀丽线虫体长的影响;图7:生物活性多肽nnqflpypyyakpa对秀丽线虫在氧化应激下的影响。具体实施方式在进一步描述本发明具体实施方案之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本
技术领域:
技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本
技术领域:
的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本
技术领域:
常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。下面结合附图和具体实施例对本发明进行详细说明。实施例1活性肽nnqflpypyyakpa的人工合成一、生物活性肽的合成1.称取rink树脂3g(取代度0.3mmol/g)于150ml的反应器中,用50ml的二氯甲烷(dcm)浸泡。2.2小时后,用3倍树脂体积的氮-二甲基甲酰胺(dmf)洗涤树脂,然后抽干,如此重复四次,将树脂抽干后待用。3.向反应器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脱色摇床上摇晃20min,以此来脱去树脂上的fmoc保护基团。脱完保护后用3倍树脂体积的dmf洗涤四次,然后抽干。4.取少量树脂用茚三酮(九井水合茚三酮)法检测(检a、检b各两滴,100℃反应1min),树脂有颜色,说明脱保护成功。5.称取氨基酸asn适量和1-羟基-苯骈三唑(hobt)适量于50ml的离心管中,加入20ml的dmf将其溶解,然后加入3ml的n,n二异丙基碳二亚胺(dic)振荡摇匀1min,待溶液澄清后加入到反应器中,然后将反应器置于30℃的摇床中反应。6.2小时后,用一定量的醋酸酐封头(醋酸酐:diea:dcm=1:1:2,v:v:v)半小时,然后用3倍树脂体积的dmf洗涤四次,抽干待用。7.向反应器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脱色摇床上摇晃20min,以此来脱去树脂上的fmoc保护基团。脱完保护后用dmf洗涤四次,然后抽干。8.取少量树脂用茚三酮(九井水合茚三酮)法检测(检a、检b各两滴,100℃反应1min),树脂有颜色,说明脱保护成功。9.称取后面第二个氨基酸适量和hobt适量于50ml的离心管中,加入25ml的dmf将其溶解,然后加入2.5ml的dic振荡摇匀1min,待溶液澄清后加入到反应器中,然后将反应器置于30℃的摇床中反应。10.1小时后,取少量树脂检测,用茚三酮法检测(检a、检b各两滴,100℃反应1min),若树脂为无色,说明反应完全;若树脂有颜色,说明缩合不完全,继续反应。11.待反应完全后,用dmf洗涤树脂四次,然后抽干,向反应器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脱色摇床上摇晃20min,以此来脱去树脂上的fmoc保护基团。脱完保护后用dmf洗涤四次,然后抽干检测保护是否脱去。12.按照步骤9-11依次接上氨基酸asn、gln、phe、leu、pro、tyr、pro、tyr、tyr、ala、lys、pro和ala。13.待接上最后一个氨基酸后,脱去保护,用dmf洗涤四次,然后用甲醇将树脂抽干。然后用95切割液(三氟乙酸:1,2乙二硫醇:3,异丙基硅烷:水=95:2:2:1,v:v:v)将多肽从树脂上切割下来(每克树脂加10ml切割液),并用冰乙醚(切割液:乙醚=1:9,v:v)离心沉降四次。至此,人工合成了生物活性肽nnqflpypyyakpa。二、生物活性肽的确认1)uplc分析uplc条件如下:仪器:watersacquityuplc超高效液相-电喷雾-四级杆-飞行时间质谱仪色谱柱规格:behc18色谱柱流速:0.4ml/min温度:50℃紫外检测波长:210nm进样量:2μl梯度条件:a液:含有0.1%甲酸(v/v)的水,b液:含有0.1%甲酸(v/v)的乙腈2)质谱分析质谱条件如下:离子方式:es+质量范围(m/z):100-1000毛细管电压(capillary)(kv):3.0采样锥(v):35.0离子源温度(℃):115去溶剂温度(℃):350去溶剂气流(l/hr):700.0碰撞能量(ev):4.0扫描时间(sec):0.25内扫描时间(sec):0.02根据以上分析方法,利用超高效液相-电喷雾-四级杆-飞行时间质谱,对生物活性肽nnqflpypyyakpa进行色谱分析和质谱分析,其质量色谱提取图如图1所示,提取此峰的二级质谱图和az、by断裂情况如图2和3所示,可得此峰的多肽质荷比为843.4302da,保留时间是65.6min。3)结果由图3可知,根据az、by断裂的情况,经过mascot软件分析计算,得到质荷比843.4302da的片段序列为asn-asn-gln-phe-leu-pro-tyr-pro-tyr-tyr-ala-lys-pro-ala(nnqflpypyyakpa),记为seqidno:1。该片段与κ-酪蛋白变体a第73~86位的残基序列相对应,κ-酪蛋白氨基酸序列的genbank编号为aaa30433.1,序列见seqidno:3。实施例2生物活性肽的调节机体免疫力活性实验一、mtt法测定生物活性多肽nnqflpypyyakpa的体外淋巴细胞增殖能力实验1.实验材料与仪器:试剂与材料:实验动物balb/c小鼠(雄性6-8周龄,上海交通大学农业与生物学院动物实验中心);实施例1获得的乳源性生物活性多肽nnqflpypyyakpa;小鼠淋巴细胞提取液(购自索来宝公司);rpmi1640培养基(购自gibco公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt,购自amresco公司);伴刀豆蛋白(cona,购自sigma公司);牛血清白蛋白(bsa,购自genebase公司);胃蛋白酶(购自sigma公司);胰酶(corolasepp,购自ab公司)。仪器设备:lrh-250f生化培养箱,上海恒科技有限公司;gl-22m高速冷冻离心机,上海卢湘仪离心机仪器有限公司;heracell150co2培养箱,heraeus公司;dragonwellscanmk3酶标仪,labsystems公司;alpha1-2-ld真空冷冻干燥机,christ公司;超高效液相色谱-四极杆飞行时间质谱仪,waters公司。2.实验方法:无菌条件下取小鼠脾脏,用淋巴细胞提取液提取小鼠淋巴细胞,进行元代培养。用完全rpmi1640培养液将细胞密度调整为2.5×106个/ml。在96孔细胞培养板中依次加入:100μl小鼠淋巴细胞悬液,100μlrpmi1640完全培养液,20μl伴刀豆蛋白,100μl样品。另外,设置空白对照组(ph7.2~7.4,3mol/l的pbs)和阴性对照组(500μg/mlbsa),研究表明其对于体外淋巴细胞增殖没有影响。每组3个平行实验样。在5%co237℃培养箱中培养68h后,无菌条件下每孔加入20μlmtt,继续培养4h,小心弃去上清液,每孔加入100μl二甲基亚砜,37℃生化培养箱孵化10min,摇匀,用酶标仪在570nm处测定吸光值。体外淋巴细胞增殖能力用刺激指数来表示,计算方法如下:式中:a1为空白对照在570nm处下的吸光值;a2为阴性对照组在570nm处下的吸光值,a3为实验组在570nm处下的吸光值。3.实验结果及分析:表1生物活性多肽nnqflpypyyakpa对体外淋巴细胞增殖的影响实验分组刺激指数si阴性对照组1nnqflpypyyakpa1.194±0.138*注:*号标记为与阴性对照比较,有显著性差异(p<0.05)。实验结果见表1。由表1可知,在生物活性肽nnqflpypyyakpa的质量浓度为100μg/ml的条件下,乳源性生物活性肽nnqflpypyyakpa的刺激指数大于bsa,说明nnqflpypyyakpa一定程度上能刺激体外小鼠淋巴细胞的增殖。并且nnqflpypyyakpa的刺激指数达到了1.194,和阴性对照组具有显著差异(p<0.05)。因此,可以认定该活性多肽nnqflpypyyakpa具有显著促进小鼠淋巴细胞增殖的能力,可以作为一种保健品或者添加剂食用,能够提高动物和人体的免疫力。二、生物活性多肽nnqflpypyyakpa的促巨噬细胞吞噬中性红能力实验1.实验试剂及仪器:试剂:实验动物balb/c小鼠(雄性6-8周龄)上海交通大学农业与生物学院动物实验中心;实施例1获得的乳源性生物活性多肽nnqflpypyyakpa;lps,购自sigma公司;中性红染色液,碧云天生物技术研究所生产。仪器设备:lrh-250f生化培养箱上海恒科技有限公司;gl-22m高速冷冻离心机上海卢湘仪离心机仪器有限公司;heracell150co2培养箱heraeus公司;dragonwellscanmk3酶标仪labsystems公司。2.实验方法:加入细胞个数为2×106/ml的细胞悬液100μl/孔,贴壁纯化后加入含活性肽nnqflpypyyakpa(1mg/ml)的rpmi1640完全培养液(10%fbs)200μl/孔为实验组,添加不含活性肽的rpmi1640完全培养液(10%fbs)200μl/孔进行培养的设为空白组;并且实验组和空白组在培养到24h时加入lps至终浓度10μg/ml;继续培养至48h后,吸弃细胞培养液。pbs清洗孔底后加入37℃的中性红染液80μl/孔,10分钟后吸弃染液,用pbs清洗两次后,每孔加入150μl细胞裂解液(冰醋酸:无水乙醇=1:1,v/v)。4℃隔夜溶解后,在波长540nm下测定吸光度值(od540)。3.实验结果及分析:表2生物活性多肽nnqflpypyyakpa促巨噬细胞吞噬中性红能力的测定实验分组炎症组吸光度值(od540)空白组0.1031±0.0846实验组0.151±0.0274**注:*,与阴性对照比较,有显著性差异(p<0.05)**,与阴性对照组比较,有显著性差异(p<0.01)实验结果见表2,与细胞空白相比较,添加1mg/ml生物活性多肽nnqflpypyyakpa的炎症组巨噬细胞吞噬中性红能力明显增加,而且与细胞空白组比较,具有显著性差异(p<0.01)。说明生物活性多肽nnqflpypyyakpa在有炎症发生的情况下对体外巨噬细胞吞噬中性红能力具有显著的促进作用。实施例3生物活性肽的抗衰老活性实验一、生物活性多肽nnqflpypyyakpa对秀丽线虫生殖能力影响的实验1.实验试剂及仪器:试剂:秀丽线虫(caenorhabditiselegans),复旦大学附属中西结合研究院;大肠菌株e.coliop50,复旦大学附属中西结合研究院;琼脂粉,国药集团化学试剂有限公司;酵母粉,国药集团化学试剂有限公司;实施例1获得的乳源性生物活性多肽nnqflpypyyakpa。仪器设备:力康ro15纯水系统,力康生物医疗科技有限公司;g136t型zealway智能高温灭菌锅,厦门致微仪器科技有限公司;thz-32型台式恒温振荡器,上海精密实验设备有限公司;tdl-40b离心机,上海安亭科学仪器厂;卢湘仪gl-22m高速冷冻离心机,上海卢湘仪仪器有限公司;博迅bj-cdseries生物安全柜,上海博讯实业有限公司;nikko倒置电子显微镜,尼康株式会社。2.实验方法:(1)ngm平板制备取大肠杆菌菌种于lb平板划线,挑取单菌落于10mllb液体培养基中,37℃,200rpm,振荡培养24h,至od600=0.4用于接种ngm平板喂养线虫。取100μl菌液涂于60mmngm平板,注意菌液边缘应距离平板边缘0.5cm左右。已涂布的ngm平板在室温(21-25℃)过夜后即可使用。(2)线虫培养本实验中所用的线虫均为雌雄同体,在标准培养条件(温度20℃,湿度40%~60%)下培养生长。(3)线虫的同期化处理1)高氯酸钠漂白法准备孕虫生长板(即板中80%以上虫子处于生殖期)2-3板,取5mlm9缓冲液冲洗2次,将缓冲液吸入15ml离心管中,1000r/min离心3min,弃去上清。加入5ml新配同期化漂白液,室温下剧烈振荡2.5min,以将成虫虫体腐蚀。离心,弃去上清。保证总处理时间不能超过5min,防止损伤虫卵。再加入m9缓冲液将沉淀重悬,混匀后离心,弃去上清,重复此过程3次。2)限时产卵法挑取若干条处于产卵期的线虫于同一平板内,挑取的具体数量以所需同期化线虫数目为依据。一般条件下,一条产卵期线虫能在1h以内产卵6个左右。在平板中培养0.5h后,挑出平板中线虫,则平板中的卵处于同一生长时期。(4)指标测定本实验以秀丽线虫作为动物模型,挑取同期化处理后的l4期线虫到相应浓度的ngm板中。每个浓度至少8条线虫,每个ngm板转入一条,记为0天,以后每天移至新板中直至线虫生殖基本不再产卵,在其进入产卵期之前对线虫总产卵数进行计数。3.实验结果及分析:实验结果如图4所示,与不喂食多肽nnqflpypyyakpa的空白组相比较,喂食不同质量浓度的实验组中,其平均产卵数均有不同程度的增加。喂食的多肽nnqflpypyyakpa浓度为300mg/l时,线虫平均产卵数与空白组相比具有极其显著的差异(p<0.01),而在其浓度为400mg/l、500mg/l时,与空白组相比却只呈现显著性差异(p<0.05),这也进一步证明了300mg/l为混合肽多肽nnqflpypyyakpa作用最佳浓度,随着肽浓度的提高并不会抑制线虫生殖,而是其作用效果减弱。综上所述,多肽nnqflpypyyakpa在一定浓度下能明显提升线虫的生殖能力。同时,此实验结果表明,多肽nnqflpypyyakpa300mg/l为最适浓度。但随着浓度的增加,线虫的生殖能力却不再出现明显提高。二、生物活性多肽nnqflpypyyakpa对秀丽线虫体长影响的实验1.实验试剂及仪器:试剂:秀丽线虫(caenorhabditiselegans),复旦大学附属中西结合研究院;大肠菌株e.coliop50,复旦大学附属中西结合研究院;琼脂粉,国药集团化学试剂有限公司;酵母粉,国药集团化学试剂有限公司;实施例1获得的乳源性生物活性多肽nnqflpypyyakpa。仪器设备:力康ro15纯水系统,力康生物医疗科技有限公司;g136t型zealway智能高温灭菌锅,厦门致微仪器科技有限公司;thz-32型台式恒温振荡器,上海精密实验设备有限公司;tdl-40b离心机,上海安亭科学仪器厂;卢湘仪gl-22m高速冷冻离心机,上海卢湘仪仪器有限公司;博迅bj-cdseries生物安全柜,上海博讯实业有限公司;nikko倒置电子显微镜,尼康株式会社。2.实验方法:(1)ngm平板制备取大肠杆菌菌种于lb平板划线,挑取单菌落于10mllb液体培养基中,37℃,200rpm,振荡培养24h,至od600=0.4用于接种ngm平板喂养线虫。取100μl菌液涂于60mmngm平板,注意菌液边缘应距离平板边缘0.5cm左右。已涂布的ngm平板在室温(21-25℃)过夜后即可使用。(2)线虫培养本实验中所用的线虫均为雌雄同体,在标准培养条件(温度20℃,湿度40%~60%)下培养生长。(3)线虫的同期化处理1)高氯酸钠漂白法准备孕虫生长板(即板中80%以上虫子处于生殖期)2-3板,取5mlm9缓冲液冲洗2次,将缓冲液吸入15ml离心管中,1000r/min离心3min,弃去上清。加入5ml新配同期化漂白液,室温下剧烈振荡2.5min,以将成虫虫体腐蚀。离心,弃去上清。保证总处理时间不能超过5min,防止损伤虫卵。再加入m9缓冲液将沉淀重悬,混匀后离心,弃去上清,重复此过程3次。2)限时产卵法挑取若干条处于产卵期的线虫于同一平板内,挑取的具体数量以所需同期化线虫数目为依据。一般条件下,一条产卵期线虫能在1h以内产卵6个左右。在平板中培养0.5h后,挑出平板中线虫,则平板中的卵处于同一生长时期。(4)指标测定实验分组:空白组和多肽组。不同组线虫,在同一时期下体长之间的差异,可以在一定程度上反映出该活性物质对于线虫生长发育的影响。各组同期化培养的线虫在生长至l2期(培养2天左右)时,分别挑取40条线虫至各自ngm平板,连续2天、3天、4天、5天、6天、8天、10天用倒置显微镜观察其生长状态,测定和记录其体长,每组取其平均值。3.实验结果及分析:在20℃的培养条件下,从线虫生长的l2期(第2天)开始观察,l3期(第3天)、l4期(第4天)、成虫期(第6天),连续观察8天,直至线虫生长的第10天,测定每个时间点下线虫的体长。结合图5和图6可以看出,各组线虫在l4期时其体长均为1000μm左右,无明显区别。同时,从线虫体长变化曲线中也可看出,实验组体长变化曲线也几乎和空白组体长变化曲线相重合,在线虫l3期(第3天)时,虽然线虫平均体长稍有区别,但是在统计学上并不呈现显著性差异。实验表明,多肽nnqflpypyyakpa的浓度并不会影响线虫的生长。同时,也可发现线虫在l3期(第3天)至l4期(第4天),是其生长最为快速的阶段。三、生物活性多肽nnqflpypyyakpa的急性氧化应激存活率实验1.实验试剂及仪器:试剂:秀丽线虫(caenorhabditiselegans),复旦大学附属中西结合研究院;大肠菌株e.coliop50,复旦大学附属中西结合研究院;琼脂粉,国药集团化学试剂有限公司;酵母粉,国药集团化学试剂有限公司;30%过氧化氢溶液,国药集团化学试剂有限公司;实施例1获得的乳源性生物活性多肽nnqflpypyyakpa。仪器设备:力康ro15纯水系统,力康生物医疗科技有限公司;g136t型zealway智能高温灭菌锅,厦门致微仪器科技有限公司;thz-32型台式恒温振荡器,上海精密实验设备有限公司;tdl-40b离心机,上海安亭科学仪器厂;卢湘仪gl-22m高速冷冻离心机,上海卢湘仪仪器有限公司;博迅bj-cdseries生物安全柜,上海博讯实业有限公司;nikko倒置电子显微镜,尼康株式会社。2.实验方法:(1)ngm平板制备取大肠杆菌菌种于lb平板划线,挑取单菌落于10mllb液体培养基中,37℃,200rpm,振荡培养24h,至od600=0.4用于接种ngm平板喂养线虫。取100μl菌液涂于60mmngm平板,注意菌液边缘应距离平板边缘0.5cm左右。已涂布的ngm平板在室温(21-25℃)过夜后即可使用。(2)线虫培养本实验中所用的线虫均为雌雄同体,在标准培养条件(温度20℃,湿度40%~60%)下培养生长。(3)线虫的同期化处理1)高氯酸钠漂白法准备孕虫生长板(即板中80%以上虫子处于生殖期)2-3板,取5mlm9缓冲液冲洗2次,将缓冲液吸入15ml离心管中,1000r/min离心3min,弃去上清。加入5ml新配同期化漂白液,室温下剧烈振荡2.5min,以将成虫虫体腐蚀。离心,弃去上清。保证总处理时间不能超过5min,防止损伤虫卵。再加入m9缓冲液将沉淀重悬,混匀后离心,弃去上清,重复此过程3次。2)限时产卵法挑取若干条处于产卵期的线虫于同一平板内,挑取的具体数量以所需同期化线虫数目为依据。一般条件下,一条产卵期线虫能在1h以内产卵6个左右。在平板中培养0.5h后,挑出平板中线虫,则平板中的卵处于同一生长时期。(4)指标测定实验分组:空白组和多肽组。将同期化处理后的l4期线虫置于相应ngm板中,实验在含20mmh2o2的ngm平板中进行,每板数量不少于10条,每半小时计数线虫死亡、存活数目,线虫死亡判断标准:无移动及吞咽动作,轻触后仍无任何反应。剔除标准:①逃离至平板壁或盖上而干死;②虫卵在体内孵化而成袋样虫:③钻入琼脂中。3.实验结果及分析:表3生物活性多肽nnqflpypyyakpa对线虫在氧化应激下的影响由表3可以看出,实验组线虫在氧化应激下平均寿命具有显著性提高(p<0.05),多肽nnqflpypyyakpa组呈现极其显著性差异(p<0.05)。各组半数死亡时间也相应在一定程度上有所延长,与其他实验组相比混合肽组呈现显著性提高(p<0.05)。如图7所示,在氧化应激条件下,实验组存活率均明显高于空白组存活率。这说明在氧化应激条件下,线虫的存活率得到了显著提高,可能是由于多肽nnqflpypyyakpa能有效帮助线虫抵抗氧化损伤,清除体内产生的自由基以及降低过氧化物的积累,而非通过增强其耐热力实现的。机体寿命的延长在一定程度上是由于改善了细胞对胁迫条件的抵抗力,因而延缓衰老与压力应激条件下的存活率存在很大关系。本实验结果证明多肽nnqflpypyyakpa能显著地增加线虫的压力应激和氧化应激能力,提高线虫的存活率,说明一定浓度的多肽nnqflpypyyakpa对于线虫具有抗衰老的功效。通过以上实施例可以得出,本发明生物活性多肽nnqflpypyyakpa具有免疫调节功能和抗衰老功能。上述的对实施例的描述是为便于该
技术领域:
的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。序列表<110>上海交通大学;浙江辉肽生命健康科技有限公司<120>一种生物活性多肽nnqflpypyyakpa及其制备方法和应用<160>3<170>siposequencelisting1.0<210>1<211>14<212>prt<213>人工序列(artificialsequence)<400>1asnasnglnpheleuprotyrprotyrtyralalysproala1510<210>2<211>42<212>dna<213>人工序列(artificialsequence)<400>2aataatcaatttctgccatacccatattatgcaaagccagct42<210>3<211>190<212>prt<213>人工序列(artificialsequence)<400>3metmetlysserphepheleuvalvalthrileleualaleuthrleu151015propheleuglyalaglngluglnasnglngluglnproileargcys202530glulysaspgluargphepheserasplysilealalystyrilepro354045ileglntyrvalleuserargtyrprosertyrglyleuasntyrtyr505560glnglnlysprovalalaleuileasnasnglnpheleuprotyrpro65707580tyrtyralalysproalaalavalargserproalaglnileleugln859095trpglnvalleuserasnthrvalproalalyssercysglnalagln100105110prothrthrmetalaarghisprohisprohisleuserphemetala115120125ileproprolyslysasnglnasplysthrgluileprothrileasn130135140thrilealaserglygluprothrserthrprothrthrglualaval145150155160gluserthrvalalathrleugluaspserprogluvalilegluser165170175proprogluileasnthrvalglnvalthrserthralaval180185190当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1