蜡梅CpWOX13基因及其编码的蛋白和应用的制作方法
本发明涉及基因工程领域,具体地说,涉及蜡梅cpwox13基因及其在花期调控中的应用。
背景技术:
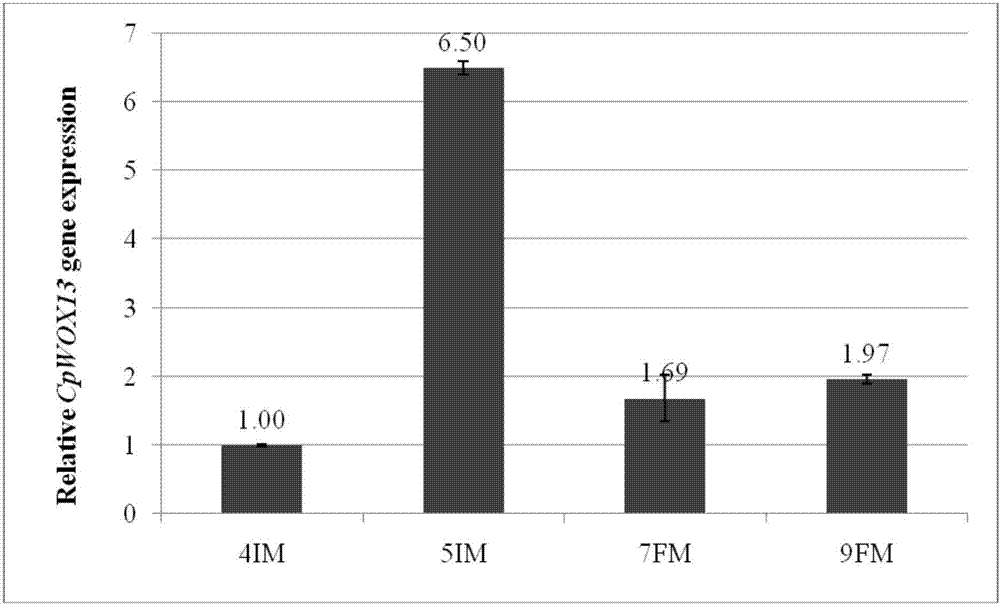
:蜡梅[chimonanthuspraecox(l.)link.]也叫腊梅,还被称为香木、唐梅、岩子桑等,是樟目蜡梅科蜡梅属的落叶灌木,属于二级濒危植物(左丹丹等,2007)。原产于我国长江下游,主要分布于苏、浙、皖、鄂、赣等地,人工栽培史可追溯至唐代,冬季开花且耐寒耐旱,有不俗的观赏价值和可观的经济价值。在世界范围内将蜡梅科植物分为4个属,10个种(张若蕙,1998)。这四个属分别是位于澳大利亚昆士兰的椅子树属(idiospermunblake),美国东南部和加利福尼亚州生长的美国蜡梅属(calycantusl.),还包括原产中国温带的夏蜡梅属(sinocalycanthuscheng)及蜡梅属(calycantusl.)。李烨(1998)通过研究蜡梅各属之间的演化及发展关系,又把蜡梅科分为了两个亚科,分别是椅子树亚科(idiospermoideae)及蜡梅亚科(calycanthoideae),其中蜡梅亚科包括夏蜡梅属、蜡梅属及美国蜡梅属,而椅子树亚科只有椅子树属。四个属中演化水平最高的属是椅子树属,而最原始的属是蜡梅属。随着现代分子生物学的发展,生物技术已经广泛应用于植物、动物和微生物的研究中。有关蜡梅的分子生物学研究主要分为品种分类和基因功能两部分。目前rapd、issr等分子标记技术已熟练地用于蜡梅的品种分类和群居遗传结构分析等。杜灵娟(2012)等人采用rapd技术对南京地区38个蜡梅品种自然居群遗传变异进行了分析,发现群内每个单株之间的遗传差异比较大,而居群间的遗传距离较近,因此得出遗传变异主要发生于群居内,这与形态学分类结果相符合。赵明晓等(2011)分别将蜡梅成熟叶及嫩叶的基因组进行提取检测比较,为后人利用aflp技术对蜡梅品种分类及自然居群遗传多样性分析进行了铺垫。而赵冰等人建立有关蜡梅的aflp分子标记体系,为aflp技术用于研究蜡梅系统发育及遗传多样性打下基础(赵冰,2007);杨佳(2012)采用了est-ssr技术对蜡梅的遗传结构和遗传多样性进行分析,对蜡梅的遗传结构特征及遗传多样性水平进行了初步探讨。此外,眭順照(2006)构建了第一个蜡梅花cdna文库,且对蜡梅开花过程中的基因进行了表达分析,在其基础上先后克隆出不同功能相关的基因,并对其进行了系统的研究;如cpcor413pm1(秦华,2006)与蜡梅的抗寒性相关,将其转入烟草,对转基因烟草进行处理发现转基因烟草的耐低温能力提高;cpap3与花瓣状器官发育形成有关;cppex22与抗衰老、抗氧化存在一定关系;将cpagl6转入拟南芥中,与野生型拟南芥相比出现提前开花、植株矮化、雄蕊的形态及数目都发生了变化;cpkti胰蛋白酶抑制基因,将其转入烟草超量表达,发现转基因烟草的抗虫性提高;cpchia(谢树章,2009)几丁质酶基因;cppr-4(秦朝,2012)病程相关蛋白基因等。上述蜡梅基因功能的初步研究,为以后蜡梅分子生物学研究做出一定贡献。近年来报道的wox基因无一例外的从植物中被发现,所以普遍认为wox是植物特有的转录因子,并且把植物中具有wus盒的转录因子都归为wox(wushomeobox)转录因子家族。如在拟南芥(arabidopsisthaliana)中的15个成员(wus、wox1-wox14)分别参与了胚的发育、花器官的形成、花发育、侧生器官的发育以及茎尖和根尖顶端分生区干细胞的维持等重要生命活动。参考系统发育树拟南芥中的wox蛋白存在三个进化枝,分别为:wus进化枝(wusclade),即现代进化枝,包括wus、wox1、wox2、wox3、wox4、wox5、wox6、wox7以及它们在种子植物中的直系同源蛋白;中间进化枝(intermediateclade),是wus进化枝的姐妹进化枝,包括wox8、wox9、wox11、wox12以及它们在维管植物中的直系同源蛋白;古老进化枝(ancientclade),包括wox10、wox13和wox14及它们在维管和非维管植物中的直系同源蛋白(haoetal.,2013;zhangetal.,2011)。wuschel-relatedhomeobox13(wox13)基因是wox基因家族的成员(priggeetal.,2005),属于古老进化枝,在拟南芥中参与成花转化和根的发育过程,也与莲座叶的发育有关,此外还参与花器官发育过程的调控。这一类转录因子,参与植物干细胞的调控。1996年laux最早发现并确定了wus基因功能(priggeetal.,2005),他发现突变体中真叶的缺失与顶端优势的消失呈正相关,wus基因的缺失导致种子萌发速度变慢,发育迟缓甚至停滞,分枝数量和密度呈上升趋势,主茎态势不明显,且分枝重复主茎莲座叶的发育模式。成功克隆出编码291个氨基酸的wus基因,分析其结构发现wus是同源异型结构域蛋白中的一个新亚型(haeckeretal.,1991)。此后关于wox家族基因的研究逐步深入,系统地形成了三大分支的基本分类体系。蜡梅作为少有的冬季开花植物,且花香浓郁,具有较高经济和观赏价值。因此对其花发育研究十分有意义。而拟南芥中wox13参与成花转化和根的发育过程,也与莲座叶的发育有关,此外还参与花器官发育过程的调控,所以,对蜡梅中cpwox13基因功能分析可以为进一步研究蜡梅开花及生物量的调控机制提供一些有价值的参考,并且为植物分子育种提供基因资源。技术实现要素:本发明的目的是提供蜡梅cpwox13基因及其在花期及生物量调控中的应用。为了实现本发明目的,本发明的蜡梅cpwox13蛋白,其为:1)由seqidno.2所示的氨基酸组成的蛋白质;或2)在seqidno.2所示的氨基酸序列中经取代、缺失或添加一个或几个氨基酸且具有同等活性的由1)衍生的蛋白质。本发明还提供蜡梅cpwox13蛋白的编码基因,即cpwox13基因的cdna序列如seqidno.2所示。本发明还提供含有cpwox13基因的载体、宿主细胞及工程菌。本发明还提供cpwox13基因在调控植物花期中和提高生物量的应用。所述植物为拟南芥。本发明还提供cpwox13基因在制备转基因植物中的应用。本发明进一步提供一种转基因植株的构建方法,采用农杆菌介导的方法,将含有cpwox13基因的载体转入植物组织中,筛选转基因植株。本发明具有以下优点:本发明首次克隆获得蜡梅cpwox13基因,并通过转基因技术,在植物(拟南芥)中验证了该基因的功能,结果表明,转基因拟南芥花期提前、株高变高、根系变长、侧根增多,为进一步改良观赏性植物,如蜡梅的花期调控及增加物种生物量提供可能。附图说明图1为蜡梅cpwox13蛋白序列系统发育树,其中,拟南芥(arabidopsisthaliana)的wox14a(np_001322715),wox14b(np_173493),wox10(np_173494),wox13(np_195280),wox11a(np_187016),wox11b(aap37140),wox12a(np_197283),wox12b(np_001330983),wox7a(np_196196),wox7b(air72305),wox7c(oao92889),wox5(np_187735),wox4a(np_001320246),wox4b(np_175145),wox1a(np_188428),wox1b(aap37133),wox8(np_199410),wus(caa09986),wox2b(aap37131),wox2a(oao90278),erythrantheguttata的wox8(xp_012845314);oryzasativajaponicagroup的wox2(xp_015639083),wox8a(xp_015626455),wox12(xp_015638690)wox4(xp_015635367),wox5(xp_015644226);oryzabrachyantha的wox3-like(xp_015692532),wox5-like(xp_006646469);phoenixdactylifera的wox8-like(xp_008812362);nelumbonucifera的wus(aap37131),wox3-like(xp_010259966),wox1-like(xp_010274717),wox2(xp_010260182),wox8-like(xp_010270477),wox9-like(xp_010279211),wox11(xp_019054443),wox7-like(xp_010256620),wox5-like(xp_010262794),wox4-like(xp_010270556),vitisvinifera的wox8(xp_002272420),amborellatrichopoda的wox8(xp_006855728);piceaabies的wox8c(agl53586),wox8d(agl53587),wox8b(agl53585),wox8a(agl53584)。图2所示为cpwox13基因在蜡梅不同月份花序样品中实时定量pcr分析结果,actin基因作为内参。其中,4im、5fm、7fm和9fm分别4、5、7、9月份的花序。图3所示为35s::cpwox13超量表达转化野生型拟南芥(col-0)t2代在长日照(14小时光照/10小时黑暗)条件下实时定量pcr检测结果;cpwox13相对表达量。三个重复,actin作为内参。其中,wt:野生型拟南芥;其他为超量表达35s::cpwox13/1#、2#、3#、6#、7#、8#拟南芥转基因株系。内参基因actin,设3次技术重复。图4为35s::cpwox13超量表达转化野生型拟南芥(col-0)t2代在长日照(14小时光照/10小时黑暗)条件下,拟南芥内源基因实时定量pcr检测结果;三个重复,tubulin作为内参。其中,在图3中cpwox1基因高表达的8#、中等表达的3#和低表达的6#为表示不同表达量的35s::cpwox13转基因株系,继续开展后续表型观察和内源基因定量分析实验。图5为35s::cpwox13超量表达转化野生型拟南芥(col-0)t2代的花期、株高等表型分析结果。a、b为28d野生型拟南芥现蕾,从左至右依次为wt、株系6#、株系3#、株系8#;c、d为60d野生型拟南芥结最后的果荚时高度对比,c中从左至右依次为株系6#、株系3#、株系8#和wt,d中右侧为wt;e、f为株系3#与株系8#中最早开花的转基因植株与wt对比,左侧为wt;所用土壤为蚯蚓粪:蛭石:腐殖土=2:2:1;培养条件为长日照ld:16h光照/8h黑暗;温度21℃左右。图6为35s::cpwox13超量表达转化野生型拟南芥(col-0)t2代的根系生长表型分析结果。其中,a中左侧为转基因植株,右侧为wt,红色圆框内转基因植株侧根数量与密集程度明显高于wt;b为a的正面照,左侧为wt;c、d中红色方框所示为wt,其他均为不同株系转基因植株,可见wt根长明显偏短;培养基为ms无抗性培养基具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。实施例1蜡梅cpwox13基因的克隆及表达分析1蜡梅cpwox13基因克隆1.1总rna的提取(1)取罄口蜡梅(chimonanthuspraecox)(种植于重庆市北碚区天生路2号西南大学校园内第四运动场旁边,常规养护管理)花芽、花蕾(4、5、7、9月份)、盛开、衰败及叶片混合样品。rna提取所用的玻璃器皿、研钵、研杵、剪刀、镊子、药勺等均用0.1%depc水溶液在37℃下浸泡处理12h,然后用锡纸包裹于180℃烘箱中干热灭菌4h后冷却备用。rna提取采用北京天根公司生产的rnapreppure植物总rna提取试剂盒,提取过程根据说明书略有改动,具体操作如下:(1)取500μl裂解液rl转入1.5ml离心管中,加入1%β-巯基乙醇,混匀备用。液氮中研磨适量植物组织成细粉后,取50mg细粉转入离心管中,加入上述rl500μl,立即用涡旋振荡器剧烈震荡混匀,使其充分裂解。(2)将溶液于12,000rpm离心5min,小心吸取收集管中的上清至新的rnase-free离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀。(3)缓慢加入0.5倍上清体积的无水乙醇(通常为250μl),混匀(此时可能出现沉淀),将得到的溶液和沉淀一起转入吸附柱cr3中,12,000rpm离心30-60s,倒掉收集管中的废液,将吸附柱cr3放回收集管中。(4)dnasei工作液的配制:取10μldnasei储存液放入新的rnase-free离心管中,加入70μlrdd溶液,轻柔混匀。(5)向吸附柱cr3中央加入80μldnasei工作液,室温放置15min。(6)向吸附柱cr3中央加入350μl去蛋白液rw1,12,000rpm离心30-60s,倒掉收集管中的废液,将吸附柱cr3放回收集管中。(7)向吸附柱cr3中央加入500μl漂洗液rw(使用前加入无水乙醇),室温静置2min,12,000rpm离心30-60s,倒掉收集管中的废液,将吸附柱cr3放回收集管中。重复该步骤一次。(8)12,000rpm离心2min,倒掉废液。将吸附柱cr3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。(9)将吸附柱cr3放入一个新的rnase-free离心管中,向吸附膜的中间部位悬空滴加20-100μlrnase-freeddh2o,室温放置2min,12,000rpm离心2min,得到rna溶液。1.2蜡梅cdna第一链的合成使用takara公司的primescriptrt-pcrkit反转录试剂盒进行cdna第一链的合成。按照说明书的步骤进行,总共分两步:第一步为去除基因组dna反应;第二步为反转录反应。具体操作如下:(1)按下表配制第一步反应体系:表1反转录第一步体系(2)42℃反应5min为混合液1。(3)按下表配置第二步反应体系:表2反转录第二步体系(4)反转录程序为,37℃反应15min,然后85℃反应5sec;(5)cdna产物保存于-20℃冰箱。1.3cpwox13基因克隆依照本实验室构建的蜡梅花cdna文库注释信息(liuatal.,2014),检测得到包含完整orf框的cpwox13基因的cdna序列。该cdna文库实验材料为校内种植的磬口蜡梅,取其的不同时期的花为材料构建。依照所得cdna序列设计特异性引物,上下游引物包含完整orf序列,引物序列如表3:表3蜡梅cpwox13基因克隆引物注:r:a/g;s:g/c;y:c/t;k:g/t;w:a/t;引物后f代表上游,r代表下游。1.4pcr回收产物的纯化pcr扩增获得的产物用l%的琼脂糖凝胶进行检测,将扩增产物中大小为800-1000bp之间的条带和特异条带切下来,进行回收,并按照天根公司普通琼脂糖凝胶dna胶回收试剂盒说明书对目的dna片段进行回收。1.5pcr回收产物的连接连接反应体系见表4。表4连接反应体系pcr回收产物1-3μl缓冲溶液solutioni5μlpmd19-tvector0.5μlrnase-freeddh2o1.5-3.5μltotal10μl4℃过夜,进行连接反应。1.6cacl2法制备大肠杆菌dh5α感受态细胞(1)从新活化的大肠杆菌平板上挑取一单菌落,接种于3-5mllb液体培养中,37℃振荡培养12h左右,直至对数生长期。将该菌悬液以1:100-1:50转接于50mllb液体培养基中,37℃振荡扩大培养,至od600为0.4-0.6时停止培养。(2)将培养液倒入在冰上预冷好的无菌50ml离心管中,冰上放置10min,于4℃,4,100rpm,离心10min。(3)倒净上清培养液,在无菌滤纸上倒置1min,用30ml冰上预冷的0.1mcacl2溶液轻轻悬浮细胞,4℃,4,100rpm,离心10min。(4)弃去上清液,加入2ml冰上预冷的0.1mo1/lcacl2溶液,轻轻悬浮细胞。冰上放置片刻后,即制成了感受态细胞悬液;制备好的感受态细胞悬液可直接用于转化实验,也可加入占总体积15%左右高压灭菌过的甘油,混匀分装后用液氮浇于其上迅速结冻后于-80℃保存。1.7连接产物的转化连接产物转化大肠杆菌感受态细胞(1)将大肠杆菌感受态从-80℃冰箱取出,置于冰上融化。将连接产物于70℃水浴锅中灭活10min。(2)将连接产物或待转化的质粒,按照每200μl感受态细胞加入100ng已纯化质粒的标准,加入到感受态细胞中,轻轻混匀后在冰上静置30min。(3)42℃水浴中热激90s,迅速取出后立即置于冰上2min。(4)加入600μl37℃预热的无抗lb液体培养基,混匀后于37℃,130rpm震荡培养1h。(5)室温下10,000rpm离心1min,弃掉400μl上清液,将剩余的200μl菌夜重悬,用无菌的涂棒将重悬菌液均匀涂在含有相应抗生素的lb固体平板上,37℃倒置培养12-14h。1.8阳性克隆培养与pcr鉴定单克隆通过iptg/x-gal筛选,取无菌的1.5ml离心管,加入0.5ml含50mg/lamp的lb液体培养基,从转化过的平板上用无菌牙签轻轻挑取单菌落置于离心管中,37℃200rpm摇床中振荡培养8-10h,待菌液浑浊后,以其作为模板进行pcr鉴定。菌液pcr扩增体系:pcr反应程序:94℃变性5min;94℃变性30s,54℃退火30s,72℃延伸1min,26个循环;72℃延伸10min。1.9测序及序列分析选择插入片段大小与预期接近且特异的阳性克隆进行测序。蜡梅cpwox13基因的cdna序列如seqidno.1所示,其编码蛋白的氨基酸序列如seqidno.2所示。通过mega5对cpwox13编码的蛋白序列及比对得到的其同源序列进行分析构建进化树(图1),采用nj法,检验参数设置为1000bootsrap重复。如图所示,所有的蛋白序列被分为明显的三个组,分别对应wox家族三个进化枝,与前人研究报道一致,其中cpwox13编码的蛋白与拟南芥wox13蛋白、葡萄wox8蛋白同属于古老进化枝,说明其进化地位比较低。在ncbi中用blastp对cpwox13的氨基酸序列进行同源性比对,结果显示其与多种植物wox13蛋白的氨基酸序列具有较高同源性,如与苹果(malusdomestica,xp_008392426.1)、梅(prunusmume,xp_008237971.1)、桃(prunuspersica,oni05494.1)、大豆(glycinemax,xp_003523048.1)的相似性均为86%,其中与莲(nelumbonucifera,xp_010270477.1)的相似性最高,达94%。2蜡梅cpwox13基因表达分析对蜡梅cpwox13基因在不同月份的花序原基或花序中表达分析,发现该基因在4月(4im),5月(5im),7月(7fm)和9月(9fm)中均有表达,但表达水平有较大差异(图2)。该基因在5im时期表达量最高,是4im中表达量的6.5倍,分别是7fm和9fm的3.8倍和3.3倍,而7fm和9fm表达量差别不大(图2)。实施例2农杆菌介导的蜡梅cpwox13基因转化(拟南芥)1表达载体的构建根据实验要求,本实施例中利用了载体pcambia2301g上的多克隆酶切位点特性,将克隆载体上的cdna片段酶切后连接到表达载体当中。2农杆菌gv3101和eha105电激感受态细胞的制备和表达载体的转化(1)挑取新鲜的农杆菌gv3101和eha105单菌落于10mllb液体培养基中,28℃振荡培养至对数晚期;(2)取1ml菌液加入100ml新鲜lb液体培养基中,28℃振荡培养至od600约为0.5-1.0;(3)将菌液转移至50ml离心管中,冰浴30分钟;(4)4℃,4000rpm离心10分钟,收集菌体,弃上清;(5)沉淀用50ml预冷的hepes灭菌蒸馏水重悬;(6)4℃,4000rpm离心10分钟,收集菌体,弃上清;(7)重复操作(5)、(6)两次,每次hepes减半;(8)用含10%甘油的灭菌蒸馏水重悬菌体,按每管50μl体积分装至1.5mleppendorf管中,即为农杆菌感受态细胞,分装后直接使用或于-70℃保存备用;(9)取50μl上述制备的感受态细胞,加入0.5μg质粒,轻轻混匀,置于冰上;(10)2500伏电击5ms,立刻加入500μllb液体培养基;(11)28℃,150rpm,恢复培养4个小时;(12)涂布适量的细胞于筛选lb固体培养基平板上,超净台吹干表层液体,28℃培养2-3天。3农杆菌介导的拟南芥转化(花芽浸泡法)待拟南芥花序抽苔约1cm高时,剪去主花序。待植株发出侧生花序,并生长至花蕾未展开时,进行转化实验。接种含有表达载体的农杆菌克隆于5mllb液体培养基(gen:50mg/l,kan:50mg/l)中,28℃,200rpm中振荡培养过夜;按1:50的比例转接到200mllb液体培养基中,28℃,200rpm,振荡培养5小时;5000rpm,离心15分钟,收集菌体;重悬于缓冲液(5%蔗糖,0.03%silwetl-77)中,调od600至0.8。将花序倒置放入混好的农杆菌菌液中10秒,用保鲜膜覆盖整个花序,24小时后取下保鲜膜,继续培养于培养室(22℃,14小时光照/10小时黑暗),直至收获种子(cloughandbent,1998)。4拟南芥阳性苗的筛选(1)将收获的转化拟南芥种子在70%乙醇中浸泡2分钟,去上清;(2)次氯酸钠溶液浸泡5分钟进一步进行消毒处理,用无菌水漂洗3-5次;(3)将拟南芥种子播于含50μg/ml抗生素kan的1/2ms培养基平板上;(4)如果穿梭载体上具kan抗性的报告基因,将培养平板置于光照培养室(22℃,16小时光照/8小时黑暗)培养7-10天;选择经过kan筛选后长势良好,真叶叶片及生长点呈深绿色且根部可以扎入培养基的植株,初步确定为阳性苗,移栽入土中。5实时定量rt-pcr以转基因拟南芥t2代和以蜡梅各器官为材料,用trizol试剂盒提取总rna,然后用primescriptrtreagentkit(takara,japan)进行cdna第一链的反转录。将cdna第一链稀释10倍后作为模板进行pcr反应。然后利用sybrpremixextaq(bio-rad,usa)反应试剂盒,在bio-radcfx96荧光定量pcr仪(bio-rad,美国)上完成反应。分析所获得的数据并计算样品中目的基因浓度。pcr反应体系为10μl,共设置3个重复,反应条件为40个循环,95℃60秒,95℃5秒,60℃34秒。6转基因拟南芥株系cpwox13及其内源基因表达分析(1)转基因拟南芥cpwox13基因表达量检测为了可以进一步验证cpwox13基因在转基因的拟南芥中的表达水平,取野生型拟南芥和转基因拟南芥较嫩叶片4-6片(约400mg),用trizol法提取总rna,反转录为cdna做为模板,内参选择拟南芥atactin基因,对转基因拟南芥单株中cpwox13基因的表达量进行实时荧光定量pcr检测(图3),设置3个技术重复。wt单株中检测到极低的cpwox13基因的表达(表达量为0.00003),14棵转基因单株中cpwox13表达量均高于野生型。在检测的14棵转基因的拟南芥单株中,cpwox13基因的表达水平差异较大,其中株系8#的表达量最高(表达量为8.23386)约为wt的2.7×105倍,株系1#的表达量最低(表达量为0.72936)但也为wt的2.4×104倍,说明转基因单株中cpwox13表达量显著上调。其他转基因单株表达量从高到低是2#、7#、3#、6#、4#。分析定量结果挑选高表达量cpwox13/8#、中等表达量cpwox13/3#和低表达量cpwox13/6#用以表示不同表达量的转基因株系,继续开展后续表型观察和内源基因定量分析实验。其中高表达量cpwox13/8#接近低表达量cpwox13/6#的2倍,差异显著。(2)转基因拟南芥内源基因表达量分析为研究cpwox13基因具体功能,从转入拟南芥的cpwox13基因对拟南芥内源基因的影响入手。分别提取转基因拟南芥株系及野生型拟南芥rna,具体步骤见前文,根据序列设计特异引物进行实时荧光定量pcr检测(图4)。结果显示,cpwox13的转入导致所有10个拟南芥内源基因的表达量增加,与野生型相比较,所有基因的表达量均显著增加,最低的都增加了2倍,说明cpwox13基因对开花相关的基因有促进作用。其中,开化整合子atsoc1和atft表现出相一致的趋势,atft中cpwox13/3#表达量偏高可能因为ft编码的蛋白产物是从叶中转运至sam中表达的,而定量材料为拟南芥新鲜叶片,故atft趋势不同于其他开花基因。研究表明wus基因与ag基因形成wus/ag反馈调节环,定量结果则显示cpwox13与atag表达量正相关,即atag表达量受cpwox13的调控,后者一定程度上可以激活前者表达。cpwox13基因的导入,对a、b、c类基因均有影响,ap1、pi和ag均表现出上调趋势,说明cpwox13基因的功能与花发育过程联系紧密。定量结果可以看出,各个开花诱导途径的关键基因均有表达量增加的情况,说明cpwox13并不单一的参与某一条开花途径的调控,而是以调控关键基因的形式参与多条途径,调节植物的成花转化从而促进开花。7转基因拟南芥表型分析(1)花期提前:参照同样生长条件下wt的生长情况,观察并记录转基因拟南芥t2代纯合株系的生长状况,统计并分析发现,就发育的各个关键时间点(如抽薹的时间、第一朵花开的时间、第一个果荚出现时间)来说,转基因植株均早于野生型(如图5)。观察结果显示(表5),抽薹的时间(抽薹标志定为抽薹至1cm左右)上,35s::cpwox13/3#、35s::cpwox13/6#和35s::cpwox13/8#与wt之间相比差异显著,皆早于wt,而三者之间差异则不显著;同样,比较第一朵花开的时间,35s::cpwox13/3#,35s::cpwox13/6#和35s::cpwox13/8#也都早于wt且差异显著,而彼此之间则无明显差异;在结第一个果荚的时间上三个株系均与wt存在有显著差异,此外,35s::cpwox13/8#株系分别于35s::cpwox13/6#株系和35s::cpwox13/3#株系无显著差异,但后两者之间存在显著差异;转基因拟南芥的三个株系与野生型拟南芥相比连坐叶的数量均比野生型的减少(图5,表5),差异显著;此外,转基因拟南芥茎生叶普遍增多,高表达量株系与wt差异显著。综上所述,从蜡梅cpwox13基因异源表达拟南芥表型来看,cpwox13基因可能有如下功能:1.促进拟南芥花分生组织的产生;2.促进植物的生长,可能通过延长植物生命周期的方式促进植物纵向生长;3.与茎生叶生长有关,即与侧生器官的发育有关。表5转cpwox13基因拟南芥株系相关指标观察注:表中数据形式为:平均值±标准差;a、b、c、d、e、f表示p<0.05水平上差异显著(2)株高变高:转基因拟南芥的三个株系与野生型拟南芥相比株高都变高了,35s::cpwox13/3#、35s::cpwox13/8#与wt相比株高均增加了约12cm,35s::cpwox13/6#和与wt之间相比株高增加了10cm,且具有显著差异(图5,表5)。(3)根系变长、侧根增多:观察纯合转基因植株的根部的生长情况,发现转基因和非转基因植株根的萌发时间相差无几,但生长速度略有不同,野生型拟南芥明显偏慢,同时播下的种子,转基因拟南芥根长明显长于野生型拟南芥(如图6)。同时,在长势基本一致的转基因拟南芥和wt的对比中发现,转基因拟南芥主根上的侧根分支明显多于野生型(如图6)。表明,wox13基因作为重要的植物干细胞调控基因,cpwox13基因的转入很可能影响了拟南芥根尖分生组织的活动,促进了侧根的分化。cpwox13基因可能具有促进植物早花的功能,或者说cpwox13可以上调其他早花基因,达到促进植物开花和生长的目的;wus基因本来就是重要的植物干细胞调控基因,而wox13基因更是直接参与根的发育过程,因此cpwox13的异源表达很可能影响了拟南芥根尖分生组织的活动;另外,cpwox13的异源表达会使转基因拟南芥植株变高,可能对于植物地上部分生物量的提高有一定的作用。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。序列表<110>西南大学<120>蜡梅cpwox13基因及其编码的蛋白和应用<130><160>2<170>patentinversion3.3<210>1<211>927<212>dna<213>chimonanthuspraecox<400>1tctttggcttgcttgacctgtagataatgaaggtagaaaaatgatggtcttagagatggg60tgctctgagacatggtgggagagagagagaagaaggagcaaggatgcagtcagaagaaga120tgatgggcaatctcaacagggggtcttgtacgttaaggtgatgacagacgatcaaatgga180gatccttcggaggcaaatttctgcttatgccaccatatgcgagcaacttgttgagatgca240caaagaactcactgcacaacacgactctctttcaggaatgaggttaggaagtgtctattg300tgatcctttaatagcatctggaggccataaggtaagtgggaggcaacggtggatgcctac360tactatgcagctccaaattcttgagagtatctttcagcaaggtgacgggactccagacaa420gaagaagataaaagagataacctctgcattatcaaagcatggccaagtttctgaaacaaa480tgtctataattggtttcagaacagacgggctagatcaaaaaggaagcaactactgccttt540gaccaataatgcagaatctgaagtggaagagacagattttcccgaggataagaaagccaa600tgtagagaaacctttcttccctttttgaactactgatgtaatctcttgttgaccacctat660ctgcaggcctcatatgggaagggcttagatcctccacccagtattattttggttaatgtc720ataattgggattactggatcaatgatccggatcactagaccttgggtcatgggtccacat780gtagaagatcttatgccttcacaaatgatacgcttgtaaaagcttagaactttgtcctgt840tttctaattggcatgatgtgtaacataaaatgttgtttttacctttgataaatgcaggaa900tcaaccagcacttgattgggaagatgg927<210>2<211>195<212>prt<213>chimonanthuspraecox<400>2metmetvalleuglumetglyalaleuarghisglyglyarggluarg151015glugluglyalaargmetglnserglugluaspaspglyglnsergln202530glnglyvalleutyrvallysvalmetthraspaspglnmetgluile354045leuargargglnileseralatyralathrilecysgluglnleuval505560glumethislysgluleuthralaglnhisaspserleuserglymet65707580argleuglyservaltyrcysaspproleuilealaserglyglyhis859095lysvalserglyargglnargtrpmetprothrthrmetglnleugln100105110ileleugluserilepheglnglnglyaspglythrproasplyslys115120125lysilelysgluilethrseralaleuserlyshisglyglnvalser130135140gluthrasnvaltyrasntrppheglnasnargargalaargserlys145150155160arglysglnleuleuproleuthrasnasnalaglusergluvalglu165170175gluthrasppheprogluasplyslysalaasnvalglulysprophe180185190pheprophe195<210>3<211>21<212>dna<213>人工序列<400>3tctttggcttgcttgacctgt21<210>4<211>21<212>dna<213>人工序列<400>4ccatcttcccaatcaagtgct21<210>5<211>23<212>dna<213>人工序列<400>5agcggataacaatttcacacagg23<210>6<211>24<212>dna<213>人工序列<400>6cgccagggttttcccagtcacgac24当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺