作为STING调节剂的环状嘌呤二核苷酸的制作方法
本发明涉及化合物,含有所述化合物的组合物、组合和药物,以及制备它们的方法。本发明还涉及所述化合物、组合、组合物和药物在治疗其中调节sting(干扰素基因刺激蛋白(stimulatorofinterferongenes))可获益的疾病中的用途,例如炎症、过敏性和自身免疫性疾病、感染性疾病、人免疫缺陷病毒(hiv)感染,aids,癌症、癌前综合征、以及作为免疫原性组合物或疫苗佐剂。
背景技术:
脊椎动物不断受到微生物侵袭的威胁,并进化出免疫防御机制,以消除感染的病原体。在哺乳动物中,这种免疫系统包括两个分支:天然免疫和适应性免疫。天然免疫系统是由模式识别受体(prrs)启动的第一道防线,所述模式识别受体检测来自病原体的配体以及损伤相关的分子模式(takeuchio.etal,cell,2010:140,805-820)。已经识别出越来越多的这些受体,包括toll样受体(tlr)、c型凝集素受体、视黄酸诱导型基因i(rig-1)样受体和nod样受体(nlr)以及双链dna传感器。prrs的激活导致参与炎症应答的基因的上调,包括抑制病原体复制并促进适应性免疫的1型干扰素、促炎细胞因子和趋化因子。
衔接蛋白sting(干扰素基因刺激蛋白)也已知为tmem173、mpys、mita和eris,其已经被识别为对胞质核酸的天然免疫应答中的中心信号分子(ishikawahandbarbergn,nature,2008:455,674-678;wo2013/1666000)。sting的激活引起irf3和nfκb通路的上调,从而诱导干扰素-β和其他细胞因子。sting对于病原体或宿主来源的胞质dna的应答是至关重要的,并且对被称为环状二核苷酸(cdn)的不寻常核酸也是至关重要的。
cdn首先被识别为负责控制原核细胞中的众多应答的细菌二级信使。细菌cdn(如c-di-gmp)是以两个3',5'磷酸二酯连接键为特征的对称分子。
近来已经通过x射线晶体学证实了由细菌cdn直接激活sting(burdettedlandvancere,natureimmunology,2013:14,19-26)。因此,细菌cdn及其类似物作为潜在的疫苗佐剂已经引起了人们的兴趣(libanovar.etal,microbialbiotechnology2012:5,168-176;wo2007/054279,wo2005/087238)。
最近,已经阐明了对胞质dna的应答,并且显示出涉及通过被称为环状gmp-amp合酶(cgas,先前称为c6orfl50或mb21d1)的酶产生一种新型哺乳动物cdn信号分子(称为cgamp),其随后激活sting。与细菌cdn不同,cgamp是一种不对称分子,特征在于它是混合的2',5'和3',5'磷酸二酯键(gaopetal,cell,2013:153,1-14)。cgamp与sting的相互作用也已经通过x射线晶体学证明(caixetal,molecularcell,2014:54,289-296)。
干扰素首先被描述为可以保护细胞免受病毒感染的物质(isaacs&lindemann,j.virusinterference.proc.r.soc.lon.ser.b.biol.sci.1957:147,258-267)。在人类中,i型干扰素是由染色体9上的基因编码并且编码干扰素α(ifnα)的至少13种同种型和干扰素β(ifnβ)的一种同种型的相关蛋白家族。重组ifnα是第一个批准的生物治疗剂,并且已成为病毒感染和癌症中的重要疗法。除了对细胞的直接抗病毒活性外,已知干扰素是作用于免疫系统细胞的免疫应答的高效调节剂。
施用可以刺激天然免疫应答(包括i型干扰素和其他细胞因子的活化)的小分子化合物可以成为治疗或预防包括病毒感染在内的人类疾病的重要策略。这种类型的免疫调节策略有可能识别出这样的化合物:其不仅可以用于感染性疾病而且用于癌症(zitvogel,l.,等人,naturereviewsimmunology,201515(7),p405-414),过敏性疾病(moisanj.etal,am.j.physiol.lungcellmol.physiol.,2006:290,l987-995),其他炎性病症如肠易激综合征(rakoff-nahoums.,cell.,2004,23,118(2):229-41),以及作为疫苗佐剂(persingetal.trendsmicrobiol.2002:10(10suppl),s32-7和dubenskyetal.,therapeuticadvancesinvaccines,publishedonlinesept.5,2013)。
过敏性疾病与对过敏原的th2优势免疫应答有关。th2应答与升高的ige水平相关,ige通过其对肥大细胞的作用促进对过敏原的超敏反应,导致例如在过敏性鼻炎和哮喘中出现的症状。在健康人群中,对过敏原的免疫应答用混合的th2/th1和调节性t细胞应答更为平衡。1型干扰素的诱导已经显示会引起局部环境中th2型细胞因子的减少并促进th1/treg应答。在这种情况下,通过例如sting的激活来诱导1型干扰素,可以在治疗过敏性疾病(如哮喘和过敏性鼻炎)方面提供益处(huberj.p.etaljimmunol2010:185,813-817)。
相反,增加和延长的i型ifn产生与各种慢性感染相关,包括分枝杆菌(collins等,chm2015;wassermann等,chm2015;watson等,chm2015)、弗朗西斯氏菌(storek等人,ji2015;jin等人,ji2011)、衣原体(prantner等人,ji2010;barker等人,mbio2013;zhang等人,ji2014)、疟原虫(sharma等人,immunity2011)和hiv(herzner等人,natimmunol2015;nissen等人,clinexpimmunol2014;gao等人,science2013;lahayeetal,science2013;)(在stifter和feng,ji2014中综述)。类似地,在具有复杂形式的自身免疫性疾病的患者中发现过量的i型干扰素产生。人类中的遗传学证据和来自动物模型研究的支持证明了抑制sting导致驱动自身免疫性疾病的i型干扰素减少的假设(crowyj等,nat.genet.2006;38917-920,stetsondb等cell2008;134;587-598)。因此,sting抑制剂为患有慢性i型干扰素和与感染或复杂自身免疫疾病相关的促炎性细胞因子生成的患者提供治疗。过敏性疾病与过敏原的th2偏颇免疫反应有关。
结合至sting且作为激动剂的化合物在与人pbmc一起孵育时已经显示出诱导1型干扰素和其它细胞因子。诱导人类干扰素的化合物可用于治疗各种疾病,例如治疗过敏性疾病和其它炎性病症,例如过敏性鼻炎和哮喘,治疗感染性疾病、癌前综合征和癌症,并且还可以用作免疫原性组合物或疫苗佐剂。结合至sting的化合物可以作为拮抗剂,并且可用于治疗,例如自身免疫性疾病。
据预测,用激活或抑制剂靶向sting可能是治疗其中调节1型ifn途径可获益的疾病的有希望的方法,包括炎症、过敏性和自身免疫疾病、感染性疾病、癌症、癌前综合征和作为免疫原性组合物或疫苗佐剂。
国际专利申请wo2014/093936,wo2014/189805,wo2013/185052,u.s.2014/0341976,wo2015/077354,pct/ep2015/062281和gb1501462.4公开了某些环状二核苷酸以及它们诱导免疫应答的用途。
本发明的一个目的是进一步提供适合用于癌症治疗的环状二核苷酸。
技术实现要素:
本发明涉及根据式(i)的化合物及其药学上可接受的盐:
其中y1、y2、x1、x2、r1、r2、r3、r4、r5、r6、r8和r9如下文定义药学上可接受。
在本发明另一方面,提供了药物组合物,其包含式(i)的化合物或其药学上可接受的盐和一种或多种药学上可接受的赋形剂。
在本发明另一方面,提供了式(i)的化合物或其药学上可接受的盐,其用于治疗。
在本发明另一方面,提供了式(i)的化合物或其药学上可接受的盐,其用于治疗其中调节sting可获益的疾病。
在本发明另一方面,提供了式(i)的化合物或其药学上可接受的盐,其用于治疗炎症、过敏和自身免疫性疾病、感染性疾病、癌症、癌前综合征和用作免疫原性组合物或疫苗佐剂。
在本发明另一方面,提供了在受试者中治疗其中调节sting可获益的疾病的方法,包括给药治疗有效量的式(i)的化合物或其药学上可接受的盐。
在本发明另一方面,提供了在受试者中治疗炎症、过敏和自身免疫性疾病、感染性疾病和癌症的方法,包括给药治疗有效量的式(i)的化合物或其药学上可接受的盐。
在本发明另一方面,提供了式(i)的化合物或其药学上可接受的盐在制备用于治疗其中调节sting可获益的疾病的药物中的用途。
在本发明另一方面,提供了式(i)的化合物或其药学上可接受的盐在制备用于治疗炎症、过敏和自身免疫性疾病、感染性疾病、癌前综合征和癌症的药物中的用途。
在另一方面提供了包含式(i)的化合物或其药学上可接受的盐和至少一种其它治疗剂的组合。
在本发明另一方面,提供了包含式(i)的化合物或其药学上可接受的盐和至少一种其它治疗剂和一种或多种药学上可接受的赋形剂的药物组合物。
在另一方面提供了包含式(i)的化合物或其药学上可接受的盐和至少一种其它治疗剂的组合,其用于治疗。
在另一方面提供了包含式(i)的化合物或其药学上可接受的盐和至少一种其它治疗剂的组合,其用于治疗其中调节sting可获益的疾病或病症。
在另一方面提供了包含式(i)的化合物或其药学上可接受的盐和至少一种其它治疗剂的组合,其用于治疗炎症、过敏和自身免疫性疾病、感染性疾病、癌前综合征和癌症。
在本发明另一方面,提供了在受试者中治疗其中调节sting可获益的疾病或病症的方法,包括给药治疗有效量的包含式(i)的化合物或其药学上可接受的盐和至少一种其它治疗剂的组合。
在本发明另一方面,提供了在受试者中治疗炎症、过敏和自身免疫性疾病、感染性疾病和癌症的方法,包括给药治疗有效量的包含式(i)的化合物或其药学上可接受的盐和至少一种其它治疗剂的组合。
在本发明另一方面,提供了免疫原性组合物或疫苗佐剂,其包含式(i)的化合物或其药学上可接受的盐。
在本发明另一方面,提供了包含式(i)的化合物或其药学上可接受的盐,和一种或多种免疫刺激剂的组合物。
在本发明另一方面,提供了包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的免疫原性组合物。
在本发明另一方面,提供了包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的免疫原性组合物,其用于治疗或预防疾病。
在本发明另一方面,提供了式(i)的化合物或其药学上可接受的盐在制备包含抗原或抗原组合物的免疫原性组合物的用途,其用于治疗或预防疾病。
在本发明另一方面,提供了治疗或预防疾病的方法,包括向患有或易患疾病的人受试者给药包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的免疫原性组合物。
在本发明另一方面,提供了包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的免疫原性组合物或疫苗组合物,其用于治疗或预防疾病。
在本发明另一方面,提供了包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的免疫原性组合物,其用于治疗或预防疾病。
在本发明另一方面,提供了式(i)的化合物或其药学上可接受的盐在制备包含抗原或抗原组合物的免疫原性组合物或疫苗组合物中的用途,以治疗或预防疾病。
在本发明另一方面,提供了治疗或预防疾病的方法,包括向患有或易患疾病的人受试者给药包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的疫苗组合物。
在另一方面提供了在患有感染或处于患感染的风险的人中治疗hiv感染的方法,其通过向所述人给药治疗有效量的式(i)的化合物或其药学上可接受的盐。
在另一方面提供了在患有感染的人中治疗aids感染的方法,其通过向所述人给药治疗有效量的式(i)的化合物或其药学上可接受的盐。
在另一方面提供了治疗人hiv感染的方法,其通过向所述人给药治疗有效量的式(i)的化合物或其药学上可接受的盐。
附图简述
图-1图1描绘了化合物1至13的结构,其中
r7如式(i)定义。
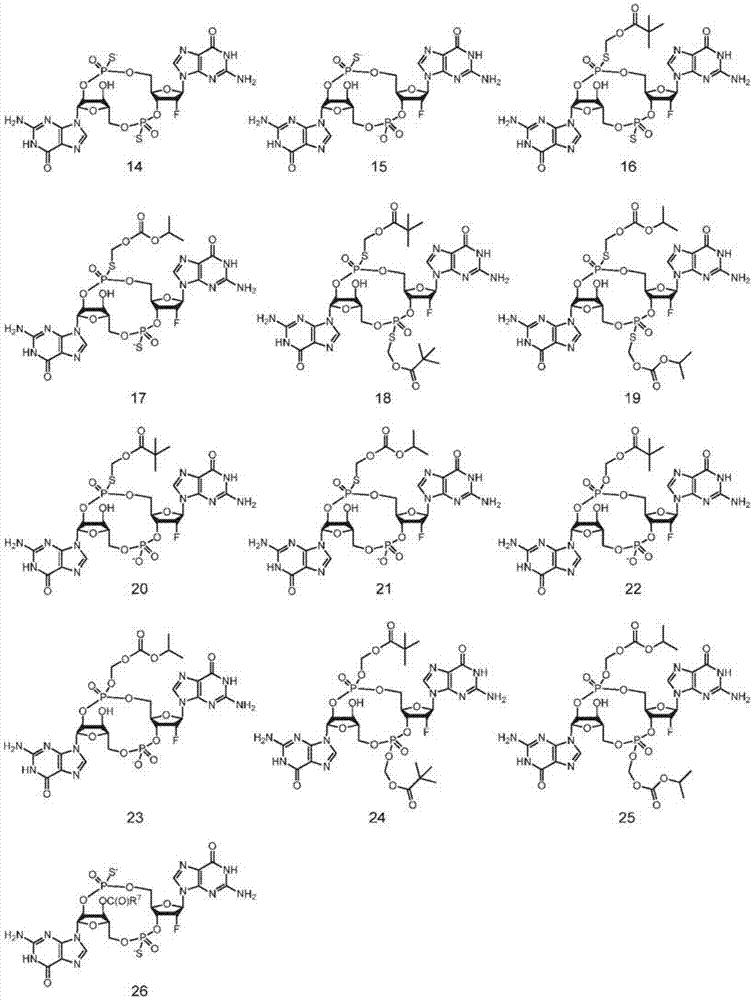
图-2图2描绘了化合物14至26的结构,其中
r7如式(i)定义。
图-3图3描绘了化合物27至39的结构,其中
r7如式(i)定义。
图-4图4描绘了化合物40至42的结构。
发明详述
本发明涉及新的式(i)的化合物:
其中:
y1和y2独立地为ch2或o;
x1和x2独立地为s或o;
r1为oh且r2为nh2或r1为nh2且r2为h;
r3为oh且r4为nh2或r3为nh2且r4为h;
r5选自:f、oh和oc(o)r7;
r6选自:f、oh和oc(o)r7;
条件是:当r5或r6都不是f时,y1和y2至少之一为ch2;且
r8和r9独立地选自:h、ch2oc(o)r7、ch2oco2r7、ch2ch2sc(o)r7、和ch2ch2ssch2r7;
条件是:当x1和x2都为o时,r8和r9至少之一不为h;
其中r7选自:芳基、杂芳基、杂环烷基、环烷基、c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基、羟基和f;
及其药学上可接受的盐。
适当地在式(i)的化合物中,y1和y2至少之一为o。适当地在式(i)的化合物中,y1和y2都为o。
适当地在式(i)的化合物中,x1和x2至少之一为s。适当地在式(i)的化合物中,x1为s。适当地在式(i)的化合物中,x1和x2都为s。
适当地在式(i)的化合物中,r1为nh2且r2为h。
适当地在式(i)的化合物中,r5为oh。
适当地在式(i)的化合物中,r6为f。
适当地在式(i)的化合物中,当r8和r9之一不为h时,其为ch2ch2sc(o)c1-6烷基。
适当地在式(i)的化合物中,当r8和r9之一不为h时,其为ch2ch2ssc1-4烷基oh。
适当地在式(i)的化合物中,当x1为s,r8和r9为h。
适当地在式(i)的化合物中,当x2为s,r8和r9为h。
适当地在式(i)的化合物中,r8和r9之一为h。
适当地在式(i)的化合物中,当x1和x2为o,r8和r9之一为h。
适当地在式(i)的化合物中,r7为c12-18烷基。
适当地在式(i)的化合物中,r7选自:c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基和f。
适当地在式(i)的化合物中,r7为c1-20烷基。
适当地在式(i)的化合物中,r7为叔丁基。
适当地在式(i)的化合物中,r7为异丙基。
本发明化合物的实例包括图1、2、3和4中所述的化合物。
式(i)的化合物可为盐的形式。
式(i)的化合物包括式(ii)的化合物:
其中:
y11和y12独立地为ch2或o;
x11为s;
x12为o;
r11为oh且r12为nh2或r11为nh2且r12为h;
r13为oh且r14为nh2或r13为nh2且r14为h;
r15选自:f、oh和oc(o)r17;
r16选自:f、oh和oc(o)r17;
条件是:当r15或r16都不为f时,y11和y12至少之一为ch2;且
r18和r19独立地选自:h、ch2oc(o)r17、ch2oco2r17、ch2ch2sc(o)r17和ch2ch2ssch2r17;
其中r17选自:芳基、杂芳基、杂环烷基、环烷基、c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基、羟基和f;
及其药学上可接受的盐。
适当地在式(ii)的化合物中,y11和y12至少之一为o。适当地在式(i)的化合物中,y11和y12都为o。
适当地在式(ii)的化合物中,r11为nh2且r12为h。
适当地在式(ii)的化合物中,r15为oh。
适当地在式(ii)的化合物中,r16为f。
适当地在式(ii)的化合物中,当r18和r19之一不为h时,其为ch2ch2sc(o)c1-6烷基。
适当地在式(ii)的化合物中,当r18和r19之一不为h时,其为ch2ch2ssc1-4烷基oh。
适当地在式(ii)的化合物中,r18和r19为h。
适当地在式(ii)的化合物中,r18和r19之一为h。
适当地在式(ii)的化合物中,r17为c12-18烷基。
适当地在式(ii)的化合物中,r17选自:c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基和f。
适当地在式(ii)的化合物中,r17为c1-20烷基。
适当地在式(ii)的化合物中,r17为叔丁基。
适当地在式(ii)的化合物中,r17为异丙基。
适当地式(ii)的化合物为药学上可接受的盐的形式。
式(i)的化合物包括式(iii)的化合物:
其中:
y21和y22独立地为ch2或o;
x21为o;
x22为s;
r21为oh且r22为nh2或r21为nh2且r22为h;
r23为oh且r24为nh2或r23为nh2且r24为h;
r25选自:f、oh和oc(o)r27;
r26选自:f、oh和oc(o)r27;
条件是:当r25或r26都不为f时,y21和y22至少之一为ch2;且
r28和r29独立地选自:h、ch2oc(o)r27、ch2oco2r27、ch2ch2sc(o)r27和ch2ch2ssch2r27;
其中r27选自:芳基、杂芳基、杂环烷基、环烷基、c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基、羟基和f;
及其药学上可接受的盐。
适当地在式(iii)的化合物中,y21和y22至少之一为o。适当地在式(iii)的化合物中,y21和y22都为o。
适当地在式(iii)的化合物中,r21为nh2且r22为h。
适当地在式(iii)的化合物中,r25为oh。
适当地在式(iii)的化合物中,r26为f。
适当地在式(iii)的化合物中,当r28和r29之一不为h时,其为ch2ch2sc(o)c1-6烷基。
适当地在式(iii)的化合物中,当r28和r29之一不为h时,其为ch2ch2ssc1-4烷基oh。
适当地在式(iii)的化合物中,r28和r29为h。
适当地在式(iii)的化合物中,r28和r29之一为h。
适当地在式(iii)的化合物中,r27为c12-18烷基。
适当地在式(iii)的化合物中,r27选自:c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基和f。
适当地在式(iii)的化合物中,r27为c1-20烷基。
适当地在式(iii)的化合物中,r27为叔丁基。
适当地在式(iii)的化合物中,r27为异丙基。
适当地式(iii)的化合物为药学上可接受的盐的形式。
式(i)的化合物和式(ii)的化合物包括式(iv)的化合物:
其中:
x31为s;
x32为o;
r31为oh且r32为nh2或r31为nh2且r32为h;
r33为oh且r34为nh2或r33为nh2且r34为h;
r35选自:f、oh和oc(o)r37;
r36选自:f、oh和oc(o)r37;
条件是:r35和r36至少之一为f;且
r38和r39独立地选自:h、ch2oc(o)r37、ch2oco2r37、ch2ch2sc(o)r37和ch2ch2ssch2r37;
其中r37选自:芳基、杂芳基、杂环烷基、环烷基、c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基、羟基和f;
及其药学上可接受的盐。
适当地在式(iv)的化合物中,r31为nh2且r32为h。
适当地在式(iv)的化合物中,r35为oh。
适当地在式(iv)的化合物中,r36为f。
适当地在式(iv)的化合物中,当r38和r39之一不为h时,其为ch2ch2sc(o)c1-6烷基。
适当地在式(iv)的化合物中,当r38和r39之一不为h时,其为ch2ch2ssc1-4烷基oh。
适当地在式(iv)的化合物中,r38和r39为h。
适当地在式(iv)的化合物中,r38和r39之一为h。
适当地在式(iv)的化合物中,r37为c12-18烷基。
适当地在式(iv)的化合物中,r37选自:c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基和f。
适当地在式(iv)的化合物中,r37为c1-20烷基。
适当地在式(iv)的化合物中,r37为叔丁基。
适当地在式(iv)的化合物中,r37为异丙基。
适当地式(iv)的化合物为药学上可接受的盐的形式。
式(i)的化合物和式(iii)的化合物包括式(v)的化合物:
其中:
x41为o;
x42为s;
r41为oh且r42为nh2或r41为nh2且r42为h;
r43为oh且r44为nh2或r43为nh2且r44为h;
r45选自:f、oh和oc(o)r47;
r46选自:f、oh和oc(o)r47;
条件是:r45和r46至少之一为f;且
r48和r49独立地选自:h、ch2oc(o)r47、ch2oco2r47、ch2ch2sc(o)r47和ch2ch2ssch2r47;
其中r47选自:芳基、杂芳基、杂环烷基、环烷基、c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基、羟基和f;
及其药学上可接受的盐。
适当地在式(v)的化合物中,r41为nh2且r42为h。
适当地在式(v)的化合物中,r45为oh。
适当地在式(v)的化合物中,r46为f。
适当地在式(v)的化合物中,当r48和r49之一不为h时,其为ch2ch2sc(o)c1-6烷基。
适当地在式(v)的化合物中,当r48和r49之一不为h时,其为ch2ch2ssc1-4烷基oh。
适当地在式(v)的化合物中,r48和r49为h。
适当地在式(v)的化合物中,r48和r49之一为h。
适当地在式(v)的化合物中,r47为c12-18烷基。
适当地在式(v)的化合物中,r47选自:c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基和f。
适当地在式(v)的化合物中,r47为c1-20烷基。
适当地在式(v)的化合物中,r47为叔丁基。
适当地在式(v)的化合物中,r47为异丙基。
适当地式(v)的化合物为药学上可接受的盐的形式。
式(i)的化合物包括式(vi)的化合物:
其中:
x51为o;
x52为o;
r51为oh且r52为nh2或r51为nh2且r52为h;
r53为oh且r54为nh2或r53为nh2且r54为h;
r55选自:f、oh和oc(o)r47;
r56为f;
r58和r59独立地选自:h、ch2oc(o)r57、ch2oco2r57、ch2ch2sc(o)r57和ch2ch2ssch2r57;
其中r57选自:芳基、杂芳基、杂环烷基、环烷基、c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基、羟基和f;
条件是r58和r59至少之一不为h。
及其药学上可接受的盐。
适当地在式(vi)的化合物中,r51为nh2且r52为h。
适当地在式(vi)的化合物中,r55为oh。
适当地在式(vi)的化合物中,当r58和r59之一不为h时,其为ch2ch2sc(o)c1-6烷基。
适当地在式(vi)的化合物中,当r58和r59之一不为h时,其为ch2ch2ssc1-4烷基oh。
适当地在式(vi)的化合物中,r58和r59之一为h。
适当地在式(vi)的化合物中,r57为c12-18烷基。
适当地在式(vi)的化合物中,r57选自:c1-20烷基和取代有1至5个独立选自以下的取代基的c1-20烷基:芳基、环烷基和f。
适当地在式(vi)的化合物中,r57为c1-20烷基。
适当地在式(vi)的化合物中,r57为叔丁基。
适当地在式(vi)的化合物中,r57为异丙基。
适当地式(vi)的化合物为药学上可接受的盐的形式。
式(i)的化合物包括:
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮;
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,异构体1;
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,异构体2;
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮;
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,异构体1;
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,异构体2;
(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮;
(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,异构体1;
(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,异构体2;
(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮;
(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,异构体1;和
(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,异构体2;
及其药学上可接受的盐。
应理解化合物2为如下所示异构体的混合物。
化合物2的异构体为:
和
应理解化合物28为如下所示异构体的混合物。
化合物28的异构体为:
和
应理解例如通过以下结构描述的化合物:
也以质子化形式存在,例如:
其表示相同的化合物。
应理解例如通过以下结构描述的化合物:
也以质子化形式存在,例如:
其表示相同的化合物。
应理解例如通过以下结构描述的化合物:
也以质子化形式存在,例如:
其表示相同的化合物。
通常,本发明的盐为药学上可接受的盐。术语"药学上可接受的盐"中包括的盐是指本发明的化合物的无毒盐。
盐,包括药学上可接受的盐,容易由本领域技术人员制备。
代表性的药学上可接受的酸加成盐包括但不限于4-乙酰氨基苯甲酸盐、乙酸盐、己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐(苯磺酸盐)、苯甲酸盐、硫酸氢盐、酒石酸氢盐、丁酸盐、依地酸钙盐、樟脑酸盐、樟脑磺酸盐(樟脑磺酸盐)、癸酸盐(癸酸盐)、己酸盐(己酸盐)、辛酸盐(辛酸盐)、肉桂酸盐、柠檬酸盐、环己基氨基磺酸盐、二葡糖酸盐、2,5-二羟基苯甲酸盐、二琥珀酸盐、十二烷基硫酸盐(estolate)、依地酸盐(乙二胺四乙酸盐)、丙酸酯十二烷基硫酸盐(月桂基硫酸盐)、乙烷-1,2-二磺酸盐(乙二磺酸盐)、乙烷磺酸盐(乙磺酸盐)、甲酸盐、富马酸盐、粘酸盐(粘酸盐)、龙胆酸盐(2,5-二羟基苯甲酸盐)、葡庚糖酸盐(葡庚糖酸盐)、葡糖酸盐、葡糖醛酸盐、谷氨酸盐、戊二酸盐、甘油磷酸盐、羟乙酸盐、己基间苯二酚盐(hexylrescorcinate)、马尿酸盐、海巴明(n,n'-二(脱氢枞基)-乙二胺)、氢溴酸盐、盐酸盐、氢碘酸盐、羟基萘甲酸盐、异丁酸盐、乳酸盐、乳糖醛酸盐、月桂酸盐、苹果酸盐、马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐(甲磺酸盐)、甲基硫酸盐、粘酸盐、萘-1,5-二磺酸盐(萘二磺酸盐)、萘-2-磺酸盐(萘磺酸盐)、烟酸盐、硝酸盐、油酸盐、棕榈酸盐、对氨基苯磺酸盐、对氨基水杨酸盐、双羟萘酸盐(双羟萘酸盐)、泛酸盐、果胶酸盐、过硫酸盐、苯乙酸盐、苯乙基巴比妥酸盐、磷酸盐、聚半乳糖醛酸盐、丙酸盐、对甲苯磺酸盐(甲苯磺酸盐)、焦谷氨酸盐、丙酮酸盐、水杨酸盐、癸二酸盐、硬脂酸盐、次乙酸盐、琥珀酸盐、氨基磺酸盐、硫酸盐、单宁酸盐、酒石酸盐、8-氯茶碱盐(8-氯茶碱盐)、硫氰酸盐、三乙基碘化物(triethiodide)、十一酸盐、十一碳烯酸盐和戊酸盐。
代表性药学上可接受的碱加成盐包括,但不限于,铝、2-氨基-2-(羟基甲基)-1,3-丙二醇(tris、缓血酸胺)、精氨酸、苯乙苄胺(n-苄基苯乙基胺)、苄星青霉素(n,n’-二苄基乙二胺)、双-(2-羟基乙基)胺、铋、钙、氯普鲁卡因、胆碱、克立咪唑(1-对氯苄基-2-吡咯烷-1’-基甲基苯并咪唑)、环己基胺、二苄基乙二胺、二乙基胺、二乙基三胺、二甲基胺、二甲基乙醇胺、多巴胺、乙醇胺、乙二胺、l-组氨酸、铁、异喹啉、勒皮啶、锂、赖氨酸、镁、葡甲胺(n-甲基葡糖胺)、哌嗪、哌啶、钾、普鲁卡因、奎宁、喹啉、钠、锶、叔丁基胺和锌。
本发明在其范围内包括式(i)的化合物的所有可能的化学计量和非化学计量形式。
本发明的化合物可以以固体或液体形式存在。在固体形式下,本发明的化合物可以以固态的连续体存在,从完全无定形到完全结晶。术语“无定形”是指材料在分子水平上缺少长程有序的状态,并且根据温度可以显示固体或液体的物理性质。通常,这些材料不能给出独特的x射线衍射图案,并且在显示固体的性质的同时,更正式地描述为液体。在加热时,发生从固体到液体性质的变化,其特征在于状态的改变,通常是二级(“玻璃化转变”)。术语“结晶”是指其中材料在分子水平上具有规则有序的内部结构,并给出具有确定峰的独特的x射线衍射图的固相。当充分加热时,这种材料也将表现出液体的性质,但是从固体到液体的变化的特征在于相变,通常是一级(“熔点”)。
本发明的化合物可以具有以多于一种形式结晶(被称为多晶型现象(“多晶型物”)的特性)的能力。多晶型现象通常可以作为对温度或压力变化或两者的变化的响应而发生,并且还可以由结晶过程的变化引起。多晶型物可以通过本领域已知的各种物理特性来区分,例如x射线衍射图、溶解度和熔点。
式(i)化合物可以以溶剂化和非溶剂化形式存在。本文所用的术语“溶剂合物”是指由溶质(在本发明中,式(i)化合物或其盐)和溶剂形成的可变化学计量的复合物。用于本发明目的的这些溶剂不会干扰溶质的生物活性。本领域技术人员将理解,药学上可接受的溶剂合物可以形成为结晶化合物,其中溶剂分子在结晶期间结合到晶格中。结合的溶剂分子可以是水分子或非水性的,例如乙醇、异丙醇、dmso、乙酸、乙醇胺和乙酸乙酯分子。与水分子结合的结晶晶格通常称为“水合物”。水合物包括化学计量的水合物以及含有可变量的水的组合物。
还应注意,式(i)的化合物可以形成互变异构体。“互变异构体”是指为特定化合物结构的可互换形式,并且氢原子和电子的置换发生变化的化合物。因此,两个结构可以通过π电子和原子(通常为h)的运动而处于平衡状态。例如,烯醇和酮是互变异构体,因为它们通过用酸或碱处理而快速相互转化。应当理解,本发明化合物的所有互变异构体和互变异构体的混合物都包括在本发明化合物的范围内。例如和为了绝对清晰,在式(i)的化合物中,当r1或r3表示oh时,该化合物将形成酮互变异构体(=o)。
虽然每个变量的各方面对于每个变量已经大体在上面单独列出,但是本发明包括其中式(i)中的几个或每个方面都选自上面列出的各个方面中的每一个的那些化合物。因此,本发明意图包括每个变量的多个方面的所有组合。
天然cdn分子可以对存在于血液中、宿主细胞表面或宿主细胞中(例如在抗原呈递细胞中)存在的磷酸二酯酶的降解敏感,其构成含有所述天然cdn分子的疫苗制剂。具体的实例是存在于细胞质膜上、面对细胞质(plasma)的外核苷酸酶(ectonucleotidiase),例如cd39、cd73和enpp1,其中许多已知会降解核苷酸,例如atp通过cd39和enpp1两者转化为amp。最近enpp1已被确定为对具有2'-5'磷酸二酯键的cdn的降解的主要贡献者(li,l.,等人,2014,naturechemicalbiology,10(12),p1043-1048)。具有sting激动剂活性的cdn的效力将由于这种降解而减弱,导致先天免疫(例如,ifn-β)的标志分子的诱导表达的量较低,从而提供较弱的佐剂效力。本发明描述了可以用来增强和保持所述新型cdn的效力的两种不同的和互补的方法。如下面更详细描述的那样,这些是在磷酸二酯的非桥接位置用硫取代氧,以及使用前体药物策略来增强细胞渗透并保护cdn免于降解。
本发明的一个方面涉及诱导sting-依赖性tbk1活化的环状嘌呤单-和二硫代-二磷酸二核苷酸的立体化学限定的非对映体及其制备和使用方法。
本发明涉及提供单独或与其他免疫肿瘤剂组合能够起效并维持对肿瘤抗原的t细胞应答的有效sting激动剂的方法,以及提供佐剂组合物的方法。这些组合物包含一种或多种式(i)的环嘌呤二核苷酸,其中存在于组合物中的环嘌呤二核苷酸是基本上纯的单一单硫代磷酸酯非对映异构体或二硫代磷酸酯非对映异构体,其制备方法以及使用它来刺激动物的免疫应答的方法。单一药剂和疫苗制剂的目标都是提供能够产生足够记忆性t细胞和/或b细胞群的抗原和佐剂的组合,以迅速地对带有感兴趣抗原的病原体、肿瘤细胞等进行反应。
硫代磷酸酯(thiophosphate)(也称为硫代磷酸酯(phosphorothioate))是正常核苷酸的变体,其中与磷连接的非桥连氧之一被硫替代。硫代磷酸酯键本质上是手性的。本领域技术人员将认识到,该结构中的硫代磷酸酯可以各自以r或s形式存在。因此,rp和sp形式在每个磷原子上是可能的。在每种情况下,优选这些分子的基本上纯的非对映异构体。这种cdn硫代磷酸酯分子的例子在本文的图1至4中示出。
如本文所用,术语“前药”是指所考虑的化合物的修饰,其中修饰的化合物通过酶促或非酶促反应在体内(例如在靶细胞或靶器官中)转变回为未修饰的形式。在许多情况下,前药形式不具有活性或比所考虑的化合物的母体非前药形式明显活性小。在某些实施方案中,一个核糖上的羟基包含前药离去基团(化合物13、26和39)。在其它实施方案中,前药形式涉及磷酸酯和/或硫代磷酸酯之一或两者的衍生化(化合物3-12、16-25和29-38)。前药可以改变药物的物理化学、生物药物学和药代动力学性质。前药开发的原因通常是水溶性差、化学不稳定、口服生物利用度低、血脑屏障渗透性不足、以及与母体药物相关的首过代谢高。合适的前药部分描述于例如“prodrugsandtargeteddelivery”,j.rautico,ed.,johnwiley&sons,2011。与本发明特别相关的磷酸酯的前药描述于wiemer,a.j.,和wiemer,d.f.“prodrugsofphosphonatesandphosphates:crossingthemembranebarrier”intopicsofcurrentchemistry,(2015)v360,115-160。
本发明优选的环嘌呤二核苷酸包括前药二磷酸酯cdn(例如图1的化合物9、10、11和12;图2的化合物22、23、24和25;图3的化合物35、36、37和38和图4的化合物40、41和42)、非前药单硫代磷酸酯(如,图1-3的化合物2、15和28)和非前药二硫代磷酸酯(如图1-3的化合物1、14和27)和单-(例如图1-3的化合物7、8、20、21、33和34)和二硫代磷酸酯(例如图1至3的化合物3-6、16-19和29-32)二者的前药形式。
定义
如本文所述,“本发明的化合物”包括式(i)的化合物及其盐的所有溶剂合物、复合物、多晶型物、放射性标记的衍生物、互变异构体、立体异构体和旋光异构体。
如本文所用,根据图中的指示,本发明的具体化合物被数字地指定。例如,化合物2是图1中的化合物,其下面是“2”,化合物27是图3中的化合物,其下面是“27”。另外的“a”和“b”等称号分别对应于异构体1和异构体2等。例如,“化合物2a”是化合物2的异构体1,“化合物27b”是化合物27的异构体2。
除非另外定义,否则称号“异构体”或“非对映异构体”是在特定条件下指定化合物从分离柱洗脱的顺序的指示。在lcms上具有较短保留时间的指定化合物被命名为“异构体1”或“非对映异构体1”,在lcms上具有较长保留时间的指定化合物被命名为“异构体2”或“非对映异构体2”等。
本文所用的术语“有效量”是指将引起例如由研究人员或临床医生寻求的组织、系统、动物或人的生物或医学响应的药物或药剂的量。此外,术语“治疗有效量”是指与未接受该量的相应个体相比,导致对疾病、紊乱或副作用的改善的治疗、治愈、预防、或缓解,或降低疾病或紊乱的进展速度的任何量。该术语还包括在其范围内有效地增强正常生理功能的量。
术语“预防”包括防止,并且是指防止而不是治愈或治疗疾病的措施或程序。预防是指降低得病或发病的风险,使得在疾病发生之前在可能暴露于致病物的个体或者易患该病的个体中该病的至少一种临床症状的不发展。
本文所用的术语“药学上可接受的”是指在合理的医学判断范围内适合用于与人类和动物的组织接触而没有过度的毒性、刺激或其他问题或并发症,与合理的收益/风险比相称的那些化合物、材料、组合物和剂型。
本文所用的“药学上可接受的赋形剂”包括与本发明化合物一起施用的所有稀释剂、载体粘合剂、助流剂和药物制剂的其它组分。
“烷基”是指具有指定数量的“成员原子”的烃链。例如,c1-c6烷基是指具有1至6个成员原子的烷基。例如,c12-c18烷基是指具有12至18个成员原子的烷基。例如,c1-c20烷基是指具有1至20个成员原子的烷基。烷基可为饱和、不饱和、直链或支链的。代表性支链的烷基具有1、2或3个支链。示例性烷基包括甲基、乙基、亚乙基、丙基(正丙基和异丙基)、丁烯、丁基(正丁基、异丁基和叔丁基)、戊基和己基。
“环烷基”,除非另有定义,是指具有3至7个碳原子的饱和或不饱和的非芳香烃环体系。环烷基为单环或双环环体系。例如,c3-c7环烷基是指具有3至7个成员原子的环烷基。本文使用的环烷基的实例包括:环丙基、环丁基、环戊基、环己基、环丁烯基、环戊烯基、环己烯基、环庚基和螺庚烷。
“芳基”是指芳香烃环。芳基为具有总共5-14个环成员原子的单环、双环和三环环体系,其中至少一个环体系为芳族的且其中体系中的各个环包含3至7个成员原子,如苯基、萘、四氢萘和联苯基。合适的芳基为苯基。
"杂芳基”是指包含1至7个碳原子且包含1至4个杂原子的单环芳族4至8元环,条件是当碳原子的数量为3时,芳环至少包含两个杂原子。包含多于一个杂原子的杂芳基可包含不同的杂原子。示例性杂芳基包括:吡咯基、吡唑基、咪唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、呋喃基、呋咱基、噻吩基、三唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、四嗪基。
“杂环烷基”是指包含4至12个成员原子的饱和或不饱和的非芳环,其中1至11个为碳原子且1至6个为杂原子。包含多于一个杂原子的杂环烷基可包含不同的杂原子。杂环烷基为单环环体系或与芳基环或与具有3至6个成员原子的杂芳基环稠合的单环。示例性杂环烷基包括:吡咯烷基、四氢呋喃基、二氢呋喃基、吡喃基、四氢吡喃基、二氢吡喃基、四氢噻吩基、吡唑烷基、噁唑烷基、氧杂环丁烷基、噻唑烷基、哌啶基、高哌啶基、哌嗪基、吗啉基、硫吗啉基、1,3-二氧杂环戊烷基、1,3-二氧杂环己烷基、1,4-二氧杂环己烷基、1,3-氧硫杂环戊烷基、1,3-氧硫杂环己烷基、1,3-二噻烷基、1,3噁唑烷-2-酮、六氢-1h-氮杂环庚三烯、4,5,6,7,四氢-1h-苯并咪唑、哌啶基、1,2,3,6-四氢-吡啶基和氮杂环丁烷基。
“杂原子”,除非另有定义,是指氮、硫或氧原子。
组合物
虽然为了用于治疗,可能可以将本发明的化合物以原料化学品的方式施用,但是可以将本发明化合物作为活性成分呈现为药物组合物的形式。这样的组合物可以以制药领域众所周知的方式制备并且包含至少一种活性化合物。因此,本发明还提供包含本发明化合物和一种或多种药学上可接受的赋形剂的药物组合物。所述赋形剂必须在与组合物的其它成分相容的意义上是可接受的,并且对其接受者无害。根据本发明的另一方面,还提供了一种制备药物组合物的方法,所述药物组合物包含所述药剂或其药学上可接受的盐,和一种或多种药学上可接受的赋形剂。所述药物组合物可用于治疗和/或预防本文所述的任何病症。
通常,本发明的化合物以药学有效量施用。实际施用的化合物的量通常由医师根据相关情况确定,包括待治疗的病症,所选择的施用途径,所施用的实际的化合物,个体患者的年龄、体重和响应,患者症状的严重程度等。
药物组合物可以以每单位剂量含有预定量的活性成分的单位剂量形式呈现。术语“单位剂量形式”是指适合作为人类个体和其他哺乳动物的单位剂量的物理上不连续的单位,每个单位都含有计算产生所需治疗效果的预定量的活性物质,以及合适的药物赋形剂,媒介物或载体。典型的单位剂型包括:液体组合物的预先填充的、预先测量的安瓿或注射器,或在固体组合物的情况下,药丸,片剂,胶囊等。
优选的单位剂量组合物是含有日剂量或亚剂量或其适当部分的活性成分的那些。因此,这样的单位剂量可以每天施用一次或多于一次。这样的药物组合物可以通过药学领域众所周知的任何方法制备。
药物组合物可适于通过任何适当途径施用,例如经口(包括口腔或舌下)、直肠、吸入、鼻内、局部(包括口腔、舌下或透皮)、阴道或可注射的(包括皮下、肌内、肠胃外、静脉内或皮内)途径。这样的组合物可以通过药学领域已知的任何方法制备,例如通过使活性成分与载体或赋形剂结合。
除了上述施用途径之外,对于癌症的治疗,药物组合物可以适于通过肿瘤内或肿瘤周围注射施用。预期直接将本发明化合物瘤内或瘤周注射到单个实体瘤中或其附近可引发免疫应答,该应答可在整个身体中攻击和破坏癌细胞,实质上减少并在某些情况下永久地消除疾病患者的肿瘤。以这种方式激活免疫系统以杀死远端部位的肿瘤通常被称为远位作用,并且已经用多种治疗方式在动物中得到证实(vanderjeught,etal.,oncotarget,2015,6(3),1359-1381)。局部或肿瘤内或肿瘤周围施用的另一个优点是能够以低得多的剂量实现相同的疗效,从而最小化或消除在高得多的全身剂量下可观察到的不良事件(marabelle,a.,etal.,clinicalcancerresearch,2014,20(7),p1747-1756)。
适于口服施用的药物组合物可以作为离散单位呈现,例如胶囊或片剂;粉末或颗粒;在水性或非水性液体中的溶液或混悬液;可食用泡沫(foams或whips);或水包油液体乳剂或油包水液体乳剂。
例如,对于片剂或胶囊形式的口服施用,可以将活性药物组分与口服无毒的药学上可接受的惰性赋形剂如乙醇、甘油、水等组合。通过将化合物减小至合适的细小尺寸并与类似制备的药物赋形剂(如可食用的碳水化合物,例如淀粉或甘露糖醇)混合制备粉末。还可以存在调味剂,防腐剂,分散剂和着色剂。
通过如上所述制备粉末混合物并填充形成的明胶鞘制备胶囊。在填充操作之前,可以向粉末混合物中加入包括助流剂和润滑剂在内的赋形剂,例如胶体二氧化硅、滑石、硬脂酸镁、硬脂酸钙或固体聚乙二醇。还可以加入崩解剂或增溶剂如琼脂、碳酸钙或碳酸钠,以改善胶囊消化时药物的可利用性。
此外,当需要或必需时,也可以将包括合适的粘合剂、助流剂、润滑剂、甜味剂、调味剂、崩解剂和着色剂的赋形剂加入混合物中。合适的粘合剂包括淀粉、明胶、天然糖如葡萄糖或β-乳糖、玉米甜味剂、天然和合成树胶如阿拉伯胶、黄蓍胶或海藻酸钠、羧甲基纤维素、聚乙二醇、蜡等。用于这些剂型的润滑剂包括油酸钠、硬脂酸钠、硬脂酸镁、苯甲酸钠、乙酸钠、氯化钠等。崩解剂包括但不限于淀粉、甲基纤维素、琼脂、膨润土、黄原胶等。制备片剂,例如通过制备粉末混合物,造粒或压块,加入润滑剂和崩解剂并压制成片剂。制备粉末化合物,通过将适当粉碎的化合物与如上所述的稀释剂或碱,并任选地与粘合剂(如羧甲基纤维素、海藻酸盐、明胶或聚乙烯吡咯烷酮),溶剂阻滞剂(如石蜡),吸收加速剂(如季盐)和/或吸收剂(如膨润土、高岭土或磷酸二钙)混合。所述粉末混合物可以通过用粘合剂(如糖浆、淀粉糊、阿卡迪亚粘液(acadiamucilage)或纤维素或聚合物材料的溶液)润湿并强制通过筛网来造粒。作为造粒的替代方案,粉末混合物可以运行通过压片机,并将所得物不完美形成的碎块破碎成颗粒。可以通过加入硬脂酸、硬脂酸盐、滑石或矿物油来润滑颗粒以防止粘附到片剂成型模具上。然后将润滑的混合物压成片剂。本发明的化合物还可以与自由流动的惰性载体组合并直接压制成片剂,而不经过造粒或压块步骤。可以提供透明或不透明的保护包衣,其由虫胶的密封包衣、糖或聚合物材料的包衣和蜡的抛光包衣组成。可以将染料加入到这些包衣中以区分不同的单位剂量。
口服流体如溶液、混悬液、糖浆和酏剂可以以剂量单位形式制备,以使给定的量含有预定量的化合物。可以通过将化合物溶解在适当调味的水溶液中制备糖浆,而通过使用无毒的醇类媒介物制备酏剂。可以通过将化合物分散在无毒的媒介物中来配制混悬液。还可以加入增溶剂和乳化剂(如乙氧基化异硬脂醇类和聚氧乙烯山梨醇醚类)、防腐剂、味道添加剂(如薄荷油或天然甜味剂或糖精或其它人造甜味剂)等。
在合适的情况下,口服施用的剂量单位组合物可以微胶囊化。还可以制备组合物以延长或维持释放,例如通过将颗粒材料涂覆或包埋在聚合物、蜡或类似物中。
本发明的化合物还可以以脂质体递送系统的形式施用,例如小单层囊泡,大单层囊泡和多层囊泡。脂质体可以由多种磷脂形成,例如胆固醇、硬脂胺或磷脂酰胆碱。本发明的化合物也可以以纳米颗粒递送载体的形式给药,其有多种组合物和制备方法。聚合物纳米颗粒和适当组成和大小的脂质体都是用于治疗癌症,特别是用于递送本发明化合物的特别有利的制剂,因为它们优先靶向肿瘤和淋巴结。这些靶向制剂具有几个潜在的优点,它们是:保护本发明的化合物免于降解,增加活性剂在所述位点作用的量,并使由于过度的全身暴露引起的不想要的潜在副作用最小化(cai,shuang等,2011advanceddrugdevliveryreviews,2011,v63,p901-908)。对于直接作用于肿瘤的制剂(nakumura,t.等人,journalofcontrolledrelease,2015,v216,p149-157)以及作为佐剂(hanson,m.等,journalofclinicalinvestigation,2015,v125(6),p2532-2546),已经证明了这种方法在配制cdnsting激动剂中的潜在用途。此外,纳米颗粒和脂质体制剂有多种给药方式(肿瘤内,皮下,静脉内,腹膜内和肌肉内),这对本发明化合物可能是特别有用的。具体而言,类似于天然cdn分子,本发明的那些分子可能对存在于宿主细胞中或其上(例如在抗原呈递细胞中)的磷酸二酯酶的降解敏感。本发明化合物的效力可以通过这种降解而减弱,导致先天免疫的标志分子(例如,ifn-β)的诱导表达量较低。因此,这种降解可以提供较弱的效力(如通过从pbmc的ifn-β释放测量),或降低的疫苗效力(如通过测量的抗原特异性免疫应答的量级所定义)。
适于透皮施用的药物组合物可以作为离散贴片来呈现,其意图是与接受者的表皮保持长时间的密切接触。
适于局部施用的药物组合物可以配制成软膏、乳膏、混悬液、洗剂、粉末、溶液、糊剂、凝胶剂、喷雾剂、气雾剂或油剂。
对于眼睛或其他外部组织(例如口腔和皮肤)的治疗,组合物优选以局部软膏或乳膏的形式施用。当配制成软膏时,活性成分可以与石蜡或水混溶性软膏基质一起使用。或者,活性成分可以用水包油乳膏基质或油包水基质配制成乳膏。
适于局部施用于眼睛的药物组合物包括滴眼剂,其中活性成分溶解或悬浮在合适的载体,特别是水性溶剂中。
适用于口腔局部施用的药物组合物包括锭剂、含片和漱口剂。
适于直肠施用的药物组合物可呈现为栓剂或灌肠剂。
用于鼻或吸入施用的剂型可以方便地配制成气雾剂、溶液、混悬液滴、凝胶或干粉。
用于鼻内施用的组合物包括通过滴剂或通过加压泵施用到鼻子的水性组合物。为此目的,合适的组合物含有水作为稀释剂或载体。用于施用到肺或鼻的组合物可以含有一种或多种赋形剂,例如一种或多种悬浮剂,一种或多种防腐剂,一种或多种表面活性剂,一种或多种张力调节剂,一种或多种共溶剂,并且可以包括控制组合物的ph的组分,例如缓冲体系。此外,组合物可以含有其它赋形剂,例如抗氧化剂(例如偏亚硫酸氢钠)和掩味剂。组合物也可以通过雾化施用于呼吸道的鼻子或其它区域。
鼻内组合物可以允许式(i)的化合物或(a)其药学上可接受的盐被递送到鼻腔(靶组织)的所有区域,并且还可以允许式(i)的化合物或(a)其药学上可接受的盐与靶组织保持更长时间的接触。用于鼻内组合物的合适的给药方案是使患者在清洗鼻腔之后通过鼻子缓慢吸入。在吸入期间,组合物将被施用于一个鼻孔,而另一个被用手压住。然后对另一鼻孔重复该操作。通常,每鼻孔一次或两次喷雾将通过上述步骤每天施用一次、两次或三次,理想地每天一次。特别令人感兴趣的是适合每日一次施用的鼻内组合物。
如果包括的话,基于组合物的总重量,悬浮剂通常以0.1至5%(w/w),例如1.5%至2.4%(w/w)的量存在。药学上可接受的悬浮剂的实例包括但不限于
用于施用至肺或鼻子的组合物可含有一种或多种赋形剂,可以通过包含一种或多种防腐剂来保护其免受微生物或真菌的污染和生长。药学上可接受的抗微生物剂或防腐剂的实例包括,但不限于,季铵化合物(例如苯扎氯铵、苄索氯铵、西曲溴铵、西吡氯铵、劳拉氯铵和米吡氯铵),汞剂(例如硝酸苯汞,乙酸苯汞和硫柳汞),醇类试剂(例如氯丁醇,苯乙醇和苄醇),抗菌酯(例如对羟基苯甲酸的酯),螯合剂(如乙二胺四乙酸二钠(edta))和其他抗微生物剂(如氯己定、氯甲酚、山梨酸及其盐(如山梨酸钾)和多粘菌素)。药学上可接受的抗真菌剂或防腐剂的实例包括,但不限于,苯甲酸钠,山梨酸,丙酸钠,对羟基苯甲酸甲酯,对羟基苯甲酸乙酯,对羟基苯甲酸丙酯和对羟基苯甲酸丁酯。如果包括的话,基于组合物的总重量,防腐剂可以以0.001至1%(w/w),例如0.015%至0.5%(w/w)的量存在。
组合物(例如其中至少一种化合物处于混悬液中)可以包括一种或多种表面活性剂,用于促进药物颗粒在组合物的水相中的溶解。例如,表面活性剂的使用量是在混合期间不会引起发泡的量。药学上可接受的表面活性剂的实例包括脂肪醇、酯和醚,例如聚氧乙烯(20)脱水山梨糖醇单油酸酯(聚山梨酯80),聚乙二醇醚和泊洛沙姆。表面活性剂可以以约0.01至10%(w/w),例如0.01至0.75%(w/w),例如约0.5%(w/w)的量存在,基于组合物的总重量。
可以包括一种或多种张力调节剂以实现与体液(例如鼻腔的流体)等渗,导致刺激性水平降低。药学上可接受的张力调节剂的实例包括,但不限于,氯化钠,葡萄糖,木糖醇,氯化钙,葡萄糖,甘油和山梨糖醇。如果存在的话,张力调节剂的含量可以为0.1至10%(w/w),例如4.5至5.5%(w/w),例如约5.0%(w/w),基于组合物的总重量。
本发明的组合物可以通过加入合适的缓冲剂来缓冲,所述缓冲剂例如柠檬酸钠、柠檬酸、氨丁三醇、磷酸盐(如磷酸二钠(例如十二水合物、七水合物、二水合物和无水形式)或磷酸钠)及它们的混合物。
如果存在的话,基于组合物的总重量,缓冲剂的含量可以为0.1至5%(w/w),例如1至3%(w/w)的量。
掩味剂的实例包括三氯蔗糖、蔗糖、糖精或其盐、果糖、葡萄糖、甘油、玉米糖浆、阿斯巴甜、安赛蜜、木糖醇、山梨糖醇、赤藓糖醇、甘草酸铵、索马甜(thaumatin)、纽甜(neotame)、甘露醇、薄荷醇、桉树油、樟脑、天然调味剂、人造调味剂及其组合。
可以包括一种或多种共溶剂以帮助药物化合物和/或其它赋形剂溶解。药学上可接受的共溶剂的实例包括,但不限于,丙二醇、二丙二醇、乙二醇、甘油、乙醇、聚乙二醇(例如peg300或peg400)和甲醇。在一个实施方案中,共溶剂是丙二醇。
如果存在的话,共溶剂的含量可以为0.05至30%(w/w),例如1至25%(w/w),例如1至10%(w/w),基于组合物的总重量。
用于吸入施用的组合物包括通过加压泵或吸入器施用于呼吸道的水的、有机或水的/有机混合物、干粉或结晶组合物,所述吸入器例如贮库干粉吸入器,单位剂量干粉吸入器,预计量多剂量干粉吸入器,鼻吸入器或加压气雾剂吸入器,雾化器或吹入器。合适的组合物含有水作为用于此目的的稀释剂或载体,并且可以提供常规赋形剂如缓冲剂,张力调节剂等。水性组合物也可以通过雾化施用于鼻子和呼吸道的其它区域。这样的组合物可以是使用合适的液化推进剂从加压包装(例如计量吸入器)输送的水溶液或混悬液或气雾剂。
用于局部地施用于鼻部(例如用于治疗鼻炎)或肺部的组合物包括通过加压泵输送到鼻腔的加压气雾剂组合物和水性组合物。非加压的并适合局部施用于鼻腔的组合物是特别令人感兴趣的。为此目的,合适的组合物含有水作为稀释剂或载体。用于施用于肺或鼻的水性组合物可以提供有常规赋形剂,例如缓冲剂、张力调节剂等。也可以通过雾化将水性组合物施用于鼻子。
通常可以使用流体分配器将流体组合物递送到鼻腔。流体组合物可以是水性或非水性的,但通常是水性的。这种流体分配器可以具有分配喷嘴或分配孔口,在将用户施加的力施加到流体分配器的泵装置上时,通过该分配喷嘴或分配孔口分配计量剂量的流体组合物。这种流体分配器通常设置有多个计量剂量的流体组合物的贮库,所述剂量在相继的泵驱动时是可分配的。分配喷嘴或孔口可以被构造为用于插入到使用者的鼻孔中以将流体组合物喷雾分散到鼻腔中。上述类型的流体分配器在国际专利申请公开号wo2005/044354(glaxogrouplimited)中描述和示出。分配器具有壳体,所述壳体容纳流体排出装置,该流体排出装置具有安装在用于容纳流体组合物的容器上的压缩泵。壳体具有至少一个可手指操作的侧杆,其可相对于壳体向内移动,以通过凸轮在壳体中向上移动容器,以使泵压缩并将计量剂量的组合物通过壳体的鼻喷嘴从泵杆泵出。在一个实施方案中,流体分配器是wo2005/044354的图30-40中所示的一般类型。
含有式(i)化合物或其药学上可接受的盐的含水组合物也可以通过如国际专利申请公开号wo2007/138084(glaxogrouplimited)中公开的,例如参考其图22-46公开的泵进行递送,或如英国专利申请号gb0723418.0(glaxogrouplimited)中公开的,例如参考其图7-32公开的泵进行递送。泵可以由如gb0723418.0的图1-6中公开的驱动器驱动。
用于通过吸入局部递送至肺的干粉组合物可以例如存在于例如明胶的胶囊和药筒中,或例如层压铝箔的泡罩中,以用于吸入器或吹入器。粉末共混组合物通常含有用于吸入式(i)化合物或其药学上可接受的盐的粉末混合物和合适的粉末基质(载体/稀释剂/赋形剂物质),例如单糖、二糖或多糖(例如乳糖或淀粉)。除了药物和载体外,干粉组合物还可以包括其它赋形剂(例如三元合剂,例如糖酯,例如纤维二糖八乙酸酯、硬脂酸钙或硬脂酸镁)。
在一个实施方案中,可以将适合于吸入施用的组合物加入到安装在合适的吸入装置内的药物包装中所提供的多个密封剂量容器中。如本领域已知的,所述容器可以是一次一个地可破裂的、可剥离的或以其他方式可打开的,并且干粉组合物的剂量在吸入装置的口上通过吸入施用。药物包装可以采取许多不同的形式,例如盘形或细长条。代表性的吸入装置是由glaxosmithkline销售的diskhalertm和diskustm装置。
干粉可吸入组合物也可以作为吸入装置中的大容量贮库(bulkreservoir)提供,然后该装置设置有计量装置,用于计量从贮库到吸入通道的组合物的剂量,其中计量的剂量能够通过患者在装置口的吸气而被吸入。这种类型的示例性市售装置是turbuhalertm(astrazeneca)、twisthalertm(schering)和clickhalertm(innovata)。
用于干粉可吸入组合物的另一种递送方法是用于使计量剂量的组合物以胶囊(每个胶囊一个剂量)提供,然后将其装载到吸入装置中,通常由患者按需要装载。该装置具有破裂、刺穿或以其它方式打开胶囊的装置,使得当患者在装置口处吸气时剂量能够被带入患者的肺中。作为这种装置的市售实例,可以提及rotahalertm(glaxosmithkline)和handihalertm(boehringeringelheim)。
适于吸入的加压气雾剂组合物可以是混悬液或溶液,并且可以含有式(i)化合物或其药学上可接受的盐和合适的推进剂,例如碳氟化合物或含氢氯氟烃或其混合物,特别是氢氟烷烃,特别是1,1,1,2-四氟乙烷、1,1,1,2,3,3,3-七氟-正丙烷或其混合物。气雾剂组合物可任选含有本领域熟知的其它组合物赋形剂,如表面活性剂例如油酸,卵磷脂或寡聚乳酸或其衍生物,例如如wo94/21229和wo98/34596(minnesotaminingandmanufacturingcompany)中所述,和共溶剂例如乙醇。加压组合物通常保留在用阀(例如计量阀)封闭的罐(例如铝罐)中并装配到设置有口的驱动器中。
适于阴道施用的药物组合物可以作为阴道栓剂、棉塞、乳膏、凝胶、糊剂、泡沫或喷雾制剂呈现。
适于注射给予的药物组合物包括水性和非水性无菌注射液,其可含有抗氧化剂、缓冲剂、抑菌剂和溶质,其使组合物与预期接受者的血液等渗;以及水性和非水性无菌混悬液,其可以包括悬浮剂和增稠剂。组合物可以存在于单位剂量或多剂量容器中,例如密封的安瓿瓶和小瓶中,并且可以储存在冷冻干燥(冻干)条件下,仅需要在临使用前加入无菌液体载体,例如注射用水。临时注射液和混悬液可以由无菌粉末、颗粒和片剂制备。
应当理解,除了上述特别提及的成分之外,考虑到所讨论的制剂类型,组合物可以包含本领域常规的其它试剂,例如适合于口服施用的那些可以包含调味剂。
可将反义或rna干扰分子施用于有需要的哺乳动物。或者,可以施用包含其的构建体。这样的分子和构建体可用于干扰有兴趣的蛋白质的表达,例如组蛋白去甲基化酶的表达,并且因此改变组蛋白去甲基化。通常,通过本领域已知的方式进行递送。
反义或rna干扰分子可以在体外递送至细胞或在体内递送至,例如哺乳动物的肿瘤。可以使用递送节点,包括但不限于:静脉内,肌内,腹膜内,动脉内,手术期间的局部递送,腔内,皮下和口服。可以选择载体用于任何特定应用的所需性质。载体可以是病毒或质粒。腺病毒载体在这方面是有用的。组织特异性、细胞类型特异性或其它可调节启动子可用于控制抑制性多核苷酸分子的转录。也可以使用非病毒载体如脂质体或纳米球。
式(i)化合物及其药学上可接受的盐也可配制以制备用作佐剂的组合物以调节疫苗活性。这样的组合物可以包含抗体或抗体片段或抗原成分,包括,但不限于,蛋白质、dna、活或死的细菌和/或病毒或病毒样颗粒,以及一种或多种具有佐剂活性的组分,包括,但不限于,铝盐、油和水乳液、热休克蛋白、脂质a制剂和衍生物、糖脂、其他tlr激动剂如cpgdna或类似药剂、细胞因子如gm-csf或il-12或类似药剂。
药物的治疗有效量将取决于许多因素,包括例如个体的年龄和体重,要求治疗的精确病症及其严重程度,制剂的性质和施用途径,并且将会最终由主治医师或兽医自主决定。特别地,待治疗的个体是哺乳动物,特别是人。
该药剂可以以日剂量施用。该量可以以每天单次剂量或更通常以每天多次(例如两次、三次、四次、五次或六次)亚剂量施用,使得总日剂量相同。
适当地,根据本发明施用的本发明化合物的量将为选自每天0.01mg至1g(以游离或未成盐化合物计算)的量。
式(i)的化合物及其药学上可接受的盐可以单独使用或与其它治疗剂组合使用。式(i)化合物及其药学上可接受的盐和其它药物活性剂可以一起或分开施用,并且当分别施用时,可以在单独或组合的药物组合物中通过任何方便的途径同时或以任何顺序相继进行施用。
选择式(i)化合物或其药学上可接受的盐和其它药学活性剂的量和相对施用时间以实现期望的组合治疗效果。本发明的化合物和其它治疗剂可以通过以包含两种化合物的单一药物组合物的形式同时施用来组合使用。或者,所述组合可以以相继方式以单独的药物组合物分开施用,每种药物组合物包含一种化合物,其中例如首先施用本发明的化合物,其次施用另一种化合物,反之亦然。这种相继施用可以在时间上接近(例如同时)或在时间上遥远。此外,化合物是否以相同的剂型施用并不重要,例如,一种化合物可以局部施用,另一种化合物可以口服施用。
组合可以作为组合试剂盒提供。本文使用的术语“组合试剂盒”或“试剂盒”是指用于施用根据本发明的组合的一种或多种药物组合物。当两种化合物同时施用时,组合试剂盒可以在单一药物组合物中(例如片剂)或分开的药物组合物中含有两种化合物。当化合物不同时施用时,组合试剂盒将在分开的药物组合物中以单独的包装或单独的包装中分开的药物组合物中含有每种化合物。
组合试剂盒也可以通过说明,如剂量和施用说明提供。这样的剂量和施用说明可以是例如通过药物产品标签提供给医生的那种类型,或者它们可以是由医生提供的那种类型,例如给患者的说明。
当以相继方式分别施用组合产品时,其中首先施用一种,其次施用另一种,反之亦然,这种相继施用可以在时间上接近或时间上遥远。例如,包括在施用第一药剂之后数分钟至几十分钟施用另一种药剂,和在施用第一药剂后数小时至数天施用另一种药剂,其中时间的间隔没有限制,例如,一种药剂可以每天施用一次,而另一种药剂可以每天施用2或3次,或者一种药剂可以每周施用一次,而另一种药剂可以每天施用一次等。
本领域技术人员将清楚,在适当的情况下,其它治疗成分可以以下列形式使用:盐,例如作为碱金属盐或胺盐或作为酸加成盐,或前药,或作为酯,例如低级烷基酯,或作为溶剂合物,例如水合物,以最优化治疗成分的活性和/或稳定性和/或物理特性,例如溶解性。还将清楚的是,在适当的情况下,治疗成分可以以光学纯的形式使用。
当在相同的组合物中组合时,应当理解,两种化合物必须是稳定的,并且彼此之间和与组合物的其它组分之间相容,并且可以配制用于给药。当单独配制时,它们可以以任何方便的组合物提供,方便地,以本领域中对这种化合物已知的方式。
当式(i)化合物与对相同疾病、病症或紊乱有活性的第二治疗剂组合使用时,每种化合物的剂量可以不同于单独使用该化合物时的剂量。本领域技术人员将容易理解适当的剂量。
在一个实施方案中,本发明的方法和用途中的哺乳动物是人。
本发明还提供包含0.5至1,000mg式(i)的化合物或其药学上可接受的盐和0.5至1,000mg药学上可接受的赋形剂的药物组合物。
本发明的化合物可用于治疗其中调节sting可获益的疾病。这包括炎症、过敏性和自身免疫性疾病、感染性疾病、癌症和癌前综合征。
作为免疫应答的调节剂,式(i)化合物及其药学上可接受的盐也可独立或作为佐剂组合用于其中调节sting可获益的疾病的治疗中。
在一方面,所述疾病或病症是炎症、过敏和自身免疫性疾病。
相关的自身免疫性疾病包括但不限于系统性红斑狼疮、牛皮癣、胰岛素依赖性糖尿病(iddm)、皮肌炎、人免疫缺陷病毒(hiv)、aids和干燥综合征(ss)。
炎症代表一组对创伤的血管、细胞和神经响应。炎症可以表征为炎症细胞如单核细胞、嗜中性粒细胞和粒细胞移动进入组织。这通常与减少的内皮屏障功能和水肿进入组织有关。炎症可分为急性或慢性。急性炎症是身体对有害刺激的初始应答,并且是通过血浆和白细胞从血液向损伤组织的移动增加而实现的。一系列生化事件传播并使炎症应答成熟,涉及损伤组织内的局部血管系统、免疫系统和各种细胞。称为慢性炎症的长期炎症导致存在于炎症部位的细胞类型的进行性变化,并且其特征在于来自炎性过程的组织的同时破坏和愈合。
当作为对感染的免疫应答的一部分或作为对创伤的急性响应发生时,炎症可能是有益的并且通常是自限制性的。然而,炎症在多种条件下可能是有害的。这包括响应感染剂而产生过度炎症,这可导致显著的器官损伤和死亡(例如,在败血症的情况下)。此外,慢性炎症通常是有害的,并且是许多慢性疾病的根源,其对组织造成严重和不可逆的损伤。在这种情况下,免疫应答通常针对自身组织(自身免疫),尽管对外来实体的慢性应答也可能导致对自身组织的旁观者损伤(bystanderdamage)。
因此,抗炎治疗的目的是减少这种炎症,以当存在时抑制自身免疫,并允许生理过程或愈合和组织修复进展。
所述药剂可用于治疗身体的任何组织和器官的炎症,包括肌肉骨骼炎症、血管炎症、神经炎症、消化系统炎症、眼部炎症、生殖系统炎症和其它炎症,如下所例示。
肌肉骨骼炎症是指肌肉骨骼系统的任何炎性病症,特别是影响骨骼关节,包括手、腕、肘、肩、颚、脊柱、颈、髋部、膝盖、踝和脚的关节的那些病症,以及影响连接肌肉到骨骼的组织例如腱的病症。可以用本发明化合物治疗的肌肉骨骼炎症的实例包括关节炎(包括,例如,骨关节炎、类风湿性关节炎、牛皮癣性关节炎、强直性脊柱炎、急性和慢性感染性关节炎、与痛风和假性痛风有关的关节炎和幼年特发性关节炎)、腱炎、滑膜炎、腱鞘炎、滑囊炎、纤维组织炎(纤维肌痛)、上髁炎、肌炎和骨炎(包括,例如,佩吉特氏病、耻骨炎和囊性纤维性骨炎)。
眼部炎症是指眼睛任何结构(包括眼睑)的炎症。可以用本发明化合物治疗的眼部炎症的实例包括睑炎、睑皮松垂症、结膜炎、泪腺炎、角膜炎、干性角结膜炎(干眼病)、巩膜炎、倒睫症和葡萄膜炎。
可以用本发明化合物治疗的神经系统的炎症的实例包括脑炎、吉兰巴雷综合征、脑膜炎、神经性肌强直、发作性睡眠、多发性硬化、脊髓炎和精神分裂症。
可以用本发明化合物治疗的脉管系统或淋巴系统的炎症的实例包括关节硬化、关节炎、静脉炎、血管炎和淋巴管炎。
可以用本发明化合物治疗的消化系统的炎性病症的实例包括胆管炎、胆囊炎、肠炎、小肠结肠炎、胃炎、胃肠炎、炎性肠病(例如克罗恩病和溃疡性结肠炎)、回肠炎和直肠炎。
可用本发明化合物治疗的生殖系统的炎性病症的实例包括子宫颈炎、绒毛膜羊膜炎、子宫内膜炎、附睾炎、脐炎、卵巢炎、睾丸炎、输卵管炎、输卵管卵巢脓肿、尿道炎、阴道炎、外阴炎和外阴痛。
所述药剂可用于治疗具有炎性成分的自身免疫病症。这种病症包括普遍性急性播散性脱发、behcet氏病(behcet’sdisease)、查加斯病(chagas’disease)、慢性疲劳综合征、家族性自主神经异常、脑脊髓炎、强直性脊柱炎、再生障碍性贫血、化脓性汗腺炎、自身免疫性肝炎、自身免疫性卵巢炎、乳糜泻、克罗恩病、1型糖尿病、巨细胞动脉炎、古德帕斯彻综合征、格雷夫斯病、吉兰巴雷综合征、桥本氏病、过敏性紫癜、川崎病、红斑狼疮、显微镜下结肠炎、显微镜下多动脉炎、混合性结缔组织病、多发性硬化、重症肌无力、肌阵挛综合征、视神经炎、ord’s甲状腺炎、天疱疮、结节性多动脉炎、多肌痛、类风湿性关节炎、莱特尔氏综合征、干燥综合征、颞动脉炎、韦格纳肉芽肿病、温抗体型自身免疫性溶血性贫血、间质性膀胱炎、莱姆病、硬斑病、牛皮癣、结节病、硬皮病、溃疡性结肠炎和白癜风。
所述药剂可用于治疗具有炎性组分的t细胞介导的超敏性疾病。这些病症包括接触性超敏反应、接触性皮炎(包括由毒葛所致的)、荨麻疹、皮肤过敏、呼吸道过敏(枯草热、过敏性鼻炎)和谷蛋白敏感性肠病(乳糜泻)。
可用所述药剂治疗的其它炎性病症包括例如阑尾炎、皮炎、皮肌炎、心内膜炎、纤维组织炎、牙龈炎、舌炎、肝炎、化脓性汗腺炎、虹膜炎、喉炎、乳腺炎、心肌炎、肾炎、耳炎、胰腺炎、腮腺炎、心外膜炎、腹膜炎、咽炎、胸膜炎、肺炎、前列腺炎、肾盂肾炎和口腔炎、移植排斥(涉及器官如肾、肝、心、肺、胰腺(例如,胰岛细胞)、骨髓、角膜、小肠、皮肤同种异体移植物、皮肤同种移植物和心脏瓣膜异种移植物、血清病和移植物抗宿主病)、急性胰腺炎、慢性胰腺炎、急性呼吸窘迫综合征、sexary's综合征、先天性肾上腺增生、非化脓性甲状腺炎、与癌症相关的高钙血症、天疱疮、大疱性皮炎、重症多形性红斑、剥脱性皮炎、脂溢性皮炎、季节性或常年性过敏性鼻炎、支气管哮喘、接触性皮炎、异位性皮炎、药物超敏反应、过敏性结膜炎、角膜炎、眼带状疱疹、虹膜炎和虹膜睫状体炎(oiridocyclitis)、脉络膜视网膜炎、视神经炎、症状性结节病、爆发性或播撒性肺结核化疗、成人的特发性血小板减少性紫癜、成人的继发性血小板减少症、获得性(自身免疫性)溶血性贫血、成人白血病和淋巴瘤、儿童急性白血病、局限性肠炎、自身免疫性血管炎、多发性硬化、慢性阻塞性肺病、实体器官移植排斥、败血症。优选的治疗包括移植排斥、类风湿性关节炎、牛皮癣性关节炎、多发性硬化、1型糖尿病、哮喘、炎性肠病、系统性红斑狼疮、牛皮癣、慢性肺部疾病和炎症伴感染病症(例如败血症)的治疗。
在本发明的另一方面,提供了式(i)化合物或其药学上可接受的盐,其用于治疗炎症、过敏和自身免疫性疾病。
在另一方面,提供了治疗炎症、过敏和自身免疫性疾病的方法,包括向需要该治疗的人施用治疗有效量的式(i)化合物或其药学上可接受的盐。
在另一方面,提供了式(i)化合物或其药学上可接受的盐在制备用于治疗炎症、过敏和自身免疫性疾病的药物中的用途。
在一个方面,待治疗的疾病是哮喘。
式(i)化合物及其药学上可接受的盐可以与一种或多种可用于预防或治疗过敏性疾病、炎性疾病、自身免疫性疾病的其它药剂组合使用,例如:抗原免疫疗法、抗组胺剂、类固醇、nsaid、支气管扩张剂(例如β2激动剂、肾上腺素激动剂、抗胆碱能剂、茶碱)、甲氨蝶呤、白细胞三烯调节剂和类似药剂;单克隆抗体疗法例如抗ige、抗tnf、抗il-5、抗il-6、抗il-12、抗il-1和类似药剂;受体疗法例如依那西普和类似药剂;抗原非特异性免疫疗法(例如干扰素或其它细胞因子/趋化因子、细胞因子/趋化因子受体调节剂、细胞因子激动剂或拮抗剂、tlr激动剂和类似药剂)。
在另一方面,提供了包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗过敏性疾病、炎症或自身免疫性疾病的其它治疗剂的组合。
在另一方面,提供了包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗过敏性疾病、炎症或自身免疫性疾病的其它治疗剂的组合,其用于治疗。
在另一方面,提供了包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗过敏性疾病、炎症或自身免疫性疾病的其它治疗剂的组合,其用于治疗过敏性疾病、炎症或自身免疫性疾病。
在另一方面,提供了包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗过敏性疾病、炎症或自身免疫性疾病的其它治疗剂的组合在制备用于治疗过敏性疾病、炎症或自身免疫性疾病的药物中的用途。
在另一方面,提供了治疗过敏性疾病、炎症或自身免疫性疾病的方法,包括向需要该治疗的人施用治疗有效量的包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗过敏性疾病、炎症或自身免疫性疾病的其它治疗剂的组合。
在另一方面,提供了药物组合物,其包含含有式(i)化合物或其药学上可接受的盐和至少一种可用于治疗过敏性疾病、炎症或自身免疫性疾病的其它治疗剂的组合和一种或多种的药学上可接受的赋形剂。
在一个方面,待用这种组合治疗的疾病是哮喘。
在一个方面,待治疗的疾病或病症是癌症。
其中式(i)化合物或其药学上可接受的盐或溶剂合物在其中可具有潜在有益的抗肿瘤作用的癌症疾病的实例包括但不限于肺、骨、胰腺、皮肤、头、颈、子宫、卵巢、胃、结肠、乳腺、食道、小肠、肠、内分泌系统、甲状腺、甲状旁腺、肾上腺、尿道、前列腺、阴茎、睾丸、输尿管、膀胱、肾或肝的癌症;直肠癌;肛门区癌;输卵管、子宫内膜、宫颈、阴道、外阴、肾盂、肾细胞的癌;软组织肉瘤;粘液瘤;横纹肌瘤;纤维瘤;脂肪瘤;畸胎瘤;胆管癌;肝母细胞瘤;血管肉瘤;血管瘤;肝癌;纤维肉瘤;软骨肉瘤;骨髓瘤;慢性或急性白血病;淋巴细胞性淋巴瘤;原发性cns淋巴瘤;cns的肿瘤;脊椎(spinalaxis)肿瘤;鳞状细胞癌;滑膜肉瘤;恶性胸膜间皮瘤;脑干胶质瘤;垂体腺瘤;支气管腺瘤;软骨瘤样错构瘤(chondromatoushanlartoma);眼眶孤立性纤维源性瘤(inesothelioma);霍奇金病或一种或多种前述癌症的组合。
适合地,本发明涉及治疗或减轻选自下列癌症的严重程度的方法:脑癌(胶质瘤)、成胶质细胞瘤、星形细胞瘤、多形性成胶质细胞瘤、bannayan-zonana综合征、cowden病、lhermitte-duclos病、wilm肿瘤、尤因氏肉瘤、横纹肌肉瘤、室管膜瘤、髓母细胞瘤、头颈癌、肾癌、肝癌、黑素瘤、卵巢癌、胰腺癌、腺癌、导管腺癌、腺鳞癌、腺泡细胞癌、胰高血糖素瘤、胰岛素瘤、前列腺癌、肉瘤、骨肉瘤、骨巨细胞瘤、甲状腺癌、淋巴细胞性t细胞白血病、慢性粒细胞性白血病、慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病、急性骨髓性白血病、慢性嗜中性白血病、急性淋巴细胞性t细胞白血病、浆细胞瘤、免疫母细胞性大细胞白血病、套细胞白血病、多发性骨髓瘤、巨核母细胞性白血病、多发性骨髓瘤、急性巨核细胞白血病、前髓细胞性白血病、红白血病、恶性淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、淋巴细胞性t细胞淋巴瘤、伯基特淋巴瘤、滤泡淋巴瘤、神经母细胞瘤、膀胱癌、尿路上皮癌、外阴癌、子宫颈癌、宫内膜癌、肾癌、间皮瘤、食管癌、唾液腺癌、肝细胞癌、胃癌、鼻咽癌、颊癌、口腔癌、gist(胃肠道间质瘤)和睾丸癌。
适合地,本发明涉及治疗或减轻包括人在内的哺乳动物的癌前综合征的严重程度的方法,其中所述癌前综合征选自:宫颈上皮癌变、未知意义的单克隆丙种球蛋白病(mgus)、骨髓增生异常综合征、再生障碍性贫血、宫颈病变、皮肤痣(前黑素瘤)、前列腺上皮内(导管内)瘤形成(pin)、导管原位癌(dcis)、结肠息肉和重型肝炎或肝硬化。
本发明的化合物还可以用作佐剂以改善对任何给定抗原产生的免疫应答和/或降低需要的患者特别是人的反应原性/毒性。如此,本发明的化合物可以与疫苗组合物联合使用,例如通过增加保护的水平或持续时间和/或允许减少抗原剂量来修饰,尤其是增强免疫应答。
式(i)的化合物及其药学上可接受的盐可与一种或多种用于预防或治疗病毒感染的疫苗或免疫原性抗原组合使用。这些疫苗或免疫原性抗原包括,但不限于病原体衍生的蛋白质或颗粒如通常用作免疫原性物质的减毒病毒、病毒颗粒和病毒性蛋白质。病毒和病毒性抗原的实例包括,但不限于脊髓灰质炎病毒、冠状病毒科和冠状病毒、鼻病毒(所有亚型)、腺病毒(所有亚型)、甲肝、乙肝、丙肝、丁肝、人乳头状瘤病毒(包括所有亚型)、狂犬病病毒、人t-淋巴细胞病毒(所有亚型)、风疹病毒、腮腺炎病毒、柯萨奇病毒a(所有亚型)、柯萨奇病毒b(所有亚型)、人肠病毒、疱疹病毒(包括巨细胞病毒)、epstein-barr病毒、人疱疹病毒(所有亚型)、单纯疱疹病毒、水痘带状疱疹病毒、人免疫缺陷病毒(hiv)(所有亚型)、aids、epstein-barr病毒、呼肠孤病毒(所有亚型)、丝状病毒(包括马尔堡病毒和埃博拉病毒(所有病毒株)、沙粒病毒(包括淋巴细胞性脉络丛脑膜炎病毒、拉沙病毒、胡宁病毒和machupo病毒)、虫媒病毒(包括西尼罗河病毒)、登革病毒(所有血清型)、寨卡病毒、科洛拉多蜱传热病毒、辛德比斯病毒、披膜病毒(togaviraidae)、黄病毒科、布尼亚病毒科、呼肠孤病毒科、弹状病毒科、正粘病毒科、痘病毒包括正痘病毒(天花病毒、猴痘病毒、痘苗病毒、牛痘病毒)、亚塔痘病毒(特纳河痘病毒、雅巴猴肿瘤病毒)、副痘病毒、软疣痘病毒、黄热病、汉坦病毒(包括hantaan、seoul、dobrava、sinnombre、puumala和dobrava-样saaremaa)、人副流感病毒和流感病毒(所有类型)、h1n1流感和猪流感病毒、呼吸道合胞体病毒(所有亚类)、轮状病毒(包括人轮状病毒a-e、牛轮状病毒、猕猴轮状病毒)、多瘤病毒(包括猿猴病毒40、jc病毒、bk病毒、科州蜱传热病毒、依埃契病毒、卡西病毒)、和细小病毒科(包括依赖病毒、细小病毒和红病毒(erythrovirus))。
本发明化合物还可用于治疗一种或多种困扰哺乳动物的疾病,所述疾病的特征在于与新血管形成和/或血管通透性相关的病状领域中的细胞增殖,包括:血管增殖性紊乱,包括关节炎(类风湿性关节炎)和再狭窄;纤维化紊乱,包括肝硬化和动脉粥样硬化;肾小球系膜细胞增殖性紊乱,包括肾小球肾炎、糖尿病性肾病、恶性肾硬化、血栓性微血管病综合征、增殖性视网膜病、器官移植排斥和肾小球病;和代谢紊乱,包括牛皮癣、糖尿病、慢性伤口愈合、炎症和神经变性疾病。
在本发明另一方面提供了式(i)的化合物或其药学上可接受的盐,其用于治疗选自以下的疾病状态:hiv、hbv、hcv、流感、皮肤疣、多发性硬化、过敏炎症,和作为佐剂。
zhijianchen-regulationandfunctionofthecgas–stingpathwayofcytosolicdnasensing–natureimmunology(2016),17,1142-1149.
seng-ryongwoo-sting-dependentcytosolicdnasensingmediatesinnateimmunerecognitionofimmunogenictumors(2014),41,830-842.
jennyp.-y.ting-nlrx1sequestersstingtonegativelyregulatetheinterferonresponse,therebyfacilitatingthereplicationofhiv-1anddnaviruses–cellhostandmicrobe(2016),19,515-528.
zhijianchen-pivotalrolesofcgas-cgampsignalinginantiviraldefenseandimmuneadjuvanteffects-science(2013),341,1390-1394.
nuchsuphasunthamala-e2proteinsofhighriskhumanpapillomavirusesdown-modulatestingandifn-ktranscriptioninkeratinocytes–plos(2014),9,1-11.
guo,h.,等人(2016).nlrx1sequestersstingtonegativelyregulatetheinterferonresponse,therebyfacilitatingthereplicationofhiv-1anddnaviruses.cellhostµbe19,515-528.
gao,d.,等人(2013).cyclicgmp-ampsynthaseisaninnateimmunesensorofhivandotherretroviruses.science341,903-906.
guo,f.,等人(2015).stingagonistsinduceaninnateantiviralimmuneresponseagainsthepatitisbvirus.antimicrobialagentsandchemotherapy59,1273-1281.
dansako,h.,等人(2016).thecyclicgmp-ampsynthetase-stingsignalingpathwayisrequiredforboththeinnateimmuneresponseagainsthbvandthesuppressionofhbvassembly.febsj283,144-156.
chang,j.,等人(2015).treatmentofchronichepatitisbwithpatternrecognitionreceptoragonists:currentstatusandpotentialforacure.antiviralresearch121,152-159.
li,x.d.,etal..(2013).pivotalrolesofcgas-cgampsignalinginantiviraldefenseandimmuneadjuvanteffects.science341,1390-1394.
carroll,e.c.,等人(2016).thevaccineadjuvantchitosanpromotescellularimmunityviadnasensorcgas-sting-dependentinductionoftypeiinterferons.immunity44,597-608.
wang,j.,等人(2016).naturalstingagonistasan"ideal"adjuvantforcutaneousvaccination.jinvestdermatol136,2183-2191.
holm,c.k.,等人(2016).influenzaavirustargetsacgas-independentstingpathwaythatcontrolsenvelopedrnaviruses.natcommun7,10680.
shirey,k.a.,等人(2011).theanti-tumoragent,5,6-dimethylxanthenone-4-aceticacid(dmxaa),inducesifn-beta-mediatedantiviralactivityinvitroandinvivo.jleukocbiol89,351-357.
nitta,s.,等人(2013).hepatitiscvirusns4bproteintargetsstingandabrogatesrig-i-mediatedtypeiinterferon-dependentinnateimmunity.hepatology57,46-58.
sunthamala,n.,等人(2014).e2proteinsofhighriskhumanpapillomavirusesdown-modulatestingandifn-kappatranscriptioninkeratinocytes.plosone9,e91473.
lau,l.,等人(2015).dnatumorvirusoncogenesantagonizethecgas-stingdna-sensingpathway.science350,568-571.
kidd,p.(2003).th1/th2balance:thehypothesis,itslimitations,andimplicationsforhealthanddisease.alternmedrev8,223-246.
huang,l.,等人(2013).cuttingedge:dnasensingviathestingadaptorinmyeloiddendriticcellsinducespotenttolerogenicresponses.jimmunol191,3509-3513.
lemos,h.,等人(2014).activationofthestingadaptorattenuatesexperimentalautoimmuneencephalitis.jimmunol192,5571-5578.
在本发明另一方面提供了式(i)的化合物或其药学上可接受的盐,其用于治疗癌症和/或癌前综合征。
在另一方面提供了治疗癌症的方法,包括向需要的人给药治疗有效量的式(i)的化合物或其药学上可接受的盐。
在另一方面,提供了式(i)化合物或其药学上可接受的盐在制备用于治疗癌症和/或癌前综合征的药物中的用途。
在一个实施方案中,本发明化合物可以与癌症治疗的其它治疗方法一起使用。特别地,在抗肿瘤治疗中,设想与其它化疗剂、激素、抗体剂以及除了上述那些之外的外科手术和/或放射治疗的组合疗法。
在一个实施方案中,所述其它抗癌疗法是外科手术和/或放射疗法。
在一个实施方案中,所述其它抗癌疗法是至少一种另外的抗肿瘤剂。
在本发明的另一方面,提供了一种组合,其包含式(i)的化合物或其药学上可接受的盐和至少一种抗肿瘤剂。
在本发明的另一方面,提供了一种组合,其包含式(i)的化合物或其药学上可接受的盐和至少一种抗肿瘤剂,用于治疗。
在本发明的另一方面,提供了一种组合,其包含式(i)的化合物或其药学上可接受的盐和至少一种抗肿瘤剂,用于治疗癌症和/或癌前综合征。
在另一方面,提供了一种组合在制备用于治疗癌症和/或癌前综合征的药物中的用途,所述组合包含式(i)的化合物或其药学上可接受的盐和至少一种抗肿瘤剂。
在另一方面,提供了治疗癌症的方法,包括向需要该治疗的人施用治疗有效量的一种组合,所述组合包含式(i)的化合物或其药学上可接受的盐和至少一种抗肿瘤剂。
在另一方面,提供了药物组合物,其包括:包含式(i)化合物或其药学上可接受的盐和至少一种其它治疗剂,特别是至少一种抗肿瘤剂的组合;和一种或多种药学上可接受的载体、稀释剂和赋形剂。
任何对于要治疗的易感肿瘤具有活性的抗肿瘤剂都可以用于组合中。可用的典型抗肿瘤剂包括,但不限于,抗微管剂,例如二萜类化合物和长春花生物碱;铂配位络合物;烷化剂,例如氮芥、氧氮磷环类(oxazaphosphorines)、烷基磺酸酯、亚硝基脲和三氮烯类;抗生素,例如蒽环类、放线菌素和博来霉素;拓扑异构酶ii抑制剂,例如表鬼臼毒素;抗代谢物,例如嘌呤和嘧啶类似物和抗叶酸化合物;拓扑异构酶i抑制剂,例如喜树碱;激素和激素类似物;信号转导通路抑制剂;非受体酪氨酸血管生成抑制剂;免疫治疗剂;促凋亡剂;细胞周期信号转导抑制剂,免疫肿瘤学试剂和免疫刺激剂。
抗微管或抗有丝分裂剂:
抗微管或抗有丝分裂剂是在细胞周期的m期或有丝分裂期对肿瘤细胞的微管具有活性的时相特异性药物。抗微管剂的实例包括,但不限于,二萜类化合物和长春花生物碱。
源自天然来源的二萜类化合物是在细胞周期的g2/m期起作用的时相特异性抗癌剂。据信二萜类化合物通过与该蛋白质结合来稳定微管的β-微管蛋白亚单位。然后蛋白质的分解似乎受到抑制,同时阻止有丝分裂,随后细胞死亡。二萜类化合物的实例包括,但不限于,紫杉醇及其类似物多西他赛。
紫杉醇,5β,20-环氧-1,2α,4,7β,10β,13α-六羟基紫杉烷-11-烯-9-酮4,10-二乙酸酯2-苯甲酸酯13-[(2r,3s)-n-苯甲酰基-3-苯基异丝氨酸酯],是从太平洋紫衫树短叶红豆杉(taxusbrevifolia)中分离的天然二萜产物,并且可作为注射液
多西他赛,(2r,3s)-n-羧基-3-苯基异丝氨酸,n-叔丁基酯,13-[5β-20-环氧-1,2α,4,7β,10β,13α-六羟基紫杉烷-11-烯-9-酮4-乙酸酯2-苯甲酸酯],三水合物;可作为注射液以
长春花生物碱是源自长春花植物的时相特异性抗肿瘤剂。长春花生物碱通过与微管蛋白特异性结合而作用于细胞周期的m期(有丝分裂)。因此,结合的微管蛋白分子不能聚合成微管。有丝分裂被认为在中期停止,随后细胞死亡。长春花生物碱的实例包括但不限于长春碱、长春新碱和长春瑞滨。
长春碱,长春花碱硫酸盐,可作为注射液以
长春新碱,22-氧代-长春花碱硫酸盐,可以作为注射液以
长春瑞滨,3’,4’-二去氢-4’-去氧-c’-去甲长春碱[r-(r*,r*)-2,3-二羟基丁二酸(1:2)(盐)],可作为酒石酸长春瑞滨注射液
铂配位络合物:
铂配位络合物是非时相特异性抗癌剂,其与dna相互作用。铂络合物进入肿瘤细胞,经历水合作用并与dna形成链内和链间交联,导致对肿瘤不利的生物效应。铂配位络合物的实例包括但不限于奥沙利铂、顺铂和卡铂。
顺铂,顺式-二氨二氯铂,可作为注射液以
卡铂,二氨[1,1-环丁烷-二羧酸根(2-)-o,o’]合铂,可以作为注射液以
烷化剂:
烷化剂是非时相特异性抗癌剂和强亲电子药剂。通常,烷化剂通过烷基化经dna分子的亲核部分如磷酸基(phosphate)、氨基、巯基、羟基、羧基和咪唑基与dna形成共价键。这种烷基化破坏了核酸功能,导致细胞死亡。烷化剂的实例包括但不限于氮芥,例如环磷酰胺,美法仑和苯丁酸氮芥;烷基磺酸酯,例如白消安;亚硝基脲,例如卡莫司汀;和三氮烯类,例如达卡巴嗪。
环磷酰胺,2-[双(2-氯乙基)氨基]四氢-2h-1,3,2-氧氮磷杂环己烷2-氧化物一水合物,可作为注射液或片剂以
美法仑,4-[双(2-氯乙基)氨基]-l-苯丙氨酸,可作为注射液或片剂以
苯丁酸氮芥,4-[双(2-氯乙基)氨基]苯丁酸,可作为
白消安,二甲磺酸-1,4-丁二醇酯,可作为
卡莫司汀,1,3-[双(2-氯乙基)-1-亚硝基脲,可作为单瓶的冻干材料以
达卡巴嗪,5-(3,3-二甲基-1-三氮烯基)-咪唑-4-甲酰胺,可作为单瓶的物质以dtic-
抗生素抗肿瘤剂:
抗生素抗肿瘤剂是非时相特异性药剂,其结合或插入dna。通常,这种作用导致稳定的dna络合物或链断裂,这破坏核酸的正常功能,导致细胞死亡。抗生素抗肿瘤剂的实例包括但不限于放线菌素如更生霉素、蒽环类如柔红霉素和多柔比星;和博来霉素。
更生霉素,也称为放线菌素d,可以注射形式以
柔红霉素,(8s-顺式)-8-乙酰基-10-[(3-氨基-2,3,6-三去氧-α-l-来苏-己吡喃糖基)氧基]-7,8,9,10-四氢-6,8,11-三羟基-1-甲氧基-5,12萘并萘二酮盐酸盐,可以脂质体注射形式以
多柔比星,(8s,10s)-10-[(3-氨基-2,3,6-三去氧-α-l-来苏-己吡喃糖基)氧基]-8-乙醇酰基,7,8,9,10-四氢-6,8,11-三羟基-1-甲氧基-5,12并四苯二酮盐酸盐,可作为注射形式以
博来霉素是从轮丝链霉菌(streptomycesverticillus)菌株中分离的细胞毒性糖肽类抗生素的混合物,可以
拓扑异构酶ii抑制剂:
拓扑异构酶ii抑制剂包括但不限于表鬼臼毒素。
表鬼臼毒素是源自曼陀罗花(mandrake)植物的时相特异性抗肿瘤剂。表鬼臼毒素通常通过与拓扑异构酶ii和dna形成三元复合物导致dna链断裂而影响细胞周期的s和g2期中的细胞。链断裂积累,接着细胞死亡。表鬼臼毒素的实例包括但不限于依托泊苷和替尼泊苷。
依托泊苷,4’-去甲基-表鬼臼毒素9[4,6-0-(r)-亚乙基-β-d-吡喃葡萄糖苷],可作为注射液或胶囊以
替尼泊苷,4’-去甲基-表鬼臼毒素9[4,6-0-(r)-噻吩亚甲基-β-d-吡喃葡萄糖苷],可作为注射液以
抗代谢物肿瘤剂:
抗代谢物肿瘤剂是时相特异性抗肿瘤剂,其作用于细胞周期的s期(dna合成),通过抑制dna合成或通过抑制嘌呤或嘧啶碱基合成从而限制dna合成。因此,s期不继续进行,接着细胞死亡。抗代谢物抗肿瘤剂的实例包括但不限于氟尿嘧啶、甲氨蝶呤、阿糖胞苷、巯基嘌呤、硫鸟嘌呤和吉西他滨。
5-氟尿嘧啶,5-氟-2,4-(1h,3h)嘧啶二酮,可作为氟尿嘧啶商购获得。施用5-氟尿嘧啶导致抑制胸苷酸合成,并且也掺入到rna和dna二者中。结果通常是细胞死亡。5-氟尿嘧啶被指示作为单一药剂或与其它化疗剂组合用于治疗乳腺癌、结肠癌、直肠癌、胃癌和胰腺癌。其它氟嘧啶类似物包括5-氟脱氧尿苷(氟尿苷)和5-氟脱氧尿苷一磷酸。
阿糖胞苷,4-氨基-1-β-d-阿拉伯呋喃糖基-2(1h)-嘧啶酮,可作为cytosar-
巯基嘌呤,1,7-二氢-6h-嘌呤-6-硫酮一水合物,可作为
硫鸟嘌呤,2-氨基-1,7-二氢-6h-嘌呤-6-硫酮,可作为
吉西他滨,2’-脱氧-2’,2’-二氟胞苷一盐酸盐(β-异构体),可作为
甲氨蝶呤,n-[4[[(2,4-二氨基-6-蝶啶基)甲基]甲基氨基]苯甲酰基]-l-谷氨酸,可作为甲氨蝶呤钠商购得到。甲氨蝶呤通过抑制合成嘌呤核苷酸和胸苷酸所需的二氢叶酸还原酶抑制dna合成、修复和/或复制,而在s期显示细胞时相特异性效应。甲氨蝶呤被指示作为单一药剂或与其它化疗剂组合用于治疗绒毛膜癌、脑膜白血病、非霍奇金淋巴瘤,以及乳腺癌、头癌、颈癌、卵巢癌和膀胱癌。
拓扑异构酶i抑制剂:
喜树碱,包括喜树碱和喜树碱衍生物,可作为拓扑异构酶i抑制剂得到或在开发中。喜树碱的细胞毒活性被认为与其拓扑异构酶i抑制活性有关。喜树碱的实例包括但不限于伊立替康、托泊替康和下文所述的7-(4-甲基哌嗪基-亚甲基)-10,11-亚乙基二氧基-20-喜树碱的各种光学形式。
盐酸伊立替康,(4s)-4,11-二乙基-4-羟基-9-[(4-哌啶基哌啶基)羰基氧基]-1h-吡喃并[3’,4’,6,7]氮茚并[1,2-b]喹啉-3,14(4h,12h)-二酮盐酸盐,可作为注射液
盐酸托泊替康,(s)-10-[(二甲基氨基)甲基]-4-乙基-4,9-二羟基-1h-吡喃并[3’,4’,6,7]吲嗪并[1,2-b]喹啉-3,14-(4h,12h)-二酮单盐酸盐,可作为注射液
激素和激素类似物:
激素和激素类似物是用于治疗癌症的有用化合物,其中在激素和癌症的生长和/或生长缺乏之间存在关系。可用于癌症治疗的激素和激素类似物的实例包括但不限于肾上腺皮质类固醇,例如泼尼松和泼尼松龙,其可用于治疗儿童的恶性淋巴瘤和急性白血病;氨鲁米特和其它芳香酶抑制剂,例如阿那曲唑、来曲唑、伏氯唑和依西美坦,其可用于治疗肾上腺皮质癌和激素依赖性乳腺癌,其含有雌激素受体;孕激素,例如醋酸甲地孕酮,其可用于治疗激素依赖性乳腺癌和子宫内膜癌;雌激素、雌激素和抗雌激素,例如氟维司群、氟他胺、尼鲁米特、比卡鲁胺、乙酸环丙孕酮和5α-还原酶例如非那雄胺和度他雄胺,其用于治疗前列腺癌和良性前列腺增生;抗雌激素,例如他莫昔芬、托瑞米芬、雷洛昔芬、屈洛昔芬、吲哚昔芬(iodoxyfene),以及选择性雌激素受体调节剂(serms),如美国专利号5,681,835、5,877,219和6,207,716中描述的那些,其可用于治疗激素依赖性乳腺癌和其它易受影响的癌症;和促性腺激素释放激素(gnrh)及其类似物,其刺激促黄体生成素(lh)和/或促卵泡激素(fsh)的释放,可用于治疗前列腺癌,例如lhrh激动剂和拮抗剂如醋酸戈舍瑞林和亮丙瑞林。
信号转导通路抑制剂:
信号转导通路抑制剂是阻断或抑制引起细胞内变化的化学过程的那些抑制剂。如本文所用,这种变化是细胞增殖或分化。可用于本发明的信号转导抑制剂包括下列的抑制剂:受体酪氨酸激酶、非受体酪氨酸激酶、sh2/sh3结构域阻断剂、丝氨酸/苏氨酸激酶、磷脂酰肌醇-3激酶、肌醇信号转导和ras致癌基因。
几种蛋白酪氨酸激酶催化参与调节细胞生长的各种蛋白质中特定酪氨酰残基的磷酸化。这种蛋白酪氨酸激酶可以广义地分类为受体或非受体激酶。
受体酪氨酸激酶是具有胞外配体结合结构域、跨膜结构域和酪氨酸激酶结构域的跨膜蛋白。受体酪氨酸激酶参与细胞生长的调节,并通常称为生长因子受体。许多这些激酶的不适当或不受控制的活化,即异常激酶生长因子受体活性,例如通过过表达或突变导致,已显示导致不受控制的细胞生长。因此,这种激酶的异常活性已经与恶性组织生长相联系。因此,这种激酶的抑制剂可以提供癌症治疗方法。生长因子受体包括例如表皮生长因子受体(egfr)、血小板衍生生长因子受体(pdgfr)、erbb2、erbb4、ret、血管内皮生长因子受体(vegfr)、具有免疫球蛋白样和表皮生长因子同源结构域的酪氨酸激酶(tie-2)、胰岛素样生长因子-i(igfi)受体、巨噬细胞集落刺激因子(cfms)、btk、ckit、cmet、成纤维细胞生长因子(fgf)受体、trk受体(trka、trkb和trkc)、肝配蛋白(eph)受体和ret原癌基因。几种生长受体抑制剂正在开发中,包括配体拮抗剂、抗体、酪氨酸激酶抑制剂和反义寡核苷酸。生长因子受体和抑制生长因子受体功能的药剂描述于例如kath,johnc.,exp.opin.ther.patents(2000)10(6):803-818;shawveretalddtvol2,no.2february1997;和lofts,f.j.etal,“growthfactorreceptorsastargets”,newmoleculartargetsforcancerchemotherapy,ed.workman,paulandkerr,david,crcpress1994,london中。
酪氨酸激酶,其不是生长因子受体激酶,被称为非受体酪氨酸激酶。可用于本发明的作为抗癌药物靶标或潜在靶标的非受体酪氨酸激酶包括csrc、lck、fyn、yes、jak、cab1、fak(粘着斑激酶)、brutons酪氨酸激酶和bcr-abl。这种非受体激酶和抑制非受体酪氨酸激酶功能的药剂描述于sinh,s.andcorey,s.j.,(1999)journalofhematotherapyandstemcellresearch8(5):465-80;和bolen,j.b.,brugge,j.s.,(1997)annualreviewofimmunology.15:371-404中。
sh2/sh3结构域阻断剂是破坏各种酶或衔接蛋白中的sh2或sh3结构域结合的药剂,所述酶或衔接蛋白包括pi3-kp85亚单元、src家族激酶、衔接分子(shc、crk、nck、grb2)和ras-gap。作为抗癌药物靶标的sh2/sh3结构域论述于smithgall,t.e.(1995),journalofpharmacologicalandtoxicologicalmethods.34(3)125-32中。
丝氨酸/苏氨酸激酶抑制剂,包括map激酶级联阻断剂,其包括raf激酶(rafk)、丝裂原或细胞外调节激酶(mek)和细胞外调节激酶(erk)的阻断剂;和蛋白激酶c家族成员阻断剂,包括pkc(α、β、γ、ε、μ、λ、ι、ζ)、ikb激酶家族(ikka、ikkb)、pkb家族激酶、akt激酶家族成员和tgfβ受体激酶的阻断剂。这种丝氨酸/苏氨酸激酶及其抑制剂描述于yamamoto,t.,taya,s.,kaibuchi,k.,(1999),journalofbiochemistry.126(5)799-803;brodt,p,samani,a.,andnavab,r.(2000),biochemicalpharmacology,60.1101-1107;massague,j.,weis-garcia,f.(1996)cancersurveys.27:41-64;philip,p.a.,andharris,a.l.(1995),cancertreatmentandresearch.78:3-27;lackey,k.etalbioorganicandmedicinalchemistryletters,(10),2000,223-226;美国专利no.6,268,391;和martinez-iacaci,l.,etal,int.j.cancer(2000),88(1),44-52中。
磷脂酰肌醇-3激酶家族成员的抑制剂,包括pi3激酶、atm、dna-pk和ku的阻断剂也可用于本发明。这种激酶论述于abraham,r.t.(1996),currentopinioninimmunology.8(3)412-8;canman,c.e.,lim,d.s.(1998),oncogene17(25)3301-3308;jackson,s.p.(1997),internationaljournalofbiochemistryandcellbiology.29(7):935-8;和zhong,h.etal,cancerres,(2000)60(6),1541-1545中。
还可用于本发明的是肌醇信号转导抑制剂,例如磷脂酶c阻断剂和肌醇类似物。这种信号抑制剂描述于powis,g.,andkozikowskia.,(1994)newmoleculartargetsforcancerchemotherapyed.,paulworkmananddavidkerr,crcpress1994,london中。
另一组信号转导通路抑制剂是ras致癌基因的抑制剂。这种抑制剂包括法尼基转移酶、香叶基香叶基转移酶和caax蛋白酶的抑制剂以及反义寡核苷酸、核酶和免疫疗法。这种抑制剂已经显示阻断含有野生型突变ras的细胞中的ras活化,从而起到抗增殖剂的作用。ras致癌基因抑制论述于scharovsky,o.g.,rozados,v.r.,gervasoni,s.i.matar,p.(2000),journalofbiomedicalscience.7(4)292-8;ashby,m.n.(1998),currentopinioninlipidology.9(2)99–102;和biochim.biophys.acta,(19899)1423(3):19-30中。
如上所述,受体激酶配体结合的抗体拮抗剂也可以用作信号转导抑制剂。这组信号转导通路抑制剂包括将人源化抗体用于受体酪氨酸激酶的细胞外配体结合结构域。例如imclonec225egfr特异性抗体(参见green,m.c.etal,monoclonalantibodytherapyforsolidtumors,cancertreat.rev.,(2000),26(4),269-286);
抗血管生成剂:
(i)包括非受体mek血管生成抑制剂的抗血管生成剂也可能是有用的。抗血管生成剂例如抑制血管内皮生长因子的作用的那些(例如抗血管内皮细胞生长因子抗体贝伐单抗[avastintm],以及通过其它机制起作用的化合物(例如利诺胺、整联蛋白αvβ3功能抑制剂、内皮他丁(endostatin)和血管他丁(angiostatin))。
免疫治疗剂:
用于免疫治疗方案的药剂也可以与式(i)化合物组合使用。免疫治疗方法,包括例如增加患者肿瘤细胞的免疫原性的离体和体内方法,例如用细胞因子如白细胞介素2、白细胞介素4或粒细胞-巨噬细胞集落刺激因子转染,降低t细胞无能的方法,使用转染的免疫细胞例如细胞因子转染的树突细胞的方法,使用细胞因子转染的肿瘤细胞系的方法和使用抗独特型抗体的方法。
促凋亡剂:
用于促凋亡方案的药剂(例如,bcl-2反义寡核苷酸)也可用于本发明的组合中。
细胞周期信号传导抑制剂
细胞周期信号传导抑制剂抑制参与细胞周期控制的分子。称为细胞周期蛋白依赖性激酶(cdk)的蛋白激酶家族及其与称为细胞周期蛋白的蛋白质家族的相互作用控制通过真核细胞周期的进展。不同细胞周期蛋白/cdk复合物的配位活化和失活对于通过细胞周期的正常进展是必需的。几种细胞周期信号转导的抑制剂正在开发中。例如,细胞周期蛋白依赖性激酶(包括cdk2、cdk4和cdk6及其抑制剂)的实例描述于例如rosaniaetal,exp.opin.ther.patents(2000)10(2):215-230中。
在一个实施方案中,本发明的组合包含式i的化合物或其盐或溶剂合物和至少一种抗肿瘤剂,所述抗肿瘤剂选自抗微管剂、铂配位络合物、烷化剂、抗生素、拓扑异构酶ii抑制剂、抗代谢物、拓扑异构酶i抑制剂、激素和激素类似物、信号转导通路抑制剂、非受体酪氨酸mek血管生成抑制剂、免疫治疗剂、促凋亡剂和细胞周期信号传导抑制剂。
在一个实施方案中,本发明的组合包含式i的化合物或其盐或溶剂合物和至少一种抗肿瘤剂,所述抗肿瘤剂是选自二萜类化合物和长春花生物碱的抗微管剂。
在另一实施方案中,至少一种抗肿瘤剂是二萜类化合物。
在另一实施方案中,至少一种抗肿瘤剂是长春花生物碱。
在一个实施方案中,本发明的组合包含式i的化合物或其盐或溶剂合物和至少一种抗肿瘤剂,所述抗肿瘤剂是铂配位络合物。
在另一实施方案中,至少一种抗肿瘤剂是紫杉醇、卡铂或长春瑞滨。
在另一实施方案中,至少一种抗肿瘤剂是卡铂。
在另一实施方案中,至少一种抗肿瘤剂是长春瑞滨。
在另一实施方案中,至少一种抗肿瘤剂是紫杉醇。
在一个实施方案中,本发明的组合包含式i的化合物及其盐或溶剂合物和至少一种抗肿瘤剂,所述抗肿瘤剂是信号转导通路抑制剂。
在另一实施方案中,信号转导通路抑制剂是生长因子受体激酶vegfr2、tie2、pdgfr、btk、erbb2、egfr、igfr-1、trka、trkb、trkc或c-fms的抑制剂。
在另一实施方案中,所述信号转导通路抑制剂是丝氨酸/苏氨酸激酶rafk、akt或pkc-ζ的抑制剂。
在另一实施方案中,所述信号转导通路抑制剂是选自src家族激酶的非受体酪氨酸激酶的抑制剂。
在另一实施方案中,所述信号转导通路抑制剂是c-src的抑制剂。
在另一实施方案中,所述信号转导通路抑制剂是ras致癌基因的抑制剂,其选自法尼基转移酶和香叶基香叶基转移酶的抑制剂。
在另一实施方案中,所述信号转导通路抑制剂是选自pi3k的丝氨酸/苏氨酸激酶的抑制剂。
在另一实施方案中所述信号转导通路抑制剂为双重egfr/erbb2抑制剂,例如n-{3-氯-4-[(3-氟苄基)氧基]苯基}-6-[5-({[2-(甲烷磺酰基)乙基]氨基}甲基)-2-呋喃基]-4-喹唑啉胺(以下结构):
在一个实施方案中,本发明的组合包含式i的化合物或其盐或溶剂合物和至少一种抗肿瘤剂,所述抗肿瘤剂是细胞周期信号传导抑制剂。
在其它实施方案中,细胞周期信号传导抑制剂是cdk2、cdk4或cdk6的抑制剂。
免疫刺激剂:
本文所用的“免疫刺激剂”是指可以刺激免疫系统的任何药剂。本文所用的免疫刺激剂包括,但不限于,疫苗佐剂,如toll-样受体激动剂,t-细胞检查点阻断剂,如对pd-1和ctl4的mabs,和t-细胞检查点激动剂,如对ox-40和icos的激动剂mabs。
用于与本发明式(i)的化合物组合或共同给药的其它活性成分或成分(抗肿瘤剂)的其它实例为抗pd-l1试剂。
抗pd-l1抗体及其制备方法是本领域已知的。
一些pd-l1的这种抗体可为多克隆或单克隆的、和/或重组和/或人源化的。
示例性pd-l1抗体公开于:
美国专利no.8,217,149;12/633,339;
美国专利no.8,383,796;13/091,936;
美国专利no8,552,154;13/120,406;
美国专利公开no.20110280877;13/068337;
美国专利公开no.20130309250;13/892671;
wo2013019906;
wo2013079174;
美国申请no.13/511,538(2012年8月7日提交),其为国际申请no.pct/us10/58007(2010年提交)的美国国家阶段;
和
美国申请no.13/478,511(2012年5月23日提交)。
另外的示例性的针对pd-l1(也称为cd274或b7-h1)的抗体和使用方法公开在美国专利no.7,943,743;us20130034559,wo2014055897,美国专利no.8,168,179;和美国专利no.7,595,048中。正在开发pd-l1抗体作为治疗癌症的免疫调节剂。
在一个实施方案中,pd-l1抗体是美国专利no.8,217,149中公开的抗体。在另一个实施方案中,抗pd-l1抗体包含美国专利no.8,217,149中公开的抗体的cdr。
在另一个实施方案中,pd-l1抗体是美国申请no.13/511,538中公开的抗体。在另一个实施方案中,抗pd-l1抗体包含美国申请no.13/511,538中公开的抗体的cdr。
在另一个实施方案中,pd-l1抗体是美国申请no.13/478,511中公开的抗体。在另一个实施方案中,抗pd-l1抗体包含美国申请no.13/478,511中公开的抗体的cdr。
在一个实施方案中,抗pd-l1抗体为bms-936559(mdx-1105)。在另一实施方案中,抗pd-l1抗体为mpdl3280a(rg7446)。在另一实施方案中,抗pd-l1抗体为medi4736。
用于与本发明的式(i)化合物组合或共同施用的另外的一种或多种活性成分(抗肿瘤剂)的另外的实例是pd-1拮抗剂。
“pd-1拮抗剂”是指阻断在癌细胞上表达的pd-l1与在免疫细胞(t细胞,b细胞或nkt细胞)上表达的pd-1结合,并且优选还阻断在癌细胞上表达的pd-l2与免疫细胞表达的pd-1结合的任何化学化合物或生物分子。pd-1及其配体的替代名称或同义词包括:用于pd-1的pdcd1、pd1、cd279和sleb2;用于pd-l1的pdcd1l1、pdl1、b7h1、b7-4、cd274和b7-h;和用于pd-l2的pdcd1l2、pdl2、b7-dc、btdc和cd273。在其中要治疗人类个体的本发明方面或实施方案的任何实施方案中,pd-1拮抗剂阻断人pd-l1与人pd-1的结合,并且优选同时阻断人pd-l1和pd-l2与人pd-1的结合。人pd-1氨基酸序列可以在ncbilocusno.:np_005009中找到。人pd-l1和pd-l2氨基酸序列分别可以在ncbilocusno.:np_054862和np_079515中找到。
可用于本发明任何方面的pd-1拮抗剂包括特异性结合pd-1或pd-l1,并且优选特异性结合人pd-1或人pd-l1的单克隆抗体(mab)或其抗原结合片段。所述mab可以是人抗体,人源化抗体或嵌合抗体,并且可以包括人恒定区。在一些实施方案中,人恒定区选自igg1、igg2、igg3和igg4恒定区,并且在优选的实施方案中,人恒定区是igg1或igg4恒定区。在一些实施方案中,抗原结合片段选自fab、fab'-sh、f(ab')2、scfv和fv片段。
结合人pd-1并且可用于本发明各个方面和实施方案的mab的实例描述在us7488802、us7521051、us8008449、us8354509、us8168757、wo2004/004771、wo2004/072286、wo2004/056875和us2011/0271358中。
在本发明的任何方面和实施方案中用作pd-1拮抗剂的具体抗人pd-1mab包括:mk-3475,一种人源化igg4mab,具有whodruginformation,vol.27,no.2,pages161-162(2013)中描述的结构,并且其包含图6所示的重链和轻链氨基酸序列;纳武单抗(nivolumab),一种人igg4mab,具有whodruginformation,vol.27,no.1,pages68-69(2013)中描述的结构,并且其包含图7所示的重链和轻链氨基酸序列;人源化抗体h409a11、h409a16和h409a17(它们描述在wo2008/156712中)以及amp-514(其正在由medimmune开发)。
可用于本发明的任何方面和实施方案的其它pd-1拮抗剂包括特异性结合pd-1并优选特异性结合人pd-1的免疫粘附素,例如含有融合到免疫球蛋白分子的恒定区(如fc区)的pd-l1或pd-l2的胞外或pd-1结合部分的融合蛋白。特异性结合pd-1的免疫粘附分子的实例描述于wo2010/027827和wo2011/066342中。在本发明的治疗方法、药物和用途中可用作pd-1拮抗剂的具体融合蛋白包括amp-224(也称为b7-dcig),其为pd-l2-fc融合蛋白并结合人pd-1。
结合人pd-l1并可用于本发明的治疗方法、药物和用途中的mab的其它实例描述于wo2013/019906,w02010/077634a1和us8383796。在本发明的治疗方法、药物和用途中可用作pd-1拮抗剂的具体的抗人pd-l1mab包括mpdl3280a,bms-936559,medi4736,msb0010718c。
keytruda/派姆单抗(pembrolizumab)是由merck销售用于治疗肺癌的抗pd-1抗体。派姆单抗的氨基酸序列和使用方法公开在美国专利no.8,168,757中。
opdivo/纳武单抗是一种完全人单克隆抗体,由bristolmyerssquibb销售,针对负免疫调节性人类细胞表面受体pd-1(程序性死亡-1或程序性细胞死亡-1/pcd-1),具有免疫增强活性。纳武单抗通过其配体pd-l1和pd-l2结合并阻断pd-1(ig超家族跨膜蛋白)的活化,导致t细胞的活化和针对肿瘤细胞或病原体的细胞介导的免疫应答。活化的pd-1通过抑制p13k/akt通路激活来负调节t细胞活化和效应子功能。纳武单抗的其他名称包括:bms-936558,mdx-1106和ono-4538。纳武单抗的氨基酸序列以及使用和制备方法公开在美国专利no.us8,008,449中。
用于与本发明的式(i)化合物组合或共同施用的另外的一种或多种活性成分(抗肿瘤剂)的另外的实例是免疫调节剂。
本文所用的“免疫调节剂”是指影响免疫系统的包括单克隆抗体在内的任何物质。本发明的icos结合蛋白可以被认为是免疫调节剂。免疫调节剂可用作抗肿瘤剂用于治疗癌症。例如,免疫调节剂包括但不限于抗ctla-4抗体,例如伊匹单抗(ipilimumab)(yervoy)和抗pd-1抗体(opdivo/纳武单抗和keytruda/派姆单抗(pembrolizumab))。其他免疫调节剂包括,但不限于,ox-40抗体、pd-l1抗体、lag3抗体、tim-3抗体、41bb抗体和gitr抗体。
yervoy(伊匹单抗)是由bristolmyerssquibb销售的全人ctla-4抗体。伊匹单抗的蛋白质结构和使用的方法描述于美国专利no.6,984,720和7,605,238中。
cd134,也称为ox40,与cd28不同,其是不在静息的天然t细胞上组成性表达的受体的tnfr-超家族的成员。ox40是辅助共刺激分子(secondarycostimulatorymolecule),其在活化后24至72小时后表达;其配体ox40l也不在静息抗原呈递细胞上表达,而是在其活化之后表达。ox40的表达依赖于t细胞的完全活化;没有cd28,ox40的表达被延迟并且降低了四倍。ox-40抗体,ox-40融合蛋白及其使用方法公开于美国专利no.us7,504,101;us7,758,852;us7,858,765;us7,550,140;us7,960,515;wo2012027328;wo2013028231。
本文所用的术语“toll样受体”(或“tlr”)是指感测微生物产物和/或启动适应性免疫应答的蛋白或其片段的toll样受体家族的成员。在一个实施方案中,tlr激活树突状细胞(dc)。toll样受体(tlr)是模式识别受体家族,最初被确认为识别微生物病原体的天然免疫系统的传感器。tlr识别微生物中的不同结构,通常称为“pamp”(病原体相关的分子模式)。与tlr结合的配体引起细胞内信号传导通路的级联,其诱导涉及炎症和免疫的因子的产生。在人类中,已经鉴定了十种tlr。在细胞表面表达的tlr包括tlr-1、-2、-4、-5和-6,而tlr-3、-7/8和-9用er区表达。人类dc亚型可以根据不同的tlr表达模式进行鉴定。举例来说,dc的骨髓或“常规”亚型(mdc)在被刺激时表达tlr1-8,并产生活化标记(例如,cd80,cd86,i类和ii类mhc,ccr7)、促炎细胞因子和趋化因子的级联。这种刺激和产生的表达的结果是抗原特异性cd4+和cd8+t细胞的引发(priming)。这些dc获得增强的获取抗原的能力,并将其以适当的形式呈递给t细胞。相比之下,dc的浆细胞样亚型(pdc)在激活时仅表达tlr7和tlr9,导致激活nk细胞以及t细胞。因为死亡的肿瘤细胞可能不利地影响dc功能,已经提出用tlr激动剂激活dc可能有益于在用于治疗癌症的免疫治疗方法中引发抗肿瘤免疫。还有人建议,使用放射和化学疗法成功治疗乳腺癌需要tlr4激活。
本领域已知且在本发明中有用的tlr激动剂包括,但不限于,以下:pam3cys,一种tlri/2激动剂;cfa,一种tlr2激动剂;malp2,一种tlr2激动剂;pam2cys,一种tlr2激动剂;fsl-1,一种tlr-2激动剂;hib-ompc,一种tlr-2激动剂;polyribosinic:polyribocytidicacid(polyi:c),一种tlr3激动剂;聚腺苷多聚尿酸(polyau),一种tlr3激动剂;用聚-l-赖氨酸和羧甲基纤维素稳定的聚肌苷酸-聚胞苷酸(hiltonol),一种tlr3激动剂;细菌鞭毛蛋白,一种tlr5激动剂;咪喹莫特,一种tlr7激动剂;瑞喹莫德,一种tlr7/8激动剂;洛索立宾,一种tlr7/8激动剂;和未甲基化的cpg二核苷酸(cpg-odn),一种tlr9激动剂。
本领域已知的并且在本发明中有用的另外的tlr激动剂还包括,但不限于,氨基烷基氨基葡糖苷磷酸酯(agp),其结合tlr4受体,已知可用作疫苗佐剂和免疫刺激剂用于在免疫动物中刺激细胞因子产生,激活巨噬细胞,促进天然免疫应答,以及增强抗体产生。天然存在的tlr4激动剂的实例是细菌lps。半合成tlr4激动剂的实例是单磷酰脂质a(mpl)。agp及其通过tlr4的免疫调节作用公开在专利公开文献中,例如wo2006/016997,wo2001/090129和/或美国专利no.6,113,918,并已在文献中报道。另外的agp衍生物公开在美国专利no.7,129,219,美国专利no.6,525,028和美国专利no.6,911,434中。一些agp作为tlr4的激动剂起作用,而其他agp被认为是tlr4拮抗剂。
除了上文所述的免疫刺激剂之外,本发明的组合物还可以包含一种或多种另外的物质,由于它们的佐剂性质,其可以起作用来刺激免疫系统对存在于灭活肿瘤细胞上的癌抗原作出响应。这些佐剂包括,但不限于,脂质,脂质体,诱导天然免疫的灭活的细菌(例如,灭活或减毒的i/ster/一种产单核细胞),通过(nod)样受体(nlds)、基于视黄酸诱导基因(rig)-i样受体(rlr)和/或c型凝集素受体(clr)介导天然免疫激活的组合物。pamp的实例包括脂蛋白、脂多肽、肽聚糖、酵母聚糖、脂多糖、奈瑟氏孔蛋白、鞭毛蛋白、抑制蛋白、半乳聚酰胺、胞壁酰二肽。肽聚糖、脂蛋白和脂磷壁酸是革兰氏阳性的细胞壁组分。脂多糖由大多数细菌表达,mpl是一个例子。鞭毛蛋白是指由致病菌和共生细菌分泌的细菌鞭毛的结构成分。rt.-半乳糖苷神经酰胺(rt.-galcer)是自然杀伤t(nkt)细胞的激活剂。胞壁酰二肽是所有细菌共有的生物活性肽聚糖基序。
由于它们的佐剂特质,优选tlr激动剂与其它疫苗、佐剂和/或免疫调节剂组合使用,并且可以以各种组合产品进行组合。因此,在一些实施方案中,本文所述的结合sting并诱导sting依赖性tbki活化的式(i)化合物和表达并分泌刺激dc诱导、募集和/或成熟的一种或多种细胞因子的灭活肿瘤细胞,如本文所述,可以与一种或多种tlr激动剂一起施用以用于治疗目的。
用于与本发明的式(i)化合物组合或共同施用的另外的一种或多种活性成分(抗肿瘤剂)的其它实例是icos抗体。
pct/ep2012/055735(wo2012/131004)显示了具有激动剂活性的人icos的鼠抗体的cdr。icos的抗体也公开在wo2008/137915、wo2010/056804、ep1374902、ep1374901和ep1125585中。
吲哚胺2,3-双加氧酶1(ido1)为调节抗肿瘤免疫应答的关键免疫抑制酶,其通过促进调节性t细胞的产生和阻断效应t细胞的活化,从而通过允许癌细胞避免免疫监视以促进肿瘤生长。(lemosh等,cancerres。2016年4月15日;76(8):2076-81),(munndh等,trendsimmunol.2016mar;37(3):193-207)。与本发明的式(i)化合物联合或共同给药的其它活性成分(抗肿瘤剂)是ido抑制剂。epacadostat,((z)-n-(3-溴-4-氟苯基)-n'-羟基-4-[2-(氨磺酰基氨基)乙基氨基]-1,2,5-噁二唑-3-甲脒)是高度有效且选择性的ido1酶的口服抑制剂,其逆转肿瘤相关的免疫抑制并恢复有效的抗肿瘤免疫应答。epacadostat公开于美国专利第8,034,953号。
与本发明的式(i)化合物组合或共同给药的其它的一种或多种活性成分(抗肿瘤剂)的另外的实例是cd73抑制剂和a2a和a2b腺苷拮抗剂。
在一个方面,待治疗的疾病是感染性疾病,例如由细菌或病毒引起的疾病。
在本发明的另一方面,提供了用于治疗感染性疾病的式(i)化合物或其药学上可接受的盐。
在另一方面,提供了治疗感染性疾病的方法,包括向有此需要的人施用治疗有效量的式(i)化合物或其药学上可接受的盐。
在另一方面,提供式(i)化合物或其药学上可接受的盐在制备用于治疗感染性疾病的药物中的用途。
在一个实施方案中,本发明化合物可以与治疗感染性疾病的其它治疗方法一起使用。特别地,考虑抗病毒剂和抗菌剂。
式(i)化合物及其药学上可接受的盐可以与一种或多种可用于预防或治疗细菌和病毒感染的药剂组合使用。这种药剂的实例包括但不限于:聚合酶抑制剂,例如wo2004/037818-a1中公开的那些,以及wo2004/037818和wo2006/045613中公开的那些;jtk-003、jtk-019、nm-283、hcv-796、r-803、r1728、r1626以及wo2006/018725、wo2004/074270、wo2003/095441、us2005/0176701、wo2006/020082、wo2005/080388、wo2004/064925、wo2004/065367、wo2003/007945、wo02/04425、wo2005/014543、wo2003/000254、ep1065213、wo01/47883、wo2002/057287、wo2002/057245中公开的那些和类似药剂;复制抑制剂,例如阿昔洛韦、泛昔洛韦、更昔洛韦、西多福韦、拉米夫定和类似药剂;蛋白酶抑制剂,例如hiv蛋白酶抑制剂沙奎那韦、利托那韦、茚地那韦、奈非那韦、氨普那韦、福沙那韦、贝卡那韦、阿扎那韦、替拉那韦、帕利那韦、拉西那韦和hcv蛋白酶抑制剂biln2061、vx-950、sch503034;和类似药剂;核苷和核苷酸逆转录酶抑制剂,例如齐多夫定、去羟肌苷、拉米夫定、扎西他滨、阿巴卡韦、司他夫定、阿德福韦、阿德福韦酯、福齐夫定、todoxil、恩曲他滨、阿洛夫定、安多索维(amdoxovir)、艾夫他滨和类似药剂;非核苷逆转录酶抑制剂(包括具有抗氧化活性的药剂,例如怡妙康、奥替普拉等),例如奈韦拉平、地拉韦啶、依法韦仑、洛韦胺、怡妙康、奥替普拉、卡普韦林、tmc-278、tmc-125、依曲韦林和类似药剂;进入抑制剂,例如恩夫韦地(t-20)、t-1249、pro-542、pro-140、tnx-355、bms-806、5-helix和类似药剂;整合酶抑制剂,例如l-870,180和类似药剂;芽殖抑制剂,例如pa-344和pa-457,以及类似的药剂;趋化因子受体抑制剂,例如vicriviroc(sch-c)、sch-d、tak779、maraviroc(uk-427,857)、tak449,以及wo02/74769、wo2004/054974、wo2004/055012、wo2004/055010、wo2004/055016、wo2004/055011和wo2004/054581中公开的那些,以及类似药剂;神经氨酸酶抑制剂,例如cs-8958、扎那米韦、奥司他韦、帕拉米韦和类似药剂;离子通道阻断剂,例如金刚烷胺或金刚乙胺和类似药剂;和干扰rna和反义寡核苷酸和例如isis-14803和类似药剂;未确定作用机制的抗病毒剂,例如wo2005/105761、wo2003/085375、wo2006/122011中公开的那些、利巴韦林和类似药剂。式(i)化合物及其药学上可接受的盐还可以与一种或多种其它药剂组合使用,所述药剂可用于预防或治疗病毒感染,例如免疫治疗(例如干扰素或其它细胞因子/趋化因子、细胞因子/趋化因子受体调节剂、细胞因子激动剂或拮抗剂和类似药剂);和治疗疫苗、抗纤维化剂、抗炎剂例如皮质类固醇或nsaid(非甾体抗炎剂)和类似药剂。
在另一方面,提供了包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗感染性疾病的其它治疗剂的组合。
在另一方面,提供了包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗感染性疾病的其它治疗剂的组合,其用于治疗。
在另一方面,提供了包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗感染性疾病的其它治疗剂的组合,其用于治疗感染性疾病。
在另一方面,提供了包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗感染性疾病的其它治疗剂的组合在制备用于治疗感染性疾病的药物中的用途。
在另一方面,提供了治疗感染性疾病的方法,包括向需要该治疗的人施用治疗有效量的包含式(i)化合物或其药学上可接受的盐和至少一种可用于治疗感染性疾病的其它治疗剂的组合。
在另一方面,提供了药物组合物,其包含含有式(i)化合物或其药学上可接受的盐和至少一种可用于治疗感染性疾病的其它治疗剂的组合和一种或多种药学上可接受的赋形剂。
在另一方面提供了包含式(i)的化合物或其药学上可接受的盐,和一种或多种免疫刺激剂的组合物。
因此,还提供了包含式(i)化合物或其药学上可接受的盐的免疫原性组合物或疫苗佐剂。
还提供了包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的免疫原性组合物。
还提供了包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的疫苗组合物。
还提供了治疗或预防疾病的方法,包括向患有或易患疾病的人受试者给药包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的免疫原性组合物。
还提供了治疗或预防疾病的方法,包括向患有或易患疾病的人受试者给药包含抗原或抗原组合物和式(i)的化合物或其药学上可接受的盐的疫苗组合物。
还提供了式(i)化合物或其药学上可接受的盐在制备用于治疗或预防疾病的包含抗原或抗原组合物的免疫原性组合物中的用途。
还提供了式(i)化合物或其药学上可接受的盐在制备用于治疗或预防疾病的包含抗原或抗原组合物的疫苗组合物中的用途。
应理解在本申请中描述的化合物可以用不同的惯例来绘制。例如,以下两个化合物在化学结构和立体化学中被认为是相等的。
化合物制备和实施例
式(i)的化合物,其中y1,y2,x1,x2,r1,r2,r3,r4,r5,r6,r8和r9如本文之前定义,可以通过如下面方案和实施例中所述的有机合成领域已知的方法制备。在所有方法中,应充分理解的是,按照化学的一般原理,在必要时可以使用敏感或反应性基团的保护基。根据有机合成的标准方法处理保护基(p.g.m.wutsandt.w.green(2007)greene’sprotectivegroupsinorganicsynthesis,第四版,johnwiley&sons)。这些基团在化合物合成的方便阶段使用本领域技术人员容易明白的方法除去。选择方法以及反应条件和它们的执行顺序应与式(i)化合物的制备一致。
式(i)化合物及其盐可通过下文所述的方法制备,其构成本发明的其它方面。
因此,提供了制备其中r5为oc(o)r7且r6为f,且y1和y2都为o,x1和x2都为s-的式(i)的化合物的方法,如式(iia)所示,其中r1、r2、r3和r4如本文之前对式(i)的化合物的定义。该方法包括酰化式(iiia)的化合物:
其中r1、r2、r3、r4和r7如本文之前对式(iia)的化合物的定义,然后,如果需要的话,制备如此形成的化合物的盐。
实施例1:式(iiia)的化合物和肉豆蔻酸酐在合适的溶剂,例如二甲基甲酰胺(dmf)中,在碱(如吡啶)的存在下,在室温搅拌或在合适的温度,例如60℃,加热合适的时间段,例如2–48小时。式(iia)的产物通过去除挥发物分离且视需要纯化。
还提供了制备其中r5为oh且r6且f,且y1和y2都为o,x1和x2都为s,且r8和r9都为ch2oc(o)tbu的式(i)的化合物的方法,如式(iva)所示,其中r1、r2、r3和r4如本文之前对式(i)的化合物的定义。该方法包括向式(iiia)的化合物加成羰基氧基甲基:
实施例2:式(iiia)的化合物和特戊酸氯甲酯(pom-cl)在合适的溶剂,例如二甲基甲酰胺(dmf)中,在碱(如et3n)的存在下,在室温搅拌合适的时间段,例如48小时。式(iva)的产物通过去除挥发物分离且视需要纯化。
式(iiia)的化合物可通过脱保护式(va)的化合物制备:
其中r1、r2、r3和r4如本文之前对式(iiia)的化合物的定义且p1为合适的保护基,如叔丁基二甲基甲硅烷基氧基(tbdms),然后,如果需要的话,制备如此形成的化合物的盐。
实施例3:式(va)的化合物,在合适的溶剂,例如吡啶中在合适的温度例如50℃加热,然后用三乙胺三氢氟酸盐和三乙胺的混合物处理合适的时间段,例如2-3小时。式(iiia)的产物,通过添加溶剂例如丙酮进行沉淀而分离,或通过去除挥发物分离,且视需要纯化。
式(va)的化合物可通过脱保护式(via)的化合物制备:
其中,p1为对式(va)的化合物定义的保护基且r12、r13、r14和r15定义为
r12为oh且r13为nhcoipr,或r12为nhbz且r13为h;
r14为oh且r15为nhcoipr或r14为nhbz且r15为h;
实施例4:将式(via)的化合物溶于例如甲基胺的甲醇溶液或氨水的甲醇溶液的合适的混合物中,且在合适的温度,例如50–55℃,加热合适的时间段,例如2–72小时。式(va)的产物,通过去除溶剂而分离且视需要纯化。
式(via)的化合物可通过式(viia)的化合物的反应制备:
其中,p1、r12、r13、r14和r15如之前对式(via)的化合物的定义。
实施例5:将式(viia)的化合物溶于合适的溶剂,例如,吡啶中,且用合适的偶合试剂,例如,2-氯-5,5-二甲基-1,3,2-二氧杂磷杂环己烷2-氧化物处理,且在合适的温度,例如20℃搅拌合适的时间段,例如0.5–2小时。通过添加合适的溶剂,例如水淬灭该反应,然后添加硫化试剂,例如3h-苯并[c][1,2]二硫醇-3-酮,且在合适的温度,例如20℃,搅拌合适的时间段,例如5–10分钟。通过添加合适的溶剂例如nahco3水溶液淬灭该反应。通过合适的有机溶剂如etoac萃取式(via)的产物。式(via)的产物,通过去除溶剂而分离且视需要纯化。
式(viia)的化合物可通过将式(viiia)的化合物与式(ixa)的化合物反应而制备:
其中,p1、r12、r13、r14和r15如之前对式(viia)的化合物的定义且dmtr为4,4-二甲氧基三苯甲基保护基。
实施例6:式(ixa)的化合物在合适的溶剂例如乙腈中在分子筛的存在下,用溶于合适的溶剂,例如乙腈中的式(viiia)的化合物的溶液处理,且在合适的温度,例如20℃,搅拌合适的时间段,例如0.5–2小时。添加合适的硫化试剂,例如n,n-二甲基-n'-(3-硫代-3h-1,2,4-二噻唑-5-基)甲脒(ddtt)的溶液,且混合物在合适的温度,例如20℃,搅拌合适的时间段,例如0.5-1小时。蒸发溶剂后,将残余物溶于合适的溶剂,例如二氯甲烷和水的混合物,且用合适的试剂,例如二氯乙酸处理,且在合适的温度,例如20℃,搅拌合适的时间段,例如15分钟。包含式(viia)的产物的溶液,通过添加合适的溶剂,例如吡啶而得到,且通过蒸发浓缩。
式(viiia)的化合物可通过式(xa)的化合物的反应制备。
其中,r12和r13如之前对式(viiia)的化合物的定义且dmtr为4,4-二甲氧基三苯甲基保护基。
实施例7:将式(xa)的化合物溶于合适的混合物,例如,包含乙腈的水中,用吡啶鎓三氟乙酸盐处理,且在合适的温度,例如20℃,搅拌合适的时间段,例如1-5分钟。然后添加叔丁基胺且混合物在合适的温度,例如20℃,搅拌合适的时间段,例如10分钟。产物通过蒸发溶剂分离,然后溶于合适的溶剂,例如包含二氯甲烷的水,且用二氯乙酸处理,且在合适的温度,例如20℃,搅拌合适的时间段,例如15分钟。式(viiia)的产物在乙腈中的浓缩溶液通过添加吡啶然后将该混合物与无水乙腈共沸而得到。
式(ixa)和(xa)的亚磷酰胺为文献中已知的,或可购自供应商如sigma、chemgenes和carbosynth或可通过已知方法制备。
实施例8–化合物1b
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
中间体1:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯
在室温,向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(2190mg,2.5mmol)在乙腈(15ml)和水(0.090ml,5.00mmol)中的溶液中添加吡啶2,2,2-三氟乙酸盐(579mg,3.00mmol)。将混合物搅拌1分钟,随后lcms指示完全转化为第一中间体,m/z(m+h)=793.3。然后,添加2-甲基丙-2-胺(13.14ml,125mmol)且将混合物搅拌10分钟,随后lcms指示首先形成的中间体被耗尽。
将混合物真空浓缩以得到白色泡沫。然后将该泡沫溶于乙腈(20ml)且浓缩。该过程再重复一次。将粗物质溶于二氯甲烷(10ml)且通过色谱法以两批次纯化(硅胶,二氯甲烷中的0-30%甲醇的梯度洗脱)。将所需级分合并且蒸发以得到两个分开的白色固体,然后将其溶于二氯甲烷,合并且蒸发以得到标题化合物(780mg,1.055mmol,42.2%产率),其为白色固体。lcmsm/z740.4(m+h)。
中间体2:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-氟-2-(羟基甲基)四氢呋喃-3-基氢膦酸酯
中间体2大体根据以下步骤制备。稍加修改,例如可使用其它实施例中对中间体2所述的步骤。
在室温向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯(775mg,1.048mmol)在二氯甲烷(20ml)和水(0.189ml,10.48mmol)中的溶液中添加2,2-二氯乙酸(0.655ml,8.38mmol)。将混合物在室温搅拌30分钟。
该反应然后通过添加吡啶(1.356ml,16.76mmol)淬灭且真空浓缩以得到无色油状物。该物质在氮气下在4℃储存。在4℃储存后,将该物质固化以得到不纯的标题化合物,其为蜡状、白色固体,其使用而不用进一步纯化。lcmsm/z438.3(m+h)。
中间体3:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯
中间体3大体根据以下步骤制备。稍加修改,例如可使用其它实施例中对中间体3所述的步骤。
以上获得的不纯的固体(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-氟-2-(羟基甲基)四氢呋喃-3-基氢膦酸酯(458mg,1.047mmol)与无水乙腈(3x20ml)共沸。最后浓缩后,约10ml乙腈保持在烧瓶中。在室温,将(2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-5-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-((叔丁基二甲基甲硅烷基)氧基)四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(1345mg,1.361mmol)通过与无水乙腈(3x20ml)共沸而干燥。最后浓缩后,约5ml乙腈保留在烧瓶中,且添加
在室温在氮气氛向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-氟-2-(羟基甲基)四氢呋喃-3-基氢膦酸酯(458mg,1.047mmol)在乙腈(10ml)中的无水混悬液中通过注射器添加(2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-5-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-((叔丁基二甲基甲硅烷基)氧基)四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(1345mg,1.361mmol)在乙腈(5ml)中的预干燥的溶液。溶液从橙色变为淡黄色。将混合物在氮气氛在室温搅拌1小时,随后lcms指示最少剩余的起始材料。然后,将(e)-n,n-二甲基-n'-(3-硫代-3h-1,2,4-二噻唑-5-基)甲脒(237mg,1.152mmol)添加至反应混合物且将混合物在室温搅拌30分钟。真空蒸发溶剂,且将残余物溶于二氯甲烷(40ml)和水(0.189ml,10.47mmol),然后添加2,2-二氯乙酸(1.037ml,12.57mmol)。将混合物在室温搅拌10分钟,随后lcms指示形成所需产物。该反应用吡啶(10ml,124mmol)淬灭,然后将混合物真空浓缩以得到不纯的标题化合物,其为橙色油状物。lcms:m/z1054(m+h)。产物在4℃氮气下储存且在以下步骤使用而不用进一步纯化。
中间体4:n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-17-(6-苯甲酰氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-氧代-12-硫基-3-硫代(sulfanylidene)-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺
将粗(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯(1104mg,1.047mmol)在吡啶(约20ml)中的溶液蒸发,然后重溶于吡啶(20ml)且浓缩至约10ml。在氮气下向该溶液一次性添加2-氯-5,5-二甲基-1,3,2-二氧杂磷杂环己烷2-氧化物(677mg,3.67mmol)。将反应混合物在室温在氮气下搅拌30分钟,随后lcms指示起始材料消耗,然后反应通过添加水(0.660ml,36.7mmol)淬灭。然后添加3h-苯并[c][1,2]二硫醇-3-酮(264mg,1.571mmol),且将混合物在室温搅拌5分钟,然后倒至包含碳酸氢钠(4400mg,52.4mmol)的水溶液(160ml)中。将该混合物搅拌5分钟,然后添加etoac(150ml),且将混合物再搅拌10分钟。将该溶液转移至分液漏斗,且从有机物分离水层。水层进一步用etoac(150ml)萃取,然后将合并的有机层干燥(na2so4),过滤且真空蒸发至橙色油状物。该物质在4℃氮气下储存过夜。
温热至室温后,粗物质用甲苯(20ml)稀释且蒸发以去除过量吡啶。粗产物通过色谱法纯化(硅胶,iscoteledynegold,80g),进行以下梯度洗脱:用0-10%甲醇的二氯甲烷溶液洗脱15分钟,然后用10%甲醇的二氯甲烷溶液等浓度洗脱5分钟。然后将梯度升高至10-20%甲醇的二氯甲烷溶液保持15分钟,然后是用20%甲醇的二氯甲烷溶液等浓度洗脱10分钟。将所需级分合并且蒸发真空以得到标题化合物(570mg,0.342mmol,32.6%产率),其为黄色固体。
4种异构体通过lcms[m/z1068.5(m+h)]观察到,近似比例为8:4:2:1,保留时间分别为1.13、1.23、1.18和1.08分钟。产物在4℃氮气下储存且在以下步骤使用而不用进一步纯化。
中间体5:(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
将以上获得的n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-17-(6-苯甲酰氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-氧代-12-硫基-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺(570mg,0.534mmol)在甲基胺(33wt%在乙醇中)(25ml,201mmol)中的溶液在室温搅拌50分钟,随后lcms指示起始材料耗尽。反应混合物真空浓缩至橙色残余物。该物质在4℃氮气下储存过夜。
使该材料温热至室温且溶于甲醇/dmso(总共4ml)。一部分使用反相hplc纯化(10-90%乙腈:水(具有0.1%nh4oh修饰剂),c1850x30mmgemini柱,47ml/min,8分钟梯度,uv收集=214nm)。
另一部分使用反相hplc纯化(10-50%乙腈:水(具有0.1%nh4oh修饰剂),c1850x30mmgemini柱,47ml/min,8分钟梯度,uv收集=214nm)。
将两次纯化的级分合并且浓缩以得到3种异构体产物:
●标题化合物的异构体1,其为二铵盐,其中在两个磷中心处的精确立体化学未确定(6mg,lcms测定的纯度=70%;4.99μmol,0.936%产率),其为灰白色胶状物,lcmsm/z807.2(m+h),tret=0.68分钟。
●标题化合物的异构体2,其为二铵盐,其中在两个磷中心处的精确立体化学未确定(64mg,lcms测定的纯度=22%,0.017mmol,3.14%产率),其为无色胶状物,lcmsm/z807.2(m+h),tret=0.80分钟。
●标题化合物的异构体3,其为二铵盐,其中在两个磷中心处的精确立体化学未确定(26mg,lcms测定的纯度=50%,0.015mmol,2.90%产率),其为白色固体,lcmsm/z807.2(m+h),tret=0.92分钟。
最后洗脱的异构体,标题化合物的异构体3,为主要产物,如色谱峰下面积所测定(uv@214nm),且用于以下脱保护步骤。
实施例8:(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
将之前步骤得到的(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮的异构体3(25mg,0.031mmol)悬浮于吡啶(0.5ml)和三乙胺(0.5ml)。将混合物搅拌且加热至50℃,然后添加三乙胺三氢氟酸盐(0.5ml,3.07mmol)且将混合物在50℃再搅拌2小时,此时lcms指示起始材料完全耗尽且转化为所需产物。
将混合物冷却至室温,然后添加丙酮(约10ml)且蒸发溶剂,且材料在4℃氮气下储存过夜。
粗残余物使用反相hplc纯化(水中0-20%乙腈(0.1%nh4oh),50x30mmgemini柱,47ml/min,8分钟梯度,uv检测@214nm)。将所需级分合并且蒸发以得到标题化合物,其为二铵盐(2.3mg),为单一非对映异构体,其中在两个磷中心处的精确立体化学未确定。该产物为白色固体。lcmsm/z693.1(m+h)。
1hnmr(600mhz,dmso-d6且具有一滴d2o):δppm8.69(s,1h),8.33(s,1h),8.14-8.17(m,1h),8.12(brs,1h),6.24(brdd,j=14.5,3.2hz,1h),6.08(brd,j=8.3hz,1h),5.71-5.86(m,1h),5.22(brt,j=8.7hz,2h),4.49-4.54(m,1h),4.32(brs,1h),4.16(brs,1h),4.08-4.15(m,2h),4.03-4.06(m,1h),4.00-4.03(m,1h),3.73(brs,1h)。
13cnmr(150mhz,dmso-d6且具有一滴d2o):δppm156.1,155.9,153.2,152.9,150.4,149.1,119.1,118.4,90.6,85.3,83.6,83.0,80.6,77.7,71.6,71.1,67.2,63.3.
31pnmr(162mhz,dmso-d6且具有一滴d2o)δppm53.84和49.04.
注意到实施例8生成化合物1b–异构体2。由于反应是小规模,没有分离化合物1a-异构体1。化合物1的异构体1和异构体2都在以下实施例8a和8b中制备。
实施例8a和8b–化合物1a和1b
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
中间体1:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯
在室温向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(10g,11.42mmol)在乙腈(65ml)和水(0.411ml,22.83mmol)中的溶液中添加吡啶2,2,2-三氟乙酸盐(2.65g,13.70mmol)。将混合物搅拌1分钟,随后lcms指示完全转化为第一中间体m/z793.7(m+h)。然后,添加2-甲基丙-2-胺(60.0ml,571mmol)且将混合物搅拌15分钟,随后lcms指示首先形成的中间体被耗尽。
将混合物真空浓缩至白色泡沫。然后将该泡沫溶于乙腈且浓缩(50ml)。该过程再重复一次。将粗物质溶于二氯甲烷且通过色谱法纯化(硅胶,iscoredisep,120g二氧化硅),用0-30%甲醇的二氯甲烷溶液梯度洗脱。将所需级分合并真空蒸发以得到标题化合物(4.8g,6.49mmol,56.8%产率),其为白色固体。lcmsm/z740.3(m+h)。
中间体2:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-氟-2-(羟基甲基)四氢呋喃-3-基氢膦酸酯
中间体2大体根据以下步骤制备。稍加修改,例如可使用其它实施例中对中间体2所述的步骤。
在室温向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯(4.8g,6.49mmol)在二氯甲烷(100ml)和水(1.169ml,64.9mmol)中的溶液中添加2,2-二氯乙酸(4.06ml,51.9mmol)。将混合物在室温搅拌30分钟。然后将该反应用吡啶(8.40ml,104mmol)淬灭且真空浓缩以得到不纯的标题化合物,其为无色油状物。该材料立即以原样用于下一步。未测定最终质量。lcmsm/z438.3(m+h)。
中间体3:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯
中间体3大体根据以下步骤制备。稍加修改,例如可使用其它实施例中对中间体2所述的步骤。
以上获得的不纯的固体(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-氟-2-(羟基甲基)四氢呋喃-3-基氢膦酸酯(2.84g,6.49mmol)与无水乙腈(3x60ml)共沸。最后浓缩后,约20ml乙腈保留在烧瓶中。在室温,将(2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-5-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-((叔丁基二甲基甲硅烷基)氧基)四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(8.00g,8.10mmol)通过与无水乙腈(3x60ml)共沸而干燥。最后浓缩后,约30ml乙腈保留在烧瓶中,且添加3a分子筛(约40个珠)。该溶液在分子筛上在室温静置1小时。
在室温氮气氛下,向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-氟-2-(羟基甲基)四氢呋喃-3-基氢膦酸酯(2.84g,6.49mmol)在乙腈(40ml)中的无水混悬液中通过注射器添加(2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-5-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-((叔丁基二甲基甲硅烷基)氧基)四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(8.00g,8.10mmol)在乙腈(30ml)中的预干燥的溶液。将混合物在氮气氛在室温搅拌1小时,随后lcms指示最少剩余的起始材料。然后,将(e)-n,n-二甲基-n'-(3-硫代-3h-1,2,4-二噻唑-5-基)甲脒(1.467g,7.14mmol)添加至反应混合物,且将混合物在室温搅拌45分钟。真空蒸发溶剂,且将残余物溶于二氯甲烷(100ml)和水(1.170ml,64.9mmol),然后添加2,2-二氯乙酸(6.43ml,78mmol)。将混合物在室温搅拌10分钟,随后lcms指示形成所需产物。该反应用吡啶(12.61ml,156mmol)淬灭,然后将混合物真空浓缩以得到不纯的标题化合物,其为橙色油状物。lcms指示形成两种异构体,其在0.98-1.04min之间具有重叠的峰。该材料立即以原样用于下一步。未测定样品最终质量。lcmsm/z1054.6(m+h)。
中间体4:n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-17-(6-苯甲酰氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-氧代-12-硫基-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺
将粗(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯(6.84g,6.49mmol)的溶液与吡啶(3x50ml)共沸,最后浓缩后留下吡啶(40ml)。在氮气下向该溶液一次性添加2-氯-5,5-二甲基-1,3,2-二氧杂磷杂环己烷2-氧化物(4.19g,22.71mmol)。该反应在室温在氮气下搅拌30分钟,随后lcms指示起始材料消耗,然后该反应通过添加水(4.09ml,227mmol)淬灭。然后,3h-苯并[c][1,2]二硫醇-3-酮(1.638g,9.73mmol),且将混合物在室温搅拌5分钟,然后倒至包含碳酸氢钠(27.3g,324mmol)的水溶液(400ml)。将混合物搅拌10分钟,然后添加etoac(200ml),且将混合物再搅拌10分钟。将该溶液转移至分液漏斗,且从有机物分离水层。水层进一步用etoac(2x200ml)萃取,然后将合并的有机层干燥(na2so4),过滤且真空蒸发至橙色油状物。该物质在4℃氮气下储存直到随后步骤使用。
温热至室温后,粗物质用甲苯(50ml)稀释且蒸发以去除过量吡啶。该过程再重复两次。粗产物通过色谱法纯化(硅胶,iscoteledynegold,220g二氧化硅)。用0-10%甲醇的二氯甲烷溶液梯度洗脱15分钟,然后用10%甲醇的二氯甲烷中等浓度洗脱5分钟。然后将梯度升高至10-20%甲醇的二氯甲烷溶液历经15分钟,然后以20%甲醇的二氯甲烷溶液等浓度洗脱5分钟。将所需级分合并且真空蒸发以得到橙色油状物。该物质在4℃氮气下储存过夜。
温热至室温后,该材料再次通过色谱法纯化(硅胶,iscoteledynegold,120g二氧化硅)。梯度洗脱用0-10%甲醇的二氯甲烷溶液运行15分钟,然后用10%甲醇的二氯甲烷溶液等浓度洗脱5分钟。然后将所述梯度升高至10-20%甲醇的二氯甲烷溶液历经10分钟,然后以20%甲醇的二氯甲烷中溶液等浓度洗脱5分钟。将所需级分合并且真空蒸发至不纯的标题化合物(2.81g),其为黄色固体。lcms指示存在两种主要的非对映异构体,其保留时间分别为1.09、1.18分钟。观察到两种次要异构体。该产物在4℃氮气下储存直到在以下步骤使用而不用进一步纯化。lcmsm/z1068(m+h)。
中间体5:(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
在室温向以上获得的n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-17-(6-苯甲酰氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-氧代-12-硫基-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺(1.0g,0.936mmol)在乙醇(5ml)中的溶液中添加甲基胺(33wt%的乙醇溶液)(20ml,161mmol)。将混合物在室温搅拌30分钟,随后lcms指示起始材料耗尽。将反应混合物真空浓缩至褐色残余物。将该物质溶于dmso且使用色谱法纯化(反相硅胶,redisepgoldc18,30g)。梯度洗脱以100%水(具有0.1%nh4oh修饰剂)运行4cv,然后是水中的0-15%乙腈(具有0.1%nh4oh修饰剂)运行3cv,然后是15-25%乙腈的水溶液(具有0.1%nh4oh修饰剂)运行6cv,然后是25-90%乙腈的水溶液(具有0.1%nh4oh修饰剂)运行3cv,然后是90%乙腈的水溶液(具有0.1%nh4oh修饰剂)等浓度洗脱运行4cv。
将纯化的级分合并且分离两种主要异构体产物:
●标题化合物的异构体2,其为二铵盐,其中在两个磷中心处的精确立体化学未确定(28mg,lcms测定的纯度=54%;0.018mmol,1.921%产率),其为无色残余物,lcmsm/z807.1(m+h),tret=0.80分钟。
●标题化合物的异构体3,其为二铵盐,其中在两个磷中心处的精确立体化学未确定(46mg,lcms测定的纯度=70%,0.038mmol,4.09%产率),其为黄色残余物,lcmsm/z807.2(m+h),tret=0.91分钟。
实施例8a和8b:(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
将以上步骤得到的中间体5的异构体2,(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮(25mg,0.031mmol),悬浮于吡啶(0.5ml)和三乙胺(0.5ml)。将混合物搅拌且加热至50℃,然后添加三乙胺三氢氟酸盐(0.5ml,3.07mmol)且将混合物在50℃搅拌2小时,然后,lcms指示起始材料完全耗尽且转化为所需产物。反应混合物真空蒸发,且烧瓶在4℃氮气下储存过夜。
温热至室温后,将残余物溶于水(约5ml)中,形成沉淀。将固体从混合物分离,且滤液使用氢氧化铵调节至ph=10。该溶液使用反相hplc纯化(0-5%乙腈:水(具有0.1%nh4oh修饰剂),c1850x30mmgemini柱,40ml/min,7分钟梯度,uv检测=214nm)。将收集的固体溶于水(约2ml)和甲醇(约0.5ml),且添加氢氧化铵至ph=10。溶液使用反相hplc纯化(0-5%乙腈:水(具有0.1%nh4oh修饰剂),c1850x30mmgemini柱,40ml/min,7分钟梯度,uv检测=214nm)。
将源自两次纯化的所需级分合并且抽真空以得到无色残余物。将残余物溶于水(2ml)且冻干过夜以得到标题化合物(实施例8a,7mg),其为二铵盐,为单一非对映异构体,其中在两个磷中心处的精确立体化学未确定。该产物为白色固体。lcmsm/z693.3(m+h)。tret=0.29分钟。
1hnmr(400mhz,dmso-d6且具有一滴d2o)δppm8.59-8.62(m,1h),8.39-8.41(m,1h),8.17(s,1h),8.13(s,1h),6.19-6.27(m,1h),6.05-6.10(m,1h),5.70-5.87(m,1h),5.24-5.36(m,1h),5.14-5.23(m,1h),4.31-4.36(m,1h),4.23-4.29(m,1h),4.15-4.23(m,1h),4.11-4.15(m,1h),3.98-4.08(m,1h),3.82-3.91(m,1h),3.66-3.72(m,1h)。
31pnmr(162mhz,dmso-d6且具有一滴d2o)δppm53.66,55.91.
19fnmr(376mhz,dmso-d6且具有一滴d2o)δppm-206.48.
将从不同批次获得的(lcms测定的纯度=50%)的中间体5的异构体3,(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮(175mg,0.217mmol),悬浮于吡啶(1ml)和三乙胺(1ml)。将混合物搅拌且加热至50℃,然后添加三乙胺三氢氟酸盐(1ml,6.14mmol)且将混合物在50℃搅拌3小时,然后,lcms指示起始材料完全耗尽且转化为所需产物。将混合物冷却至室温,然后添加丙酮(约10ml)且形成细微沉淀。将沉淀通过真空过滤收集以得到灰色残余物,将其丢弃。将滤液真空蒸发,且烧瓶在4℃氮气下储存过夜。
温热至室温后,将残余物溶于甲醇(约6ml)且使用反相hplc纯化(0-15%乙腈:水(具有0.1%nh4oh修饰剂),c1850x30mmgemini柱,47ml/min,8分钟梯度,uv检测=214nm)。将所需级分合并且真空抽滤以得到白色固体,其仍然被一些杂质污染。
该固体进一步使用制备型hilic柱纯化(lunahilic,5u21x250mm,20ml/min,uv检测=254nm),使用20%甲酸铵水溶液和80%乙腈的等浓度洗脱梯度。将所需级分合并且真空蒸发90%,然后溶于水和乙腈且添加5滴氢氧化铵至ph=10。将材料冷冻且冻干过夜。该过程再重复两次以得到标题化合物(实施例8b,12mg),其为二铵盐,为单一非对映异构体,其中在两个磷中心处的精确立体化学未确定。该产物为白色固体。lcmsm/z693.3(m+h),tret=0.37分钟。
1hnmr(600mhz,dmso-d6且具有一滴d2o)δppm8.50-9.29(m,1h),8.43(brs,1h),8.16(s,1h),7.73-8.11(m,1h),6.26(brd,j=14.4hz,1h),6.15(brd,j=7.2hz,1h),5.72(s,1h),5.29-5.41(m,1h),5.17-5.29(m,1h),4.27-4.46(m,2h),4.21(brs,1h),4.01-4.15(m,1h),3.86-3.91(m,1h),3.81-3.86(m,1h),3.77(brd,j=10.6hz,1h)。
31pnmr(162mhz,dmso-d6且具有一滴d2o)δppm54.27,49.69.
19fnmr(376mhz,dmso-d6且具有一滴d2o)δppm-204.90(br.)
实施例9a和9b–化合物2a和2b
(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
中间体2:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-氟-2-(羟基甲基)四氢呋喃-3-基氢膦酸酯
中间体2大体根据以下步骤制备。稍加修改,例如可使用其它实施例中对中间体2所述的步骤。
向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-氟四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(4.01g,4.6mmol)在乙腈(35ml)和水(0.165ml,9.1mmol)中的室温溶液中添加吡啶2,2,2-三氟乙酸盐(1.06g,5.5mmol)。将反应搅拌10分钟,然后添加纯的叔丁基胺(24.2ml,228mmol)。将反应在室温搅拌30分钟然后在减压下浓缩。所得白色泡沫与乙腈(2x)共沸,然后将干燥残余物溶于二氯甲烷(100ml)和水(0.82ml,45.7mmol)的混合物,且用纯的2,2-二氯乙酸(3.01ml,36.5mmol)处理。30分钟后,该反应用吡啶(5.91ml,73.1mmol)淬灭,然后在减压下浓缩至油性混悬液。该材料与乙腈共沸(3x)然后溶于无水乙腈(60ml)且浓缩至体积为约20ml以得到不纯的标题化合物,其为浅橙色混悬液。lcmsm/z437.9(m+h)。该混合物用于下一步而不用进一步纯化。
中间体3:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯
中间体3大体根据以下步骤制备。稍加修改,例如可使用其它实施例中对中间体3所述的步骤。
(2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-5-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-((叔丁基二甲基甲硅烷基)氧基)四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(5.9g,5.9mmol)与乙腈共沸(2x),然后溶于40ml无水乙腈,浓缩大约一半,然后在氮气下经
中间体6:n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-17-(6-苯甲酰氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-羟基-12-氧代-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺
在氮气下向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,3r,4r,5r)-2-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯(中间体3,4.8g,4.6mmol)在吡啶(20ml)中的粗制溶液中添加2-氯-5,5-二甲基-1,3,2-二氧杂磷杂环己烷2-氧化物(3.0g,16.0mmol)。该反应在室温氮气下搅拌30分钟,然后通过添加水(2.9ml,160mmol)、然后是碘(1.5g,5.9mmol)淬灭。10分钟后,将混合物倒入亚硫酸氢钠(0.95g,9.1mmol)在水(300ml)中的溶液中。5分钟后,该反应混合物用固体碳酸氢钠(19.2g,229mmol)分批处理。所得褐色混悬液用etoac(3x200ml)萃取,然后萃取物用饱和碳酸氢钠水溶液洗涤,用na2so4干燥且浓缩至油状物。以下两个的纯化方法之一然后用于纯化不同批次的产物。
方法a:将油状物与甲苯共沸以去除过量吡啶,然后通过色谱法在二氧化硅上纯化(biotage-100g),用dcm中的0-10%meoh(10分钟)、dcm中的10%meoh(10分钟)、dcm中的10-20%meoh(10分钟)以及最后dcm中的20-40%meoh(10分钟)的连续梯度洗脱。将通过lcms鉴定的感兴趣的级分合并且浓缩以得到不纯的标题化合物(1.03g,0.979mmol),其为浅橙色固体。两种异构体通过lcms观察[m/z1052.3(m+h)],近似比例为1:1,且保留时间分别为1.00、1.09分钟。产物在4℃氮气下储存且用于下一步而不用进一步纯化。
方法b:将油状物与甲苯共沸以去除过量吡啶然后通过色谱法在二氧化硅上纯化(teledyneiscogold-120g),用100%dcm(5分钟)、dcm中的0-10%meoh(5分钟)、dcm中的10%meoh(10分钟)、和dcm中的10-40%meoh(20分钟)的连续梯度洗脱。将感兴趣的级分合并且浓缩以得到非对映异构体的近似1:1混合物,其为暗黄色固体。非对映异构体混合物通过反相hplc分离(geminic-18:30x50mm柱;45-60%ch3cnw/0.1%tfa/水w/0.1%tfa),运行12分钟,在214nm收集。将感兴趣的级分合并,用饱和碳酸氢钠水溶液处理,然后浓缩以去除乙腈。然后将水性浓缩物用etoac萃取。将干燥的萃取物(经na2so4)浓缩以得到单独的非对映异构体。
●标题化合物的非对映异构体1(42mg),其为白色固体,其中在手性磷中心的精确立体化学未确定。lcmsm/z1052.7(m+h),tret=1.00分钟。
●标题化合物的非对映异构体2(43mg),其为白色固体,其中在手性磷中心的精确立体化学未确定。lcmsm/z1052.7(m+h)。tret=1.09分钟。
实施例9a和9b:(1r,6r,8r,9r,10r,15r,17r,18r)-8,17-二(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
将中间体6(通过方法a纯化),n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-17-(6-苯甲酰氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-羟基-12-氧代-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺(1.03g,0.979mmol)在33%wt甲基胺的etoh溶液(40ml,321mmol)中的溶液在室温搅拌4小时,此时lcms指示起始材料完全转化且存在所需的o-tbs保护的中间体。对中间体只观察到一个稍宽的峰,表明至少一种非对映异构体存在。将反应浓缩至暗橙色残余物,其通过反相hplc纯化(geminic-18:30x50mm柱;10-60%乙腈w/0.1%tfa/水w/0.1%tfa),12分钟梯度,且在254nm检测。将感兴趣的级分合并且在减压下浓缩。此时,lcms指示甲硅烷基保护基损失。水相进一步浓缩至约3-5ml,然后添加甲醇(25ml)。将所得混悬液过滤且固体用meoh、然后乙醚冲洗,然后抽滤干燥以得到75mg不纯的所需产物-ditfa盐,其为白色固体。lcmsm/z677.2(m+h)。
将产物进一步通过制备型色谱法纯化(lunahilic3u:4.6x150mm;20%30mmhco2nh4水溶液,80%ch3cn等浓度洗脱)。将感兴趣的级分合并且浓缩至残余物,其通过溶于水(5ml)和3滴氢氧化铵中然后冻干得到。为去除残余甲酸铵,冻干过程再重复4次以得到标题化合物(实施例9a,50mg),其为二铵盐,为单一非对映异构体,其中在手性磷中心的精确立体化学未确定。标题产物为白色固体。lcmsm/z677.6(m+h)。tret=0.11min
1hnmr(600mhz,dmso-d6且具有一滴d2o):δppm8.48(s,1h),8.39(s,1h),8.17(s,1h),8.12(s,1h),6.23(dd,j=15.1,3.0hz,1h),6.09(d,j=8.3hz,1h),5.69(brdt,j=52.1,3.4hz,1h),5.16(ddd,j=8.1,6.6,4.2hz,1h),5.02-5.10(m,1h),4.35(d,j=4.2hz,1h),4.24(brs,1h),4.11-4.18(m,1h),4.09(brs,1h),3.97(brd,j=10.6hz,1h),3.89-3.95(m,1h),3.72(brd,j=12.5hz,1h)。
13cnmr(150mhzdmso-d6,具有一滴d2o):δppm156.0,155.8,153.0,152.8,150.3,148.9,119.1,118.4,92.4,85.4,84.0,83.3,81.0,77.9,72.3,71.4,65.9,62.6.
31pnmr(162mhz,dmso-d6,具有一滴d2o)δppm55.67和-2.51.
19fnmr(376mhz,dmso-d6,具有一滴d2o)δppm-205.16.
注意到实施例9a也可使用以下实施例9b所述的方法制备。
将中间体6的非对映异构体2(通过方法b纯化),n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-17-(6-苯甲酰氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-羟基-12-氧代-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺(43mg,0.041mmol)在33%wt甲基胺的etoh溶液(8.0ml,64.3mmol)中的溶液在室温搅拌30分钟,然后浓缩。所得暗橙色残余物溶于无水吡啶(0.50ml)和三乙胺(0.50ml),加热至50℃,然后用三乙胺三氢氟酸盐(0.50ml,3.07mmol)处理。1小时后,反应完成。将混合物冷却且浓缩至深色油状物,将其溶于水(7.5ml)和氢氧化铵(10滴)。将所得混悬液(ph约3)过滤且将固体溶于水(2ml)和氢氧化铵(1ml)的混合物,然后通过反相hplc纯化(geminic-18:30x50mm柱;0-10%乙腈/水w/0.1%nh4oh;214nm)。将感兴趣的级分合并且在减压下浓缩至湿残余物,将其溶于水(5ml)和5滴氢氧化铵,然后冻干以得到标题化合物(实施例9b,7.0mg),其为二铵盐,为单一非对映异构体,其中在手性磷中心处的精确立体化学未确定。该产物为白色固体。lcmsm/z677.2(m+h),tret=0.32分钟。
1hnmr(600mhz,dmso-d6且具有一滴d2o):δppm8.65-9.35(m,1h),8.44(brs,1h),7.77-8.29(m,2h),6.25(brd,j=14.4hz,1h),6.11-6.19(m,1h),5.53-5.73(m,1h),5.18-5.44(m,1h),4.96-5.08(m,1h),4.40-4.54(m,1h),4.33(brs,2h),4.23-4.30(m,1h),4.16(brs,1h),3.98-4.06(m,1h),3.81(brs,1h)。
31pnmr(162mhz,dmso-d6且具有一滴d2o)δppm49.48和-2.94.
19fnmr(376mhz,dmso-d6且具有一滴d2o)δppm-206.44(br)。
实施例10a和10b–化合物28a和28b
(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮
中间体7:(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,3r,4r,5r)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)-2-(2-异丁酰氨基-6-氧代-1h-嘌呤-9(6h)-基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯
将(2r,3r.4r,5r)-5-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-((叔丁基二甲基甲硅烷基)氧基)-2-(2-异丁酰氨基-6-氧代-1h-嘌呤-9(6h)-基)四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺(4.0g,4.12mmol)与乙腈(20ml)共沸三次。最后浓缩后,将约15ml乙腈保持在反应烧瓶中且将
向单独的圆底烧瓶中的(2r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-4-氟-2-(羟基甲基)四氢呋喃-3-基氢膦酸酯(1.5g,3.43mmol)在乙腈(10ml)中的之前制备的粗混合物(中间体2)中通过注射器添加(2r,3r.4r,5r)-5-((二(4-甲氧基苯基)(苯基)甲氧基)甲基)-4-((叔丁基二甲基甲硅烷基)氧基)-2-(2-异丁酰氨基-6-氧代-1h-嘌呤-9(6h)-基)四氢呋喃-3-基(2-氰基乙基)二异丙基亚磷酰胺在乙腈(约15ml)中的上述预干燥溶液。在室温搅拌30分钟后,添加(e)-n,n-二甲基-n'-(3-硫代-3h-1,2,4-二噻唑-5-基)甲脒(ddtt)(780mg,3.80mmol)。将混合物在室温搅拌30分钟,然后真空蒸发乙腈。然后将二氯甲烷(dcm)(50ml)和水(650μl)添加至残余物,然后添加2,2-二氯乙酸(3.5ml,42.4mmol)。将其在室温搅拌30分钟,然后用吡啶(20ml)淬灭。将混合物真空浓缩以得到不纯的标题化合物,其为橙色油状物。lcmsm/z1036.2(m+h)。粗产物用于下一步而不用进一步纯化。
中间体8:n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-羟基-17-[2-(2-甲基丙酰氨基)-6-氧代-6,9-二氢-1h-嘌呤-9-基]-12-氧代-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺
向(2r,3r,4r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,3r,4r,5r)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)-2-(2-异丁酰氨基-6-氧代-1h-嘌呤-9(6h)-基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯(中间体7,3.55g,3.43mmol)在吡啶(60ml)中的粗制溶液中添加2-氯-5,5-二甲基-1,3,2-二氧杂磷杂环己烷2-氧化物(dmocp)(2.2g,11.92mmol),且将混合物在室温氮气下搅拌30分钟。该反应用水(2.2ml,10当量于dmocp)淬灭,然后添加碘(1.2g,4.73mmol)。将混合物搅拌10分钟,然后倒入水(400ml)和亚硫酸氢钠(nahso3)(1.0g,9.61mmol)的溶液中。搅拌5分钟后,以固体分批缓慢添加碳酸氢钠(nahco3)(14.4g,171mmol)(注意:气体逸出)。产物用1:1乙醚:etoac(300mlx2)萃取且合并的萃取物用硫酸钠干燥,过滤,且真空浓缩。通过用甲苯(100mlx2)浓缩而去除过量吡啶。粗物质通过色谱法在二氧化硅(100克柱)上纯化,其使用0-20%meoh/dcm、然后保持在20%meoh/dcm的梯度,直到所有所需产物从柱上洗脱。将所需级分合并且浓缩以得到两种异构体产物:
●标题化合物的异构体1,极性较大,其为不纯的混合物(1.39g,lcms测定的纯度约33%,伴随约28%异构体2)。lcmsm/z1034.1(m+h),tret=0.98分钟。
●标题化合物的异构体2,极性较小,其为不纯的混合物(230mg,lcms测定的纯度约33%)。lcmsm/z1034.2(m+h),tret=1.09分钟。
中间体9a和9b:(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-12-羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮
在室温氮气下,将中间体8的异构体1,n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-羟基-17-[2-(2-甲基丙酰氨基)-6-氧代-6,9-二氢-1h-嘌呤-9-基]-12-氧代-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺(1.39g,1.34mmol)在甲胺(33%wt的etoh溶液)(10.0ml,80mmol)中搅拌3小时。将反应混合物浓缩且残余物通过反相hplc纯化,使用10-50%acn/h2o(0.1%tfa))的梯度,以得到标题化合物的异构体1(中间体9a,不纯的,280mg),其为褐色固体。lcmsm/z807.1(m+h),tret=0.80分钟。
按照与制备中间体9a相同的步骤,在室温氮气下,将中间体8的异构体2,n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-12-羟基-17-[2-(2-甲基丙酰氨基)-6-氧代-6,9-二氢-1h-嘌呤-9-基]-12-氧代-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺(230mg,0.22mmol),在甲胺(33%wt的etoh溶液)(2.0ml,16mmol)中搅拌3小时。将反应混合物浓缩且残余物通过反相hplc纯化,使用10-50%acn/h2o(0.1%tfa))的梯度,以得到标题化合物的异构体2(中间体9b,不纯的,60mg),其为褐色固体。lcmsm/z807.1(m+h),tret=0.85分钟。
实施例10a和10b:(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-12,18-二羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮
在50℃,向(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-12-羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮的异构体1(中间体9a,280mg,0.35mmol)在吡啶(2ml)和三乙胺(2ml)中的混悬液中添加三乙胺三氢氟酸盐(1.5ml,9.21mmol)。将混合物在50℃搅拌4小时。lcms指示一些起始材料仍然未消耗,并将该反应在室温继续搅拌16小时。然后,将该反应混合物用丙酮(约25ml)稀释且形成沉淀。搅拌15分钟后,将反应过滤。固体用丙酮(约10ml)冲洗且干燥。将滤液真空浓缩且然后添加甲苯以去除任何剩余吡啶。粗滤液和过滤的固体分别通过反相hplc纯化,使用0-20%acn:h2o(0.1%nh4oh)的梯度且合并。19fnmr谱显示残余tfa存在于样品中。第二次反相hplc纯化,使用0-10%acn/h2o(0.1%nh4oh)的梯度,得到标题化合物(实施例10a,4mg),其为二铵盐,为单一非对映异构体,其中在磷中心处的精确立体化学未确定,该产物为白色固体。lcmsm/z693.0(m+h)。tret=0.11分钟。
1hnmr(600mhz,dmso-d6且具有一滴d2o):δppm8.30(s,1h),8.19(s,1h),7.97(s,1h),6.26(dd,j=15.9,2.3hz,1h),5.86(d,j=8.3hz,1h),5.59-5.76(m,1h),5.30(brs,1h),5.06(brd,j=15.5hz,1h),4.35(d,j=3.8hz,1h),4.25(brs,1h),4.02-4.07(m,1h),4.01-4.13(m,2h),3.88-3.99(m,2h)。
19fnmr(376mhz,dmso-d6且具有一滴d2o)δppm-203.83.
31pnmr(162mhz,dmso-d6且具有一滴d2o)δppm55.73,-2.66.
按照与制备实施例10a相同的步骤,(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-12-羟基-3-硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮的异构体2(中间体9b,60mg,0.35mmol)的反应得到标题化合物(实施例10b,7mg),其为二铵盐,为单一非对映异构体,其中在磷中心处的精确立体化学未确定,该产物为白色固体。lcmsm/z693.0(m+h),tret=0.37分钟。
1hnmr(400mhz,dmso-d6且具有一滴d2o):δppm8.50(br.s.,1h),h)8.22(br.s.,1h),7.94(br.s.,1h),6.35(d,j=14hz,1h),5.87(d,j=7.86hz,1h),5.54-5.67(m,1h),4.98(br.d.,j=15.5hz,1h),4.39(br.s.,1h),4.33(d,j=6.84hz,1h),4.24(br.s.,1h),4.13(br.s.,1h),4.00-4.10(m,2h),3.89-3.98(m,2h)。
19fnmr(376mhz,dmso-d6且具有一滴d2o)δppm-205.00.
31pnmr(162mhz,dmso-d6且具有一滴d2o)δppm49.15,-2.90.
实施例11a和11b–化合物27a和27b
(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮,二铵盐
中间体10:n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-17-[2-(2-甲基丙酰氨基)-6-氧代-6,9-二氢-1h-嘌呤-9-基]-12-氧代-12-硫基-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}
向(2r,5r)-5-(6-苯甲酰氨基-9h-嘌呤-9-基)-2-((((((2r,5r)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(羟基甲基)-2-(2-异丁酰氨基-6-氧代-1h-嘌呤-9(6h)-基)四氢呋喃-3-基)氧基)(2-氰基乙氧基)硫代磷酰基)氧基)甲基)-4-氟四氢呋喃-3-基氢膦酸酯(中间体7,2.58g,2.49mmol)在吡啶(50ml)中的粗溶液中添加2-氯-5,5-二甲基-1,3,2-二氧杂磷杂环己烷2-氧化物(dmocp)(1.70g,9.21mmol),且将混合物在室温氮气下搅拌30分钟。然后将该反应用水(1.6ml,89mmol)淬灭,然后添加3h-苯并[c][1,2]二硫醇-3-酮(660mg,3.92mmol)。将混合物搅拌10分钟,然后倒入包含水(350ml)和碳酸氢钠(nahco3)(10g,119mmol)的烧杯中。将黄色浆液搅拌10分钟,然后转移至分液漏斗。产物用1:1乙醚:etoac(300mlx2)萃取。合并的萃取物用硫酸钠干燥,过滤,且真空浓缩。粗物质通过色谱法在二氧化硅(100克柱)上纯化,用0-10%meoh/dcm洗脱,然后保持在10%meoh/dcm洗脱。将所需级分合并且浓缩,得到不纯的标题化合物(1.1g),其为褐色固体。通过lcms测定,两种主要异构体似乎构成混合物的约77%。lcmsm/z1050.1(m+h),分别地,tret=1.09和1.20分钟。
中间体11:(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮
将不纯的n-{9-[(1r,6r,8r,9r,10r,15r,17r,18r)-18-[(叔丁基二甲基甲硅烷基)氧基]-3-(2-氰基乙氧基)-9-氟-17-[2-(2-甲基丙酰氨基)-6-氧代-6,9-二氢-1h-嘌呤-9-基]-12-氧代-12-硫基-3-硫代-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-8-基]-9h-嘌呤-6-基}苯甲酰胺(中间体10,0.77g,0.73mmol)在甲胺(33%wt在etoh中)(10.0ml,80mmol)中的溶液在室温氮气下搅拌2小时。粗lcms指示4种异构体((m+h)+=823),其中tret=0.74,0.83,0.90和0.94分钟,大概比例为20:3:13:19(但是该比例可能会受到与杂质峰的可能重叠的显著影响)。真空去除挥发物。粗物质通过反相hplc纯化,使用10-60%acn:h2o(0.1%tfa)的梯度。分离两种主要异构体。
●标题化合物的异构体1(120mg,64%lcms测定的纯度,伴随8%tbs-脱保护产物),其为褐色固体,其中在两个磷中心处的精确立体化学未确定。lcmsm/z823.1(m+h)。tret=0.74分钟。
●标题化合物的异构体2(130mg,50%lcms测定的纯度,伴随18%tbs-脱保护产物),其为褐色固体,其中在两个磷中心处的精确立体化学未确定。lcmsm/z823.1(m+h)。tret=0.96-1.00分钟,作为具有峰拖尾的宽峰。
实施例11a和11b:(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-9-氟-18-羟基-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-
在50℃,向中间体11的异构体1,(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮(120mg,0.146mmol)在吡啶(2ml)和三乙胺(2ml)中的混悬液中添加三乙胺三氢氟酸盐(700μl,4.30mmol),且将混合物搅拌且在50℃加热4小时。lcms指示一些起始材料仍然未耗尽。该反应混合物在室温保持搅拌16小时。然后添加丙酮(约25ml),沉淀出固体。将其在室温保持搅拌约30分钟,过滤且用丙酮冲洗。lcms测定过滤的固体不包含任何所需产物且被丢弃。将包含所需产物的滤液真空浓缩且添加甲苯以进一步去除任何剩余吡啶。残余物通过反相hplc纯化,使用0-10%acn:h2o(0.1%nh4oh)的梯度,以得到产物,其不是非常纯且似乎被三氟乙酸盐污染。因此将固体溶于约2ml水且添加几滴30%nh4oh水溶液,将其进一步通过反相hplc纯化,使用0-10%acn:h2o(0.1%nh4oh)的梯度,以得到标题化合物(实施例11a,13mg),其为二铵盐,为单一非对映异构体,其中在两个磷中心处的精确立体化学未确定。该产物为白色固体。lcmsm/z708.9(m+h)。tret=0.17分钟。
1hnmr(600mhz,dmso-d6且具有一滴d2o):δppm8.31(s,1h),8.21(s,1h),8.11(brs,1h),6.25(dd,j=15.1,2.6hz,1h),5.84(d,j=8.3hz,1h),5.68(d,j=51.7hz,1h),5.27-5.37(m,1h),5.16-5.25(m,1h),4.32(d,j=4.2hz,1h),4.26(brs,1h),4.01-4.17(m,3h),3.90-3.96(m,1h),3.81(brd,j=11.7hz,1h)。
19fnmr(376mhz,dmso-d6且具有一滴d2o)δppm-205.30(br)。
31pnmr(162mhz,dmso-d6且具有一滴d2o)δppm55.77,54.01.
按照与制备实施例11a相同的步骤,除了第一次纯化使用0-20%acn:h2o(0.1%nh4oh)的梯度,中间体11的异构体2,(1r,6r,8r,9r,10r,15r,17r,18r)-17-(2-氨基-6-氧代-6,9-二氢-1h-嘌呤-9-基)-8-(6-氨基-9h-嘌呤-9-基)-18-[(叔丁基二甲基甲硅烷基)氧基]-9-氟-3,12-二硫基-2,4,7,11,13,16-六氧杂-3λ5,12λ5-二磷杂三环[13.2.1.06,10]十八烷-3,12-二酮(130mg,0.158mmol)的反应,得到标题化合物(实施例11b,16mg),其为二铵盐,为单一非对映异构体,其中在两个磷中心处的精确立体化学未确定。该产物为白色固体。lcmsm/z708.9(m+h)。tret=0.42分钟。
1hnmr(600mhz,dmso-d6且具有一滴d2o):δppm8.22(brs,1h),8.18(s,1h),8.05(brs,1h),6.27(dd,j=15.3,2.1hz,1h),5.82(brd,j=8.3hz,1h),5.60(d,j=49.9hz,1h),5.27-5.46(m,1h),5.12-5.27(m,1h),4.42-4.59(m,1h),4.30(brs,1h),4.14(brd,j=2.3hz,1h),4.11(brd,j=5.7hz,2h),4.06(brd,j=9.1hz,1h),3.82(brd,j=11.0hz,1h)。
19fnmr(376mhz,dmso-d6且具有一滴d2o)δppm-205.05.
31pnmr(162mhz,dmso-d6且具有一滴d2o)δppm53.85,47.48.
缩写
以下列表提供了本文所用的某些缩写的定义。应当理解,该列表不是穷尽的,但本文下面未定义的那些缩写的含义对于本领域技术人员将是非常明显的。
dcm二氯甲烷
dmfn,n-二甲基甲酰胺
dmso二甲基亚砜
dmtr二甲氧基三苯甲基
thf四氢呋喃
etoac乙酸乙酯
meoh甲醇
etoh乙醇
mecn乙腈
hcl盐酸
hplc高效液相色谱法
mdap质量定向自动化制备型hplc
spe固相萃取
meoh甲醇
tbdms叔丁基二甲基甲硅烷基
tbme叔丁基甲基醚
tfa三氟乙酸
dipean,n-二异丙基乙基胺
命名
使用chemdraw(cambridgesoft)或marvinsketch(chemaxon)中的命名工具由结构命名化合物。
实施例12-可注射的组合物
用于本发明给药的可注射形式通过在0.9%盐水溶液中搅拌1.7%重量的化合物#2而制备。
测试
化合物在与li等人(naturechemicalbiology,10,1043-1048,(2014))描述的类似的sting结合测试中进行测试。
生物活性
本发明化合物在与li等人(naturechemicalbiology,10,1043-1048,(2014))描述的测试类似的sting结合测试中进行测试。本发明化合物在荧光共振能量转移(fret)结合测试中测试。li等人使用闪烁亲近测定法(spa)结合测试。
本发明化合物的sting活性列于下表1。
表1
虽然以上说明了本发明的优选实施方案,但应理解,本发明不限于在此公开的精确说明,而是保留在以下权利要求范围内的所有修改形式的权利。
- 还没有人留言评论。精彩留言会获得点赞!