用于检测猪伪狂犬病毒野毒的引物及探针、荧光定量PCR试剂盒及方法、应用与流程
本发明涉及病毒pcr检测技术领域,特别涉及一种用于检测猪伪狂犬病毒的引物及探针、荧光定量pcr试剂盒及方法、应用。
背景技术:
猪伪狂犬病(pseudorabies,pr)是由pr病毒(prv)引起的一种烈性传染病,猪是唯一的自然宿主,是病毒的长期贮存和排出者。prv可感染各个年龄段的猪,主要引起妊娠母猪流产、死胎、木乃伊胎,哺乳仔猪高死亡率及种猪不育。该病在世界范围内广泛分布,随着bartha-k61等疫苗以及鉴别诊断方法的应用,prv在欧美一些国家已经得到净化。然而从2011年开始,我国多个省份免疫过bartha-k61疫苗的猪场相继爆发pr疫情,给我国养猪业造成了严重的经济损失。
随着规模化养猪的不断发展以及新流行毒株变异株的出现,prv的发生和流行日趋严重,不断危害着我国养猪业。目前,我国很多规模化猪场的prv野毒呈阳性,很多中小规模的猪场和小养殖场感染情况更为糟糕,这使得本病的控制变得更加复杂。目前prv的常规检测方法包括病毒分离和鉴定、间接免疫荧光抗体试验(ifa)、血清中和试验(sn)、聚合酶链式反应(pcr)等。这些常规方法用于prv野毒感染检测时在特异性、敏感性和时效性等方面存在不足,特别是在病毒感染早期诊断中体现得尤为明显。实时荧光定量pcr将常规pcr与荧光探针检测技术相结合,具有特异性强、灵敏度更高、重复性好等优点,并且操作简便,用时短,污染少,通过分析软件可自动定量分析,结果更为准确直观,适用于大批量的病毒定性和定量的检测,已逐渐成为病原体检测的重要方法。
ge基因是prv的主要毒力决定因子,也是世界动物卫生组织所规定基因缺失疫苗的缺失基因。以ge基因序列为基础建立的荧光定量pcr检测方法能够区分基因缺失疫苗接种和野毒感染。本研究旨在建立一种可区分猪伪狂犬野毒株及基因缺失疫苗株的特异性荧光定量pcr方法,为prv的早期快速检测,及其流行病学调查以及预防和控制我国prv的流行提供快速、简便和可靠的技术工具。
技术实现要素:
为了能够提供一种快速、准确的检测prv野毒的检测试剂,为prv野毒的快速检测及其流行病学调查以及预防和控制我国prv的流行提供快速、简便和可靠的技术工具,本发明提供了一种用于检测猪伪狂犬病毒野毒的特异性引物及探针、荧光定量pcr试剂盒及方法、应用。
为了实现上述发明目的,本发明提供了一种用于猪伪狂犬病毒特异性检测用引物及探针,其中:
所述引物的核苷酸序列如下:
上游引物:5'cggcttcgacgtctggtt3',
下游引物:5'gccatagttgggtccattcg3';
所述探针序列如下:
5'fam-ccggagaaaccggaag-mgb3'。
为了更好的实现上述发明目的,本发明还提供了一种用于检测猪伪狂犬病毒的荧光定量pcr检测试剂,所述试剂包括以下组分:反应混合液、水和用于猪伪狂犬病毒特异性检测用引物和探针;
所述引物的核苷酸序列如下:
上游引物:5'cggcttcgacgtctggtt3',
下游引物:5'gccatagttgggtccattcg3';
所述探针序列如下:
5'fam-ccggagaaaccggaag-mgb3'。
其中,所述反应混合液为takara公司生产的premixextaq(probeqpcr)。
所述水为takara公司生产的rnase-freewater。
一种制备检测猪伪狂犬病毒的荧光定量pcr试剂盒,为含有权利要求2-4任一项所述的荧光定量pcr检测试剂的试剂盒。
所述引物和探针或所述试剂或所述试剂盒,在检测猪伪狂犬病毒或制备检测猪伪狂犬病毒检测产品中的应用。
为了更好的实现上述发明目的,本发明还提供了一种用于检测猪伪狂犬病毒的荧光定量pcr检测方法,所述检测方法包括:
(1)设计及合成引物和探针;
其中,所述引物的核苷酸序列如下:
上游引物:5'cggcttcgacgtctggtt3',
下游引物:5'gccatagttgggtccattcg3';
所述探针序列如下:
5'fam-ccggagaaaccggaag-mgb3';
(2)病毒dna的提取和制备阳性质粒标准品;
(3)进行荧光定量pcr反应条件的优化,建立荧光定量pcr检测体系;
(4)采用荧光定量pcr检测体系对病毒进行检测。
其中,所述步骤(2)具体为:
用dna/rna核酸共提试剂盒分别提取内脏组织匀浆、病毒培养物和血清的dna,溶于20μlrnase-freewater,所得dna可直接用于荧光定量pcr或置-20℃保存备用;
以primerf/r为引物通过常规pcr扩增prvge目的基因,产物经回收试剂盒纯化后连接pmd19-t载体,转化至e.colidh5α大肠杆菌,通过序列测定获得阳性克隆质粒即为质粒标准品;测定dna浓度后,换算成拷贝数,并稀释至1010copies•μl-1,-20℃保存,用前稀释作为质粒标准品。
所述步骤(3)中,优化后的反应条件为:95℃5min;94℃15sec,55℃35sec,40个循环。
所述步骤(3)中,所述荧光定量pcr反应体系共为25μl,含12.5μl2×premixextaq(probeqpcr),10μlrnase-freewater,0.5μlprobe(10μm),0.5μlprimerf(10μm),0.5μlprimerr(10μm),质粒标准品1μl。
本发明的有益效果是:本发明的引物和探针是根据genbank中猪伪狂犬病毒(pseudorabiesvirus,prv)序列设计出的一对特异性引物和一条特异性taqman-mgb探针,建立了一种可以快速、准确地对prv野毒感染进行特异性检测的taqman-mgb荧光定量pcr检测方法,通过对反应条件和反应体系的优化,使得该方法在9.2×101~9.2×109copies•μl-1模板范围内具有良好的线性关系,灵敏度达到9.2×101copies•μl-1,是常规pcr方法的100倍。而且与常规pcr方法相比,该方法可对其结果进行实时监控,无需进一步进行凝胶电泳分析。将待检样品提取dna后进行荧光定量pcr反应,可以在2h内快速准确地对样品中的prv进行检测,既能进行定性检测,又能准确定量。进一步地,通过试验表明,利用本发明引物和探针构建的荧光定量prv检测方法,具有特异性强、灵敏度高、重复性好等优势,为prv的早期快速检测,及其流行病学调查以及预防和控制我国prv的流行提供快速、简便和可靠的技术工具。
附图说明
图1为本发明实施例5中prv目的基因pcr扩增结果的示意图;其中,m:dl2000marker;1-2:prv;3:阴性对照。
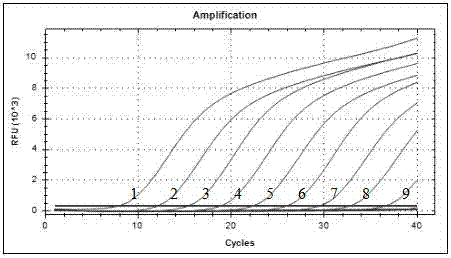
图2为本发明实施例5中prvtaqman-mgb荧光定量pcr动力学曲线图;其中,1-9分别为9.2x109-9.2x101copies•μl-1的标准品。
图3为本发明实施例5中prvtaqman-mgb荧光定量pcr标准曲线图。
图4为本发明实施例5中prvtaqman-mgb荧光定量pcr特异性试验结果的示意图;其中,1:标准品;2-10分别为csfv,prrsv,pedv,tgev,rv,ppv,pcv2和阴性对照。
图5为本发明实施例5中prv常规pcr敏感性试验结果的示意图;其中,m:dl2000marker;1-7:稀释度为1.12×107-1.12×101copies•μl-1的模板dna。
具体实施方式
本发明根据genbank中猪伪狂犬病毒(prv)ge基因序列设计一对特异性引物和一条特异性taqman-mgb探针,建立了一种可以快速、准确地对prv野毒感染进行特异性检测的taqman-mgb荧光定量pcr检测方法。通过对反应条件和反应体系的优化,使得该方法在9.2×101~9.2×109copies•μl-1模板范围内具有良好的线性关系,灵敏度达到9.2×101copies•μl-1,是常规pcr方法的100倍。而且与常规pcr方法相比,该方法可对其结果进行实时监控,无需进一步进行凝胶电泳分析。
为能清楚说明本方案的技术特点,下面通过具体实施方式,对本方案进行阐述。
实施例1引物及探针
本发明实施例提供了一种用于猪伪狂犬病毒野毒特异性检测用引物及探针,其中:
所述引物的核苷酸序列如下:
上游引物:5'cggcttcgacgtctggtt3',
下游引物:5'gccatagttgggtccattcg3';
所述探针序列如下:
5'fam-ccggagaaaccggaag-mgb3';
实施例2荧光定量pcr检测试剂
本发明实施例提供了一种用于检测猪伪狂犬病毒野毒的荧光定量pcr检测试剂,所述试剂包括以下组分:反应混合液、水和用于猪伪狂犬病毒野毒特异性检测用引物和探针;其中,
引物的核苷酸序列如下:
上游引物:5'cggcttcgacgtctggtt3',
下游引物:5'gccatagttgggtccattcg3';
所述探针序列如下:
5'fam-ccggagaaaccggaag-mgb3'。
反应混合液为takara公司生产的premixextaq(probeqpcr);水为takara公司生产的rnase-freewater。
实施例3荧光定量pcr试剂盒
本发明实施例提供了一种制备检测猪伪狂犬病毒野毒的荧光定量pcr试剂盒,具体为含有实施例2荧光定量pcr检测试剂的试剂盒。
实施例4荧光定量pcr检测方法
本发明实施例提供了一种用于检测猪伪狂犬病毒野毒的荧光定量pcr检测方法,检测方法包括:
(1)设计及合成引物和探针;
其中,所述引物的核苷酸序列如下:
上游引物:5'cggcttcgacgtctggtt3',
下游引物:5'gccatagttgggtccattcg3';
所述探针序列如下:
5'fam-ccggagaaaccggaag-mgb3';
(2)病毒dna的提取和制备阳性质粒标准品;
(3)进行荧光定量pcr反应条件的优化,建立荧光定量pcr检测体系;
(4)采用荧光定量pcr检测体系对病毒进行检测。
其中,所述步骤(2)具体为:
用dna/rna核酸共提试剂盒分别提取内脏组织匀浆、病毒培养物和血清的dna,溶于20μlrnase-freewater,所得dna可直接用于荧光定量pcr或置-20℃保存备用;
以primerf/r为引物通过常规pcr扩增prvge目的基因,产物经回收试剂盒纯化后连接pmd19-t载体,转化至e.colidh5α大肠杆菌,通过序列测定获得阳性克隆质粒即为质粒标准品;测定dna浓度后,换算成拷贝数,并稀释至1010copies•μl-1,-20℃保存,用前稀释作为质粒标准品。
所述步骤(3)中,优化后的反应条件为:95℃5min;94℃15sec,55℃35sec,40个循环。
所述步骤(3)中,所述荧光定量pcr反应体系共为25μl,含12.5μl2×premixextaq(probeqpcr),10μlrnase-freewater,0.5μlprobe(10μm),0.5μlprimerf(10μm),0.5μlprimerr(10μm),质粒标准品1μl。
实施例5应用
本实施例提供了一种引物和探针、或荧光定量pcr检测试剂、或荧光定量pcr试剂盒,用于猪伪狂犬病毒野毒特异性检测的应用,具体如下:
1材料与方法
1.1仪器与试剂
e.colidh5α购自takara公司;cfx96荧光定量pcr仪购自bio-rad公司;紫外分光光度计购自thermo公司;质粒提取试剂盒购自axygen公司;dna/rna核酸共提试剂盒购自invitrogen公司;premixextaq(probeqpcr)购自takara公司;pmd19-t载体购自takara公司。
1.2设计引物和探针
特异性引物对和taqman-mgb荧光探针具体如下:
引物对的序列如下:
上游引物为primerf:5'cggcttcgacgtctggtt3',
下游引物为primerr:5'gccatagttgggtccattcg3';
探针序列为probe:5'fam-ccggagaaaccggaag-mgb3'。
探针5'端标记的荧光报告基团是fam,3'端标记荧光淬灭基团为non-fluorescentquencher和minorgroovebinder(mgb)。
1.3病毒dna的提取和质粒标准品制备
用dna/rna核酸共提试剂盒按其操作说明书分别提取内脏组织匀浆、病毒培养物和血清的dna,溶于20μlrnase-freewater,所得dna可直接用于荧光定量pcr或置-20℃保存备用。
以primerf/r为引物通过常规pcr扩增prvge目的基因,产物经回收试剂盒纯化后连接pmd19-t载体,转化至e.colidh5α大肠杆菌,通过序列测定获得阳性克隆质粒即为质粒标准品。测定dna浓度后,换算成拷贝数,并稀释至1010copies•μl-1,-20℃保存,用前稀释作为质粒标准品。
1.4荧光定量pcr反应条件的优化
以质粒标准品为模板,在不同退火温度下进行常规pcr反应,扩增产物通过琼脂糖凝胶电泳进行分析,确定最佳的引物退火温度。应用矩阵法对荧光定量pcr的引物和探针浓度进行优化,以得到最佳的反应体系和反应条件。
1.5荧光定量pcr标准曲线的建立
将质粒标准品10倍倍比稀释至浓度范围为9.2x101-9.2x109copies•μl-1。每个稀释度设3个重复,进行荧光定量pcr检测,绘制标准曲线。
1.6特异性试验
分别提取猪瘟病毒(csfv),猪繁殖与呼吸综合征病毒(prrsv),猪流行性腹泻病毒(pedv),猪传染性胃肠炎病毒(tgev),轮状病毒(rv),猪细小病毒(ppv)和猪圆环病毒2型(pcv2)等病毒的核酸,利用建立的荧光定量pcr方法对上述核酸进行检测验证该方法的特异性。
1.7敏感性试验
将阳性dna按10倍倍比稀释至最低浓度为1.12x101copies•μl-1,进行荧光定量pcr反应。同时以该dna为模板,进行常规pcr反应,上下游引物分别为5'ccgcgggccgtgttctttgt3'和5'cgtggccgttgtgggtcat3'。取扩增产物10μl,用1.5%的琼脂糖凝胶电泳进行分析,比较二者敏感性的差异。
1.8重复性试验
用5种浓度的标准品质粒分别进行4次批次内和批次间的重复性试验并且根据ct值计算变异系数。
1.9对临床样品的检测
由新希望六和动保中心收集可疑prv临床样品60份,分别进行荧光定量pcr检测和常规pcr检测,比较分析结果。
2结果
2.1质粒标准品的制备
以primerf/r为引物通过常规pcr扩增prvge目的基因(图1),产物经回收试剂盒纯化后连接pmd19-t载体,转化至e.colidh5α大肠杆菌,通过序列测定获得阳性克隆质粒即为质粒标准品。测定dna浓度后,换算成拷贝数,并稀释至1010copies•μl-1,-20℃保存,用前稀释作为质粒标准品。
2.2荧光定量pcr反应条件的优化
通过对退火温度及引物与探针浓度的优化,最终确定了荧光定量pcr方法的最优反应条件。荧光定量pcr反应体系共为25μl,含12.5μl2×premixextaq(probeqpcr),10μlrnase-freewater,0.5μlprobe(10μm),0.5μlprimerf(10μm),0.5μlprimerr(10μm),质粒标准品1μl。反应条件为:95℃5min;94℃15sec,55℃35sec,40个循环。
2.3荧光定量pcr标准曲线的建立
取浓度为9.2x101-9.2x109copies•μl-1的标准品质粒为模板进行荧光定量pcr扩增并建立标准曲线。由图2和图3可知,线性关系良好,标准曲线建立成功,可用于临床样品检测。
2.4特异性试验
用所建立的荧光定量pcr方法对csfv,prrsv,pedv,tgev,rv,ppv和pcv2进行检测,检测结果均为阴性,这些病毒的扩增曲线均为水平线,未达到检出阈值(图4),试验结果表明该方法具有良好的特异性。
2.5敏感性试验
荧光定量pcr方法能检出的dna模板最低浓度为9.2x101copies•μl-1(图2),而常规pcr能检出的模板最低浓度为1.12×104copies•μl-1(图5),试验结果表明所建立的荧光定量pcr方法的敏感性是常规pcr方法的100倍左右。
2.6重复性试验
用5种不同浓度的标准品分别进行批次内和批次间的重复性试验。试验结果表明,批次内和批次间重复性试验的变异系数均小于1.5%(表1),表明该方法具有良好的重复性与稳定性。
表1pcrtaqman-mgb荧光定量pcr重复性试验结果
2.7临床样品检测结果
对收集的可疑prv临床样品60份,分别进行荧光定量pcr检测和常规pcr检测。检测结果表明,荧光定量pcr方法阳性检出率(58.3%)比常规pcr方法(46.7%)更高(表2)。对临床样品的检测结果表明荧光定量方法具有更高的敏感性,更适用于prv野毒的临床检测,尤其是感染早期病毒含量较低时。
表2临床样品检测结果
综上,通过上述将本发明的引物、探针应用于猪伪狂犬病毒野毒特异性检测以及样品结果,能够看出,采用本发明的引物、探针构建的荧光定量pcr检测方法,与其它猪病病毒无交叉反应,具有良好的特异性,敏感性是常规pcr方法的100倍,且该方法将待检样品提取dna后直接进行荧光定量pcr反应,利用所建立的荧光定量pcr方法可以在2h内快速准确地对prv野毒感染进行检测,并且既能进行定性检测,又能准确定量。具有灵敏度高、特异性强、重复性好等优势,为猪伪狂犬病毒的实验室诊断及调查猪伪狂犬病毒在我国猪群中的流行情况提供了快速、准确的检测手段。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!