一种新型T细胞免疫调节剂生物活性检测方法与流程
本发明涉及生物医药技术领域,具体地说是涉及一种采用睡美人转座子系统建立t细胞免疫调节剂的生物活性检测方法。
背景技术:
转座子又称可移动基因,跳跃基因,是一种可在基因组内插入和切离并能改变自身位置的dna序列。早在20世纪50年代,首先由mcclintock在玉米中发现,随后又陆续在细菌、真菌及动植物中发现,如细菌中的tn5,酵母中的ty以及来源于鳞翅目昆虫的piggybac转座子等。睡美人(sleepingbeauty,sb)转座系统是tc1/mariner转座子超家族中的一员,已经失活了一千多万年;1997年,ivics等根据积累的系统发生数据,利用生物信息学的方法,对其进行分子重建,终于唤醒了其转座活性,恢复跳跃能力,因此被命名“睡美人”。sb转座子由两部分组成,转座酶基因和能够被转座酶识别的两端反向重复序列(terminalinvertedrepeat,itr)。转座酶的开放式阅读框编码340个氨基酸的蛋白质,它可以与两端的反向重复序列相结合,促进转座的发生。两端的反向重复序列长约230bp,由外侧的32bp反向重复序列、内侧与ir相似的同向重复序列(dr)以及两者间相距165bp-166bp的片段3个部分等组成。dr是转座酶的结合区域,是转座子的严格保守区。
sb转座子使用经典的“剪切-粘贴”(cut-and-paste)的作用机制进行转座。转座酶特异性识别dr,与细胞内的一种高度保守蛋白-高迁移率族蛋白1(highmobilitygroupbox-1protein,hmgb1)结合形成突起复合物;此时,转座酶催化转座子的切除,释放转座子序列,并插入到新的整合位点上。一般情况下,sb转座子能特异性的整合到基因组中的ta双核苷酸位点。
在实际的研究中,则是将sb转座子的两个功能成分(转座酶和itr)分开,将这两个成分以双质粒系统进行构建;即将编码转座酶基因的序列从转座子中分离下来,构建成一个独立的表达载体,而转座酶基因原来的位置则可以被其它的dna序列(兴趣基因及相关启动子等)代替,构建成另外一个载体;利用这种双质粒系统,sb转座子可以携带外源dna序列整合到染色体上,并在细胞和体内稳定表达。显然地,睡美人转座子将成为天然并容易控制的dna序列转移载体,并成为遗传工程包括基因治疗领域中广泛使用的工具。
目前基因递送系统可以分为整合型和非整合型系统,其中能将外源基因稳定整合至真核宿主染色体的整合型系统包括逆转录病毒载体、慢病毒载体以及睡美人、piggybac(pb)转座子系统。相对于其他常用的基因递送载体,睡美人转座子具有其无可比拟的优势:1.能将外源基因永久整合插入到宿主染色体基因组上;2.工业化生产简单、廉价;3.免疫原性低,体内安全性高;4.具有很大的外源基因包装能力,甚至可包装100kb以上的bacs。
胸腺依赖性淋巴细胞(thymus-dependentlymphocyte,简称t细胞)功能的抑制或激活在肿瘤免疫、自身免疫疾病及移植排斥反应中起着极为重要的作用。t细胞的激活依靠“双信号”系统精密细致的调控。一个激活信号来自于t细胞上的cd3/tcr(tcellreceptor,t细胞受体)复合物与抗原提呈细胞或其它种类细胞上的主要组织相容性复合体(majorhistocompatibilitycomplex,mhc)及抗原复合物;另一个来自共刺激分子(cd28,ox40,4-1bb)和共抑制分子(ctla4,pd-l1,pd-1)的信号传递。例如源自t细胞上的共刺激信号受体cd28与抗原提呈细胞上的cd80/86的结合,刺激t细胞激活。若对该信号通路进行调节,如通过ctla-4竞争性抑制cd28与cd80/86的结合,可阻断第二信号共刺激信号通路。或者通过加入共抑制信号分子的抗体如抗ctla-4抗体、pd-1抗体、pd-l1抗体,则可解除对t细胞激活的抑制。亦或加入抗cd3抗体竞争性结合cd3/tcr复合物,从而阻断第一信号通路,最终实现对t细胞活性进行调节(抑制或激活)的效果。基于此,涌现出大量已上市或在研的针对t细胞活化过程中所涉及的分子事件而设计的药物,以下统称为t细胞活化调节剂。对t细胞活化水平进行检测,是基于细胞水平的在开发此类药物时对其药效进行评估和生产中质量控制的重要指标。
目前通用的t细胞活化调节剂的生物活性的测定方法,是采用混合淋巴细胞反应,通常是采用人外周血单核细胞(pbmc)进行生物活性测定,然而这种方法变异性大,成本高,方法耐用性和重复性较差。其测定方法为测试t细胞活化调节剂在混合淋巴细胞反应中对t细胞增殖和细胞因子ifn-y和il-2分泌产生的影响。使用人cd3+t细胞富集柱从pbmc中纯化人t细胞,每份培养物在200ul的总体积中包含105个纯化的t细胞和104个同种异基因的树突细胞;向每份培养物中加入不同浓度的t细胞活化调节剂,将细胞于37℃培养5天;5天后,从每份培养物中取出100ul培养基用于细胞因子的测量。采用细胞因子测试试剂盒来测量ifn-y和il-2等细胞因子的水平。同时可加入cck8试剂[2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2h-四唑单钠盐]测试t细胞的增殖;此传统的生物活性测试方法需要采集分离足够多的新鲜人外周血单核细胞(pbmc),通过长时间的(2-5天)培养后测定细胞增殖情况及上清中细胞因子的表达情况。这些传统的方法存在所需时间较长,成本较高,而且方法本身容易受到不同人体之间pbmc活性差异的影响,变异性较大等缺点。
现有技术还不能解决上述技术困难。
技术实现要素:
本发明采用睡美人转座子系统作为基因转移载体,将外源基因高效整合到t细胞,建立了一种新型t细胞免疫调节剂的生物活性检测方法。本发明用t细胞活化基因的反式转录调控元件驱动报告基因的表达,并用睡美人转座子系统将其稳定整合至jurkatt细胞上,并同时加入第一信号和第二信号,通过测试报告基因的活性,来检测t细胞活化调节剂的生物活性。采用睡美人转座子建立的报告基因检测法不需要任何人血液来源的细胞成分或其他成分,测试结果稳定,操作简便,所需测试时间短,非常适宜后期对药物质量控制以及批次放行检测,可以广泛应用。
本发明提供了一种用睡美人转座子系统建立t细胞活化调节剂生物活性的报告基因检测方法,所述方法包括:
步骤一:t细胞活化基因的反式转录调控元件驱动的报告基因载体构建;所述报告基因为萤光素酶。
步骤二:在萤光素酶基因两端插入睡美人转座子末端反向重复序列;
步骤三:构建转座酶的表达载体;
步骤四:将睡美人转座子的双质粒系统电转jurkatt细胞,筛选表达t细胞活化基因的反式转录调控元件驱动的报告基因的稳定细胞株;
步骤五:对t细胞活化调节剂的生物活性进行检测,其检测方法包括:在第一信号和第二信号的共同作用下,步骤四中稳定细胞株被激活,t细胞活化基因的反式转录调控元件驱动的报告基因表达上调或下降,同步加入t细胞活化调节剂,通过检测报告基因的表达量,定量评估t细胞活化调节剂生物学活性。
其中,所述步骤一中,所述t细胞活化基因选自il-2、nfat、foxp3、cd40、ox40、cd137或stat3中的任一种,优选il-2。
其中,所述步骤一中,所述反式转录调控元件选自il-2启动子、cd28responseelement、nfatresponseelement或stat3responseelement中的任一种,优选il-2启动子。
其中,所述步骤二中,睡美人转座子末端反向重复序列中的左臂序列(seqidno.1)为:aagtcggaagtttacatacacttaagttggagtcattaaaactcgtttttcaactactccacaaatttcttgttaacaaacaatagttttggcaagtcagttaggacatctactttgtgcatgacacaagtcatttttccaacaattgtttacagacagattatttcacttataattcactgtatcacaattccagtgggtcagaagtttacatacactaa;右臂序列(seqidno.2)为:tgagtgtatgtaaacttctgacccactgggaatgtgatgaaagaaataaaagctgaaatgaatcattctctctactattattctgatatttcacattcttaaaataaagtggtgatcctaactgacctaagacagggaatttttactaggattaaatgtcaggaattgtgaaaaagtgagtttaaatgtatttggctaaggtgtatgtaaacttccgacttcaactg。
其中,所述步骤三中,所述转座酶选自sb10、sb11或sb100x,优选sb11。
其中,所述sb11转座酶的基因序列(seqidno.3)为:atgggaaaatcaaaagaaatcagccaagacctcagaaaaaaaattgtagacctccacaagtctggttcatccttgggagcaatttccaaacgcctgaaagtaccacgttcatctgtacaaacaatagtacgcaagtataaacaccatgggaccacgcagccgtcataccgctcaggaaggagacgcgttctgtctcctagagatgaacgtactttggtgcgaaaagtgcaaatcaatcccagaacaacagcaaaggaccttgtgaagatgctggaggaaacaggtacaaaagtatctatatccacagtaaaacgagtcctatatcgacataacctgaaaggccgctcagcaaggaagaagccactgctccaaaaccgacataagaaagccagactacggtttgcaagagcacatggggacaaagatcgtactttttggagaaatgtcctctggtctgatgaaacaaaaatagaactgtttggccataatgaccatcgttatgtttggaggaagaagggggaggcttgcaagccgaagaacaccatcccaaccgtgaagcacgggggtggcagcatcatgttgtgggggtgctttgctgcaggagggactggtgcacttcacaaaatagatggcatcatgaggaaggaaaattatgtggatatattgaagcaacatctcaagacatcagtcaggaagttaaagcttggtcgcaaatgggtcttccaacaagacaatgaccccaagcatacttccaaacacgtgagaaaatggcttaaggacaacaaagtcaaggtattggagtggccatcacaaagccctgacctcaatcctatagaaaatttgtgggcagaactgaaaaagcgtgtgcgagcaaggaggcctacaaacctgactcagttacaccagctctgtcaggaggaatgggccaaaattcacccaacttattgtgggaagcttgtggaaggctacccgaaacgtttgacccaagttaaacaatttaaaggcaatgctaccaaatactag。
其中,所述步骤五中,所述第一信号和第二信号为cd3抗体和表达cd80/86细胞、cd3抗体和表达pd-1/pd-l1的细胞。
本发明还提供了包括ctla4-fc融合蛋白、pd-1单克隆抗体和pd-l1单克隆抗体的t细胞活化调节剂的生物活性检测方法。
本发明还提供了在ctla4-fc融合蛋白、pd-1单克隆抗体和pd-l1单克隆抗体质控中的应用。
本文使用的所有科技术语具有本领域普通技术人员所理解的相同含义。
其中,所述jurkat为人急性t淋巴细胞白血病细胞;
所述il-2启动子序列(seqidno.4)为aaaattttctgagttacttttgtatccccacccccttaaagaaaggaggaaaaactgtttcatacagaaggcgttaattgcatgaattagagctatcacctaagtgtgggctaatgtaacaaagagggatttcacctacatccattcagtcagtctttgggggtttaaagaattccaaagagtcatcagaagaggaaaaatgaaggtaatgttttttcagacaggtaaagtctttgaaaatatgtgtaatatgtaaaacattttgacacccccataatatttttccagaattaacagtataaattgcatctcttgttcaagagttccctatcactctctttaatcactactcacagtaacctcaactcctgccac;
所述nfat响应元件(nfatresponseelement)序列(seqidno.5)为ggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgt。
所述ctla4单克隆抗体为ipilimumab、tremelimumab中任一种,pd-1单克隆抗体为nivolumab、pembrolizumab中任一种,pd-l1单克隆抗体为atezolizumab、bms936559、durvalumab、avelumab中任一种。
本发明与现有技术相比具有以下优点:
目前,国内尚无采用睡美人转座子建立报告基因检测法,来实现对t细胞活化调节剂生物活性进行定量评估的相关报道,本发明填补了这一空白。本发明采用睡美人转座子系统介导获得萤光素酶报告基因稳定细胞株,相较于常用的外源质粒转染获得稳定细胞株阳性率高,整合高效,细胞代次更稳定,更适合用来建立测试生物活性,更稳定的报告基因检测法。另外,与使用原代t细胞进行检测的实验体系相比,本发明所提供的检测方法,无需使用人外周血,解决了目前人外周血来源困难且不同人来源的外周血所引起的实验结果一致性较差的这一难题;而且无需同时分离原代t细胞,避免了繁琐的pbmc分离及t细胞磁珠分选等流程,缩短实验流程,简化实验操作步骤。本发明采用睡美人转座子建立t细胞活化调节剂的生物活性报告基因检测方法,方法稳定,操作简便,对t细胞活化调节剂质量控制和临床应用具有重要意义。
附图说明
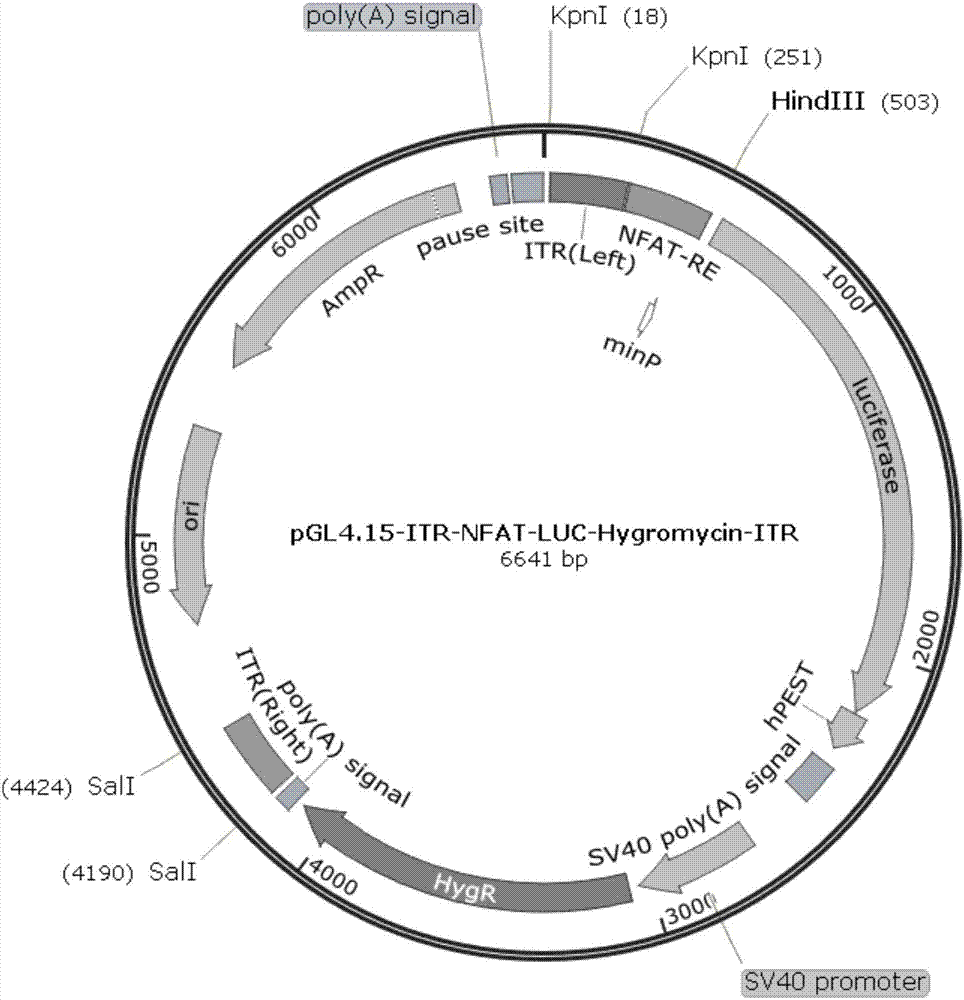
图1.插入末端反向重复序列的pgl4.15-il-2p载体图谱;
图2.插入末端反向重复序列的pgl4.15-nfat载体图谱;
图3.插入sb11转座酶序列的pcdna3.1-sb11载体图谱;
图4.筛选不同il2p-luc阳性克隆的萤光素酶活性测试;
图5.筛选不同nfat-luc阳性克隆的萤光素酶活性测试;
图6.ctla4-fc融合蛋白的生物活性测试方法的建立;
图7.pd-1单克隆抗体的生物活性测试方法的建立;
图8.ctla4-fc融合蛋白的生物活性测试方法的特异性;
图9.ctla4-fc融合蛋白的生物活性测试方法的稳定性。
具体实施方式
本发明详细的实施方法参见实施例,实施例中所述的实验方法和试剂,若无特殊说明均为常规实验方法和试剂。以下实施例仅用于说明和解释本发明,而不是以任何方式限制本发明。
一种用睡美人转座子系统建立t细胞活化调节剂生物活性的报告基因检测方法,所述方法包括:
步骤一:t细胞活化基因的反式转录调控元件驱动的报告基因载体构建;所述报告基因为萤光素酶。
步骤二:在萤光素酶基因两端插入睡美人转座子末端反向重复序列;
步骤三:构建转座酶的表达载体;
步骤四:将睡美人转座子的双质粒系统电转jurkatt细胞,筛选表达t细胞活化基因的反式转录调控元件驱动的报告基因的稳定细胞株;
步骤五:对t细胞活化调节剂的生物活性进行检测,其检测方法包括:在第一信号和第二信号的共同作用下,步骤四中稳定细胞株被激活,t细胞活化基因的反式转录调控元件驱动的报告基因表达上调或下降,同步加入t细胞活化调节剂,通过检测报告基因的表达量,定量评估t细胞活化调节剂生物学活性。
优选地,所述步骤一中,所述t细胞活化基因选自il-2、nfat、foxp3、cd40、ox40、cd137或stat3中的任一种,优选il-2。
更加优选地,所述步骤一中,所述反式转录调控元件选自il-2启动子、cd28responseelement、nfatresponseelement或stat3responseelement中的任一种,优选il-2启动子。
更加优选地,所述步骤二中,睡美人转座子末端反向重复序列中的左臂序列(seqidno.1)为:aagtcggaagtttacatacacttaagttggagtcattaaaactcgtttttcaactactccacaaatttcttgttaacaaacaatagttttggcaagtcagttaggacatctactttgtgcatgacacaagtcatttttccaacaattgtttacagacagattatttcacttataattcactgtatcacaattccagtgggtcagaagtttacatacactaa;右臂序列(seqidno.2)为:tgagtgtatgtaaacttctgacccactgggaatgtgatgaaagaaataaaagctgaaatgaatcattctctctactattattctgatatttcacattcttaaaataaagtggtgatcctaactgacctaagacagggaatttttactaggattaaatgtcaggaattgtgaaaaagtgagtttaaatgtatttggctaaggtgtatgtaaacttccgacttcaactg。
更加优选地,所述步骤三中,所述转座酶选自sb10、sb11或sb100x,优选sb11。
更加优选地,sb11转座酶的基因序列(seqidno.3)为:atgggaaaatcaaaagaaatcagccaagacctcagaaaaaaaattgtagacctccacaagtctggttcatccttgggagcaatttccaaacgcctgaaagtaccacgttcatctgtacaaacaatagtacgcaagtataaacaccatgggaccacgcagccgtcataccgctcaggaaggagacgcgttctgtctcctagagatgaacgtactttggtgcgaaaagtgcaaatcaatcccagaacaacagcaaaggaccttgtgaagatgctggaggaaacaggtacaaaagtatctatatccacagtaaaacgagtcctatatcgacataacctgaaaggccgctcagcaaggaagaagccactgctccaaaaccgacataagaaagccagactacggtttgcaagagcacatggggacaaagatcgtactttttggagaaatgtcctctggtctgatgaaacaaaaatagaactgtttggccataatgaccatcgttatgtttggaggaagaagggggaggcttgcaagccgaagaacaccatcccaaccgtgaagcacgggggtggcagcatcatgttgtgggggtgctttgctgcaggagggactggtgcacttcacaaaatagatggcatcatgaggaaggaaaattatgtggatatattgaagcaacatctcaagacatcagtcaggaagttaaagcttggtcgcaaatgggtcttccaacaagacaatgaccccaagcatacttccaaacacgtgagaaaatggcttaaggacaacaaagtcaaggtattggagtggccatcacaaagccctgacctcaatcctatagaaaatttgtgggcagaactgaaaaagcgtgtgcgagcaaggaggcctacaaacctgactcagttacaccagctctgtcaggaggaatgggccaaaattcacccaacttattgtgggaagcttgtggaaggctacccgaaacgtttgacccaagttaaacaatttaaaggcaatgctaccaaatactag。
更加优选地,所述步骤五中,所述第一信号和第二信号为cd3抗体和表达cd80/86细胞、cd3抗体和表达pd-1/pd-l1的细胞。
一种包含ctla4-fc融合蛋白、pd-1单克隆抗体和pd-l1单克隆抗体的t细胞活化调节剂的生物活性检测方法。
一种在ctla4-fc融合蛋白、pd-1单克隆抗体和pd-l1单克隆抗体质控中的应用。
实施例1:睡美人转座子双质粒系统的构建
1.pgl4.15-il-2p报告基因载体构建和pgl4.15-nfat报告基因载体的构建
(1)全基因合成il-2启动子(-329到+48位),其中上游带有kpni酶切位点ggtacc,下游带hindiii酶切位点aagctt,il-2启动子(-329到+48位)全序列如下:
ggtaccgaaaattttctgagttacttttgtatccccacccccttaaagaaaggaggaaaaactgtttcatacagaaggcgttaattgcatgaattagagctatcacctaagtgtgggctaatgtaacaaagagggatttcacctacatccattcagtcagtctttgggggtttaaagaattccaaagagtcatcagaagaggaaaaatgaaggtaatgttttttcagacaggtaaagtctttgaaaatatgtgtaatatgtaaaacattttgacacccccataatatttttccagaattaacagtataaattgcatctcttgttcaagagttccctatcactctctttaatcactactcacagtaacctcaactcctgccacaaagctt。
全基因合成产物与pgl4.15质粒经kpni和hindiii酶切后,将il-2启动子插入到pgl4.15载体上。构建pgl4.15-il-2p质粒,进行测序,结果完全正确。
(2)全基因合成6xnfat响应元件,其中上游带有kpni酶切位点ggtacc,下游带hindiii酶切位点aagctt,6xnfat响应元件全序列如下:
ggtaccggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtagatctagactctagagggtatataatggaagctcgaattccagcttggcattccggtactgttggtaaaaagctt;
全基因合成产物与pgl4.15质粒经kpni和hindiii酶切后,将nfat响应元件插入到pgl4.15载体上。构建pgl4.15-nfat质粒,进行测序,结果完全正确。
2.在报告基因两端插入睡美人转座子末端反向重复序列(invertedterminalrrepeat,itr)
全基因合成itr(l)和itr(r)末端反向重复序列,其中itr(l)序列经kpni单酶切,itr(r)经sali单酶切,分别插入至测序正确的pgl4.15-il-2p和pgl4.15-nfat载体上。合成的序列如下:
itr(l)序列:
ggtacccagttgaagtcggaagtttacatacacttaagttggagtcattaaaactcgtttttcaactactccacaaatttcttgttaacaaacaatagttttggcaagtcagttaggacatctactttgtgcatgacacaagtcatttttccaacaattgtttacagacagattatttcacttataattcactgtatcacaattccagtgggtcagaagtttacatacactaaggtacc;
itr(r)序列:
gtcgacttgagtgtatgtaaacttctgacccactgggaatgtgatgaaagaaataaaagctgaaatgaatcattctctctactattattctgatatttcacattcttaaaataaagtggtgatcctaactgacctaagacagggaatttttactaggattaaatgtcaggaattgtgaaaaagtgagtttaaatgtatttggctaaggtgtatgtaaacttccgacttcaactggtcgac;
正确插入末端反向重复序列的pgl4.15-il-2p载体图谱和pgl4.15-nfat载体图谱见图1和图2。
3.构建转座酶的表达载体
全基因合成sb11转座酶基因,上游携带bamhi酶切位点,下游携带有noti酶切位点,合成序列如下;将序列经bamhi和noti双酶切后,插入到pcdna3.1真核表达载体上,构建的载体图谱见图3。
sb11转座酶基因序列:
ggatccgccaccatgggaaaatcaaaagaaatcagccaagacctcagaaaaaaaattgtagacctccacaagtctggttcatccttgggagcaatttccaaacgcctgaaagtaccacgttcatctgtacaaacaatagtacgcaagtataaacaccatgggaccacgcagccgtcataccgctcaggaaggagacgcgttctgtctcctagagatgaacgtactttggtgcgaaaagtgcaaatcaatcccagaacaacagcaaaggaccttgtgaagatgctggaggaaacaggtacaaaagtatctatatccacagtaaaacgagtcctatatcgacataacctgaaaggccgctcagcaaggaagaagccactgctccaaaaccgacataagaaagccagactacggtttgcaagagcacatggggacaaagatcgtactttttggagaaatgtcctctggtctgatgaaacaaaaatagaactgtttggccataatgaccatcgttatgtttggaggaagaagggggaggcttgcaagccgaagaacaccatcccaaccgtgaagcacgggggtggcagcatcatgttgtgggggtgctttgctgcaggagggactggtgcacttcacaaaatagatggcatcatgaggaaggaaaattatgtggatatattgaagcaacatctcaagacatcagtcaggaagttaaagcttggtcgcaaatgggtcttccaacaagacaatgaccccaagcatacttccaaacacgtgagaaaatggcttaaggacaacaaagtcaaggtattggagtggccatcacaaagccctgacctcaatcctatagaaaatttgtgggcagaactgaaaaagcgtgtgcgagcaaggaggcctacaaacctgactcagttacaccagctctgtcaggaggaatgggccaaaattcacccaacttattgtgggaagcttgtggaaggctacccgaaacgtttgacccaagttaaacaatttaaaggcaatgctaccaaatactaggcggccgc。
实施例2:il-2启动子驱动萤光素酶稳定细胞株和nfatre驱动萤光素酶稳定细胞株的获得
1.睡美人转座子系统整合报告基因到jurkat宿主细胞
(一)睡美人双质粒系统转染宿主细胞
(1)提前1天传代jurkat细胞;
(2)取rpmi1640生长培养基+10%牛血清+1%双抗加入6孔板的两孔中,2ml/孔,在培养箱中预热;另取220ulcelllinenucleofectorsolutionv在培养箱中预热10min;
(3)分别取5ugpgl4.15-il-2p质粒、5ugpgl4.15-nfat质粒于两只ep管中,然后再各加入0.5ugpcdna3.1-sb11质粒混合备用;
(4)nucleofector电转仪开机,选择程序x-001;
(5)jurkat细胞计数,分取100万个细胞于1支离心管中,共两支,90g离心5min,弃尽上清;
(6)将预热的celllinenucleofectorsolutionv取100ul加入细胞沉淀中,后轻吹混匀,将细胞悬液加入放有质粒的ep管中,再轻吹转至电转杯中;
(7)将电转杯放入电转仪,按‘x’键,完成电转后,用试剂盒提供的吸管取500ul预热的培养基加入电转杯底部略吹吸后吸出细胞,加至已加入1ml预热培养基的6孔板中,继续培养24h。
(二)加压筛选及稳定单克隆细胞株分离培养
(1)转染后24h,加入潮霉素选择培养基,筛选3周,每3-4天更换一次选择培养基;
(2)待对照组细胞全死,筛选完成。计数,选择培养基稀释至30个细胞/15ml,150ul/孔铺至u-96孔板;
(3)用选择培养基培养2周,显微镜下观察,挑选有单克隆生长的细胞孔,并转移至24孔板,1周后再传至6孔板扩大培养。
(三)稳定单克隆细胞株效应功能检测
1.il-2pluc阳性克隆细胞的效应检测
(1)计数jurkatil-2pluc细胞,培养基稀释至200万个细胞/ml;
(2)计数raji细胞,培养基稀释至200万个细胞/ml;
(3)将上述两种稀释好的细胞等体积混匀,按照100ul/孔的密度铺至v底96孔板;
(3)用选择培养基将cd3抗体稀释至终浓度为0.4ug/ml,按照100ul/孔的体积加至上述v底96孔板中,吹吸使其使其与细胞混匀;
(4)细胞于二氧化碳培养箱中培养6h;
(5)3000rpm离心5min,吸去细胞上清,50ul/孔加入裂解液glo-lysis,室温裂解5min;
(6)吸取10ul细胞裂解物转入白色384孔板,加入萤光素酶底物bright-gloluciferaseassaysystem10ul/孔,反应5min,检测萤光素酶活性。
cd3抗体和raji共刺激细胞后使细胞被激活而表达il-2,与无刺激的对照组比较,il-2表达量明显增高,说明cd3抗体和raji共刺激可以激活该稳定细胞株使其表达il-2,同步刺激报告基因萤光素酶的表达见图4。选取10个潮霉素抗性的单细胞克隆(分别编号为1,2,3,4,5,6,7,8,9,10),各加入cd3抗体和raji细胞共刺激6小时后,测试萤光素酶活性.从图4测试结果中可见所挑选的10个克隆相对无刺激对照组均明显被激活,其中6号克隆萤光素酶活性值最高,表明6号克隆响应最灵敏。在后续实验中选取6号克隆进行测试。
2.nfatluc阳性克隆细胞的效应检测
(1)计数pdl1-cd3过表达细胞,培养基稀释至100万个细胞/ml,按50ul/孔接入96孔u底板;
(2)样品稀释:在96孔细胞板上,将pd-1单克隆抗体nivolumab按400μg/ml进行4倍梯度稀释,共10个稀释度。每个梯度3个复孔,稀释好样品后,按50μl/孔体积加入到dc细胞中。
(3)计数jurkatnfatluc药物抗性单克隆细胞,培养基稀释至100万个细胞/ml;每孔加入细胞悬液100μl,37℃,5%co2培养6小时。
(4)3000rpm离心5min,吸去细胞上清,50ul/孔加入裂解液glo-lysis,室温裂解5min;
(5)吸取10ul细胞裂解物转入白色384孔板,加入萤光素酶底物bright-gloluciferaseassaysystem10ul/孔,反应5min,检测萤光素酶活性。
将表达pd-l1和cd3抗体细胞和表达pd-1的jurkat细胞混合孵育在一起,模拟体内t细胞激活“双信号”系统,在加入pd-1单克隆抗体后,解除了pd-1/pd-l1共抑制信号对t细胞激活的抑制,nfat驱动的萤光素酶活性增强(图5)。选取4个潮霉素抗性的单细胞克隆(分别编号为1,2,3,4),测试4个克隆对不同浓度的pd-1单克隆抗体的响应,测试结果显示4号克隆对pd-1单克隆抗体响应曲线最好,其灵敏度和相关性较其他3个克隆均好。在后续实验中选取响应最好的4号克隆进行测试。
实施例3:t细胞活化剂生物活性的测试
1.ctla4-fc融合蛋白生物活性的测试
将筛选得到的il2和萤光素酶活性正相关的il-2pluc阳性细胞株,选取6号克隆进行后续实验。根据细胞密度为10万个/孔,ctla4-fc起始浓度为67ug/ml,10倍倍比系列稀释13个梯度,共14个浓度点。ctla4-fc作用6小时检测萤光素酶活性。
如图6所示,加入梯度稀释的ctla4-fc融合蛋白后,随着ctla4-fc浓度的增大,萤光强度逐渐减小,即il-2表达量逐渐减少,可见随着ctla4-fc浓度的增加,抑制t细胞活化的活性增强,表明该体系可用于定量检测t细胞活化调节剂如ctla4-fc的生物学活性。
2.pd-1单克隆抗体或pd-l1单克隆抗体生物活性的测试
将筛选得到的nfat-luc阳性细胞株,选取4号克隆进行后续实验。调整靶细胞密度为10万个/ml,其中每孔细胞效靶比为2:1,效应细胞10万个,靶细胞数目为5万个,然后加入pd-1单克隆抗体或pd-l1单克隆抗体。pd-1单克隆抗体或pd-l1单克隆抗体起始浓度为400ug/ml,4倍倍比系列稀释9个梯度,共10个浓度点。pd-1单克隆抗体或pd-l1单克隆抗体作用6小时检测萤光素酶活性。
如图7所示加入梯度稀释的pd-1单克隆抗体后,随着抗体浓度的增大,萤光强度逐渐增强,即激活t细胞能力增强,表明pd-1单克隆抗体加入到该体系后,解除pd-1/pd-l1对t细胞激活的抑制,使得t细胞被激活。同时表明所建立的测试体系可应用来测试pd-1单克隆抗体的生物活性。加入梯度稀释的pd-l1单克隆抗体后,随着抗体浓度的增大,萤光强度逐渐增强,即激活t细胞能力增强,表明pd-l1单克隆抗体加入到该体系后,解除pd-1/pd-l1对t细胞激活的抑制,使得t细胞被激活。同时表明所建立的测试体系可应用来测试pd-l1单克隆抗体的生物活性。
实施例4:方法学的验证
采用同型无关igg作为阴性对照,评估该方法的特异性。如图8所示,加入同型无关igg,未观察到t细胞活化的抑制,加入ctla4-fc融合蛋白后,t细胞活化被显著抑制,表明此方法体系可特异响应测试ctla4-fc融合蛋白的生物学活性。并且我们采用不同代次(分别为13代、25代、40代)的睡美人转座子系统介导的il-2p-luc稳定细胞株jurkat,评价该细胞株代次对活性测试的稳定性影响,如图9所示,采用睡美人转座子介导的不同代次的的细胞株测试结果非常稳定,可用于后续的药物活性评价和批次质量放行。
对于本领域的普通技术人员而言,具体实施例只是对本发明进行的示例性描述,显然本发明具体实现并不受上述方式的限制,凡是采用了本发明的方法构思和技术方案进行的各种非实质性的改进,或未经改进将本发明的构思和技术方案直接应用于其他场合的,均在本发明的保护范围之内。
序列表
<110>北京东方百泰生物科技有限公司.
<120>一种新型t细胞免疫调节剂生物活性检测方法.
<141>2017-12-01
<160>5
<170>siposequencelisting1.0
<210>1
<211>221
<212>dna
<213>人工序列(tanichthysalbonubes)
<400>1
aagtcggaagtttacatacacttaagttggagtcattaaaactcgtttttcaactactcc60
acaaatttcttgttaacaaacaatagttttggcaagtcagttaggacatctactttgtgc120
atgacacaagtcatttttccaacaattgtttacagacagattatttcacttataattcac180
tgtatcacaattccagtgggtcagaagtttacatacactaa221
<210>2
<211>227
<212>dna
<213>人工序列(tanichthysalbonubes)
<400>2
tgagtgtatgtaaacttctgacccactgggaatgtgatgaaagaaataaaagctgaaatg60
aatcattctctctactattattctgatatttcacattcttaaaataaagtggtgatccta120
actgacctaagacagggaatttttactaggattaaatgtcaggaattgtgaaaaagtgag180
tttaaatgtatttggctaaggtgtatgtaaacttccgacttcaactg227
<210>3
<211>1029
<212>dna
<213>人工序列(homosapiens)
<400>3
gccaccatgggaaaatcaaaagaaatcagccaagacctcagaaaaaaaattgtagacctc60
cacaagtctggttcatccttgggagcaatttccaaacgcctgaaagtaccacgttcatct120
gtacaaacaatagtacgcaagtataaacaccatgggaccacgcagccgtcataccgctca180
ggaaggagacgcgttctgtctcctagagatgaacgtactttggtgcgaaaagtgcaaatc240
aatcccagaacaacagcaaaggaccttgtgaagatgctggaggaaacaggtacaaaagta300
tctatatccacagtaaaacgagtcctatatcgacataacctgaaaggccgctcagcaagg360
aagaagccactgctccaaaaccgacataagaaagccagactacggtttgcaagagcacat420
ggggacaaagatcgtactttttggagaaatgtcctctggtctgatgaaacaaaaatagaa480
ctgtttggccataatgaccatcgttatgtttggaggaagaagggggaggcttgcaagccg540
aagaacaccatcccaaccgtgaagcacgggggtggcagcatcatgttgtgggggtgcttt600
gctgcaggagggactggtgcacttcacaaaatagatggcatcatgaggaaggaaaattat660
gtggatatattgaagcaacatctcaagacatcagtcaggaagttaaagcttggtcgcaaa720
tgggtcttccaacaagacaatgaccccaagcatacttccaaacacgtgagaaaatggctt780
aaggacaacaaagtcaaggtattggagtggccatcacaaagccctgacctcaatcctata840
gaaaatttgtgggcagaactgaaaaagcgtgtgcgagcaaggaggcctacaaacctgact900
cagttacaccagctctgtcaggaggaatgggccaaaattcacccaacttattgtgggaag960
cttgtggaaggctacccgaaacgtttgacccaagttaaacaatttaaaggcaatgctacc1020
aaatactag1029
<210>4
<211>375
<212>dna
<213>人工序列(homosapiens)
<400>4
aaaattttctgagttacttttgtatccccacccccttaaagaaaggaggaaaaactgttt60
catacagaaggcgttaattgcatgaattagagctatcacctaagtgtgggctaatgtaac120
aaagagggatttcacctacatccattcagtcagtctttgggggtttaaagaattccaaag180
agtcatcagaagaggaaaaatgaaggtaatgttttttcagacaggtaaagtctttgaaaa240
tatgtgtaatatgtaaaacattttgacacccccataatatttttccagaattaacagtat300
aaattgcatctcttgttcaagagttccctatcactctctttaatcactactcacagtaac360
ctcaactcctgccac375
<210>5
<211>180
<212>dna
<213>人工序列(homosapiens)
<400>5
ggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgt60
ggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgt120
ggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgt180
- 还没有人留言评论。精彩留言会获得点赞!