一种纳米金的制备方法、纳米金及应用与流程
本发明涉及生物工程技术领域,特别是涉及一种纳米金的制备方法、纳米金及应用。
背景技术:
金是一种稀有的贵金属,化学性质稳定,由于独特的理化特性,其在装饰、电子学、器械、生物医学工程等方面表现出奇特而新颖的作用。
纳米金即指金的微小颗粒,其直径在1~100nm,具有高电子密度、介电特性和催化作用,能与多种生物大分子结合,且不影响其生物活性,因此在催化、生物传感、生物芯片、光学以及生物医学等领域有着广泛的应用。由氯金酸通过还原法可以方便地制备各种不同粒径的纳米金,其颜色依直径大小而呈红色至紫色。
一般而言,纳米材料可通过物理方法、化学方法和生物方法合成。虽然理化方法合成纳米金具有快速、方便、优质等优点,但高成本、高污染、高耗能等弊端也见诸报端,而生物方法具有环保、经济、稳定、高效等优势。
植物的水提物,如香蕉果肉提取物、毛酸浆果肉汁液、甘蔗提取液等,能够绿色合成纳米金。比如公开号为cn106623970a的中国发明专利公开了一种采用香蕉果肉提取物制备尺寸小于5nm纳米金的方法。通过将新鲜去皮的香蕉果肉与去离子水混合(质量比2∶1),充分搅拌离心,取上清液得到香蕉果肉提取物;沸水浴中分别预热香蕉果肉提取物和氯金酸水溶液至96-100℃后,将占反应体系总体积5%~10%的香蕉果肉提取物加入到浓度为0.4~0.5mmol/l氯金酸水溶液中,继续在沸水浴中加热5~30s,然后加入占反应体系总体积0.3%~7%的0.2mol/l氢氧化钠水溶液,在沸水浴中继续加热5~10min,即可得到粒径小于5nm的纳米金颗粒溶液。
与植物相比,细菌生命力强、适应性广、易得、繁殖速度快、代谢物质多。将其作为生物合成剂的重要来源、通过菌体提取物合成纳米金,具有很大的优势。目前,鲜有利用细菌提取物合成纳米金的报道。
技术实现要素:
本发明研究发现耐辐射奇球菌(deinococcusradiodurans)提取物可以用于制备纳米金,耐辐射奇球菌抗逆性强、适应性广,菌体提取物含量丰富、有效成分高,合成的纳米金稳定可控、生物相容性好。
耐辐射奇球菌(deinococcusradiodurans)作为一种极端微生物,生存条件简单、繁殖较快,体内存在着强大的抗氧化系统,由氧化还原酶、小分子抗氧化化合物等多种抗氧化物质组成,能够耐受多种极端环境如电离辐射、氧化压力、uv和干燥等。因此,将耐辐射奇球菌提取物作为合成金属纳米的材料具有普通植物及细菌提取物所不具备的优势。
一种纳米金的制备方法,包括以下步骤:
(1)将耐辐射奇球菌菌体破碎后取上清液制成纳米金合成剂;
(2)纳米金合成剂加入含au3+的溶液进行反应;
(3)收集沉淀并清洗后获得所述纳米金。
优选的,耐辐射奇球菌菌体破碎后取上清液,上清液经冷冻干燥制成纳米金合成剂。
更优选的,冷冻干燥前,将上清液使用硫酸铵进行沉淀,沉淀收集后使用蒸馏水溶解并透析去除多余离子。
优选的,步骤(2)中含au3+的溶液使用氯金酸溶液,其中au3+的浓度为1mm~3mm。
优选的,步骤(2)中反应时间不小于2h,反应温度为25℃~45℃,反应ph为2.5~8.5。
更优选的,步骤(2)中反应时间不小于6h,反应温度为30℃~45℃,反应ph为4~8.5。
进一步优选的,反应温度为37℃,反应ph为7。
优选的,步骤(3)中清洗过程包括:滤膜过滤、再使用蒸馏水洗涤,然后透析去除残留的au3+,清洗后冷冻干燥获得所述纳米金。
本发明还提供了所述制备方法制备的纳米金。通过uv/vis波长扫描,本发明纳米金在545nm位置附近有峰值的出现;通过eds能谱分析,本发明纳米金在2.12kev位置有明显的特征峰。
本发明还提供了所述的纳米金在作为药物载体或生物传感器中的应用。本发明纳米金经实验验证基本无细胞毒性,具有较好的生物相容性。
本发明使用耐辐射奇球菌的提取物来制备纳米金,可以高效、绿色、方便地合成纳米金,,合成出的纳米金纯度好、大小适中(约51.72nm)、表面带负电而且基本无细胞毒性,用耐辐射奇球菌提取物作为合成金属纳米的材料金具有普通植物及细菌提取物所不具备的优势。纳米金合成剂来源于生存条件简单、繁殖较快、抗逆性强、适应性广的耐辐射奇球菌,菌体提取物含量丰富、有效成分高;耐辐射奇球菌之所以够耐受多种极端环境如电离辐射、氧化压力、uv和干燥,一定程度上是因为体内存在着强大的抗氧化系统,由氧化还原酶、小分子抗氧化化合物等多种抗氧化物质组成,而这些物质是制备纳米金的关键物质。
附图说明
图1为本发明纳米金合成剂和纳米金的外观图,其中图a为纳米金合成剂;图b为纳米金颗粒;图c为溶液状态的纳米金。
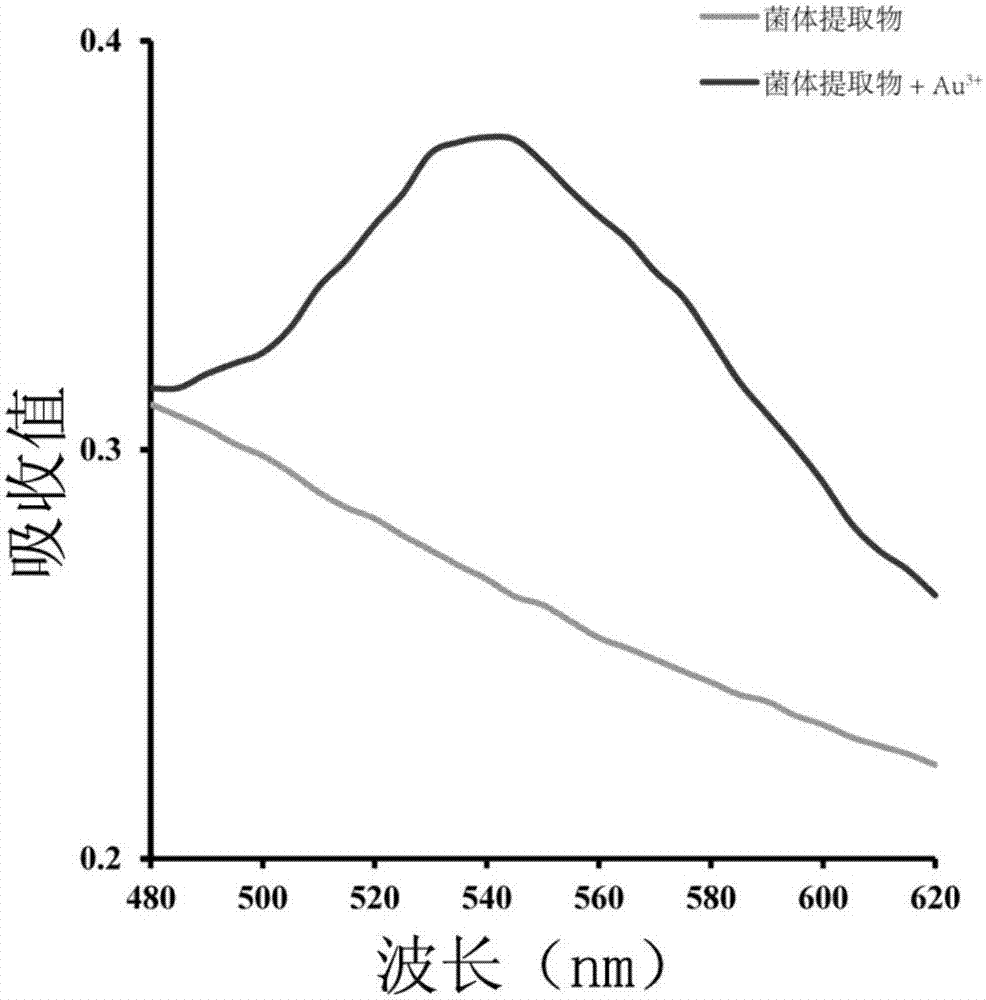
图2为纳米金制备反应后uv/vis波长扫描结果图。
图3为纳米金透射电镜检测结果图。
图4为纳米金扫描电镜-能谱分析结果图,其中图a为扫描电镜结果图;图b为图a中au元素的分布图;图c为图a中各元素的鉴定图。
图5为纳米金的x射线衍射分析结果图。
图6为纳米金的动态光散射分析结果图。
图7为不同反应条件下纳米金制备的筛选比较结果图,其中图a为反应时间筛选;图b为au3+浓度筛选;图c为反应温度筛选;图d为反应ph筛选。
具体实施方式
菌株:耐辐射奇球菌(deinococcusradiodurans),购买自美国模式菌种保藏中心(atcc),保藏号为atcc13939。
tgy培养基:5g蛋白胨、3g酵母粉和1g葡萄糖溶于1l水中,后于高压灭菌锅中121℃灭菌20min。
tgy固体培养基:在tgy培养基的基础上增加15g/l琼脂。
实施例1
细菌培养及纳米金合成剂制备。
(1)细菌培养:将保藏号为atcc13939的耐辐射奇球菌涂板活化培养,然后挑取单菌落接种于5mltgy培养基中,用摇床在32℃的条件过夜培养,摇床转速为220rpm;然后按1∶100的比例转接到大瓶培养基(内含500mltgy培养基的1l培养瓶),于32℃、220rpm的条件下培养24h使细菌培养至稳定期(od600nm=1.0)。
(2)收集、洗涤菌体:细菌培养至稳定期后,在8000g,10min的条件下离心收集,得到新鲜菌体。通过ph为7.0的0.01m的磷酸缓冲液将其重悬浮,充分震荡,再8000g,10min离心,收集菌体。
(3)破碎菌体和制备菌体提取物:用磷酸缓冲液重悬浮收集到的菌体,并通过低温高压细胞破碎仪对其破碎(3min,4℃,1200bar)。结束后,10000g,30min离心,去除未破碎的细胞或残渣,收集上清液,4℃保存提取物。
(4)收集菌体提取物:将上述收集的提取物置于-20℃条件下10h,后置于-80℃的条件下10h,收集冰冻的菌体提取物并置于冷冻干燥机中,在-50℃的温度下干燥28h。从冷冻干燥机中取出提取物,收集得到的粉末状物质,即为基于au3+溶液的纳米金合成剂。
实施例2
细菌培养及纳米金合成剂制备。
(1)细菌培养:将保藏号为atcc13939的耐辐射奇球菌涂板活化培养,然后挑取单菌落接种于5mltgy培养基中,用摇床在30℃的条件过夜培养,摇床转速为220rpm;然后按1∶100的比例转接到大瓶培养基(内含500mltgy培养基的1l培养瓶),于30℃、220rpm的条件下培养24h使细菌培养至稳定期(od600nm=1.0)。
(2)收集、洗涤菌体:细菌培养至稳定期后,在8000g,10min的条件下离心收集,得到新鲜菌体。通过ph为7.0的0.01m的磷酸缓冲液将其重悬浮,充分震荡,再8000g,10min离心,收集菌体。
(3)破碎菌体和制备菌体提取物:用磷酸缓冲液重悬浮收集到的菌体,并通过低温高压细胞破碎仪对其破碎(3min,4℃,1200bar)。结束后,10000g,30min离心,去除未破碎的细胞或残渣,收集上清液,并加入80%(w/v)的固体硫酸铵进行24h盐析,8000g,30min离心收集沉淀,并用蒸馏水将其溶解,再用蒸馏水24h透析除去溶液中的离子后,4℃保存提取物。
(4)收集菌体提取物:将上述收集的提取物置于-20℃条件下10h,后置于-80℃的条件下10h,收集冰冻的菌体提取物并置于冷冻干燥机中,在-50℃的温度下干燥28h。从冷冻干燥机中取出提取物,收集得到的粉末状物质,即为基于au3+溶液的纳米金合成剂(图1a)。
实施例3
纳米金制备。
(1)配制合成反应液:将1mmau3+溶液(氯金酸,haucl4·3h2o)于50ml的离心管中,加入适量的耐辐射奇球菌提取物干粉(实施例1制备,未经硫酸铵处理),使其浓度为3.00mg/ml,在室温(ph7,25℃)条件下使其充分混合、反应。
(2)监测反应过程:随着反应的进行,溶液颜色发生变化,逐渐变紫后趋于稳定,反应6h后进行波长扫描(545nm处有峰值)。
(3)纯化纳米金溶液:用0.22μm针头式过滤器过滤上述呈紫色的溶液,15000g,30min离心,收集沉淀,蒸馏水数次洗涤后,用截留量14kd的透析袋透析24h以除去残存的au3+等,再次收集溶液。
(4)收集纳米金:将收集的溶液置于-20℃、12h,然后置于-80℃、12h,然后将冰冻的溶液置于冷冻干燥机中,温度为-50℃,干燥24h。将干燥物从冷冻干燥机中取出,得到的紫色物质即为纳米金颗粒。40ml的溶液共得到纳米金颗粒0.23g。
实施例4
纳米金制备。
(1)配制合成反应液:将1mmau3+溶液(氯金酸,haucl4·3h2o)于50ml的离心管中,加入适量的耐辐射奇球菌提取物干粉(实施例2制备,经硫酸铵处理),使其浓度为3.00mg/ml,在ph7,37℃条件下使其充分混合、反应。
(2)监测反应过程:随着反应的进行,溶液颜色发生变化,逐渐变紫后趋于稳定,反应6h后进行波长扫描(545nm处有峰值)。
(3)纯化纳米金溶液:用0.22μm针头式过滤器过滤上述呈紫色的溶液,15000g,30min离心,收集沉淀,蒸馏水数次洗涤后,用截留量14kd的透析袋透析24h以除去残存的au3+等,再次收集溶液,获得溶液状态下的纳米金(图1c),通过uv/vis波长扫描(480-620nm),在545nm位置附近有峰值的出现,标志着纳米金颗粒的形成(图2)。
(4)收集纳米金:将收集的溶液置于-20℃、12h,然后置于-80℃、12h,然后将冰冻的溶液置于冷冻干燥机中,温度为-50℃,干燥28h。将干燥物从冷冻干燥机中取出,得到的紫色物质即为纳米金颗粒(图1b)。40ml的溶液共得到纳米金颗粒0.17g。
实施例5
实施例4制备的纳米金颗粒,进行检测。
图3为tem(透射电镜)检测结果图,箭头所指为纳米金颗粒(下同),经测量平均大小约为51.72nm。
图4为sem-edxa(扫描电镜-能谱分析)的结果,其中图4a是扫描电镜的结果图,图4b是图4a中au元素的分布图,图4c是对图4a中各元素的鉴定图,在2.12kev位置有极强的纳米金特征峰的出现,表明该合成剂可以高效合成纳米金。
图5为xrd(x射线衍射)分析结果,布拉格衍射峰有38.12°、44.32°、64.54°、77.54°及81.64°的衍射峰分别对应于面心立方金的(111)、(200)、(220)、(311)及(222)的晶面,无杂质峰,表明该合成剂合成的纳米金为纯净的晶体结构。
图6为dls(动态光散射)分析结果,展示了溶液状态纳米金的粒径分布以及近单分散体系,其平均大小为94.63±1.97nm(由于动态光散射和电镜的测量原理不同,两者测出的粒径大小会有差异,一般前者的结果要大于后者)。
实施例6
对实施例4制备的纳米金颗粒的特性进行评估,步骤如下:
a.配制纳米金溶液:将10mg纯化的纳米金颗粒溶于80ml的蒸馏水,使其浓度为125μg/ml,备用。
b.培养细胞:将mcf-10a细胞(人乳腺正常细胞)在10%fbs+dmem+100u/ml青霉素+0.1mg/ml链霉素的培养基中及5%co2、37℃的条件下培养,密度达到5×103cells/ml后,用细胞消化液(0.5%胰蛋白酶:edta=1∶1,v/v)收集细胞备用。
c.检测纳米金的细胞毒性:向上述的细胞中添加10%的纳米金溶液,使其终浓度为12.5μg/ml,培养24h后,加入20%mts孵育2h,利用多功能酶标仪(spectramaxm5)测量od490nm。
d.评价纳米金:耐辐射奇球菌提取物合成的纳米金对mcf-10a细胞基本无毒性(细胞存活率为95.50%左右),可以在生物传感器等领域应用。
实施例7
对实施例4制备的纳米金颗粒的特性进行评估,步骤如下:
a.配制纳米金溶液:将10mg纯化的纳米金颗粒溶于20ml的蒸馏水,使其浓度为500μg/ml,备用。
b.培养细胞:将nrk细胞(大鼠肾细胞)在10%fbs+dmem+100u/ml青霉素+0.1mg/ml链霉素的培养基中及5%co2、37℃的条件下培养,密度达到5×103cells/ml后,用细胞消化液(0.5%胰蛋白酶:edta=1∶1,v/v)收集细胞备用。
c.检测纳米金的细胞毒性:向上述的细胞中添加10%的纳米金溶液,使其终浓度为50μg/ml,培养24h后,加入20%mts孵育2h,利用多功能酶标仪(spectramaxm5)测量od490nm。
d.评价纳米金:耐辐射奇球菌提取物合成的纳米金对nrk细胞基本无毒性(细胞存活率为99.43%左右),表现出较好的生物相容性,可以在生物医学领域用作药物载体等。
实施例8
检测不同的条件如反应时间、au3+浓度、温度和ph对纳米金粒径大小、合成效率的影响。通过uv/vis波长扫描,在545nm位置附近有峰值的出现,标志着纳米金颗粒的形成;峰值位置的变化表明颗粒大小的不同、峰值的高低表明合成的纳米金浓度的不同。
使用浓度为3.00mg/ml的纳米金合成剂(实施例2制备,经硫酸铵处理)按实施例4中方法制备纳米金,每次改变其中一个参数,具体实验设置如表1所示。其中,纳米金合成剂的使用浓度与au3+使用浓度的影响效果近似等同,所以,如果降低纳米金合成剂的使用浓度则相应增加au3+使用浓度,增加纳米金合成剂的使用浓度则相应减少au3+使用浓度。
表1
结果如图7所示,编号1~4组实验将浓度为3.00mg/ml的纳米金合成剂与终浓度为1mm的au3+溶液均匀混合后在室温(25℃)条件下反应,每间隔一定时间利用多功能酶标仪(spectramaxm5)进行波长扫描(450-650nm),该合成剂在反应6h左右后,545nm位置的峰值趋于稳定,即达到反应平衡,其效率较高于菌体本身(图7a)。编号5~8组实验将3.00mg/ml的纳米金合成剂分别与终浓度为0、1、3、5mm的au3+溶液均匀混合,在室温条件下反应6h,利用多功能酶标仪(spectramaxm5)进行波长扫描,结果au3+在一定浓度内时纳米金合成能力较高(3mm)、粒径大小改变,au3+过高(5mm)则反而不利于纳米金的合成(图7b)。编号9~12组实验将浓度为3.00mg/ml的合成剂与终浓度为1mmau3+的溶液混合后分别在25℃、30℃、37℃、45℃,ph7的条件下反应6h后,利用多功能酶标仪(spectramaxm5)进行波长扫描,结果在37℃时合成能力较高、45℃时粒径较小(图7c)。编号13~16组实验用hcl溶液、naoh溶液将浓度为3.00mg/ml的合成剂与终浓度为1mmau3+的溶液的ph调节至2.5、4、7、8.5,在37℃的条件下反应6h后,利用多功能酶标仪(spectramaxm5)进行波长扫描,结果在中性条件下合成能力较高、粒径较小(图7d)。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于金属表面制备镍纳米线的电镀装置的制造方法
- 一种沥青基硬炭纳米片的制备方法及其应用
- 一种掺氧GeSb纳米相变薄膜及其制备方法和应用
- 一种上引连续ecap拉拔制备纳米高强度铜扁线的方法
- 一种热生长Al<sub>2</sub>O<sub>3</sub>或Cr<sub>2</sub>O<sub>3</sub>膜型M?Cr?Al纳米复合镀层及制备和应用
- 一种生物纳米复合汽油燃料及其制备方法
- 一种用于防治雾霾的耐膨胀纳米建筑材料及其制备方法
- 一种纳米硼化铬增强的瓷砖及其制备方法
- 纳米防尘自洁表层结构及其制备方法
- 一种Zn<sub>3</sub>(OH)<sub>2</sub>V<sub>2</sub>O<sub>7</sub>·2H<sub>2</sub>O纳米片的制备方法