一种产生多种单糖产物的内切型双功能褐藻胶裂解酶Aly2及其编码基因与应用的制作方法
本发明涉及一种产生多种单糖产物的内切型双功能褐藻胶裂解酶aly2及其编码基因与应用,属于基因工程技术领域。
背景技术:
褐藻胶是重要的酸性多糖,由β-d-甘露糖醛酸(β-d-mannuronate,m))和α-l-古罗糖醛酸(α-l-guluronate,g)以交替排列的顺序通过β-1,4糖苷键连接形成的线性阴离子多糖。在褐藻胶分子内,这两种糖单元通常随机排列组合成聚甘露糖醛酸(polymannuronate,pm)、聚古罗糖醛酸(polyguluronate,pg)或甘/古交替嵌段[1]。天然褐藻胶主要来自巨藻、马尾藻、海带等药食同源的大型海洋褐藻。作为海洋褐藻的结构组分,褐藻胶的含量可达干重的40%以上。此外,一些细菌,如铜绿假单胞菌,棕色固氮菌等能合成并分泌具有乙酰基修饰的褐藻胶[2]。
褐藻胶因其无毒、无害、吸水成胶的特性被广泛用于食品、化工和医药等行业。近期,越来越多的证据表明褐藻胶寡糖具有重要生物活性,如抗肿瘤、抗凝血、抗细菌,调节细胞凋亡、神经炎症、血糖血脂等。以源自褐藻胶的聚甘露糖醛酸片段制备的一类候选新药“971”能够抑制β样淀粉细胞的聚集,目前已经进入抗阿兹海默症临床研究三期阶段;另有研究表明,聚古罗糖醛酸寡糖与抗生素联合作用可以抑制临床致病菌[3]。因此制备含有特定m/g比例和特定聚合度大小的不同褐藻胶寡糖具有重要价值。
褐藻胶裂解酶,通过β-消去反应催化褐藻胶分子内糖苷键的断裂,生成聚合度不同的系列寡糖产物,并在新生成的非还原末端糖环内形成c4=c5不饱和双键,与c5位的c=o双键形成共轭结构,因而寡糖产物在235nm处具有特征吸收。这种不饱和的糖单元,已经不同于原始的m或g糖单元,故称为δ单糖[4]。根据酶的底物选择性,褐藻胶裂解酶可分为g-专一性、m-专一性和m/g兼性(或称双功能)等三大类。按照底物降解模式的不同,大多数的褐藻胶裂解酶是内切酶,在降解褐藻胶时,最终主产物包括不饱和型二糖、不饱和型三糖,以及更大的系列寡糖产物[5];少数一些酶是外切酶,在降解褐藻胶的过程中主产物始终是不饱和型糖单元δ,该产物利于微生物的生长或者向生物能源如乙醇的深度转化[4]。与酸降解、碱降解、氧化降解等化学方法,或者超声、微波降解等物理学方法相比,酶解法制备褐藻胶寡糖的反应有条件温和、易控制及产物结构专一等优点,这使得工具型褐藻胶裂解酶的资源发掘与改造逐渐成为海洋生物资源开发的研究重点之一。
近年来,关于褐藻胶裂解酶的专利申请虽然数量日益增长,但是关于酶的底物降解模式、寡糖生成特性等涉及酶用途和应用价值的深入研究相对较少。2014年中国专利文献zl201410469861.4首次公开了第一个来自flammeovirgayaeyamensismy04的褐藻胶裂解酶algl-5,证明了该酶具有g-专一性,并提供了关于证明该酶是内切酶的研究方法与详细证据。关于algl-5的深入研究(专利文献zl201410469861.4、论文[5])还证明了该酶降解褐藻胶后的主产物是不饱和型二糖、不饱和型三糖、不饱和型四糖、不饱和型五糖等系列寡糖产物,并证实终产物不饱和型二糖基本上是由δg二糖单元组成的。2016年,中国专利文献(申请号201610838337.9)首次公开了来自flammeovirgayaeyamensismy04的第一个双功能的内切型褐藻胶裂解酶aly-1,该专利申请还公开了该酶可用于降解褐藻胶,主要产生不饱和型二糖、不饱和型三糖的重要特征,并证明了不饱和型二糖产物中主要是δg二糖单元;此外,关于aly-1及其截短体蛋白质aly1-t185n的研究(中国专利文献申请号201610838337.9、中国专利文献申请号201710110627.6和研究论文[6])还表明,双功能酶aly1及其核心催化域在降解小聚合度的饱和型寡糖底物如富含m的四糖、五糖或富含g的四糖、五糖时,具有可变的底物降解模式和寡糖生成特性,且m、g和不饱和型二糖是最小的产物形式。但是,目前在关于内切型褐藻胶裂解酶的已有报道中,在寡糖生成特性方面,未发现能够既产生m、g等饱和单糖产物也能产生不饱和型δ单糖产物的内切型褐藻胶裂解酶。
技术实现要素:
本发明针对现有技术的不足,提供一种产生多种单糖产物的内切型双功能褐藻胶裂解酶aly2及其编码基因与应用。
本发明的技术方案如下:
一种内切型双功能褐藻胶裂解酶aly2,氨基酸序列如seqidno.2所示。
上述内切型双功能褐藻胶裂解酶aly2的编码基因,核苷酸序列如seqidno.1所示。
一种重组表达载体,在表达载体中插入了上述内切型双功能褐藻胶裂解酶aly2的编码基因。
上述表达载体选自大肠杆菌表达载体、酵母表达载体、枯草杆菌表达载体、乳酸菌表达载体、链霉菌表达载体、噬菌体载体、丝状真菌表达载体、植物表达载体、昆虫表达载体或哺乳动物细胞表达载体。
一种重组细胞,在细胞中插入了上述内切型双功能褐藻胶裂解酶aly2的编码基因。
上述细胞选自大肠杆菌宿主细胞、酵母菌宿主细胞、枯草杆菌宿主细胞、乳酸菌宿主细胞、放线菌宿主细胞、丝状真菌宿主细胞、昆虫细胞或哺乳动物细胞。
用于表达重组内切型褐藻胶裂解酶raly2的重组细胞,选自大肠杆菌宿主细胞(如escherichiacolibl21、escherichiacolijm109、escherichiacolidh5α等)、酵母菌宿主细胞(如saccharomycescerevisiae、pichiapastoris、kluyveromycesiactis等)、枯草杆菌宿主细胞(如bacillussubtilisr25、bacillussubtilis9920等)、乳酸菌宿主细胞(如lacticacidbacteriac0cc101等)、放线菌宿主细胞(如streptomycesspp.等)、丝状真菌宿主细胞(如trichodermaviride,trichodermareesei,aspergillusniger、aspergillusnidulans等)、昆虫细胞(如bombyxmori,antharaeaeucalypti等)或哺乳动物细胞(如中国仓鼠卵巢细胞cho,幼小仓鼠肾脏细胞bhk、中国仓鼠肺细胞chl等)。
上述内切型双功能褐藻胶裂解酶aly2在降解褐藻胶、制备结构相对均一的不同聚合度寡糖中的应用。
上述内切型双功能褐藻胶裂解酶aly2在降解褐藻胶系列寡糖底物中的应用。
有益效果
1、本发明所述的褐藻胶裂解酶aly2,由火色杆菌属细菌(flammeovirgayaeyamensis)my04的基因组编码,该酶理化性质稳定,降解活性高,具备工业应用的潜质。
2、本发明制备的重组褐藻胶裂解酶raly2对褐藻胶、聚古罗糖醛酸、聚甘露糖醛酸的比活力分别为2025u/mg、3672u/mg和1324u/mg,因此是双功能内切酶,且降解褐藻胶时是内切酶模式、最终的主产物是不饱和二糖和不饱和三糖,因此可应用于医药及食品等领域,具有广阔的应用前景。
3、本发明所述的重组褐藻胶裂解酶raly2,在降解褐藻胶多糖、系列不饱和寡糖片段、系列富含m的饱和型寡糖片段或者系列富含g的寡糖片段时,最小底物是四糖,且最小寡糖产物中包括m、g和δ等所有的三单糖产物形式。
附图说明
图1、内切型双功能褐藻胶裂解酶aly2的蛋白质三维结构模型;
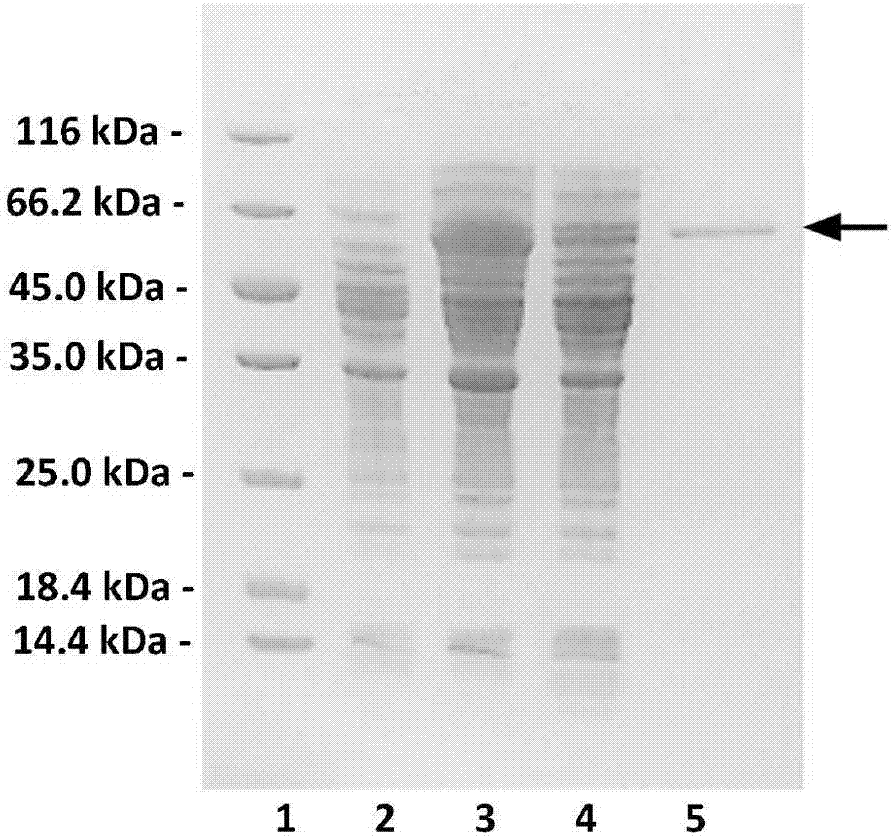
图2、内切型双功能褐藻胶裂解酶aly2表达及纯化情况的聚丙烯酰胺凝胶电泳图(sds-page);
其中:1、蛋白质分子量标准,条带自上至下大小为116kd,66.2kd,45kd,35kd,25kd,18.4kd,14.4kd;泳道2、对照菌株破壁前菌体,上样量6μl,泳道3、重组菌破壁后菌液,上样量6μl,泳道4、重组菌破壁后上清,上样量6μl,泳道5、经镍柱纯化的aly2,上样量6μl。
图3、pη值对内切型双功能褐藻胶裂解酶raly2的活性影响曲线;
图4、温度对内切型双功能褐藻胶裂解酶raly2的活性影响曲线;
图5、温度对内切型双功能褐藻胶裂解酶raly2的稳定性影响曲线;
图6、金属离子对内切型双功能褐藻胶裂解酶raly2活性的影响柱形图;
图7、内切型双功能褐藻胶裂解酶raly2降解褐藻胶所得终产物的hplc分析图;
图中:1:不饱和三糖,2:不饱和二糖;alg:褐藻胶,pg:聚古罗糖醛酸,pm:聚甘露糖醛酸
图8、内切型双功能褐藻胶裂解酶raly2不同时间降解褐藻胶多糖所得产物的hplc分析图;
图中:1:不饱和八糖,2:不饱和七糖,3:不饱和六糖;4:不饱和五糖,5:不饱和四糖,6:不饱和三糖,7:不饱和二糖;
图9、内切型双功能褐藻胶裂解酶raly2降解用ralgl-5所制备不饱和寡糖的hplc分析图;
图中:1:不饱和五糖,2:不饱和四糖,3:不饱和三糖;4:不饱和二糖;a:raly2降解不饱和五糖的hplc产物分析图;b:raly2降解不饱和四糖的hplc产物分析图;
图10、内切型双功能褐藻胶裂解酶raly2降解褐藻胶所制备不饱和型寡糖最终主产物的质谱(ms)分析图;
图中:udp2:不饱和二糖,udp3:不饱和三糖;
图11、内切型双功能褐藻胶裂解酶raly2降解褐藻胶所制备不饱和型寡糖最终主产物的核磁共振分析图;
图中:udp2:不饱和二糖,udp3:不饱和三糖;
图12、内切型双功能褐藻胶裂解酶raly2降解系列富含m的饱和型寡糖片段的hplc分析图;
图中:1:不饱和四糖;2:不饱和三糖;3:不饱和二糖;
图13、内切型双功能褐藻胶裂解酶raly2降解系列富含g的饱和型寡糖片段的hplc分析图;
图中:1:不饱和四糖;2:不饱和三糖;3:不饱和二糖。
具体实施方式
以下实施例的阐述,是为了全面公开本发明如何实施的一些常用技术,而不是为了限制本发明的应用范围。发明人已经尽最大努力确保实施例中个参数的准确性(例如量,温度,等等),但是一些实验误差和偏差也应该予以考虑。除非另有说明,本发明中分子量是指重均分子量,温度是摄氏度。
生物材料来源
火色杆菌(flammeovirgayaeyamensis)my04菌株购自中国微生物菌种保藏管理委员会普通微生物中心,保藏编号cgmccno.2777,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏日期2008年11月27日。
实施例1、火色杆菌(flammeovirgayaeyamensis)my04菌株基因组dna的提取
将火色杆菌(flammeovirgayaeyamensis)my04接种至液体培养基中,在28℃、200rpm的条件下,振荡培养至od600为1.2;取培养菌液10ml,在12,000rmp条件下离心25min,收集菌体沉淀,用10ml的溶菌酶缓冲液(10mmtris-hclph8.0)洗涤,在12,000rpm条件下离心25min,收集菌体沉淀。
上述液体培养基每升组分如下:
胰蛋白胨10g、酵母提取物5g、nacl30g,水定容至1l,ph值为7.2。
上述菌体沉淀中,每管加入溶菌酶缓冲液6.0ml,得到约7.0ml的菌液,分别加入浓度为20mg/ml的溶菌酶各280μl,其终浓度约800μg/ml;冰浴1.0h后,37℃温浴2h,至溶液粘稠;加入100mg/ml的sds0.41ml,100mg/ml的蛋白酶k溶液30μl,52℃水浴1.0h;加入tris-平衡过的酚/氯仿/异戊醇(体积比25:24:1)7.5ml,轻轻颠倒混匀,至充分乳化;10,000g、4℃条件下离心10min,转移上清,加入1.0ml的naac-hac(ph5.2,3.0m)缓冲液,以及8.5.0ml的无水乙醇,混匀;用1.0ml的枪头挑出丝状dna,转移至1.5ml的ep离心管中,以体积百分比70%乙醇溶液(贮于-20℃),洗涤2次,微离心后弃上清;10,000g、4℃条件下离心3min,彻底弃掉上清;样品于无菌工作台中,酒精灯下风吹干燥;用无菌去离子水重悬溶解dna样品,4℃过夜,得到大分子量基因组dna。
实施例2、火色杆菌(flammeovirgayaeyamensis)my04菌株基因组扫描及其序列分析。
将实施例1制得的大分子量基因组dna进行测序(美吉生物公司)。用ncbi(nationalcenterforbiotechnologyinformation,http://www.ncb1.nlm.nih.gov/)上的软件对测序结果进行分析。所用到的ncbi分析软件是openreadingframefinder(orffinder,http://www.ncb1.nlm.nih.gov/gorf/gorf.html)和basiclocalalignmentsearchtool(blast,http://blast.ncbi.nlm.nih.gov/blast.cgi)。
ncbi分析结果显示火色杆菌(flammeovirgayaeyamensis)my04菌株基因组上携带一个褐藻胶裂解酶基因aly2,该基因编码区长1620bp,其核苷酸序列如seqidno.1所示。基因aly2所编码的褐藻胶裂解酶aly2共含有539个氨基酸,其氨基酸序列如seqidno.2所示。用blast软件在线分析,结果显示aly2与corynebacteriumsp.的全基因组序列中polyguluronate-specificlyase基因所编码的由256氨基酸组成的褐藻胶裂解酶(ncbi序列号:baa83339.1)有30%的同源性;与中国专利文献申请号201610838337.9、中国专利文献申请号201710110627.6和研究论文[6]所述的flammeovirgayaeyamensismy04菌株的双功能褐藻胶裂解酶aly1具有46%的序列一致性。蛋白质aly2中n端含有碳水化合物结合域cmb_4_9,c端含有褐藻胶裂解酶超级家族2中保守结构域。
用在线软件expasy分析aly2蛋白,结果显示蛋白的理论分子量约为60.58kda,理论等电点为9.14。用simplemodulararchitectureresearchtool(smart,http://smart.embl_heidelberg.de/)和signalp4.0在线分析褐藻胶裂解酶aly2的结构信息,结果显示n端第1至第26个氨基酸是信号肽序列,用swiss-model同源建模服务器(http://swissmodel.expasy.org)对内切型双功能褐藻胶裂解酶aly2的蛋白质三维结构进行同源建模,最终得到的aly2蛋白质三维结构模型,如图1所示。
实施例3、aly2的基因在大肠杆菌中的重组表达
以实施例1制得的大分子量基因组dna为模板,进行pcr扩增。
引物如下:
正向引物30aaly2-f:5’-cggatcccaacaacctatcgttattgtaaac-3’(bamhi);
反向引物30aaly2-r:5’-gctcgagttttatttggtgtataagtggtttttaac-3’(xhoi);
正向引物下划线标注的是限制性内切酶bamhi,反向引物下划线标注的是限制性内切酶xhoi位点。primerstarhsdna聚合酶购自宝生物公司,pcr反应体系按照公司提供的产品说明操作。
pcr反应条件:95℃预变性4min;95℃变性40s,60℃退火40s,72℃延伸2min,30个循环;72℃延伸10min,4℃稳定15min。
将pcr产物用bamhi和xhoi双酶切,琼脂糖凝胶电泳回收酶切的pcr产物。将购于美国novagen公司的产物pet-30a载体用bamhi和xhoi双酶切,琼脂糖凝胶电泳回收酶切载体大片段。bamhi和xhoi均购于宝生物公司,酶与底物反应的体系、温度和时间均按照公司提供的产品说明操作。
将经过双酶切的pcr产物与同样经过双酶切pet-30a载体连接,连接产物转化大肠杆菌dh5α菌株后涂布于含有50μg/ml卡那青霉素的luria-bertani培养基固体平板(按常规技术配制)上,37℃培养14h,挑取单克隆;将单克隆接入含有50μg/ml卡那青霉素的液体luria-bertani培养基(按常规技术配制)中培养,提取质粒;将质粒用正向引物30aaly2-f和反向引物30aaly2-r进行菌液pcr验证,结果得到大小正确的扩增产物,初步证明构建的重组质粒正确;重组质粒测序结果表明,在pet-30a的bamhi和xhoi酶切位点之间插入seqidno.1所示的基因aly2,且插入方向正确,所以进一步证明构建的重组质粒正确,将该重组质粒命名为pet30a-aly2。
将pet30a-aly2转化大肠杆菌菌株bl21(de3)(购自美国novagen公司),然后按照该公司提供的操作步骤进行重组褐藻胶裂解酶raly2的诱导表达。并用nisepharose6fastflow(ge)凝胶对raly2进行纯化,纯化条件按照ge公司的产品手册操作。用13.2%聚丙烯酰胺凝胶电泳检测重组褐藻胶裂解酶raly2的纯化情况,结果如图2所示,纯化后的重组褐藻胶裂解酶raly2在电泳胶上呈单一条带,且位置与预测的分子量相吻合。
实施例4、重组褐藻胶裂解酶raly2的酶学性质分析
ph和温度对酶活性的影响
将质量浓度为1%的褐藻酸钠、raly2酶液、不同ph值的150mmhac-naac、nah2po4-na2hpo4、tris-hcl缓冲液以及水(ph范围为5.0~10.0),按2:1:3:4(体积比)的比例混合后,在40℃反应60min,按紫外分光光度法测酶活力。结果显示raly2在ph6.0时达到最大活力,表明raly2的最适反应ph为6.0(如图3)。
在最适ph下,将质量浓度为1%的褐藻酸钠、raly2酶液、150mmhac-naac缓冲液和水(ph6.0)按2:1:3:4(体积比)的比例混合,分别在不同温度(0℃~100℃)反应60min,按前述的紫外分光光度法测酶活力。结果显示raly2在40℃时达到最大活力,表明raly2的最适反应温度为40℃(如图4)。
所述紫外分光光度法,是测量波长235nm处的光密度值,以每分钟光密度值增加0.1定义为一个酶活单位u,测定酶活力。
温度对酶稳定性的影响
将在0℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃下热处理不同时间后的raly2酶液与质量浓度为1%的褐藻酸钠底物溶液按2:3(体积比)的比例混合,然后在最适温度和最适ph下测定剩余酶活,以不经过热处理的酶液酶活定义为100%相对活力(relativieactivity),结果显示raly2在40℃的温度下,1h后仍具有大于50%活性(如图5),具有一定的热稳定性。
金属离子对raly2活性的影响
将质量浓度为1%的褐藻酸钠、raly2酶液、150mmhac-naac缓冲液以及水按2:1:3:4(体积比)的比例混合后,接着向反应体系中添加不同的金属离子,添加的离子终浓度为5mm,然后在30℃反应60min,按前述的紫外分光光度法测酶活力。对照组为不加任何金属离子时raly2的活性(设定为100%),结果图6所示。实验结果显示,li+,na+,k+,ca2+,mg2+,和mn2+对raly2活性基本无影响,co2+,ni2+,fe2+,cu2+,cr3+,ag+,hg2+,pb2+,fe3+,zn2+等其他离子对酶活呈现抑制作用(图6)。
实施例5、raly2的酶活测定
将质量浓度为1%的褐藻酸钠、raly2酶液、150mmhac-naac缓冲液以及水按2:1:3:4(体积比)的比例混合后,在最适温度和最适ph下反应1~10min,按前述的紫外分光光度法测酶活力,同时用购于康为世纪公司的蛋白质定量试剂盒测定raly2酶液的蛋白含量,结果表明raly2对褐藻酸钠比活为2025u/mg。对聚古罗糖醛酸和聚甘露糖醛酸底物的降解活性按照上述方法测定,结果表明raly2对聚古罗糖醛酸和聚甘露糖醛酸比活分别为3672u/mg,1324u/mg。这说明,aly2与中国专利文献(申请号:201710110627.6)及研究论文[6]所述的aly1相似,都是双功能褐藻胶裂解酶。
实施例6、raly2降解褐藻酸钠降解产物的高效液相色谱(hplc)分析
将质量浓度为1%的褐藻酸钠底物、raly2酶液、150mmhac-naac缓冲液以及水按2:1:3:4(体积比)的比例混合后,在ph6.0,40℃条件下反应,选取不同酶解时间(0、10、30、60min)以及彻底降解的产物进行hplc分析。hplc分析条件为:分子凝胶柱:superdexpeptide10/300gl(ge);流动相:0.2m碳酸氢铵;流速:0.4ml/min;检测条件:uv235nm。
结果如图7和图8所示,图7表明raly2可以将褐藻酸钠彻底降解,终产物主要为不饱和二糖和不饱和三糖。对褐藻酸钠的时间梯度降解试验和彻底降解表明,随着降解时间的延长,具有235nm特征吸收的寡糖产物聚合度随时间的增加而降低,最终转变成不饱和二糖和三糖(图8)。该结果初步表明aly2属于内切型褐藻胶裂解酶。
实施例7、raly2降解不饱和寡糖的产物分析
按照专利文献zl201410469861.4所述,将20mg褐藻酸钠用重组酶ralgl-5的酶液进行不完全降解,样品分批过分子凝胶柱superdexpeptide10/300gl(ge),并根据出峰时间分别收集不饱和五糖和不饱和四糖,配制底物溶液。按照实施例6所述比例与raly2酶液、缓冲液混合后反应。结果如图9所示:不饱和五糖可以被raly2降解产生一系列不饱和寡糖,包括不饱和二糖到不饱和四糖;不饱和四糖可以被raly2降解产生不饱和二糖、不饱和三糖。由于不饱和单糖不稳定,在非催化条件下可以转化成其它化合物,失去235nm特征吸收,所以检测不到产物的信号。因此,结合各产物的面积积分,计算后推测:不饱和四糖可被raly2降解生成两分子不饱和二糖,或者等摩尔数的不饱和三糖与不饱和单糖。
在已有专利文献zl201410469861.4或论文的报道中,g-专一性褐藻胶裂解酶ralgl-5的最小底物是不饱和五糖,且在降解不饱和五糖时产生等摩尔数的不饱和二糖和不饱和三糖;在降解不饱和四糖时只产生2倍摩尔数的不饱和二糖[5]。同样的,中国专利文献zl201610838337.9、中国专利文献zl201710110627.6和研究论文[6]所述的兼性褐藻胶裂解酶raly-1及其截短体raly1-t185n在降解不饱和四糖时,也不能生成δ。因此,当褐藻胶降解酶aly2降解不饱和寡糖时可以产生不饱和单糖δ,从而为微生物利用褐藻胶作为碳源提供了更好的保障,这是aly2显著区别与所有已知内切型褐藻胶裂解酶的重要特征。
实施例8、raly2降解褐藻酸钠主产物的分子量鉴定
按照实施例6所述,将20mg褐藻酸钠用重组酶raly2的酶液进行彻底降解,样品分批过分子凝胶柱superdexpeptide10/300gl(ge),并根据出峰时间(图7)分别收集不饱和二糖和不饱和三糖,收集的寡糖经过反复冻干三次以上除去碳酸氢铵盐。用无菌去离子水溶解所得寡糖,进行一级质谱分析,以确定各寡糖的相对分子量。
阴离子模式一级质谱结果表明,重组酶raly2降解褐藻酸钠后的最终主产物,对应图7所述的且在235nm处具有特征吸收的两个不饱和寡糖主产物,其esi(-)-ms所显示的质荷比(m/z)分别为351.05和527.08(图10)。这表明,这两个寡糖主产物分别对应着raly2降解褐藻胶之后所产生的不饱和二糖和不饱和三糖。因此,aly2的这一褐藻胶降解模式及寡糖生成特征,与中国专利文献(申请号:201710110627.6)及研究论文[6]所述的褐藻胶裂解酶aly1相似。
实施例9、raly2降解褐藻酸钠主产物的结构鉴定
按照实施例8所述收集raly2降解褐藻酸钠主要终产物不饱和二糖和不饱和三糖集的寡糖,经过反复冻干三次以上除去碳酸氢铵盐,除盐后加入重水d2o进行置换,反复冻干四次,然后进行核磁共振氢谱分析。
所得寡糖产物的一维氢谱数据如图11所示。在不饱和二糖udp2的氢谱图中5.72ppm处的信号对应h-4δg,5.61ppm处的信号对应h-4δm,二者积分面积比为10.53:1,这说明udp2主要为δg,且与δm的摩尔比为10.53:1。在udp3的氢谱图中,h-4δg信号在5.67ppm处,h-4δm信号在5.56ppm处,说明在不饱和三糖中既含有δg末端也含有δm末端,且二者积分面积比是1.49:1,表明二者摩尔比是1.49:1;在3.44和3.53ppm处的信号分别说明δg或δm后面连接着g,因此,说明udp3中δgg和δmg,两者的摩尔量比为1.49:1。
实施例10、raly2降解系列富含m的寡糖片段的产物分析
将质量浓度为1%的富含m的寡糖片段、raly2酶液、150mmhac-naac缓冲液(ph6.0)以及水,按2:1:3:4(体积比)的比例混合后,在40℃条件下反应12h,反应产物进行hplc分析。hplc分析条件为:分子凝胶柱:superdexpeptide10/300gl(ge);流动相:0.2m碳酸氢铵;流速:0.4ml/min;检测条件:uv235nm。
结果如图12所示,重组酶raly2降解m6、m5或m4寡糖12小时后主要产生不饱和二糖,不饱和三糖和不饱和四糖,且不饱和三糖比例最高。raly2降解m5产生不饱和四糖,说明在降解过程中也产生了饱和单糖m,而饱和单糖m因为在235nm处无特征吸收所以检测不到。同样地,raly2降解m4时产生不饱和三糖,说明也有饱和单糖m产生。上述产生饱和单糖m的性质与已经报道的来自同一株菌(flammeovirgayaeyamensis)的褐藻胶裂解酶aly-1[6]相似。
实施例11、raly2降解系列富含g的寡糖片段的产物分析
按照实施例10所述,将质量浓度为1%的富含g的寡糖片段、raly2酶液、150mmhac-naac缓冲液(ph6.0)以及水按2:1:3:4(体积比)的比例混合后,在40℃条件下反应12h,反应产物进行hplc分析。
结果如图13所示,重组酶raly2降解g6、g5或g4寡糖12小时后主要产生不饱和二糖,不饱和三糖和不饱和四糖,且不饱和三糖比例最高,其产物在235nm紫外吸收值明显高于降解富含m的寡糖片段产物的吸收值(图12,图13),再次说明aly2降解富含g的寡糖的活性高于富含m的寡糖的活性。同样地raly2在降解g5产生了不饱和四糖、降解g4时产生了不饱和三糖,说明也产生饱和单糖g。上述产生饱和单糖g的性质与已经报道的来自同一株菌(flammeovirgayaeyamensis)的褐藻胶裂解酶aly-1[6]相似。
结果分析
aly2与现有已经鉴定的来自同一菌株flammeovirgayaeyamensismy04的双功能褐藻胶裂解酶aly1(中国专利文献申请号201710110627.6和研究论文[6])具有最高序列相似性(46%)。在可比条件下,它们的重组酶raly2与raly1具有相似之处,如实施例5、8、10、11,表明他们都是双功能内切型褐藻胶裂解酶,且降解褐藻胶后的最终主产物都是不饱和二糖、不饱和三糖。但是,它们也具有明显的差异,主要表现在:(1)如实施例1所述,最适温度不同,本申请中raly2的最适温度为40℃而raly1的最适温度为50℃;(2)如实施例5所述,raly2对褐藻胶、多聚古罗糖醛酸、多聚甘露糖醛酸的比活力分别为2025u/mg、3672u/mg和1324u/mg,明显高于raly1双功能褐藻胶裂解酶对各个底物的比活力1261u/mg,1162u/mg,122u/mg;(3)如实施例7所述,raly2降解udp5、udp4时可以产生不饱和单糖δ,而raly1在降解任何不饱和寡糖底物时都不能产生δ,因此说明aly2可以更彻底地降解褐藻胶,为my04菌株利用褐藻胶作为碳源提供了更好的保障。其中,实施例7、10、11的结果充分说明,raly2在降解褐藻胶底物时,既能生成饱和型的单糖产物m、g,又能生成不饱和型的单糖产物δ,这是aly2显著区别与所有已知内切型褐藻胶裂解酶的重要特征。
参考文献:
[1]pawarsn,edgarkj.alginatederivatization:areviewofchemistry,propertiesandapplications[j].biomaterials.2012,33(11):3279-3305.
[2]kimhs,leec,leeey.alginatelyase:structure,property,andapplication[j].biotechnologyandbioprocessengineering.2011,16(5):843-851.
[3]alkawashma,soothilljs,schillernl.alginatelyaseenhancesantibiotickillingofmucoidpseudomonasaeruginosainbiofilms[j].apmis.2006,114(2):131-138.
[4]takaser,ochiaia,mikamib,etal.molecularidentificationofunsaturateduronatereductaseprerequisiteforalginatemetabolisminsphingomonassp.a1[j].biochimbiophysacta.2010,1804(9):1925-1936.
[5]hanw,guj,chengy,etal.novelalginatelyase(aly5)fromapolysaccharide-degradingmarinebacterium,flammeovirgasp.strainmy04:effectsofmoduletruncationonbiochemicalcharacteristics,alginatedegradationpatterns,andoligosaccharide-yieldingproperties[j].appliedandenvironmentalmicrobiology.2015,82(1):364-374.
[6]chengy,wangd,guj,etal.biochemicalcharacteristicsandvariablealginate-degradingmodesofanovelbifunctionalendolyticalginatelyase[j].applenvironmicrobiol.2017。
sequencelisting
<110>山东大学
<120>一种产生多种单糖产物的内切型双功能褐藻胶裂解酶aly2及其编码基因与应
用
<160>2
<170>patentinversion3.5
<210>1
<211>1620
<212>dna
<213>flammeovirgayaeyamensis
<400>1
atgactacagaaatgaaacaaacgatcaaaggattattattactactacttatctggcaa60
tctaaccttgcctttgcacaacaacctatcgttattgtaaacagtgggttcgaagacggt120
ttaaaaaactgggaggtaaaaggtaaagtacaaaaatctcaagatgccaattctggtaac180
ggttcagctaaactagcagagaaaggtgcagaggttactcaatttgtaagagtagaacct240
aaaaccgattatatattaacgttagctgttaaaggtaatgctacagcttttgtttctgta300
aaagggaaaaaacaagaagtaaataccgacaacaagaagtttgctactgtagaaatcgct360
tttaatagcggaaaagctaaaaatgtaatcattggtgcaaagtacaataacggacaagca420
cgaattgatgacgtaaaactaaaacaagtaaaaggtgctgcggcatctaaccaagaaaca480
ttaaatccaattcttgtagtcaatggcggtttcgaaagcaaactagccaattgggaaact540
acaggaaaagtatcttcttcagatgtctgtcatagcggtgtaaaatcggctaaaatggat600
gctaaagctgaagtaagacaaatggtaaaaatatatccttcattagaatacagattagac660
gttgccgtgaaaggtagaggtcaaatcttcgcaaaagtgaaaggtgatgaattcgttcaa720
gatttcgatacaaaagaatttcaaatagtaagcattgagtttactgctccagcaaaagga780
aaatttgttacaattggaggtagatatacagatagacaagttcgttttgatgatttcaaa840
gtagtgattttaaatcaagaactagatgaaaatcatcaatacccaacagatgtgattcct900
tcattgaccgattggaaaatcactttaccaatagatgctcaaggtagagataacaaaaga960
gtatttgatgtgaatcagagaatcaaaacgccattagaaattgcagataatggtattatt1020
gatttcgaatacagaccttacttcttcgcaaaagatggtgaggtgttctttagagctcat1080
gcggcaggagcaacaacaaaaggatcaaaatatcctcgttcagaattaagacaacgttca1140
ggtcacggtaacttatactggtctgtaaacgacgctcaatatttagaaacacaattaaga1200
gtaacacacgttccaaccgaaaaaccagaggtgtgtatggtacaaattcatggtccagaa1260
gatgagccattaagagttcaataccatacaaagaaaggtgtttatattgtctggaacgag1320
aacaataaagattacgaaaacgcaatcccttacaacatgggagagcagttaaaaatatct1380
gtcttggtagacaaagggtatatcacttgtcagattcaaaacctgactcaaggcactaaa1440
tacaaaaagacttggaaatctatggatgacactggctattttaaagttggttgctatacc1500
caggcatctaaattccaaagtcaaattaagaagggatctcgcgacgagccatatagctca1560
tacggtgaggtagctgtcaaatcaatcatgttaaaaaccacttatacaccaaataaataa1620
<210>2
<211>539
<212>prt
<213>flammeovirgayaeyamensis
<400>2
metthrthrglumetlysglnthrilelysglyleuleuleuleuleu
151015
leuiletrpglnserasnleualaphealaglnglnproilevalile
202530
valasnserglyphegluaspglyleulysasntrpgluvallysgly
354045
lysvalglnlysserglnaspalaasnserglyasnglyseralalys
505560
leualaglulysglyalagluvalthrglnphevalargvalglupro
65707580
lysthrasptyrileleuthrleualavallysglyasnalathrala
859095
phevalservallysglylyslysglngluvalasnthraspasnlys
100105110
lysphealathrvalgluilealapheasnserglylysalalysasn
115120125
valileileglyalalystyrasnasnglyglnalaargileaspasp
130135140
vallysleulysglnvallysglyalaalaalaserasnglngluthr
145150155160
leuasnproileleuvalvalasnglyglyphegluserlysleuala
165170175
asntrpgluthrthrglylysvalserserseraspvalcyshisser
180185190
glyvallysseralalysmetaspalalysalagluvalargglnmet
195200205
vallysiletyrproserleuglutyrargleuaspvalalavallys
210215220
glyargglyglnilephealalysvallysglyaspgluphevalgln
225230235240
asppheaspthrlysglupheglnilevalserilegluphethrala
245250255
proalalysglylysphevalthrileglyglyargtyrthrasparg
260265270
glnvalargpheaspaspphelysvalvalileleuasnglngluleu
275280285
aspgluasnhisglntyrprothraspvalileproserleuthrasp
290295300
trplysilethrleuproileaspalaglnglyargaspasnlysarg
305310315320
valpheaspvalasnglnargilelysthrproleugluilealaasp
325330335
asnglyileileasppheglutyrargprotyrphephealalysasp
340345350
glygluvalphepheargalahisalaalaglyalathrthrlysgly
355360365
serlystyrproargsergluleuargglnargserglyhisglyasn
370375380
leutyrtrpservalasnaspalaglntyrleugluthrglnleuarg
385390395400
valthrhisvalprothrglulysprogluvalcysmetvalglnile
405410415
hisglyprogluaspgluproleuargvalglntyrhisthrlyslys
420425430
glyvaltyrilevaltrpasngluasnasnlysasptyrgluasnala
435440445
ileprotyrasnmetglygluglnleulysileservalleuvalasp
450455460
lysglytyrilethrcysglnileglnasnleuthrglnglythrlys
465470475480
tyrlyslysthrtrplyssermetaspaspthrglytyrphelysval
485490495
glycystyrthrglnalaserlyspheglnserglnilelyslysgly
500505510
serargaspgluprotyrsersertyrglygluvalalavallysser
515520525
ilemetleulysthrthrtyrthrproasnlys
530535
- 还没有人留言评论。精彩留言会获得点赞!