细胞扩增的制作方法
细胞扩增系统(ces)可用于扩增和区分可用于研究目的和治疗目的的多种细胞类型。作为一个实例,已经鉴定cd34+祖细胞血液祖干细胞(hsc)为诸如癌症(例如,淋巴瘤、白血病、骨髓瘤等)的疾病中的可能治疗。hsc可以从骨髓、脐带血和/或外周血中收集。已有建议,应给予最低数量的hsc作为有效剂量。因此,hsc可以从初始量生长到至少可以被认为是有效剂量的量。
已经根据这些和其他考虑做出了一些实施方案。然而,上面讨论的相对特定的问题不限制本发明的这些实施方案的适用性。
技术实现要素:
提供发明内容是为了以简化的形式介绍一些实施方案的方面,并且不旨在确定关键元素或基本元素,也不旨在限制权利要求的范围。
一些实施方案涉及细胞扩增系统(ces)和在细胞扩增系统的生物反应器中生长细胞的方法。一些实施方案提供了用于在生物反应器(诸如中空纤维生物反应器)中扩增细胞的方法。一些实施方案可以提供将诸如造血干细胞(hsc)(如cd34+细胞)的细胞引入中空纤维生物反应器,其中,中空纤维生物反应器包括多个中空纤维。一些实施方案可以提供将第一多个细胞暴露于生长条件。生长条件可包括将第一多个细胞暴露于中空纤维生物反应器中的生长因子的组合。在一些实施方案中,生长条件可包括但不限于共培养的细胞及生长因子的组合。在将细胞暴露于生长条件后,可以使细胞扩增以产生第二多个扩增的细胞。然后可以从生物反应器中移除第二多个扩增的细胞。
附图说明
参考以下附图描述非限制性和非穷举性实施方案。
图1描绘了根据一些实施方案的中空纤维生物反应器的透视图。
图2示出了根据一些实施方案的具有预安装的流体运输设备的细胞扩增系统的透视图。
图3描绘了根据一些实施方案的细胞扩增系统的壳体的透视图。
图4示出了根据一些实施方案的预安装的流体运输设备的透视图。
图5描绘了根据一些实施方案的细胞扩增系统的示意图。
图6示出了根据一些实施方案的细胞扩增系统的另一个实施方案的示意图。
图7示出了根据一些实施方案的用于扩增细胞的过程的流程。
图8示出了根据另一个实施方案的用于扩增细胞的过程的流程。
图9示出了根据另一个实施方案的用于扩增细胞的过程的流程。
图10a-d示出了根据一些实施方案的在生物反应器旋转期间中空纤维的横截面。
图11示出了可用于实施一些实施方案的计算系统的部件。
图12示出了根据一个用于生物反应器系统中cd34+细胞扩增的实施方案的生长的细胞数的柱状图。
图13示出了显示根据一个用于cd34+细胞扩增的实施方案的代谢谱的图。
图14示出了显示根据一个用于cd34+细胞扩增的实施方案的代谢率的图。
图15示出了显示根据一个用于cd34+细胞扩增的实施方案的细胞计数的图。
图16示出了显示根据另一个用于cd34+细胞扩增的实施方案的细胞计数的图。
图17示出了显示根据另一个用于cd34+细胞扩增的实施方案的细胞计数的图。
图18示出了显示根据一些实施方案生长的细胞上的不同类型的生物标志物的柱状图。
具体实施方式
通过参考以下详细描述和附图中描绘的实施方案,可进一步理解本发明的原理。应当理解,尽管下面参考详细实施方案显示和描述了特定特征,但是本发明不限于下面描述的这些实施方案。
现在将详细参考在附图中示出并在下面描述的实施方案。在可能的情况下,在附图和说明书中使用相同的附图标记表示相同或相似的部分。
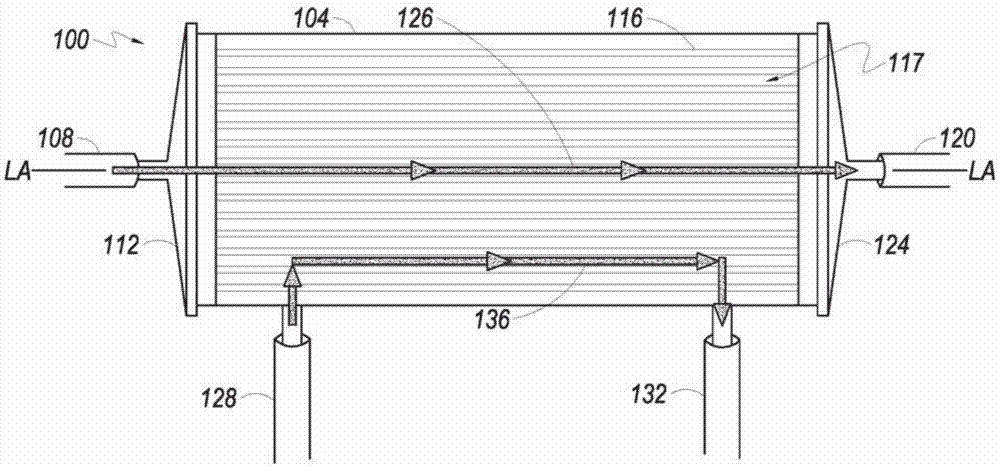
参考图1,在前侧视图中示出了可以与本发明一起使用的中空纤维生物反应器100的实例。中空纤维生物反应器100具有纵向轴线la-la并且包括腔室壳体104。在至少一个实施方案中,腔室壳体104包括四个开口或端口:毛细管内(ic)入口端口108、ic出口端口120、毛细管外(ec)入口端口128和ec出口端口132。
根据本发明的一些实施方案,第一循环路径中的流体通过中空纤维生物反应器100的第一纵向端112处的ic入口端口108进入中空纤维生物反应器100,进入并通过多个中空纤维116的毛细管内侧(在各种实施方案中被称为中空纤维膜的毛细管内(“ic”)侧或“ic空间”),并且通过位于中空纤维生物反应器100的第二纵向端124的ic出口端口120,离开中空纤维生物反应器100。ic入口端口108和ic出口端口120之间的流体路径限定了中空纤维生物反应器100的ic部分126。第二循环路径中的流体通过ec入口端口128流入中空纤维生物反应器100,与中空纤维116的毛细管外侧或中空纤维116的外侧(被称为膜的“ec侧”或“ec空间”)接触,并通过ec出口端口132离开中空纤维生物反应器100。ec入口端口128和ec出口端口132之间的流体路径包括中空纤维生物反应器100的ec部分136。经由ec入口端口128进入中空纤维生物反应器100的流体可以与中空纤维116的外侧接触。小分子(例如,离子、水、氧气、乳酸等)可以通过中空纤维116从中空纤维的内部或ic空间扩散到外部或ec空间,或者从ec空间扩散到ic空间。诸如生长因子的大分子量的分子,可能太大而不能通过中空纤维膜,并且留在中空纤维116的ic空间中。在一些实施方案中,可以根据需要更换培养基。培养基也可以通过氧合器或气体传输模块循环以根据需要交换气体(参见例如细胞扩增系统500(图5)和600(图6))。根据一些实施方案,细胞可以如下所述包含在第一循环路径和/或第二循环路径内,并且可以在膜的ic侧和/或ec侧。
用于制造中空纤维膜的材料可以是任何能够制成中空纤维的生物相容的聚合物材料。根据本发明的实施方案,可以使用的一种材料是合成的基于聚砜的材料。为了使细胞粘附到中空纤维的表面,可以用某种方式修饰表面,通过用蛋白质(例如糖蛋白(诸如纤连蛋白或胶原蛋白))至少涂覆细胞生长表面,或通过将表面暴露于辐射。伽马射线处理过的膜表面可允许贴壁细胞的附着,而无需另外用纤连蛋白等涂覆膜。经伽马射线处理的膜制成的生物反应器可以重复使用。可以根据本发明的一些实施方案可使用用于细胞附着的其他涂层和/或处理。
转到图2,根据本发明的一些实施方案示出了具有预安装的流体运输组件的细胞扩增系统200的实施方案。ces200包括细胞扩增机202,该细胞扩增机包括用于与细胞扩增机202的后部206接合的舱口或可关闭的门204。细胞扩增机202内的内部空间208包括适于接收和接合预安装的流体运输组件210的特征,所述预安装的流体运输组件包括生物反应器100。预安装的流体运输组件210可以可拆卸地附接到细胞扩增机202,以便于在细胞扩增机202处促进在同一细胞扩增机202处使用过的预安装的流体运输组件210相对快速地更换为新的或未使用的预安装的流体运输组件210。可以操作单细胞扩增机202以使用第一预安装的流体运输组件210使第一细胞组生长或扩增第一细胞组,并且然后可以使用第二预安装的流体运输组件210使第二细胞组生长或扩增第二细胞组,而不需要在第一预安装的流体运输组件210到第二预安装的流体运输组件210的更换之间进行消毒。预安装的流体运输组件包括生物反应器100和氧合器或气体传输模块212。根据一些实施方案,管道引导槽显示为214,用于接收管接至预安装的流体运输组件210的各种培养基。
接下来,图3示出了根据本发明的一些实施方案,在可拆卸地附接预安装的流体运输组件210(图2)之前的细胞扩增机202的后部206。图3中省略了可关闭的门204(图2中所示)。细胞扩增机202的后部206包括一些不同的结构,用于与预安装的流体运输组件210的元件配合工作。更具体地,细胞扩增机202的后部206包括多个用于与预安装的流体运输组件210上的泵回路配合的蠕动泵,包括ic循环泵218、ec循环泵220、ic入口泵222和ec入口泵224。此外,细胞扩增机202的后部206包括多个阀,包括ic循环阀226、试剂阀228、ic培养基阀230、空气移除阀232、细胞入口阀234、洗涤阀236、分配阀238、ec培养基阀240、ic废液阀242、ec废液阀244和收获阀246。多个传感器也与细胞扩增机202的后部206相连,包括ic出口压力传感器248、ic入口压力和温度组合传感器250、ec入口压力和温度组合传感器252以及ec出口压力传感器254。还示出了用于空气移除室的光学传感器256。
根据一些实施方案,图3示出了用于旋转生物反应器100的轴或摇杆控制器258。与轴或摇杆控制器258相连的轴配件260允许轴通过孔的合适的对准,参见例如管道组织器的424(图4)、参见例如预安装运输组件210的300(图4)或与细胞扩增机202的后部206一起的400。轴或摇杆控制器258的旋转赋予轴配件260和生物反应器100旋转运动。因此,当ces200的操作者或用户附接新的或未使用的预安装的流体运输组件400(图4)到细胞扩增机202时,对准是相对简单的事,其合适地通过孔424(图4)定向预安装的流体运输组件210或400的轴与配有轴配件260。
转到图4,示出了可拆卸地附接的预安装的流体运输组件400的透视图。预安装的流体运输组件400可以可拆卸地附接到细胞扩增机202,以便于在细胞扩增机202处促进在同一细胞扩增机202处使用过的预安装的流体运输组件400相对快速地更换为新的或未使用的预安装的流体运输组件400。如图4所示,生物反应器100可以附接到包括轴配件402的生物反应器联轴器(coupling)。轴配件402包括一个或多个轴紧固机械装置,诸如用于接合细胞扩增机202的轴(例如258(在图3示出))的偏置臂或弹簧构件404。
在实施方案中,轴配件402和弹簧构件404连接到旋转生物反应器100的细胞扩增系统的机械装置。例如,在一些实施方案中,细胞扩增系统可以是
根据一些实施方案,预安装的流体运输组件400包括管道408a、408b、408c、408d、408e等,以及各种管道配件,以提供如下所述如图5和6所示的流体路径。还可以为泵提供泵回路406a和406b。在一些实施方案中,尽管可以在细胞扩增机202所在的位置处提供各种培养基,但是根据一些实施方案,预安装的流体运输组件400可以包括足够的管道长度以延伸到细胞扩增机202的外部并且能够焊接到与培养基袋相连的管道。
图5示出了细胞扩增系统500的实施方案的示意图,而图6示出了细胞扩增系统600的另一个实施方案的示意图。如图5和6中的实施方案所示,并且如下所述,细胞在ic空间中生长。然而,本发明不限于这些实例,并且在其他实施方案中可以提供细胞在ec空间中生长。在其他实施方案中,诸如当共培养细胞时,第一细胞可以在ec空间中生长,而第二细胞可以在ic空间中生长。还可以通过在ec空间中使第一细胞和第二细胞生长,或在ic空间中使第一细胞和第二细胞生长来进行细胞的共培养。
根据一些实施方案,图5示出了ces500,其包括第一流体循环路径502(也称为“毛细管内回路”或“ic回路”)和第二流体循环路径504(也称为“毛细管外回路”或“ec回路”)。第一流体流动路径506可以与中空纤维生物反应器501流体相连以形成第一流体循环路径502的至少一部分。流体通过ic入口端口501a流入中空纤维生物反应器501,通过中空纤维生物反应器501中的中空纤维,并经由ic出口端口501b离开。压力计510测量离开中空纤维生物反应器501的培养基的压力。培养基流过可用于控制培养基流速/流体循环速率的ic循环泵512。ic循环泵512可以沿第一方向(例如,顺时针)或与第一方向相反的第二方向(例如,逆时针)泵送流体。出口501b可以用作反向的入口。进入ic回路502的培养基可以通过阀514进入。如本领域技术人员将理解的,可以在各个位置放置额外的阀和/或其他设备以隔离和/或测量沿着流体路径的多个部分的培养基特征。因此,应该理解,所示的示意图表示ces500的各种元件的一种可能的配置,并且所示的示意图的修改在一个或更多个现有实施方案的范围内。
关于ic回路502,可以在操作期间从样品端口516或样品线圈518获得培养基样品。设置在第一流体循环路径502中的压力/温度计520允许在操作期间检测培养基压力和温度。然后培养基返回到ic入口端口501a以完成流体循环路径502。在中空纤维生物反应器501中生长/扩增的细胞可以通过阀598从中空纤维生物反应器501冲洗到收获袋599中,或者在中空纤维内重新分布以进一步生长。
第二流体循环路径504中的流体经由ec入口端口501c进入中空纤维生物反应器501,并经由ec出口端口501d离开中空纤维生物反应器501。ec回路504中的培养基可以与中空纤维生物反应器501中的中空纤维的外侧接触,从而允许小分子扩散进出中空纤维。
设置在第二流体循环路径504中的压力/温度计524允许在培养基进入中空纤维生物反应器501的ec空间之前测量培养基的压力和温度。压力计526允许在培养基离开中空纤维生物反应器501之后测量第二流体循环路径504中的培养基的压力。关于ec回路,可以在操作期间从样品端口530或样品线圈获得培养基样品。
在一些实施方案中,在离开中空纤维生物反应器501的ec出口端口501d之后,第二流体循环路径504中的流体通过ec循环泵528到达氧合器或气体传输模块532。ec循环泵528也可以相反的方向泵送流体。第二流体流动路径522可经由氧合器入口端口534和氧合器出口端口536与氧合器或气体传输模块532流体相连。在操作中,流体培养基经由氧合器入口端口534流入氧合器或气体传输模块532,并且经由氧合器出口端口536离开氧合器或气体传输模块532。氧合器或气体传输模块532向ces500中的培养基添加氧气并从中移除气泡。在各种实施方案中,第二流体循环路径504中的培养基可以与进入氧合器或气体传输模块532的气体处于平衡。氧合器或气体传输模块532可以是任何适当尺寸的氧合器或气体传输设备。空气或气体经由过滤器538流入氧合器或气体传输模块532,并通过过滤器540流出氧合器或气体传输设备532。过滤器538和540减少或防止氧合器或气体传输模块532和相关培养基的污染。在灌注事件(primingsequence)部分期间从ces500净化的空气或气体可经由氧合器或气体传输模块532排放到大气中。
在针对ces500描绘的配置中,第一流体循环路径502和第二流体循环路径504中的流体培养基以相同方向(并流配置)流过中空纤维生物反应器501。ces500还可以配置成以对流配置来流动。
根据至少一个实施方案,可以经由第一流体流动路径506将包括细胞的培养基(来自袋562)和来自袋546的流体培养基引入第一流体循环路径502。流体容器562(例如,用于将空气引出系统的细胞入口袋或盐水灌注液)可以经由阀564与第一流体流动路径506和第一流体循环路径502流体相连。
流体容器或培养基袋,544(例如,试剂)和546(例如,ic培养基)可分别经由阀548和550与第一流体入口路径542流体相连,或经由阀548、550和570与第二流体入口路径574流体相连。还提供了第一和第二无菌可密封输入灌注路径508和509。空气移除室(arc)556可以与第一循环路径502流体相连。空气移除室556可以包括一个或更多个超声波传感器,该超声传感器包括上部传感器和下部传感器以检测空气、流体缺乏,和/或空气/流体界面(例如,在空气移除室556内的某些测量位置处的气体/流体界面)。例如,可以在空气移除室556的底部附近和/或顶部附近使用超声波传感器来检测这些位置处的空气、流体和/或空气/流体界面。在不脱离本发明的精神和范围的情况下,实施方案提供了许多其他类型的传感器的使用。例如,可以根据本发明的实施方案使用光学传感器。在灌注事件或其他方案的部分期间从ces500净化的空气或气体可经由管线558排放到空气阀560外的大气,管线558可与空气移除室556流体相连。
可以将ec培养基(来自袋568)或洗涤溶液(来自袋566)添加到第一或第二流体流动路径中。流体容器566可与阀570流体相连,阀570可以经由分配阀572和第一流体入口路径542与第一流体循环路径502流体相连。或者,通过打开阀570并关闭分配阀572,流体容器566可以经由第二流体入口路径574和ec入口路径584与第二流体循环路径504流体相连。同样地,流体容器568可与阀576流体相连,阀576可以经由第一流体入口路径542和分配阀572与第一流体循环路径502流体相连。或者,通过打开阀576并关闭分配阀572,流体容器568可以与第二流体入口路径574流体相连。可以提供可选的热交换器552用于培养基试剂或洗涤溶液引入。
在ic回路中,流体可以最初由ic入口泵554推进。在ec回路中,流体可以最初由ec入口泵578推进。诸如超声波传感器的空气检测器580也可以与ec入口路径584相连。
在至少一个实施方案中,第一和第二流体循环路径502和504连接到废物管线588。当阀590打开时,ic培养基可以流过废物管线588并流到废物袋或出口袋586。同样,当阀582打开时,ec培养基可以通过废物管线588流到废物袋或出口袋586。
在一些实施方案中,可以通过细胞收获路径596收获细胞。此处,可以通过将含有细胞的ic培养基通过细胞收获路径596和阀598泵送至细胞收获袋599来收获来自中空纤维生物反应器501的细胞。
ces500的各种部件可以包含或容纳在机器或壳体内(诸如细胞扩增机202(图2和3)),其中,该机器在预定温度下维持细胞和培养基。
转到图6,示出了细胞扩增系统600的另一个实施方案的示意图。ces600包括第一流体循环路径602(也称为“毛细管内回路”或“ic回路”)和第二流体循环路径604(也称为“毛细管外回路”或“ec回路”)。第一流体流动路径606可以与中空纤维生物反应器601流体相连以形成第一流体循环路径602。流体通过ic入口端口601a流入中空纤维生物反应器601,通过中空纤维生物反应器601中的中空纤维,并经由ic出口端口601b离开。压力传感器610测量离开中空纤维生物反应器601的培养基的压力。除了压力之外,在一些实施方案中,传感器610也可以是在操作期间检测培养基压力和温度的温度传感器。
培养基流过可用于控制培养基流速或循环速率的ic循环泵612。ic循环泵612可以沿第一方向(例如,顺时针)或与第一方向相反的第二方向(例如,逆时针)泵送流体。出口601b可以用作反向的入口。进入ic回路的培养基可以通过阀614流动。如本领域技术人员将理解的,可以在各个位置放置额外的阀和/或其他设备以隔离和/或测量沿着流体路径的各部分的培养基特征。可以在操作期间从样品线圈618获得培养基样品。然后培养基返回到ic入口端口601a以完成流体循环路径602。
在中空纤维生物反应器601中生长/扩增的细胞可以通过阀698和管线697从中空纤维生物反应器601冲出到收获袋699中。或者,当阀698关闭后,细胞可以在中空纤维生物反应器601中重新分布以进一步生长。应当理解,所示的示意图表示ces600的各种元件的一种可能的配置,并且所示的示意图的修改在一个或更多个本实施方案的范围内。
第二流体循环路径604中的流体经由ec入口端口601c进入中空纤维生物反应器601,并经由ec出口端口601d离开中空纤维生物反应器601。根据实施方案,ec回路中的培养基可以与中空纤维生物反应器601中的中空纤维的外侧接触,从而允许小分子扩散进入和离开可在室601内的中空纤维。
设置在第二流体循环路径604中的压力/温度传感器624允许在培养基进入中空纤维生物反应器601的ec空间之前测量培养基的压力和温度。传感器626允许在第二流体循环路径604中的培养基在离开中空纤维生物反应器601之后测量其压力和/或温度。关于ec回路,可以在操作期间从样品端口630或样品线圈获得培养基样品。
在离开中空纤维生物反应器601的ec出口端口601d之后,第二流体循环路径604中的流体通过ec循环泵628到达氧合器或气体传输模块632。根据一些实施方案,ec循环泵628也可以沿相反方向泵送流体。第二流体流动路径622可以经由氧合器或气体传输模块632的入口端口632a和出口端口632b与氧合器或气体传输模块632流体相连。在操作中,流体培养基经由入口端口632a流入氧合器或气体传输模块632,并经由出口端口632b离开氧合器或气体传输模块632。氧合器或气体传输模块632将氧气添加到ces600中的培养基中并从中移除气泡。
在各种实施方案中,第二流体循环路径604中的培养基可以与进入氧合器或气体传输模块632的气体相平衡。氧合器或气体传输模块632可以是用于氧合或气体传输的任何适当尺寸的设备。空气或气体经由过滤器638流入氧合器或气体传输模块632,并通过过滤器640流出氧合器或气体传输设备632。过滤器638和640减少或防止氧合器或气体传输模块632和相关培养基的污染。在灌注事件的部分期间从ces600净化的空气或气体可经由氧合器或气体转移模块632排放到大气中。
在对ces600描绘的配置中,第一流体循环路径602和第二流体循环路径604中的流体培养基以相同方向(并流配置)流过中空纤维生物反应器601。ces600还可以配置成以对流配置流动。
根据至少一个实施方案,包括细胞(来自诸如细胞容器(如袋)的源)的培养基可以接合在接合点662,并且来自培养基源的流体培养基可以接合在接合点646。可以经由第一流体流动路径606将细胞和培养基引入第一流体循环路径602。接合点662可以经由阀664与第一流体流动路径606流体相连,并且接合点646可以经由阀650与第一流体流动路径606流体相连。试剂源可以流体地连接到点644并且经由阀648与流体入口路径642流体相连,或经由阀648和672与第二流体入口路径674流体相连。
空气移除室(arc)656可以与第一循环路径602流体相连。空气移除室656可以包括一个或更多个超声波传感器,该超声传感器包括上部传感器和下部传感器以检测空气、流体缺乏,和/或空气/流体界面(例如,在空气移除室656内的某些测量位置处的气体/流体界面)。例如,可以在空气移除室656的底部附近和/或顶部附近使用超声波传感器来检测这些位置处的空气、流体和/或空气/流体界面。在不脱离本发明的精神和范围的情况下,实施方案提供了许多其他类型的传感器的使用。例如,可以根据本发明的实施方案使用光学传感器。在灌注事件或其他方案的部分期间从ces600净化的空气或气体可经由管线658排放到空气阀660外的大气,管线658可与空气移除室656流体相连。
ec培养基源可以接合到ec培养基接合点668,并且洗涤溶液源可以接合到洗涤溶液接合点666,以将ec培养基和/或洗涤溶液添加到第一或第二流体流动路径。接合点666可与阀670流体相连,阀670可以经由阀672和第一流体入口路径642与第一流体循环路径602流体相连。或者,通过打开阀670并关闭阀672,接合点666可以经由第二流体入口路径674和第二流体流动路径684与第二流体循环路径604流体相连。同样地,接合点668可与阀676流体相连,阀676可以经由第一流体入口路径642和阀672与第一流体循环路径602流体相连。或者,通过打开阀676并关闭分配阀672,流体容器668可与第二流体入口路径674流体相连。
在ic回路中,流体可以最初由ic入口泵654推进。在ec回路中,流体可以最初由ec入口泵678推进。诸如超声波传感器的空气检测器680也可以与ec入口路径684相关联。
在至少一个实施方案中,第一和第二流体循环路径602和604连接到废物管线688。当阀690打开时,ic培养基可以流过废物管线688流到废物袋或出口袋686。同样,当阀692打开时,ec培养基可以流到废物袋或出口袋686。
当细胞在中空纤维生物反应器601中生长之后,可以通过细胞收获路径697收获细胞。此处,可以在阀698打开的情况下,通过将含有细胞的ic培养基通过细胞收获路径697泵送至细胞收获袋699来收获来自中空纤维生物反应器601的细胞。
ces600的各种部件可以包含或容纳在机器或壳体内(诸如细胞扩增机202(图2和3)),其中该机器在预定温度下维持细胞和培养基。进一步应注意,在一些实施方案中,可以组合ces600和ces500(图5)的部件。在其他实施方案中,ces可以包括比图5和6中所示的组件更少或额外的部件,并仍然在本发明的范围内。在一些实施方案中,可以通过
在使用ces600的一个特定实施方案中,可以在ces600的实施方案中扩增造血干细胞(hsc),例如cd34+细胞。在该实施方案中,将可使用白细胞去除过程或手动过程(例如,脐带)收集的hsc(包括cd34+细胞)引入生物反应器601。可以通过路径602将hsc(包括cd34+细胞)引入生物反应器601中。
在一些实施方案中,hsc(包括cd34+细胞)可以在引入生物反应器601之前经历选择过程(例如,纯化过程)。该过程可涉及使用离心机、纯化柱、磁性选择、化学选择等。细胞选择/纯化程序的一些实例包括使用来自例如德国bergischgladbach的miltenyibiotec的分离柱。在一个实例中,脐带血首先经历细胞选择过程,该细胞选择过程在将细胞引入生物反应器601之前选择hsc(包括cd34+细胞)。其他实例可利用单采血液成分机来耗尽最初收集时包括在hsc(包括cd34+细胞)中的其他细胞。例如,hsc可以源自脐带血、骨髓或外周血。在初始收集之后,但在引入生物反应器601之前,可以处理包括cd34+细胞的一定体积的hsc以从该体积中耗尽红细胞、特定白细胞、粒细胞和/或其他细胞。这些仅仅是一些实例,并且本发明的实施方案不限于此。
在其他实施方案中,hsc(包括cd34+细胞)可以在收集后直接添加到生物反应器601中,无需任何额外的纯化。例如,可以将脐带血(具有hsc)添加到生物反应器中。除了许多蛋白质和其他生物活性分子外,脐带血还可能包括hsc(包括cd34+细胞)、红细胞、血小板、粒细胞和/或白细胞。
应注意,在一些实施方案中,可在灌注步骤之后将hsc添加至生物反应器601。可以理解,扩增的细胞可能不是粘附的并因此可能不需要它们粘附到生物反应器601的中空纤维壁上以进行扩增/增殖。在这些实施方案中,可能没有必要在中间纤维的内部涂覆涂层(例如纤连蛋白)以促进粘附。在这些实施方案中,可以在灌注步骤之后并且在没有生物反应器涂覆步骤的情况下将hsc(包括cd34+细胞)(纯化的或未纯化的)引入生物反应器601中。如果细胞是贴壁细胞,则可以在灌注步骤之后和引入hsc之前进行涂覆步骤。
一旦进入生物反应器601,细胞可暴露于生长因子、激活剂、激素、试剂、蛋白质和/或可有助于细胞扩增的其他生物活性分子。在一个实例中,可以在生物反应器601中预先生长/引入共培养细胞系,以优化hsc(包括cd34+细胞)的生长条件。在一个特定实施方案中,人间充质干细胞(hmsc)可与hsc(包括cd34+细胞)共培养以促进cd34+细胞的生长。不受理论束缚,认为msc可以释放与hsc(例如cd34+细胞)相互作用并促进这些细胞增殖的因子(例如,sdf-1因子)。在一些实施方案中,共培养的hmsc的使用可涉及在hsc(包括cd34+细胞)引入生物反应器601之前在优化的用于增殖hmsc的条件下进行的生长过程。在实施方案中,hmsc可以来自骨髓、外周血、脐带细胞、脂肪组织和/或臼齿(molar)组织。
除了共培养细胞之外,可以将包括一种或更多种生长因子、活化剂、激素、试剂、蛋白质和/或其他生物活性分子的补充物添加到生物反应器601中以生长和扩增hsc。补充剂可以作为单次体积添加或在一段时间内(例如,连续地、间歇地或定期地)添加。在一个实施方案中,细胞因子和/或其他蛋白质(例如重组细胞因子、激素等)的组合,可以作为补充剂的一部分包括在内。作为一个实例,补充物可包括以下项中的一种或更多种:重组人flt3配体(rhflt-3l)、重组人干细胞因子(rhscf)、重组人血小板生成素(rhtpo)、重组人(rh)神经胶质衍生的神经营养因子和/或其组合。可以与实施方案一起使用的补充物的一个实例是stemcell2maxtm补充物(stemcell2max,cantanhede,portugal)。
应注意,在一些实施方案中,因子组合可包括在细胞悬浮于其中的培养基中。例如,hsc可以悬浮在培养基中并在培养基中引入生物反应器中。在实施方案中,培养基可包括有助于hsc增殖的生长因子的组合。
将细胞与补充物、共培养细胞和/或用于扩增细胞的其他材料一起引入生物反应器后,允许细胞在生物反应器601中扩增。在扩增期间,可能存在一些添加到生物反应器601中或从生物反应器601中移除的材料。作为一个实例,可以将额外的蛋白质(例如,细胞因子)添加到生物反应器601中。在一些实施方案中,可以使用超过一种蛋白质或其他生物活性剂。额外材料可以单独地在不同时间添加、同时添加,或者可以组合并且以组合的形式添加。
应注意,可以提供一些实施方案将材料更直接地添加到生物反应器601中(诸如通过端口618)。然而,在其他实施方案中,可以将材料添加到例如通过路径606的位置,使得材料可以更慢地灌注到生物反应器601中。
除了用于帮助hsc(包括cd34+细胞)生长的材料之外,还可以诸如通过添加包含一些营养物的培养基而供养hsc。在一些实施方案中,培养基可以是可包含血清的可商购的培养基。在其他实施方案中,培养基可以是无血清的并且包含其他添加剂。可通过添加其他材料来改良培养基,一些非限制性实例包括盐、血清、蛋白质、试剂、生物活性分子、营养物等。可用于供养hsc(包括cd34+细胞)的培养基的一个实例包括
在一些实施方案中,当共培养细胞位于ic空间中时,可以在ec空间中进行供养。在一些实施方案中,通过ec空间的供养可以减少细胞从ic空间中的循环流体可能感受到的力的量。在一些实施方案中,ec空间中的培养基循环可以为hsc(包括cd34+细胞)的扩增提供足够的营养物。
作为hsc(包括cd34+细胞)扩增的一部分,还可以在生物反应器601中控制其他条件(诸如温度、ph、氧气浓度、二氧化碳浓度、废物浓度、代谢物浓度等)。在一些实施方案中,ec侧(例如路径604)的流速可用于控制各种参数。例如,如果希望减少细胞生长的ic侧的废物或代谢物浓度,可以增加ec侧的流速以确保通过中空纤维从ic侧到ec侧的迁移由ic侧移除废物和/或代谢物。
在扩增cd34+细胞后,可以从生物反应器601中移除该细胞。可以将cd34+细胞收集在容器699中。在一些实施方案中,可以将收集的cd34+细胞施用于患者以重建造血作用。一些非限制性实例包括经历可能影响造血作用的各种癌症(例如白血病、骨髓增生异常、非霍奇金淋巴瘤等)治疗的患者。细胞可以与其他化合物或分子一起施用。
在一些实施方案中,使用ces600可以提供优于常规过程的hsc(包括cd34+细胞)生长的优势。例如,中空纤维的使用允许紧密的细胞与细胞的通信,这可以增强cd34+细胞的生长以开始并继续增殖。此外,使用中空纤维生物反应器(诸如生物反应器601),可以为细胞生长提供大的表面区域,这可以产生更高浓度或更高体积的cd34+细胞。
进一步地,可以使用ces600的一些不同部件来控制生物反应器601中的条件,包括ic流速和ec流速。此外,ces600提供了添加材料的各种位置,这允许更直接或更间接地(例如灌注)细胞因子进入生物反应器601。
另外,ces600提供封闭的系统。也就是说,可以在不直接暴露于周围环境的情况下进行生长cd34+细胞的步骤,周围环境可能污染细胞,或被用于培养细胞的细胞或材料污染。还认为,可以提供一些实施方案来使用比其他方法/系统更低的cd34+细胞起始浓度进行扩增。在这些实施方案中,同样可以扩增cd34+细胞以产生比其他方法/系统更大的量。还认为可以提供一些实施方案来缩短用于生长有效剂量的cd34+细胞的时间。
图7-9示出了可以在一些实施方案中进行以使细胞(例如hsc)生长的流程700、800和900。尽管在方下面可能描述了用于进行流程700、800和900中的步骤的特定设备,但是实施方案不限于此。例如,可以描述一些步骤为通过细胞扩增系统(例如,ces500或600)或处理器(1100(图11))的部分来进行,所述处理器可以基于作为处理器可执行指令提供的软件来执行步骤。这仅出于说明性目的而完成,并且流程700、800和900不限于通过任何特定设备进行。
流程700在步骤704处开始并进行到可以收集/制备细胞(例如,包括cd34+细胞的hsc)的可选步骤708。作为一个实例,步骤708可以涉及单采血液成分过程,例如白细胞去除术过程。在一个特定实施方案中,作为步骤708的一部分进行单采血液成分过程。能够收集包括在单采血液成分过程中的细胞的设备包括spectra
在其他实施方案中,可选步骤708可以涉及解冻或以其他方式制备细胞(例如,从脐带血)。在一些实施方案中,脐带血细胞的制备可涉及通过选择cd34+细胞的选择过程处理脐带血细胞。该过程可以是阳性选择过程,也可以是阴性选择过程。该过程可涉及使用纯化柱、磁柱、功能化磁珠、试剂或将cd34+细胞与其他细胞分离的其他材料。作为一个实例,选择过程可以涉及使用抗原功能化的磁珠,以及利用磁柱完成分离的设备(诸如clinimacs
在其他实施方案中,单采血液成分机可以用于耗尽最初收集的细胞中可能包含的其他细胞。例如,细胞可以源自脐带血、骨髓或外周血。在初始收集之后,但在引入生物反应器之前,可以处理一定体积的靶细胞以在引入生物反应器之前从该体积中耗尽红细胞、特定白细胞、粒细胞和/或其他细胞。这仅是一个实例,并且实施方案可以利用其他材料和系统来产生分离。
流程700从步骤708到达步骤712,步骤712可以将细胞引入细胞扩增系统,特别是细胞扩增系统的生物反应器。如上所述,在一些实施方案中,流程700可以在步骤712处开始。在一些实施方案中,生物反应器可以是中空纤维生物反应器(诸如生物反应器100(图1))。在这些实施方案中,步骤712可涉及使细胞流入一个或更多个单独的中空纤维。步骤712可涉及使用处理器、泵、阀、流体导管等以将细胞引入生物反应器中。在一个实施方案中,步骤712可以涉及打开阀(例如,564、514、664和/或614)并激活泵(例如,554和654)。
在步骤712之后,流程700到达步骤716,步骤716将细胞暴露于一种或更多种生长条件。可以理解,某些细胞类型需要特定的生长条件以扩增。生长条件可以例如包括暴露于某些蛋白质。这种细胞的一个实例包括cd34+细胞。步骤716提供将细胞暴露于可促进细胞扩增和生长的任何必需的生长因子、蛋白质、试剂、营养物等。
步骤716可以涉及可以作为步骤716的一部分或者在步骤716之前进行的一些步骤。例如,在一些实施方案中,可以进行使共培养细胞生长的步骤720,其中共培养细胞可产生促进靶细胞系生长的材料。在一个实施方案中,步骤720可以在步骤716之前进行,或甚至在步骤708之前进行。在一个特定实例中,可以在生物反应器中使人间充质干细胞(hmsc)生长。在这些实施方案中,步骤720可涉及一些步骤(例如,从骨髓、外周血、脐带细胞、脂肪组织和/或臼齿组织收集hmsc),这些步骤使得共培养细胞在步骤716期间存在于生物反应器中。可以理解,可以在步骤712之前进行这些步骤。
关于使共培养细胞生长,可以进行用于调节使共培养细胞生长的生物反应器的若干步骤。在一些实施方案中,所述步骤可以包括灌注生物反应器、用促进共培养细胞(例如,当共培养细胞是贴壁细胞时)附着的材料涂覆生物反应器、在引入共培养细胞到生物反应器中之前洗涤以移除材料、附着共培养细胞,以及扩增共培养细胞。
在其他实施方案中,步骤716可以涉及步骤724,步骤724可以将生长因子添加到生物反应器中。如可以理解的,在一些实施方案中,可以添加一种或更多种生长因子(例如细胞因子)以促进细胞的增殖。作为一个实例,当使cd34+细胞生长时,生长因子可包括以下一种或更多种:重组人flt3配体(rhflt-3l)、重组人干细胞因子(rhscf)、重组人血小板生成素(rhtpo)、重组人(rh)神经胶质衍生的神经营养因子,及其组合。这仅是一个实例,并且在其他实施方案中,可以使用不同的生长因子、生长因子的组合或其他蛋白质作为步骤724的一部分。
在一个实施方案中,可以在步骤712将至少一部分生长因子与细胞一起引入。例如,可以用生长因子的组合调节在引入生物反应器时细胞处于其中培养基,其中生长因子包括重组人flt3配体(rhflt-3l)、重组人干细胞因子(rhscf)、重组人血小板生成素(rhtpo)、重组人(rh)胶质细胞衍生的神经营养因子及其组合中的一种或更多种。在这些实施方案中,步骤716和可选步骤724可以涉及补充可能已经与细胞一起添加到生物反应器中的生长因子。
在步骤716之后,流程可以到达扩增(即增殖)细胞的步骤728。步骤728可以涉及许多子步骤。例如,在子步骤732,细胞可以暴露于额外的生长因子、蛋白质、生物活性分子等。可提供暴露用于细胞继续增殖。
在一些实施方案中,步骤728可以在几小时、几天或甚至几周的时段期间发生。在该时段期间,可以在此期间的各个时间进行各个子步骤(例如,732、736和/或740)。例如,在此期间,可以将诸如生长因子的额外物质灌注或直接注入生物反应器中,以补充并继续暴露细胞并促进增殖。
步骤728还可以涉及供养细胞步骤736。步骤736可以涉及添加各种营养物,包括葡萄糖、磷酸盐、盐等。在一些实施方案中,步骤736可以涉及感测营养物的浓度并且响应相对低的浓度、向生物反应器中添加营养物。步骤736可涉及使用处理器、泵、阀、流体导管等来添加营养物以供养细胞。或者,可以基于预定的时间表添加诸如葡萄糖的营养物的添加物。
在一些实施方案中,步骤728可以涉及在ec空间中循环培养基。培养基可包括cd34+细胞扩增所必需的营养物。在一些实施方案中,如果培养基在ic空间中循环,则通过ec空间的供养可以减少细胞可能感受到的力的大小。在一些实施方案中,ec空间中的培养基循环可以通过营养物质通过中空纤维的扩散为hsc(包括cd34+细胞)的扩增提供足够的营养物(例如葡萄糖)。在其他实施方案中,步骤728可以涉及在ic空间中循环具有营养物(例如葡萄糖)的培养基用于更直接的供养。
步骤740可涉及控制生物反应器的生长环境。如可以理解的,除了营养物之外,用于优化细胞生长的环境可能涉及一些不同的参数。例如,可作为步骤740的一部分监测和控制温度、ph、氧气浓度、二氧化碳浓度、废物浓度、代谢物浓度等。在一个特定实施方案中,流过生物反应器的毛细管外空间(ec)侧的流体的流速可用于控制细胞扩增的毛细管内空间中的ph、氧气浓度、二氧化碳浓度、废物浓度、代谢物浓度等。
流程700从步骤740进行到步骤744,步骤744从生物反应器中移除细胞。步骤744可以涉及一些子步骤。例如,本身包括一些步骤的收获过程748可以作为步骤744的一部分来进行。在一些实施方案中,步骤748可以涉及改变生物反应器的毛细管内空间(ic)和外毛细管空间(ec)侧的循环速率。在其他实施方案中,步骤744可以涉及使各种材料循环以确保可将其自身附着到纤维内表面的任何细胞从生物反应器中释放和移除。作为一个实例,可以添加蛋白酶以分解可以帮助细胞与纤维结合的蛋白质(诸如糖蛋白)。
在一个实施方案中,作为收获过程748的一部分,生物反应器内(例如,毛细管内空间)的流体可以以相对高的速率循环。流体的循环可以促进在步骤728扩增的细胞的悬浮。循环可以发生预定的一段时间,以确保扩增的细胞悬浮在流体中并且可以从生物反应器中回收尽可能多的细胞。流程700在步骤752结束。
可以在一些实施方案中进行流程800以共培养使细胞(诸如cd34+细胞)生长。在一些实施方案中,共培养可以改善cd34+细胞的生长。流程800在步骤804处开始并进行到步骤808,步骤808可以将第一细胞(例如,人间充质干细胞(hmsc))引入生物反应器中。在一些实施方案中,生物反应器(例如,生物反应器100(图1))可以是包括一些中空纤维(例如,中空纤维116(图1))的中空纤维生物反应器。
在一些实施方案中,可以在步骤808之前调节中空纤维生物反应器中的中空纤维。例如,为了使hmsc粘附到中空纤维的内壁,中空纤维例如可以涂覆有糖蛋白(纤连蛋白、胶原蛋白)。涂覆过程可能涉及一些子步骤。
可以将在步骤808中引入的细胞引入中空纤维生物反应器的毛细管内空间(例如中空纤维的内部)。步骤808可涉及使用处理器(1100,(图11))、泵、阀、流体导管等以将细胞引入生物反应器中。在一个实施方案中,步骤808可以涉及打开阀(例如,564、514、664和/或614)并激活泵(例如,554和654)。
在其他实施方案中,步骤808可将细胞引入中空纤维生物反应器的毛细管外空间(例如中空纤维的外侧)。步骤808可涉及使用处理器(1100,(图11))、泵、阀、流体导管等以将细胞引入生物反应器中。在一个实施方案中,步骤808可以涉及打开阀(例如570、576、670和/或676)并激活泵(例如,578和/或678)。
流程从步骤808到达步骤812,在步骤812中第一细胞暴露于第一生长条件。可以优化第一生长条件以使在步骤808中引入的第一细胞生长。例如,步骤812可以涉及用第一生长培养基(可选步骤816)供养第一细胞,第一生长培养基包含用于培养第一细胞的营养物。生长培养基可包含各种营养物中的一种或更多种,包括葡萄糖、磷酸盐、盐等。
在预定的一段时间(可能取决于已在生物反应器内生长的一定数量的第一细胞)之后,流程800到达820,在820中第二细胞(例如,hsc、造血祖细胞(cd34+)等。)可以引入生物反应器。在一些实施方案中,第二细胞与第一细胞一样引入毛细管内空间。在其他实施方案中,如上所述,第一细胞可以在毛细管外空间中,而第二细胞可以引入毛细管内空间。
在一些实施方案中,在引入第二细胞之前,可以进行洗脱程序以从生物反应器中移除先前的流体。如可以理解的,生物反应器中的流体可以包含适于生长第一细胞的营养物。实施方案可以提供在步骤820之前或作为步骤820的一部分将该流体冲洗出生物反应器,并将第二细胞引入生物反应器中。
步骤820可涉及使用处理器(1100,(图11))、泵、阀、流体导管等以将第二细胞引入生物反应器中。在一个实施方案中,步骤820可以包括打开阀(例如,564、514、664和/或614)并激活泵(例如,554和654)。
流程从步骤820到达步骤824,在步骤824中第二细胞暴露于第二生长条件。可以优化第二生长条件以使在步骤820引入的第二细胞生长。例如,步骤820可以涉及用第二生长培养基(在可选步骤828)供养第二细胞,所述第二生长培养基包含用于培养第二细胞的营养物。第二培养基可包含各种营养物中的一种或更多种,包括葡萄糖、磷酸盐、盐等。
另外,在一些实施方案中,步骤820可以涉及可选步骤832,步骤832添加促进第二细胞(例如cd34+细胞)生长的生长因子。在一些实施方案中,可以添加生长因子(例如细胞因子)以促进细胞的增殖。作为一个实例,当使cd34+细胞时生长,生长因子可包括以下项中的一种或更多种:重组人flt3配体(rhflt-3l)、重组人干细胞因子(rhscf)、重组人血小板生成素(rhtpo)、重组人(rh)神经胶质衍生的神经营养因子及其组合。这仅是一个实例并且在其他实施方案中,可以使用不同的生长因子、生长因子的组合或其他蛋白质。在一些实施方案中,可以将生长因子添加到中空纤维生物反应器的毛细管内空间中。
在一些实施方案中,可以在步骤820将至少一部分生长因子与细胞一起引入。例如,可以用生长因子的组合调节在引入生物反应器时细胞处于其中的培养基,生长因子包括重组人flt3配体(rhflt-3l)、重组人干细胞因子(rhscf)、重组人血小板生成素(rhtpo)、重组人(rh)胶质细胞衍生的神经营养因子及其组合中的一种或更多种。在这些实施方案中,步骤820和可选步骤832可以涉及补充可能已经与细胞一起添加到生物反应器中的生长因子。
流程从步骤824到达步骤836,步骤836将细胞以共培养来扩增。步骤836可以涉及一些可选的子步骤。例如,可以在可选子步骤840供养细胞。当细胞以共培养来扩增时,可以向细胞提供额外的葡萄糖或其他营养物。在子步骤844,可以控制其他条件以扩增细胞。例如,可以监测和改变温度、ph、气体浓度等,以控制细胞扩增的环境
流程800从步骤836进行到步骤848,在步骤848中将细胞从生物反应器中移除。步骤848可以涉及一些子步骤。例如,本身包括一些步骤的收获过程852可以作为步骤848的一部分来进行。在一些实施方案中,步骤848可以涉及改变生物反应器的毛细管内空间(ic)和外毛细管空间(ec)侧的循环速率。在其他实施方案中,步骤848可以涉及循环各种材料以确保可将其自身附着到纤维内表面的任何细胞从生物反应器中释放和移除。作为一个实例,可以添加蛋白酶来分解可以帮助细胞与纤维结合的蛋白质(诸如糖蛋白(纤连蛋白、胶原蛋白))。
在一个实施方案中,作为收获过程852的一部分,生物反应器内(例如,毛细管内空间)的流体可以以相对高的速率循环。流体的循环可以促进在步骤836扩增的细胞的悬浮。循环可以发生预定的一段时间,以确保扩增的细胞悬浮在流体中并且可以从生物反应器中回收尽可能多的细胞。流程800在步骤856结束。
流程900在步骤904处开始并进行到步骤908,在步骤908中第一细胞(例如,人间充质干细胞(hmsc))可以在静态生长室中生长。步骤908可以涉及使用培养瓶或透气反应器,其中流体不通过泵移动。相反,生长室保持静止并且流体在添加到腔室后不会流动。
然后,流程900可以从步骤908到达步骤912,在步骤912中将第二细胞在静态生长室中静态生长。在一些实施方案中,第二细胞可以是造血祖细胞(例如,cd34+细胞)。在步骤912之后,可以从生长室中移除可能已经在静态生长室中扩增的第二细胞,用于在动态细胞扩增系统(例如,ces500和/或600)中的额外扩增,流体在其中可以随着细胞的扩增而循环(例如,自动地)。
然后,流程900可以到达步骤920,步骤920可以将第一细胞(例如,hmsc)引入到包括一些中空纤维的中空纤维生物反应器中。可以将在步骤920中引入的细胞引入中空纤维的内部(内腔)。
在一些实施方案中,可以在步骤920之前调节中空纤维生物反应器中的中空纤维。例如,为了使hmsc粘附到中空纤维的内壁,中空纤维例如可以涂覆有糖蛋白(纤连蛋白、胶原蛋白)。涂覆过程可能涉及一些子步骤。
步骤920可涉及使用处理器(1100,(图11))、泵、阀、流体导管等以将第一细胞引入生物反应器中。在一个实施方案中,步骤920可以涉及打开阀(例如,564、514、664和/或614)并激活泵(例如,554和654)。
步骤920可以涉及一些子步骤。在一些实施方案中,作为将细胞引入中空纤维生物反应器的一部分,生物反应器可以在子步骤922旋转。例如,为了使第一细胞尽可能多的附着到中空纤维的内部(内腔)上,生物反应器可以以特定模式旋转。
图10a-d示出了在将第一细胞引入并附着到中空纤维内部的过程期间中空纤维1000(例如,纤维116(图1))的横截面。在图10a中,用泵将具有第一细胞1008的流体1004在中空纤维膜的毛细管内空间周围循环(参见图5和6以及上面的描述)。如图10a所示,最初1008细胞分布在整个流体中。
然后可以停止泵,如10b所示,这引起第一细胞沉降,并且在一段时间之后,附着到中空纤维的内部1012的一部分上。在一些实施方案中,中空纤维可以预先涂覆有化合物,以促进细胞与中空纤维内壁的粘附。例如,中空纤维的内腔可以涂覆有糖蛋白(诸如纤连蛋白)。
在第一细胞1008已沉降并附着之后,生物反应器(且因此纤维1000)可旋转180度。用于在装载细胞时旋转生物反应器以便将细胞更均匀地分布在中空纤维的内表面上的方法的实例至少描述于2017年4月11日出版的题为“在生物反应器中扩增细胞”的美国专利no.9,617,506中,通过引用整体并入本文,如同在本文中完整阐述一样。
在一些实施方案中,在旋转之后,可以再次激活泵以使剩余的未附着的第一细胞1008在中空纤维膜的毛细管内空间中循环。在其他实施方案中,可以不重新激活泵。
如图10c所示,第一细胞1008的第二部分然后可以开始沉降并附着到中空纤维1000的内部1012的第二部分。在一段时间之后,第一细胞1008的第二部分可以如图10d所示附着。以这种方式,第一细胞1008(例如,hmsc)可以更均匀地分布在整个内表面1012周围,例如,中空纤维内部的顶部和底部。
再次参考图9,流程从步骤920到达步骤924,在步骤924中将第一细胞暴露于第一生长条件。可以优化第一生长条件以生长在步骤920引入的第一细胞。例如,步骤924可以涉及用第一生长培养基(可选步骤928)供养第一细胞,第一生长培养基包含用于培养第一细胞的营养物。生长培养基可包含各种营养物中的一种或更多种,包括葡萄糖、磷酸盐、盐等。
在预定的一段时间(其可取决于已在生物反应器内生长的一定数量的第一细胞)之后,流程900到达932,932可以将第二细胞(例如,hsc、造血祖细胞(cd34+)等)引入生物反应器中。在一些实施方案中,将第二细胞与第一细胞一样引入毛细管内空间。在其他实施方案中,如上所述,第一细胞可以在毛细管外空间中,而第二细胞可以引入毛细管内空间中。
在一些实施方案中,在引入第二细胞之前,可以进行洗脱程序以从生物反应器中移除先前的流体。如可以理解的,生物反应器中的流体可以包含适于使第一细胞生长的营养物。实施方案可以提供在步骤932之前或作为步骤932的一部分将该流体冲洗出生物反应器,并将第二细胞引入生物反应器中。
步骤932可以包括使用处理器(1100,(图11))、泵、阀、流体导管等以将第二细胞引入生物反应器中。在一个实施方案中,步骤932可以涉及打开阀(例如,564、514、664和/或614)并激活泵(例如,554和654)。
流程从步骤932转到步骤936,其将第二细胞暴露于第二生长条件。可以优化第二生长条件以使在步骤932引入的第二细胞生长。例如,步骤936可以包括用第二生长培养基(在可选步骤940处)供养第二细胞,其中第二生长培养基包含用于培养第二细胞的营养物。第二培养基可包含各种营养物中的一种或更多种,包括葡萄糖、磷酸盐、盐等。
另外,在一些实施方案中,步骤936可以涉及添加促进第二细胞(例如cd34+细胞)生长的生长因子的步骤944。在一些实施方案中,可以添加生长因子(例如细胞因子)以促进细胞的增殖。作为一个实例,当生长cd34+细胞时,生长因子可包括以下项中的一种或更多种:重组人flt3配体(rhflt-3l)、重组人干细胞因子(rhscf)、重组人血小板生成素(rhtpo)、重组人(rh)神经胶质衍生的神经营养因子及其组合。这仅是一个实例并且在其他实施方案中,可以使用不同的生长因子、生长因子的组合或其他蛋白质。在一些实施方案中,可以将生长因子添加到中空纤维生物反应器的毛细管内空间中。
在一个实施方案中,可以在步骤936将至少一部分生长因子与细胞一起引入。例如,可以用生长因子的组合调节在引入生物反应器时细胞处于其中的培养基,生长因子包括重组人flt3配体(rhflt-3l)、重组人干细胞因子(rhscf)、重组人血小板生成素(rhtpo)、重组人(rh)胶质细胞衍生的神经营养因子及其组合中的一种或多种。在这些实施方案中,步骤936和可选步骤944可以涉及补充可能已经与细胞一起添加到生物反应器中的生长因子。
流程从步骤936到达步骤948,在步骤948中以共培养扩增细胞。步骤948可以涉及一些可选的子步骤。例如,可以在可选子步骤952供养细胞。当细胞以共培养来扩增时,可以向细胞提供额外的葡萄糖或其他营养物。在子步骤956,可以控制其他条件以扩增细胞。例如,可以监测和改变温度、ph、气体浓度等,以控制细胞扩增的环境
流程900从步骤948进行到步骤960,在步骤960中将细胞从生物反应器中移除。步骤960可以涉及一些子步骤。例如,本身包括一些步骤的收获过程964可以作为步骤960的一部分来进行。在一些实施方案中,步骤964可以涉及改变生物反应器的毛细管内空间(ic)和外毛细管空间(ec)侧的循环速率。在其他实施方案中,步骤964可以涉及循环各种材料以确保可将其自身附着到纤维内表面的任何细胞从生物反应器中释放和移除。作为一个实例,可以添加蛋白酶来分解可以帮助细胞与纤维结合的蛋白质(诸如糖蛋白(纤连蛋白,胶原蛋白))。
在一个实施方案中,作为收获过程964的一部分,生物反应器内(例如,毛细管内空间)的流体可以以相对高的速率循环。流体的循环可以促进在步骤948扩增的细胞的悬浮。循环可以发生预定的一段时间,以确保扩增的细胞悬浮在流体中并且可以从生物反应器中回收尽可能多的细胞。流程900在步骤968结束。
根据本发明的实施方案,关于图7-9中所示的流程700、800和900,所描绘的操作步骤是出于说明目的而提供的,并且可以被重新排列、组合成其他步骤(例如,将步骤908和/或912添加到流程700和/或800中)、与其他步骤并行使用等。在不脱离本发明的精神和范围的情况下,可以在实施方案中使用更少或额外的步骤。而且,步骤(和任何子步骤)可以在一些实施方案中自动进行(诸如通过执行存储在存储器中的预编程任务的处理器(1100(图11))),其中仅用于说明目的而提供这些步骤。
此外,应注意,尽管上面已经以特定顺序的各个步骤描述了流程700、800和900,但是本发明不限于此。在其他实施方案中,各个步骤和子步骤可以以不同的顺序并行地进行,部分地以图7-9中所示的顺序(order)进行,和/或如图7-9所示的次序(sequence)进行。另外,指示由特定特征或结构进行的步骤或子步骤的以上描述并不旨在限制本发明。相反,仅用于说明目的而提供描述。在其他实施方案中可以使用上面未描述的其他结构或特征来进行流程700、800和900中的一个或更多个步骤。此外,流程700、800和900可以包括一些可选步骤。然而,上面未指示为可选的那些步骤不应认为是对本发明必不可少的,而是可以在本发明的一些实施方案中进行而不是在其他实施方案中进行。
图11示出了可以在其上实现本发明的实施方案的计算机系统1100的示例部件。例如,在细胞扩增系统使用处理器来执行任务(如作为诸如通过流程700、800和900以及上述示出的过程的一部分进行的自定义任务或预编程任务)的情况下,计算机系统1100可以用在实施方案中。
计算机系统1110可以包括用户界面1102、处理系统1104和/或贮存器(storage)1106。如本领域技术人员所理解的,用户界面1102可以包括输出设备1108,和/或输入设备1111。输出设备1108可以包括一个或更多个触摸屏,其中触摸屏可以包括用于提供一个或更多个应用窗口的显示区域。触摸屏还可以是输入设备1110,其可以例如从用户或操作者接收和/或捕获物理触摸事件。触摸屏可以包括具有电容结构的液晶显示器(lcd),该电容结构允许处理系统1104推断出触摸事件的位置,如本领域技术人员所理解的。然后,处理系统1104可以将触摸事件的位置映射到在应用窗口的预定位置中呈现的ui元素。根据实施方案,触摸屏还可以通过一个或更多个其他电子结构接收触摸事件。其他输出设备1108可以包括打印机、扬声器等。如本领域技术人员所理解的,其他输入设备1111可以包括键盘、其他触摸输入设备、鼠标、语音输入设备等。
根据本发明的实施方案,处理系统1104可以包括处理单元1112和/或存储器1114。处理单元1112可以是可操作以执行存储在存储器1114中的指令的通用处理器。根据一些实施方案,处理单元1112可以包括单个处理器或多个处理器。进一步地,在一些实施方案中,每个处理器可以是具有一个或更多个核心的多核处理器,以读取和执行单独的指令。如本领域技术人员所理解的,处理器可以包括通用处理器、专用集成电路(asic)、现场可编程门阵列(fpga)、其他集成电路等。
根据一些实施方案,存储器1114可以包括用于数据和/或处理器可执行指令的任何短期或长期存储。如本领域技术人员所理解的,存储器1114可以包括例如随机存取存储器(ram)、只读存储器(rom)或电可擦除可编程只读存储器(eeprom)。如本领域技术人员所理解的,其他贮存介质可以包括例如cd-rom、磁带、数字通用盘(dvd)或其他光学贮存器、录音带(tape)、磁盘贮存器、磁带(magnetictape)、其他磁贮存设备等。
贮存器1106可以是任何长期数据贮存设备或组件。根据一些实施方案,贮存器1106可以包括结合存储器1114描述的一个或更多个系统。贮存器1106可以是永久的或可移动的。在一些实施方案中,贮存器806存储由处理系统104生成或提供的数据。
实施例
以下提供可以实现实施方案的方面的一些实施例。尽管可以在这些实施例中描述特定特征,但是仅提供其用于说明和描述目的。本发明不限于以下提供的实施例。
实施例1
来自三(3)个供体的未经选择的脐带血来源的(cb)hsc、cd34+细胞的初始扩增通过脐带血的阳性免疫磁性选择从
表1:cb来源的cd34+细胞接种数和收获细胞数
图12示出了上表1中所示的一些数据的柱状图,即显示了从各个供体收获的细胞的平均数。图13示出了显示各个供体的代谢谱的图。图14示出了显示各种运行的代谢速率的图。
结果可表明,quantumces中空纤维膜生物反应器可以使用自动化ces支持共培养的cb来源的cd34+细胞、cd38-cd133+祖细胞的扩增。rhflt-3l、rhscf、rhtpo、rh神经胶质衍生的神经营养因子的生长因子补充物可以支持cb来源的cd34+谱系细胞的共培养。扩增的cb来源的cd34+细胞可以在适当的细胞因子和补充物(scf、gm-csf、il-3、gsf、epo)存在下证明谱系分化。下表2提供了流式细胞术结果的总结。
表2:流式细胞术结果的总结
实施例2
使用补充有fbs或人ab血清的imdm培养基单培养或与人间充质干细胞(hmsc)共培养从allcells获得i-mag选择的人hsccbcd34+细胞(冷冻cb008f-2)的培养物,以改善开发cd34+扩增的培养基成本框架。细胞培养设备包括wilsong-rex10透气性膜设备和传统的组织培养聚苯乙烯培养瓶。在第一次实验的结果之后,决定切换到含有改良的imdm(bsa、rh-胰岛素、转铁蛋白)加fbs或人血清ab的stemspanspemii培养基以及决定增加细胞接种密度以便改善细胞生长和生物标志物表达。
实验1
将在gibcoα-mem(目录号32561-037)完全培养基(cm224)中的hmsc-p2t1以1,000个细胞/cm2接种t25tcps培养瓶,在37℃(5%co2)下孵育,并在第6天于接种解冻的cbcd34+细胞之前生长至80%汇合度。相比之下,没有hmsc接种到wilsong-rex透气性细胞培养设备中。将cbcd34+细胞以2.0×104/ml的浓度接种,并用7mlgibcoimdm(目录号31980-030)、20%hyclonefbs(目录号sh30070.03)或18%akronhs-ab(目录号ak9340-0100),加上gibco青霉素/链霉素/新霉素抗生素(目录号15640-055),生长四(4)天。cd34+细胞接种密度基于推荐以将细胞浓度维持在3.0×104/ml以下。称重培养容器以确定培养体积,并在第0天、第2天和第4天用校准的beckmancoultervi-cellxr细胞活力分析仪获得细胞计数。
实验2
将在gibcoα-mem完全培养基(cm231)中的hmsc-p2t1以8.48×103/cm2接种六(6)个t25tcps培养瓶,在37℃(5%co2)下孵育,并在第3天于解冻的(37℃)cbcd34+细胞(allcellscb-cd34+,目录号cb008f-2,id号cbp140129c)接种之前生长至80%汇合度。将cbcd34+细胞(2.5ml)重悬于22.5mlstemspansfemⅱ培养基中,以500×g离心7分钟,分别重悬于10ml完全培养基中,并用校准的beckmancoultervi-cellnr细胞活力分析仪计数。每个培养瓶培养基更换为6ml无菌过滤(corning0.22μmpes)stemspansfemii完全培养基20%fbs(hyclone目录号sh30070.03)或20%hs-ab(innovativeresearch(cat.ipla-serab-otc-16138))、gibco青霉素/链霉素/新霉素抗生素(目录号15640-055)。将在补充20%fbs或20%hs-ab的stemspansfemii培养基中的cbcd34+细胞以3.00x104/ml或3.00x105/ml接种总共四(4)个t25共培养培养瓶,每个培养瓶6ml,在37℃(5%co2)下孵育四(4)天。在第2天从每个瓶中移除悬浮细胞,转移至15ml无菌离心管中,以500×g离心7分钟,分别重悬于6ml完全stemspansfemii培养基中,并返回t25共培养瓶进行孵育。第4天,悬浮细胞图像通过相差显微镜照相(具有qcapturepro6.0软件的olympusckx41)拍摄,称量培养瓶以确定培养瓶体积,并如前所述计数细胞。制备高细胞接种密度的等分试样(1.25×105个细胞)用于使用流式细胞术准备方案的改良版本的流式细胞术染色(bdpharmingenfitc小鼠抗人cd34cat.555821、bdpharmingenfitc小鼠igg1κ同型对照cat.555748、bdpharmingenapc小鼠抗人cd38cat.555462、bdpharmingen小鼠igglκ同型对照cat.555751、bdpharmingenpe小鼠抗人cd34cat.555822、bdpharmingenpe小鼠igg1κ同型对照cat.555749、miltenyibioteccd133/1-pecat.180-080-801)。使用配备有bd
实验1可评估在使用补充有20%fbs或18%hs的imdm基础培养基的7ml总体积中以2.00×104/ml的低接种密度的脐带血来源的cd34+细胞的单培养和共培养。t25组织培养聚苯乙烯(tcps)培养瓶和透气性g-rex-10容器用作主要静态培养环境。
图15示出了显示来自使用fbs的实验1的细胞计数的图。图16示出了显示来自使用人血清的实验1的细胞计数的图。
fbs和hs补充的imdm均证明了第2天细胞计数的增加。然而,到第4天,细胞浓度也会降低。在两种补充培养基中,从第2天到第4天,细胞膜完整性也降低,其中fbs从87%降低至76.4%,hs从88.5%降低至76.3%。对我们而言,这可能是由于第3天缺乏培养基更换或2.00x105/ml的低细胞接种密度所致。总之,补充20%fbs培养基到第4天可在共培养培养中产生7.5-7.6倍增加、单培养培养产生7.1倍增加、g-rex-10单培养产生7.0-7.2倍增加。相比之下,补充18%hs培养基到第4天可使共培养培养产生7.3-7.5倍增加、单培养培养产生6.8倍增加、g-rex10单培养产生6.7-6.9倍增加。
实验2可以评估低接种密度和高接种密度。图17示出了显示在低接种密度和高接种密度条件下的cd34+细胞的图。在6ml补充有20%fbs的stemspansfemⅱ中,低(3.00x104/ml)和高(3.00x105/ml)cbcd34+细胞接种密度均可分别在第4天产生57%和36%的悬浮细胞计数增加。相反,补充有20%hs-ab的培养基在4天培养期的同一时间内可减少悬浮细胞计数。
图18示出了显示流式细胞术结果的柱状图。这些流式细胞术结果表明,大多数cd34+细胞也可以在高细胞接种条件下在补充fbs或hs-ab的培养基中表达cd38+生物标志物。cd38生物标志物可以指示早期祖细胞cd34+细胞群。在第4天后的短期培养中,更成熟的cd34+细胞在扩增期间可逐渐变为cd38低/-。cd133+cd34+血液祖细胞可能是接受自体外周血干细胞移植的患者血小板植入的推测标志物。这些数据还表明,补充fbs和hs-ab的培养基可在静态共培养中支持cd133+细胞亚群,分别为30%和47%。
实施例3
以下是可以在一些实施方案中使用的方案的实施例。该方案表明当使用细胞扩增系统(ces)时所采用的来自常规方案的可能修改。
ces细胞装载修改3-具有cric.分配&旋转的装载
可以使用下面以组合的粗体、下划线和斜体显示的以下修改来进行传统的预先选择的msc扩增方案。将生物反应器旋转180度并使细胞沉降到中空纤维膜(hfm)的顶部5分钟。然后将生物反应器旋转至“原位”水平位置并继续进行扩增方案。修改的基本原理是将细胞分布在生物反应器中空纤维的整个表面区域上(图10a-d)。
第0天:用旋转附着饲养层(feeder)细胞
目的:使贴壁细胞附着到生物反应器膜上,同时允许在ec循环回路上流动。ic回路的泵流量设定为零。
在用分配和旋转将细胞装载到所有ces之前,使用以下现有/修改步骤任命自定义任务:通过触摸屏显示器或gui配置>任务。这些溶液和相应的体积基于这些自定义任务的默认或修改设置。
表3:用于附着细胞的溶液,修改
表4:hmsc供养层装载和接种
在第2天或根据需要返回常规细胞供养任务,并使用供养细胞任务继续预培养的hmsc扩增方案。
第5天:用旋转引入cbcd34+悬浮细胞
用于cbcd34+细胞的ic/ec交换和条件培养基。
将scgm基础培养基接合到ic培养基线。分别进行ic/ec洗脱和条件培养基任务。
将具有cbcd34+细胞悬浮液scgm(98ml)+stemcel12max100x补充物(2ml)的细胞入口袋接合到使用无菌焊接的系统的细胞入口管线。
表5:cbcd34+细胞装载和接种
收获前细胞的重悬
该循环任务的目的是在开始收获任务之前重悬可能在共培养期间附着于hmsc饲养层的细胞。
表6:细胞的循环和重悬
收获
具有修改的ces收获任务
表7:收获、修改
对于本领域技术人员显而易见的是,在不脱离本发明的范围的情况下,可以对本发明的方法和结构进行各种修改和变化。因此,应该理解,本发明不限于给出的特定实施例。相反,本发明旨在覆盖所附权利要求及其等同物的范围内的修改和变化。
虽然已经阐明和描述了本发明的示例性实施方案和应用,但是应该理解,本发明不限于上述精确配置和资源。在不脱离本发明的范围的情况下,可以对本文公开的本发明的方法和系统的设置、操作和细节进行对本领域技术人员显而易见的各种修改、改变和变化。
- 还没有人留言评论。精彩留言会获得点赞!