毛发再生用细胞包埋珠及其制备方法以及毛发再生用试剂盒与流程
本发明涉及毛发再生用细胞包埋珠(cell-embeddedbeads)及其制备方法以及毛发再生用试剂盒(kit)。本申请基于申请日为2016年6月17日、在日本申请的申请号为特愿2016-120808号要求优先权,其内容援引于本申请。
背景技术:
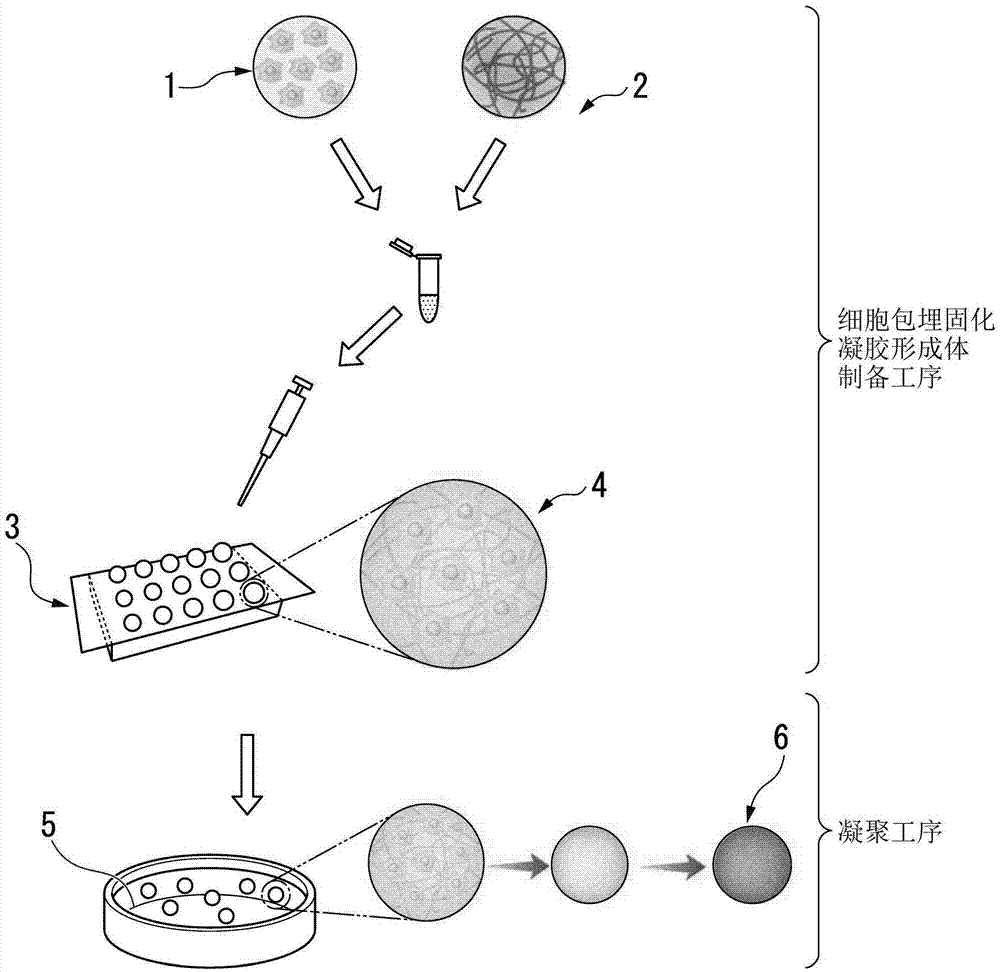
:就值得用于临床应用的毛囊再生医疗的建立而言,需要再生毛囊具有正常的组织结构且具有适于移植部位的毛干的毛发形成并延伸。包括毛发等的皮肤附属器官的外胚层性附属器官通常在胎儿期借助于上皮类细胞及间充质类细胞的相互作用而产生。众所周知,作为外胚层性附属器官之一的毛囊在个体的生命中重复生长和退化(毛发周期),生长期的毛球部的再生是由与毛囊器官产生期相同的分子机制诱导的。此外,认知为像这种毛发周期中的毛球部的再生是由作为间充质类细胞的毛乳头细胞诱导的。即,在生长期中,毛囊上皮干细胞通过作为间充质类细胞的毛乳头细胞来进行分化诱导而使毛球部再生。目前为止,针对毛囊再生尝试了利用替换间充质类细胞(真皮乳头细胞及真皮毛根鞘细胞)的毛囊可变区域的再生或利用具有毛囊诱导能力的间充质类细胞的毛囊新生、利用上皮类细胞及间充质类细胞的毛囊的重建等。具体而言,可例举如下方法:通过利用向源自身体的多种细胞添加wnt信号激活剂的培养液进行混合培养,来形成原始毛囊器官的方法(例如,参照专利文献1);制备在毛囊间充质类细胞的细胞集块(球状体)的外侧粘结有上皮细胞的人工毛球体的方法(例如,参照专利文献2);以及将毛乳头细胞的球状体(spheroid)与上皮类细胞一同进行移植而使毛发再生的方法(例如,参照非专利文献1)等。现有技术文献专利文献专利文献1:日本特开2013-78344号公报专利文献2:日本特开2003-70466号公报非专利文献非专利文献1:huang,y-c.,etal.,“scalableproductionofcontrollabledermalpapillaspheroidsonpvasurfacesandtheeffectsofspheroidsizeonhairfollicleregeneration”,biomaterials,vol.34,p442-451,2013.技术实现要素:发明所要解决的问题在现有的毛囊再生方法中,通过将在体外(invitro)再生的毛囊器官移植于皮肤来使正常的毛发从移植部进行再生的方法为常见的方法,但毛发再生效率存在问题。本发明是鉴于上述情况而完成的,提供具有高毛发再生活性的毛发再生用细胞包埋珠及其制备方法。用于解决问题的方案本发明人为了解决上述问题而反复锐意研究的结果,发现利用间充质类细胞来制备的毛发再生用细胞包埋珠具有高的毛发再生活性并完成了本发明。本发明包括以下方式。根据本发明第一方式的毛发再生用细胞包埋珠(cell-embeddedbeads)包含间充质类细胞(mesenchymalcells)及生物相容性水凝胶(biocompatiblehydrogel)。上述生物相容性水凝胶可以为凝胶化的细胞外基质(matrix)成分。上述细胞外基质成分可以为i型胶原蛋白。上述间充质类细胞的细胞密度可以为2×105细胞(cells)/cm3以下。根据本发明的第二方式的毛发再生用细胞包埋珠的制备方法包括:细胞包埋固化凝胶(cell-embeddedcuredgel)形成体制备工序,其中,制备包含间充质类细胞及生物相容性水凝胶的液滴,使上述生物相容性水凝胶固化(cure)而制备细胞包埋固化凝胶形成体;以及凝聚工序(aggregationstep),其中,对上述细胞包埋固化凝胶形成体进行悬浮培养,并借助于细胞的牵引力来进行凝聚。在上述细胞包埋固化凝胶形成体制备工序中,可向具有拒水性表面的支撑体进行滴加而制备上述液滴。在上述细胞包埋固化凝胶形成体制备工序中,包含于上述液滴中的上述间充质类细胞的浓度可以为5×105细胞(cells)/ml以上且1×108细胞(cells)/ml。根据本发明的第三方式的毛发再生用试剂盒(kit)具有根据上述第一方式的毛发再生用细胞包埋珠及上皮类细胞。发明的效果根据上述方式,可提供具有高的毛发再生活性的毛发再生用细胞包埋珠及其制备方法。附图说明图1为示意性地示出本发明一个实施方式的毛发再生用细胞包埋珠的制备方法的工序图。图2的(a)部分为示出实施例1中的利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)来观察培养3日后的毛发再生用细胞包埋珠及球状体的结果的图像。(b)部分为示出实施例1的培养3日后的毛发再生用细胞包埋珠及球状体的苏木精-伊红(he)染色的结果的图像。图3为示出试验例1中的培养3日后的毛发再生用细胞包埋珠、球状体及单层培养的进行了碱性磷酸酶(alp)染色的结果的图像。图4a为示出试验例1中的培养3日后的毛发再生用细胞包埋珠、球状体及单层培养的根据贝西-劳里方法的对碱性磷酸酶(alp)活性进行定量化的结果的图表。图4b为示出试验例1中的培养3日后的毛发再生用细胞包埋珠、球状体及单层培养的细胞数的图表。图5为示出试验例2中的培养3日后的毛发再生用细胞包埋珠及球状体中的相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的多功能蛋白聚糖(versican)的相对表达量的图表。图6a为示出试验例3中的培养3日后的毛发再生用细胞包埋珠及球状体中的相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的igfbp5的相对表达量的图表。图6b为示出试验例3中的培养3日后的毛发再生用细胞包埋珠及球状体中的相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的tgfb2的相对表达量的图表。图7为示意性地示出试验例4中的对裸鼠(nudemouse)的培养3日后的毛发再生用细胞包埋珠或球状体与上皮类细胞的混合物的利用贴片方法的皮下移植方法的图。图8的(a)部分及(b)部分为利用数码显微镜(vhx-1000基恩士(keyence)公司制造)来拍摄试验例4中的实施例1的从毛发再生用细胞包埋珠与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发的图像。(c)部分为利用数码显微镜(vhx-1000基恩士(keyence)公司制造)拍摄的取出了试验例4中的(a)的内部的毛发的状态的图像。(d)部分~(f)部分为利用扫描电子显微镜(scanningelectronmicroscope;sem)拍摄的试验例4中的实施例1的从毛发再生用细胞包埋珠与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发的图像。图9的(a)部分及(b)部分为利用数码显微镜(vhx-1000基恩士(keyence)公司制造)拍摄的试验例4中的比较例2的从间充质类细胞的球状体与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发的图像。(c)部分为利用数码显微镜(vhx-1000基恩士(keyence)公司制造)拍摄的取出了试验例4中的(a)的内部的毛发的状态的图像。(d)部分~(f)部分为利用扫描电子显微镜(scanningelectronmicroscope;sem)拍摄的试验例4中的比较例2的从间充质类细胞的球状体与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发的图像。图10a为示出试验例4中的实施例1的从毛发再生用细胞包埋珠或比较例2的间充质类细胞的球状体与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发数的图表。图10b为示出试验例4中的实施例1的从毛发再生用细胞包埋珠或比较例2的间充质类细胞的球状体与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发的粗度(thickness)的图表。图11a为示出实施例2中的利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)来观察培养3日后的毛发再生用细胞包埋珠(间充质类细胞的细胞数:5、10、20或40×103细胞/珠(beads))的结果的图像。图11b为示出实施例2中的毛发再生用细胞包埋珠(间充质类细胞的细胞数:5、10、20或40×103细胞/珠)的直径的随时间变化的图表。图12的(i)部分为示出试验例5中的实施例2的培养3日后的毛发再生用细胞包埋珠(间充质类细胞的细胞数:5、10、20或40×103细胞/珠)中的相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的多功能蛋白聚糖(versican)的相对表达量的图表。(ii)部分示出试验例5中的实施例2的培养3日后的毛发再生用细胞包埋珠(间充质类细胞的细胞数:5、10、20或40×103细胞/珠)中的相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的缺氧诱导因子-1α(hif1α)的相对表达量的图表。图13a为示出实施例3中的利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)观察培养3日后的毛发再生用细胞包埋珠(胶原蛋白的浓度:0.75、1.5、2.25、3.0mg/ml)的结果的图像。图13b为示出实施例3中的毛发再生用细胞包埋珠(胶原蛋白的浓度:0.75、1.5、2.25、3.0mg/ml)的直径的随时间变化的图表。图14为示出试验例6中的实施例3的培养3日后的毛发再生用细胞包埋珠(胶原蛋白的浓度:0.75、1.5、2.25、3.0mg/ml)中的相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的多功能蛋白聚糖(versican)的相对表达量的图表。图15a的(上)部分为示出利用共聚焦激光显微镜(lsm700卡尔·蔡司(carlzeiss)公司制造)观察的实施例4的布比斯他汀未添加(-)下培养3日后的毛发再生用细胞包埋珠及比较例3的布比斯他汀添加(+)下培养3日后的毛发再生用细胞包埋珠的结果的图像。(下)部分为示出利用共聚焦激光显微镜(lsm700卡尔·蔡司(carlzeiss)公司制造)观察的实施例4的布比斯他汀未添加(-)下培养3日后的毛发再生用细胞包埋珠及比较例3的布比斯他汀添加(+)下培养3日后的毛发再生用细胞包埋珠的结果的图像。图15b为示出实施例4的布比斯他汀未添加(-)下培养3日后的毛发再生用细胞包埋珠及比较例3的布比斯他汀添加(+)下培养3日后的毛发再生用细胞包埋珠的直径的随时间变化的图表。图16为示出试验例7中的实施例4的从布比斯他汀未添加(-)下培养开始起第一日及第三日的毛发再生用细胞包埋珠及比较例3的从布比斯他汀添加(+)下培养开始起第一日及第三日的毛发再生用细胞包埋珠中的相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的多功能蛋白聚糖(versican)的相对表达量的图表。图17a为示意性地示出试验例8中的实施例5的毛发再生用细胞包埋珠与上皮类细胞的混合物(hairbeads;hb)或参考例1的再生毛囊原基(hairfolliclegerms;hfg)的对裸鼠的利用贴片方法的皮下移植方法的图。图17b的(i)部分为利用数码显微镜(vhx-1000基恩士(keyence)公司制造)拍摄的试验例8中的实施例5的从hb的移植起三周后的裸鼠的移植部中的再生毛发的图像。(ii)部分为(i)部分的放大图像。(iii)部分为利用数码显微镜(vhx-1000基恩士(keyence)公司制造)拍摄的从参考例1的hfg的移植起三周后的裸鼠的移植部中的再生毛发的图像。(iv)部分为(iii)的放大图像。图17c为示出试验例8中的从实施例5的hb及参考例1的hfg的移植起三周后的裸鼠的移植部中的再生毛发数的图表。图18a的a)部分为利用数码显微镜(vhx-1000基恩士(keyence)公司制造)拍摄的试验例9中的实施例6的从利用人毛乳头细胞制备的毛发再生用细胞包埋珠与上皮类细胞的混合物(hb2)的移植起三周后的裸鼠的移植部中的再生毛发的图像。b)部分为利用数码显微镜(vhx-1000基恩士(keyence)公司制造)拍摄的试验例9中的参考例2的从再生毛囊原基(hfg2)的移植起三周后的裸鼠的移植部中的再生毛发的图像。图18b为示出试验例9中的从实施例6的hb2或参考例2的hfg2的移植起三周后的裸鼠的移植部中的再生毛发数的图表。图18c为示出试验例9中的实施例6的从hb2的移植起三周后的裸鼠的移植部的皮肤切片的he染色的结果的图像。图18d为利用sem拍摄的试验例9中的实施例6的从hb2的移植起三周后的裸鼠的移植部中的再生毛发的图像。具体实施方式以下,根据需要来参照附图,对本发明的实施方式进行详细说明。《毛发再生用细胞包埋珠》本发明一个实施方式的毛发再生用细胞包埋珠包含间充质类细胞及生物相容性水凝胶(biocompatiblehydrogel)。本实施方式的毛发再生用细胞包埋珠具有高毛发再生活性。因此,可通过利用本实施方式的毛发再生用细胞包埋珠,来实现高毛发再生效率。在本说明书中,“间充质类细胞”是指源自间充质组织的细胞或通过培养该细胞获得的细胞。作为间充质类细胞,具体而言,可例举的有,毛乳头细胞、真皮毛根鞘细胞、发育期的皮肤间充质类细胞、从万能细胞(例如,胚胎干(es)细胞、胚胎生殖(eg)细胞、人工多能性(ips)干细胞等)诱导的毛囊间充质类细胞等。在本说明书中,“上皮类细胞”是指源自上皮组织的细胞及通过培养该细胞获得的细胞。作为上皮类细胞,具体而言,例如,凸起区域的外毛根鞘最外层细胞、毛母基部的上皮类细胞、从万能细胞万能细胞(例如,胚胎干(es)细胞、胚胎生殖(eg)细胞、人工多能性(ips)干细胞等)诱导的毛囊上皮类细胞等。作为细胞的来源,优选地,为源自动物的细胞,更优选地,为源自脊椎动物的细胞,尤其优选地,为源自人类的细胞。在本说明书中,“毛发再生用细胞包埋珠”是指如上所述地包含间充质类细胞及生物相容性水凝胶且在后述的制备方法中借助于细胞的牵引力进行凝聚并可直接利用于生物体移植的珠(beads)。在本说明书中,“毛囊原基”是指作为毛囊的基部的组织,并由上述的间充质类细胞及上述的上皮类细胞构成。作为形成毛囊原基的流程,首先,通过上皮类细胞变厚并陷入间充质类细胞侧来包围间充质性细胞的细胞集块(球状体)。接着,包围有间充质性细胞的球状体(spheroid)的上皮性细胞形成毛母原基,间充质性细胞的球状体形成具有毛发诱导能力的毛乳头,来形成由毛母原基和毛乳头等构成的毛囊原基。在该毛囊原基中,毛乳头细胞向毛母细胞提供生长因子,并诱导毛母细胞的分化,所分化的细胞能够形成毛发。在本说明书中,“毛囊”是指表皮向内侧以呈筒状的方式进入的部分且产生毛发的皮肤的附属器官。在本说明书中,“再生毛囊原基”是指例如,利用本实施方式的毛发再生用细胞包埋珠和上皮类细胞来再生的毛囊原基。此外,在本说明书中,“毛发再生活性”是指在间充质类细胞中与毛发的再生相关的基因的表达增加。作为上述基因,可例举的有,多功能蛋白聚糖(versican)(多功能蛋白聚糖)、wnt、转化生长因子β(transforminggrowthfactor-β;tgf-β)、成纤维细胞生长因子(fibroblastgrowthfactors;fgf)等。在本实施方式中,上述的间充质类细胞的细胞密度需要稠密,并且为2×105细胞/cm3以下,优选地,为5×104细胞/cm3以上且2×105细胞/cm3以下,优选地,为7.5×104细胞/cm3以上且1.5×105细胞/cm3,更优选地,为9×104细胞/cm3以上且1.2×105细胞/cm3,尤其优选地,为1×105细胞/cm3。细胞密度处于上述范围内,可成为接近于毛乳头的细胞密度,可实现高毛发再生效率。在本说明书中,“生物相容性水凝胶”是指与生物体具有相容性的凝胶(gel),是聚合物通过化学键来取得网络结构而在该网格中保存有大量的水的物质。更具体地,是指向源自天然产物的聚合物或合成聚合物的人工材料中引入交联而进行凝胶化而获得的。作为源自天然产物的聚合物,可例举凝胶化的细胞外基质成分等。作为凝胶化的细胞外基质成分,可例举的有,胶原蛋白(i型、ii型、iii型、v型、xi型等)、由鼠ehs肿瘤提取物(包含iv型胶原蛋白、层粘连蛋白、硫酸乙酰肝素蛋白多糖等)重新构成的基底膜成分(产品名称:基底膜)、纤维蛋白、糖胺聚糖、透明质酸、蛋白多糖(proteoglycan)等。作为其他源自天然产物的聚合物,可使用明胶(gelatin)、琼脂、琼脂糖等。可通过选择各个适合于凝胶化的盐等的成分、其浓度、ph等来制备水凝胶。此外,还可对这些原料进行组合。此外,作为合成聚合物,可例举的有,聚丙烯酰胺、聚乙烯醇、甲基纤维素、聚环氧乙烷、聚(ii甲基丙烯酸羟乙酯)/聚己内酯(poly(ii-hydroxyethylmethacrylate)/polycaprolactone)等。此外,可利用两种以上的这些聚合物来制备水凝胶。其中,优选地,生物相容性水凝胶为源自天然产物的聚合物,更优选地,为凝胶化的细胞外基质成分,进一步优选地,为i型胶原蛋白。可通过包含i型胶原蛋白,形成接近于毛乳头的组成,并实现高毛发再生效率。《毛发再生用细胞包埋珠的制备方法》本发明一个实施方式的毛发再生用细胞包埋珠的制备方法包括:细胞包埋固化凝胶形成体制备工序,其中,制备包含间充质类细胞及生物相容性水凝胶的液滴,并使上述生物相容性水凝胶固化而制备细胞包埋固化凝胶形成体;以及凝聚工序,其中,对上述细胞包埋固化凝胶形成体进行悬浮培养,并借助于细胞的牵引力来进行凝聚。根据本实施方式的制备方法,可容易地获得具有高毛发再生活性的毛发再生用细胞包埋珠。图1为示意性地示出本发明一个实施方式的毛发再生用细胞包埋珠的制备方法的工序图。以下,参照图1,对本实施方式的毛发再生用细胞包埋珠的制备方法进行详细说明。细胞包埋固化凝胶形成体制备工序首先,使间充质类细胞1悬浮于含有生物相容性水凝胶2的溶液中,以制备适合于用途的大小的液滴。在本实施方式的制备方法中,间充质类细胞与如上所述的内容相同。作为细胞的来源,优选地,为源自动物的细胞,更优选地,为源自脊椎动物的细胞,尤其优选地,为源自人类的细胞。在本实施方式的制备方法中,生物相容性水凝胶可例举出与上述相同的物质。其中,生物相容性水凝胶优选地为源自天然产物的聚合物,更优选地,为凝胶化的细胞外基质(matrix)成分,进一步优选地,为i型胶原蛋白。可通过使用i型胶原蛋白,形成接近于毛乳头的组成,并实现高毛发再生效率。包含生物相容性水凝胶的溶液可含有ham’snutrientmixturesf-10或ham’snutrientmixturesf-12等的无血清培养基或用于生物相容性水凝胶重新组成的缓冲液(例如,由氢氧化钠、碳酸氢钠、羟乙基哌嗪乙磺酸缓冲液(hepes-buffer)形成的缓冲液等)等。当生物相容性水凝胶为胶原蛋白的情况下,溶液中的胶原蛋白浓度可以为例如,1.0mg/ml以上且10mg/ml以下,例如2.0mg以上且5.0mg以下。当溶液中的胶原蛋白浓度为上述范围时,如后述的实施例所示,作为生发(毛囊诱导)标记的多功能蛋白聚糖(versican)基因的表达增加,并能够以更高效率再生毛发。作为包含上述的间充质类细胞及生物相容性水凝胶的悬浊液中所含有的上述间充质类细胞的浓度,优选地,为5.0×105细胞/ml以上且1.0×108细胞/ml以下,更优选地,为2.5×106细胞/ml以上且5.0×107细胞/ml以下,进一步优选地,为2.5×106细胞/ml以上且2.5×107细胞/ml以下。当上述间充质类细胞的浓度为上述范围时,后述的凝聚工序后的细胞密度成为接近于毛乳头的细胞密度,并可实现高毛发再生效率。液滴的制备方法无特别限定,本发明所属
技术领域:
的普通技术人员可根据公知的方法来决定。可例举的有,向由油性成分形成的溶液中滴加包含上述的间充质类细胞及生物相容性水凝胶的悬浊液来制备液滴的方法或者如图1及后述的实施例向具有拒水性表面的支撑体3滴加上述的悬浊液来制备液滴的方法等。在本说明书中,所谓“拒水性”是指排斥水的性质。具体而言,作为拒水性,水接触角通常为90°以上,优选地,为100°以上,更优选地,为105°以上。此外,还包括水接触角超过150°的超级拒水状态。通过在支撑体的表面进行拒水处理或叠加具有拒水性的材料,可获得具有拒水性表面的支撑体。作为拒水处理,无特别限定,可例举的有,将烷基、烯基、烷氧基或烯氧基等的低级性的官能团或用氟原子取代一个以上的氢原子的烷基或烷氧基等的疏水性的官能团引入于基板表面的方法。此外,作为具有拒水性的材料,无特别限定,可例举:疏水性聚合物,例如聚丙烯、聚乙烯、聚砜等;含氯或氟的聚合物,如聚偏二氯乙烯、聚偏二氟乙烯、氟化碳、聚四氟乙烯等。作为支撑体的材料,无特别限定,可例举的有,树脂(例如,聚酯树脂、聚苯乙烯树脂、聚乙烯树脂、聚丙烯树脂、丙烯腈丁二烯苯乙烯树脂(acrylonitrilebutadienestyrene树脂;abs树脂)、尼龙树脂、丙烯酸类树脂、氟树脂、聚碳酸酯树脂、聚烯烃树脂、聚氨酯树脂、聚偏二氯乙烯、甲基戊烯树脂、酚树脂、三聚氰胺树脂、聚醚醚酮树脂、环氧树脂及氯乙烯树脂等)、金属(例如,金、银、铜、铝、钨、钼、铬、铂、钛、镍等)、合金(例如,不锈钢、哈斯特洛合金、铬镍铁合金、蒙奈尔铜镍合金、杜拉铝等)、玻璃(例如,玻璃、石英玻璃、熔融石英、合成石英、氧化铝、蓝宝石、陶瓷、镁橄榄石及光敏玻璃等)、半导体材料、硅、橡胶(例如,天然橡胶及合成橡胶)等,但并不限定于此。此外,还可在这些材料中组合多个材料。接着,将所制备的液滴静置20分钟以上且小于60分钟(优选地,30分钟)、25℃以上且小于40℃(优选地,37℃),使得生物相容性凝胶固化。随后,利用杜氏改良伊格尔培养基(dulbecco’smodifiedeagle’smedium:dmem)等的基本培养基来清洗表面并回收细胞包埋固化凝胶形成体。【凝聚工序】接着,将所回收的上述细胞包埋固化凝胶形成体在1日以上且10日以下、优选地为2日以上且4日以下,25℃以上且小于40℃(优选地,37℃)的条件下进行悬浮培养。使用的培养基无特别限定,包含细胞的生存增殖中所需的成分(无机盐、碳水化合物、激素、必需氨基酸、非必需氨基酸、维生素)等的基本培养基即可。可例举的有,杜氏改良伊格尔培养基(dmem)、低限量必需培养基(minimumessentialmedium;mem)、洛斯维·帕克纪念研究所-1640(rpmi-1640)、伊格尔基础培养基(basalmediumeagle;bme)、杜氏改良伊格尔培养基/f-12(dulbecco’smodifiedeagle’smedium:nutrientmixturef-12;dmem/f-12)、格拉斯哥极限必需培养基(glasgowminimumessentialmedium;glasgowmem)等。但并不限定于此。通过将细胞包埋固化凝胶形成体4在上述条件下进行悬浮培养,借助于细胞的牵引力进行凝聚,可取得与对上述的毛发再生用细胞包埋珠所示例的相同的细胞密度的毛发再生用细胞包埋珠6。此外,在本实施方式中的凝聚工序中,可再现实际上是在生物体的皮肤组织进行的如下的一系列的生成过程,即,间充质类细胞凝聚、形成毛乳头。因此,可获得具有高毛发活性的毛发再生用细胞包埋珠6。《毛发再生用试剂盒》本发明一个实施方式的毛发再生用试剂盒具有上述的毛发再生用细胞包埋珠及上皮类细胞。根据本实施方式的毛发再生用试剂盒能够以高效率再生毛发。作为毛发再生用细胞包埋珠及上皮类细胞,可例举与在上述的毛发再生用细胞包埋珠中示例的内容相同的。作为包含于毛发再生用细胞包埋珠中的间充质类细胞及上皮类细胞的来源,优选地,为源自动物的细胞,更优选地,为源自脊椎动物的细胞、尤其优选地,为源自人类的细胞。本实施方式的毛发再生用试剂盒还可具有后述中所示的可在移植时为了固定毛发再生用细胞包埋珠而使用的支撑体。此外,本实施方式的毛发再生用试剂盒还可具有为了移植毛发再生用细胞包埋珠及上皮类细胞而使用的器具(例如,镊子)等。《毛发再生用细胞包埋珠的使用方法》<毛发再生用细胞包埋珠的移植方法>优选地,当进行移植时,向移植部同时移植本实施方式的毛发再生用细胞包埋珠和上皮类细胞。作为用于移植的上皮类细胞,可例举在上述的毛发再生用细胞包埋珠中所示例的内容相同的内容。此外,优选地,对于上皮类细胞的包含于本实施方式的毛发再生用细胞包埋珠中的间充质类细胞的比率为0.1倍以上且100倍以下,更优选地,为1倍以上且10倍以下。此外,如后述的实施例中所示,在上述的毛发再生用细胞包埋珠的制备方法中,在细胞包埋固化凝胶形成体制备工序之后,混合上皮类细胞和细胞包埋固化凝胶形成体并经凝聚工序来制备毛发再生用细胞包埋珠和上皮类细胞的混合物也可。可通过将所得的毛发再生用细胞包埋珠和上皮类细胞的混合物移植到移植部,来使毛囊原基再生且再生毛发。能够用对本发明所属
技术领域:
的普通技术人员的公知的方法来将本实施方式的毛发再生用细胞包埋珠移植到对象部位。可使用例如,利用夏皮罗式植发术或崔氏植发器的植发、利用气压的植入器等来进行移植。所谓夏皮罗式植发术为利用微型手术刀等将移植部位做成移植伤口之后,利用镊子进行移植的方法。本实施方式的毛发再生用细胞包埋珠的移植量可根据试验动物(包括人类或非人类动物的各种哺乳动物,优选地为人类)的年龄、性別、症状、治疗部位、治疗时间等进行适当调节。此外,作为移植深度,可根据再生对象的部位适当变更。例如,可以为0.05mm以上且5mm以下,例如,可以为0.1mm以上且1mm以下,例如,可以为0.3mm以上且0.5mm以下。此外,作为移植的部位,优选地,向试验动物的真皮层内移植。进一步优选地,为毛囊形成及其后续的生发效率优秀的比真皮及皮下组织的边界面更上方的部位。此外,优选地,当以在移植伤口上端部露出毛囊原基的上皮类细胞成分的上端部的方式调节移植深度时,可进一步提高与试验动物的上皮类细胞之间的连续性。就本实施方式的毛发再生用细胞包埋珠而言,还可借助于皮肤接合用的胶带或带(band)、缝合等来将毛发再生用细胞包埋珠与移植对象部位固定。此外,本实施方式的毛发再生用细胞包埋珠还可利用支撑体固定。作为支撑体的材料,只要是在移植之后可促进包含于移植并所形成的再生毛囊原基中的上皮类细胞侧的部分与试验动物侧的上皮类细胞之间的连接,则无特别限定。作为支撑体的材料,具体而言,可例举的有,由尼龙等的聚合物或者合成或天然的生物体可吸收的聚合物制备而成的纤维、不锈钢等的金属纤维、碳纤维、玻璃纤维等的化学纤维、天然的动物纤维(源自生物体的毛发等)或植物纤维等,更具体地,可例举有尼龙线或不锈钢丝等。支撑体的直径及长度可根据作为再生对象的部分适当设计。直径可以为例如5μm以上且100μm以下,可以为例如20μm以上且50μm以下。此外,长度可以为例如1mm以上且10mm以下,外可以为例如4mm以上且6mm以下。此外,就本实施方式的毛发再生用细胞包埋珠而言,在利用支撑体的情况下,在移植本实施方式的毛发再生用细胞包埋珠及上皮类细胞之后,过一会儿确保了试验动物的上皮类细胞与再生毛囊原基的源自上皮类细胞侧之间的连续性之后,从移植部位移除支撑体。可根据移植后的状态来适当设定,但优选地,例如,在移植后3日以上且7日以下从移植部位移除。或者可放置到支撑体自然地从移植部位移除为止。生物体吸收性的材料的支撑体可放置到自然地从移植部位移除或被分解或被吸收为止。此外,就本实施方式的毛发再生用细胞包埋珠而言,在利用支撑体的情况下,毛囊原基的源自上皮类细胞的细胞沿着支撑体延伸。由此,可提高移植后的试验动物侧的上皮类细胞与毛囊原基的上皮类细胞侧之间的连续性。尤其是,在支撑体保持在比移植部位的表皮更外侧的情况下,试验动物侧的上皮类细胞沿着支撑体向移植部位的内侧延伸,以排除杂质,因此可进一步提高连续性。进而,可促使向目标方向形成毛囊。其结果,可使从毛囊原基的生发率得以提高的同时,还可控制生发方向。<毛发再生方法>此外,在本发明的一个方面中,提供用于因疾病或事故等而引起的表皮的缺陷或脱发等的毛发缺陷部位的治疗的毛发再生用细胞包埋珠。此外,在本发明的一个方面中,提供包含治疗的有效量的毛发再生用细胞包埋珠的药物组合物。此外,在本发明的一个方面中,提供包含上述药物组合物的毛囊再生治疗剂。此外,在本发明的一个方面中,提供用于制备包含上述药物组合物的毛囊再生治疗剂的上述毛发再生用细胞包埋珠的使用。此外,在本发明的一个方面中,提供因疾病或事故等而引起的表皮的缺陷或脱发等的毛发缺陷部位的治疗方法,上述治疗方法包括向需要治疗的患者移植上述毛发再生用细胞包埋珠的有效量。在本说明书中,作为包含可再生的毛囊组织的组织,无特别限定,只要是使毛囊再生且欲再生毛发的体表皮即可,可例举的有头皮等。此外,作为可适用的疾病,为伴随着脱发的任意疾病,例如男性型脱发症(androgeneticalopecia:aga)、女子男性型脱发症(femaleandrogeneticalopecia:faga)产后脱发症、弥漫性脱发症、脂溢性脱发症、秕糠性脱发症、牵引性脱发症、代谢异常性脱发症、压力性脱发症、斑秃、神经性脱发症、拔毛癖、全身性脱发症、症状性脱发症等,但不限定于此。作为治疗对象,无特别限定,可例举的有包括人类或非人类动物的哺乳动物,优选地为人类。实施例以下,举出实施例来进一步对本发明进行详细说明,但本发明不限定于这些实施例。[实施例1]小鼠毛发再生用细胞包埋珠的制备1(1)间充质类细胞及上皮类细胞的提取利用对参考资料「toyoshima,k.,etal.,“fullyfunctionalhairfollicleregenerationthroughtherearrangementofstemcellsandtheirniches”,nat.commun.,vol.3,no.784,2012.」中所记载的方法进行一部分修改的方法来提取了间充质类细胞及上皮类细胞。更具体地,提取妊娠小鼠(老鼠,mouse)c57bl/6jjcl的子宫内的胎龄为18日龄的小鼠胎儿的背部皮肤,在4℃温度、30rpm的振荡条件下进行中性蛋白酶(dispase,注册商标)ii(和光纯药工业株式会社(wako)生产)的处理1小时,使得上皮层与间充质层分离。接着,用100u/ml的胶原酶(和光纯药工业株式会社(wako)生产)处理上皮层2小时,进而,用胰蛋白酶处理10分钟上皮层,使得上皮类细胞分离。另一方面,用100u/ml的胶原酶(和光纯药工业株式会社(wako)生产)处理间充质层2小时,使得间充质类细胞分离。所得的间充质类细胞为1.0×107细胞(cells)、上皮类细胞为1.0×106细胞。(2)细胞包埋固化凝胶形成体制备工序接着,向所提取的间充质类细胞中的2.5×106细胞中添加杜氏改良伊格尔培养基(dulbecco’smodifiedeaglemedium;dmem)(含有10%胎牛血清(fetalbovineserum;fbs)、1%青霉素/链霉素(p/s)),并以1000rpm离心分离180秒之后,去除了上清液。接着,将间充质类细胞悬浮于1ml胶原蛋白1型(type1)(含有3mg/ml胶原蛋白,新田明胶株式会社生产)中。向培养皿的盖的里面(拒水性表面)分别滴加了2μl(5.0×103细胞/2μl)悬浊液。在37℃温度条件下培养30分钟,制备了细胞包埋固化凝胶形成体。(3)凝聚工序接着,利用移液器,从培养皿的盖的里面剥离了细胞包埋固化凝胶形成体。接着,将细胞包埋固化凝胶形成体放入培养皿中,添加杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s)并悬浮培养3日,制备了毛发再生用细胞包埋珠。(4)观察结果在图2的(a)部分示出利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)观察了从培养开始起3日后的毛发再生用细胞包埋珠的结果。从图2的(a)部分确认到毛发再生用细胞包埋珠中借助于细胞的牵引力而凝聚成平均直径2mm至0.5mm。(5)毛发再生用细胞包埋珠的苏木精-伊红(hematoxylin-eosin:he)染色(5-1)毛发再生用细胞包埋珠的切片的制备利用磷酸缓冲生理食盐水(phosphatebufferedsaline:pbs)清洗毛发再生用细胞包埋珠,并利用4%多聚甲醛(paraformaldehyde)进行了固定。接着,回收固定液,并分别在70%乙醇、90%乙醇、100%乙醇、2-丁醇中浸渍1小时。接着,利用显微镜用薄片切片机,来将毛发再生用细胞包埋珠切割成了微小的厚度。将所切割的切片垂直压在载玻片上并进行了转录。(5-2)苏木精-伊红(hematoxylin-eosin:he)染色所得的载玻片中滴加1ml二甲苯并静置1小时之后,去除了溶液。接着,滴加100%乙醇1ml并静置5分钟之后,去除了溶液。接着,滴加100%乙醇1ml,并再一次重复了相同操作。接着,滴加90%乙醇溶液1ml并静置5分钟之后,去除了溶液。接着,滴加70%乙醇溶液1ml并静置5分钟之后,去除了溶液。接着,滴加蒸馏水1ml并静置3分钟之后,去除了水分。接着,滴加迈耶·苏木精染色液(和光纯药工业株式会社(wako)生产)1ml并静置4分钟之后,去除了溶液。接着,在流水中浸渍13分钟并洗掉。接着,滴加伊红溶液(武藤化学株式会社生产)1ml并静置4分钟之后,去除了溶液。接着,滴加蒸馏水1ml并静置1分钟之后,去除了水分。接着,滴加70%乙醇溶液1ml并静置5分钟之后,去除了溶液。接着,滴加90%乙醇溶液1ml并静置5分钟之后,去除了溶液。接着,滴加100%乙醇1ml并静置5分钟之后,去除了溶液。接着,滴加100%乙醇1ml并再一次重复了相同的操作。接着,滴加二甲苯1ml并静置5分钟之后,去除了溶液。最后,滴加二甲苯1ml并再一次重复了相同的操作。当载玻片干燥时,滴下少量mount-quick(封片剂),用微盖玻片缓慢覆盖,以便不含气泡并密封。利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)所观察的结果在图2的(b)部分中示出。(5-3)结果及讨论从图2的(b)部分来看,在毛发再生用细胞包埋珠中的苏木精-伊红染色中,细胞质染色成粉红色,但未被染色成粉红色的部分存在几处。据推断,未被染色的部分为存在较多胶原蛋白的部分。[比较例1]作为比较例,将间充质类细胞以5.0×103细胞/孔接种在96孔板中,添加杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s),并单层培养了3日。[比较例2](1)球状体的制备作为比较例,将间充质类细胞的球状体制备成5.0×103细胞/球状体,添加杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s),并培养了3日。(2)观察结果在图2的(a)部分中示出利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)观察了从培养开始起3日后的球状体。从图2的(a)部分可确认到从培养开始起3日后的球状体的直径为约200μm。(3)球状体的苏木精-伊红(he)染色(3-1)球状体的切片的制备针对球状体,利用与实施例1的(5-1)相同的方法制备了切片。(3-2)苏木精-伊红(he)染色针对球状体,利用与实施例1的(5-2)相同的方法,进行了苏木精-伊红染色。在图2的(b)部分中示出利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)观察染色后的球状体的结果。从图2的(b)部分可确认到球状体中稠密地凝聚着细胞。[试验例1]碱性磷酸酶(alkalinephosphatase:alp)活性评估试验(1)碱性磷酸酶(alkalinephosphatase:alp)染色将实施例1的毛发再生用细胞包埋珠、比较例1的间充质类细胞的单层培养及比较例2的间充质类细胞的球状体浸渍于柠檬酸-丙酮固定液中30秒钟,并用去离子水冲洗了45秒钟。接着,利用染色液(固蓝rr盐(fastbluerrsalt)胶囊1胶囊(西格玛(sigma)公司生产)+去离子水48ml+萘酚as-mx磷酸盐碱性溶液(naphtholas-mxphosphatealkalinesolution,西格玛(sigma)公司生产)2ml),在避光、常温条件下染色了30分钟。接着,用去离子水冲洗了120秒钟。接着,利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造),分别观察了经碱性磷酸酶染色的实施例1的毛发再生用细胞包埋珠、比较例1的间充质类细胞的单层培养及比较例2的间充质类细胞的球状体。结果在图3中示出。从图3中确认到在单层培养中几乎未观察到作为毛乳头细胞的标记蛋白质而周知的碱性磷酸酶被活性化的细胞。另一方面,球状体及毛囊再生用细胞包埋珠中观察到了碱性磷酸酶的活性。尤其,毛囊再生用细胞包埋珠中观察到了碱性磷酸酶的强活性。(2)根据贝西-劳里方法的碱性磷酸酶(alp)活性的定量(2-1)细胞的破碎及细胞提取液的调配利用pbs(-)分别将实施例1的毛发再生用细胞包埋珠、比较例1的间充质类细胞的单层培养及比较例2的间充质类细胞的球状体清洗2次,加入1ml缓冲液(50mmol/ltris/hcl、ph7.6、0.1%(v/v)tritonx-100),在-80℃温度下冷冻保管。接着,将该冷冻和融解重复3次,利用一次性均质器(亚速旺(asone)株式会社生产)进行了均化。接着,超声处理30秒钟、涡旋10秒钟重复2次,由此破坏了细胞膜。接着,以1300rpm离心分离10分钟,并回收上清液,得到细胞提取液。(2-2)稀释标准溶液的调配标准溶液(0.5mmol/l的对硝基苯酚溶液)依次连续稀释,调配了0.5、0.25、0.125、0.0625、0mmol/l的2倍稀释系列。(2-3)alp反应分别取出在(2-1)中获得的细胞提取液20μl,并加入至96孔板中。作为标准列,向列的最末端的孔中加入(2-2)中所调配的稀释标准溶液各20μl。接着,向所有孔中加入基质缓冲液(对硝基苯磷酸二钠6.7mmol/l+2.0mmol/l氯化镁)各100μl。接着,将孔板避光,用酶标仪(帝肯(tecan)公司生产)搅拌1分钟之后,在37℃温度下培养了15分钟。此后,向各孔中加入反应终止溶液(0.2mol/l的氢氧化钠)各80μl来终止反应。(2-4)分析接着,用酶标仪(帝肯(tecan)公司生产)搅拌1分钟之后,用酶标仪测定各细胞提取液的405nm处的吸光度,并计算了各细胞提取液中的alp活性。将结果在图4a中示出。在图4中,“凝胶珠(gelbeads)”表示实施例1的毛发再生用细胞包埋珠,“球状体(spheroid)”表示比较例2的间充质类细胞的球状体,“单层(monolayer)”表示比较例1的间充质类细胞的单层培养。此外,图4b为示出测定了细胞提取液调配前的悬浮培养3日后的毛发再生用细胞包埋珠、球状体及单层培养的细胞数的结果的图表。(2-5)结果与讨论在图4a中,alp活性的高度为“凝胶珠”(实施例1的毛发再生用细胞包埋珠)>“球状体”(比较例2的间充质类细胞的球状体)>“单层”(比较例1的间充质类细胞的单层培养)。此外,在图4b中,用相同数量的接种细胞数培养3日后的细胞数为“凝胶珠”(实施例1的毛发再生用细胞包埋珠)<“球状体”(比较例2的间充质类细胞的球状体)<“单层”(比较例1的间充质类细胞的单层培养)。据报告,间充质类细胞的细胞倍增时间(细胞数量加倍所需的时间)为24小时。在比较例1的间充质类细胞的单层培养中,如报告所示,以约24小时的细胞倍增时间增殖(培养开始时5.0×103细胞→培养3日后4.5×104细胞)。另一方面,在实施例1的毛发再生用细胞包埋珠及比较例2的间充质类细胞的球状体中几乎未观察到细胞数的增加。通常,已知间充质类细胞在每当增殖时(每当增加传代数),都失去作为毛乳头细胞标记的alp活性。基于本研究结果,alp活性以细胞增殖较少的实施例1的毛发再生用细胞包埋珠、比较例2的间充质类细胞的球状体、比较例1的间充质类细胞的单层培养的顺序变高,因此可推断实施例1的毛发再生用细胞包埋珠因细胞增殖受到抑制,alp活性得以维持。[试验例2]多功能蛋白聚糖(versican)基因的聚合酶链式反应(pcr)分析使用实施例1的毛发再生用细胞包埋珠及比较例2的间充质类细胞的球状体进行了作为生发标记蛋白质的多功能蛋白聚糖(versican)基因的逆转录-聚合酶链反应(rt-pcr)分析。(1)核糖核酸(rna)提取首先,将实施例1的毛发再生用细胞包埋珠及比较例2的间充质类细胞的球状体分别回收在15ml试管中,并当毛发再生用细胞包埋珠或球状体沉淀时,去除了上清的培养基,使得成为1ml溶液。接着,将成为1ml的含有毛发再生用细胞包埋珠或球状体的溶液移入1.5ml微管中。接着,在4℃温度、5000rpm条件下离心分离3分钟。因丢弃残留的培养基,该操作是为了使毛发再生用细胞包埋珠或球状体沉淀的同时,在离心机内的预冷却而进行。接着,丢弃了上清(培养基)之后,加入缓冲液(buffer)rlt350μl,并充分移液。接着,将移液后的溶液回收在qiashredder离心柱中,在4℃温度、10000rpm条件下离心分离2分钟。接着,丢弃qiashredder离心柱的上部,向收集管内的溶液加入70%乙醇350μl,并转移至rneasy离心柱。接着,在4℃温度、10000rpm条件下离心分离15秒钟。接着,丢弃收集管内的滤液,并加入700μl的缓冲液(buffer)rw1,在4℃温度、10000rpm条件下离心分离15秒钟。接着,丢弃收集管内的滤液,并加入缓冲液(buffer)rpe500μl,在4℃温度、10000rpm条件下离心分离15秒钟。接着,丢弃收集管内的滤液,并加入缓冲液(buffer)rpe500μl,在4℃温度、10000rpm条件下离心分离2分钟。接着,将离心分离后的柱子移至新的2ml收集管,在4℃温度、10000rpm条件下离心分离1分钟。这样是为了去除残留的缓冲液(buffer)rpe。接着,将离心分离后的柱子移至1ml微管中,加入30μl的无核糖核酸酶的水(rnasefreewater),并在4℃温度、10000rpm条件下离心分离1分钟。接着,向设置有离心分离后的柱子的1ml微管中再次加入30μl的无核糖核酸酶的水(rnasefreewater),并在4℃温度、10000rpm条件下离心分离1分钟,由此得到核糖核酸溶解液。(2)利用分光光度计的核糖核酸浓度测定接着,启动nanovue电源并将稀释率设定为60.0。这里,稀释率为核糖核酸的提取中的最终容量。接着,用70%乙醇擦拭测定板之后,将2μl的无核糖核酸酶的水(rnasefreewater)向测定板的中心涂敷,并按下[oa/100%t]按钮。在该操作中得到了基线。接着,将(1)中所得到的核糖核酸溶解液2μl涂敷(apply)于测定板的中心,并按下了测定按钮。a260/a280表示试样的纯度,靠近2.0为优选。接着,当测定下一个试样(核糖核酸溶解液)时,用擦拭纸擦拭并用70%乙醇擦拭之后使用。源自毛发再生用细胞包埋珠的核糖核酸溶解液的浓度为311μg/ml,源自球状体的核糖核酸溶解液的浓度为344μg/ml。(3)逆转录-聚合酶链反应(rt-pcr)接着,将在(2)中测定了浓度的核糖核酸溶解液稀释成150μg/ml,并在65℃温度下培养5分钟,然后在冰上冷却。接着,向微管中加入下列表1中所示的组成的溶液,并用透明膜覆盖。在表1中,核糖核酸表示源自毛发再生用细胞包埋珠的核糖核酸溶解液或源自球状体的核糖核酸溶解液。[表1]种类量(μl)无核的水(nuclearfreewater)125×rt缓冲液(rtbuffer)4混合引物(primermix)1混合酶(enzymemix)1核糖核酸2合计20接着,将其置于热循环仪中并确认其紧密关闭。接着,在37℃温度下进行15分钟的逆转录反应,98℃温度下进行5分钟的逆转录反应,分别得到了作为源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna及作为源自球状体的核糖核酸的逆转录产物的cdna。接着,向微管中加入如下表2中所示的组成的溶液,并用透明膜覆盖。在表2中,脱氧核糖核酸(dna)表示作为源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna或作为源自球状体的核糖核酸的逆转录产物的cdna。进而,聚合酶链反应中使用的引物的核苷酸序列(碱基顺序)示于表3中。[表2]种类量(μl)sybr绿色主混合物(greenmastermix)10正向引物(forwardprimer)0.4反向引物(reverseprimer)0.4燃料(dye)0.4无核的水(nuclearfreewater)7.8脱氧核糖核酸(dna)1合计20[表3]接着,将其置于热循环仪中并确认其紧密关闭。接着,利用在95℃温度下4分钟、(95℃温度下5秒钟、60℃温度下60秒钟)×45循环、72℃温度下10分钟的方案10(protocol)进行了聚合酶链反应。作为对照,测定了甘油醛-3-磷酸脱氢酶(gapdh)的表达量,并计算了相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的多功能蛋白聚糖(versican)的相对表达量。结果示于图5中。在图5中,“凝胶珠”表示实施例1的毛发再生用细胞包埋珠,“球状体”表示比较例2的间充质类细胞的球状体。就多功能蛋白聚糖(versican)基因的表达而言,在图5中确认到实施例1的毛发再生用细胞包埋珠与比较例2的间充质类细胞的球状体相比提高约3倍。通常,已知间充质类细胞在每当重复增殖时(每当增加传代数),多功能蛋白聚糖(versican)的表达降低。此外,据报告,球状体培养与培养皿上的单层培养相比,可维持多功能蛋白聚糖(versican)基因的表达。根据本研究结果表明了如下的可能性,即,实施例1的毛发再生用细胞包埋珠示出比比较例2的间充质类细胞的球状体更高的多功能蛋白聚糖(versican)基因的表达,根据实施例1的毛发再生用细胞包埋珠的间充质类细胞的培养法比现有的球状体的间充质类细胞的培养法更能成为适于间充质类细胞的培养法。[试验例3]igfbp5基因及tgfb2基因的聚合酶链反应(pcr)分析利用实施例1的毛发再生用细胞包埋珠及比较例2的间充质类细胞的球状体来评估了与生发相关的标记基因的表达。(1)核糖核酸(rna)的提取利用与试验例2的(1)相同的方法来从实施例1的毛发再生用细胞包埋珠及比较例2的间充质类细胞的球状体得到了核糖核酸溶解液。(2)利用分光光度计的核糖核酸(rna)浓度测定接着,利用与试验例2的(2)相同的方法来测定了实施例1的毛发再生用细胞包埋珠及比较例2的间充质类细胞的球状体的核糖核酸溶解液的浓度。源自毛发再生用细胞包埋珠的核糖核酸溶解液的浓度为398μg/ml,源自球状体的核糖核酸溶解液的浓度为279μg/ml。(3)逆转录-聚合酶链反应(rt-pcr)接着,利用与试验例2的(3)相同的方法来进行了逆转录反应,并得到了作为源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna或作为源自球状体的核糖核酸的逆转录产物的cdna。接着,除了代替多功能蛋白聚糖(versican)基因的扩增用的正向引物及反向引物而使用下列表4中所示的igfbp5基因及tgfb2基因的扩增用的正向引物及反向引物之外,利用与试验例2的(3)相同的方法来进行pcr反应,并计算了相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的igfbp5或tgfb2的相对表达量。结果示于图6a及图6b中。[表4]就igfbp5基因及tgfb2基因的表达而言,从图6a及图6b中确认到实施例1的毛发再生用细胞包埋珠与比较例2的间充质类细胞的球状体相比提高约1.6~3倍。据现有技术中报告,通过将小鼠间充质类细胞进行球状体培养,这些基因表达与单层培养相比明显增加。根据本研究结果表示,根据实施例1的毛发再生用细胞包埋珠的间充质类细胞的培养法比根据现有的球状体的间充质类细胞的培养法呈现出更高的igfbp5基因及tgfb2基因的表达。此外,在试验例2中确认到实施例1的毛发再生用细胞包埋珠比比较例2的间充质类细胞的球状体呈现出更高的多功能蛋白聚糖(versican)基因的表达。基于这些结果,表明与根据现有的球状体的间充质类细胞的培养法相比,根据实施例1的毛发再生用细胞包埋珠的间充质类细胞的培养法为能表达更高的毛发再生活性的培养法。可能的因素包括富含胶原蛋白的环境、与球状体相比得到改善的氧气供应及珠的制备中凝聚工序中的对细胞的机械刺激的贡献等。[试验例4]利用裸鼠的皮下移植试验(1)对裸鼠进行皮下移植利用贴片(patch)方法,将实施例1的毛发再生用细胞包埋珠及比较例2的间充质类细胞的球状体移植到裸鼠皮内。动物的饲养及动物实验遵照横浜国立大学动物实验委员会的指南进行。具体而言,首先,用异氟烷抽吸麻醉裸鼠,并用聚维酮碘对背部进行了消毒。接着,利用v标枪(v-lance)微型手术刀(日本爱尔康(alcon)公司制造),形成了从皮肤表皮层至真皮层下部的移植伤口(参照图7左)。接着,将实施例1的毛发再生用细胞包埋珠各30个/1处或比较例2的间充质类细胞的球状体各30个/1处与从妊娠小鼠(c57bl/6jjcl)子宫内的小鼠胎儿提取的上皮类细胞1.0×106细胞/1处混合,合计插入于3处的移植伤口(参照图7右)。此外,向一只裸鼠的左侧面的3处移植了实施例1的毛发再生用细胞包埋珠与上皮类细胞的混合物,向右侧面的3处移植了比较例2的间充质类细胞的球状体与上皮类细胞的混合物。从实施例1的毛发再生用细胞包埋珠与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发的状态示于图8中。此外,从比较例2的间充质类细胞的球状体与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发的状态示于图9中。此外,在图8及图9中,(a)部分、(b)部分为利用数码显微镜(vhx-1000,基恩士(keyence)公司制造)拍摄的移植部中的再生毛发的图像。(c)部分为利用数码显微镜(vhx-1000,基恩士(keyence)公司制造)拍摄的取出了(a)部分的内部的毛发的状态的图像。(d)部分~(f)部分为利用扫描电子显微镜(scanningelectronmicroscope;sem)拍摄的再生毛发的图像。此外,图10为示出从毛发再生用细胞包埋珠与上皮类细胞的混合物或者从比较例2的间充质类细胞的球状体与上皮类细胞的混合物的移植起一个月后的裸鼠的移植部中的再生毛发数(参照图10a)和再生毛发的粗度(参照图10b)的图。在图8及图9中,实施例1的毛发再生用细胞包埋珠与上皮类细胞的混合物的移植部中形成有成黑色块的毛发,从黑色块内观察到了大量的毛发。另一方面,比较例2的间充质类细胞的球状体与上皮类细胞的混合物的移植部中观察到了毛发的再生数量少,黑色块的大小也较小的状态。此外,形成的是任一毛发均具有表皮(cuticle)结构的形态正常的毛发。如图10所示,在分析各个再生毛发数量时,毛发再生用细胞包埋珠和上皮类细胞的混合物的移植部与比较例2的间充质类细胞的球状体和上皮类细胞的混合物的移植部相比,再生毛发数量多将近2倍。此外,再生毛发的粗度均为20μm,几乎与小鼠的体毛相同。基于以上结果表示,本发明的毛发再生用细胞包埋珠比球状体更能够实现高毛发再生效率。[实施例2]小鼠毛发再生用细胞包埋珠的制备2(1)间充质类细胞的提取利用与实施例1的(1)相同的方法来从妊娠小鼠c57bl/6jjcl的子宫内的胎龄18日龄的小鼠胎儿提取了间充质类细胞。(2)细胞包埋固化凝胶形成体制备工序接着,向所提取的间充质类细胞中的1.0×106细胞、2.0×106细胞、4.0×106细胞或8.0×106细胞中添加杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s),并以1000rpm离心分离180秒钟之后,去除了上清液。接着,将间充质类细胞悬浮于0.2ml胶原蛋白1型(type1)(含有3mg/ml胶原蛋白、新田明胶株式会社生产)中。向培养皿的盖的里面(拒水性表面)分别滴加了2μl(0.5×104、1.0×104、2.0×104、4.0×104细胞/2μl)悬浊液。在37℃温度条件下培养30分钟,制备了细胞包埋固化凝胶形成体。(3)凝聚工序接着,利用移液器,从培养皿的盖的里面剥离了细胞包埋固化凝胶形成体。接着,将细胞包埋固化凝胶形成体放入培养皿中,添加杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s)并悬浮培养3日,制备了毛发再生用细胞包埋珠。(4)观察结果利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)观察了从培养开始起3日后的毛发再生用细胞包埋珠,其结果示于图11a中。在图11a中观察到了伴随着包埋细胞数的增加,珠的直径变小的倾向。(5)毛发再生用细胞包埋珠的直径测定利用相差显微镜,取得了从培养开始起第0日、第一日及第三日的毛发再生用细胞包埋珠的图像。接着,利用imagej分析图像,并测定了毛发再生用细胞包埋珠的直径。结果示于图11b中。在图11b中,通过3日的培养,毛发再生用细胞包埋珠的直径产生动态性的变化,其直径为500~800μm。此外,观察到了伴随着包埋细胞数的增加,珠的直径变小的倾向。这被认为是由于细胞的牵引力导致珠内的胶原蛋白纤维凝聚,通过细胞数的增加来使得用于凝聚胶原蛋白纤维的力增加。[试验例5]多功能蛋白聚糖(versican)基因及hif1α基因的聚合酶链反应(pcr)分析利用实施例2的间充质类细胞的细胞数不同的毛发再生用细胞包埋珠,进行了作为生发标记蛋白质的多功能蛋白聚糖(versican)基因及作为低酶标记的hif1α基因的逆转录-聚合酶链反应(rt-pcr)分析。(1)核糖核酸(rna)的提取首先,利用与试验例2的(1)相同的方法来取得了实施例2的间充质类细胞的细胞数不同的毛发再生用细胞包埋珠的核糖核酸溶解液。(2)利用分光光度计的核糖核酸(rna)浓度测定接着,利用与试验例2的(2)相同的方法来测定了各毛发再生用细胞包埋珠的核糖核酸溶解液的浓度。(3)逆转录-聚合酶链反应(rt-pcr)接着,利用与试验例2的(3)相同的方法来得到了作为各源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna。接着,向微管加入上述表2中示出的组成的溶液,并用透明膜覆盖。在表2中,dna表示作为各源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna。进而,在聚合酶链反应中使用的引物的核苷酸序列示于表5中。[表5]接着,将其置于热循环仪中并确认其紧密关闭。接着,利用在95℃温度下4分钟、(95℃温度下5秒钟、60℃温度下60秒钟)×45循环、72℃温度下10分钟的方案进行了聚合酶链反应。作为对照,测定了甘油醛-3-磷酸脱氢酶(gapdh)的表达量,并计算了相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的多功能蛋白聚糖(versican)或hif1α的相对表达量。结果示于图12((i)多功能蛋白聚糖(versican)、(ii)hif1α)中。就多功能蛋白聚糖(versican)的相对表达量而言,在图12的(i)部分中确认到间充质类细胞的细胞数为1×104细胞/珠的毛发再生用细胞包埋珠呈现出了最高的基因表达。此外,伴随着珠内的间充质类细胞的细胞数增加,作为低氧标记的hif1α基因的表达量降低,另一方面,多功能蛋白聚糖(versican)基因的表达量减少。基于以上内容,通过使毛发再生用细胞包埋珠内的间充质类细胞的细胞数多于1×104细胞/珠(细胞密度:约1×105细胞/cm3),使得在一部分的细胞中产生了因低氧引起的生发活性的降低。因此,将1×104细胞/珠判断为毛发再生用细胞包埋珠内的间充质类细胞不陷入于低氧中且呈现出最高的毛囊诱导能力的包埋细胞数,并推进后续的实验。[实施例3]小鼠毛发再生用细胞包埋珠的制备3(1)间充质类细胞的提取利用与实施例1的(1)相同的方法来从妊娠小鼠c57bl/6jjcl的子宫内的胎龄18日龄的小鼠胎儿提取了间充质类细胞。(2)胶原蛋白溶液的调配接着,根据需要来将3mg/ml的胶原蛋白1型(type1)(新田明胶株式会社生产)用ph3的盐酸稀释,并调配了0.75mg/ml、1.50mg/ml、2.25mg/ml或3.00mg/ml的胶原蛋白溶液。(3)细胞包埋固化凝胶形成体制备工序接着,向所提取的间充质类细胞中的1.0×106细胞添加杜氏改良伊格尔培养基(含有10%fbs、1%p/s),并以1000rpm离心分离180秒钟之后,去除了上清液。接着,将间充质类细胞悬浮于在(2)中所调配的0.75mg/ml、1.50mg/ml、2.25mg/ml或3.00mg/ml的胶原蛋白溶液0.2ml中。向培养皿的盖的里面(拒水性表面)分别滴加了2μl(1.0×104/2μl)悬浊液,共滴加100个。在37℃温度条件下培养30分钟,制备了细胞包埋固化凝胶形成体。(4)凝聚工序接着,利用移液器,从培养皿的盖的里面剥离了细胞包埋固化凝胶形成体。接着,将细胞包埋固化凝胶形成体放入培养皿中,添加杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s)并悬浮培养3日,制备了毛发再生用细胞包埋珠。(5)观察结果利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)观察了从培养开始起3日后的毛发再生用细胞包埋珠,其结果示于图13a中。从图13a中观察到了随着胶原蛋白浓度的上升,珠的直径变大的倾向。(6)毛发再生用细胞包埋珠的直径测定利用相差显微镜,取得了从培养开始起第0日、第一日及第三日的毛发再生用细胞包埋珠的图像。接着,利用imagej分析图像,并测定了毛发再生用细胞包埋珠的直径。结果示于图13b中。在图13b中,通过3日的培养,毛发再生用细胞包埋珠的产生动态性的变化,其直径为300~900μm。此外,观察到了伴随着胶原蛋白浓度的上升,珠的直径变大的倾向。这被认为是胶原蛋白浓度,即,胶原蛋白纤维的密度越低,凝胶的交联越脆弱,从而借助于细胞的牵引力易于使凝胶收缩。[试验例6]多功能蛋白聚糖(versican)基因的聚合酶链反应(pcr)分析利用实施例3的胶原蛋白浓度不同的毛发再生用细胞包埋珠,进行了作为生发标记蛋白质的多功能蛋白聚糖(versican)基因的逆转录-聚合酶链反应分析。(1)核糖核酸(rna)的提取首先,就实施例2的间充质类细胞的细胞数不同的毛发再生用细胞包埋珠而言,利用与试验例2的(1)相同的方法得到了核糖核酸溶解液。(2)利用分光光度计的核糖核酸浓度测定接着,利用与试验例2的(2)相同的方法测定了各毛发再生用细胞包埋珠的核糖核酸溶解液的浓度。(3)逆转录-聚合酶链反应(rt-pcr)接着,利用与试验例2的(3)相同的方法,得到了作为各源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna。接着,向微管加入上述表2中示出的组成的溶液,并用透明膜覆盖。在表2中,dna表示作为各源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna。进而,在聚合酶链反应中利用的引物的核苷酸序列示于上述表3中。接着,将其置于热循环仪中并确认其紧密关闭。接着,利用在95℃温度下4分钟、(95℃温度下5秒钟、60℃温度下60秒钟)×45循环、72℃温度下10分钟的方案进行了聚合酶链反应。作为对照,测定了甘油醛-3-磷酸脱氢酶(gapdh)的表达量,并计算出了相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的多功能蛋白聚糖(versican)的相对表达量。结果示于图14中。在图14中观察到了随着胶原蛋白浓度减少,作为生发(毛囊诱导)标记的多功能蛋白聚糖(versican)基因的表达减少的倾向。基于以上内容表明,构成毛发再生用细胞包埋珠的胶原蛋白浓度为3.0mg/ml呈现出最高的生发活性,另一方面,通过使胶原蛋白浓度减少来可使生发活性降低。因此,判断3.0mg/ml作为构成毛发再生用细胞包埋珠的胶原蛋白浓度是适当的,并决定利用该浓度来推进后续的实验。[实施例4]小鼠毛发再生用细胞包埋珠的制备4(1)间充质类细胞的提取利用与实施例1的(1)相同的方法,从妊娠小鼠c57bl/6jjcl的子宫内的胎龄18日龄的小鼠胎儿提取了间充质类细胞。(2)细胞包埋固化凝胶形成体制备工序接着,向所提取的间充质类细胞中的1.0×106细胞添加杜氏改良伊格尔培养基(含有10%fbs、1%p/s),并以1000rpm离心分离180秒钟之后,去除了上清液。接着,将间充质类细胞悬浮于0.2ml胶原蛋白1型(type1)(含有3mg/ml胶原蛋白、新田明胶株式会社生产)中。向培养皿的盖的里面(拒水性表面)分别滴加了2μl(1.0×104细胞/2μl)悬浊液,滴加了100个。在37℃温度条件下培养30分钟,制备了细胞包埋固化凝胶形成体。(3)凝聚工序接着,利用移液器,从培养皿的盖的里面剥离了细胞包埋固化凝胶形成体。接着,将细胞包埋固化凝胶形成体放入培养皿中,添加杜氏改良伊格尔培养基(含有10%fbs、1%p/s)并悬浮培养3日,制备了毛发再生用细胞包埋珠。(4)肌动蛋白及核的染色利用多聚甲醛将从培养开始起3日后的毛发再生用细胞包埋珠进行固定,并以以下顺序染色了肌动蛋白(actin)及核。首先,向毛发再生用细胞包埋珠中添加pbs并静置1分钟,并去除了pbs。接着,重复相同操作2次,清洗了毛发再生用细胞包埋珠。接着,添加triton-x-100并静置10分钟(透彻)。接着,添加pbs并静置1分钟,并去除了pbs。接着,重复相同操作2次,清洗了毛发再生用细胞包埋珠。接着,添加罗丹明鬼笔环肽(rhodaminephalloidin)(分子探针(molecularprobes)公司生产),并静置30分钟来染色了肌动蛋白。接着,添加pbs并静置1分钟,并去除了pbs。接着,重复相同操作2次,清洗了毛发再生用细胞包埋珠。接着,添加4',6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole;dapi,和光纯药工业生产)并静置5分钟来对核进行了染色。接着,添加pbs并静置5分钟,并去除了pbs。接着,重复相同操作2次,清洗了毛发再生用细胞包埋珠。(5)观察结果利用荧光显微镜(dp-71,奥林巴斯(olympus)公司制造)及共聚焦激光显微镜(lsm700,卡尔·蔡司(carlzeiss)公司制造)来观察了从培养开始起3日后的毛发再生用细胞包埋珠的结果并示于图15a(上右:荧光显微镜像、下右:共聚焦激光显微镜像)中。在图15a(上右:荧光显微镜像、下右:共聚焦激光显微镜像)中,毛发再生用细胞包埋珠内的间充质类细胞形成有发达的肌动蛋白骨格。(6)毛发再生用细胞包埋珠的直径测定利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)来取得了从培养开始起第0日、第一日及第三日的毛发再生用细胞包埋珠的图像。接着,利用imagej分析图像,并测定了毛发再生用细胞包埋珠的直径。将结果示于图15b的(-)中。在图15b的(-)中,通过3日的培养,毛发再生用细胞包埋珠的直径产生动态性的变化,其直径为800μm左右。[比较例3](1)间充质类细胞的提取利用与实施例1的(1)相同的方法,从妊娠小鼠c57bl/6jjcl的子宫内的胎龄18日龄的小鼠胎儿提取了间充质类细胞。(2)细胞包埋固化凝胶形成体制备工序利用与实施例4的(2)相同的方法,制备了细胞包埋固化凝胶形成体。(3)凝聚工序接着,除了利用了添加有30μm的布比斯他汀(blebbistatin)的杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s)之外,利用与实施例4的(3)相同的方法,制备了毛发再生用细胞包埋珠。此外,众所周知,布比斯他汀为用于抑制与细胞的牵引力相关的肌球蛋白(myosin)的抑制剂,抑制发达的肌动蛋白骨格的形成。(4)肌动蛋白及核的染色就从培养开始起3日后的毛发再生用细胞包埋珠而言,利用与实施例4的(4)相同的方法来对肌动蛋白及核进行了染色。(5)观察结果利用荧光显微镜(dp-71,奥林巴斯(olympus)公司制造)及共聚焦激光显微镜(lsm700卡尔·蔡司(carlzeiss)公司制造)观察了从培养开始起3日后的毛发再生用细胞包埋珠,其结果示于图15a(上左:荧光显微镜像、下左:共聚焦激光显微镜像)中。在图15a(上左:荧光显微镜像、下左:共聚焦激光显微镜像)中,对于毛发再生用细胞包埋珠内的间充质类细胞未观察到肌动蛋白骨格的形成。(6)毛发再生用细胞包埋珠的直径测定利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)取得了从培养开始起第0日、第一日及第三日的毛发再生用细胞包埋珠的图像。接着,利用imagej分析图像,并测定了毛发再生用细胞包埋珠的直径。结果示于图15b的(+)中。在图15b的(+)中,通过3日的培养,毛发再生用细胞包埋珠的直径几乎未产生变化,依旧为约2.0mm左右。这被判断为因布比斯他汀的添加而使间充质类细胞的细胞牵引力受到抑制。[试验例7]多功能蛋白聚糖(versican)基因的聚合酶链反应(pcr)分析利用实施例4及比较例3的毛发再生用细胞包埋珠,进行了作为生发标记蛋白质的多功能蛋白聚糖(versican)基因的逆转录-聚合酶链反应(rt-pcr)分析。(1)核糖核酸(rna)的提取首先,对于实施例4及比较例3的毛发再生用细胞包埋珠,利用与试验例2的(1)相同的方法得到了核糖核酸溶解液。(2)利用分光光度计的核糖核酸(rna)浓度测定接着,利用试验例2的(2)相同的方法,测定了各毛发再生用细胞包埋珠的核糖核酸溶解液的浓度。(3)逆转录-聚合酶链反应(rt-pcr)接着,利用与试验例2的(3)相同的方法,得到了作为各源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna。接着,向微管中加入上述表2中示出的组成的溶液,并用透明膜覆盖。在表2中,dna表示作为各源自毛发再生用细胞包埋珠的核糖核酸的逆转录产物的cdna。进而,在聚合酶链反应(pcr)中利用了引物的核苷酸序列并示于上述表3中。接着,将其置于热循环仪中并确认其紧密关闭。接着,利用在95℃温度下4分钟、(95℃温度下5秒钟、60℃温度下60秒钟)×45循环、72℃温度下10分钟的方案进行了聚合酶链反应(pcr)。作为对照,测定了甘油醛-3-磷酸脱氢酶(gapdh)的表达量,并计算了相对于甘油醛-3-磷酸脱氢酶(gapdh)的表达量的多功能蛋白聚糖(versican)的相对表达量。结果示于图16中。此外,在图16中,(+)表示添加比较例3的布比斯他汀来培养的毛发再生用细胞包埋珠,(-)表示无添加实施例4的布比斯他汀来培养的毛发再生用细胞包埋珠。在图16中,从培养开始起第一日及第三日均呈现出了布比斯他汀(+)(比较例3)比布比斯他汀(-)(实施例4)多功能蛋白聚糖(versican)基因的表达明显较低的倾向。这被判断为布比斯他汀添加所引起的毛发再生用细胞包埋珠的收缩抑制是由于抑制了毛囊诱导基因(多功能蛋白聚糖(versican))的表达。以上内容表明,毛发再生用细胞包埋珠的收缩可有使间充质类细胞的毛囊诱导基因的表达增加的效果。[实施例5]小鼠毛发再生用细胞包埋珠与上皮类细胞的混合物的制备(1)间充质类细胞及上皮类细胞的提取利用与实施例1的(1)相同的方法,从妊娠小鼠c57bl/6jjcl的子宫内的胎龄18日龄的小鼠胎儿提取了间充质类细胞及上皮类细胞。(2)细胞包埋固化凝胶形成体制备工序接着,向所提取的间充质类细胞中的1.0×106细胞中添加杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s)并以1000rpm离心分离180秒钟之后,去除了上清液。接着,将间充质类细胞悬浮于0.2ml胶原蛋白1型(type1)(含有3mg/ml胶原蛋白、新田明胶株式会社生产)中。96孔板u型底(primesurface96uplate)(住友电木株式会社制造)的孔中各滴加2μl(1.0×104细胞/2μl)悬浊液。在37℃温度条件下培养30分钟,制备了细胞包埋固化凝胶形成体。(3)上皮类细胞的细胞悬浊液的调配接着,向杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s)与humedia-kg2培养基(仓敷纺绩(kurabo)株式会社生产)的1:1混合培养基中使在(1)中所提取的上皮类细胞悬浮,以成为1.0×105细胞/ml。(4)毛发再生用细胞包埋珠与上皮类细胞的混合物制备工序接着,将包含上皮类细胞的悬浊液各100μl添加至在(2)中所制备的包含细胞包埋固化凝胶形成体的孔中,并悬浮培养3日,制备了毛发再生用细胞包埋珠与上皮类细胞的混合物。[参考例1]小鼠再生毛囊原基的制备(1)间充质类细胞及上皮类细胞的提取利用与实施例1的(1)相同的方法,从妊娠小鼠c57bl/6jjcl的子宫内的胎龄18日龄的小鼠胎儿提取了间充质类细胞及上皮类细胞。(2)毛囊原基的形成接着,向96孔板u型底(住友电木株式会社制造)的孔中加入上皮类细胞(1×105细胞/ml)及间充质类细胞(1×105细胞/ml)的细胞混合悬浊液0.1ml(分别含有1×104cells的上皮类细胞及间充质类细胞),并培养3日,制备了再生毛囊原基。培养基使用了杜氏改良伊格尔培养基(dmem)(含有10%fbs、1%p/s)与humedia-kg2培养基(仓敷纺绩(kurabo)株式会社生产)的1:1混合培养基。[试验例8]利用裸鼠的皮下移植试验(1)对裸鼠进行皮下移植利用贴片方法,将实施例5的毛发再生用细胞包埋珠与上皮类细胞的混合物及参考例1的再生毛囊原基移植到裸鼠皮内。动物的饲养及动物实验遵照横浜国立大学动物实验委员会的指南进行。具体而言,首先,用异氟烷抽吸麻醉裸鼠,并用聚维酮碘对背部进行了消毒。接着,利用20gv标枪微型手术刀(爱尔康公司制造),形成了从皮肤表皮层至真皮层下部的移植孔。接着,利用微量移液器向该移植孔插入了实施例5的毛发再生用细胞包埋珠与上皮类细胞的混合物各1个/1处(合计50处)或者参考例1的再生毛囊原基各1个/1处(合计50处)(参照图17a)。图17a为示意性地示出实施例5的小鼠毛发再生用细胞包埋珠的制备方法及参考例1的再生毛囊原基的制备方法以及对裸鼠进行的借助于贴片方法的皮下移植方法的图。在图17a中,“hb”为“hairbeads”的简称,表示在实施例5中所制备的毛发再生用细胞包埋珠及上皮类细胞的混合物。此外,“hfg”为“hairfolliclegerms”的简称,表示参考例1的再生毛囊原基。从实施例5的毛发再生用细胞包埋珠与上皮类细胞的混合物(hb)及参考例1的再生毛囊原基(hfg)的移植起三周后,利用数码显微镜(vhx-1000,基恩士(keyence)公司制造)观察了移植部的结果并示于图17b中。此外,图17c为示出从实施例5的hb及参考例1的hfg的移植起三周后的裸鼠的移植部中的再生毛发数量的图形。(2)结果在图17b中,从移植起三周后,实施例5的毛发再生用细胞包埋珠与上皮类细胞的混合物(hb)及参考例1的再生毛囊原基(hfg)分别接枝在裸鼠的皮肤内,并观察了毛发生长的状态。此外,在图17c中,就再生毛发数量而言,hb比hfg呈现出明显高的值。基于以上内容表明,包含高密度的胶原蛋白的hb具有比hfg更高的毛发再生能力。[实施例6]利用人类毛乳头细胞的毛发再生用细胞包埋珠与上皮类细胞的混合物的制备(1)上皮类细胞的提取利用与实施例1的(1)相同的方法,从妊娠小鼠c57bl/6jjcl的子宫内的胎龄18日龄的小鼠胎儿提取了上皮类细胞。(2)细胞包埋固化凝胶形成体制备工序接着,人类毛乳头细胞(promocell公司生产)1.0×106细胞中添加人类毛乳头细胞增殖培养基(dpcgm)(promocell公司生产),并以1000rpm离心分离180秒钟之后,去除了上清液。接着,将间充质类细胞悬浮于0.2ml胶原蛋白1型(type1)(含有3mg/ml胶原蛋白、新田明胶株式会社生产)中。向96孔板u型底(住友电木株式会社制造)的孔中分别滴加悬浊液2μl(1.0×104细胞/2μl)。在37℃温度条件下培养30分钟,制备了细胞包埋固化凝胶形成体。(3)上皮类细胞的细胞悬浊液的调配接着,在人类毛乳头细胞增殖培养基(dpcgm)(promocell公司生产)与humedia-kg2培养基(仓敷纺绩(kurabo)株式会社生产)的1:1混合培养基中,使在(1)中所提取的上皮类细胞悬浮,以成为1.0×105细胞/ml。(4)毛发再生用细胞包埋珠与上皮类细胞的混合物制备工序接着,分别将包含上皮类细胞的悬浊液100μl添加至在(2)中所制备的包含细胞包埋固化凝胶形成体的孔中,悬浮培养3日,制备了毛发再生用细胞包埋珠与上皮类细胞的混合物。[参考例2]利用人类间充质类细胞及小鼠上皮类细胞的再生毛囊原基的制备(1)上皮类细胞的提取利用与实施例1的(1)相同的方法,从妊娠小鼠c57bl/6jjcl的子宫内的胎龄18日龄的小鼠胎儿提取了上皮类细胞。(2)毛囊原基的形成接着,向96孔板u型底(住友电木株式会社制造)的孔中加入上皮类细胞(1×105细胞/ml)及人类毛乳头细胞(promocell公司生产)(1×105细胞/ml)的细胞混合悬浊液0.1ml(分别含有上皮类细胞及人类毛乳头细胞1×104细胞),并培养3日,制备了再生毛囊原基。培养基使用了杜氏改良伊格尔培养基(deme)(含有10%fbs、1%p/s)和humedia-kg2培养基(仓敷纺绩(kurabo)株式会社生产)的1:1混合培养基。[试验例9]利用裸鼠的皮下移植试验(1)对裸鼠进行皮下移植利用贴片方法将实施例6的毛发再生用细胞包埋珠与上皮类细胞的混合物(以下称为“hb2”)及参考例2的再生毛囊原基(以下称为“hfg2”)移植于裸鼠皮内。动物的饲养及动物实验遵照横浜国立大学动物实验委员会的指南进行。具体而言,首先,用异氟烷抽吸麻醉裸鼠,并用聚维酮碘对背部进行了消毒。接着,利用20gv标枪微型手术刀(爱尔康公司制造)形成了从皮肤表皮层至真皮层下部的移植孔。接着,利用微量移液器向该移植孔插入了实施例6的毛发再生用细胞包埋珠与上皮类细胞的混合物各1个/1处(合计25处)或参考例2的再生毛囊原基各1个/1处(合计25处)。(2)观察结果从实施例6的毛发再生用细胞包埋珠与上皮类细胞的混合物(hb2)及参考例2的再生毛囊原基(hfg2)的移植起三周后,利用数码显微镜(vhx-1000,基恩士(keyence)公司制造)观察了移植部。将其结果示于图18a中。此外,图18b为示出从实施例6的hb2及参考例2的hfg2的移植起三周后的裸鼠的移植部中的再生毛发数量的图表。(3)切片的制备接着,切取了从实施例6的hb2的移植起三周后的裸鼠的移植部的皮肤。之后,10%中性缓冲福尔马林溶液(和光纯药工业株式会社(wako)生产)中浸渍1日,由此进行了组织的固定。之后,在10%、20%、30%的蔗糖溶液(通过稀释和光纯药工业株式会社(wako)生产的蔗糖来调配了溶液)中分别浸渍各1小时。向蔗糖取代的切片静静流入冻结组织切片制备用包埋剂(optimalcuttingtemperaturecompound:o.c.tcompound)(樱花检验仪器株式会社(sakurafinetekjapan)生产),封入了混合球状体。之后,利用低温显微镜用薄片切片机切割成微小的厚度。将切割的切片垂直压入载玻片上并进行了转录。(4)苏木精-伊红(he)染色接着,利用与实施例1的(5-2)相同的方法,对在(3)中所制备的切片进行了苏木精-伊红染色。将染色后的切片利用相差显微镜(ix-71,奥林巴斯(olympus)公司制造)观察,其结果示于图18c中。(5)毛发的表皮(cuticle)结构的观察为了确认毛发的表皮结构,将从实施例6的hb2的移植起三周后的裸鼠的移植部利用sem来进行了观察。其结果示于图18d中。(6)结果与讨论在图18a中,从移植起三周后,实施例6的毛发再生用细胞包埋珠与上皮类细胞的混合物(hb2)及参考例2的再生毛囊原基(hfg2)分别接枝于作为移植对象的裸鼠的皮肤内,并观察了毛发生长的状态。此外,在图18b中在再生毛发数量方面上hb2呈现出比hfg2明显高的值。此外,在图18c中确认到了hb2的移植部中形成有毛囊。此外,在图18d中确认到了在hb2的移植部中具有表皮结构毛发的再生。以上内容表明,包含高密度的胶原蛋白的hb2具有比hfg2更高的毛发再生能力。产业上的可利用性根据本发明,可提供具有高毛发再生活性的毛发再生用细胞包埋珠。进而,通过利用本发明的毛发再生用细胞包埋珠来实现高的毛发再生效率。(附图标记的说明)1:间充质类细胞;2:生物相容性水凝胶;3:具有拒水性表面的支撑体;4:细胞包埋固化凝胶形成体;5:培养基;6:毛发再生用细胞包埋珠序列表<110>国立大学法人横滨国立大学地方独立行政法人神奈川县立产业技术综合研究所<120>毛发再生用细胞包埋珠及其制备方法以及毛发再生用试剂盒<130>osp79760<160>10<170>patentin3.5版<210>1<211>17<212>dna<213>人工序列<220><223>合成<400>1gacgactgtcttggtgg17<210>2<211>17<212>dna<213>人工序列<220><223>合成<400>2atatccaaacaagcctg17<210>3<211>20<212>dna<213>人工序列<220><223>合成<400>3agaacatcatccctgcatcc20<210>4<211>20<212>dna<213>人工序列<220><223>合成<400>4tccaccaccctgttgctgta20<210>5<211>20<212>dna<213>人工序列<220><223>合成<400>5atgagacaggaatccgaaca20<210>6<211>20<212>dna<213>人工序列<220><223>合成<400>6tcaacgttactgctgtcgaa20<210>7<211>20<212>dna<213>人工序列<220><223>合成<400>7tcccgaataaaagcgaagag20<210>8<211>20<212>dna<213>人工序列<220><223>合成<400>8aagcttcgggatttatggtg20<210>9<211>22<212>dna<213>人工序列<220><223>合成<400>9ggagatccttcgaggagcactt22<210>10<211>25<212>dna<213>人工序列<220><223>合成<400>10ggcgatttagcagcagatataagaa25当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1