细胞膜穿透肽及包含其的细胞内输送载体的制作方法
本发明涉及细胞膜穿透肽及包含其的细胞内输送载体。
背景技术:
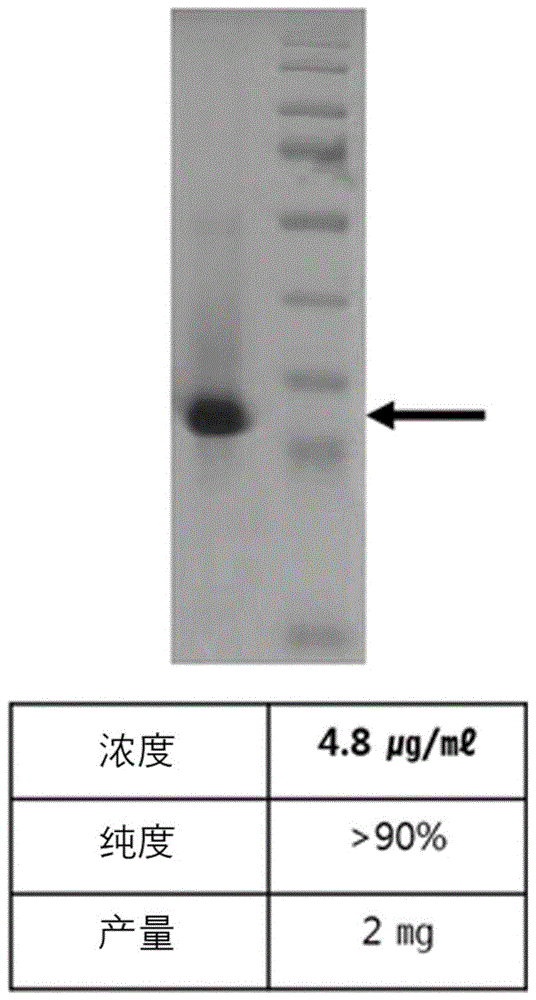
:人类免疫缺陷病毒(hiv,humanimmunodeficiencyvirus)的核衣壳蛋白质(nucleocapsid,以下,称为“nc”)不仅起到用于病毒个体形成的结构性作用,还在病毒的生命周期(virallifecycle)起到功能性的重要作用,其功能如下。第一,nc肽参与病毒的基因组衣壳化(genomicencapsidation)。这种功能基于由独特的cchc基序构成的2个锌指结构域,所述结构域在所有逆转录病毒(retrovirus)呈现高保存性,对于人类免疫缺陷病毒rna包装(packaging)和感染性病毒生产是必要。第二,nc肽在病毒的逆转录反应(reverstranscription,rt)过程中促进trna引物退火(annealing)和链转移(strandtransfer),由此可知,nc肽对于病毒复制(viralreplication)具有重要功能。第三,nc肽具有病毒的生命周期所需的核酸伴侣(chaperone)活性。最近,据报告,当病毒dna向宿主细胞染色体插入时,nc肽也起到一定作用。另一方面,细胞穿模肽(cellpenetratingpeptides:cpp)为由约10~30个左右的短肽构成的细胞膜穿透性肽,大多数由蛋白质-穿透结构域(protein-transductiondomain)或膜转运序列(membrane-translocatingsequence)诱导。与外部物质的常规细胞内流入途径不同,细胞穿模肽在不损伤细胞膜的同时向细胞内移动,还可将以无法通过细胞膜的dna或蛋白质向细胞内传递。作为细胞穿模肽而众所周知的肽具有tat肽,所述tat肽从人类免疫缺陷病毒(humanimmuno-deficiencyvirus:hiv)诱导,目前在如细胞治疗剂或诊断试剂的各种方面应用并使用。并且,从同源域转录因子的dna-结合域诱导的穿膜肽(penetratin)用于将对人体有用的蛋白质向皮肤传递。转运素(transportan)为融合称作甘丙肽(galanin)的神经肽和从称作黄蜂毒素(mastoparan)的马蜂的毒分离的肽中的一部分来制备的肽,与诱导细胞死亡的肽结合来用作细胞死亡诱导肽。本发明人在研究人类免疫缺陷病毒nc肽的生理活性的过程中,确认了nc肽具有细胞膜穿透活性,由此,确认了可用作可向细胞内传递物质的药物传递系统,从而完成了本发明。技术实现要素:本发明的一目的在于,提供如下的包含由通式i表示的氨基酸序列的细胞穿模肽:通式i:cys-xaa1-xaa2-cys-xaa3-xaa4-xaa5-gly-his-xaa6-xaa7-xaa8-xaa9-cys,在所述通式中,xaa1为选自由ala、val、ile、leu、met、phe、tyr、trp、ser、thr、asn及gln组成的组中的氨基酸,xaa2为选自由ala、val、ile、leu、met、phe、tyr、trp、arg、his、lys、asn、ser、thr以及gln组成的组中的氨基酸,xaa3及xaa4相互独立地为选自由asp、glu、arg、his、lys、ser、thr、asn、gln以及gly组成的组中的氨基酸,xaa5为选自由asp、glu、arg、his、lys、ala、val、ile、leu、met、phe、tyr、trp以及pro组成的组中的氨基酸,xaa6及xaa7相互独立地为选自由ser、thr、asn、gln、ala、val、ile、leu、met、phe、tyr以及trp组成的组中的氨基酸,xaa8为lys、ala或arg,xaa9为选自由asp、glu、ser、thr、asn以及gln组成的组中的氨基酸。本发明的再一目的在于,提供所述细胞穿模肽末端与细胞内转运对象的货物(cargo)结合的细胞内输送载体。本发明的另一目的在于,提供包括使所述细胞内输送载体与细胞接触的步骤的向细胞内传递细胞内转运对象的货物的方法。本发明的还有一目的在于,提供逆转录病毒的nc肽末端与细胞内转运对象的货物结合的细胞内输送载体。本发明的又一目的在于,提供包括使细胞内输送载体与细胞接触的步骤的向细胞内传递细胞内转运对象的货物的方法,在所述细胞内输送载体中,逆转录病毒的nc肽末端与细胞内转运对象的货物结合。为了实现所述目的,本发明的一实施方式提供包含由如下的通式i表示的氨基酸序列的细胞穿模肽:通式i:cys-xaa1-xaa2-cys-xaa3-xaa4-xaa5-gly-his-xaa6-xaa7-xaa8-xaa9-cys,在所述通式中,xaa1为选自由ala、val、ile、leu、met、phe、tyr、trp、ser、thr、asn以及gln组成的组中的氨基酸,xaa2为选自由ala、val、ile、leu、met、phe、tyr、trp、arg、his、lys、asn、ser、thr以及gln组成的组中的氨基酸,xaa3及xaa4相互独立地为选自由asp、glu、arg、his、lys、ser、thr、asn、gln以及gly组成的组中的氨基酸,xaa5为选自由asp、glu、arg、his、lys、ala、val、ile、leu、met、phe、tyr、trp以及pro组成的组中的氨基酸,xaa6及xaa7相互独立地为选自由ser、thr、asn、gln、ala、val、ile、leu、met、phe、ty以及trp组成的组中的氨基酸,xaa8为lys、ala或arg,xaa9为选自由asp、glu、ser、thr、asn以及gln组成的组中的氨基酸。本发明的再一实施方式提供所述细胞穿模肽末端与细胞内转运对象的货物结合的细胞内输送载体。在本说明书中,术语“细胞内输送载体”意味着可穿透细胞膜来穿透组织为止的输送载体。在本说明书中,术语“肽”或“多肽”意味着氨基酸残基通过肽结合相互结合而形成的线性分子,由4~70个,优选地,由4~40个,更优选地,由4~30个,最优选地,由4~20个氨基酸残基构成。由所述通式i表示的多肽呈现各种逆转录病毒(例如,人类免疫缺陷病毒、鼠白血病病毒(mlv,murineleukemiavirus)、猴免疫缺陷病毒(siv,simianimmunodeficiencyvirus)、劳氏肉瘤病毒(rsv,roussarcomavirus)、猫免疫缺陷病毒(fiv,felineimmunideficiencyvirus)、马免疫缺陷病毒(eiv,equineimmunideficiencyvirus))的存在于nc肽内的锌指结构域(zincfingerdomain)的保存序列(cys-xaa-xaa-cys-xaa-xaa-xaa-xaa-his-xaa-xaa-xaa-xaa-cys),本发明人通过实验确认了包含所述序列的多肽具有优秀的细胞膜穿透活性,由此,确认了可用作可向细胞内传递物质的药物传递系统。根据本发明的一具体例,在通式i(序列16)中,所述xaa1为选自由作为疏水性氨基酸的ala、val、ile、leu、met、phe、tyr以及trp和作为极性氨基酸的ser、thr、asn以及gln组成的组中的氨基酸。更优选地,所述xaa1为选自由phe、trp、tyr、ala以及gln组成的组中的氨基酸。根据一具体例,所述xaa2为选自由作为疏水性氨基酸的ala、val、ile、leu、met、phe、tyr、trp和作为碱性氨基酸的arg、his、lys,作为极性氨基酸的ser、thr、asn以及gln组成的组中的氨基酸。更优选地,所述xaa2为选自由asn、thr、lys、leu以及tyr组成的组中的氨基酸。并且,根据一具体例,所述xaa3及xaa4相互独立地为选自由作为亲水性氨基酸的asp、glu、arg、his、lys、ser、thr、asn、gln以及gly组成的组中的氨基酸。更优选地,所述xaa3可选自由gly、asp以及lys组成的组中,xaa4为选自由arg、ser、gly以及glu组成的组中的氨基酸。并且,根据本发明的一具体例,所述xaa5为选自由除极性氨基酸之外的asp、glu、arg、his、lys、ala、val、ile、leu、met、phe、tyr、trp以及pro组成的组中的氨基酸。更优选地,所述xaa5为选自由pro、glu、lys、ile以及met组成的组中的氨基酸。并且,根据一具体例,所述xaa6及xaa7相互独立地选自作为疏水性氨基酸的ala、val、ile、leu、met、phe、tyr以及trp,作为极性氨基酸的ser、thr、asn或gln组成的组中,更优选地,xaa6为选自由thr、asn、gln、met、tyr以及trp组成的组中的氨基酸,xaa7为选自由ala、met、gln组成的组中的氨基酸。并且,根据一具体例,所述xaa8为作为lys、ala或arg的氨基酸,xaa9为选自由作为酸性氨基酸的asp、glu和作为极性氨基酸的ser、thr、asn、gln组成的组中的氨基酸,优选地,为asp、glu、asn或gln。根据本发明的一具体例,包含由所述通式i表示的氨基酸序列的肽为包含逆转录病毒的锌指结构域的多肽,可选自由具有序列17至序列23的氨基酸序列的多肽组成的组中。本发明的另一实施方式提供逆转录病毒的nc肽末端与细胞内转运对象的货物结合的细胞内输送载体。在本说明书中,术语“nc肽”意味着构成逆转录病毒的核衣壳(nucleocapsid)的多肽,所述多肽强有力地与逆转录病毒的基因组rna结合来形成核糖核蛋白质核复合物(ribonucleoproteincorecomplex)。在本说明书中,术语“细胞穿模肽”意味着具有可在生物体外(invitro)和/或在生物体内(invivo)向细胞内输送转运对象的货物的能力的肽,细胞穿模肽为本身具有可通过磷脂双层膜的细胞膜的氨基酸序列的肽。根据本发明的一具体例,所述逆转录病毒可选自由人类免疫缺陷病毒、鼠白血病病毒、猴免疫缺陷病毒及劳氏肉瘤病毒组成的组中,最优选地,可为人类免疫缺陷病毒。在本说明书中,术语“货物”意味着与作为细胞膜穿透肽起作用的nc肽结合并可向细胞输送的化学物质、小分子、多肽、核酸等。在本发明中,可与由通式i表示的肽或逆转录病毒的nc肽末端结合的物质,即,可以成为货物的物质多种多样,例如,包括蛋白质(多肽)、核酸(多核苷酸)、化学物质(药物)等,但并不限定于此。例如,可为药物、造影剂(例如,t1造影剂、如超磁性材料的t2造影剂、放射性同位素等)、荧光标记、染色物质等,但并不限定于此。所述多肽为由2种或其以上的残基构成的氨基酸的聚合物,包含肽及蛋白质。例如,多肽可为参与细胞永生的蛋白质(例如,sv40大t抗原及端粒酶)、抗凋亡蛋白质(例如,突变型p53及bclxl)、抗体、癌基因(例如,ras、myc、hpve6/e7及腺病毒ela)、细胞周期调节蛋白质(例如,细胞周期蛋白质及细胞周期蛋白质依赖性磷酸化酶)或酶(例如,绿色荧光蛋白、β-半乳糖苷酶及氯霉素乙酰转移酶),但并不限定于此。并且,例如,核酸可为rna、dna或cdna,核酸的序列可为编码部位序列或非编码部位序列(例如,反义寡核苷酸或sirna)。作为核酸货物的核苷酸可为标准核苷酸(例如,腺苷、胞嘧啶、鸟嘌呤、胸腺嘧啶、肌苷及尿嘧啶)或类似核苷酸(例如,硫代磷酸核苷酸)。例如,核酸货物可为由硫代磷酸核苷酸构成的反义序列或rnai。根据本发明的一具体例,与由本发明的通式i表示的肽或nc肽结合的物质以非常高的效率穿透细胞膜,残留于细胞内的细胞质及细胞核。根据本发明的一具体例,所述nc肽可具有1个以上的锌指结构域,优选地,包含2个锌指结构域。根据一具体例,所述nc肽可选自由具有序列12至序列15的氨基酸序列的多肽组成的组中。本发明的还有一实施方式提供一种向细胞内传递细胞内转运对象的货物的方法,所述向细胞内传递细胞内转运对象的货物的方法包括使包含由所述通式i表示的氨基酸序列的肽末端与细胞内转运对象的货物结合的细胞内输送载体或逆转录病毒的nc肽末端与细胞内转运对象的货物结合的细胞内输送载体与细胞接触的步骤。本发明的方法利用所述细胞内输送载体,因此,为了避免本说明书过于复杂,将省略与两者之间的相同内容有关的记载。另一方面,若与货物结合的包含由通式i表示的氨基酸序列的肽或与货物结合的nc肽被赋予在生物体外或生物体内与细胞膜接触的机会,则向细胞内输送与肽结合的货物。在所述细胞内输送载体与细胞膜接触的过程中没有特殊要求的条件,例如,有限的时间、温度及浓度等条件,能够以在该领域中通常适用于细胞膜穿透的常规条件实施。相比于以往的来源于病毒的肽,包含由本发明的通式i表示的氨基酸序列的肽的细胞内输送载体或包含nc肽的细胞内输送载体具有能够以低浓度有效地向细胞内传输物质的优点。附图说明图1示出利用sds-page确认nc-egfp蛋白质的表达与否的结果。图2示出比较各种逆转录病毒的nc肽序列及fitc(异硫氰酸荧光素)结合的各种nc肽的细胞膜穿透活性的结果。红色框示出锌指结构域。图3a至图3c示出在raw264.7细胞中以浓度或时间的依赖性确认fitc-hiv-nc肽(nucleocapsidpeptide)的细胞膜穿透活性的结果。图4示出通过免疫染色法确认hiv-nc肽的细胞膜穿透与否的结果。图5a至图5e示出在raw264.7细胞(图5a)、thp-1细胞(图5b)、cem细胞(图5c)、mdck细胞(图5d)及293ft细胞(图5e)中根据浓度依赖性确认fitc-hiv-nc肽的细胞膜穿透活性的结果。图6a至图6c示出在raw264.7细胞中根据浓度依赖性比较gfp-hiv-nc肽及gfp-tat肽的细胞膜穿透活性的比较。图7示出比较fitc-hiv-nc肽、fitc-tat肽、fitc-ma11肽、fitc-ptd-ys肽、fitc-tlm肽及fitc-td1肽的细胞膜穿透活性的结果。图8示出确认fitc-13nc35肽的细胞膜穿透活性程度的结果。图9示出确认fitc-29nc50肽的细胞膜穿透活性程度的结果。图10示出确认穿透hiv-nc肽的生物体内组织之后在组织细胞中的分布与否的结果。各照片中的刻度尺(scalebar)表示50μm。图11示出确认穿透hiv-nc肽的眼球组织之后在视网膜细胞中的分布与否的结果:gcl意味着神经节细胞层(ganglioncelllayer),inl意味着内核层(innernuclearlayer),onl意味着外核层(outernuclearlayer)。图12示出呈现与hiv-nc肽结合的六肽的细胞膜穿透活性的结果。图13示出呈现与hiv-nc肽结合的rna的细胞膜穿透活性的结果。具体实施方式以下,通过1个以上的具体例对实施例进行更详细地说明。但是,这些实施例仅用于例示性地说明1个以上的具体例,本发明的范围并不局限于这些实施例。实验方法1.制备用于nc肽表达的重组载体(recombinantvector)为了确认nc肽与egfp结合(conjugation)的重组蛋白质的表达与否并纯化蛋白质,以如下的方式制备了重组载体。为了在nc肽基因的n-末端添加作为限制酶(纽英伦生物技术(newenglandbiolabs);neb,美国)的ndei并在c-末端添加可使bspei作用的限制酶识别序列(recognitionsequence),利用包含限制酶识别序列的引物(primer)进行了聚合酶链反应(polymerasechainreaction,以下,以聚合酶链反应(pcr)表示)。在下述表1及表2记载了用于聚合酶链反应的引物序列(序列1及序列2)和聚合酶链反应条件。表1序列号序列nc-ndei序列1catatgcagcggggaacttnc-bspei序列2tccggagtttgcctgtctc表2之后,为了在增强型绿色荧光蛋白(egfp,enhancedgreenfluorescentprotein)基因的n-末端添加bspei并在c-末端添加可使hindш作用的限制酶识别序列,以与所述表2相同的条件进行聚合酶链反应。但是,利用了在下述表3记载的序列3及序列4的引物。表3序列号序列egfp-bspei-f序列3tccggagtgagcaagggcgaegfp-hindш-r序列4aagcttcttgtacactctcgt如上所述,使添加限制酶识别序列的nc肽基因及egfp基因在16℃的温度条件下反应12小时并结合(结扎,ligation)。对结合的nc肽-egfp基因(以下,以“nc-egfp基因”表示)进行聚合酶链反应(利用序列1、2、3及4的引物)来获取了nc-efgp基因的整体序列。在下述表4记载了nc-egfp基因结合反应条件。表4dh2o6μlt4dna连接酶缓冲剂(ligasebuffer)(10x)1μlnc肽dna(50ng/μl)1μlegfp基因dna(50ng/μl)1μlt4dna连接酶(ligase)(400units/μl)1μl总计(total)10μl之后,利用ndei及hindiii限制酶发切段pet21a(novagen,美国)载体之后,利用聚合酶链反应纯化试剂(purificationkit)(qiagen,美国)根据制造公司的方法分离了载体片段。利用nebuffer#2在37℃的温度条件下进行2小时的限制酶反应。结合所述分离的pet21a载体片段和nc-egfp基因之后,利用聚合酶链反应纯化试剂分离了重组载体,将插入nc-egfp基因的重组载体命名为pet21anc-egfp。为了复制pet21anc-egfp载体,向大肠杆菌dh5α转化所述载体,在lb液体培养基中,达到od0.5至0.6为止在37℃的温度条件下进行振荡培养(shakeculture)。在培养结束之后,对培养液进行离心来获取了大肠杆菌颗粒(pellet),利用质粒提取试剂(plasmidextractionkit)(qiagen)并根据制造公司的方法从获取的大肠杆菌颗粒中分离了pet21anc-egfp载体。利用紫外分光光度(uv)法定量分离的pet21anc-egfp载体之后进行了确认。2.nc-egfp表达、分离及纯化为了确认在所述内容中制备的pet21anc-egfp载体的蛋白质表达与否,进行了如下的实验。在bl21(de3)(赛默飞世尔科技公司(thermofisher),美国)转化pet21anc-egfp载体,向lb板涂抹并在37℃的温度条件下培养了12小时。将12小时之后形成的菌落(colony)接种于lb液体培养基并在37℃的温度条件下进一步培养。约12小时之后,将达到od0.5至0.6的培养液接种于250ml的lb液体培养基,在37℃的温度条件下培养了3小时至4小时,以使达到od0.5至0.6。当培养液的od达到0.5至0.6时,向培养液添加0.5mm的异丙基β-d-硫半乳糖苷(iptg,isopropylβ-d-thiogalactoside)并在25℃温度条件下培养了24小时。24小时之后,对培养液进行离心来获取了bl21颗粒,使获取的颗粒在溶解缓冲液(50mm的磷酸二氢钠(nah2po4)、300mm的氯化钠(nacl)、10mm的咪唑(imidazole)及ph8.0)悬浮之后利用超声波破碎机对大肠杆菌进行破碎(振幅(amplitude)40%)。对所述大肠杆菌破碎物进行离心来分离为上清液和沉淀物,利用0.45μm的过滤器向管填充了上清液。将填充于管的上清液放入填充有氮基三乙酸(ni-nta,nitrilotriaceticacid)树脂(resin)的柱使蛋白质好树脂相互结合。之后,为了去除未与树脂结合的外来蛋白质,添加清洗缓冲液(50mm的磷酸二氢钠、300mm的氯化钠、20mm的咪唑及ph8.0)来进行清洗。利用添加咪唑(imidazole)的缓冲液(50mm的磷酸二氢钠、300mm的氯化钠、250mm的咪唑及ph8.0)并通过流动相梯度(gradientmobilephase)获取了最终蛋白质。之后,为了去除咪唑,将获取的蛋白质放入膜管并利用未包含咪唑的缓冲液(20mm的磷酸二氢钠、300mm的氯化钠及ph7.2)进行通过渗透压作用的缓冲液更换。最终,通过布拉德福试验(bradfordassay)检测溶解于未包含咪唑的缓冲液的蛋白质浓度来确认了nc-egfp蛋白质表达。结果,即使nc基因序列与其他序列结合,也不影响nc肽的表达。图1示出利用sds-page确认nc-egfp蛋白质的结果,经确认,表达了约35kda大小的nc-egfp蛋白质。3.分析nc肽的细胞膜穿透性3-1.培养细胞hela、raw264.7及293ft细胞在添加有10%的胎牛血清(fbs)和100u/μl的青霉素/链霉素的dmem培养基进行培养,mdck细胞在添加有10%的胎牛血清(fbs)和100u/μl的青霉素/链霉素的emem培养基(胎牛血清(hyclone),logan,ut,usa)进行培养。thp-1及cem细胞在添加有10%的胎牛血清(fbs)和100u/μl的青霉素/链霉素的rpmi-1640培养基(胎牛血清(hyclone),logan,ut,usa)进行培养。所有细胞在37℃的温度条件下在5%的co2的加湿恒温器进行培养。3-2.nc肽细胞膜穿透性分析-荧光激活细胞拣选法(facs,fluorescence-activatedcellsorting)将在所述3-1中培养的各种细胞以1×106细胞/孔的密度接种于6-孔板之后,进行24小时的培养并向板附着了细胞。之后,在肽浓度(0.5μm、1.0μm、2.5μm、5.0μm及10μm)或肽处理时间上具有差异地,在细胞分别处理了与fitc结合(conjugation)的nc肽(以下,以“fitc-nc肽”表示)、与egfp结合的nc肽(以下,以“nc-egfp肽”表示)或与egfp结合的tat肽(以下,以“tat-egfp肽”表示)。所述肽从chempeptide(中国)及lifetein(美国)订购并制备。之后,利用磷酸缓冲盐溶液(pbs)对细胞进行3次清洗,利用胰蛋白酶(trypsin)-edta分离细胞之后,在包含2%的胎牛血清(fbs)/0.1%的牛血清白蛋白(bovineserumalbumin,bsa)的磷酸缓冲盐溶液(pbs)进行悬浮。在2000rpm中对所述悬浮液进行2分钟的离心来获取了细胞颗粒,利用3.7%的甲醛(formaldehyde)对获取的细胞进行20分钟的固定。之后,在2000rpm进行2分钟的离心来获取了细胞颗粒,利用磷酸缓冲盐溶液(pbs)进行2次清洗之后在包含2%的胎牛血清(fbs)及0.1%的牛血清白蛋白(bsa)的磷酸缓冲盐溶液(pbs)进行悬浮。利用荧光活化细胞分选仪(fluorescence-activatedcellsorter;流式细胞仪(facscalibur),beckondickinson,ca,usa)并通过流式细胞术(flowcytometry)对细胞进行分析。3-3.nc肽细胞膜穿透性分析-免疫染色(immunostaining)将hela细胞接种于包含1×105细胞/孔的密度的玻璃的12-孔板之后,进行24小时的培养并向玻璃附着了细胞。之后,在细胞以3mm浓度对fitc-nc肽进行3小时的处理。3小时之后,利用磷酸缓冲盐溶液(pbs)对细胞进行3次清洗,之后,利用3.7%的甲醛对细胞进行20分钟的固定,对包含0.2%的曲拉通x-100(tritonx-100)的磷酸缓冲盐溶液(pbs)进行处理来增加了细胞膜穿透性。之后,利用3%的牛血清白蛋白(bsa)进行1小时的阻断(blocking)之后在常温条件下与核层蛋白(lamina/c)抗体(sigma-aldrich,美国)进行2小时的反应,并利用磷酸缓冲盐溶液(pbs)进行3次清洗。接着,对cy3结合二抗(cy3-conjugatedsecondaryantibody;jacksonimmunoresearch,美国)进行处理并在常温条件下进行1小时的反应,利用磷酸缓冲盐溶液(pbs)进行2次清洗之后利用4',6-二脒基-2-苯基吲哚(dapi,4',6-diamidino-2-phenylindol)进行10分钟的染色。揭下附着有hela细胞的玻璃并放置于滑动玻璃上,并利用共焦激光扫描显微镜(confocallaserscanningmicroscopy,lsm700,zeiss,germany)观察。并且,为了比较nc肽与其他细胞穿模肽的穿透性,利用了下述方法。将hela细胞接种于包含1×105细胞/孔的密度的玻璃的12-孔板之后,进行24小时的培养并在玻璃附着了细胞。之后,在hela细胞对fitc-nc肽、fitc-tat肽(反式激活肽(trans-activatingtranscriptionalactivatorpeptide))、fitc-ma11肽、fitc-ptd-ys肽(蛋白质转导域ys肽(proteintransductiondomain-yspeptide))、fitc-tlm肽(易位基序肽(translocationmotifpeptide))及fitc-td1肽进行3小时的处理。3小时之后,利用磷酸缓冲盐溶液(pbs)对细胞进行3次清洗,利用3.7%的甲醛对细胞进行20分钟的固定。对包含0.2%的曲拉通x-100的磷酸缓冲盐溶液(pbs)进行处理来增加细胞膜穿透性,并利用3%的牛血清白蛋白(bsa)进行1小时的阻断。之后,在常温条件下与微管蛋白(tubulin)抗体(santacruzbiotechnology,美国)反应了2小时,并利用磷酸缓冲盐溶液(pbs)进行3次清洗。对cy3结合二抗进行处理并在常温条件下反应1小时,利用磷酸缓冲盐溶液(pbs)进行2次清洗之后利用4',6-二脒基-2-苯基吲哚(dapi)进行10分钟的染色。揭下附着有hela细胞的玻璃并放置于滑动玻璃上,利用共焦激光扫描显微镜观察。并且,为了确认通过fitc-nc肽的细胞膜穿透活性变化,以与所述方法相同的方法在hela细胞对六肽(hexapeptide)、fitc-六肽、fitc-nc-六肽、fitc-13nc35肽及fitc-29nc50肽进行3小时的处理,并利用共焦激光扫描显微镜观察。另一方面,在所述内容中使用的六肽、ptd-ys肽、tlm肽、td1肽、nc-六肽、13nc35肽及29nc50肽的氨基酸序列如下述表5。表53-4.nc肽细胞膜穿透性分析-荧光分析仪(fluorometer)将raw264.7细胞以5×104细胞/孔的密度接种于24-孔板之后,进行24小时的培养,并在板附着细胞。之后,以互不相同的浓度分别对tat-egfp肽及nc-egfp肽进行1小时的处理。1小时之后,利用磷酸缓冲盐溶液(pbs)对细胞进行3次清洗,添加100ml的放射免疫沉淀法(ripa,radio-immunoprecipitationassay)缓冲液并在4℃温度条件下对细胞进行30分钟的溶解。将100ml的所述细胞溶解液向荧光分析仪用96-孔板移动之后,利用荧光分析仪(synergymx,biotek,美国)检测绿色荧光蛋白(gfp)荧光。并且,以与所述方法相同的方法在raw264.7细胞以1.0μm的浓度对与fitc结合的人类免疫缺陷病毒、鼠白血病病毒、猴免疫缺陷病毒及劳氏肉瘤病毒的nc肽(以下,分别为fitc-hiv-nc、fitc-mlv-nc,fitc-siv-nc,fitc-rsv-nc)和tat肽进行1小时的处理并检测荧光信号。3-5.接着nc肽的rna穿透(transduction)效率变化将mt4细胞以2×105细胞/孔的密度接种于24-孔板,在37℃的温度条件及5%的co2的加湿恒温器中进行24小时的培养。混合互不相同的2ml的nc肽和40nm的siglo(绿色转染指示器(greentransfectionindicator),dharmacon,d-001630-01-05)并在常温条件下进行30分钟的反应之后在mt4细胞进行处理。进一步培养24小时后,利用磷酸缓冲盐溶液(pbs)对mt4细胞进行3次清洗,利用荧光活化细胞分选仪并通过流式细胞术进行分析。并且,利用荧光显微镜(fluorescenceinvertedmicroscope,olympus)进行观察。4.nc肽生物体内组织穿透及在组织细胞的分布与否利用30容量(gauge)注射器向小鼠尾静脉分别注射3.2mg/100μl浓度的fitc-hiv-nc肽及fitc-tat肽。在肽给药2小时之后,摘除小鼠的肾脏(kidney)、肝(liver)、肺(lung)、心脏(heart)及脾脏(spleen)并利用4%的多聚甲醛进行1小时的固定,在组织沉淀为止浸渍于30%的蔗糖(sucrose)。之后,利用oct包埋剂(octcompound;leica,germany)冷冻各组织,并利用冷冻切片器制造了组织切片载玻片。根据本领域周知的方法利用4',6-二脒基-2-苯基吲哚(dapi)对组织切片载玻片进行10分钟的染色之后利用共焦激光扫描显微镜进行观察。并且,将100μm原种(stock)的fitc-hiv-nc肽向玻璃体内部(intravitreal)给药1μl、向视网膜下(subretinal)给药2μl,24小时之后,摘除小鼠眼球组织,并以与所述方法相同的方法制造了眼球组织切片载玻片。利用4',6-二脒基-2-苯基吲哚(dapi)对载玻片进行10分钟的染色之后利用共焦激光扫描显微镜进行观察。实验结果1.确认各种逆转录病毒nc肽的细胞膜穿透活性为了确认细胞膜穿透活性程度是否根据nc肽序列的相似(similarity)程度具有差异,在raw264.7细胞以1.0μm的浓度对与fitc结合的人类免疫缺陷病毒、猴免疫缺陷病毒、劳氏肉瘤病毒及鼠白血病病毒的nc肽和tat肽进行1小时的处理。结果,如图2所示,可通过fitc荧光亮度确认人类免疫缺陷病毒、猴免疫缺陷病毒、劳氏肉瘤病毒及鼠白血病病毒的nc肽的细胞膜穿透性优秀,在荧光激活细胞拣选法(facs)分析中,也确认人类免疫缺陷病毒的nc肽在96.8%的细胞、猴免疫缺陷病毒的nc肽在54.0%的细胞、劳氏肉瘤病毒的nc肽在24.2%的细胞、鼠白血病病毒的nc肽在5.7%的细胞中呈现荧光。所述实验结果意味着,相比于以往的tat肽,包括人类免疫缺陷病毒在内的各种逆转录病毒的nc肽的细胞膜穿透活性优秀。并且,如图2所示,可确认以共有序列(consensussequence)包含人类免疫缺陷病毒、猴免疫缺陷病毒、劳氏肉瘤病毒及鼠白血病病毒的nc肽的锌指结构域。另一方面,使用的所述人类免疫缺陷病毒、猴免疫缺陷病毒、劳氏肉瘤病毒及鼠白血病病毒的nc肽的氨基酸序列如下述表6。表62.确认hiv-nc肽的细胞膜穿透活性在所述实验中,为了将细胞膜穿透活性最高的hiv-nc肽(序列12)为对象确认各浓度的细胞膜穿透活性,在raw264.7巨噬细胞以0.5μm、1μm、2.5μm、5.0μm及10μm的浓度对fitc-hiv-nc肽进行1小时的处理。1小时之后,利用荧光显微镜(leicamicoscopesystems,德国)确认细胞的荧光程度的结果,如图3a所示,可确认,fitc-hiv-nc肽的浓度越增加肽的细胞膜穿透性越高。并且,如图3b所示,通过荧光分析仪确认的结果可知,fitc-hiv-nc肽的浓度越增加荧光信号越增加,从而可知细胞膜穿透性增加。并且,为了确认根据处理时间的fitc-hiv-nc肽的细胞膜穿透程度,在raw264.7细胞以2.5μm的浓度对肽以20分钟、40分钟及60分钟的时间进行处理。结果,如图3c所示,可通过荧光显微镜及荧光激活细胞拣选法(facs)分析确认,处理fitc-hiv-nc肽的时间越长肽的细胞膜穿透性增加。并且,为了确认hiv-nc肽的细胞膜穿透性,在hela细胞进行免疫染色并利用共焦激光扫描显微镜进行观察。结果,如图4所示,可确认,多个hiv-nc肽在细胞膜、细胞质及核膜均匀地分布,一部分hiv-nc肽在核内侧分布。所述结果意味着hiv-nc肽在低浓度可穿透细胞膜且在短时间内进行hiv-nc肽的细胞膜穿透。3.确认各种细胞中的hiv-nc肽的细胞膜穿透活性为了确认hiv-nc肽的细胞膜穿透活性是否根据细胞的种类具有差异,在raw264.7、thp-1、cem、mdck及293ft细胞以1.0μm、2.5μm及5.0μm的浓度对fitc-hiv-nc肽进行1小时或2小时的处理。结果,如图5a至5e所示,通过荧光显微镜及荧光激活细胞拣选法(facs)分析确认,fitc-hiv-nc肽的浓度越增加肽的细胞膜穿透性越增加。图5a为raw264.7(小鼠巨噬细胞)、图5b为thp-1(人类单核细胞株)细胞的结果,图5c为cem、图5d为狗肾传代细胞(mdck,madin-darbycaninekidney,狗肾源细胞)及图5e为293ft(来源于人类胎儿肾脏细胞)的结果。所述结果意味着hiv-nc肽可穿透癌细胞、免疫细胞、上皮细胞等的多种细胞膜。4.比较hiv-nc肽与tat肽的细胞膜穿透活性为了确认hiv-nc肽的细胞膜穿透活性的程度,与以往的作为细胞穿透蛋白质而周知的tat肽进行了比较实验。在raw264.7细胞各自以0.25μm、0.5μm、1.0μm、2.5μm及5.0μm的浓度对于与绿色荧光蛋白(greenfluorescenceprotein,gfp)结合的hiv-nc肽(以下,称为gfp-hiv-nc肽),以1.0μm、2.5μm、5.0μm及10μm的浓度对gfp-tat肽进行1小时的处理,并确认了1小时之后的肽的荧光程度。结果,如图6a及6b所示,可确认,gfp-hiv-nc肽在0.25μm的低浓度中呈现荧光,相反,gfp-tat肽在10μm的高浓度中微微地呈现荧光。并且,如图6a及6b所示,获取细胞并利用荧光激活细胞拣选法(facs)进行分析的结果,1μm的浓度的gfp-hiv-nc肽中,99.9%的细胞呈现荧光,在相同浓度的gfp-tat肽中,4.3%的细胞呈现荧光。并且,如图6c所示,通过荧光分析仪确认的结果可知,gfp-hiv-nc肽的浓度越增加细胞膜穿透性也增加,但是,与处理浓度无关地,gfp-tat肽的细胞膜穿透性非常低。所述实验结果意味着,相比于以往的作为细胞穿透蛋白质而周知的tat肽,hiv-nc肽为高效率的细胞穿模肽。5.比较hiv-nc肽与其他细胞穿模肽的细胞穿透活性在hela细胞对fitc-hiv-nc肽、fitc-tat肽、fitc-ma11肽、fitc-ptd-ys肽、fitc-tlm肽、fitc-td1肽进行处理之后确认各肽的细胞膜穿透程度。结果,如图7所示,即使以20μm的高浓度对fitc-tlm肽及fitc-td1肽进行处理,几乎未穿透细胞膜,但是,以3μm的浓度对fitc-hiv-nc肽进行处理也呈现强的荧光信号,从而可确认细胞膜穿透活性显著地优秀。并且,可确认,fitc-hiv-nc肽的细胞膜穿透活性比fitc-ma11肽优秀约2.5倍、比fitc-tat肽优秀约7倍、比fitc-ptd-ys肽优秀约10倍左右。6.确认nc肽内锌指结构域的细胞膜穿透活性在实验结果1中确认了各种逆转录病毒nc肽具有细胞膜穿透活性,如图2所示,人类免疫缺陷病毒、猴免疫缺陷病毒、劳氏肉瘤病毒具有2个锌指结构域,鼠白血病病毒具有1个锌指结构域。因此,为了确认细胞膜穿透活性是否通过各种nc肽内的作为共有序列(consensussequence)的锌指结构域呈现,以hiv-nc肽的包含由第13个氨基酸至第35个氨基酸组成的第一锌指结构域的肽(13nc35肽,序列10)和包含由第29个氨基酸至第50个氨基酸组成的第二锌指结构域的肽(29nc50肽,序列11)为对象结合fitc并在hela细胞确认细胞膜穿透活性。结果,如图8及图9所示,可确认,13nc35肽和29nc50肽的荧光信号均与浓度成比例的增加。这意味着nc肽的锌指结构域为呈现细胞膜穿透活性的重要部分。另一方面,将人类免疫缺陷病毒、猴免疫缺陷病毒、劳氏肉瘤病毒及鼠白血病病毒的nc肽的锌指结构域的氨基酸序列示出于下述表7。表7名称序列号氨基酸序列hiv-nc1st锌指结构域序列17cfncgkeghtarnchiv-nc2nd锌指结构域序列18cwkcgkeghqmkdcsiv-nc1st锌指结构域序列19cfncgkeghmqrecsiv-nc2nd锌指结构域序列20cfkcgkighmakdcrsv-nc1st锌指结构域序列21cytcgspghyqaqcrsv-nc2nd锌指结构域序列22cqlcdgmghnakqcmlv-nc锌指结构域序列23cayckekghwakdc7.确认hiv-nc肽生物体内组织穿透及组织细胞中的分布与否为了确认nc肽向生物体内组织穿透并是否在组织细胞很好地分布,向小鼠尾静脉给药hiv-nc肽的结果,如图10所示,可知,均匀地在肾脏、肝、肺、心脏及脾脏组织细胞分布。尤其,与肾脏、肝、及肺组织细胞有关的分布效率显著优秀。相反,可确认,tat肽几乎无法在除肾脏之外的其他组织分布。并且,通过眼球的玻璃体内和视网膜下给药路径给药hiv-nc肽的结果,如图11所示,确认强烈的呈现荧光信号,可知hiv-nc肽通过眼球给药路径向眼球组织穿透并很好地在视网膜细胞分布。8.确认借助hiv-nc肽的多肽的细胞膜穿透与否为了确认是否可将多肽作为货物借助hiv-nc肽穿透细胞膜,使hiv-nc肽与六肽结合并在细胞进行处理之后观察荧光信号。结果,如图12所示,可确认,六肽本身无法穿透细胞膜,但在与hiv-nc肽结合的情况下,可穿透细胞膜,细胞膜穿透活性与浓度成比地增加。9.确认借助hiv-nc肽的多核苷酸的细胞膜穿透与否为了确认是否可将多核苷酸作为货物借助hiv-nc肽穿透细胞膜,使hiv-nc肽与siglorna结合并在mt4细胞进行处理之后观察细胞。结果,如图13所示,确认gfp荧光信号根据hiv-nc肽的处理浓度增加,可知siglo的细胞膜穿透程度增加。所述结果意味着hiv-nc肽可显著改善多核苷酸的细胞膜穿透程度。以上,以优选实施例为中心对本发明进行了说明。本发明所属
技术领域:
的普通技术人员可在不超出本发明的本质特性的范围内以变形的形态实现本发明。因此,所公开的实施例用于说明本发明,而不是限定本发明。本发明的范围通过发明要求保护范围定义,而不是通过所述说明定义,属于本发明等同范围内的所有区别均包括于本发明。<110>爱维斯健有限公司<120>细胞膜穿透肽及包含其的细胞内输送载体<130>px170050pct<150>kr10-2016-0172548<151>2016-12-16<160>23<170>kopatentin3.0<210>1<211>19<212>dna<213>人工序列<220><223>合成多核苷酸<400>1catatgcagcggggaactt19<210>2<211>19<212>dna<213>人工序列<220><223>合成多核苷酸<400>2tccggagtttgcctgtctc19<210>3<211>20<212>dna<213>人工序列<220><223>合成多核苷酸<400>3tccggagtgagcaagggcga20<210>4<211>21<212>dna<213>人工序列<220><223>合成多核苷酸<400>4aagcttcttgtacactctcgt21<210>5<211>6<212>prt<213>人工序列<220><223>六肽<400>5gluglumetglnargarg15<210>6<211>11<212>prt<213>人工序列<220><223>ptd-ys肽<400>6tyralaargvalargargargglyproargarg1510<210>7<211>12<212>prt<213>人工序列<220><223>tlm肽<400>7proleuserserilepheserargileglyasppro1510<210>8<211>13<212>prt<213>人工序列<220><223>td1肽<400>8lysalametileasnileasnlyspheleuasnglncys1510<210>9<211>45<212>prt<213>人工序列<220><223>nc-六肽<400>9vallyscyspheasncysglylysgluglyhisthralaargasncys151015argalaproarglyslysglycystrplyscysglylysgluglyhis202530glnmetlysaspcysthrglugluglumetglnargarg354045<210>10<211>23<212>prt<213>人工序列<220><223>13nc35肽<400>10vallyscyspheasncysglylysgluglyhisthralaargasncys151015argalaproarglyslysgly20<210>11<211>22<212>prt<213>人工序列<220><223>29nc50肽<400>11argalaproarglyslysglycystrplyscysglylysgluglyhis151015glnmetlysaspcysthr20<210>12<211>55<212>prt<213>人工序列<220><223>hiv-nc肽<400>12metglnargglyasnpheargasnglnarglysilevallyscysphe151015asncysglylysgluglyhisthralaargasncysargalaproarg202530lyslysglycystrplyscysglylysgluglyhisglnmetlysasp354045cysthrgluargglnalaasn5055<210>13<211>42<212>prt<213>人工序列<220><223>siv-nc肽<400>13argglyproleulyscyspheasncysglylyspheglyhismetgln151015argglucyslysalaproargglnilelyscysphelyscysglylys202530ileglyhismetalalysaspcyslysasn3540<210>14<211>63<212>prt<213>人工序列<220><223>rsv-nc肽<400>14glyglnthrglyserglyglyargalaargglyleucystyrthrcys151015glyserproglyhistyrglnalaglncysprolyslysarglysser202530glyasnserarggluargcysglnleucysaspglymetglyhisasn354045alalysglncysarglysargaspglyasnglnglyglnargpro505560<210>15<211>56<212>prt<213>人工序列<220><223>mlv-nc肽<400>15alathrvalvalserglyglnlysglnaspargglnglyglygluarg151015argargserglnleuaspargaspglncysalatyrcyslysglulys202530glyhistrpalalysaspcysprolyslysproargglyproarggly354045proargproglnthrserleuleu5055<210>16<211>14<212>prt<213>人工序列<220><223>合成多肽<220><221>unsure<222>(2)<223>ala,val,ile,leu,met,phe,tyr,trp,ser,thr,asnorgln<220><221>unsure<222>(3)<223>ala,val,ile,leu,met,phe,tyr,trp,arg,his,lys,asn,ser,throrgln<220><221>unsure<222>(5)<223>asp,glu,arg,his,lys,ser,thr,asn,glnorgly<220><221>unsure<222>(6)<223>asp,glu,arg,his,lys,ser,thr,asn,glnorgly<220><221>unsure<222>(7)<223>asp,glu,arg,his,lys,ala,val,ile,leu,met,phe,tyr,trporpro<220><221>unsure<222>(10)<223>ser,thr,asn,gln,ala,val,ile,leu,met,phe,tyrortrp<220><221>unsure<222>(11)<223>ser,thr,asn,gln,ala,val,ile,leu,met,phe,tyrortrp<220><221>unsure<222>(12)<223>lys,alaorarg<220><221>unsure<222>(13)<223>asp,glu,ser,thr,asnorgln<400>16cysxaaxaacysxaaxaaxaaglyhisxaaxaaxaaxaacys1510<210>17<211>14<212>prt<213>人工序列<220><223>hiv-nc第一锌指结构域<400>17cyspheasncysglylysgluglyhisthralaargasncys1510<210>18<211>14<212>prt<213>人工序列<220><223>hiv-nc第二锌指结构域<400>18cystrplyscysglylysgluglyhisglnmetlysaspcys1510<210>19<211>14<212>prt<213>人工序列<220><223>siv-nc第一锌指结构域<400>19cyspheasncysglylysgluglyhismetglnargglucys1510<210>20<211>14<212>prt<213>人工序列<220><223>siv-nc第二锌指结构域<400>20cysphelyscysglylysileglyhismetalalysaspcys1510<210>21<211>14<212>prt<213>人工序列<220><223>rsv-nc第一锌指结构域<400>21cystyrthrcysglyserproglyhistyrglnalaglncys1510<210>22<211>14<212>prt<213>人工序列<220><223>rsv-nc第二锌指结构域<400>22cysglnleucysaspglymetglyhisasnalalysglncys1510<210>23<211>14<212>prt<213>人工序列<220><223>mlv-nc锌指结构域<400>23cysalatyrcyslysglulysglyhistrpalalysaspcys1510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1