用于治疗中风和相关凝血障碍的凝血酶抑制剂的制作方法
本发明涉及中风及相关疾病的治疗,纤维蛋白凝块形成和相关凝血酶活性,还涉及化合物,具体是抑制或改变凝血酶对纤维蛋白原的裂解的肽和多肽的制备。
背景技术:
说明书中提及的任何现有技术不是,也不应被视为认可或以任何形式暗示该现有技术构成澳大利亚或任何其他司法管辖区的一般常识的一部分。
缺血性中风是由脑循环中血凝块或血栓的发展引起的,是全球第三大常见死亡原因(世界卫生组织,2014)。中风事件也是全世界致残的主要原因,并且与长期、资源密集和昂贵的康复计划相关(世界卫生组织,2014)。
目前唯一批准的,通过促进缺血性脑的快速再灌注,以便最大程度降低中风事件的中风药物治疗方案,是静脉内输送血栓溶解剂重组组织纤溶酶原激活物(tpa)。tpa将纤溶酶原激活为纤溶酶,随后降解纤维蛋白和其他凝血相关蛋白,从而改善通过受影响血管的血流量(wardlawjm等人,2012)。
尽管广泛应用于临床治疗,基于tpa的疗法在功效和应用方面具有许多限制。特别值得关注的是,在tpa治疗后,只有20-30%的患者会完全动脉再通,20-30%的患者会再次闭塞(alexandrovav,grottajc,2002;rubieram等人,2005)。该问题被认为是由凝血相关凝血酶引起的,当tpa来源的纤溶酶降解血凝块中的纤维蛋白的同时,凝血酶保留纤维蛋白原裂解成纤维蛋白的活性。
进一步的关注是观察到与tpa治疗相关的颅内出血(ich)发生率增加,这明显限制了可用于溶栓治疗的tpa剂量(molinaca,saverjl.,2005)。
tpa治疗的显著局限性引发了开发改进的溶栓治疗的新兴趣。
凝血酶主要通过产生不溶性纤维蛋白而在凝块形成中起主要作用。因此,凝血酶抑制剂有望成为用作tpa辅助疗法的候选。
迄今为止,已经研究了间接凝血酶抑制剂肝素(vonkummerr2004;jangi-k1999)和直接凝血酶抑制剂(dti)水蛭素(karabiyikoglum2004)及阿加曲班(barretoad2012)。虽然观察到血管再通的整体改善,但这些辅助治疗也增加了出血和症状性颅内出血的风险。
因此,需要开发可用于改善缺血性中风结果的凝血酶抑制剂。
还需要开发可与tpa联用以改善缺血性中风结果的凝血酶抑制剂。
还需要可用于改善其他血栓形成疾病或凝血障碍的凝血酶抑制剂。
发明概述
本发明试图解决一个或多个上述需求或限制,并且在一个实施方案中提供包含seqidno:1a中所示氨基酸序列的肽:
pxyxxxzzpxyzzz
或seqidno:1b中所示的氨基酸序列:
zxzyzxyzxxx
其中,
z是d,e,q,s或p,以及
x是任何氨基酸。
所述的肽可以由seqidno:1a或seqidno:1b中所示的氨基酸序列组成。
优选地,该肽与凝血酶的外部位点ii结合。
更优选地,该肽竞争性地抑制凝血相关的纤维蛋白,优选纤维蛋白原γ’与凝血酶的外部位点ii的结合。
在一实施方式中,该肽可以抑制选自下组的化合物与凝血酶的外部位点ii的结合:因子v,因子viii,gp1bα,硫酸软骨素和肝素。
典型地,该肽至少有一个残基是硫酸化酪氨酸残基。
优选地,seqidno:1a中第11位的酪氨酸是硫酸化的。seqidno:1a中第3位的酪氨酸可能不被硫酸化。
优选地,seqidno:1b中第4位的酪氨酸是硫酸化的。seqidno:1b中第7位的酪氨酸可能不被硫酸化。
优选地,seqidno:1b中第7位的酪氨酸是硫酸化的。seqidno:1b中第4位的酪氨酸可能不被硫酸化。
在另一个实施方式中,seqidno:1a中第11位的酪氨酸是硫酸化的,第3位的酪氨酸是硫酸化的。
在另一个实施方式中,seqidno:1b中第4位的酪氨酸是硫酸化的,第7位的酪氨酸是硫酸化的。
在另一个实施方式中,提供了式1的凝血酶抑制剂:
a-b
其中:
a是具有seqidno:1a或seqidno:1b所示序列的肽,并具有上述一种或多种结合特征;
b是一肽,具有以下所示序列:
seqidno:10a:
ltytd
或seqidno:10b:
vvytd
或seqidno:10c:
dpgrrlge
或seqidno:10d:
vaepkm
或seqidno:10e:
eipgir
或seqidno:10f:
ptakpr
或seqidno:10g:
ralhvk
或seqidno:10h:
epakpr
或seqidno:10i:
prggpk
或seqidno:10j:
tlisar
用于结合凝血酶活性位点,防止凝血酶活性位点切割纤维蛋白原以形成纤维蛋白;
其中a和b连接,以便当b与凝血酶活性位点结合时,a能够与凝血酶的外部位点ii结合。
区域a连接于b的n端。在另一个实施方式中,b位于a的n端。
在另一个实施方式中,提供了式2的凝血酶抑制剂:
a-b-c
其中:
a是具有seqidno:1a或seqidno:1b所示序列的肽,具有上述一种或多种结合特征;
b是具有seqidno:10a至10j之一所示序列的肽,其与凝血酶活性位点结合,以防止凝血酶活性位点切割纤维蛋白原形成纤维蛋白;
c是一肽,具有以下所示序列:
seqidno:11a:
dfeeipeeylq
或seqidno:11b:
edyaaieaslsetf
或seqidno:11c:
pfdfeaipeeylddes
用于结合凝血酶的外部位点i;
其中a,b和c连接,以便当b与凝血酶活性位点结合并且c与凝血酶的外部位点i结合时,a能够与凝血酶的外部位点ii结合。
区域a可以位于c的n端。在另一个实施方式中,c位于a的n端。
在另一个实施方式中,提供了式3的凝血酶抑制剂:
a-c-b
其中:
a是具有seqidno:1a或seqidno:1b所示序列的肽,具有上述一种或多种结合特征;
b是具有seqidno:10a至10j之一中的序列的肽,用于结合凝血酶活性位点以防止凝血酶活性位点切割纤维蛋白原以形成纤维蛋白;
c是具有seqidno:11a至11c之一所示序列的肽,用于与凝血酶的外部位点i结合;
其中a,b和c连接,以便当b与凝血酶活性位点结合并且c与凝血酶的外部位点i结合时,a能够与凝血酶的外部位点ii结合。
区域a可以位于b的n端。在另一个优选例中,b位于a的n端。
在另一个实施方式中,提供了式4的凝血酶抑制剂:
b-a-c
其中:
a是具有seqidno:1a或seqidno:1b所示序列的肽,具有上述一种或多种结合特征;
b是具有seqidno:10a至10j之一所示序列的肽,其与凝血酶活性位点结合,以防止凝血酶活性位点切割纤维蛋白原形成纤维蛋白;
c是具有seqidno:11a至11c之一所示序列的肽,用于与凝血酶的外部位点i结合;
其中a,b和c连接,以便当b与凝血酶活性位点结合并且c与凝血酶的外部位点i结合时,a能够与凝血酶的外部位点ii结合。
区域b可以位于c的n端。在另一个实施方式中,c位于b的n端。
在一个实施方式中,在肽和水蛭素的摩尔当量水平上,式1或式2或式3或式4的肽表现出比水蛭素短至少20%的凝血时间。
优选地,在肽和水蛭素的摩尔当量水平上,式1或式2或式3或式4的肽表现出比水蛭素短至少20%的出血时间。
在另一个实施方式中,提供了一药物组合物,其包含如上所述的seqidno:1a或seqidno:1b的肽,或上述的式1或式2或式3或式4的肽,以及药学上有效的载体,稀释剂或赋形剂。
在另一个实施方式中,提供了一核酸,优选cdna,其具有编码如上文一般性描述的seqidno:1a或seqidno:1b所示肽,或上述的式1或式2或式3或式4所示肽的核苷酸序列,以及含有所述核酸的载体、表达构建体和细胞。
优选地,所述的细胞含有能够使酪氨酸硫酸化的磺基转移酶。
在一个实施方式中,通过琥珀密码子抑制将磺基酪氨酸遗传掺入本发明的肽中。
在另一个实施方式中,提供如上所述的seqidno:1a或seqidno:1b的肽,或如上所述的式1或式2或式3或式4的肽,或上述药物组合物,用于溶栓治疗。
优选地,溶栓治疗包括tpa治疗。
更优选地,溶栓治疗用于最大程度降低缺血性中风的后果。
附图简述
图1.硫酸化凝血酶抑制剂具有有效的体内抗凝血活性。a)用不同浓度的水蛭素和双硫酸化凝血酶抑制剂进行体外aptt测定;b)给予水蛭素和硫酸化凝血酶抑制剂(均为1毫克/千克;静脉注射)后血栓体积减少;c)在尾部流血模型中给予相同摩尔的水蛭素(0.5毫克/千克)和硫酸化凝血酶抑制剂肽(0.5毫克/千克)后的出血次数;d)在针刺血管损伤后给予水蛭素和硫酸化凝血酶抑制剂(均为1毫克/千克;静脉注射)后纤维蛋白减少;e)代表性的共聚焦图像显示在针刺血管损伤后,通过给予水蛭素(1毫克/千克;静脉注射)和硫酸化凝血酶抑制剂(1毫克/千克;静脉注射),血小板血栓(红色)和纤维蛋白(黄色)减少。
图2.硫酸化凝血酶抑制剂的抑制常数(ki),以及原始抑制数据的表格。
图3a)aaa(31-61)片段88的分析性uplc:rt1.50分钟(3分钟内0至60%b,洗脱液b,λ=230nm);b)片段88的质谱(esi+):计算质量:(中性)c143h225n39o56s2[m]3449.5,[m+2h]2+:1777.7(100%),[m+3h]3+:1185.5(100.0%);实测质量(esi+)[m+2h]2+:1778.0,[m+3h]3+:1185.6。
图4a)aaa(1-30)片段87的分析性uplc:rt1.55分钟(3分钟内0至60%b,洗脱液b,λ=230nm);b)片段87的质谱(esi+):计算质量:(中性)c142h210n33o61s[m]3386.4,[m+3h]3+:1150.8(100%),[m+4h]4+:863.6(100.0%);实测质量(esi+)[m+3h]3+:1151.0,[m+4h]4+:863.5。
图5a)c-末端aaa(31-61)片段87和aaa(1-30)肽硫酯86之间的连接反应得到相应的连接产物95(λ=230nm)的粗uplc-ms分析。95的计算质量(100%相对丰度)[m+4h]4+:1683.2,[m+5h]5+:1346.7,实测质量(esi+)m/z:[m+4h]4+:1683.3,[m+5h]5+:1347.1。b)连接产物95的原位脱硫反应16小时,得到相应的二硫酸化aaa(86)的粗uplc-ms分析。86的计算质量(100%相对丰度)[m+4h]4+:1675.2,[m+5h]5+:1340.4,[m+6h]6+:1117.1,实测质量(esi+)m/z:[m+4h]4+:1675.8,[m+5h]5+:1340.9,[m+6h]6+:1117.3。
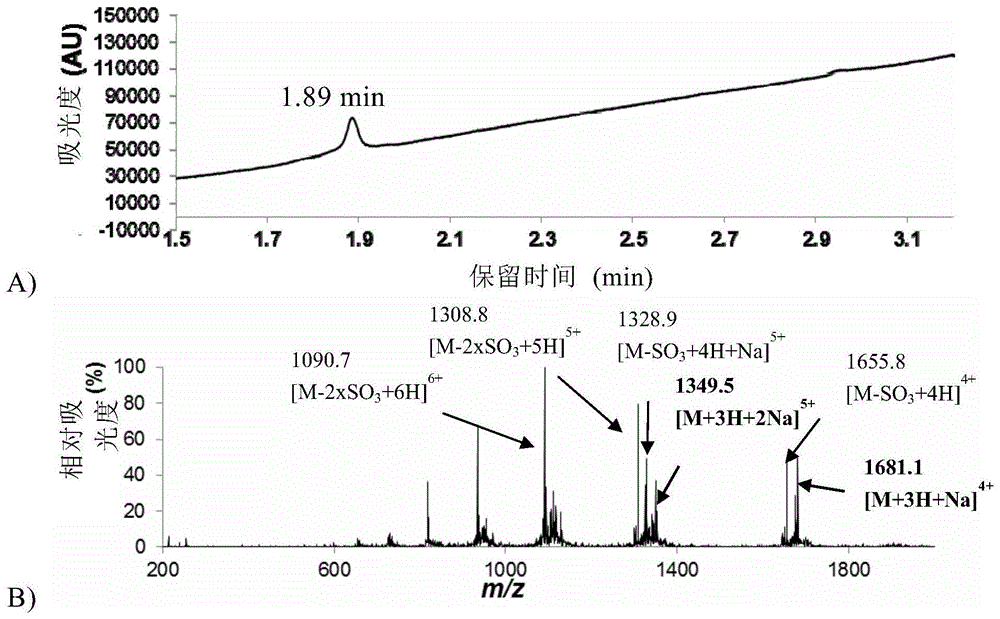
图6a)双重硫酸化aaa(86)的分析uplc:rt1.89分钟(3分钟内0至60%b,洗脱液b,λ=214nm);b)片段86的质谱(esi+):质子化(中性)c275h416n72o119s2的计算质量[m]:6696.8,[m+3h+na]4+:1680.7(100%),[m+3h+2na]5+:1349.2(100.0%);实测质量(esi+)[m+3h+na]4+:1681.1,[m+3h+2na]5+:1349.5。[c275h416n72o119s2-h]-的计算hrms(maldi)6697.789(平均值),实测6698.295。
具体实施方式
本发明特别关注抑制凝血级联的内源性组分与凝血酶的外部位点ii的结合。本文公开了与凝血酶外部位点ii结合并竞争性抑制这些组分中的一些的肽。
本发明提出,这些肽抑制剂可用于抑制凝血相关凝血酶形成纤维蛋白,从而解决与tpa疗法相关的血管再通的一些问题。该肽抑制剂也可用于调节其它肽的结合亲和力和/或功能,所述其它肽能结合凝血酶活性位点或凝血酶外部位点i并阻断凝血酶活性位点或凝血酶外部位点i的功能。
a.定义
“凝血酶”是一丝氨酸蛋白酶,其通过将纤维蛋白原转化为纤维蛋白而在止血过程中起核心作用。
“凝血酶活性位点”是切割一系列底物的催化位点,其底物包括纤维蛋白原、纤维蛋白肽、因子v、因子viii、蛋白酶活化受体(par)、糖蛋白v、因子xi、因子xiii、adamts13、蛋白c。
“凝血酶外部位点ii”(也称为“肝素结合外部位点”)是带正电荷的识别表面,其影响底物与辅助因子结合,特别是纤维蛋白原,gp1bα和肝素。凝血酶外部位点ii可能包括残基r93,r101,r126,k236,k240和r233。
“凝血酶外部位点i”(也称为“纤维蛋白原结合外部位点”)是带正电的识别表面,其影响底物与辅助因子结合,特别是纤维蛋白原,因子v,因子viii,adamts13,因子xiii,par-1,因子xi和血栓调节蛋白。凝血酶外部位点i可能包括残基k36,h71,r73,r75,y76和r77。
关于凝血酶包括凝血酶活性位点和外部位点i和ii的概论详见(laned等人,2005bloodj.106:2605-2612)。
“硫酸化酪氨酸残基”和“酪氨酸-o-硫酸盐”是由含硫基团转移到酪氨酸的羟基侧链产生的残基。该残基可能源于酪氨酰蛋白磺基转移酶(tpst)的作用。
“出血时间”通常指出血停止所需的时间。它已被用于临床评估血小板功能。用于评估出血时间的一系列测定是本领域已知的:参见以下三篇文章greenet.k.等人,2010j.thrombandhaem8:2820-2822;刘y等人,2012wjem2:30-36;brozeg.j.等人,2001thrombhaemost85:747-748。
“凝血时间”通常是指形成纤维蛋白凝块所需的时间。通常通过活化的部分促凝血酶原激酶时间(aptt)测试来评估凝血时间。
“水蛭素”是由65个氨基酸组成的低分子量肽(7kda)(dodt等人,1984febslett,165:180-4),其通过与外部位点i和凝血酶活性位点结合来防止血液凝固(stone和hofsteenge,1986biochem,25:4622-28)。
“包含”和该术语的变体,例如“包括”,“含有”和“包含的”,并不旨在排除其他添加剂,组分,整数或步骤。
b.外部位点ii抑制剂
在一个实施方式中,提供了包含seqidno:1a中所示氨基酸序列或由其组成的肽
pxyxxxzzpxyzzz
其中,
z是d或e,以及
x是任何氨基酸。
该肽可能具有如下所示的序列:
seqidno:2(pbyxxgzzpxyzzz,其中z是d/e,b是k/r/h,x是任何氨基酸。)
seqidno:3(pqyjxgzzpoyzzz,其中z是d/e,j是a/t/s或g,o是s或t,x是任何氨基酸。)
seqidno:4(pqyaxgzzpoyzzz,其中z是d/e,o是s/t,x是任何氨基酸。)
seqidno:5(pqyaxgzzpoyzzzxxxxzxx,其中z是d/e,o是s/t,x是任何氨基酸。)
seqidno:6(pqyaxgzzpoyzzz(d/t)(d/g/f)(d/a)(s/d/e)(d/e)(k/p/s)(l/v)其中z是d/e,o是s/t,x是任何氨基酸。)
seqidno:7(pqyaxgzzpoyzzzddddd(k/p/s)(l/v)其中z是d/e且o是s/t且x是任何氨基酸。)
seqidno:8(pqyaxgzzpoyzzzdddee(k/p/s)(l/v)其中z是d/e且o是s/t且x是任何氨基酸。)
seqidno:8a(pqyapgdepsyded)
seqidno:8b(pqyapgeepsyded)
seqidno:8c(pqythgeepeyded)
seqidno:8d(pqyaqgeeptyded)
seqidno:8e(pqyargdvptydee)
在另一个实施方式中,提供了包含seqidno:1b中所示氨基酸序列或由其组成的肽
zxzyzxyzxxx
其中,
z是d,e,q,s或p和
x是任何氨基酸。
肽可具有如下所示的序列:
seqidno:12(dadydeyeedg)
seqidno:13(dgdydeydnde)
seqidno:14(qgdydeydqde)
seqidno:15(dadyddydeeg)
seqidno:16(dvsydeyedng)
seqidno:17(qddydeydade)
seqidno:18(etdydeyeene)
seqidno:19(esdydtypddn)
seqidno:20(ddeydmyesdg)
seqidno:21(etsyeeypdds)
seqidno:22(esdydtypddn)
seqidno:23(erddedydnsn)
seqidno:24(zxzyzzyzzzz,其中z是d/e,x是t/m/e/s/d/g/n/p)
seqidno:25zszyztypddn,其中z是d/e)
seqidno:26zdzyzmyesdg,其中z是d/e)
seqidno:27ztsyzeypdds,其中z是d/e)
seqidno:28zszyztypddn,其中z是d/e)
在一个优选例中,所述的肽由不超过约35个氨基酸,优选约30至35个氨基酸,更优选约30,31,32,33,34或35个氨基酸组成。
优选地,所述肽与凝血酶的外部位点ii结合。
所述肽可以竞争性地抑制凝血相关的纤维蛋白,优选地纤维蛋白原γ'与凝血酶的外部位点ii的结合。所述肽对凝血酶的外部位点ii的亲和力可能高于对纤维蛋白原的。这将使得该肽能够从tpa溶栓治疗的受试者的凝块表层洗脱凝血相关的凝血酶,从而最大程度减少tpa治疗相关的血管再通降低的发生率。
在一个实施方式中,所述的肽可以抑制选自下组的化合物与凝血酶的外部位点ii的结合:因子v、因子viii、gp1bα、硫酸软骨素和肝素。
通常,该肽的至少一个残基是硫酸化酪氨酸残基。
优选地,seqidno:1a中第11位的酪氨酸是硫酸化的。seqidno:1a中第3位的酪氨酸可能不被硫酸化。
在另一个实施方式中,seqidno:1a中第11位的酪氨酸是硫酸化的,第3位的酪氨酸是硫酸化的。
如本文的实施例中所述,一个或两个酪氨酸残基的硫酸化与凝血酶活性抑制的增强有关。
优选地,seqidno:1b中第4位的酪氨酸是硫酸化的。seqidno:1b中第7位的酪氨酸可能不被硫酸化。
优选地,seqidno:1b中第7位的酪氨酸是硫酸化的。seqidno:1b中第4位的酪氨酸可能不被硫酸化。
在另一个实施方式中,seqidno:1b中第4位的酪氨酸是硫酸化的,第7位的酪氨酸是硫酸化的。
通过在含有酪氨酰蛋白磺基转移酶(tpst)的细胞中表达编码seqidno:1a或seqidno:1b所示肽的核酸,可以实现酪氨酸残基的硫酸化。更详细地,无机硫酸盐可以分别通过atp硫酸化酶和aps激酶活化成腺苷-5'-磷酸硫酸盐(aps)和3'-磷酸-腺苷-5'-磷酸硫酸盐(paps)的形式。然后可以通过高尔基体中的tpst将活化的硫酸盐转移至酪氨酸。
在本发明的肽中获得硫酸化酪氨酸残基的另一种方法是利用涉及琥珀密码子抑制的重组表达系统,从而使得磺基酪氨酸能够在肽的重组合成期间掺入肽中。
在本文的实施例中,本发明人提供了能够产生硫酸化肽的均一组合物的合成方法(即,含有仅具有一种硫酸化模式的肽的组合物)。
通过利用如lovelyrs等人(2002)所述的凝血酶γ’肽结合试验,可以测试本文所述的外部位点ii抑制剂对结合凝血酶外部位点ii的特异性。简而言之,标记外部位点ii抑制剂或结合物,或推定的外部位点ii抑制剂或结合物,与凝血酶一起温育并测量荧光偏振。该测定法可用于竞争性抑制剂模型中,以确定对每种外部位点ii结合肽的抑制常数。
如上所述,接受tpa治疗缺血性中风的患者中至少20-30%将在tpa治疗后出现完全动脉再通,并且这其中20-30%将经历再闭塞。一些人认为,这种情况会出现是因为tpa治疗暴露出凝块包埋的凝血酶(据信,凝血酶通过外部位点ii与凝块结合),从而使得凝血酶的活性位点能够切割纤维蛋白原并使得纤维蛋白肽扩增和构建凝块。将本文所述的,外部位点ii抑制剂提供给接受tpa治疗的个体,从而能够将凝血相关凝血酶从纤维蛋白凝块中洗脱,藉此最大程度降低凝块中的凝血酶量,否则凝血酶将导致纤维蛋白产生和凝块扩张。
因此,在一个实施方式中提供了,在tpa治疗方法中以治疗有效量提供本文所述凝血酶的外部位点ii抑制剂的步骤。
凝血酶的外部位点ii抑制剂通常以适于静脉内注射的组合物的形式提供。
凝血酶的外部位点ii抑制剂以接受者约100微克/千克至10毫克/千克的量提供。
c.凝血酶抑制剂
在进一步的实施方式中,本发明涉及利用本文公开的外部位点ii结合肽来设计,修饰和/或产生新的凝血酶活性抑制剂,特别是用于预防或至少尽可能降低凝血酶切割纤维蛋白原或纤维蛋白肽的抑制剂。这些外部位点ii结合肽可以提供与凝血酶活性位点和/或外部位点i的结合亲和力改善的抑制剂。
凝血酶抑制剂可以如式1所述:
a-b
其中:
a是外部位点ii结合肽,其具有seqidno:1a或seqidno:1b所示的序列,如上所述;
b是具有seqidno:10a至10j之一所示序列的肽,其与凝血酶活性位点结合,以防止凝血酶活性位点切割纤维蛋白原形成纤维蛋白;
其中a和b连接,以便当b与凝血酶活性位点结合时,a能够与凝血酶的外部位点ii结合。
可以理解,a可以位于b的n端,或者b可以位于a的n端。
在进一步的实施方式中,凝血酶抑制剂可以如式2所述:
a-b-c
其中:
a是具有seqidno:1a或seqidno:1b所示序列的外部位点ii结合肽,如上所述;
b是具有seqidno:10a至10j之一所示序列的肽,其与凝血酶活性位点结合,以防止凝血酶活性位点切割纤维蛋白原形成纤维蛋白;
c是具有seqidno:11a至11c之一所示序列的肽,用于与凝血酶的外部位点i结合;
其中a,b和c连接,以便当b与凝血酶活性位点结合并且c与凝血酶的外部位点i结合时,a能够与凝血酶的外部位点ii结合。
可以理解,a可以位于c的n端,或者c可以位于a的n端。
在又一个实施方式中,可以根据式3描述凝血酶抑制剂:
a-c-b
其中:
a是外部位点ii结合肽,其具有seqidno:1a或seqidno:1b所示的序列,如上所述;
b是具有seqidno:10a至10j之一所示序列的肽,其与凝血酶活性位点结合,以防止凝血酶活性位点切割纤维蛋白原形成纤维蛋白;
c是具有seqidno:11a至11c之一所示序列的肽,用于与凝血酶的外部位点i结合;
其中a,b和c连接,以便当b与凝血酶活性位点结合并且c与凝血酶的外部位点i结合时,a能够与凝血酶的外部位点ii结合。
可以理解,a可以位于b的n端,或者b可以位于a的n端。
在又一个实施方式中,可以根据式4描述凝血酶抑制剂:
b-a-c
其中:
a是外部位点ii结合肽,其具有seqidno:1a或seqidno:1b所示的序列,如上所述;
b是具有seqidno:10a至10j之一所示序列的肽,其与凝血酶活性位点结合,以防止凝血酶活性位点切割纤维蛋白原形成纤维蛋白;
c是具有seqidno:11a至11c之一所示序列的肽,用于与凝血酶的外部位点i结合;
其中a,b和c连接,以便当b与凝血酶活性位点结合并且c与凝血酶的外部位点i结合时,a能够与凝血酶的外部位点ii结合。
可以理解,b可以位于c的n端,或者c可以位于b的n端。
式1至4的凝血酶抑制剂可包括肽序列(例如包含2个或更多个氨基酸残基,例如gly和ala的肽)或其他聚合物(例如,二甘醇接头)形式的接头,所述接头连接b(活性位点结合肽)与a(外部位点ii结合肽);或b(活性位点结合肽)与c(外部位点i结合肽);或a(外部位点ii结合肽)与c(外部位点i结合肽)。肽序列的实例包括polyala或polygly肽。接头肽的长度可以根据相关凝血酶位点之间的分子距离来确定。这些分子距离如下:(i)凝血酶活性位点至外部位点ii:38至60埃;(ii)凝血酶活性位点至外部i:27至40埃;(iii)外部位点ii至外部位点i:65至100埃。
上述抑制剂可以通过固相肽合成来制备。例如,式1的抑制剂可以通过包括以下步骤的方法制备:a的固相合成,a的选择性脱硫以保持所需的酪氨酸硫酸化模式,b的固相合成和a与b的连接;或者,作为最后一步的替代方案,将a连接到接头,并将a-接头缀合物与b连接以形成a接头-b缀合物。
在其他实施方式中,抑制剂可以通过重组dna技术合成。特别优选的是,该技术中使用的细胞系是(i)能够在无机硫酸盐存在下生长和(ii)能够将无机硫酸盐同化到生物系统中,特别是涉及酪氨酸残基的翻译后修饰的系统。这种细胞系通常在高尔基体中包含酪氨酰蛋白磺基转移酶,从而能够形成一个或多个酪氨酸-o-硫酸盐残基。在某些实施方式中,表达产物在酪氨酸硫酸化模式方面可以是异质的。通过在各种分离系统,包括能够基于酪氨酸硫酸化表型区分同种型的色谱系统上纯化表达产物可以获得均一的酪氨酸-硫酸化同种型群。
可以通过对一组蛋白酶进行反筛选来研究本文所述的抑制剂的凝血酶选择性,所述蛋白酶包括胰蛋白酶,胰凝乳蛋白酶,弹性蛋白酶,木瓜蛋白酶,蛇毒凝血酶和因子xa以及来自血液凝固级联的活化蛋白c。采用如上所述的荧光偏振测定法,首先以单一浓度(5μm)筛选抑制剂。
可以通过解析凝血酶的复合物的三维结构来确定本文所述抑制剂的凝血酶识别和抑制的分子细节。简言之,在体外制备凝血酶-抑制剂复合物,并为结晶条件作广泛的亚微级别筛选。采用惯常的晶格筛选来完善和优化初始条件。使用x射线衍射仪确定冷冻保护条件和初始样品表征。利用高亮度同步加速器源处收集高分辨率x射线衍射数据,确保所得模型具有足够的细节水平。通过分子置换技术,使用未配位的人凝血酶的坐标作为搜索模型来解析结构,并使用计算平台对其进行完善和解释。这些数据提供了抑制剂结合模式的详细信息,并揭示了与凝血酶的关键相互作用。
本文公开的凝血酶抑制剂的抗凝血活性通过使用临床tt测定法测量它们在体外延长人血浆凝固的能力来确定。简言之,将来自健康供体的人血浆(800微升)与一系列浓度的抑制剂混合,通过加入凝血酶引发凝固,并使用凝血计测量凝血时间。在50nm浓度下将凝固时间延长至≥30秒的化合物可以在体外/离体进一步aptt研究。简而言之,将来自c57bl6/j小鼠的合并的柠檬酸盐血浆与各种浓度(0-12微克/毫升)的抑制剂一起预孵育。加入凝固活化剂和cacl2后,定量测定每种血浆样品的aptt。在离体测定中,抑制剂通过静脉内注射给小鼠(由体外aptt测定的固定浓度),在给药后0,5,30和60分钟将全血收集到柠檬酸钠(~130微升)中。使用randoxaptt试剂盒定量测定分离的血浆的aptt,监测纤维蛋白生成以测量凝血时间。
本发明人在实施例中表明,与已知的抗凝血剂相比,具有上述外部位点ii结合肽的多肽具有有效的体内抗血栓活性,同时凝固时间减少和出血时间减少。这是很有益处的,因为许多抗血栓形成药物由于出血风险(包括中风治疗中的颅内出血)而在使用上受到限制。
出血时间在临床上是一个重要问题,因为接受抗凝治疗的患者出血风险显著增加。具体而言,针对已知的抗凝血剂(包括水蛭素)引起的出血没有有效的治疗可用。因此需要减少出血时间的药剂。
本发明人证明了,本发明的硫酸化多肽与已知的凝结剂水蛭素相比,表现出明显出血更少的惊人效果。
在一个实施方式中,与水蛭素相比,本发明的硫酸化多肽减少出血超过2倍。在另一个实施方式中,与水蛭素相比,本发明的硫酸化多肽将出血时间减少超过3倍。在另一个实施方式中,在本发明的硫酸化多肽存在下的出血时间发生不超过10分钟。
在另一个实施方式中,本发明的硫酸化多肽存在下的出血时间与水蛭素相比,减少超过20%,超过30%,超过40%,超过50%或超过60%。
本发明所公开的肽和组合物可用于在不希望发生病理性血栓的受试者,例如人中抑制凝血酶活性,例如足以抑制凝血酶活性的抗凝剂量。该组合物可用于患有诸如心肌梗塞、中风、肺栓塞、深静脉血栓形成、外周动脉闭塞、弥散性血管内凝血、心血管和脑血管血栓形成、与术后创伤相关的血栓形成、肥胖、妊娠、口服避孕药的副作用、长期固定,和与血液学、免疫学或风湿病相关的高凝状态等病症的受试者。或者受试者可能患有不稳定的心绞痛、动脉硬化、用球囊导管进行血管成形术后血管重新阻塞或血液透析中的血液凝固。
实施例:
实施例1——硫酸化外部位ii结合剂的合成
通过fmoc-策略spps合成仅结合外部位点ii的全长凝血酶抑制剂的片段。
树脂装载:按照制造商的说明,给2-氯三苯甲基氯树脂,rink酰胺树脂或wang树脂加载目标磺基肽的c-末端氨基酸。
迭代肽组装(fmoc-spps)
脱保护:用哌啶/dmf(1:4,v/v,3毫升,3×5分钟)处理树脂,过滤,然后用dmf(5×3毫升),ch2cl2(5×3毫升)和dmf(5×3毫升)清洗。
偶联(标准fmoc保护的氨基酸):含标准fmoc保护的氨基酸(4当量),pybop(4当量)和nmm(8当量)的dmf(终浓度0.1m)溶液加入树脂。1小时后,过滤树脂并用dmf(5×3毫升),ch2cl2(5×3毫升)和dmf(5×3毫升)清洗。
硫酸酪氨酸的位点特异性掺入:通过以下两种方法之一将酪氨酸硫酸盐掺入所需的肽片段中:
1)氨基酸盒[fmoc-tyr(so2och2c(ch3)3)-oh]的偶联:将含fmoc-tyr(so2och2c(ch3)3)-oh(1.2当量),hatu(1.2当量)和nmm(2.4当量)的dmf(最终浓度0.1m)溶液加入树脂。18小时后,过滤树脂并用dmf(5×3毫升),ch2cl2(5×3毫升)和dmf(5×3毫升)清洗。
2)掺入fmoc-tyroall-oh后的固相硫酸化:使用咪唑鎓硫酸化试剂,采用taleski,d等人.2011或hsieh,y.s.等人,2014.描述的方法进行固相硫酸化。
加帽:将乙酸酐/吡啶(1:9,v/v,3毫升)加入树脂中。3分钟后,过滤树脂,用dmf(5×3毫升),ch2cl2(5×3毫升)和dmf(5×3毫升)清洗。
切割:使用酸性切割混合物例如,90:5:5v/v/v三氟乙酸/三异丙基硅烷/水将硫酸化的肽从树脂上切下,同时侧链脱保护。
硫酸酯保护基团的脱保护:
1)如ziarek,j.j等人2013所述,用叠氮化钠溶液或乙酸铵水溶液处理,实现新戊基硫酸酯脱保护(来自盒策略)。
2)如taleski,d.等人2011所述,采用氢化进行二氯乙烯基硫酸酯和三氯乙基硫酸酯的脱保护(来自固相硫酸化策略)。使用如hsieh,y.s.等人.2014.中所述的乙酸铵水溶液实现三氟乙基硫酸酯的脱保护。
纯化:使用反相hplc纯化实现位点特异性硫酸化的外部位点ii结合肽片段的纯化。
实施例2-式2的凝血酶抑制剂(aaa)的合成。
方案1aaa(31-61)片段88的合成
方案1续
使用标准加载程序将fmoc-pro-oh(84mg,250μmol)加载到ctc树脂上。然后如上所述进行迭代fmoc-spps,得到完全组装的树脂结合aaa(32-61)。将树脂上的肽分散,并将25μmol肽用于以下处理。用含20%哌啶的dmf(2×5毫升)将肽作fmoc去保护,随后在室温下,boc-asp(stmb,otbu)-oh(25毫克,50μmol,2.0当量)与溶于dmf(1.5毫升)中pybop(26毫克,50μmol,2.0当量)和nmm(0.11毫升,101毫克,0.10mmol,4.0当量)偶联,持续16小时。用dmf(5×5毫升),ch2cl2(5×5毫升)和dmf(5×5毫升)清洗树脂。将肽去保护并使用tfa/ipr3sih/h2o(4毫升,90:5:5v/v/v)从树脂上切割下,并将所得混合物搅拌2小时。将粗制肽从冰冷的et2o(20毫升)中沉淀,并通过反相制备型hplc(20至80%b,60分钟,洗脱液a)纯化,冻干后得到所需的肽88,为tfa盐(8.8毫克,9.0%)。见图3a和b。
方案2:aaa(1-30)片段(87)的合成
方案2续
按照标准加载程序将fmoc-thr(otbu)-oh(100毫克,250μmol)加载到ctc树脂上。然后如上所述进行迭代fmoc-spps,得到完全组装的树脂结合aaa(1-30)。将树脂上的肽分散,并将25μmol肽用于以下处理。使用hfip/ch2cl2(4毫升,7:3v/v)从树脂中释放受保护的肽。随后用溶于dmf(2毫升)中的pybop(65毫克,0.13mmol,5.0当量),ipr2net(22微升,16毫克,0.13mmol,5.0当量)和3-巯基丙酸乙酯(160微升,170毫克,1.3mmol,50当量)在-40℃下处理所得产物过夜。此时,将反应混合物真空浓缩。然后用tfa/ipr3sih/h2o(4毫升,90:5:5v/v/v)将肽去保护,并将反应混合物搅拌2小时。将得到的粗产物从冰冷的et2o(20毫升)中沉淀,并通过制备型hplc(20至80%b,60分钟,洗脱液a)纯化,在冷冻干燥后得到肽硫酯87,即为tfa盐(11毫克,12%)。见图4a和b.
一炉法合成二硫酸化aaa的一般程序:
方案3一炉法合成双硫酸化aaa(86)
将溶于连接缓冲液(6mgn.hcl,100mmna2hpo4,25mmtcep,ph6.8,320微升)中的肽88(6.0毫克,1.6μmol,1.2当量)溶液加入肽硫酯87(5毫克,1.3mol,1.0当量)中得到最终的5mm肽硫酯87溶液。所得溶液用2mnaoh小心地重新调节至ph7.4,然后加入tfet(10体积%)并在30℃温育2小时。uplc-ms分析表明完全转化为连接的蛋白95。然后加入溶于缓冲液(6mgn.hcl,100mmna2po4,320微升)中tcep(0.5m)和谷胱甘肽(100mm)的中性溶液,得到2.5mm终浓度的连接产物。将所得溶液调节至ph6.5,然后通过用ar喷射10分钟脱气,这也从反应混合物中除去过量的tfet。然后加入固体形式va-044(10mm),轻轻搅拌反应混合物并在37℃下孵育16小时。此后,uplc-ms分析显示完全转化为双硫酸化的aaa86。粗制反应混合物经制备型hplc纯化(0至60%b,60分钟,0.1mnh4oac),冷冻干燥后得到二硫酸化的aaa86,即乙酸铵盐(3.9毫克,43%)。见图5。
实施例3——与水蛭素相比,aaa的凝血和出血时间
我们研究了实施例2的抑制剂(aaa)在体外活化的部分促凝血酶原激酶时间(aptt)测定中延长凝血时间的能力(图1a)。这些研究表明,虽然在高于2微克/毫升的浓度下,水蛭素的凝血时间增加了8倍,但aaa(5.7倍)仍然在更安全的凝血时间范围内。
我们还发现,虽然aaa在针刺损伤体内模型中具有与水蛭素非常相似的抗血栓形成活性(图1b),但它在尾部放血体内模型中显示出少3倍的出血(图1c)。虽然aaa对于从血栓中去除纤维蛋白与水蛭素同样有效(图1d),但它看来在去除血小板方面效果较差(参见图1e,水蛭素和aaa的共聚焦图像)。这种对纤维蛋白和血小板的不同影响是出乎意料的,这可以部分解释用aaa观察到的出血显著减少。
实施例4——通过硫酸盐形式的aaa抑制凝血酶
如图2a所示,本发明人证明硫酸化肽抑制凝血酶,其中ki小于约6pm,具体地小于3.0pm。此外,这些肽和蛋白的双重硫酸化变体作为体外人凝血酶抑制剂的效力比未硫酸化对应物高两个数量级。
参考文献
世界卫生组织(2014),事实单第310号,死亡的前10个原因(2014年5月更新).
wardlawjm,等.(2012).用于急性缺血性中风的重组组织型纤溶酶原激活剂:更新的系统评价和meta-分析(recombinanttissueplasminogenactivatorforacuteischaemicstroke:anupdatedsystematicreviewandmeta-analysis).lancet.379(9834):2364-72.
molinaca,saverjl.(2005).延长再灌注治疗急性缺血性中风的新药理、机理和影像学策略(extendingreperfusiontherapyforacuteischemicstrokeemergingpharmacological,mechanical,andimagingstrategies).stroke.36(10):2311-20.
alexandrovav,grottajc.(2002).静脉组织纤溶酶原激活剂治疗中风患者的动脉再闭塞(arterialreocclusioninstrokepatientstreatedwithintravenoustissueplasminogenactivator).neurology.59(6):862-7.
rubieram等.(2005).急性缺血性中风中组织型纤溶酶原激活剂诱导再通后的早期动脉再闭塞预测因子(predictorsofearlyarterialreocclusionaftertissueplasminogenactivator-inducedrecanalizationinacuteischemicstroke).stroke.36(7):1452-6.
barretoad等.(2012).阿加曲班和组织型纤溶酶原激活剂中风研究试点安全性研究的最终结果(theargatrobanandtissue-typeplasminogenactivatorstrokestudyfinalresultsofapilotsafetystudy).stroke.43(3):770-5.
vonkummerr,hackew.(1992)静脉内组织纤溶酶原激活剂和肝素治疗急性大脑中动脉中风的安全性和有效性(safetyandefficacyofintravenoustissueplasminogenactivatorandheparininacutemiddlecerebralarterystroke).stroke.23(5):646-52.
jangi-k等.(1999).阿加曲班与肝素在急性心肌梗死中作为组织纤溶酶原激活物(tpa)辅助的多中心随机研究:诺保思泰和tpa(mint)的心肌梗死研究(amulticenter,randomizedstudyofargatrobanversusheparinasadjuncttotissueplasminogenactivator(tpa)inacutemyocardialinfarction:myocardialinfarctionwithnovastanandtpa(mint)study).j.am.coll.cardiol.33(7):1879-85.
karabiyikoglum,huay,keeprf,ennissr,xig.(2004).脑内水蛭素注射可减轻缺血性损伤和神经功能缺损而不改变局部脑血流量(intracerebralhirudininjectionattenuatesischemicdamageandneurologicdeficitswithoutalteringlocalcerebralbloodflow).j.cereb.bloodflowmetab.24(2):159-66.
lovelyrs等,2002j.thrombosisandhaemostasis1:124-131.
ziarek,j.j.;getschman,a.e.;butler,s.j.;taleski,d.;stephens,b.;kufareva,i.;handelt.m.;payne,r.j.;volkman,b.f.cxcr4/cxcl12界面的磺基肽探针显示低聚物特异性接触和趋化因子变构反应(sulfopeptideprobesofthecxcr4/cxcl12interfacerevealoligomer-specificcontactsandchemokineallostery),acschem.biol.2013,8(9),1955-1963.
taleski,d.;butler,s.j.;stone,m.j.;payne,r.j.磺基肽的分散和位点选择性固相合成(divergentandsite-selectivesolid-phasesynthesisofsulfopeptides).chem.asianj.2011,6(6),1316-1320.
hsieh,y.s.;wilkinson,b.l.;wijeyewickrema,l.c.;pike,r.n.;payne,r.j.水蛭素p6的均一变体的全合成:翻译后修饰的抗血栓形成水蛭衍生蛋白(totalsynthesisofhomogeneousvariantsofhirudinp6:apost-translationallymodifiedanti-thromboticleech-derivedprotein).angew.chem.int.ed.2014,53,3947-3951
序列表
<110>悉尼大学
<120>用于治疗中风和相关凝血障碍的凝血酶抑制剂
<130>50189913tpg
<150>au2016905231
<151>2016-12-16
<160>44
<170>patentinversion3.5
<210>1
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>1
proxaatyrxaaxaaxaaglxglxproxaatyrglxglxglx
1510
<210>2
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>2
glxxaaglxtyrglxxaatyrglxxaaxaaxaa
1510
<210>3
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>3
proasxtyrxaaxaaglyglxglxproxaatyrglxglxglx
1510
<210>4
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>4
proglntyrxaaxaaglyglxglxproxaatyrglxglxglx
1510
<210>5
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>5
proglntyralaxaaglyglxglxproxaatyrglxglxglx
1510
<210>6
<211>21
<212>prt
<213>人工序列(artificialsequence)
<400>6
proglntyralaxaaglyglxglxproxaatyrglxglxglxxaaxaa
151015
xaaxaaglxxaaxaa
20
<210>7
<211>21
<212>prt
<213>人工序列(artificialsequence)
<400>7
proglntyralaxaaglyglxglxproxaatyrglxglxglxxaaxaa
151015
xaaxaaxaaxaaxaa
20
<210>8
<211>21
<212>prt
<213>人工序列(artificialsequence)
<400>8
proglntyralaxaaglyglxglxproxaatyrglxglxglxaspasp
151015
aspaspaspxaaxaa
20
<210>9
<211>21
<212>prt
<213>人工序列(artificialsequence)
<400>9
proglntyralaxaaglyglxglxproxaatyrglxglxglxaspasp
151015
aspglugluxaaxaa
20
<210>10
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>10
proglntyralaproglyaspgluprosertyraspgluasp
1510
<210>11
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>11
proglntyralaproglyglugluprosertyraspgluasp
1510
<210>12
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>12
proglntyrthrhisglyglugluproglutyraspgluasp
1510
<210>13
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>13
proglntyralaglnglyglugluprothrtyraspgluasp
1510
<210>14
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>14
proglntyralaargglyaspvalprothrtyraspgluglu
1510
<210>15
<211>5
<212>prt
<213>人工序列(artificialsequence)
<400>15
leuthrtyrthrasp
15
<210>16
<211>5
<212>prt
<213>人工序列(artificialsequence)
<400>16
valvaltyrthrasp
15
<210>17
<211>8
<212>prt
<213>人工序列(artificialsequence)
<400>17
aspproglyargargleuglyglu
15
<210>18
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>18
valalagluprolysmet
15
<210>19
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>19
gluileproglyilearg
15
<210>20
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>20
prothralalysproarg
15
<210>21
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>21
argalaleuhisvallys
15
<210>22
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>22
gluproalalysproarg
15
<210>23
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>23
proargglyglyprolys
15
<210>24
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>24
thrleuileseralaarg
15
<210>25
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>25
asppheglugluileprogluglutyrleugln
1510
<210>26
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>26
gluasptyralaalaileglualaserleusergluthrphe
1510
<210>27
<211>16
<212>prt
<213>人工序列(artificialsequence)
<400>27
propheasppheglualaileprogluglutyrleuaspaspgluser
151015
<210>28
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>28
aspalaasptyraspglutyrglugluaspgly
1510
<210>29
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>29
aspglyasptyraspglutyraspasnaspglu
1510
<210>30
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>30
glnglyasptyraspglutyraspglnaspglu
1510
<210>31
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>31
aspalaasptyraspasptyraspgluglugly
1510
<210>32
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>32
aspvalsertyraspglutyrgluaspasngly
1510
<210>33
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>33
glnaspasptyraspglutyraspalaaspglu
1510
<210>34
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>34
gluthrasptyraspglutyrglugluasnglu
1510
<210>35
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>35
gluserasptyraspthrtyrproaspaspasn
1510
<210>36
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>36
aspaspglutyraspmettyrgluseraspgly
1510
<210>37
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>37
gluthrsertyrgluglutyrproaspaspser
1510
<210>38
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>38
gluserasptyraspthrtyrproaspaspasn
1510
<210>39
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>39
gluargaspaspgluasptyraspasnserasn
1510
<210>40
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>40
glxxaaglxtyrglxglxtyrglxglxglxglx
1510
<210>41
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>41
glxserglxtyrglxthrtyrproaspaspasn
1510
<210>42
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>42
glxaspglxtyrglxmettyrgluseraspgly
1510
<210>43
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>43
glxthrsertyrglxglutyrproaspaspser
1510
<210>44
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>44
glxserglxtyrglxthrtyrproaspaspasn
1510
- 还没有人留言评论。精彩留言会获得点赞!