获得胎儿细胞核酸的方法与流程
本发明涉及用于获得母体血液样品中胎儿细胞来源的染色体dna的方法。
背景技术:
为了进行非侵入性产前基因检测(nipt),已经继续尝试开发一种收集高纯度胎儿细胞来源的染色体dna的方法。已经尝试浓缩在母体血液中的来自胎儿的有核红细胞(nrbc)以收集胎儿细胞来源的染色体dna。
专利文献1至3和12中的每一个公开了一种用于浓缩母体血液样品中的nrbc的方法。在专利文献1至3和12中,使用密度梯度离心方法。专利文献2还使用微通道芯片。专利文献3使用磁场。
引用列表
专利文献
专利文献1:日本专利第5265815号
专利文献2:日本专利第5311356号
专利文献3:日本未审查的专利申请公开第2009-511001号
专利文献4:日本未审查的专利申请公开第2016-067268号
专利文献5:日本专利第4091123号
专利文献6:已公布的专利申请第2007-530629号的pct国际公开的日文译文
专利文献7:日本专利第5857537号
专利文献8:日本专利第5308834号
专利文献9:已公布的专利申请第2015-515263号的pct国际公开的日文译文
专利文献10:日本专利第5642537号
专利文献11:日本未审查的专利申请公开第2007-175684号
专利文献12:已公布的专利申请第h06-509178号的pct国际公开的日文译文
专利文献13:日本未审查的专利申请公开第2015-158489号
非专利文献
非专利文献1:taizankamide,nagayoshiumehara,haruhikosago,"newtrialsforefficienterythroblastisolationfrommaternalblood",sei-i-kai,tokyojikeikaimedicaljournal,2015,130:11-7
非专利文献2:coldspringharbperspectmed2013;3:a011643
非专利文献3:macaulayi.c.,haertyw.,kumarp.,liy.i.,hut.x.,等人(2015)g&t-seq:parallelsequencingofsingle-cellgenomesandtranscriptomes.natmethods12:519-522
技术实现要素:
技术问题
如专利文献3第0164段所示,当通过facs分析母体血液样品时,检测到表达cd71(tfrc,转铁蛋白受体蛋白1)和cd235a(gpa,血型糖蛋白a)的有核细胞,即nrbc在母体血液中占单核细胞的比例不超过0.15%。母体血液中的有核细胞主要由母体来源的白细胞(wbc)占据。
即使在通过上述浓缩方法之一获得的nrbc的级分中,母体来源的wbc在一些情况下仍然是主要的血细胞。因此,母体来源wbc的dna可能混合在由这些级分获得的胎儿细胞来源的染色体dna中。此外,母体来源nrbc也包含在母体血液中。因此,获得具有高纯度的胎儿细胞来源的染色体dna变得更加困难。
专利文献4公开了一种方法,其中通过在载玻片上观察血细胞的形态来分离nrbc的候选细胞(第0069和0070段)。在该方法中,将通过密度梯度离心法浓缩的nrbc层施加于载玻片,然后通过may-giemsa染色对血细胞进行染色(第0066至0068段)。此外,通过分子生物学分析检查分离的nrbc的候选细胞是否是来自胎儿的细胞(第0079段)。
本发明提供了从母体血液样品中获得胎儿细胞来源的染色体dna的方法。本发明的一个目的是提供一种能够获得来自胎儿的在单细胞水平上分离的有核红细胞(nrbc)的染色体dna的方法。
技术方案
[p1].获得胎儿细胞来源的染色体dna的方法,其包括:
a.对级分a中的红细胞(rbc)和核酸进行特异性标记,该级分a是从母体血液样品中获得的级分,其中nrbc浓缩在全血细胞群中;
b.至少通过细胞分选而在级分a中分选出标记的血细胞,来获得nrbc纯度增加的级分b;
c.通过在单细胞水平上分离级分b中的每个血细胞来获得级分c,并独立地进行用于提取每个分离的血细胞的染色体dna的过程,每个级分c含有在单细胞水平上可区分的染色体dna;和
d.通过对每个级分c进行分子生物学分析,从级分c的组中选出含有来自胎儿的染色体dna的级分d。
[p2].根据[p1]中描述的方法,其中级分a是通过从母体血液样品中的血细胞中除去至少一些无核rbc而获得的级分。
[p3].根据[p2]中描述的方法,其中级分a是通过基于血细胞体积质量密度和血细胞大小中的至少一种性质对母体血液样品中的血细胞进行分级而获得的级分。
[p4].根据[p3]中描述的方法,其中,
在步骤c中,无论级分b中的每个血细胞是否具有nrbc的特征,通过在单细胞水平上任意地进行级分b中血细胞的分离,且通过任意地进行提取染色体dna的过程来获得级分c,和
由于级分c是任意获得的,因此基于步骤d中确定的染色体dna来源于胎儿,以事后的方式推测级分d中包含的染色体dna来源于nrbc。
[p5].根据[p4]中描述的方法,其中,
在步骤c中,通过有限稀释方法对级分b进行分级来获得级分e,在单细胞水平上分离每个包含血细胞的级分e,和
通过进行用于提取每个级分e的染色体dna的方法来获得级分c。
[p6].根据[p5]中描述的方法,其还包括:
从级分b中任意地分选级分f;
对级分f进行拍照;和
通过使用级分f的图像检查在单细胞水平上分离的血细胞是否包含在级分f中来确定级分f是否作为级分e获得。
[p7].根据[p3]至[p6]中任一项描述的方法,其中在不对级分a中的血细胞进行组织学交联/固定的情况下对级分a中的血细胞进行标记和细胞分选。
[p8].根据[p3]至[p7]中任一项描述的方法,其中
在步骤a中,通过使用荧光标记进行标记,
在步骤b中,在细胞分选仪中形成含有级分a的液体流,
通过在与液体流相交的方向上产生脉冲流,同时使用液体流中标记的血细胞作为靶标,并由脉冲流携带标记的血细胞,而从液体流中分离标记的血细胞,和
通过连续收集分离的血细胞而产生级分b。
[p9].根据[p3]至[p8]中任一项描述的方法,其中
在步骤a中,级分a是通过由免疫学去除方法从至少通过基于血细胞的体积质量密度或血细胞的大小对母体血液样品中的血细胞进行分级所获得的级分中进一步除去wbc而获得的级分。
[p10].根据[p3]中描述的方法,其中
在步骤a中,通过使用荧光标记进行标记,
在步骤b中,通过细胞分选而分选出级分a中的荧光标记的血细胞,来获得nrbc纯度增加的级分g;
通过将包含在级分g中的血细胞铺展在平面芯片上并将它们从平面芯片中分选出来,而获得nrbc纯度进一步增加的级分b;
在步骤c中,通过在单细胞水平上任意地进行级分b中血细胞的分离并且任意地进行提取染色体dna的方法来获得级分c,和
由于级分c是任意获得的,因此基于步骤d中确定的染色体dna来源于胎儿,以事后的方式推测级分d中包含的染色体dna来源于nrbc。
[p11].根据[p3]至[p10]中任一项描述的方法,其还包括通过基于血细胞的体积质量密度或大小对母体血液样品进行分级来获得级分a。
[p12].根据[p11]中描述的方法,其中通过使用血细胞分离芯片处理母体血液样品,基于血细胞的大小来对母体血液样品进行分级。
[p13].根据[p12]中描述的方法,其中
血细胞分离芯片包括主通道、连接到主通道的去除通道、以及去除通道下游的连接到主通道的回收通道,
母体血液样品流经主通道,
在去除通道处从母体血液样品中除去无核rbc,并在回收通道处从母体血液样品中收集nrbc,从而从回收通道获得级分a,
去除通道的内径为12μm至19μm,并且
回收通道的内径为20μm至30μm。
[p14].一种方法,其包括:
通过微阵列或测序方法分析由[p1]至[p13]中任一项描述的方法获得的级分d中的染色体dna;和
由分析结果获得用于非侵入性产前基因检测诊断的数据。
[r1].一种获得来自胎儿的核酸的方法,其包括:
a.对级分a中的wbc和细胞核进行特异性标记,该级分a是通过基于血细胞体积质量密度和血细胞大小中的任一个或两者对母体血液样品中的血细胞进行分级而从母体血液样品中获得的级分,其中nrbc浓缩在全血细胞群中;
b.至少通过细胞分选而在级分a中分选出标记的血细胞,来获得含有母体来源的nrbc和来自胎儿的nrbc的级分b,其中进行分选以去除由wbc特异性标记物所标记的血细胞并收集对细胞核具有特异性的标记物所标记的血细胞;
c.无论血细胞是否是nrbc,通过在单细胞水平上分离级分b中的每个血细胞来获得级分c,并且无论血细胞是否是nrbc,进行用于提取在单个细胞水平上分离的每个血细胞的核酸的过程,每个级分c含有在单细胞水平上可区分的核酸;和
d.通过对每个级分c进行分子生物学分析,从级分c的组中选出含有在单细胞水平上可区分的来自胎儿的核酸的级分d。
[r2].根据[r1]中描述的方法,其中在步骤c中,由于级分c是通过不确定血细胞是否来自nrbc的方法获得的,因此基于步骤d中确定的核酸来源于胎儿,以事后的方式推测级分d中包含的核酸源自在单细胞水平上分离的nrbc。
[r3].根据[r1]或[r2]中描述的方法,其中
母体血液样品是母体血液本身或者是与母体血液相比,nrbc未浓缩在全血细胞群中的非浓缩样品,
级分a是通过基于血细胞的大小对母体血液样品中的血细胞进行分级并从母体血液样品中的血细胞中除去至少一些无核rbc而从母体血液样品中获得的级分。
[r4].根据[r3]中描述的方法,其中
通过使用血细胞分离芯片处理母体血液样品,基于血细胞的大小对母体血液样品的血细胞进行分级,
血细胞分离芯片包括主通道、连接到主通道一侧的子通道、以及在子通道下游连接到主通道一侧的去除通道,去除通道所连接的主通道一侧与子通道所连接的主通道一侧相反,
母体血液样品流经主通道,
从子通道流出的液体将流经主通道的血细胞从主通道一侧推向去除通道,
在去除通道处从母体血液样品中去除无核rbc,并且在主通道中去除通道的连接点下游的位置处从母体血液样品中收集nrbc,从而获得级分a,并且
去除通道的内径为12μm至19μm。
[r5].根据[r4]中描述的方法,其中
血细胞分离芯片还包括在去除通道下游的连接到主通道一侧的回收通道,回收通道所连接的主通道一侧与子通道所连接的主通道一侧相反,
从子通道流出的液体还将流经主通道的血细胞从主通道一侧推向回收通道,
在回收通道处从母体血液样品中收集nrbc,从而从回收通道获得级分a,和
回收通道的内径为20μm至30μm。
[r6].根据[r1]至[r5]中任一项描述的方法,其中在步骤c中,通过有限稀释方法对级分b进行分级而获得级分e,并且通过进行用于提取每个级分e的核酸的方法来获得级分c,每个级分e含有在单细胞水平上分离的血细胞。
[r7].根据[r6]中描述的方法,其还包括:
无论血细胞是否是nrbc,通过从级分b中分选血细胞来获得级分f,
对级分f进行拍照;和
通过使用级分f的图像检查在单细胞水平上分离的血细胞是否包含在级分f中来确定级分f是否作为级分e获得,而不从级分f图像确定在单细胞水平上分离的血细胞是否是nrbc。
[r8].根据[r1]至[r5]中任一项描述的方法,其中,
在步骤c中,通过使用流体装置获得级分c,所述流体装置包括通道、沿通道连续布置并连接到通道的多个捕获结构、以及为各个捕获结构设置的反应结构,和
通过将血细胞通过通道分配到各个捕获结构而使包含在级分b中的血细胞在单细胞水平上彼此分离,在将血细胞捕获在各个捕获结构中之后通过溶解被捕获的细胞并从捕获结构朝向反应结构洗去溶解的物质,而在反应结构中获得级分c。
[r9].根据[r1]至[r8]中任一项描述的方法,其中,
在步骤a中,通过使用荧光标记至少对核酸进行标记,和
在步骤b中,通过基于荧光激活细胞分选方法的细胞分选来分选出已经至少对级分a中的核酸进行特异性荧光标记的血细胞。
[r10].根据[r1]至[r9]中任一项描述的方法,其中,
在步骤c中,级分c中包含的核酸是染色体dna,
在步骤d中,扩增染色体dna的全基因组或基因组中的部分区域以进行分子生物学分析,和
分选出含有dna的级分d作为来自胎儿的核酸,该dna是扩增产物。
[r11].根据[r1]至[r9]中任一项描述的方法,其中,
在步骤c中,级分c中包含的核酸是rna,
rna是mrna和非编码rna中的任一种或两者,
在步骤d中,进行rna的逆转录以进行分子生物学分析,和
分选出含有cdna的级分d作为来自胎儿的核酸,该cdna是逆转录产物。
[r12].根据[r11]中描述的方法,其中
在步骤c中,通过在提取rna的同时从每个血细胞中提取染色体dna,进一步获得与各个级分c相关的级分w,和
从级分w的组中获得与级分d相关的级分z,作为含有在单细胞水平上可区分的来自胎儿的染色体dna的级分。
[r13].一种方法,其包括:
通过微阵列或测序方法分析由根据[r1]至[r12]中任一项的方法获得的级分d中的核酸序列;和
从分析结果获得用于非侵入性产前基因检测诊断的数据。
[r14].一种获得胎儿细胞来源的染色体dna的方法,其包括:
a.对级分a中的rbc和核酸进行特异性标记,该级分a是从母体血液样品中获得的级分,其中nrbc浓缩在全血细胞群中,其中核酸至少通过使用荧光标记进行标记;
b.通过细胞分选而在级分a中至少分选出标记的血细胞,从而获得nrbc纯度增加的级分b,其中通过基于荧光激活细胞分选方法的细胞分选来分选出级分a中已经至少对核酸进行特异性荧光标记的血细胞;
c.通过在单细胞水平上任意地分离级分b中的每个血细胞而获得级分c,并任意地且独立地进行用于提取每个分离的血细胞的染色体dna的过程,每个级分c含有在单细胞水平上可区分的染色体dna;和
d.通过对每个级分c进行分子生物学分析,从级分c的组中选出含有在单细胞水平上可区分的来自胎儿的染色体dna的级分d,其中
由于级分c是任意获得的,因此基于步骤d中确定的染色体dna来源于胎儿,以事后的方式推测级分d中包含的染色体dna来自在单细胞水平上分离的nrbc,
通过基于血细胞的体积质量密度或血细胞大小对母体血液样品中的血细胞进行分级来获得级分a,
在步骤c中,通过有限稀释方法对级分b进行分级而获得级分e,每个级分e包含在单细胞水平上分离的血细胞,并且通过进行用于提取每个级分e的染色体dna的过程来获得级分c,和
母体来源的nrbc和来自胎儿的nrbc包含在级分b中。
[r15].根据[r14]中描述的方法,其中
在步骤a中,以另外的方式对级分a中的wbc进行特异性标记,和
在步骤b中,通过细胞分选而分选出级分a中标记的血细胞,来获得级分b,该级分b是去除了由wbc特异性标记物所标记的血细胞的级分。
[r16].根据[r14]或[r15]中描述的方法,其中
在步骤a中,通过磁性标记进行rbc的标记,
在步骤b中,在基于荧光激活细胞分选方法的细胞分选之前或之后,通过基于使用磁性标记的细胞分选方法的细胞分选来分选出级分a中已经对红细胞进行特异性磁性标记的血细胞,或
在步骤a中,通过使用荧光标记进行rbc的标记,和
在步骤b中,通过基于荧光激活细胞分选方法的细胞分选来分选级分a中已经对核酸和rbc进行特异性荧光标记的血细胞。
发明的有益效果
根据本发明的方法的特征在于,在进行提取染色体dna的方法之后,发现所收集的染色体dna来自胎儿的在单细胞水平分离的nrbc。作为结果,在本发明中,可以获得来自胎儿的在单细胞水平分离的nrbc的染色体dna。
附图说明
图1是获得染色体dna的流程图;
图2是表示单细胞水平的分离和dna提取的概念图;
图3是表示有限稀释方法的概念图;
图4是在单细胞水平上分离细胞的设备的示意图;
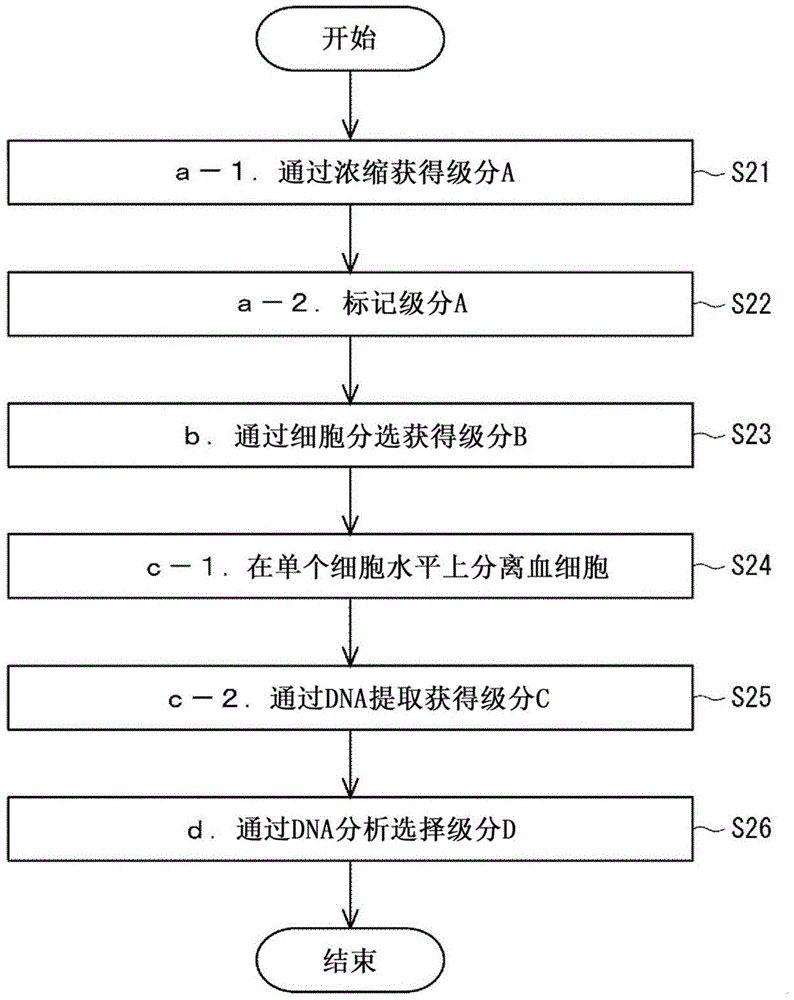
图5是选择级分d的流程图;
图6是获取诊断数据的流程图;
图7是表示通过平面芯片上的荧光进行分选的示意图;
图8是获得级分a的流程图;
图9是表示母体血液的密度梯度离心结果的示意图;
图10是细胞分选仪的示意图;
图11显示了hoechst33342的荧光强度分布;
图12显示了母体血液中免疫标记的荧光强度分布;
图13显示了普通血液中免疫标记的荧光强度分布;
图14是扩增的sry基因序列的dna的电泳图像;
图15是血细胞分离芯片的平面图;
图16是血细胞分离芯片的示意图;
图17是血细胞的染色图像;
图18是扩增的sry基因序列的dna的电泳图像;
图19是表示单细胞水平的分离和rna提取的概念图;
图20是选择级分d的流程图;
图21是显示同时提取染色体dna和rna的概念图;和
图22是扩增的dna的电泳图像。
具体实施方式
<<第一实施方案>>
在下面示出的<<第一实施方案>>及其实施例1和2中,来源于胎儿的nrbc的染色体dna是通过图1所示的过程获得的。首先,描述作为起始材料的母体血液样品。
[收集血液]
在该实施方案中,起始材料是人类孕妇的母体血液样品。对于孕妇,月经后的胎龄优选为10周至33周。月经后的胎龄由完成天数或完成周数表示,同时将最后一次月经的第一天定义为第一天。月经后的胎龄可以通过受精后的胎龄增加两周来计算。
母体血液样品可以是未经处理的母体血液本身。母体血液样品可以是通过对原始母体血液进行某种类型的化学或物理过程而改变的母体血液,以使得改变的母体血液变得适合于后续过程的保存和功效。这些过程包括例如添加防腐剂如细胞凋亡抑制剂、调节温度、添加试剂以防止血细胞沉淀、以及通过使用气垫来保护血细胞免受由振动引起的物理损伤。然而,该过程不限于这些实例。
在该实施方案中,母体血液是指从孕妇采集的血液。可以通过普通的医疗方法从孕妇收集母体血液。可立即浓缩收集的母体血液中的nrbc。此外,可以在将母体血液从收集血液的地方运输到血液浓缩的地方之后浓缩nrbc。可以对母体血液进行所需的防腐过程。
[有核红细胞(nrbc)]
在该实施方案中,目的是获得来自胎儿的nrbc的染色体dna。来自胎儿的nrbc在下文中描述。
在该实施方案中,血细胞是指血液中的细胞。血液中含有血细胞和血浆。根据一种理论,认为rbc占人体血细胞的大部分。此外,wbc和血小板也包括在血细胞中。母体血液含有来自胎儿的nrbc。
在该实施方案中,nrbc为成红血细胞,优选为失去其细胞分裂能力的成红血细胞。随着造血干细胞分化和成熟,产生了rbc。通过分化和成熟的过程,从造血干细胞开始,髓样祖细胞、rbc/巨核细胞前体细胞、前期红细胞前体细胞(bfu-e)、后期红细胞前体细胞(cfu-e)、原红细胞、嗜碱性成红血细胞、多色成红血细胞、正色成红血细胞、网织红细胞和红细胞相继地出现。
成红血细胞包括原红细胞、嗜碱性成红血细胞、多色成红血细胞和正常色成红血细胞。在正常色成红血细胞分化成网织红细胞的过程中,血细胞中的细胞核会丢失。通常,正常色成红血细胞已失去其细胞分裂能力。
nrbc通常存在于骨髓中。然而,如背景技术部分所述,在血液中发现了非常少量的nrbc。此外,在母体血液中发现非常少量的母体来源的nrbc和来自胎儿的nrbc。母体血液中来自胎儿的nrbc的数量通常小于母体来源的nrbc的数量。
[a.对级分a进行标记]
<a-1.通过浓缩获得级分a>
在步骤a中,对浓缩了nrbc的级分a中的rbc和核酸进行特异性标记。注意,级分a是通过基于血细胞的体积质量密度和其大小中的至少一种性质对母体血液样品中的血细胞进行分级而获得的级分。级分a可以通过根据血细胞的体积质量密度和其大小两者对母体血液样品中的血细胞进行分级来获得。在下文中,分别描述“a-1.通过浓缩获得级分a”和“a-2.级分a的荧光标记”。
在图1所示的步骤s21中,从母体血液样品中获得级分a,在该级分a中,在全血细胞群中,优选在rbc群中浓缩nrbc。在该实施方案中,表述“浓缩nrbc”表示级分中的nrbc与全血细胞的比例增加。优选地,这意味着nrbc与rbc的比例增加。
通过基于血细胞的体积质量密度或其大小对母体血液样品中的血细胞进行分级来获得级分a。可以例如通过上述密度梯度离心方法来进行基于血细胞的体积质量密度的分级。可以例如通过血细胞分离芯片,例如上述微通道芯片来进行基于血细胞大小的分级。通过上述分级,获得已从母体血液样品中的血细胞中除去至少一些无核rbc的级分。
此外,可以例如通过使用迪安流或迪安力的方法来进行基于血细胞大小的分级。这些方法可以通过使用可从microfluidicchipshopgmbh获得的螺旋分选仪来进行。
在图1所示的步骤s21中,可以通过免疫学去除方法,从通过基于体积质量密度或大小对母体血液样品中的血细胞进行分级所获得的级分中进一步去除wbc。以此方式,获得其中nrbc被进一步浓缩的级分a.
图1中所示的步骤s21可以结合到下面描述的步骤s22到s26中,并且它们可以在一个实验室中作为一系列过程来进行。或者,可以在临床设施中从该临床设施中所收集的母体血液获得级分a,然后将其运输到中心实验室。在中心实验室中,可以仅进行步骤s22至s26而不进行步骤s21。
<a-2.<级分a的标记>
在图1所示的步骤s22中,对级分a中的rbc和核酸进行特异性标记。标记(标记物)可以是磁性标记或荧光标记,但优选荧光标记。标记可以是直接标记或间接标记。间接标记可以是由标签和二抗进行的标记,或者可以是通过生物素-抗生物素蛋白结合进行的标记。
对rbc具有特异性的标记可以对rbc表面进行特异性标记。对rbc具有特异性的标记可以是免疫标记。免疫标记可以是由抗体进行的标记。免疫标记的靶抗原可以是糖类抗原。标记可以是由针对rbc的特异性抗原例如cd71和cd235a(gpa,血型糖蛋白a)的抗体进行的标记。
对rbc具有特异性的免疫标记可以是对早期rbc具有特异性的标记。它可以是免疫标记,该免疫标记的靶抗原是对早期rbc具有特异性的肽链,例如血红蛋白的胚胎ε珠蛋白链。这些用于免疫标记的抗体在专利文献5中提及。
nrbc中包含的核通过对核酸具有特异性的标记进行特异性标记。对核酸具有特异性的标记可以是染料标记。待标记的核酸优选为dna。染料可以是荧光染料。核可以通过荧光染料进行荧光标记。荧光染料可以是hoechst33342。
此外,可以使用与胎儿nrbc上存在的表面抗原反应但不与母体rbc上存在的表面抗原反应的抗体。抗体可以是单克隆抗体。例如,它可以是专利文献6中提到的抗体4b9。上述抗体可以与上述对rbc具有特异性的免疫标记或对核酸具有特异性的标记一起使用。通过使用这样的抗体,可以在不依赖于对核酸具有特异性的标记的情况下对nrbc进行特异性标记。
在图1所示的步骤s22中,可以同时进行针对rbc的特异性标记和针对核酸的特异性标记。或者,可以在一个标记过程之前进行另一标记。此外,可以在一个标记过程之前进行另一标记,且也可以在一个标记过程之前进行步骤s23中的分选。之后,可以进行其他标记和分选。
注意,可以在进行一个或所有上述标记过程之前对级分a中的血细胞进行组织学交联固定。此外,可以在该状态下通过细胞分选进行下述分级。通过交联/固定血细胞可以防止血细胞聚集。因此,可以通过细胞分选精确地进行分选。可以在后面描述的步骤d中所进行分子生物学分析之前对提取的dna进行去交联。
可以在不对级分a中的血细胞进行组织学交联/固定的情况下进行以下描述的分级,即通过细胞分选进行分级。以这种方式,可以使由后面描述的步骤d中所进行的分子生物学分析中的交联/固定引起的影响最小化。
例如,可以在不进行血细胞的交联/固定的情况下同时进行针对核酸的特异性标记和针对rbc的特异性标记。此外,在进行这些标记过程之后,可以交联/固定血细胞。此外,可以对交联/固定的血细胞进行针对wbc的特异性免疫标记。
[b.通过细胞分选获取级分b]
<b-1.基础细胞的选择>
在步骤s23中,通过细胞分选从级分a中分选出经标记的血细胞来获得级分b。在细胞分选中,例如使用用于分选细胞的设备(例如细胞分选仪)。在标记是荧光标记的情况下,通过细胞分选的分选方法可以是荧光激活细胞分选(facs)方法。通过细胞分选的分选方法可以是通过使用磁性标记的细胞分选方法。在该实施方案中,对细胞分选的原理和细胞分选仪的类型没有特别限制。细胞分选优选通过流式细胞术进行。
在一个方面,由配备有分选设备的细胞分析仪进行facs,例如通过细胞分选仪进行facs。在一个方面,细胞分选仪使细胞由连续流动的流体携带,并基于通过用激发光照射细胞而产生的细胞荧光来识别单个细胞的特征。该识别也是细胞分析仪的功能。基于通过识别获得的信息,细胞分选仪进一步将细胞限制在液滴中并收集含有特定细胞的液滴。通过这样做,细胞分选仪对特定细胞进行分选。
在一个方面,细胞分选仪使细胞由连续流动的流体携带,并基于通过用激发光照射细胞而产生的细胞荧光来识别单个细胞的特征。基于通过识别获得的信息,细胞分选仪在连续流动的流体连续地携带细胞的状态下分选出含有特定细胞的级分。
作为上述不使用液滴的细胞分选仪,如后面描述的图10所示和专利文献7中所公开的,已知使用脉冲流进行分选的细胞分选仪。此外,如专利文献8中所公开的,已知使用流体的溶胶-凝胶转变进行分选的细胞分选仪。
在上述细胞分选仪不使用液滴的情况下,由于将细胞引导至分选容器中的同时可以保持由流体携带细胞,因此细胞不太可能被损坏。此外,通过在将细胞引导至容器的过程中将流体限制在通道芯片中,容易防止设备和环境由于流体的飞溅而被污染。
在图1所示的步骤s23中,优选地分选出血细胞,以便获得已经用rbc特异性标记物进行标记的血细胞。由于nrbc是rbc,因此可以通过对rbc具有特异性的标记将nrbc与包括wbc在内的其他血细胞区分开。
在图1所示的步骤s23中,优选地分选出血细胞,从而获得已经用有核血细胞特异性标记物进行标记的血细胞。由于nrbc具有细胞核,因此可以通过对核酸特异的标记将nrbc与包括无核rbc在内的其他血细胞区分开。
在图1所示的步骤s23中,通过组合上述标记过程获得具有提高的nrbc纯度的级分b。所获得的级分b包括母体来源的nrbc和来自胎儿的nrbc。通过对rbc具有特异性的标记的分选和通过对核酸具有特异性的标记的分选可以同时进行。或者,可以在一个分选过程之前进行另一个分选。例如,可以首先通过对rbc具有特异性的磁性标记进行分选,然后通过使用对核酸具有特异性的荧光标记进行分选来获得级分b。
在图1所示的步骤s22中,可以以另外的方式特异性标记级分a中的wbc。对wbc具有特异性的标记可以是免疫标记。该标记可以标记wbc特异性抗原例如cd45。抗原可以是糖类抗原。在步骤s23中,优选对血细胞进行分选,以便去除已经用wbc特异性标记物进行标记的血细胞。
<b-2.附加的细胞选择>
在图1所示的步骤s21中,当级分a中的血细胞被荧光标记时,facs优选用作细胞分选。此外,由于荧光标记物甚至在细胞分选过程之后仍然存在,因此可以有效地使用该荧光标记物。
例如,通过另外将荧光用于通过细胞分选获得的第一级分,可以进一步分选细胞。例如,可以通过对所获得的第一级分进行细胞分选来进一步重复分选,从而获得第二级分和随后的级分。以这种方式,最终可以获得上述级分b。
[c.血细胞分离与dna提取]
在步骤c中,以单细胞水平分离级分b中的每个血细胞。此外,对于每个分离的血细胞独立地实施提取染色体dna的方法。以这种方式,获得各自含有在单细胞水平可区分的染色体dna的级分c。在该实施方案中,染色体dna指基因组dna。
在下文中分别描述了“c-1.在单细胞水平上分离血细胞”和“c-2.通过dna提取获得级分c”。
<c-1.在单细胞水平上分离血细胞>
在图1所示的步骤s24中,以单细胞水平分离级分b中的每个血细胞。此外,级分b中的血细胞在单细胞水平上彼此分离。在该实施方案中,在单细胞水平上分离血细胞包括逐个细胞地分离血细胞。也就是说,其包括获得单个细胞。
无论级分b中的每个血细胞是否具有nrbc的特征,优选在单细胞水平上任意地分离级分b中的血细胞。即,无论每个血细胞是否是nrbc,优选分离血细胞。术语“任意地”不旨在基于血细胞的体积质量密度和其大小以及基于直至获得级分b的过程中的血细胞标记来排除nrbc的浓缩。
作为上述浓缩和细胞分选的结果,含有细胞核40的nrbc41相对丰富地包含在图2中所示的级分b中。级分b也可含有其他血细胞。其他血细胞包括例如无核rbc42和含有细胞核40的wbc43。任意的分离指以包括所有的方式在单细胞水平分离这些细胞。
图2中所示的级分b中的每个血细胞优选地分散到单个容器44,以便在单细胞水平上分离它们。通过这种分散,可以进一步对级分b进行分级。分级优选通过有限稀释方法进行。通过有限稀释方法进行分级,可以获得各自含有以单细胞水平分离的血细胞的级分e。可以在限定分选体积后进行有限稀释方法,以使得通过从良好悬浮的级分b中分选出血细胞所获得的级分的数量变得大于血细胞的数量。
在图2中,总共示出了八个容器,每个容器相当于容器44。可以根据级分b中的血细胞数或待获得的级分c的数量确定容器44的数量。例如,容器可以是八个管,或可以是具有96个孔、384个孔或任何数量的孔的孔板。在图2中,级分e1、e2和e4至e8显示为级分e。在有限稀释方法中,可以如级分e3的情况那样产生不含血细胞的级分。
如上所述,优选地任意地进行血细胞向图2所示的容器44中的分散。也就是说,nrbc41的分散并未在单细胞水平上排除无核rbc42和wbc43的所有分散。
该实施方案不依赖于基于如专利文献4中所述的细胞形态信息来区分胎儿nrbc的候选细胞。此外,该实施方案不包括基于候选细胞的这种区分在逐个细胞的基础上分离候选细胞。在该实施方案中的单细胞水平分离中,优选不进行包括识别nrbc的这种分离操作。在一个优选方面,根据该实施方案的方法不包括基于血细胞形态信息从级分中分选出血细胞的附加过程,该附加过程在步骤c-1中的在单细胞水平上分离血细胞的过程中处理通过细胞分选获得的级分之前进行。
在该实施方案中,优选使用有限的处理时间以优选用于在单细胞水平上分离血细胞。在一个优选的方面,根据该实施方案的方法不包括上述用于在平面芯片上分散级分和通过荧光识别nrbc的方法。在一个优选方面,根据该实施方案的方法不包括从级分b中分选出血细胞的附加过程,该附加过程在步骤c-1中的在单细胞水平上分离血细胞的过程中处理通过细胞分选获得的级分之前进行。
以上描述并不排除观察部分或全部级分a或级分b并确认其中包含nrbc。例如,可以通过显微镜观察部分级分并通过基于形态信息或荧光的信息或基于其他特征的信息确认nrbc的存在来控制每个过程的质量。
图3显示了一种有限稀释方法。在该方法中,从级分b中任意地分选出级分f。也就是说,无论每个血细胞是否是nrbc,都将级分f分选出来。在该图中,级分f1至f3显示为级分f。对这些级分f1至f3进行拍照。级分f1含有在单细胞水平上分离的血细胞。级分f2含有两个血细胞。f3级分不含血细胞。通过使用级分f1至f3的图像来确认它们。作为结果,级分f1作为级分e获得。或者,可以通过图像分析确定是否已经获得级分e。级分f2可以返回到级分b。
在图3所示的有限稀释方法中,当通过使用照相机等来分配每个级分时,可以确定是否实际上已经分配了一个细胞。通过该方法,可以更可靠地在单细胞水平分离血细胞。此外,可以避免产生不含血细胞的级分。可从on-chipbiotechnologiesco.,ltd.获得的单细胞分配器“on-chipspis”可用于进行上述有限稀释方法。
此外,可以通过将级分b的血细胞分散在载玻片或芯片上然后逐个任意地分离这些血细胞来进行图1所示的步骤s24。也就是说,无论每个血细胞是否是nrbc,血细胞都被分离。此外,可以在步骤s23中进行细胞分选的同时进行步骤s24,即,步骤s24与步骤s23中的细胞分选并行地进行。也就是说,在细胞分选中,连续分选出非常少量的含有血细胞的流体。可以将这些流体分配到单独的容器中,而不将流体再次收集到一个容器中,以使得每个容器包含一个血细胞。
<c-2.通过dna提取获取级分c>
在图1和图2所示的步骤s25中,通过独立地进行用于提取每个分离的血细胞的染色体dna的过程来获得级分c。通过进行步骤s24和s25,每个级分c含有在单细胞水平上可区分的染色体dna。在该实施方案中,在单细胞水平上的染色体dna提取之前,含有能够追溯到血细胞的染色体dna的级分包括含有从单个血细胞中提取的染色体dna的级分。
如图2所示,优选任意地进行用于提取级分e1至e8的染色体dna的过程,该级分e1至e8含有分选到各个容器44中的血细胞。无论级分b中包含的每个血细胞是否具有nrbc的特征,都不加区别地进行提取过程。此外,无论每个级分e中包含的血细胞是否具有nrbc的特征,都不加区别地进行提取过程。也就是说,无论每个血细胞是否是nrbc,都进行提取过程。术语“任意地”不旨在基于血细胞的体积质量密度和其大小以及基于在直至获得级分b的过程中的血细胞标记来排除nrbc的浓缩。
作为提取过程的结果,级分c1、c2和c4至c8作为级分c获得。也就是说,nrbc41的染色体dna的提取不排除无核rbc42和wbc43的染色体dna的提取。此外,如在级分c3的情况下,可以存在通过进行用于提取不含血细胞的级分的染色体dna的化学过程所获得的级分。
dna提取过程独立地在单细胞水平上进行。因此,例如,来自nrbc41的染色体dna包含在级分c4和c7中。此外,其他细胞的染色体dna不在级分c4和c7中混合。如上所述,级分c4和c7中包含具有与从预先分离的nrbc获得的染色体dna相当的纯度的染色体dna。注意,关于这里提到的纯度,注意是否混合了母体来源的wbc的染色体dna。
如图2所示,对各个血细胞任意地进行染色体dna的提取。也就是说,无论每个血细胞是否是nrbc,都进行提取过程。作为结果,在来自无核rbc42的级分c1、c5和c8中不包含染色体dna。wbc的染色体dna包含在来自wbc43的级分c2和c6中。由于级分e3中没有血细胞,因此级分c3中不含染色体dna。
根据该实施方案的方法允许上述低效操作。通过如上所述任意地分离细胞和提取dna,可以在不依赖包括识别nrbc的分离操作的情况下获得nrbc的染色体dna。因此,改善了一系列过程的整体效率。
在该实施方案的步骤c中,应注意以下三点。第一点,对于实施该实施方案的人来说,可接受的是,来自nrbc的染色体dna包含在图2中所示的八个级分c中的级分c4和c7中这一事实在该步骤c中仍然是未知的。这是因为在根据本实施方案的方法中基于形态信息分离nrbc不是必需的。更具体地,这是因为级分c是如上所述任意获得的。
第二点,通过在后面描述的步骤d中进行分子生物学分析,以事后方式推定在图2中所示的级分c之一中获得来自nrbc的染色体dna。通常,在母体血液中混合的胎儿细胞是胎儿nrbc。因此,当发现染色体dna来源于胎儿时,进行上述推定。
第三点,对于实施该实施方案的人来说,可接受的是,图2中所示的级分c4和c7中包含的染色体dna是来自母亲的nrbc还是来自胎儿nrbc在步骤c中是未知的。这是因为在上述步骤中使用用于区分母亲的nrbc和胎儿nrbc的手段是非必需的。通过在后面描述的步骤d中进行分子生物学分析,以事后的方式发现染色体dna来源于胎儿的事实。
可以使用图4中所示的设备74来代替图2中所示的容器44。设备74包括通道75、捕获结构76和反应结构77。沿通道75连续布置多个捕获结构76。为各个捕获结构76提供反应结构77。
在图4所示的设备74中,细胞78分散在每个捕获结构76中,因此细胞78在单细胞水平上彼此分离。然而,由捕获结构76捕获的细胞78未被分选到特定容器中。在所有细胞78或所需数量的细胞78被捕获在捕获结构76中之后,捕获的细胞78被溶解,并且通过朝向反应结构77冲洗掉溶解的物质来处理细胞。在反应结构77中,可以进行染色体dna的提取和下面描述的用于全基因组扩增的反应作为对细胞的处理。
作为图4所示的设备74,可以使用专利文献9中公开的微流体装置。此外,作为微流体装置,可以使用可从fluidigmcorporation获得的c1单细胞自动准备阵列ifc。
[d.从级分c的组中选择级分d]
<d-1.通过dna分析选择级分d>
在图1和图2中所示的步骤s26中,对每个级分c进行分子生物学分析。通过这样做,从级分c的组中选择含有来自胎儿的染色体dna的级分d。如图2所示,除了母亲来源的染色体m的dna拷贝之外,级分d还含有父亲来源的染色体p的dna拷贝。当胎儿是男性时,y染色体与x染色体配对,但它们并非同源染色体。
图5示出了图1和2中所示的步骤s26的优选实例。在图5所示的步骤s28中,对级分c中的染色体dna进行全基因组扩增。作为全基因组扩增的方法,可以使用以malbac(多重退火环状循环扩增)、mda(多链置换扩增)和dop-pcr(简并寡核苷酸引发的pcr)为代表的pcr方法。其中,malbac是优选的,因为在基因组的整个区域上扩增的不均匀性很小。
通过全基因组扩增,染色体dna的拷贝大量包含在级分c中。除非另有说明,否则染色体dna的拷贝也称为染色体dna。
在图5所示的步骤s29中,进行分子生物学分析。以这种方式,区分每个级分c中的染色体dna是母体来源还是来自胎儿。在区分中,可以注意以下几点。
在该实施方案中,母体来源的染色体与母亲来源的染色体不同。母体来源的染色体完全来源于母体的体细胞。在母体来源的一对染色体的情况下,该成对的染色体都来自母体。
在该实施方案中,母亲来源的染色体是指源自母亲的生殖细胞的染色体。除非另有说明,否则母亲来源的染色体是指来自胎儿的染色体。这些母亲来源的染色体与父亲来源的染色体形成同源染色体。
当母体来源与母亲来源相同时,母亲来源染色体的dna序列与母体来源染色体的dna序列相同。注意,即使当胎儿来自源自除母亲以外的女性的卵子而不是源自母体的卵子时,也可以应用根据该实施方案的方法。
str(短串联重复)分析优选作为图5中所示的步骤s29中的分子生物学分析。str(短串联重复)分析使得可以区分父亲来源序列和母亲来源序列。来自胎儿的dna含有不是母亲来源的str。因此,无论胎儿的性别如何,都可以识别出染色体dna是来自胎儿的。
当已经确定胎儿是男性时,可以基于y染色体特异性序列进行分析。来自男性胎儿的dna含有不是来自母亲的y染色体。因此,可以识别出染色体dna是来自胎儿的。
在图5所示的步骤s30中,基于上述分子生物学分析的结果,检查哪些级分c来自胎儿。以这种方式,可以从级分c中选择级分d。
在图5所示的步骤s30中,无需进行确认,级分d毫无疑问地来自nrbc。在步骤s30中,血细胞的形态信息已经丢失。由于在步骤s23中nrbc的纯度增加,因此随机推测级分d源自nrbc。
通过图1至图5中所示的一系列过程,可以获得含有在单细胞水平分离的来自胎儿的nrbc的染色体dna的级分d。为了使用该染色体dna进行产前诊断,进行图6所示的处理。
注意,一般来说,术语“产前检测”和“产前诊断”可包括非最终检测。此外,通过该实施方案获得的染色体dna可用于最终诊断。这是因为在该实施方案中获得的用于测试的数据仅从胎儿细胞中的染色体dna获得。
dna样品中混合了母体细胞来源的染色体dna而产生的对仅使用来自胎儿的染色体dna所获得的数据的影响是极小的或是根本不产生影响。注意,这里提到的混合的存在与否并非指遗传原则,即胎儿的同源染色体的一半来自母亲而另一半来自父亲的原则。
认为根据该实施方案的方法比常规nipt,例如使用血浆中含有的dna片段的方法更适合于最终诊断。这是因为母体细胞来源的染色体dna和胎儿细胞来源的染色体dna在常规nipt中使用的dna样品中混合。
上述染色体dna和本实施方案中获得的数据可用于nipd(非侵入性产前诊断)。医生可以确定该实施方案中的染色体dna或数据是否用于非最终检测或最终诊断。关于基于染色体dna的诊断和由该实施方案获得的数据是否用作最终诊断的充分性取决于医学判断,并且不影响本发明的技术实质。
当分析dna时,必须将用于固定染色体dna的交联断开。也就是说,染色体dna是去交联的。通过这样做,可以有效地进行dna分析。此外,可以省略交联,从而防止dna在去交联反应中被破坏。
[e.获取用于诊断的数据]
<e-1.用染色体dna作为样品获取用于诊断的数据>
图6显示了获取用于诊断的数据的方法。在步骤s32中,分析上述级分d的染色体dna的部分或全部序列信息。可以通过使用测序来进行分析。可以对部分基因组或全基因组进行测序。测序可以是sanger测序或ngs(下一代测序)。
ngs可以是由f.hoffmann-larocheltd提供的任何焦磷酸测序;由illumina公司提供的合成测序;和由thermofisherscentificinc提供的连接和离子半导体测序。
在图6所示的步骤s32中,可以通过使用微阵列来进行序列信息的分析。微阵列可以是snp微阵列。在根据该实施方案的方法中,可以在不引起来自胎儿的染色体dna的整个长度上的拷贝数不均匀的情况下获得拷贝。因此,它适合于提供可靠的snp微阵列数据,这在mps(大规模并行测序)方法中难以获得。此外,微阵列可以是cgh阵列。
在图6所示的步骤s33中,根据序列信息的分析结果生成适合于医生诊断的数据。该数据可以包括部分或全部分析的原始数据。此外,可以在合理程序下创建适合于医学统计分析的数据。
[修改的实施例]
注意,本发明不限于上述实施方案,并且本发明可以在不脱离本发明的精神和范围的情况下适当地修改。上述实施方案是一种用于人类的方法。根据该实施方案的方法可以应用于除人以外的哺乳动物。
<溶血法>
在上述实施方案中,使用母体血液样品中血细胞的体积质量密度或大小从血细胞中除去至少一些无核红细胞。可以通过选择性地使母体血液样品中的血细胞溶血来选择性地去除无核rbc。以这种方式,溶血的无核rbc被排除在该级分中所有血细胞的范围之外。因此,可以获得浓缩了nrbc的级分a。溶血可以通过例如调节分散介质的渗透压来进行,在该分散介质中,通过使用氯化铵溶血剂使血细胞分散。
<通过平面芯片进行分选>
图7是在平面芯片上通过荧光进行分选的示意图。如上所述,在图1所示的步骤s23中通过细胞分选获得级分b。注意,可以额外使用作为用于辅助通过细胞分选进行分选的另一种分级方法,即使用平面芯片的分选方法。
首先,通过由如上所述的细胞分选来分选出级分a中的荧光标记血细胞,从而获得有核红细胞纯度增加的级分g。之后,级分g中的血细胞在图7所示的平面芯片61上铺展开。此外,从平面芯片61分选出发射对rbc和核酸具有特异性的标记信号的血细胞62。以这种方式,获得nrbc纯度从级分g进一步增加的级分b。
作为通过使用平面芯片的上述荧光分选装置,可以使用可从menarinisiliconbiosystems(专利文献10)获得的deparray和可从rarecyte,inc获得的cytefinder和cytepicker。
如上所述,根据该实施方案的方法不依赖于由使用平面芯片的分类装置做出的关于血细胞是否为nrbc的精确确定。注意,在一些情况下,可以通过使用上述装置通过统一处理来进行级分b的获取和级分c的获取。
[实施例1]
<收集血液>
图8示出了图1中所示的步骤s21的实施例。在步骤s35中,收集母体血液。在该实施例中,母体血液和普通血液是在合法程序下获得的。孕妇在怀孕第33周提供母体血液用于测试和研究。胎儿的性别是男性。本实施例中使用的普通血液是由未怀孕的人提供的,以用于测试和研究。在医疗机构(设施)收集母体血液和普通血液。这些血样在适当的管理下被运送到发明人等人的实验室。
一定量的必要母体血液被认为如下。通常,已知在10ml母体血液中含有约3×1010个血细胞。此外,已知在具有相同体积的母体血液中含有约36至2168个nrbc(非专利文献1)。
鉴于上述nrbc的比例,用作起始材料的母体血液的量可以是0.01ml至100ml。母体血液的量可以是0.01ml、0.02ml、0.03ml、0.04ml、0.05ml、0.06ml、0.07ml、0.08ml、0.09ml、0.1ml、0.2ml、0.3ml、0.4ml、0.5ml、0.6ml、0.7ml、0.8ml、0.9ml、1ml、2ml、3ml、4ml、5ml、6ml、7ml、8ml、9ml、10ml、11ml、12ml、13ml、14ml、15ml、16ml、17ml、18ml、19ml、20ml、30ml、40ml、50ml、60ml、70ml、80ml或90ml。在该实施例中,使用20ml母体血液作为起始材料。
根据全自动细胞计数器tc20(biorad)的测量,每10ml母体血液中含有3.16×1010个血细胞。用相同体积的pbs(磷酸盐缓冲盐水)稀释母体血液。
优选在血液收集后48小时或36小时内,更优选在24小时内,进一步优选在3小时内,特别优选在2小时内进行通过密度梯度离心法的后续浓缩过程。从收集血液到过程开始的时间越短,密度梯度离心法的浓缩效率就越高。在该实施例中,该过程在血液收集后两小时开始。此外,通过添加诸如凋亡抑制剂的防腐剂,可以防止浓缩效率由于时间的流逝而降低。
<浓缩nrbc>
通过图8中所示的步骤s36和s37,通过包括两个阶段的密度梯度离心法浓缩母体血液中的nrbc。注意,浓缩是指除去nrbc以外的血细胞。浓缩期间从母体血液中除去的血细胞优选是无核rbc。更优选地,血小板也在浓缩期间从母体血液中除去。
通过根据图8中所示的步骤s36和s37而进行的浓缩获得级分a。浓缩后,级分a中nrbc与所有血细胞的比高于母体血液样品中nrbc与所有血细胞的比。
在图8所示的步骤s36中,通过密度梯度分层离心法将母体血液分级。密度梯度分层离心法是一种密度梯度离心法。在该实施例中,通过使用percoll和盐水制备密度为1.085g/ml和1.075g/ml的等渗溶液。将它们接连放入离心管中后,10ml母体血液被进一步分层。在20℃下以1750g将离心管离心30分钟。
图9显示了密度梯度分层离心的结果的示意图。从离心管46的顶部开始,一层接一层地形成层45a至层45f。血浆浓缩在层45a中。wbc43浓缩在层45b中。据推测,层45a和层45b的密度小于1.075g/ml。层45c是密度为1.075g/ml的等渗溶液层。
nrbc41浓缩在图9中所示的层45d中。据推测,层45d的密度大于1.075g/ml且小于1.085g/ml。通过从层45d分选出血细胞并洗涤血细胞,来获得含有nrbc的级分。该级分称为样品1。通过使用全自动细胞计数器tc20测量样品1中的血细胞数。血细胞数为约9.95×106。
图9中所示的层45e是密度为1.085g/ml的等渗溶液层。无核rbc42浓缩在层45f中。据推测,层45f的密度大于1.085g/ml。
在图8所示的步骤s37中,在步骤s36中获得的级分可以是通过高渗离心来分级(专利文献1)。高渗离心是一种密度梯度离心法。接下来,将样品1的一半用作级分a,并进行下面的荧光标记步骤。
<荧光标记>
在图1所示的步骤s22中,对级分a中的血细胞进行荧光标记。优选地,荧光标记的血细胞与包括荧光标记的血细胞在内的其他血细胞分离。在该实施例中,荧光标记可以例如在以下条件下进行。
首先,用hoechst33342(由sigma-aldrich制造)、抗cd45-pe标记的抗体(由miltenyi-biotec制造,克隆名称:5b1)和抗cd235a-fitc标记的抗体(miltenyi-biotec,克隆名称:rea175)同时对级分a中的血细胞进行染色。在染色过程中未进行血细胞的交联/固定。染色在4℃下进行10分钟。染色后,通过在4℃下以300g将血细胞悬浮液离心10分钟来收集标记的血细胞。
注意,荧光标记的条件可以如下改变。例如,首先,可以用hoechst33342对级分a的血细胞进行染色。之后,可以用抗cd45-pe标记的抗体和抗cd235a-fitc标记的抗体对血细胞进行免疫染色。抗体-抗原反应可以在室温下进行,同时颠倒混合血细胞和抗体。之后,可以在血细胞悬浮液中加入磷酸盐缓冲盐水。通过这样做,可以降低添加的荧光抗体的浓度。之后,可以通过在25℃下以300g将血细胞悬浮液离心3分钟来收集血细胞。
抗体的浓度可以是附于抗体的文件中提到的抗体正常浓度的约1/100至1/10。以这种方式,可以改善细胞分选过程中的信噪比。在该实施例中,关于抗体的稀释,抗cd45-pe标记的抗体和缓冲溶液之间的体积比(即稀释比)是1:10。此外,抗cd235a-fitc标记的抗体和缓冲溶液之间的体积比(即稀释比)是1:1099。
在图1所示的步骤s23中,通过细胞分选进一步对级分a进行分级。作为细胞分选仪,使用图10的示意图中所示的细胞分选仪。该细胞分选仪用于检测血细胞的荧光。
首先,在图10所示的主通道47中产生包含荧光标记的级分a的稳定液体流。将激发光施加到液体流中的血细胞48a,并且基于荧光检测存在或不存在标记的信号。子通道49与主通道47相交。血细胞48a流向主通道47和子通道49之间的交叉点。
图10所示的血细胞48b是检测到信号的血细胞。该血细胞流经主通道47并进入交叉点。在子通道49中,可以在与液体流相交的方向上产生脉冲流。基于上述信号,以血细胞48b为其靶标产生脉冲流。
通过使图10所示的血细胞48b由脉冲流携带通过子通道49,血细胞48b从通过主通道47的液体流中分离。连续收集分离的血细胞48b。以这种方式,产生由所收集的血细胞48b构成的级分b。
在图10中,对于没有检测到信号或信号微弱的血细胞48c,不产生脉冲流。血细胞48c由液体流连续地携带并流过主通道47。
在专利文献7中描述了上述细胞分选仪的细节。此外,在该实施例中,使用可从on-chipbiotechnologiesco.,ltd获得的细胞分选仪(细胞分选仪模型:on-chip-sortms6)。在该实施例中,用于细胞分选的细胞分选仪的操作条件如下。
<通过细胞分选进行分析>
图11显示hoechst33342的荧光强度分布。纵轴表示血细胞出现的频率。横轴表示hoechst的荧光信号的强度。存在两个峰。在强度40和50之间观察到出现的最低频率。基于该范围定义边界值,并推测信号强度高于该边界值的血细胞是有核血细胞。此外,推测信号强度低于该边界值的血细胞是无核血细胞。
图12显示了母体血液中免疫标记的荧光强度分布。图13显示了普通血液中免疫标记的荧光强度分布。纵轴表示与抗cd235a抗体结合的fitc(异硫氰酸荧光素)的发光信号的强度。横轴表示与抗cd45抗体结合的pe(藻红蛋白)的发光信号的强度。
图12和13中的ar1代表其中cd235a-fitc信号强的一组细胞。ar2代表用cd45标记的一组wbc。
基于母体血液的结果与普通血液的结果之间的比较,发现母体血液中属于ar1组的血细胞的数量大于普通血液中属于ar1组的血细胞的数量。
在图12中,选择fitc(异硫氰酸荧光素)的发光信号强度高于1×103的ar1组中的细胞作为nrbc的候选物。该阈值是基于背景噪声的事实确定的,即在初步实验中wbc的fitc发光信号强度为1×103或低于1×103。基于上述条件的检查,通过细胞分选获得含有nrbc候选物的级分b。
<分子生物学分析>
通过使用nucleospintissuexs从整个级分b中提取dna。也可以首先在单细胞水平分离细胞然后提取dna。此外,还可以对从在单细胞水平上分离的细胞获得的dna进行全基因组扩增。例如,可以使用可从yikongenomics获得的malbac进行全基因组扩增。
在该实施例中,通过使用由dna提取获得的dna作为模板,用提取的dna进行pcr反应。在pcr反应中,使用ex-taq聚合酶。图14显示了分子生物学分析的结果。通过针对sry基因序列的pcr,图14中所示的电泳图像中的泳道1至11表示长度为270bp的扩增产物。模板如下。
在泳道1的左侧显示200bpdna梯状条带。
泳道1:人类男性标准dna,200个拷贝。
泳道2:人类女性标准dna,200个拷贝。
泳道3:人类男性标准dna,0个拷贝。
泳道4:人类男性标准dna,1个拷贝。
泳道5:人类男性标准dna,4个拷贝。
泳道6:人类男性标准dna,8个拷贝。
泳道7:人类男性标准dna,16个拷贝。
泳道8:人类男性标准dna,64个拷贝。
泳道9:人类男性标准dna,100个拷贝。
泳道10:样品1。
根据图14中所示的电泳图像,发现样品1含有具有4个至16个sry基因序列拷贝的dna。因此,发现样品1含有来自胎儿的染色体dna。
[实施例2]
在该实施例中,使用从怀孕第33周的孕妇采集的血液。胎儿的性别是男性。
<通过血细胞分离芯片浓缩母体血液>
在实施例2中,使用0.3ml母体血液,并通过使用血细胞分离芯片进行其浓缩过程。作为血细胞分离芯片,例如可以使用专利文献11中所示的血细胞分离芯片。血细胞分离芯片基于细胞的大小对母体样品中的血细胞进行分级。
图15显示了作为血细胞分离芯片的实施例的血细胞分离芯片50的平面图。血细胞分离芯片50包括入口51、主通道52、子通道53和出口54a至54d和55。主通道52包括从入口51朝向出口55连续布置的通道56a至56d。通道56a至56d从入口51朝向出口55一个接一个地连接。
图15中所示的入口51连接到含有母体血液的注射器57。母体血液以预定的流速从注射器57送到入口51。母体血液通过入口51进入通道56a。血液开始浓缩时,母体血液的采集已经过了两到三个小时。
优选预先稀释母体血液。稀释比可以是2至500。在该实施例中,稀释比为50。用磷酸盐缓冲盐水稀释母体血液。经稀释的母体血液的每单位时间的流速可以是1μl/分钟至1000μl/分钟。在该实施例中,流速为25μl/分钟。使用血细胞分离芯片进行持续十小时的分级。例如,可以在一个分级过程中处理15ml经稀释的母体血液。
图15中所示的血细胞分离芯片50包括子通道53。子通道53连接到注射器58。注射器58含有pbs。通过对注射器58施加压力,pbs流过子通道53进入通道56b。
图15中所示的每个分支通道59a至59d是从主通道52分支出的通道。在通道56c中,分支通道59a、59b、59c和59d从上游侧一个接一个地依次从主通道52分支出来。
图15中所示的每个分支通道59a至59d包括从主通道52分支出的多个窄通道。这些窄通道组沿主通道52的上游到下游设置。分支通道59a至59d分别延伸到出口54a至54d。每个分支通道59a至59d的窄通道分别紧接在出口54a至54d之前连接在一起。通道56d延伸到出口55。
图16示意性地示出了通过使用血细胞分离芯片50对血细胞进行分级的过程。如图15所示,每个分支通道59a至59d包括多个窄通道。在图16中,对于每个分支通道59a至59d,仅示出了一个窄通道以简化说明。
母体血液从图16中所示的主通道52的上游侧流动。母体血液含有大量血细胞。血细胞到达通道56b。同时,从子通道53流出的pbs推动血细胞从主通道52的一侧流过主通道52。在通道56b和56c中,血细胞被推向分支通道59a至59d的一侧。
在图16所示的通道56a中,分支通道59a至59d布置在主通道52的与设置子通道53的一侧相反的一侧上。分支通道59a至59d的窄通道的内径根据它们在布置中的位置而增加。注意,窄通道的内径是窄通道的正交截面上的内切圆的直径。在该实施例中,分支通道59a至59d的窄通道的内径分别为8μm、12μm、15μm和25μm。在该实施例中,窄通道的横截面具有正方形形状。窄通道的横截面可以具有其他多边形形状或圆形形状。
在图15和图16中所示的血细胞分离芯片50中,提供了四个分支通道。只要分支通道的数量不小于2,对该数量没有特别限制。例如,可以提供至少两个分支通道。在两个分支通道中,设置在上游侧的窄通道的内径可以是12μm至19μm。上游侧的窄通道的内径可以是13μm、14μm、15μm、16μm、17μm和18μm中的任何一个。本实施例的分支通道59c对应于该窄通道。分支通道59c可以被视为用于去除无核rbc的通道。
同时,设置在下游侧的窄通道的内径可以是20μm至30μm。设置在下游侧的窄通道的内径可以是21μm、22μm、23μm、24μm、25μm、26μm、27μm、28μm、29μm和29μm中的任何一个。本实施例的分支通道59d对应于该窄通道。分支通道59d可以被视为用于收集nrbc的通道。
由子通道53推动的血细胞流入图16所示的分支通道59a至59d。流入每个分支通道的血细胞的直径略小于该分支通道的窄通道的内径。在图中,颗粒体39显示为略小于分支通道59a的窄通道内径的血细胞。颗粒体39到达出口54a。在图中,无核rbc42显示为略小于分支通道59b和59c的窄通道内径的血细胞。无核rbc42到达出口54b和54c。
认为nrbc的直径为11μm至13μm。在图中,nrbc41显示为略小于分支通道59d的窄通道内径的血细胞。此外,示出了wbc43。nrbc41和wbc43到达出口54d。
未进入图16所示的分支通道59a至59d的血细胞与血浆一起作为通流(ft)穿过通道56d,并到达图15所示的出口55。例如,聚集的血细胞等包括在通流中。用于接收流体的储库设置在每个出口54a至54d和出口55中。
将级分fr1至fr4分别分选到连接出口54a至54d的各个储库中,如图16所示。将通流作为级分fr5分选到连接图15中所示的出口55的储库中。通过上述过程,可以通过血细胞分离芯片50基于血细胞的大小对血细胞进行分级。此外,由于血细胞分离芯片用作筛子,因此级分fr1至fr4不包含任何大于各个窄通道直径的颗粒。因此,可以防止聚集的血细胞在级分fr4中混合。
使用血细胞大小的浓缩方法优于使用体积质量密度的方法。其中一个优点是,血液收集后时间的流逝对血细胞的体积质量密度的影响很大,而时间的流逝对血细胞大小的影响很小。这是指即使当收集血液的地方远离对血细胞进行分级的地方时,也可以容易地进行根据该实施例的方法。另一个优点是,例如,如上述血细胞分离芯片的操作所示,可以通过简单的操作进行基于大小的分级。
<实际的分级>
表1显示了使用上述血细胞分离芯片对15ml经稀释的母体血液进行分级的结果。母体血液含有300μl母体全血。推测母体全血中含有1.43×109个血细胞。通过使用全自动细胞计数器tc20进行测量。表1显示了通过分支通道1和2的级分以及通流3的血细胞数。
[表1]
表1中所示的级分fr4中的血细胞数为3.29×107。考虑到密度梯度分层离心的结果,认为该级分含有对应于nrbc和wbc的血细胞。将级分fr4用作上述级分a并通过细胞分选对其进行分析。
在实施例1的密度梯度离心法中,必需收集漂浮在离心管中的级分。与此相反,在使用血细胞分离芯片的该实施例中,可以通过血细胞分离芯片本身分选出级分a。因此,可以简化浓缩操作以获得级分a。
<通过细胞分选对级分b进行分选>
以与实施例1类似的方式分选出级分b。首先,用hoechst33342和pe标记的抗cd45抗体对级分a进行染色。在不进行包括交联/固定细胞在内的固定过程的情况下进行染色。接下来,使用fitc标记的抗cd235a抗体进行染色。以与实施例1类似的方式优化抗体浓度。
然后,通过可从on-chipbiotechnologiesco.,ltd获得的细胞分选仪分选出出级分fr4的3.29×107个血细胞。分选出对hoechst33342和cd235a呈阳性且对cd45呈阴性的血细胞。可以通过使用cd45抗体珠的亲和纯化进行免疫学去除来选择对cd45呈阴性的血细胞。通过上述过程,获得含有661个血细胞的级分b。
<单细胞水平的分离>
图17显示了如上所述进行染色的血细胞。如图所示,防止了聚集体的形成。因此,已经显示出血细胞可以在单细胞水平上彼此分离。认为该实施例中防止了聚集是因为优化了用于对血细胞进行染色的抗体的浓度。
<染色体dna的提取>
将上述级分b分成三个级分,每个级分含有200个血细胞。预期这些级分中的每一种都含有一种或两种来自胎儿的nrbc。
从每个级分中提取染色体dna。通过malbac(多重退火环状循环扩增)方法对染色体dna进行全基因组扩增。通过这样做,扩增了来自胎儿的y染色体,从而可以在后续过程中容易地检测sry基因。使用扩增的染色体dna作为模板,进行对sry基因序列特异的pcr扩增。图18显示了sry基因的pcr产物的电泳图像。模板如下。
在泳道1的左侧显示200bpdna梯状条带。
泳道1:蒸馏水。
泳道2:人类男性标准dna,20ng。
泳道3:人类女性标准dna,20ng。
泳道4:malbac方法的扩增产物1,450ng。
泳道5:malbac方法的扩增产物2,610ng。
泳道6:malbac方法的扩增产物3,700ng。
在泳道4中观察到sry条带,在该条带中以扩增产物1作为模板进行pcr。在使用其他扩增产物作为模板的pcr中未观察到sry条带。根据上述内容,已经发现可以将级分b分级并由此将级分b分成含有来自胎儿的血细胞的级分和不含来自胎儿的血细胞的级分。此外,已经表明,通过在单细胞水平进行有限稀释,可以识别在单细胞水平上分离的血细胞中存在或不存在sry基因。
基于上述新发现,认为本领域技术人员可以容易地理解,可以获得在单细胞水平上可区分并且来自胎儿的染色体dna。也就是说,虽然在该实施例中获得了三个级分,每个级分包含200个血细胞,但是在其他方法中,通过有限稀释法将级分b分成每个级分包含600个血细胞的多个级分,可以在单细胞水平上分离血细胞。上述分级可以任意地进行,或者可以在确认每个获得的小级分含有一个细胞的同时进行。此外,可以在单细胞水平对含有血细胞的这些小级分进行特定dna提取过程和扩增过程。
一般来说,对应于一个细胞的染色体dna只有一个基因或等位基因的拷贝,该拷贝来自每一个亲本的配子。然而,包括malbac方法的全基因组扩增方法可以通过将对应于一个细胞的染色体dna用作模板来扩增这种dna序列的一个拷贝。扩增的dna可适用于获得产前检测或产前诊断所需的分子生物学数据。
[参考例:挑选方法]
专利文献4公开了所谓的挑选方法。在所述挑选方法中,在载玻片上观察由may-giemsa染色剂染色的血细胞,并基于它们的形态分离nrbc。在该方法中,在单细胞水平上分离nrbc。因此,可以获得不含白细胞的级分。因此,从这种级分获得的胎儿细胞来源的染色体dna的纯度非常高。关于这里提到的纯度,注意是否存在母体来源的细胞的染色体dna的混合。
然而,在专利文献4中,提到通过形态学观察最可能被识别为nrbc的五个细胞中的任何一个,即排在最前的五个细胞中的任何一个不是来自胎儿的nrbc(第0078段)。在专利文献4中,没有选择,但对排在第二高位置的五个细胞进行了分子生物学分析,并且从它们获得了一个来自胎儿的细胞(第0079段)。
不用说,当进行产前诊断时,可以从对象收集的母体血液样品的量是有限的。此外,产科上明显地,只有在有限的一段时间内可以对每个孕妇,即每个诊断对象进行产前诊断。此外,血液中来自胎儿的nrbc的数量非常少。因此,需要一种能够在有限时间内检测全部样品量的方法。换句话说,不需要在发现获取来自胎儿的细胞失败时,再次重复获取过程的前提下执行的方法。
基于形态学观察的方法是可靠的,因为可以可靠地收集nrbc。然而,作为高可靠性的成本,可以在一定时间段内获得来自胎儿的nrbc的合理预期会受到损害。
此外,由于母体来源的nrbc也包含在母体血液中,因此通过形态学观察很难分选出来自胎儿的nrbc。需要通过分子生物学分析来证实基于形态学信息对来自胎儿的nrbc候选物的分选。
此外,在本发明的研究过程中,发明人发现,在挑选方法中,操作者需要具有足够的技能将识别的nrbc从制剂输送到容器。同时,发明人还发现,在如上述实施方案和实施例的情况下血细胞充分浓缩的状态下,即使在单细胞水平上通过任意的分子生物学分析,也有可能获得来自胎儿的nrbc的染色体dna。
基于上述发现,在上述实施方案和实施例中没有优先考虑nrbc的分离。相反,优先考虑来自胎儿的染色体dna的收集,其最终可以在单细胞水平上区分开。已经发现,为了实现上述优先目标,首先通过有限稀释方法等进行无差别分级,然后进行任意的分子生物学分析是更有效的。
为了进行任意的分子生物学分析,有必要制备nrbc被浓缩为水平高于依赖于形态学信息的方法中所用级分的水平的级分。换句话说,有必要从该级分中充分除去其他血细胞。否则,应该进行分子生物学处理的血细胞数量变得巨大,从而使得该级分不适合于单细胞水平的分子生物学分析。因此,通过组合基于体积质量密度或大小的浓缩与通过细胞分选的浓缩来实现高水平的nrbc的浓缩。
<<第二实施方案>>
与<<第一实施方案>>类似,在下述第二实施方案及其实施例中获得在单细胞水平分离的来自胎儿的nrbc的染色体dna。主要在下文中描述与<<第一实施方案>>的差异。在以下描述中省略但对于第二实施方案是必需的技术事项与<<第一实施方案>>中描述的那些相同。
[收集血液和nrbc]
收集血液和目标nrbc的细节与<<第一实施方案>>中描述的相同。
[a.对级分a进行标记]
<a-1.通过浓缩获得级分a>
如<<第一实施方案>>中所述的,通过浓缩获得级分a。
<a-2.级分a的标记>
在图1所示的步骤s22中,对级分a中的wbc和细胞核进行特异性标记。标记(标记物)可以是磁性标记或荧光标记,但优选荧光标记。标记可以是直接标记或间接标记。间接标记可以是由标签和二抗进行的标记,或者可以是通过生物素-抗生物素蛋白结合进行的标记。
对wbc具有特异性的标记可以对wbc表面进行特异性标记。对wbc具有特异性的标记可以是免疫标记。免疫标记可以是由抗体进行的标记。免疫标记的靶抗原可以是糖类抗原。标记可以是由针对wbc的特异性抗原例如cd45的抗体进行的标记。
nrbc中包含的细胞核通过对核酸具有特异性的标记进行特异性标记。对核酸具有特异性的标记可以是染料标记。待标记的核酸优选为dna。染料可以是荧光染料。核可以通过荧光染料进行荧光标记。荧光染料可以是hoechst33342。对细胞核具有特异性的标记可以是免疫标记。
在图1所示的步骤s22中,可以同时进行针对wbc特异性标记和针对细胞核特异性标记。或者,可以在一个标记过程之前进行另一标记。此外,可以在一个标记过程之前进行另一标记,且也可以在一个标记过程之前进行步骤s23中的分选。之后,可以进行其他标记和分选。
注意,可以在进行一个或所有上述标记过程之前对级分a中的血细胞进行组织学交联固定。此外,可以在该状态下通过细胞分选进行下述分级。通过交联/固定血细胞可以防止血细胞聚集。因此,可以通过细胞分选精确地进行分级。可以在后面描述的步骤d中所进行分子生物学分析之前对提取的dna进行去交联。
可以在不对级分a中的血细胞进行组织学交联/固定的情况下进行以下描述的分级,即通过细胞分选进行分级。以这种方式,可以使由后面描述的步骤d中所进行的分子生物学分析中的交联/固定引起的影响最小化。
例如,可以在不进行血细胞的交联/固定的情况下同时进行针对细胞核的特异性标记和针对wbc的特异性标记。此外,在进行这些标记过程之后,可以交联/固定血细胞。此外,可以对交联/固定的血细胞进行针对rbc的特异性免疫标记。
[b.通过细胞分选获取级分b]
<b-1.基础细胞的选择>
在步骤s23中,通过细胞分选从级分a中分选出经标记的血细胞来获得级分b。细胞分选的原理和细胞分选仪的类型与<<第一实施方案>>中描述的相同。
在图1中所示的步骤s23中,优选对血细胞进行分选,以便去除已经用wbc特异性标记物进行标记的血细胞。由于nrbc是rbc,因此可以通过对wbc具有特异性的标记将nrbc与wbc区分开。
在图1所示的步骤s23中,优选地分选出血细胞,从而获得已经用有核血细胞特异性标记物进行标记的血细胞。由于nrbc具有细胞核,因此通过对细胞核具有特异性的标记可以将nrbc与无核rbc区分开。
在图1所示的步骤s23中,通过组合上述标记过程获得具有提高的nrbc纯度的级分b。所获得的级分b包括母体来源的nrbc和来自胎儿的nrbc。通过对wbc具有特异性的标记去除wbc和通过对细胞核具有特异性的标记来收集有核血细胞可以同时进行。或者,可以在去除和收集中的一个之前进行另一个过程。例如,可以通过首先通过对wbc具有特异性的磁性标记去除wbc,然后通过使用对细胞核具有特异性的荧光标记进行分选来获得级分b。
在图1所示的步骤s22中,可以以另外的方式特异性标记级分a中的rbc。对rbc具有特异性的标记可以是免疫标记。该标记可以标记rbc特异性抗原,例如cd71和cd235a。抗原可以是糖类抗原。在步骤s23中,优选对血细胞进行分选,以便收集已经用rbc特异性标记物进行标记的血细胞。
<b-2.附加的细胞选择>
可以进行附加的选择选择。用于附加的细胞选择的方法可以类似于<<第一实施方案>>中描述的方法。
[c.血细胞分离与核酸提取]
在步骤c中,在单细胞水平上分离级分b中的每个血细胞。此外,对于每个分离的血细胞独立地进行提取核酸的方法。以这种方式,获得各自含有在单细胞水平可区分的核酸的级分c。核酸可以是dna或rna。此外,除了获得dna级分之外,还可以从已经获得dna级分的单个细胞中提取rna级分。dna可以是染色体dna。在该实施例中,染色体dna是指基因组dna。rna可以是mrna或非编码rna。mrna和非编码rna可以是全长序列或部分序列。
如<<第一实施方案>>中所述进行"c-1.在单细胞水平上分离血细胞"。有限稀释方法优选用于在单细胞水平上分离血细胞。作为一种有限稀释方法,可以通过使用排出含有颗粒物质的液滴的设备在单细胞水平分离血细胞。
作为使用排出设备进行有限稀释的实施例,专利文献13公开了一种使用排出设备的方法。该排出设备通过使用诸如压电装置的致动器朝向目标容器排出具有确定体积的液滴,使得液滴包含一个血细胞。注意,排出设备通过首先为每个血细胞选择多个容器中的一个,然后朝向所选容器排出液滴来在单细胞水平上分离血细胞。
在单细胞水平上分离血细胞后,获得级分c。当从胎儿细胞获得的核酸是染色体dna时,如<<第一实施方案>>中所述进行"c-2.通过dna提取获得级分c"。当rna包含在从胎儿细胞获得的核酸中时,如下地进行"c-3.通过rna提取获得级分c"。如上所述,可以同时进行从血细胞中提取rna和从血细胞中提取染色体dna。
<c-3.通过rna提取获得级分c>
图19示意性地显示了在单细胞水平的分离和rna提取。在进行图1所示的步骤s24之后,在不进行步骤s25的情况下提取rna,如图19所示。在步骤s65中,通过独立地进行用于提取每个分离的血细胞的rna的过程来获得级分c。通过进行步骤s24和s65,每个级分c含有在单细胞水平上可区分的rna。在该实施方案中,在单细胞水平的染色体rna提取之前,含有能够追溯到血细胞的rna的级分包括含有从单个血细胞中提取的rna的级分。
如图2所示,优选任意地进行用于提取级分e1至e8的rna的过程,该级分e1至e8含有分选到各个容器44中的血细胞。无论级分b中包含的每个血细胞是否具有nrbc的特征,都任意地进行提取过程。此外,无论每个级分e中包含的血细胞是否具有nrbc的特征,都任意地进行提取过程。也就是说,无论每个血细胞是否是nrbc,都进行提取过程。术语“任意地”不旨在基于血细胞的体积质量密度和其大小以及基于在直至获得级分b的过程中的血细胞标记来排除nrbc的浓缩。
作为提取过程的结果,级分c11、c12和c14至c18被作为级分c获得。也就是说,来自nrbc41的rna的提取不排除来自无核rbc42和wbc43的染色体rna的提取。此外,如在级分c13的情况下,可以存在通过进行用于提取不含血细胞的级分的rna的化学过程所获得的级分。
在单细胞水平上独立地进行rna提取过程。因此,例如来自nrbc41的rna包含在级分c14和c17中。此外,其他细胞的rna不在级分c14和c17中混合。如上所述,具有与从预先分离的nrbc获得的rna相当的纯度的rna包含在级分c14和c17中。注意,关于这里提到的纯度,注意是否混合了母体来源的wbc和rbc的rna。
如图2所示,对各个血细胞任意地进行rna的提取。也就是说,无论每个血细胞是否是nrbc,都进行提取过程。作为结果,无核rbc的rna包含在来自无核rbc42的级分c11、c15和c18中。wbc的rna包含在来自wbc43的级分c12和c16中。由于级分e3中没有血细胞,因此级分c13中不含rna。
根据该实施方案的方法允许上述低效操作。通过如上所述任意地分离细胞和提取rna,可以在不依赖包括识别nrbc的分离操作的情况下获得nrbc的rna。因此,改善了一系列过程的整体效率。
在该实施方案的步骤c中,应注意以下三点。第一点,对于实施该实施方案的人来说,可接受的是,来自nrbc的rna包含在图2中所示的八个级分c中的级分c14和c17中这一事实在该步骤c中仍然是未知的。这是因为在根据本实施方案的方法中基于形态信息分离nrbc不是必需的。更具体地,这是因为级分c是如上所述任意获得的。
第二点,通过在后面描述的步骤d中进行分子生物学分析,以事后方式推定在图2中所示的级分c之一中获得来自nrbc的rna。通常,在母体血液中混合的胎儿细胞是胎儿nrbc。因此,当发现rna来源于胎儿时,进行上述推定。
第三点,对于实施该实施方案的人来说,可接受的是,图2中所示的级分c14和c17中包含的rna是来自母亲的nrbc还是来自胎儿nrbc在步骤c中是未知的。这是因为在上述步骤中使用用于区分母亲的nrbc和胎儿nrbc的手段是非必需的。通过在后面描述的步骤d中进行分子生物学分析,以事后的方式发现rna来源于胎儿的事实。
可以使用图4中所示的设备74来代替图2中所示的容器44。设备74包括通道75、捕获结构76和反应结构77。沿通道75连续布置多个捕获结构76。为各个捕获结构76提供反应结构77。
在图4所示的设备74中,细胞78分散在每个捕获结构76中,因此细胞78在单细胞水平上彼此分离。然而,由捕获结构76捕获的细胞78未被分选到特定容器中。在所有细胞78或所需数量的细胞78被捕获在捕获结构76中之后,捕获的细胞78被溶解,并且通过朝向反应结构77冲洗掉溶解的物质来处理细胞。在反应结构77中,可以进行rna的提取和下面描述的用于cdna扩增的反应作为对细胞的处理。
作为图4所示的设备74,可以使用专利文献9中公开的微流体装置。此外,作为微流体装置,可以使用可从fluidigmcorporation获得的c1单细胞自动准备阵列ifc。
rna的提取和染色体dna的提取可以同时进行,如后面<d-3.染色体dna和rna同时提取和分析补充说明>中所述。
[d.通过核酸分析选择级分d]
当从胎儿细胞获得的核酸是染色体dna时,如<<第一实施方案>>中所述进行"d-1.通过dna分析选择组分d"。如图5中的步骤s28所示,例如可以对级分c中的染色体dna进行全基因组扩增。代替提取整个基因组,可以扩增基因组中的部分区域。之后,如<<第一实施方案>>中所述,在步骤s29中进行分子生物学分析,并且在步骤s30中选择级分d。
当从胎儿细胞获得的核酸是rna时,如下地进行"d-2.通过rna分析选择级分d"。
<d-2.通过rna分析选择级分d>
在图19所示的步骤s66中,对每个级分c进行分子生物学分析。通过这样做,从级分c的组中选择含有来自胎儿的rna或衍生自来自胎儿rna的cdna的级分d。
图20显示了图19中所示的步骤s66的优选实施例。在图20所示的步骤s68中,通过将级分c中的rna用作模板进行逆转录。通过逆转录,级分c变成含有cdna的级分,该cdna具有大量与rna的序列互补的序列。在下文中,由于逆转录而含有cdna的级分也称为级分c。级分c中的rna可以在逆转录后被消化。
在图5所示的步骤s29中,进行分子生物学分析。以这种方式,区分每个级分c中的rna是母体来源还是来自胎儿。在区分中,可以注意以下几点。
在该实施方案中,母体来源的rna与转录自母亲来源的基因组的rna不同。母体来源的rna完全来源于母体的体细胞。
在该实施方案中,转录自母亲来源的基因组的rna是指衍生自胎儿遗传自母亲的染色体的转录产物。除非另有说明,否则转录自母亲来源的基因组的rna是指衍生自胎儿的rna。这种rna可以处于这样的状态,其中rna与衍生自胎儿遗传自父亲的染色体的rna的混合。
当母体与母亲相同时,转录自母亲来源的基因组的rna序列与母体来源的rna序列相同。注意,即使当胎儿来自除母亲以外的女性的卵子而不是源自母亲的卵子时,也可以应用根据该实施方案的方法。
作为图20所示的步骤s69中的分子生物学分析,优选基于与β珠蛋白基因相关的胚胎ε珠蛋白基因的方法(非专利文献2)。由于胚胎ε珠蛋白基因特异性表达于胚胎,因此胎儿细胞和母体细胞(wbc和其他有核血细胞)可以基于ε珠蛋白基因的转录产物的表达水平彼此区分。
当已经确定胎儿是男性时,可以基于y染色体特异性序列进行分析。衍生自男性胎儿的rna含有衍生自y染色体的序列,该序列作为并非衍生自母亲基因组的序列。因此,可以识别rna来自胎儿。
在图20所示的步骤s70中,基于上述分子生物学分析的结果,检查哪些级分c来自胎儿。以这种方式,可以从级分c中选择级分d。注意,由于进行了逆转录,级分c含有cdna。获得的级分d含有cdna。
在图20所示的步骤s70中,无需进行确认,级分d毫无疑问地来自nrbc。在步骤s70中,血细胞的形态信息已经丢失。由于在步骤s23中nrbc的纯度增加,因此随机推测得到来自nrbc的级分d。
通过图1、图19和图20中所示的一系列过程,可以获得含有cdna的级分d,该cdna通过使用衍生自在单细胞水平上分离的来自胎儿的nrbc的rna作为模板合成。
当进行逆转录时,必须使步骤b中用于固定的交联断开。也就是说,rna被去交联。通过这样做,可以有效地进行逆转录和dna分析。此外,可以省略交联,从而防止rna在去交联反应中被破坏。
<d-3.关于同时提取和分析染色体dna和rna的补充说明>
图21显示了染色体dna和rna的同时提取。优选通过进行步骤s65中所示的rna的提取和步骤s25中所示的染色体dna的提取来同时获得级分w。在这种情况下,通过步骤s66中所示的rna分析来选择级分d,而不是通过染色体dna分析来选择级分d。以这种方式,可以在不进行染色体dna分析的情况下获得在单细胞水平上分离的来自胎儿细胞的染色体dna。
基于图21中所示的选择包含rna的级分d的结果,如步骤s72中所示,从对应于级分w组的级分w1至w8中选择级分w4作为级分z。与级分c14类似,级分w4来自级分e4。因此,基于级分d选择的结果,已经发现级分w4来自胎儿细胞。在实际操作中,必需将级分w1至w8分别与级分c11至c18相关联。优选地,通过使用识别符来进行关联。在通过rna分析选择级分d之后,可以从级分z中包含的染色体dna获得用于稍后描述的诊断的数据。
预计从单个细胞获得的rna拷贝数大于染色体dna拷贝数。基于rna识别胎儿细胞比基于染色体dna识别胎儿细胞更有效。
用于同时提取rna和dna并分析序列的优选方法的实施例包括非专利文献3中公开的g&t测序(基因组和转录组测序)方法。在g&t测序方法中,从单个细胞中提取染色体dna和全长mrna。在该方法中,首先溶解经分离的单个细胞。接下来,通过使用用于溶解的物质的生物素化寡聚dt捕获引物来捕获rna。此外,通过使用包被有链霉亲和素的磁珠将dna与溶解的物质分离。通过使用smart-seq2方法来扩增捕获的rna。同时,使用mda方法来扩增dna。
在同时获得rna和染色体dna的方法中,例如g&t测序方法中,将染色体dna和rna储存在不同的容器中。这些容器需要附有上述识别符,以便将这些容器与染色体dna和rna相关联。
此外,通过根据图21所示的方法选择含有rna的多个级分d,可以收集与级分d相同数量的含有染色体dna的级分z。此外,将级分z彼此混合。以这种方式,可以以大规模状态而不是在单细胞水平上扩增染色体dna。换句话说,dna的扩增可以在用作模板的染色体dna的拷贝数大于1的状态下开始。如上述实施方案中所述,可以对扩增的染色体dna进行分析。尽管如上所述它们可以在整体状态下进行分析,但是混合母体来源的dna的风险非常小。这是因为级分z来自胎儿细胞的事实是以单细胞水平的精确度确定的。在多个级分z彼此混合之后,染色体dna不一定必须被扩增。可能扩增来自一个级分z的染色体dna。
[e.获取用于诊断的数据]
当级分d含有染色体dna时,如<<第一实施方案>>中所述进行“e-1.基于染色体dna获取用于诊断的数据”。也可以以类似方式从含有染色体dna的级分z获得数据。
当级分d含有rna时,rna样品可用于胎儿诊断技术的研究,包括产前基因检测。
[修改的实施例]
可以如<<第一实施方案>>中所描述的那样修改实施例。
[实施例3]
与前一实施例类似,实施例3中待获得的核酸是染色体dna。此外,在细胞分选中不进行通过对rbc具有特异性的标记的选择。除非另有说明,否则以与实施例2类似的方式进行以下过程。
使用从怀孕第24周的孕妇采集的血液。胎儿的性别是男性。与实施例1和2类似,实验中的操作由女性实验者进行。这是为了防止男性实验者所拥有的sry基因序列的污染。
<通过血细胞分离芯片浓缩母体血液>
在该实施例中,使用约8ml母体血液。将血液稀释至5倍。通过使用具有微通道结构的芯片进行其浓缩过程,该微通道结构具有与实施例2中所述的血细胞分离芯片(微通道结构)相同的功能。
与实施例2中使用的芯片中的微通道结构不同,实施例3中使用的芯片的微通道结构仅包括对应于级分fr3(通道直径15μm)、级分fr4(通道直径25μm)和级分fr5(ft,通流)的通道。因此,在级分fr3中收集包括无核rbc的相对小的血细胞。通过如上所述的通过级分fr3除去无核rbc,获得其中浓缩了nrbc的级分a。
由于芯片中微通道结构的处理能力有限,因此将样品分成多个批次,并且每个批次由单独的微通道结构处理。对于在该过程之后仍然呈红色的批次,其被认为是由于经处理的样品中存在无核rbc,因此再次进行使用血细胞分离芯片的过程。从第一次处理后不再呈红色的批次中,总共获得6.8×106个血细胞(在该实施例中称为级分a1)。从处理两次的批次中,总共获得2.74×106个血细胞(在该实施例中称为级分a2)。通过使用部分级分a1和整个级分a2进行细胞分选。
<通过细胞分选对级分b进行分选>
如下进行含有母体来源的nrbc和来自胎儿的nrbc的级分b的分级。用hoechst33342和抗cd45抗体对级分a进行染色。选择对hoechst33342呈阳性和对cd45呈阴性(wbc)的血细胞。通过重复细胞分选,对级分a1中的血细胞进行两次细胞分选。对于级分a2中的血细胞仅进行一次细胞分选。总共获得含有300个血细胞的级分b。
<在单细胞水平上分离并提取染色体dna>
从级分b中,如下获得16个级分c。首先,从级分b中,以0.5个细胞/孔的预期量将血细胞分配到pcr管(孔)中。在该实施例中,一个分配体积为0.7μm。通过使用连续自动分配器(eppendorfag制造的autopipettor)进行分配。通过从每个孔中的血细胞中提取染色体dna来获得级分c。
通过malbac(多重退火环状循环扩增)方法对级分c中的染色体dna进行全基因组扩增。使用扩增的染色体dna作为模板,进行对sry基因序列特异的pcr扩增。此外,还进行了对gapdh基因序列特异的pcr扩增。由于gapdh基因存在于常染色体中,因此也将母体细胞的染色体dna用作gapdh的模板。图22显示pcr产物的电泳图像。模板和标记如下。
阴性:可商购获得的女性来源的人类基因组dna(阴性对照)
阳性:可商购获得的男性来源的人类基因组dna(阳性对照)
标记:dna梯状条带
泳道1至16:malbac方法的扩增产物
如图22所示,在泳道1至7、10至12、15和16中观察到gapdh的扩增。电泳图像表明,源自有核血细胞的染色体dna分布在这些级分c中。所有泳道即16个泳道的成功率为75%。在泳道9和13中,观察到迁移率与其他泳道不同的条带。尽管这些条带被认为是衍生自malbac方法的扩增产物,但不知道它们具有何种序列。
如图22所示,在泳道3、6、11和16中观察到sry的扩增。这表明来自胎儿血细胞的染色体dna被分配到级分c中。因此,已经发现,泳道3、6和11中所示的级分c可以选择作为级分d。如上所述,已经显示出,可以通过根据该实施例的方法获得在单细胞水平上可区分且来自胎儿的染色体dna。
<关于直至获取组分b的过程中的浓缩效率>
无论级分b中的每个血细胞是否具有nrbc的特征,通过有限稀释方法在单细胞水平上任意地分离b细胞中的血细胞。也就是说,无论每个血细胞是否是nrbc,均分离血细胞。因此,认为每个泳道中所示的上述结果反映了级分b中每种血细胞的组成比。
从对应于16个泳道的16个级分c中获得四个级分d。因此,在一个方面,预计从级分b中的每100个血细胞中获得25个胎儿nrbc。
从对应于扩增了gapdh的12个泳道的11个级分c中获得四个级分d。因此,在一个方面,预计从级分b中的全部每100个血细胞中获得33个胎儿nrbc。
如上所述,已经预计级分b中胎儿nrbc与所有血细胞的比率为至少25%或高于25%且最大为33%,即该比率处于高水平。认为该实施例中的浓缩效率高于其他方法。
此外,在直至获得上述实施例中所示的级分b的过程中,使用血细胞分离芯片去除无核rbc和通过细胞分选去除wbc。在这些过程中胎儿细胞的浓缩效率很高。根据本发明的一个方面是一种用于浓缩来自胎儿的rbc的方法,包括通过使用血细胞分离芯片直至获得级分b的过程。这种方法是优选的浓缩方法,用于有效地获得含有可在单细胞水平上区分的来自胎儿的核酸的级分d。
本申请基于并要求2016年12月27日提交的日本专利申请第2016-253589号的优先权,其公开内容通过引用整体并入本文。
参考符号列表
39颗粒体
40细胞核
41有核红细胞(nrbc)
42无核红细胞(无核rbc)
43白细胞(wbc)
44容器
45a至45f
46离心管
47主通道
48a至48c血细胞
49子通道
50血细胞分离芯片
51入口
52主通道
53子通道
54a至54d出口
55出口
56a至56d通道
57注射器
58注射器
59a至59d分支通道
61平面芯片
62血细胞
74设备
75通道
76捕获结构
77反应结构
78细胞
b级分
c1至c8级分
c11至c18级分
d级分
e1至e8级分
f1至f3级分
fr1至fr5级分
ft通流
g级分
m染色体
p染色体
s21至s26步骤
s28至s30步骤
s32至s33步骤
s35至s37步骤
s65至s66步骤
s68至s70步骤
s72步骤
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于CRISPR‑Cas9系统的基因编辑载体及其应用的制造方法与工艺
- 一种基于CRISPR/Cas9技术制备水稻OsPIL15突变体的方法及应用与流程
- 检测黄曲霉毒素M1的核酸适配体、传感器、试剂盒及应用的制造方法与工艺
- 一组肌酸激酶同工酶核酸适配体及其应用的制造方法与工艺
- 用于抑制KRAS靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制EIF4E靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制VEGFA靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 一种新型向导RNA表达盒及在CRISPR/Cas系统中的应用的制造方法与工艺
- 一种具备双单链末端PCR产物的获得方法及其检测方法与流程
- 一种通过生物技术扩增脱氧胸苷三磷酸的方法与流程