三维细胞培养容器的制作方法
本发明涉及三维细胞培养容器。更为详细地,涉及一种如下结构的设备,其作为易于三维细胞培养的容器,具有可使实验人员按照规定高度准确地将细胞试样注入容器内,可使注入容器的细胞与培养基进行适当的物质交换,并且可便于观察细胞培养结果物的结构。
背景技术:
以活细胞为基础的分析技术主要应用于多种基础研究等新药开发以及药动力学试验中。以细胞为基础的分析技术与现有的生物化学分析或利用实验动物模型的分析方法相比,在人类活体模拟方面突出,在时间和成本方面具有经济性,因而在相关业界的需求呈增大趋势。并且,以细胞为基础的分析技术尽管是一种体外分析技术,但可以进行通过细胞辅助因子测量药物渗透性等对反映人体内环境的药物特性及功效的研究,因此具有能够研究与药物反应相关的整体分子机制的优点。
由于这种优点,以细胞为基础的分析技术的发展日新月异,为了克服以二维细胞为基础的分析技术的局限性,正在积极进行以三维细胞为基础的分析技术的开发,其以使用包括胶原蛋白、细胞外基质、水凝胶等的支架结构培养的三维细胞为基础,更为准确地模拟活体内环境或疾病状态。尤其是对于具有在体内进行三维接触的神经元(neuron)及神经干细胞(neuralstemcell)的脑组织细胞而言,由于上述二维细胞培养模型的局限性,对于能够准确地模拟活体组织的空间结构和生物化学复杂性的三维细胞培养模型的关注日益提高。三维细胞培养模型能够准确地模拟活体内状态,能够在活体外实验中实现定向生长及细胞-细胞连接的复杂性,同时,三维细胞培养模型相比于二维细胞培养模型,表现出改善的细胞生存和增强的神经干细胞分化。因此,三维细胞培养模型在以分子为基础的组织功能研究中,相比于二维细胞培养模型,在捕获多种疾病状态的信号传导和药物反应方面更为有用。
在三维细胞培养和以其为基础的分析中,为获得可靠性高的结果物,需要在多种变量中对实验对象细胞进行准确控制。尤其是在将所要培养的细胞试样注入培养装置内的过程中,根据实验人员的熟练度,其注入量及注入形式的调节较为困难,这可能给实验结果物的可靠性带来影响。举例来说,当向培养容器内注入凝胶剂型的细胞试样时,由于周围气体的界面能,可能无法顺畅地注入细胞,或者由于注入细胞试样的高度差异,可能难以在显微镜下观察培养结果物以及定量分析结果。即使具有能够按照规定高度注入的装置,也存在诸如培养环境、培养基数量的限制、注入方法的复杂性之类的问题。因此,需要开发能够解决这些实验上的困难的装置。
技术实现要素:
技术问题
本发明为解决现有问题而提出,本发明的目的在于提供一种细胞培养容器,该细胞培养容器能够弥补实验人员的熟练度来稳定地向细胞培养容器内注入规定量的细胞,支撑细胞试样以使其能够与周围培养基轻易且适当地进行物质交换,能够使细胞试样维持在规定高度以便于在显微镜下观察细胞培养结果物。
技术方案
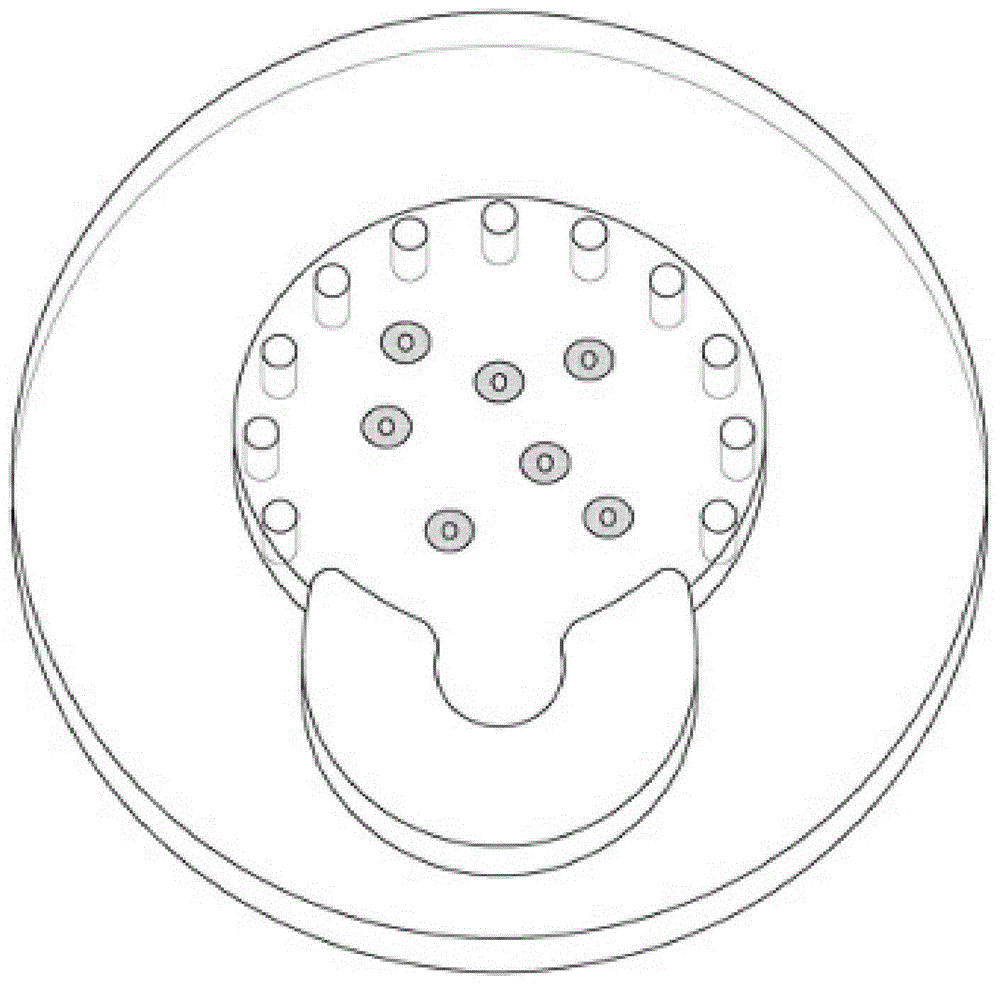
为了实现上述目的,本发明实施例的细胞培养容器可以包括:下板120;屏障部,由设置于上述下板的上侧的两个以上的柱子110形成;上板130,用于封闭上述屏障部的开放的端部;以及一个以上的细胞试样注入引导部220,设置于上述上板的一侧。
上述细胞培养容器可制造成包括微孔板形态、培养器的连接形态在内的多个容器水平阵列的形态或垂直排列的形态。
一个以上的上述细胞试样注入引导部可以位于上述细胞培养容器的一侧面,可以具有突出的孔结构,以能够支撑作为细胞试样注入工具的移液管等实验设备。
优选地,上述多个柱子由两个以上的柱子构成,柱子的直径为20μm以上且2000μm以下,柱子之间的间隔优选为10μm以上且2000μm以下,为了细胞试样与培养基之间的顺畅的物质交换,优选地,可以排列成圆形。
由上述多个柱子包围的细胞培养部的直径优选为0.1mm以上且10mm以下。
上述上板部能够以与柱子部垂直连接并与下板平行的方式设置,与下板之间的间隔优选为0.05mm以上且5mm以下。
发明效果
通过这种结构,本发明可以借助注入口的引导部稳定地在准确位置注入包含细胞的试样,并且,注入口的引导部可起到屏障作用,使得试样的流动朝向培养容器侧且防止泄漏到外部。上板和多个柱子起到有助于顺畅且均匀地注入适量试样的作用,从而使实验人员的操作更为轻松的同时,具有规定间隔的柱子部不但起到防止凝胶形态的试样泄漏到外部的作用,还起到开放空间以能够与外部细胞内的培养基进行物质交换的作用,从而可以进行稳定的细胞培养。与底面平行的上板确定试样的高度,从而可以使三维细胞培养物维持在规定高度。
附图说明
图1为示出本发明一实施例的三维细胞培养容器结构的立体图。
图2为示出可将本发明实施例的三维细胞培养容器的结构制成阵列形态或板形态的立体图。
图3为描述用于实现本发明实施例的容器制造方法的例示和三维细胞培养过程的示意图。
图4为示出用于在注入细胞试样时考虑到表面张力而导出细胞培养容器的柱子部的适当间隔的实验结果的图。
图5作为确认向细胞培养部中注入细胞试样液的注入形态的实验,示出根据容器表面性质的变化,培养部的直径、柱子的间隔给试样液加载成功率带来的影响的有关结果的图。
图6为示出通过实际细胞培养及分化实验来对根据细胞培养部直径,确认与培养基进行物质交换的程度的实验结果的图。
具体实施方式
后述的对本发明的详细说明将参照以能够实施本发明的特定实施例作为例示来示出的附图。将详细说明这些实施例,使得本技术领域的普通技术人员能够充分实施本发明。应该理解的是,虽然本发明的多个实施例互不相同,但它们之间不必相互排斥。举例来说,在此记载的特定形状、结构及特性在一实施例中不脱离本发明的主旨及范围的情况下也可实现为其他实施例。并且,应该理解的是,可在不脱离本发明的主旨及范围的前提下变更各公开的实施例中的每个结构要素的位置或配置。因此,并非所要以限定的含义来限制后述的详细说明,只要适当地说明,本发明的范围就仅由与其发明要求保护范围的主张等同的所有范围以及所附的发明要求保护范围来限定。附图中类似的附图标记可在多个方面中表示相同或类似的功能,为了便于说明,能够以夸张的方式表达长度及面积、厚度等以及它们的形态。
以下,参照附图详细说明本发明的优选实施例,使得本发明所属技术领域的普通技术人员能够容易实施本发明。
本发明的细胞培养容器包括:下板120;屏障部,由设置于上述下板的上侧的两个以上的柱子110形成;上板130,用于封闭上述屏障部的开放的端部;以及一个以上的细胞试样注入引导部220,设置于上述上板的一侧。
本发明的细胞培养容器可以包含含有玻璃(glass)的透明陶瓷类、含有聚二甲基硅氧烷(polydimethylsiloxane;pdms)和共聚酯(ecoflex)中的至少一种的硅胶类、含有聚苯乙烯(polystyrene)、聚甲基丙烯酸甲酯(polymethylmethacrylate)、聚丙烯(polypropylene)、聚碳酸酯(polycarbonate)和聚氨酯(polyurethane)中的至少一种的工程塑料类、含有透明陶瓷类、硅胶类和工程塑料类中的至少两种的混合物、透明陶瓷类的化学变体、硅胶类的化学变体、工程塑料类的化学变体、或者含有透明陶瓷类的化学变体、硅胶类的化学变体和工程塑料类的化学变体中的一种或至少两种的混合物。并且,还可以包含所有光固化型塑料类、薄膜、热塑性塑料及金属等可用作3d打印机材料的材料中的一种以上或它们的化学变体。
本发明的细胞培养容器的细胞试样注入部可位于细胞培养容器结构的一侧面。优选地,细胞试样注入部具有圆形的孔结构,以能够引导用来注入细胞试样的移液器、注射器针头等排出件。并且,可以包括用于引导液体流动的屏障结构体,以防止试样在试样注入口周围泄漏到柱子外,而是填充到培养部内部。
本发明的细胞培养容器的多个柱子部具有适合于凝胶形态的细胞试样通过其表面张力放置于柱子部内部程度的间隔,柱子的间隔可以为10μm至2000μm,柱子的直径可以为20μm至2000μm左右。起到屏障作用的柱子部具有若柱子的直径越小则柱子间的间隔越小的倾向。但是,过小的间隔会限制细胞和培养液之间的物质交换,或缝隙间产生气泡的可能性大,而过大的间隔会打破柱子和试样间表面能和张力之间的均衡,从而提高试样向柱子外泄漏的可能性。如实施例,当柱子的直径为300μm时,各柱子间的间隔优选为约200μm至400μm,这适于将细胞试样放置于内部。并且,柱子的数量由适合构成能够将细胞试样放置于内部的空间的数字构成,优选为1个以上且100个以下。柱子的截面除了圆形之外还可以呈可调节界面张力的多种形态。
优选地,本发明的细胞培养容器的形态可呈圆形,或者圆形之外的其他形态也无妨。培养部的宽度应为能够进行充分的物质交换来可向内部的细胞顺畅地供给氧气和营养成分的尺寸,当细胞培养部呈圆形时,基于直径,其大小可以为0.1mm至10mm左右。若尺寸过小,则难以提供足够数量的细胞试样,过大的直径(培养部为多边形时其内接圆的直径)会限制从侧面传递物质,因而不适用作细胞培养器。
本发明的细胞培养容器的上板可以呈与支柱部垂直连接并与下板平行的形态。从而形成与底面平行的形态。上板与下板之间的高度具有适合在显微镜下观察细胞培养结果物的间隔,优选为0.05mm至5mm之间。在0.05mm以下的情况下,难以确保在观察范围内观察到足够数量的对象细胞,在5mm以上的情况下,由于作为观察对象的细胞的重叠等问题,因而不适于在显微镜下对细胞培养结果物进行观察。
通过下述实施例对本发明进行更为详细的说明。但是,下述实施例仅用于具体化本发明的内容,而并非所要限制本发明。
实施例1.导出优选的柱子部间隔
考虑到通常使用的凝胶形态的细胞试样和容器表面之间的表面能,为了导出适合于防止细胞试样涌出而是使其固定于由多个柱子构成的屏障部内的柱子间的间隔,在200μm至400μm的范围内以100μm的间隔设置柱子之间的间隔并进行了细胞试样加载试验。作为注入试样,使用了2mg/ml的胶原蛋白,此时柱子的直径设置为300μm。上板和底面的厚度(试样的厚度)固定为250μm。
实验结果,如可从图4中所确认,在200μm至400μm的范围内,呈现出柱子间的间隔越大,凝胶试样的界面则越向柱子外部突出的倾向。即,更大的间隔可能导致试样向柱子外泄漏,因此根据柱子的直径及培养部的直径,需要最佳间隔。在本实验中,当柱子的直径固定为300μm时,可以确认到在柱子间的间隔为200μm至400μm的情况下,凝胶形态的细胞试样不向柱子外涌出,而是通过其张力适当地位于由柱子形成的屏障部内部。
实施例2.根据容器表面的亲水性程度的试样注入成功率
在本实验中,在对细胞培养器和柱子的表面进行亲水性处理(等离子处理)后,对注入容器内的试样是否准确地放置于内部的成功率进行了调查。进行等离子处理后,容器的表面能具有高亲水性,并且随着时间的经过,逐渐恢复为疏水性,当柱子表面为亲水性时,试样的湿润性提高,因此易于向柱子外流出,导致试样加载失败率增高,随着疏水性的逐渐恢复,通过液体的表面张力,试样加载的成功率提高。在本实验中,为了将柱子的间隔、注入部直径给加载带来的效果极大化,在将柱子表面处理为亲水性后的8小时内确认了加载成功率。在该实验中,将试样泄漏到一个以上的柱子外的情况定义为失败,将成功地放置于柱子内的情况定义为成功。图5的(a)部分示出在亲水性表面上随时间的变化成功加载试样的概率。如图所示,随着时间的经过,由亲水性逐渐变为疏水性,进而试样加载的成功率也逐渐提高,并且在8小时后接近100%。这表明柱子结构可成功加载试样。从图5的(b)部分中观察了细胞培养部的直径的尺寸给加载成功率带来的影响。观察到在强亲水性表面(等离子处理后1小时(1h,timeafterplasmatreatment)),观察到培养部的直径越大,在试样完全填充于培养部之前,溶液泄漏到周边柱子外的概率则越高。该概率随着恢复疏水性的时间而逐渐变小,并在8小时后,与直径尺寸无关地,加载成功率达到了100%。并且,在图5的(c)部分中,根据培养部周边柱子部的间隔来测量了试样加载概率。同样,在强亲水性的表面(等离子处理后1小时(1h,timeafterplasmatreatment)),可以确认到柱子间的间隔越大,试样向柱子外泄漏的概率越高,随着时间的经过,这概率逐渐减变小,并且在恢复疏水性的8小时后,与间隔无关地,几乎没有失败率。由此,可以确认柱子部的间隔和培养部的直径给细胞加载成功率带来的效果,在表面能不高的表面,细胞加载的概率接近100%,这证明可以非常有效地填充细胞试样。
实施例3.通过确认细胞与培养基的物质交换来导出细胞注入部尺寸
为了导出以能够使位于由多个柱子形成的屏障部内部的细胞试样与培养基之间适当地进行物质交换程度的细胞注入部尺寸,在2mm至5mm的范围内,以1mm的间隔设置细胞加载部的直径并进行了物质交换实验。上板和底面的厚度(试样的厚度)固定为250μm。
细胞使用了ren-vm(神经干细胞(neuralstemcell)),细胞的培养条件及观察基准如下:
细胞名称(nameofcell):ren-vm(神经干细胞(neuralstemcell))
基质凝胶浓度(matrigelconcentration):5.7mg/ml
细胞浓度(cellconcentration):1.0×107cells/ml
培养期(cultureperiod):1周(week)
染色方法(stainingmethod):fitc标记的鬼笔环肽(fitc-phalloidin),50分钟
实验结果,如可从图6中所确认的,当细胞培养部的直径为2mm至4mm时,可以确认到在整个细胞培养部中,通过注入神经干细胞的凝胶环境和培养液,分化的进行良好。由此可以确认到在试样的全部范围内顺畅地进行着与培养基之间的物质交换。但是,在有限的50分钟的染色时间内进行观察时发现,在5mm的细胞培养部中,染色液的扩散最不均匀。这说明可能对细胞培养部直径的无限增大是有限制的。
虽然通过上述优选实施例对本发明进行了说明,但可以在不脱离本发明的主旨和范围的前提下进行多种修改或变形。并且,所附的发明要求保护范围包括属于本发明主旨的这些修改或变形。
- 还没有人留言评论。精彩留言会获得点赞!