一种具有抗肿瘤活性的多肽IMB-P1及其应用的制作方法
本发明涉及一种具有抗肿瘤活性的多肽imb-p1及其应用,属于抗肿瘤药物研发与应用技术领域。
背景技术:
恶性肿瘤是严重威胁人类生命健康的疾病之一,近年来肿瘤发病率在世界范围内普遍上升。传统疗法联合化学治疗虽能降低癌症死亡率,但手术治疗仅能有效切除肉眼可见肿瘤,而现有的抗肿瘤药物在杀伤肿瘤细胞的同时对正常细胞也有较大的杀伤性副作用,这些可能引起患者严重的胃肠道反应并影响免疫重建,使得复发率增高及生存率降低。因此,研制新的具有高度选择性兼具低毒副作用等优良特性的抗肿瘤药物,已在世界范围内成为各国政府投资的重点领域。
从自然产物中分离提取抗肿瘤药物已日益引起国内外学者的重视,大多数预防和治疗肿瘤的药物均来自于自然。而肽类物质是一类或天然存在于动、植物和微生物等生物体内,或动、植物蛋白质经过蛋白酶解以及人工化学合成、生物工程等三种方式存在的肽类混合物。众所周知,肽的作用涉及机体的激素、神经、细胞生长和生殖各领域,其重要性在于调节体内各个系统器官和细胞的功能活动,其最大特点是具有极强的活性和多样性,而且具有特殊的生物学功能。
抗癌生物活性肽(anticancerbioactivepeptide,acbps),以下简称“acbps”,是用人胃癌细胞碎片免疫山羊,从其脾脏中分离获得的具有良好抗肿瘤活性的分子量单一的(16.7kd)肽类混合物(该方法已获得发明专利,no:zl96/22236)。该项目开始于1996年,研究历经20余年。科研人员经动物体内实验证实acbps是一种无毒副作用,可长期反复使用并有明显的抑制肿瘤细胞增殖作用,同时,体外实验表明有较强的杀伤癌细胞、抑制肿瘤细胞dna合成的生物功能。对荷胃癌小鼠的肿瘤细胞超微结构观察证实,acbps不仅有抑制肿瘤细胞增殖的作用,还可诱导肿瘤细胞凋亡,纠正因癌变引起的肝、脾损伤。同时,acbps与decreases联合用药发现,其可有效降低化疗药物给动物带来的细胞毒性,改善患癌小鼠的生活质量。此外,acbps对乳腺癌、胆囊癌及结肠癌等各种不同组织来源的肿瘤细胞增殖具有抑制作用,提示acbps具有广谱的抗肿瘤活性。
虽然acbps良好的抗癌活性及卓越的成药潜质毋庸置疑,但来源有限、成份复杂等问题限制其作为多肽候选药的研发,因此进行抗癌生物活性肽的活性组分分析及生物信息获取的研究十分必要。本专利发明人带领课题组成员多年来一直围绕acbps的单组分化开展研究工作,取得了一系列原创性有意义的研究成果:(1)应用2d-nano-lc-esiltq-orbitrapms/ms技术,已解析抗癌生物活性肽各组分的组成及各单组分的基本生物合成信息,其中可以获得九个单组分的基本生物合成信息;(2)已确证其中一个单组分,命名为sxl-5并进行异源表达,其体外增免抑瘤作用得到确证;(3)通过blast分析发现,sxl-5与来自于人体的负责调控细胞中活性氧分子水平的抗氧化酶家族peroxiredoxin5(简写为prdx5)相似率达89%,通过相似序列具有相似功能的预测,因此推断prdx5也有类似抗肿瘤活性;(4)对prdx5进行异源表达,并进行体内活性测定,发现其对结肠癌c26荷瘤小鼠有明显的抑制作用且呈剂量依赖性,对评价药物或药物前体物通过免疫系统杀伤肿瘤的经典——荷b16黑色素瘤小鼠的活性优异,抑瘤率达39.44%。
然而,prdx5发挥其抗肿瘤活性的作用机制尚不清楚。根据文献报道,胸腺五肽是胸腺分泌物的一种胸腺生成素ii的有效部分,其由5个氨基酸组成,却有着与胸腺生成素ii相同的全部生理功能,目前已作为人工合成肽类新药应用于临床。此外,内皮抑素(endostatin)是目前作用最强、实验效果最好的肿瘤血管生成抑制剂,目前在美国已进行i期和ii期临床试验。基于内皮抑素序列设计出相关系列多肽,再经活性比较,发现一个包含内皮抑制素部分序列的27肽与内皮抑素的功能相近,同时wickstrom等合成了含11-13个氨基酸的内皮抑素衍生多肽,并发现其中ivrradraavp多肽在体外具有显著的抑制内皮细胞迁移和血管生成的活性。综上抗肿瘤药物研发思路,对prdx5序列及结构进行分析,设计并构建相关多肽库,再经活性筛选确定其活性片段,为新一代抗肿瘤药物的发现奠定基础。
本发明的目的是,提供一种由21个氨基酸组成的多肽,其特点是调节机体免疫功能和抑制肿瘤生长的活性,并且治疗肿瘤安全有效,可作为抗肿瘤药物。
技术实现要素:
第一方面,本发明提供了具有抗肿瘤活性的多肽的氨基酸序列,所述多肽即为本发明中的imb-p1。
第二方面,本发明提供了与imb-p1具有相同功能的变体或衍生物,所述多肽变体或衍生物具有抗肿瘤的活性。
第三方面,本发明提供了药物或药物组合物,其包含本发明的多肽或其药物可接受的盐,以及赋形剂或药用载体。
第四方面,本发明提供了利用本发明的多肽、其变体或衍生物制备抗肿瘤药物或药物组合物的用途,所述药物或药物组合物还包含赋形剂或药用载体。
第五方面,本发明提供了抑制个体的肿瘤细胞或治疗个体的癌症的方法,包括对所述个体进行有效量的本发明的多肽、其变体或衍生物、药物或药物组合物的给药。
附图说明:
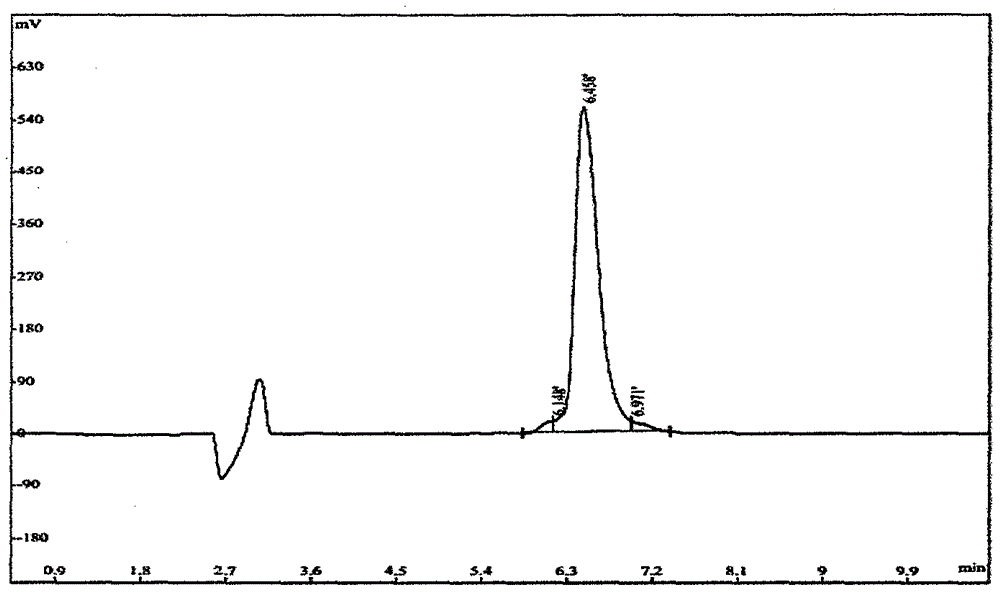
图1多肽imb-p1的hplc图谱。
图2多肽imb-p1的质谱图。
图3多肽imb-p1在体内对肿瘤的抑制效果。
图4多肽imb-p1及其突变体在体内对肿瘤的抑制效果。
具体实施方式:
本发明人对prdx5序列及结构进行分析,设计并构建相关多肽库,经活性筛选确定其活性片段包含在多肽imb-p1中,该多肽具有与prdx5相当的抗肿瘤活性。
由此,一方面,本发明提供了多肽imb-p1的氨基酸序列,该多肽具有抗肿瘤活性或抑制肿瘤生长。另一方面,提供了具有抗肿瘤活性或抑制肿瘤生长的多肽,其包含imb-p1的氨基酸序列,或其具有相同功能的变体或衍生物。
本发明的“多肽”或“肽”可以交替使用,“多肽”或“肽”是二种或更多种氨基酸的任意链,无论翻译后修饰(例如,糖基化或磷酸化)的情况如何,包括自然发生或非自然发生的氨基酸或氨基酸类似物。
在本领域中,众所周知可以在多肽的结构中进行诸如取代、添加或替换的某些修饰和变化而基本上不改变该多肽的生物学功能,从而得到生物学等同的多肽。
本发明的“多肽”或“肽”可包含有异常连接、交联和末端帽子,非肽键或其它修饰基团。这些修饰基团也在本发明范围之内。术语“修饰基团”是指包括直接附着于所述肽结构(例如,通过共价轭合)的结构,以及那些间接附着于所述肽结构(例如,通过稳定的非共价连接或通过共价偶联于其它的氨基酸残基或其模拟物、类似物或衍生物,其可以位于所述核心肽结构的侧翼)的结构。例如,所述修饰基团可以偶联于肽结构的氨基末端或羧基末端,或偶联于所述核心结构域侧翼的肽或肽模拟结构。或者,所述修饰基团可以耦合于肽结构的至少一个氨基酸残基的侧链,或偶联于所述核心结构域侧翼的肽或肽模拟区域(例如,通过赖氨酸残基的ε氨基,通过天冬氨酸残基或谷氨酸残基的羧基,通过酪氨酸残基、丝氨酸残基或苏氨酸残基的羟基,或在氨基酸侧链上的其它适合的反应基团)。共价偶联于所述肽结构的修饰基团可通过本领域中公知的方式和方法结合于连接性化学结构,包括,例如酰胺、烷氨基、氨基甲酸盐或尿素键。
在本发明的一个实施方式中,本发明的多肽也可以扩展为生物学等同的多肽;或通过保守性氨基酸替换而获得的本发明所述多肽序列的部分序列的变体;或通过不影响生物学功能,例如所述结构域的非保守性替换而获得的本发明所述多肽序列的部分序列的变体。
本文所使用的术语“保守的氨基酸替换”是指在所述多肽的给定位置上一种氨基酸对另一种氨基酸的替换,其中可以在基本上不丧失相关功能的条件下进行所述替换。
保守性的氨基酸替换包括用对应的d-氨基酸或用自然发生的、非遗传编码形式的氨基酸替换l-氨基酸,或者是l-氨基酸的保守性替换。
自然发生非遗传编码的氨基酸包括β-丙氨酸、3-氨基丙酸、2,3-二氨基丙酸、α-氨基异丁酸、4-氨基丁酸、n-甲基甘氨酸(肌氨酸)、羟基脯氨酸、鸟氨酸、瓜氨酸、t-丁基丙氨酸、t-丁基甘氨酸、n-甲基异亮氨酸、苯基甘氨酸、环己基丙氨酸、正亮氨酸、戊氨酸、2-萘基丙氨酸、吡啶基丙氨酸、3-苯并噻吩基丙氨酸、4-氯苯基丙氨酸、2-氟苯基丙氨酸、3-氟苯基丙氨酸、4-氟苯基丙氨酸、青霉胺、1,2,3,4-四氢-异喹啉-3-羧酸、β-2-噻吩基丙氨酸、甲硫氨酸亚砜、高精氨酸、n-乙酰赖氨酸、2-氨基丁酸、24-二氨基丁酸、ρ-氨基苯丙氨酸、n-甲基缬氨酸、高半胱氨酸、高丝氨酸、磺基丙氨酸、ε-氨基己酸、δ-氨基戊酸或2,3-二氨基丁酸。
在某些实施方案中,“保守取代”为用一氨基酸取代另一具有类似特性的氨基酸的取代,从而肽化学领域的技术人员将预料多肽的二级结构和亲水性不会发生实质性改变。氨基酸取代通常基于残基的极性、电荷、溶解度、疏水性、亲水性和/或兼性性质的相似性进行。例如,带负电荷的氨基酸包括天冬氨酸和谷氨酸;带正电荷的氨基酸包括赖氨酸和精氨酸;具有相似亲水性值的带有不带电荷的极性头部基团的氨基酸包括亮氨酸、异亮氨酸和缬氨酸,甘氨酸和丙氨酸,天冬酰胺和谷氨酰胺,以及丝氨酸、苏氨酸、苯丙氨酸和酪氨酸。其它可代表保守改变的氨基酸基团包括:(1)ala、pro、gly、glu、asp、gln、asn、ser、thr;(2)cys、ser、tyr、thr;(3)val、ile、leu、met、ala、phe;(4)lys、arg、his;和(5)phe、tyr、trp、his。变体也可以或可择地含有非保守改变。
在其它实施方案中,保守性改变还可包括通过例如氨基酸的官能侧链反应,对非衍生残基进行化学衍生。因此,这些取代基可包括这样的化合物,其游离的氨基被衍生成盐酸胺、ρ-甲苯磺酰基、卞氧羰基、t-丁氧羰基、氯乙酰基或甲酰基。类似地,游离的羧基可被衍生形成盐,甲基或乙基酯或其它类型的酯或肼,且侧链可被衍生形成游离羟基的o-酰基或o-烷基衍生物,或组氨酸咪唑氮的n-亚氨苯甲基组氨酸。多肽类似物还可包括被化学改变的,例如甲基化,通过诸如乙胺、乙醇胺或乙二胺的烷基胺对c-末端氨基酸的酰胺化,或对氨基酸侧链的乙酰化或甲基化的氨基酸。多肽衍生物还可包括用取代的酰胺对酰胺键进行替换或酰胺键的同电子排列体。
在一个实施方案中,鉴定了本发明的多肽imb-p1中的活性位点,用丙氨酸替换活性位点氨基酸之后得到seqidno:2,可获得基本不再具有seqidno:1活性的变体。取代、缺失多肽氨基酸序列中特定位点的氨基酸,从而得到该多肽的衍生物或变体的方法是本领域公知的。
本发明的另一方面涉及所述的多肽在制备药物、多肽药物或药物组合物中的用途,所述药物、多肽药物或药物组合物用于治疗和/或预防个体的肿瘤,优选恶性肿瘤或癌症。所述的多肽可以与脂质体、赋形剂或药用载体组成药物或药物组合物。
本发明的另一方面涉及治疗和/或预防个体的肿瘤,优选恶性肿瘤或癌症的方法,所述方法包括对所述个体进行有效量的所述多肽、多肽药物或组合物的给药。
在本发明的实施方案中,所述肿瘤或癌症选自肝癌、胃癌、结肠直肠癌、胰腺癌、乳腺癌、诸如骨肉瘤的肉瘤、白血病、卵巢癌、输尿管癌、膀胱癌、前列腺癌、淋巴瘤、多发性骨髓瘤、胰腺癌、肾癌、内分沁腺癌、皮肤癌、黑色瘤、血管瘤以及脑或中枢神经系统癌症。在优选的实施方案中,所述的癌症是肝癌、黑素瘤、胃癌、结肠直肠癌、乳腺癌、肺癌。所述癌症可以为原发肿瘤,也可以是转移性癌症。
在本发明的实施方案中,所述多肽药物或药物组合物能以适于对哺乳动物个体,例如人、猴子、猪、马、牛、绵羊、狗、大鼠、小鼠、豚鼠、家兔、猫等给药的适当形式,可单独提供本发明所述的多肽或与其它化合物(例如,核酸分子、小分子、多肽、肽或肽类似物)组合提供。如果需要,可将本发明的多肽与多种传统和现存的治疗癌症的药物或手段联合使用,例如与化疗药物和/或放疗联合使用。
在本发明的实施方案中,与imb-p1联合使用的抗癌试剂选自:顺铂、卡铂、环磷酰胺、美法仑(左旋苯丙氨酸氮芥)、卡莫司汀、氨甲蝶呤、5-氟尿嘧啶、阿糖胞苷、巯基嘌呤、柔红霉素、阿霉素、表阿霉素、长春花碱、放线菌素、丝裂霉素c、紫杉醇、左旋天冬酰胺酶、粒细胞集落刺激因子g-csf、依托泊甙、秋水仙素、甲磺酸及喜树碱。
可使用常规的制药方法提供适合的药物制剂或组合物从而对患有癌症的个体、优选人,进行所述多肽或所述药物的给药。可以采用任意适合的,例如非肠道的、静脉的、皮下的、肌肉的、颅内的、眶内的、眼的、心室内的、囊内的、脊柱内、脑池内、腹膜内的、鼻内的、气雾剂或口服给药方法。药物制剂或配方可以是液体溶液或悬液、片剂或胶囊、粉末、滴鼻剂或气雾剂形式。
制备所述制剂的方法是本领域公知的。适于非肠道给药的配方可含有,例如赋型剂、灭菌水、盐水、诸如聚乙二醇的聚亚烷基二醇、植物来源的油或氢化的萘。也可以采用生物匹配的、生物可降解的交酯聚合物、交酯/乙交酯聚合物或聚氧乙烯-聚氧丙烯共聚物来控制所述化合物的释放。其它潜在的用于调节化合物非肠道传递的系统包括乙烯-醋酸乙烯酯共聚物颗粒、渗透泵、可植入的灌注系统以及脂质体。适于吸入的配方可包括赋形剂,例如乳糖、或可以是以滴鼻剂形式给药的油状溶液或作为凝胶。对治疗性或预防性组合物而言,可以足以中止或延缓肿瘤细胞增殖的量对个体给药所述化合物。
本发明的多肽或药物组合物的治疗有效量通常能够改善癌症症状至少约10%,通常至少约20%,优选至少约30%,或更优选至少约50%。癌症转移的抑制指肿瘤细胞的迁移或转移受到影响或抑制。这将导致例如受影响细胞数目的统计学显著的或可定量的变化,例如,在一段时间内或靶区域内受影响的靶细胞数目的减少。还可以监测原发肿瘤进展的速度、大小、扩散或生长。
以下实施例进一步帮助本领域技术人员更好地了解本发明,但不以任何方式限制本发明。
《实施例1》多肽的设计与合成
本实施例设计与合成的多肽如表1所示,其中seqdno.1即为本发明所述的imb-p1。
表1实施例1设计与合成的多肽序列
《实施例2》在体内评估imb-p1的生物活性
取对数生长期的b-16黑色素瘤细胞,在无菌条件下制备成1×109/l细胞悬液,分别以0.2ml接种于小鼠背部皮下,隔天观察肿瘤生长情况,测量硬结大小,观测小鼠生存期并记录相关数据。将小鼠随机分组,通过皮下注射方式进行动物实验评价。其中胸腺肽α1(2mg/kg)作为阳性对照,pbs作为阴性对照,给药组为imb-p1(l25、25、5、10、20mg/kg)。给药方式:每周三次,给药三周。观察小鼠生长状态及生理状态,实验终止后处死小鼠,分离瘤体,测量瘤重。
结果如图3所示,与对照组相比,多肽imb-p15mg/kg处理组抑制小鼠皮下肿瘤生长的效果最为明显。此外,在整个实验观察期间,未见到小鼠有药物毒性反应。
《实施例3》在体内评估imb-p1突变体的生物活性
通过活性位点氨基酸的丙氨酸取代而不同于原序列。重复上述实验,给药剂量为5mg/kg,如图4未表现出同seqidno:1的抗肿瘤活性。
本领域技术人员可以理解,可以任意组合上文所述的各种实施方案,以便提供其它的实施方案。而且,在不违背本发明精神的前提下,可对上述实施方案的元素、步骤、特征做出适当的修改和替换,获得其等同的实施方案。
- 还没有人留言评论。精彩留言会获得点赞!