全人源的抗LAG-3抗体及其应用的制作方法
本发明涉及特异性结合lag-3的新型抗体和抗体片段以及含有所述抗体或抗体片段的组合物。此外,本发明涉及编码所述抗体或其抗体片段的核酸及包含其的宿主细胞,以及相关用途。此外,本发明涉及这些抗体和抗体片段的治疗和诊断用途。特别地,本发明涉及这些抗体和抗体片段与其它疗法,例如治疗方式或治疗剂,例如抗pd-1或抗pd-l1抗体的联合治疗。
背景技术:
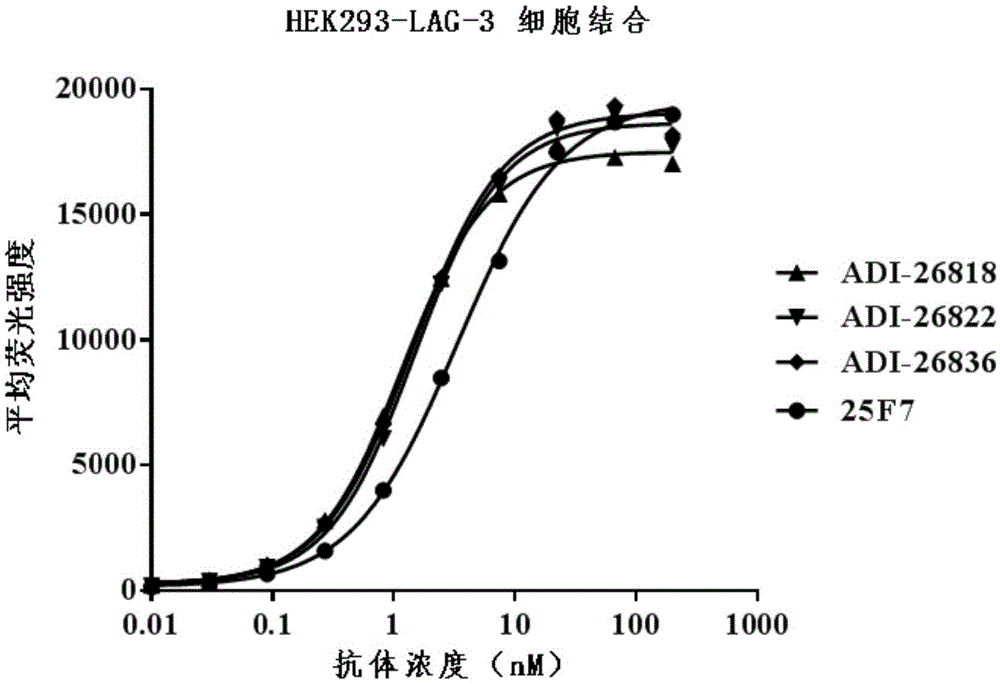
:淋巴细胞激活基因3(lag-3),也称为cd223,是由lag3基因在人体中编码的i型跨膜蛋白。lag-3的分子性质和生物学功能已经有充分的表征和描述,参见例如sierro等人,expertopinthertargets(2011)15(1):91-101。lag-3是一种cd4样蛋白,在t细胞(特别是活化的t细胞)、自然杀伤细胞、b细胞和浆细胞样树突状细胞表面表达。已显示lag-3是负共刺激受体,即抑制性受体。已经提出,lag-3与mhcii类分子的结合在下调cd4+t淋巴细胞的抗原依赖性刺激中起作用(huard等,(1994)eur.j.immunol.24:3216-3221)。还认为lag3和ii类mhc之间的相互作用在调节树突细胞功能中起作用(andreae等人.jimmunol168:3874-3880,2002)。近期的临床前研究也已经记录了lag-3在cd8t-细胞耗竭中的作用(blackburn等人.natimmunol10:29-37,2009)。研究表明,慢性病毒感染后耗尽的cd8+t细胞表达多种抑制性受体(如pd-1,cd160和2b4)。lag-3在lcmv感染后以高水平表达,并且显示阻断pd-1/pd-l1途径与阻断lag-3显著降低慢性感染小鼠中的病毒载量(blackburn等人,natimmunol(2009)10:29-37)。还显示pd-1/pd-l1途径和lag-3阻断剂的联合抑制提供了抗肿瘤功效(jing等人,journalforimmunotherapyofcancer(2015)3:2)。鉴于lag-3的上述重要作用,需要开发调节其活性的新的抗lag-3抗体,特别是全人源抗体。这类抗体能够更好地用于治疗肿瘤以及其它疾病如感染。此外,也希望获得能够与其他疗法(例如治疗剂,例如抗pd-1或抗pd-l1抗体)联合用于治疗肿瘤或者感染的新抗lag-3抗体。发明概述本发明提供了全人源的抗人lag-3抗体及其编码基因与应用。通过基因工程手段和酵母表面展示技术,本发明人从展示在酵母表面的人抗体库中筛选出抗人lag-3的全人源抗体,在此基础上进一步获得经亲合力成熟的高亲合力抗人lag-3抗体。本发明的全人源抗体分子能够有效地阻断lag-3与主要组织相容性(mhc)ii类分子的结合,结合激活的人cd4+t细胞上表达的lag-3,并且在体内施用时抑制肿瘤生长,尤其是在与抗pd-1抗体联用时,抑瘤效果尤为显著。因此,本发明的抗体可以用于多种用途,包括但不限于检测lag-3蛋白和在携带肿瘤的受试者中抑制肿瘤生长。因此,一个方面,本发明提供特异性地结合lag-3(优选人lag-3蛋白质)的抗体或其抗原结合片段。在一个实施方案中,本发明特异性结合人lag-3的抗体或其抗原结合片段包含:(i)如seqidno:33或34所示的重链可变区的3个互补决定区hcdr,以及如seqidno:39所示的轻链可变区的3个互补决定区lcdr,或者(ii)如seqidno:35或36所示的重链可变区的3个互补决定区hcdr,以及如seqidno:40或41所示的轻链可变区的3个互补决定区lcdr;或者(iii)如seqidno:37或38所示的重链可变区的3个互补决定区hcdr,以及如seqidno:42或43所示的轻链可变区的3个互补决定区lcdr。再一方面,本发明也提供具有以下一个或多个特性的抗lag-3抗体或其抗原结合片段:(i)抑制(例如,竞争性抑制)表3所列的任一抗体与人lag-3的结合;(ii)与表3所示的任一抗体结合相同或重叠的表位;(iii)与表3所示的任一抗体竞争结合人lag-3。在一些实施方案中,本发明的抗体表现出以下一个或多个生物学活性:(i)以高亲和力与人lag-3结合;(ii)以小于100×10-4,例如0.5×10-4至50×10-4的解离常数(kd)与人lag-3结合;(iii)以高亲和力与细胞表面表达的人lag-3结合;(iv)阻断人lag-3与细胞表面mhcii分子的结合;(v)结合表达人lag-3的激活的cd4+和/或cd8+t细胞;(vi)刺激免疫应答,优选抗肿瘤免疫应答;(vii)抑制表达人lag-3的肿瘤细胞,尤其是与抗pd1抗体联用时。优选地,抗体表现出上述性质中的至少二个、更优选地至少三个、四个、五个,甚至更优选地上述所有性质。再一方面,本发明提供编码本发明抗体或其片段的核酸,包含所述核酸的载体,包含所述载体的宿主细胞。本发明也提供制备本发明抗体或其片段的方法。再一方面,本发明提供包含本发明抗体的免疫缀合物、多特异性抗体和药物组合物。本发明还提供在受试者中刺激免疫应答的方法,以及预防或治疗癌症或感染的方法。本发明还涉及在样品中检测lag-3的方法。附图简述图1显示,通过流式细胞术检测,母抗体(adi-26818、adi-26822和adi-26836)与hek293细胞上表达的hlag-3的结合能力。25f7是对照抗体。图2显示,通过流式细胞术检测,亲和力优化的抗hlag-3抗体与hek293细胞上表达的hlag-3的结合能力。25f7是对照抗体。图3显示,通过流式细胞术检测,抗lag-3抗体阻断人mhcii(hla-dr)和lag-3的相互作用。图4显示,通过流式细胞术检测,流式细胞术检测抗lag-3抗体和激活的人cd4+t细胞的结合能力。图5显示,抗lag-3抗体在a375-人pbmc模型中的肿瘤抑制效果。adi-31798为本发明抗体。antibodyd为pct/cn2016/094122中公开的抗pd-1抗体(“抗体d”)。图6显示,本发明示例性抗体vl区的比较。图7显示,本发明示例性抗体vh区的比较。发明详述定义除非另有定义,否则本文中使用的所有技术和科学术语均具有与本领域一般技术人员通常所理解的含义相同的含义。为了本发明的目的,下文定义了以下术语。术语“约”在与数字数值联合使用时意为涵盖具有比指定数字数值小5%的下限和比指定数字数值大5%的上限的范围内的数字数值。术语“和/或”应理解为意指可选项中的任一项或可选项中的任意两项或多项的组合。如本文中所用,术语“包含”或“包括”意指包括所述的要素、整数或步骤,但是不排除任意其他要素、整数或步骤。在本文中,当使用术语“包含”或“包括”时,除非另有指明,否则也涵盖由所述及的要素、整数或步骤组成的情形。例如,当提及“包含”某个具体序列的抗体可变区时,也旨在涵盖由该具体序列组成的抗体可变区。在本文中,术语“抗体”是指至少包含轻链或重链免疫球蛋白可变区的多肽,所述免疫球蛋白可变区特异性识别并结合抗原。该术语涵盖各种抗体结构,包括、但不限于单克隆抗体、多克隆抗体、单链抗体或多链抗体、单特异性或多特异性抗体(例如双特异性抗体)、全人源抗体或嵌合抗体或人源化抗体、全长抗体和抗体片段,只要它们呈现期望的抗原结合活性即可。本领域技术人员明了,“全抗体”(在本文中可与“全长抗体”、“完全抗体”和“完整抗体”互换使用)包含至少两条重链(h)和两条轻链(l)。每条重链由重链可变区(本文中缩写为vh)和重链恒定区组成。重链恒定区由3个结构域ch1、ch2和ch3组成。每条轻链由轻链可变区(本文中缩写为vl)和轻链恒定区组成。轻链恒定区由一个结构域cl组成。可变区是抗体的重链或轻链中参与抗体与其抗原的结合的结构域。恒定区不直接参与抗体与抗原的结合,但是显示出多种效应子功能。抗体的轻链可以基于其恒定结构域的氨基酸序列归入两种类型(称为kappa(κ)和lambda(λ))中的一种。抗体的重链可以取决于其重链恒定区的氨基酸序列而划分为主要5种不同的类型:iga、igd、ige、igg和igm,并且这些类型中的几种可以进一步划分成亚类,如,igg1、igg2、igg3和igg4、iga1以及iga2。对应于不同抗体类型的重链恒定区分别称作α、δ、ε、γ和μ。术语“同种型”是指由抗体重链恒定区确定的抗体类型。参见例如fundamentalimmunology,ch.7(paul,w.编辑,第二版,ravenpress,n.y.(1989))(其为所有目的以其整体在此引作参考)。术语抗体的“抗原结合部分”(在本文中可与“抗体片段”和“抗原结合片段”互换使用),是指并非完整抗体的分子,其包含完整抗体中用于结合该完整抗体所结合的抗原的部分。如本领域技术人员理解的,抗体的抗原结合部分通常包含来自“互补决定区”或“cdr”的氨基酸残基。可以通过重组dna技术、或通过酶或化学切割完整的抗体制备抗原结合片段。抗原结合片段包括但不限于fab、scfab、fab’、f(ab’)2、fab’-sh、fv、单链fv、双链抗体(diabody)、三链抗体(triabody)、四链抗体(tetrabody)、微抗体(minibody)、单结构域抗体(sdab)。关于抗体片段的更详细的描述,可以参见:基础免疫学(fundamentalimmunology),w.e.paul编辑,ravenpress,n.y.(1993);邵荣光等人(编辑),抗体药物研究与应用,人民卫生出版社(2013);hollinger等人,pnasusa90:6444-6448(1993);hudson等人,nat.med.9:129-134(2003)。术语“人抗体”或“全人源抗体”在本文中可以互换使用,指包括其中构架区和cdr区二者均源自人种系免疫球蛋白序列的可变区的抗体。而且,如果抗体含有恒定区,恒定区也源自人种系免疫球蛋白序列。本发明的人抗体可包括不由人种系免疫球蛋白序列编码的氨基酸序列(例如,通过体外随机或点特异诱变或体内体细胞突变引入的突变),例如在cdr——尤其在cdr3中。然而,如本文所使用的,术语“人抗体”不包括其中的cdr序列衍生自其他哺乳动物物种(如,小鼠)的种系而移植入人构架序列的抗体。如本文所用,术语“重组人抗体”包括所有通过重组方式制备、表达、产生或分离的人抗体,例如,(a)自用人免疫球蛋白基因进行转基因或转染色体的动物(例如小鼠)或由其制备的杂交瘤分离的抗体,(b)自转化成表达人抗体的宿主细胞例如转染瘤分离的抗体,(c)自重组、组合人抗体文库例如酵母展示文库分离的抗体,和(d)通过包括剪接人免疫球蛋白基因至其他dna序列的任意其他方式制备、表达、产生或分离的抗体。这些重组人抗体具有构架区和cdr区源自人种系免疫球蛋白序列的可变区。然而,在某些实施方案中,可以对重组人抗体进行体外诱变(或使用人ig序列转基因动物时为体内体细胞诱变),由此得到的重组抗体的vh和vl区的氨基酸序列,尽管源自人种系vh和vl序列并与之相关、但是并不天然存在于体内的人抗体种系库中。术语“单克隆抗体”在本文中指,得自基本上同质的抗体群体的抗体,即,除了通常以很少量存在的可能变体抗体(例如,含有天然突变或在单克隆抗体制品的生产过程中产生的变体抗体)以外,构成所述群体的各个抗体是相同的和/或结合相同表位。术语“嵌合抗体”是指可变区序列源自一物种、恒定区序列源自另一物种的抗体,例如,其中可变区序列源自小鼠抗体、恒定区序列源自人抗体的抗体。术语“人源化抗体”是指将源自其他哺乳动物物种例如小鼠种系的cdr序列接到人构架序列上的抗体。可以在人构架序列内进行额外的构架区修饰。“分离的”抗体是已经与它的天然环境中的组分分离的抗体。在一些实施方案中,将抗体纯化至大于95%或99%纯度,所述纯度通过例如电泳(例如,sds-page、等电聚焦(ief)、毛细管电泳)或色谱(例如,离子交换或反相hplc)确定。关于评价抗体纯度的方法的综述,参见,例如,flatman,s.等,j.chrom.b848(2007)79-87。术语“表位”是指抗体所结合的抗原区域。表位可以由连续的氨基酸形成或者通过蛋白的三级折叠而并置的非连续氨基酸形成。术语“淋巴细胞活化基因-3”和“lag-3”可互换使用,包括lag-3的变体、同种型、同源物、和物种同源物。术语“人lag-3”指的是人序列lag-3,例如,genbank登录号np_002277下的人lag-3的完整氨基酸序列。人lag-3序列可以不同于genbank登录号np_002277的人lag-3,在序列上具有例如保守突变或在非保守区中的突变,但仍具有基本上相同的生物功能,例如,在胞外域中具有与本发明抗体特异结合的表位,或具有与mhcii类分子结合的功能。一般而言,人lag-3序列与genbank登录号np_002277的人lag-3氨基酸序列具有至少90%同一性,并且含有当与其它物种(鼠)的lag-3氨基酸序列进行比较时可以将其鉴定为人的氨基酸序列的氨基酸残基。在一些实施方案中,人lag-3序列与genbank登录号np_002277的人lag-3氨基酸序列具有至少95%,甚至至少96%,97%,98%,或99%氨基酸序列同一性。lag-3蛋白也可包括lag-3的片段,诸如包含胞外结构域以及胞外结构域的片段,例如保持与本发明任何抗体结合能力的片段,例如可溶性lag-3分子。术语“免疫应答”是指,例如淋巴细胞、抗原呈递细胞、吞噬细胞、粒细胞、和上述细胞或肝脏产生的可溶性大分子(包括抗体、细胞因子和补体)的作用,该作用导致选择性的损伤、破坏、或清除入侵的病原体、感染了病原体的细胞或组织、或癌细胞。术语“特异性结合”表示抗体选择性地或优先地结合抗原。如果在生物光干涉测量中,抗体以大约5x10-7m或更低、大约1x10-7m或更低、大约5x10-8m或更低、大约1x10-8m或更低、大约5x10-9m或更低的kd,与人lag-3结合,则该抗体是“与人lag-3特异性结合”的抗体。然而,特异性结合人lag-3的抗体可以与来自其它物种的lag-3蛋白具有交叉反应性。例如,特异于人lag-3的抗体,在一些实施方案中,可以与非人物种的lag-3蛋白交叉反应。在另一些实施方案中,特异于人lag-3的抗体可以完全特异于人lag-3而不表现出物种或其它类型的交叉反应性,或仅表现出对某些物种的lag-3的交叉反应性。“亲和力”或“结合亲和力”指反映结合对子的成员之间相互作用的固有结合亲和力。分子x对其配偶物y的亲和力可以通常由平衡解离常数(kd)代表,平衡解离常数是解离速率常数和结合速率常数(分别是kdis和kon)的比值。亲和力可以由本领域已知的常见方法测量。用于测量亲和力的一个具体方法是本文中的fortebio动力学结合测定法。术语“高亲合力”对于igg抗体指,该抗体以1x10-7m或更低、优选地5x10-8m或更低、更优选地大约1x10-8m或更低、甚至更优选地大约5x10-9m或更低的kd,与靶抗原结合。然而,“高亲合力”结合可以随抗体同种型而变。例如对于igm同种型,“高亲合力”指抗体具有1x10-6m或更低、优选地1x10-7m或更低、更优选地大约1x10-8m或更低的kd。与结合例如lag-3的抗原的参考抗体“竞争结合的抗体”是指这样的抗体,所述抗体在竞争检验中阻断参考抗体与抗原(例如lag-3)结合的50%或更多,并且反过来,参考抗体在竞争检验中阻断该抗体与抗原(例如lag-3)结合的50%或更多。示例性竞争检验描述于:“antibodies”,harlowandlane(coldspringharborpress,coldspringharbor,ny)。竞争结合的抗体可以与参考抗体结合相同的表位区,例如相同表位、相邻表位或重叠表位。本文中的术语“fc区”用于定义含有至少一部分的恒定区的免疫球蛋白重链的c-端区域。该术语包括天然序列fc-区和变体fc-区。在一个实施方案中,人igg重链fc-区从重链的cys226或从pro230延伸至羧基端。然而,fc-区的c-端赖氨酸(lys447)可以存在或可以不存在。除非本文中另外指出,fc-区或恒定区中的氨基酸残基的编号根据eu编号系统,也称为eu索引,如kabat,e.a.等,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md(1991),nihpublication91-3242中所述。与抗体相关的术语“变体”在本文中指,与参考抗体相比,包含已经通过至少1个,例如1-30,或1-20或1-10个,例如1或2或3或4或5个氨基酸取代、缺失和/或插入而具有氨基酸改变的目标抗体区域的抗体,其中变体基本上保持改变之前的抗体分子的至少一个生物学特性(例如,抗原结合能力)。目标抗体区域可以是抗体全长、或重链可变区或轻链可变区或其组合、或(一个或多个)重链cdr区或(一个或多个)轻链cdr区或其组合。在本文中,相对于参考抗体区域具有氨基酸改变的抗体区域,也称作该抗体区域的“变体”。在本文中,“序列同一性”是指在比较窗中以逐个核苷酸或逐个氨基酸为基础的序列相同的程度。可以通过以下方式计算“序列同一性百分比”:将两条最佳比对的序列在比较窗中进行比较,确定两条序列中存在相同核酸碱基(例如,a、t、c、g、i)或相同氨基酸残基(例如,ala、pro、ser、thr、gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、gln、cys和met)的位置的数目以得到匹配位置的数目,将匹配位置的数目除以比较窗中的总位置数(即,窗大小),并且将结果乘以100,以产生序列同一性百分比。为了确定序列同一性百分数而进行的最佳比对,可以按本领域已知的多种方式实现,例如,使用可公开获得的计算机软件如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可以确定用于比对序列的适宜参数,包括为实现正在比较的全长序列范围内或目标序列区域内最大比对所需要的任何算法。在本发明中,就抗体序列而言,氨基酸序列同一性百分数通过将候选抗体序列与参考抗体序列最佳比对后,在一个优选方案中按照kabat编号规则进行最佳比对后,予以确定。比对后,将参考抗体上的目标抗体区域(例如,重链或轻链的整个可变区、或其部分例如一个或多个cdr区)与候选抗体上的对应区域进行比较。候选抗体区域和参考抗体区域之间的序列同一性百分数为:在候选抗体区域和参考抗体区域两者中被相同氨基酸占据的位置的数目除以两个区域的比对位置总数(空位不计入)并乘以100得到的百分数。因此,在本文中,如果一个候选抗体与参考抗体经比对后在与参考抗体的目标抗体区域相对应的区域上具有x%的序列同一性时,则视为所述候选抗体为与参考抗体在目标抗体区域上具有x%序列同一性的抗体。在本文中,在不指定目标抗体区域的情况下,将适用于在参考抗体序列的全长上进行比对。在一些实施方案中,就抗体而言,序列同一性可以分布在整个重链可变区和/或整个轻链可变区上,或序列百分数同一性可以仅限定于构架区,而对应cdr区的序列保持100%相同。类似地,就抗体序列而言,基于比对,可以确定相对于参考抗体在目标抗体区域具有氨基酸改变的候选抗体。因此,在本文中,如果一个候选抗体与参考抗体经比对后在与参考抗体的目标抗体区域(如cdr区)相对应的区域上具有x个氨基酸改变时,则视为所述候选抗体是与参考抗体在目标抗体区域上具有x个氨基酸改变的抗体。当x为0时,则视为所述候选抗体与参考抗体具有相同的目标抗体区域,例如,当目标抗体区域为cdr序列时,则视为候选抗体是与参考抗体具有相同cdr序列的抗体。在本发明中,“保守性取代”是指导致某个氨基酸置换为化学上相似的氨基酸的氨基酸改变。可以通过本领域已知的标准方法,例如定点诱变和pcr介导的诱变,将氨基酸修饰如取代引入本发明的抗体中。提供功能上相似氨基酸的保守性置换表是本领域熟知的。在一个优选的方面,保守取代残基来自以下的保守替代表a,优选地为表a中所示的优选保守取代残基。表a原始残基示例性取代优选的保守取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;asp;lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnaspgly(g)alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;phe;正亮氨酸leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)trp;leu;val;ile;ala;tyrtyrpro(p)alaalaser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu本发明的各方面将在下面各小节中进一步详述。i.本发明的抗lag-3抗体本发明一方面提供特异性地结合lag-3,优选人lag-3蛋白质的抗体或其抗原结合片段,尤其是全人源抗体或其片段。在一些实施方案中,本发明抗体的抗原结合片段是选自以下的抗体片段:fab、fab’、fab’-sh、fv、单链抗体例如scfv、(fab’)2片段、单结构域抗体、双抗体(dab)或线性抗体。抗体的有利生物性质在一些实施方案中,本发明的抗lag-3抗体或其片段以高亲和力与人lag-3结合,例如,解离平衡常数(kd)小于约100nm,小于或等于大约50nm,更优选地小于或等于大约20nm、15nm或10nm,例如0.1-20nm,更优选地小于或等于大约5nm、4nm、3nm或2nm,优选0.5-3nm,甚至更优选地,小于或等于大约1nm、0.5nm。优选地,kd通过使用生物光干涉测定法(例如fortebio亲和测量法)测定。在一些实施方案中,本发明抗体或其片段与人lag-3结合的解离常数(kdis)小于100×10-4、60×10-4、例如0.5×10-4至50×10-4,优选1×10-4至10×10-4,或1×10-4至6×10-4s-1,例如约5×10-4s-1。在一些实施方案中,抗lag-3抗体分子与人lag-3结合的结合常数(kon)大于0.5×105、1×105、2×105、3×105、4×105或5×105m-1s-1,例如以约5×105m-1s-1的kon与人lag-3结合。优选地,kdis和kon通过使用生物光干涉测定法(例如fortebio亲和测量法)测定。在一些实施方案中,本发明抗体或其片段以高亲和力结合表达lag-3的细胞。在一个实施方案中,表面表达人lag-3的细胞是293细胞,例如hek293细胞。优选地,以流式细胞术(例如facs)测定,抗体与表达人lag-3的hek293细胞结合的ec50值小于大约50nm、30nm或10m,例如0.1-10nm,优选地,小于或等于大约8nm、5nm、3nm、或2nm,更优选地小于或等于大约1.5nm、1.2nm或1nm,甚至更优选地小于或等于大约0.8nm、0.6nm、0.3m或0.2nm。在一些实施方案中,本发明抗体或其片段抑制lag-3的相关活性,例如ic50值小于或等于大约20nm、10nm、9nm、8nm、7nm、6nm或5nm,更优选ic50小于或等于大约1-7nm、1-5nm、6.5nm、6nm、5.5nm、5nm、4.5nm、4nm、3.5nm、或3nm。在一些实施方案中,lag-3的相关活性是mhcii类分子与lag-3的结合。在一些实施方案中,本发明的抗体或其片段以小于或等于大约20nm、10nm,例如1-9nm、如1-8nm,更优选大约1-7nm、1-2nm、例如,小于或等于6.5nm、6nm、5.5nm、5nm、4.5nm、4nm、3.5nm或3nm的ic50,阻断人lag-3与表达mhcii类分子的细胞上的mhcii类分子的结合。在一些实施方案中,mhcii类分子是hla-dr。在一些实施方案中,细胞为cho细胞。在一些实施方案中,用流式细胞术(例如facs)测量本发明抗体或其片段对lag-3的相关活性的抑制。在一些实施方案中,本发明抗体或其片段结合表面表达人lag-3的激活的cd4+和/或cd8+t细胞。优选地,以流式细胞术(例如facs)测定,抗体与激活的人cd4+t细胞结合的ec50值小于或等于大约35pm、30pm、25pm、20pm、15pm、或10pm,优选大约1-20pm、6-15pm、6-10pm,例如小于或等于大约12pm、11pm、10pm、9pm、8pm、7pm、6pm或5pm。在一些实施方案中,在accuric6系统中进行流式细胞术。在一些实施方案中,本发明的抗体或其片段抑制lag-3的一种或多种活性,例如,导致以下一种或多种:cd4+t淋巴细胞的抗原依赖性刺激增加;t细胞增殖增加;活化抗原(例如,cd25)的表达增加;细胞因子(例如,干扰素-γ(ifn-γ)、白介素-2(il-2)或白介素-4(il-4))的表达增加;趋化因子(例如,ccl3、ccl4或ccl5)的表达增加;treg细胞的阻抑活性减少;t细胞稳态增加;肿瘤浸润型淋巴细胞增加;或癌细胞的免疫逃避减少。在一些实施方案中,本发明的抗体或其片段抑制表达人lag-3的肿瘤细胞的生长。在一个实施方案中,肿瘤细胞是皮肤癌细胞,优选人皮肤癌细胞。例如,在体内肿瘤移植模型中,例如nog小鼠中,抑制人皮肤癌细胞的生长。在一些实施方案中,本发明抗体与抗pd1抗体联用,获得显著好于单独一种抗体施用时的抗肿瘤效果。优选地,本发明抗体或其抗原结合片段表现出上述性质中的至少一个、更优选地至少二个、更优选地至少三个、四个、或五个,甚至更优选地上述所有性质。抗体cdr区“互补决定区”或“cdr区”或“cdr”(在本文中与超变区“hvr”可以互换使用),是抗体可变区中主要负责与抗原表位结合的氨基酸区域。重链和轻链的cdr通常被称作cdr1、cdr2和cdr3,从n-端开始顺序编号。位于抗体重链可变结构域内的cdr被称作hcdr1、hcdr2和hcdr3,而位于抗体轻链可变结构域内的cdr被称作lcdr1、lcdr2和lcdr3。本领域公知多种用于在一个给定的vh或vl氨基酸序列中确定其cdr序列的方案。例如,kabat互补决定区(cdr)是基于序列变异性确定的并且是最常用的(kabat等人,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))。而chothia指的是结构环的位置(chothia和lesk,j.mol.biol.196:901-917(1987))。abmhvr是kabathvr和chothia结构环之间的折中,并且由oxfordmolecular的abm抗体建模软件使用。“接触性”(contact)hvr基于对可获得的复杂晶体结构的分析。根据不同的cdr确定方案,这些hvr中的每一个hvr/cdr的残基如下所述。hvr也可以是根据kabat编号系统位于如下kabat残基位置的hvr序列:vl中的位置24-36或24-34(lcdr1),位置46-56或50-56(lcdr2),和位置89-97或89-96位置(lcdr3);和vh中的位置26-35或27-35b(hcdr1),位置50-65或49-65(hcdr2),和位置93-102、94-102或95-102(hcdr3)。在一个实施方案中,本发明抗体的hvr是根据kabat编号系统位于如下kabat残基位置的hvr序列:vl中的位置24-34(lcdr1)、位置50-56(lcdr2)、和位置89-97(lcdr3),以及vh中的位置27-35b(hcdr1)、位置50-65(hcdr2)、和位置93-102(hcdr3)。在一个实施方案中,本发明抗体的hvr是根据kabat编号系统位于如下kabat残基位置的hvr序列:vl中的位置24-34(lcdr1)、位置50-56(lcdr2)、和位置89-97(lcdr3),以及vh中的位置26-35b(hcdr1)、位置50-65(hcdr2)、和位置95-102(hcdr3)。hvr也可以基于与参考cdr序列(例如本发明示例性cdr之任一)具有相同的kabat编号位置而确定。除非另有说明,否则在本发明中,术语“cdr”或“cdr序列”或“hvr”或“hvr序列”涵盖以上述任一种方式确定的hvr或cdr序列。除非另有说明,否则在本发明中,当提及抗体可变区中的残基位置(包括重链可变区残基和轻链可变区残基)时,是指根据kabat编号系统(kabat等人,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))的编号位置。在一个优选的实施方案中,本发明cdr序列如表1所示;在一个最优选的实施方案中,本发明cdr序列如表2所示。具有不同特异性(即,针对不同抗原的不同结合位点)的抗体具有不同的cdr。然而,尽管cdr在抗体与抗体之间是不同的,但是cdr内只有有限数量的氨基酸位置直接参与抗原结合。使用kabat,chothia,abm和contact方法中的至少两种,可以确定最小重叠区域,从而提供用于抗原结合的“最小结合单位”。最小结合单位可以是cdr的一个子部分。正如本领域技术人员明了,通过抗体的结构和蛋白折叠,可以确定cdr序列其余部分的残基。因此,本发明也考虑本文所给出的任何cdr的变体。例如,在一个cdr的变体中,最小结合单位的氨基酸残基可以保持不变,而根据kabat或chothia定义的其余cdr残基可以被保守氨基酸残基替代。在一些实施方案中,本发明的抗体有至少一个、两个、三个、四个、五个或六个cdr与表3所列任一抗体的对应cdr相同,或是其变体。在一些实施方案中,本发明的抗体有至少一个、两个、或三个hcdr与表3所列任一抗体的对应重链cdr相同,或是其变体。在一些实施方案中,本发明的抗体有至少一个、两个、或三个lcdr与表3所列任一抗体的对应轻链cdr相同,或是其变体。在本文中,“对应cdr”是指,在最佳比对后,在候选抗体的可变区氨基酸序列中与参考抗体的cdr位于最相似位置上的cdr。在本文中,cdr变体是已经通过至少一个,例如1或2或3个氨基酸取代、缺失和/或插入而修饰的cdr,其中包含cdr变体的抗原结合分子基本上保持包含未修饰cdr的抗原结合分子的生物学特性,例如,保持至少60%,70%,80%,90%,或100%的生物学活性(例如抗原结合能力)。可以理解,各cdr可以单独修饰或组合修饰。优选地,氨基酸修饰为氨基酸取代,尤其是保守氨基酸取代,例如表a中列出的优选保守氨基酸置换。在一些实施方案中,氨基酸取代优选发生在与本文提供的共有cdr序列(例如,seqidno:16,17,18,19,20,21,30,31,32)的x残基相对应的氨基酸位置上。此外,本领域已知,cdr3区,独立于cdr1和/或cdr2区,单独可以确定抗体对关联抗原的结合特异性。并且,可以基于共同cdr3序列,可产生具有相同结合特异性的多种其它抗体。参见例如,uspatentsnos.6,951,646;6,914,128;6,090,382;6,818,216;6,156,313;6,827,925;5,833,943;5,762,905和5,760,185。所有这些参考文献并入本文作为参考。因此,在一个实施方案中,本发明抗体包含来自表3所示抗体之一的重链和/或轻链可变区的cdr3,其中所述抗体能够特异地结合人lag-3。在再一实施方案中,所述抗体还可以包含来自同一抗体的重链和/或轻链可变区的cdr2,或来自不同的lag-3抗体的重链和/或轻链可变区的cdr2。在再一实施方案中,所述抗体还可以包含来自同一抗体的重链和/或轻链可变区的cdr1,或来自不同的lag-3抗体的重链和/或轻链可变区的cdr1。可以通过本文描述的测定方法,表征这些抗体的活性,包括与人lag-3的结合活性、阻断lag-3与mhcii类分子结合的活性、抑制肿瘤生长的活性。再一方面,考虑到抗原结合特异性主要由cdr1、2和3区提供,在一些实施方案中,可以将vhcdr1、2和3序列和vlcdr1、2和3序列“混合并匹配”(即,可以混合并匹配来自结合同一lag-3抗原的不同抗体的cdr,不过每种抗体优选地含有vhcdr1、2和3和vlcdr1、2和3),以产生结合lag-3的本发明其他分子。可以使用本领域已知的结合测定法(例如,elisa、set、biacore)和实施例中描述的那些测定法,测试这类“混合和匹配的”抗体与lag-3的结合。当混合并匹配vhcdr序列时,来自特定vh序列的cdr1、cdr2和/或cdr3序列优选地替换为结构上相似的cdr序列。同样,当混合并匹配vlcdr序列时,来自特定vl序列的cdr1、cdr2和/或cdr3序列优选地替换为结构上相似的cdr序列。可以在本发明表3所示抗体之间进行cdr的“混合和匹配”。此外,本领域技术人员明了,也可以通过用来自其它不同抗体的一个或多个vh和/或vlcdr区序列,置换本文中所示抗体的结构上相似的cdr序列,以产生本发明的其它抗体。因此,在一些实施方案中,本发明的抗体或其抗原结合片段包含重链可变区,所述重链可变区包含重链互补决定区3(hcdr3),所述hcdr3:(i)与表3列出的任一抗体的重链可变区的hcdr3相同;或(ii)相对于(i)的hcdr3,包含至少1个且不超过3个(优选1-2个或更优选1个)氨基酸改变(优选取代、更优选保守取代)。优选地,所述hcdr3包含选自seqidno:3,6,9,12,15,18和21的氨基酸序列,或由其组成。在一些实施方案中,本发明的抗体或其抗原结合片段包含重链可变区和轻链可变区,且所述抗体的重链互补决定区3(hcdr3)和轻链互补决定区3(lcdr3):(i)与表3列出的任一抗体的重链和轻链可变区序列的hcdr3和lcdr3相同;或(ii)相对于(i)的hcdr3和lcdr3,共包含至少1个且不超过3个(优选1-2个或更优选1个)氨基酸改变(优选取代、更优选保守取代)。优选地,所述hcdr3和lcdr3包含选自以下的氨基酸序列组合:seqidno:3/24,6/24,18/24,9/25,9/26,9/30,12/28,15/29和21/32的氨基酸序列。在一个实施方案中,本发明抗体或其抗原结合片段包含重链可变区(vh),其中所述vh包含:(i)表3所列任一抗体的vh序列中所含的hcdr1、hcdr2和hcdr3序列;或(ii)相对于(i)的序列,在所述三个cdr区上共包含至少一个且不超过10或5、4、3、2、1个氨基酸改变(优选氨基酸取代,优选保守取代)的序列。在另一个实施方案中,本发明抗体或其抗原结合片段包含轻链可变区(vl),其中所述vl包含:(i)表3所列任一抗体的vl序列中所含的lcdr1、lcdr2和lcdr3序列;或(ii)相对于(i)的序列,在所述三个cdr区上共包含至少一个且不超过10或5、4、3、2、1个氨基酸改变(优选氨基酸取代,优选保守取代)的序列。在另一个实施方案中,本发明抗体或其抗原结合片段包含重链可变区和轻链可变区,其中所述抗体包含:(i)与表3所列任一抗体的vh和vl序列中所含的6个cdr序列分别相同的6个cdr序列;或(ii)相对于(i)的序列,在6个cdr区上共包含至少一个且不超过20、10或5、4、3、2、1个氨基酸改变(优选氨基酸取代,优选保守取代)的序列。在一个实施方案中,本发明抗体或其抗原结合片段包含:(i)如seqidno:33或34所示的重链可变区的3个互补决定区hcdr,以及如seqidno:39所示的轻链可变区的3个互补决定区lcdr,或者(ii)如seqidno:35或36所示的重链可变区的3个互补决定区hcdr,以及如seqidno:40或41所示的轻链可变区的3个互补决定区lcdr;或者(iii)如seqidno:37或38所示的重链可变区的3个互补决定区hcdr,以及如seqidno:42或43所示的轻链可变区的3个互补决定区lcdr。在一个优选实施方案中,本发明抗体或其抗原结合片段包含重链可变区和轻链可变区,其中重链可变区包含来自seqidno:33的重链可变区的cdr1序列,cdr2序列,和cdr3序列,且轻链可变区包含来自seqidno:39的轻链可变区的cdr1序列,cdr2序列,和cdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含重链可变区和轻链可变区,其中重链可变区包含来自seqidno:34的重链可变区的cdr1序列,cdr2序列,和cdr3序列,且轻链可变区包含来自seqidno:39的轻链可变区的cdr1序列,cdr2序列,和cdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含重链可变区和轻链可变区,其中重链可变区包含来自seqidno:35的重链可变区的cdr1序列,cdr2序列,和cdr3序列,且轻链可变区包含来自seqidno:40的轻链可变区的cdr1序列,cdr2序列,和cdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含重链可变区和轻链可变区,其中重链可变区包含来自seqidno:36的重链可变区的cdr1序列,cdr2序列,和cdr3序列,且轻链可变区包含来自seqidno:41的轻链可变区的cdr1序列,cdr2序列,和cdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含重链可变区和轻链可变区,其中重链可变区包含来自seqidno:37的重链可变区的cdr1序列,cdr2序列,和cdr3序列,且轻链可变区包含来自seqidno:42的轻链可变区的cdr1序列,cdr2序列,和cdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含重链可变区和轻链可变区,其中重链可变区包含来自seqidno:38的重链可变区的cdr1序列,cdr2序列,和cdr3序列,且轻链可变区包含来自seqidno:43的轻链可变区的cdr1序列,cdr2序列,和cdr3序列。在一个实施方案中,本发明抗lag-3抗体或其抗原结合片段包含重链可变区(vh),其中所述vh包含(i)选自以下氨基酸序列组合的重链hcdr组合(按顺序分别为hcdr1、hcdr2和hcdr3):seqidnos:1/2/3,seqidnos:4/5/6,seqidnos:16/17/18,seqidnos:7/8/9,seqidnos:10/11/12,seqidnos:13/14/15,和seqidnos:19/20/21;或(ii)选自以下氨基酸序列组合的重链hcdr组合(按顺序分别为hcdr1、hcdr2和hcdr3):seqidnos:70/2/71,seqidnos:72/5/73,seqidnos:74/8/75,seqidnos:76/11/77,和seqidnos:78/14/79;或(iii)(i)或(ii)的hcdr组合的变体,所述变体在所述三个cdr区上共包含至少一个且不超过10或5、4、3、2、1个氨基酸改变(优选氨基酸取代,优选保守取代)。在另一个实施方案中,本发明抗lag-3抗体或其抗原结合片段包含轻链可变区(vl),其中所述vl包含:(i)选自以下氨基酸序列组合的轻链lcdr组合(按顺序分别为lcdr1、lcdr2和lcdr3):seqidnos:22/23/24,seqidnos:31/23/24,seqidnos:22/23/25,seqidnos:22/23/26,seqidnos:31/23/30,seqidnos:27/23/28,seqidnos:27/23/29,和seqidnos:31/23/32;(ii)(i)的lcdr组合的变体,所述变体在所述三个cdr区上共包含至少一个且不超过10或5、4、3、2、1个氨基酸改变(优选氨基酸取代,优选保守取代)。在另一个实施方案中,本发明抗lag-3抗体或其抗原结合片段包含:(i)选自以下氨基酸序列组合的重链和轻链cdr组合(按顺序分别为hcdr1、hcdr2和hcdr3、lcdr1、lcdr2和lcdr3):seqidnos:1/2/3/22/23/24,seqidnos:4/5/6/22/23/24,seqidnos:16/17/18/31/23/24,seqidnos:7/8/9/22/23/25,seqidnos:7/8/9/22/23/26,seqidnos:7/8/9/31/23/30,seqidnos:10/11/12/27/23/28,seqidnos:13/14/15/27/23/29,和seqidnos:19/20/21/31/23/32;或(ii)选自以下氨基酸序列组合的重链和轻链cdr组合(按顺序分别为hcdr1、hcdr2和hcdr3、lcdr1、lcdr2和lcdr3):seqidnos:70/2/71/22/23/24,seqidnos:72/5/73/22/23/24,seqidnos:74/8/75/22/23/25,seqidnos:74/8/75/22/23/26,seqidnos:74/8/75/31/23/30,seqidnos:76/11/77/27/23/28,和seqidnos:78/14/79/27/23/29;(ii)(i)的重链和轻链cdr组合的变体,所述变体在所述六个cdr区上共包含至少一个且不超过10或5、4、3、2、1个氨基酸改变(优选氨基酸取代,优选保守取代)。在一个优选实施方案中,本发明抗体或其抗原结合片段包含重链可变区的3个互补决定区hcdr,以及轻链可变区的3个互补决定区lcdr,其中(i)hcdr1包含seqidno:1或4或16或70或72所示的氨基酸序列,hcdr2包含seqidno:2或5或17所示的氨基酸序列,hcdr3包含seqidno:3或6或18或71或73所示的氨基酸序列,lcdr1包含seqidno:22或31所示的氨基酸序列,lcdr2包含seqidno:23所示的氨基酸序列,且lcdr3包含seqidno:24所示的氨基酸序列;或者(ii)hcdr1包含seqidno:7或74所示的氨基酸序列,hcdr2包含seqidno:8所示的氨基酸序列,hcdr3包含seqidno:9或75所示的氨基酸序列,lcdr1包含seqidno:22或31所示的氨基酸序列,lcdr2包含seqidno:23所示的氨基酸序列,且lcdr3包含seqidno:25或26或30所示的氨基酸序列;或者(iii)hcdr1包含seqidno:10或13或19或76或78所示的氨基酸序列,hcdr2包含seqidno:11或14或20所示的氨基酸序列,hcdr3包含seqidno:12或15或21或77或79所示的氨基酸序列,lcdr1包含seqidno:27或31所示的氨基酸序列,lcdr2包含seqidno:23所示的氨基酸序列,且lcdr3包含seqidno:28或29或32所示的氨基酸序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:1的hcdr1序列;seqidno:2的hcdr2序列;seqidno:3的hcdr3序列;seqidno:22的lcdr1序列;seqidno:23的lcdr2序列;seqidno:24的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:70的hcdr1序列;seqidno:2的hcdr2序列;seqidno:71的hcdr3序列;seqidno:22的lcdr1序列;seqidno:23的lcdr2序列;seqidno:24的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:4的hcdr1序列;seqidno:5的hcdr2序列;seqidno:6的hcdr3序列;seqidno:22的lcdr1序列;seqidno:23的lcdr2序列;seqidno:24的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:72的hcdr1序列;seqidno:5的hcdr2序列;seqidno:73的hcdr3序列;seqidno:22的lcdr1序列;seqidno:23的lcdr2序列;seqidno:24的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:7的hcdr1序列;seqidno:8的hcdr2序列;seqidno:9的hcdr3序列;seqidno:22的lcdr1序列;seqidno:23的lcdr2序列;seqidno:25的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:74的hcdr1序列;seqidno:8的hcdr2序列;seqidno:75的hcdr3序列;seqidno:22的lcdr1序列;seqidno:23的lcdr2序列;seqidno:25的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:7的hcdr1序列;seqidno:8的hcdr2序列;seqidno:9的hcdr3序列;seqidno:22的lcdr1序列;seqidno:23的lcdr2序列;seqidno:26的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:74的hcdr1序列;seqidno:8的hcdr2序列;seqidno:75的hcdr3序列;seqidno:22的lcdr1序列;seqidno:23的lcdr2序列;seqidno:26的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:10的hcdr1序列;seqidno:11的hcdr2序列;seqidno:12的hcdr3序列;seqidno:27的lcdr1序列;seqidno:23的lcdr2序列;seqidno:28的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:76的hcdr1序列;seqidno:11的hcdr2序列;seqidno:77的hcdr3序列;seqidno:27的lcdr1序列;seqidno:23的lcdr2序列;seqidno:28的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:13的hcdr1序列;seqidno:14的hcdr2序列;seqidno:15的hcdr3序列;seqidno:27的lcdr1序列;seqidno:23的lcdr2序列;seqidno:29的lcdr3序列。在一个优选实施方案中,本发明抗体或其抗原结合片段包含:seqidno:78的hcdr1序列;seqidno:14的hcdr2序列;seqidno:79的hcdr3序列;seqidno:27的lcdr1序列;seqidno:23的lcdr2序列;seqidno:29的lcdr3序列。抗体可变区“可变区”或“可变结构域”是抗体的重链或轻链中参与抗体与其抗原的结合的结构域。重链可变区(vh)和轻链可变区(vl)可以进一步再划分为高变区(hvr,又称作互补决定区(cdr)),其间插有较保守的区域(即,构架区(fr))。每个vh和vl由三个cdr和4个fr组成,从氨基端到羧基端以如下顺序排列:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。在一些情况下,单个vh或vl结构域足以赋予抗原-结合特异性。此外,结合特定抗原的抗体可以使用来自结合所述抗原的抗体的vh或vl结构域筛选互补vl或vh结构域文库而分离(参见,例如,portolano,s.等,j.immunol.150(1993)880-887;clackson,t.等,nature352(1991)624-628)。本领域已知,可以对两个可变区之一或两者(即vh和/或vl)中的一个或多个残基进行修饰,例如,对一个或多个cdr区和/或对一个或多个构架区进行残基修改,尤其是保守残基取代,而修饰后的抗体仍基本上保持改变之前的抗体分子的至少一个生物学特性(例如,抗原结合能力)。例如,可以突变cdr区的残基,改善抗体的一种或多种结合性质(例如亲和性)。可以在体外或体内测定试验中,评估突变后的抗体的抗体结合性质或其它功能性质。优选地,引入保守替代。优选地,在cdr区中引入的残基改变不超过1个、2个、3个、4个或5个。此外,可以突变构架区残基,例如以改善抗体的性质。例如,可以将一个或多个构架残基“回复突变”为对应的种系序列残基。cdr移植是本领域已知的另一种抗体可变区修饰方式。由于cdr序列负责大多数抗体-抗原相互作用,故可以构建模拟已知抗体的性质的重组抗体变体。在该抗体变体中,来自已知抗体的cdr序列被移植到具有不同性质的不同抗体的构架区上。因此,在一个实施方案中,本发明涉及这样的抗lag-3抗体或其抗原结合片段,所述抗体包含来自表3抗体之一的重链和轻链cdr序列,但具有不同的构架区序列。可以从公共dna数据库,包括种系抗体基因序列,或从公开文献报道的lag-3抗体序列,获得用于替换的构架区序列。例如,可以从genbank数据库获得编码人重链和轻链可变区基因的种系dna。可以将抗体蛋白序列与数据库中的蛋白序列,使用序列相似性检索工具,例如gappedblast,进行比较。优选,用于替代的构架序列,与选择进行改变的本发明抗体的构架序列,具有结构相似性,例如,具有序列同一性至少80%,85%,90%,或95%、96%、97%、98%、99%以上的构架序列。在再一实施方案中,可以“混合并匹配”来自本发明示例性抗体(表3所示抗体之一)与其它不同抗lag-3抗体(优选地,表3所示另一抗体)的vh和vl序列,以产生结合lag-3的本发明其他抗体。在混合和匹配这些链时,优选地,将来自具体vh/vl配对的vh序列替换为结构相似的vh序列。同样,来自特定vh/vl配对的vl序列优选地替换为结构上相似的vl序列。可以使用本领域已知的结合测定法(例如,elisa,和实施例部分中描述的其他测定法)测试这类“混合和匹配的”抗体与lag-3的结合。因此,在一个实施方案中,本发明的抗体包含重链可变区vh序列,所述vh序列包含选自seqidnos:33,34,35,36,37和38所示的氨基酸序列,或由所述氨基酸序列组成。在再一实施方案中,本发明的抗体包含所述vh序列的变体。在另一个实施方案中,本发明的抗体包含轻链可变区vl序列,所述vl序列包含选自seqidnos:39,40,41,42和43所示的氨基酸序列,或由所述氨基酸序列组成。在再一实施方案中,本发明的抗体包含所述vl序列的变体。在再一实施方案中,本发明的抗体包含重链和轻链可变区vh/vl序列对,其中vh序列(i)包含选自seqidnos:33,34,35,36,37和38所示的氨基酸序列,或由所述氨基酸序列组成,或(ii)是(i)的vh序列的变体;且vl序列包含(i)选自seqidnos:39,40,41,42和43所示的氨基酸序列,或由所述氨基酸序列组成,或(ii)是(i)的vl序列的变体。在一个优选的实施方案中,本发明的抗体包含选自以下的重链可变区和轻链可变区序列对:(a)包含seqidno:33的氨基酸序列的vh序列或其变体,和包含seqidno:39的氨基酸序列的vl序列或其变体;(b)包含seqidno:34的氨基酸序列的vh序列或其变体,和包含seqidno:39的氨基酸序列的vl序列或其变体;(c)包含seqidno:35的氨基酸序列的vh序列或其变体,和包含seqidno:40的氨基酸序列的vl序列或其变体;(d)包含seqidno:36的氨基酸序列的vh序列或其变体,和包含seqidno:41的氨基酸序列的vl序列或其变体;(e)包含seqidno:37的氨基酸序列的vh序列或其变体,和包含seqidno:42的氨基酸序列的vl序列或其变体;(f)包含seqidno:38的氨基酸序列的vh序列或其变体,和包含seqidno:43的氨基酸序列的vl序列或其变体。在一个实施方案中,vh序列的变体在氨基酸序列上,与参考vh序列相比,(优选地,在全长上或在cdr1、2和3三个区域上),具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性。在一个实施方案中,vh序列的变体在氨基酸序列上,与参考vh序列相比,(优选地,在全长上或在cdr1、2和3三个区域上),包含至少一个且不超过30个、10个、或5、4、3、2、1、0氨基酸改变(优选氨基酸取代,优选保守取代)。优选地序列差异不发生在cdr区中。在一个优选的实施方案中,vl序列的变体在氨基酸序列上,与参考vl序列相比,(优选地,在全长上或在cdr1、2和3三个区域上),具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性。在一个优选的实施方案中,vl序列的变体在氨基酸序列上,与参考vl序列相比,(优选地,在全长上或在cdr1、2和3三个区域上),包含至少一个且不超过30个、10个、或5、4、3、2、1、0氨基酸改变(优选氨基酸取代,优选保守取代)。优选地序列差异不发生在cdr区中。在一个优选的实施方案中,本发明的抗体包含重链可变区和轻链可变区vh/vl序列对,所述vh/vl序列对包含选自以下的氨基酸序列对:seqidnos:33/39,34/39,35/40,36/41,37/42,和38/43,或由所述氨基酸序列对组成。本发明也提供该抗体的变体,例如在vh、vl或vh和vl上具有至少95-99%同一性或包含不超过10个氨基酸改变的变体。在上述任一实施方案中,优选地,相对于参考抗体,抗体变体的重链可变区在1个或多个cdr(优选全部3个cdr)区域上包含不超过10个,优选不超过5个(例如,3、2、1或0个)氨基酸改变(优选氨基酸取代,优选保守取代)。在上述任一实施方案中,优选地,相对于参考抗体,抗体变体的轻链可变区vl在1个或多个cdr(优选全部3个cdr)区域上包含不超过10个,优选不超过5个(例如,3、2、1或0个)氨基酸改变(优选氨基酸取代,优选保守取代)。在上述任一实施方案中,优选地,本发明抗体或其抗原结合片段包含选自以下的cdr序列组合(按顺序分别为hcdr1、hcdr2和hcdr3、lcdr1、lcdr2和lcdr3):seqidnos:1/2/3/22/23/24,seqidnos:4/5/6/22/23/24,seqidnos:16/17/18/31/23/24,seqidnos:7/8/9/22/23/25,seqidnos:7/8/9/22/23/26,seqidnos:7/8/9/31/23/30,seqidnos:10/11/12/27/23/28,seqidnos:13/14/15/27/23/29,和seqidnos:19/20/21/31/23/32。抗体重链和轻链在一些实施方案中,本发明抗体包含重链fc区,例如igg1,igg2或igg4同种型的fc区。在一个实施方案中,本发明抗体含有igg4-fc区,其中在氨基酸残基228位置(eu编号)具有丝氨酸至脯氨酸突变(s228p)。在再一优选实施方案中,本发明抗体包含igg4-paafc部分。该igg4-paafc部分在位置228具有丝氨酸至脯氨酸突变(s228p),并且在位置234(eu编号)具有苯丙氨酸至丙氨酸突变,在位置235(eu编号)具有亮氨酸至丙氨酸突变。s228p突变是肿瘤恒定区的铰链区的突变,可以减少或消除重链间二硫桥异质性。f234a和l235a突变可以进一步降低(已经具有低效应子功能的)人igg4同种型的效应子功能。在一些实施方案中,本发明抗体含有去除了重链c末端赖氨酸(des-lys)的igg4-paafc部分。在一些实施方案中,本发明抗体包含κ轻链恒定区,例如人κ轻链恒定区。在再一优选的实施方案中,fc区包含seqidno:68的氨基酸序列,或相对于seqidno:68的氨基酸序列包含至少一个,两个或三个,但不超过20个,10个或5个氨基酸改变的氨基酸序列,或与seqidno:68的氨基酸序列具有至少95-99%同一性的序列。在一个优选的实施方案中,本发明抗体包含轻链恒定区。在一个优选实施方案中,轻链恒定区为人κ轻链恒定区。在再一优选实施方案中,轻链恒定区包含seqidno:69的氨基酸序列,或相对于seqidno:69的氨基酸序列包含至少一个,两个或三个,但不超过20个,10个或5个氨基酸改变的氨基酸序列,或与seqidno:68的氨基酸序列具有至少95-99%同一性的序列。在一些优选的实施方案中,本发明抗体包含重链,并且所述重链包含选自seqidno:44、45、46、47、48和49的氨基酸序列、或相对于其包含至少一个,两个或三个,但不超过20个,10个或5个氨基酸改变的氨基酸序列,或与其具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性的氨基酸序列。优选地,氨基酸改变不发生在cdr区中,更优选地,不发生在可变区中。在一些优选的实施方案中,本发明抗体包含轻链,并且所述轻链包含选自seqidno:63、64、65、66和67的氨基酸序列、或相对于其包含至少一个,两个或三个,但不超过20个,10个或5个氨基酸改变的氨基酸序列,或与其具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性的氨基酸序列。优选地,氨基酸改变不发生在cdr区中,更优选地,不发生在可变区中。在一个优选实施方案中,本发明的抗体包含选自以下的重链序列和/或轻链序列:(a)包含seqidno:44的氨基酸序列的重链序列或其变体,和/或包含seqidno:50的氨基酸序列的轻链序列或其变体;(b)包含seqidno:45的氨基酸序列的重链序列或其变体,和/或包含seqidno:50的氨基酸序列的轻链序列或其变体;(c)包含seqidno:46的氨基酸序列的重链序列或其变体,和/或包含seqidno:51的氨基酸序列的轻链序列或其变体;(d)包含seqidno:47的氨基酸序列的重链序列或其变体,和/或包含seqidno:52的氨基酸序列的轻链序列或其变体;(e)包含seqidno:48的氨基酸序列的重链序列或其变体,和/或包含seqidno:53的氨基酸序列的轻链序列或其变体;(d)包含seqidno:49的氨基酸序列的重链序列或其变体,和/或包含seqidno:54的氨基酸序列的轻链序列或其变体,其中所述变体与对应的参考序列相比包含至少一个,两个或三个,但不超过20个,10个或5个氨基酸改变的氨基酸序列,或具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性的氨基酸序列。优选地,氨基酸改变不发生在cdr区,更优选地不发生在可变区。在一个实施方案中,在抗体的恒定区中进行残基修饰,以例如改变抗体的性质,例如效应子功能。示例性抗体序列本发明提供了如实施例中分离并表征的特异性结合lag-3(例如人lag-3)的全人源抗体。下表3中列出了本发明这些示例性抗体的抗体可变区vh和vl序列。下表1和2中列出了抗体的示例性cdr序列。表4和5显示了本发明示例性抗体的重链和轻链氨基酸序列。表6和7显示了本发明示例性抗体可变区vh和vl的编码核苷酸序列。抗体变体在一方面,本发明提供在本文中所述及的任何抗体,尤其是表3所列示例性抗体,的变体。在一个实施方案中,抗体变体保持改变前抗体的至少60%,70%,80%,90%,或100%的生物学活性(例如抗原结合能力)。在一些实施方案中,所述改变不导致抗体变体丧失对抗原的结合,但任选地可以赋予诸如提高的抗原亲和力和不同的效应子功能等性质。可以理解的,抗体的重链可变区或轻链可变区、或各cdr区可以单独改变或组合改变。在一些实施方案中,在一个或多个或全部三个重链cdr中的氨基酸改变不超过1个、2个、3个、4个、5个、6个、7个、8个、9个或10个。优选地,所述氨基酸改变为氨基酸取代,优选保守取代。在一些实施方案中,在一个或多个或全部三个轻链cdr中的氨基酸改变不超过1个、2个、3个、4个、5个、6个、7个、8个、9个或10个。在一些实施方案中,在一个或多个或全部6个cdr中的氨基酸改变不超过1个、2个、3个、4个、5个、6个、7个、8个、9个或10个。优选地,所述氨基酸改变为氨基酸取代,优选保守取代。在一些实施方案中,抗体变体与参考抗体在目标抗体序列区域上具有至少80%、85%、90%或95%或99%或更高的氨基酸同一性。例如,在一个实施方案中,本发明抗体,与参考抗体(例如表3所列抗体之一)相比,在3个重链cdr区域上具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%或更高的同一性。在一个实施方案中,本发明抗体,与参考抗体(例如表3所列抗体之一相比),在3个轻链cdr区域上具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%或更高的同一性。在另一实施方案中,本发明抗体,与参考抗体(例如表3所列抗体之一相比),在6个cdr区域上具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%或更高的同一性。在再一实施方案中,本发明抗体,与参考抗体(例如表3所列抗体之一)相比,在重链可变区上具有至少80%、85%、90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%或更高的序列同一性。在再一实施方案中,本发明抗体,与参考抗体(例如表3所列抗体之一)相比,在轻链可变区上具有至少80%、85%、90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%或更高的序列同一性。在再一实施方案中,本发明抗体,与参考抗体(例如表3所列抗体之一)相比,在重链可变区和/或轻链可变区上具有至少80%、85%、90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%或更高的序列同一性。此外,可以对抗体的fc区进行改变。fc区的改变可以单独进行,或与上述对构架和/或cdr区的改变相组合。可以改变fc区,例如,以改变抗体的一种或多种功能,例如血清半衰期,补体固定、fc受体结合、和/或抗原依赖性细胞毒性。此外,还可以对本发明抗体进行化学修饰(例如,与peg连接)或改变其糖基化模式。在某些实施方案中,fc区可以包含具有一个或多个提高adcc活性的氨基酸置换的fc-区,例如,fc-区的位置298、333和/或334的置换(残基的eu编号)。在一些实施方案中,也可以对fc-区进行改变,以导致改变的(即,提高的或降低的)c1q结合和/或补体依赖性细胞毒性(cdc)(参见,例如,us6,194,551、wo99/51642和idusogie,e.e.等,j.immunol.164(2000)4178-4184)。在另一些实施方案中,可以对fc进行改变以增加或降低其糖基化程度和/或改变其糖基化模式。对fc的糖基化位点的添加或缺失可通过改变氨基酸序列以便产生或移除一或多个糖基化位点而方便地实现。举例而言,可实施一或多种氨基酸取代以消除一或多个糖基化位点,由此消除该位点处的糖基化。可制备具有改变类型的糖基化的抗体,例如具有减小量的岩藻糖基残基的低或无岩藻糖化抗体或具有增加的等分glcnac结构的抗体。这类改变的糖基化模式已显示可增加抗体的adcc能力。本发明也考虑在与fc区连接的寡糖中具有至少一个半乳糖残基的抗体变体。这些抗体变体可具有提高的cdc功能。在某些实施方案中,本发明也考虑具有一些但非所有效应子功能的抗体变体,这使其成为某些应用的理想候选物,在所述应用中抗体的体内半衰期是重要的,但某些效应子功能(如补体和adcc)是不必要或有害的。例如,fc区可以包含消除或减弱效应子功能的突变,例如具有突变p329g和/或l234a和l235a的人igg1fc区,或具有突变p329g和/或s228p和l235e的人igg4fc区。在某些实施方案中,可能需要产生经半胱氨酸工程改造的抗体,例如“硫代mab”,其中抗体的一或多个残基经半胱氨酸残基置换。例如,可以改变抗体铰链区中的半胱氨酸残基数目,以例如利于轻链和重链的装配或增加或降低抗体的稳定性。残基例如美国专利号5,677,425。在某些实施方案中,本文中所提供的抗体可进一步经修饰为含有非蛋白质部分。适合抗体衍生的部分包括,但不限于,水溶性聚合物。水溶性聚合物的非限制性实例包括,但不限于,聚乙二醇(peg),以例如增加抗体的(例如血清)半衰期。用于蛋白质peg化的方法是本领域已知的,可以将其应用于本发明的抗体。参见例如ep0154316和ep0401384。ii.多核苷酸、载体和宿主本发明提供编码以上任何抗lag-3抗体或其片段的核酸。还提供包含所述核酸的载体。在一个实施方案中,载体是表达载体。还提供包含所述核酸或所述载体的宿主细胞。在一个实施方案中,宿主细胞是真核的。在另一个实施方案中,宿主细胞选自酵母细胞、哺乳动物细胞(例如cho细胞或293细胞)。在另一个实施方案中,宿主细胞是原核的。在一方面,本发明提供编码以上任何抗lag-3抗体或其片段的核酸。所述核酸可以包含编码抗体的轻链可变区和/或重链可变区的氨基酸序列的核酸,或包含编码抗体的轻链和/或重链的氨基酸序列的核酸。示例性的编码抗体重链可变区的核酸序列包含与选自seqidno:57,58,59,60,61或62的核酸序列具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性的核酸序列,或者包含选自57,58,59,60,61或62的核酸序列。示例性的编码抗体轻链可变区的核酸序列包括与选自seqidno:50,51,52,53,或54的核酸序列具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性的核酸序列,或者包括选自seqidno:50,51,52,53,或54的核酸序列。从适宜的表达载体表达时,由这些多核苷酸编码的多肽能够显示lag-3抗原结合能力。本发明中还提供多核苷酸,所述多核苷酸编码来自上文所述的结合lag-3的抗体的重链vh或轻链vl序列的至少一个cdr区和通常全部三个cdr区。一些进一步的实施方案中,多核苷酸编码上文所述的结合lag-3的抗体的重链和/或轻链的完整或基本上完整可变区序列。如本领域技术人员明了的,因为密码子简并性,每一个抗体或多肽氨基酸序列可以由多种核酸序列编码。在一个优选实施方案中,编码抗体的本发明核酸还包含编码重链fc区的核苷酸序列,例如seqidno:68中所示的fc区序列或与其基本相同的序列。在一个优选实施方案中,编码抗体的本发明核酸还包含编码轻链恒定区序列的核苷酸序列,例如seqidno:69中所示的序列或与其基本相同的序列。可以采用本领域熟知的方法,通过从头固相dna合成或通过pcr诱变编码结合lag-3的抗体或其结合片段的现有序列(例如,表6-7中所示的序列),产生这些多核苷酸序列。在一个实施方案中,提供包含本发明核酸的一个或多个载体。在一个实施方案中,载体是表达载体,例如真核表达载体。载体包括但不限于病毒、质粒、粘粒、λ噬菌体或酵母人工染色体(yac)。在优选的实施方案中,本发明的表达载体是ptt5表达载体。在一个实施方案中,提供包含所述载体的宿主细胞。用于克隆或表达编码抗体的载体的适当宿主细胞包括本文描述的原核或真核细胞。例如,抗体可在细菌中产生,特别当不需要糖基化和fc效应子功能时。对于抗体片段和多肽在细菌中的表达,见,例如,美国专利号5,648,237,5,789,199和5,840,523,还见charlton,methodsinmolecularbiology,卷248(b.k.c.lo,编辑,humanapress,totowa,nj,2003),第245-254页,其描述抗体片段在大肠杆菌中的表达)。在表达后,抗体可以从可溶级分中的细菌细胞糊状物分离,并且可以进一步纯化。在一个实施方案中,宿主细胞是真核的。在另一个实施方案中,宿主细胞选自酵母细胞、哺乳动物细胞或适用于制备抗体或其抗原结合片段的其它细胞。例如,真核微生物诸如丝状真菌或酵母是关于编码抗体的载体的合适克隆或表达宿主。例如,糖基化途径已经进行“人源化”的真菌和酵母菌株导致产生具有部分或完全人糖基化模式的抗体。参见gerngross,nat.biotech.22:1409-1414(2004),和li等,nat.biotech.24:210-215(2006)。适于表达糖基化抗体的宿主细胞也衍生自多细胞生物体(无脊椎动物和脊椎动物)。也可以将脊椎动物细胞用作宿主。例如,可以使用被改造以适合于悬浮生长的哺乳动物细胞系。有用哺乳动物宿主细胞系的其它实例是用sv40转化的猴肾cv1系(cos-7);人胚肾系(293hek或293细胞,如例如graham等,j.genvirol.36:59(1977)中所描述的)等。其它有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub等,proc.natl.acad.sci.usa77:216(1980));以及骨髓瘤细胞系如y0,ns0和sp2/0。关于适合产生抗体的某些哺乳动物宿主细胞系的综述见例如yazaki和wu,methodsinmolecularbiology,卷248(b.k.c.lo,ed.,humanapress,totowa,nj),第255-268页(2003)。v.抗体的制备在一个实施方案中,提供了制备抗lag-3抗体的方法,其中所述方法包括,在适合抗体表达的条件下,培养包含编码所述抗体的核酸的宿主细胞,如上文所提供的,和任选地从所述宿主细胞(或宿主细胞培养基)回收所述抗体。为了重组产生抗lag-3抗体,分离编码抗体(例如上文所描述的抗体)的核酸,并将其插入一个或多个载体,用于在宿主细胞中进一步克隆和/或表达。此类核酸易于使用常规规程分离和测序(例如通过使用能够与编码抗体重链和轻链的基因特异性结合的寡核苷酸探针进行)。vi.测定法可以通过本领域中已知的多种测定法对本文中提供的抗lag-3抗体鉴定,筛选,或表征其物理/化学特性和/或生物学活性。一方面,对本发明的抗体测试其抗原结合活性。例如,可以通过本领域已知的方法,诸如elisa,western印迹等,或本文实施例公开的例示性方法,来测定与人lag-3的结合。例如,可以使用流式细胞术进行测定,其中抗体与表达人lag-3的细胞系,例如经转染在细胞表面上表达人lag-3的hek293细胞,进行反应。其它的细胞也适用于流式细胞术,包括表达天然lag-3的激活的cd4+t细胞。备选地,抗体的结合,包括结合动力学(例如kd值),可以使用重组lag-3蛋白,在生物光干涉测定法中测定。在一些实施方案中,使用生物光干涉测定法(例如fortebio亲和测量)。另一方面,可使用竞争测定法来鉴定与本文中公开的任何抗lag-3抗体竞争对lag-3的结合的抗体。在某些实施方案中,此类竞争性抗体结合与本文中公开的任何抗lag-3抗体所结合表位相同或重叠的表位(例如线性或构象表位)。用于定位抗体所结合表位的详细例示性方法见morris(1996)“epitopemappingprotocols”,methodsinmolecularbiologyvol.66(humanapress,totowa,nj)。本发明还提供了用于鉴定具有生物学活性的抗lag-3抗体的测定法。生物学活性可以包括例如结合lag-3(例如结合人lag-3),阻断lag-3(例如结合人lag-3)与细胞表面mhcii类分子结合、结合激活的cd4+和/或cd8+t细胞、抑制肿瘤生长。例如,在体内肿瘤抑制模型中(参见例如实施例8),测试抗体抑制肿瘤生长的能力。在本发明也提供在体内和/或在体外具有此类生物学活性的抗体。可以理解的是,能够使用本发明的免疫缀合物或多特异性抗体替换或补充抗lag-3抗体来进行任何上述测定。ii.多特异性抗体在再一方面,本发明提供特异性地结合lag-3(优选人lag-3)的多特异性(包括双特异性)抗体分子。在一个实施方案中,在多特异性抗体中,本发明的抗体(或其抗原结合片段)形成针对lag-3的第一结合特异性。在再一实施方案中,所述多特异性抗体还针对以下一种的第二特异性、或还包含针对以下两种分子的第二和第三结合特异性:pd-1、tim-3、ceacam(例如、ceacam-1或ceacam-5)、pd-l1或pd-l2。在再一实施方案中,所述多特异性抗体是结合lag-3和pd-1、结合lag-3和pd-l1、或结合lag-3和pd-l2的双特异性抗体。在一个实施方案中,结合特异性由抗体的“结合位点”或“抗原结合位点”(抗体分子中与抗原实际结合的区域)提供。在一个优选的实施方案中,抗原结合位点由抗体轻链可变结构域(vl)和抗体重链可变结构域(vh)组成的vh/vl对构成。因此,在一个实施方案中,“多特异性”抗体是具有至少两个抗原结合位点的抗体,所述至少两个抗原结合位点中的每一个抗原结合位点可以与相同抗原的不同表位或与不同抗原的不同表位结合。有关多特异性抗体及其制备,可以参见例如wo2009/080251、wo2009/080252、wo2009/080253、wo2009/080254、wo2010/112193、wo2010/115589、wo2010/136172、wo2010/145792和wo2010/145793中的描述。iii.免疫缀合物再一方面,本发明提供通过将本发明抗体缀合于异源分子而产生的免疫缀合物。在一个实施方案中,在免疫缀合物中,本发明的抗体(或其抗原结合片段)与治疗剂或诊断剂。在一些实施方案中,本发明抗体可以以全长抗体或抗体片段的形式与异源分子缀合。例如,以fab片段、fab’片段、f(ab)’2片段、单链scfab抗体、单链scfv等片段形式进行缀合。可以使用接头来共价连接缀合物的不同实体。适宜的接头包括化学接头或肽接头。有利地的是,接头是利于多肽在递送至靶位点后释放的“可裂解接头”。例如,可以使用酸不稳定性接头、肽酶敏感性接头、光不稳定性接头、二甲基接头或含二硫化物的接头(chari等,cancerresearch52(1992)127-131;us5,208,020)。适用于缀合物中的治疗剂包括但不限于细胞毒素(例如细胞生长抑制剂或细胞杀伤剂),药物或放射性同位素。适合于形成免疫缀合物的细胞毒性剂(例如化疗剂)的例子是本领域中已知的,参见例如wo05/103081。例如,细胞毒性剂包括但不限于:放射性同位素;生长抑制剂;酶及其片段如核酸水解酶;抗生素;毒素如小分子毒素或细菌、真菌、植物或动物起源的酶促活性毒素,包括其片段和/或变体;和已知的各种抗肿瘤或抗癌剂。再一方面,本发明的抗体可以与诊断剂或可检测剂缀合。这类缀合物可以作为临床检验方法的部分(如确定特定疗法的效力),用于监测或预测疾病或病症的发作、形成、进展和/或严重性。可以通过将抗体与可检测剂偶联实现这类诊断和检测,所述可检测剂包括但不限于多种酶,如但不限于辣根过氧化物酶;辅基,如但不限于链霉亲和素/生物素和抗生物素蛋白/生物素;荧光物质;发光物质;放射性物质;和用于各种正电子发射成像术中的正电子发射金属和非放射性顺磁金属离子。vii.药物组合物和药物制剂本发明还包括包含抗lag-3抗体或其免疫缀合物或多特异性抗体的组合物(包括药物组合物或药物制剂)和包含编码抗lag-3抗体或其免疫缀合物或多特异性抗体的多核苷酸的组合物。这些组合物还可以任选地包含合适的药用辅料,如本领域中已知的药用载体、药用赋形剂,包括缓冲剂。在一个实施方案中,组合物还包含第二治疗剂,优选地,抗pd-1抗体。适用于本发明的药用载体可以是无菌液体,如水和油,包括那些具有石油、动物、植物或合成起源的,如花生油、大豆油、矿物油、芝麻油等。当静脉内施用药物组合物时,水是优选的载体。还可以将盐水溶液和水性右旋糖以及甘油溶液用作液体载体,特别是用于可注射溶液。合适的药用赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、米、面粉、白垩、硅胶、硬脂酸钠、甘油单硬脂酸酯、滑石、氯化钠、干燥的脱脂乳、甘油、丙烯、二醇、水、乙醇等。对于赋形剂的使用及其用途,亦参见“handbookofpharmaceuticalexcipients”,第五版,r.c.rowe,p.j.seskey和s.c.owen,pharmaceuticalpress,london,chicago。若期望的话,所述组合物还可以含有少量的润湿剂或乳化剂,或ph缓冲剂。这些组合物可以采用溶液、悬浮液、乳剂、片剂、丸剂、胶囊剂、粉末、持续释放配制剂等的形式。口服配制剂可以包含标准载体,如药用级甘露醇、乳糖、淀粉、硬脂酸镁、糖精。可以通过将具有所需纯度的本发明的抗lag-3抗体、免疫缀合物或多特异性抗体,与一种或多种任选的药用辅料(remington′spharmaceuticalsciences,第16版,osol,a.编(1980))混合,来制备包含本发明的药物制剂,优选地以冻干制剂或水溶液的形式。示例性的冻干抗体制剂描述于美国专利号6,267,958。水性抗体制剂包括美国专利号6,171,586和wo2006/044908中所述的那些,后一种制剂包括组氨酸-乙酸盐缓冲剂。本发明的药物组合物或制剂还可以包含一种或多种其它活性成分,所述活性成分是被治疗的特定适应症所需的,优选具有不会不利地影响彼此的互补活性的那些活性成分。例如,理想的是还提供其它抗癌活性成分,例如化疗剂、pd-1轴结合拮抗剂(例如抗pd-1抗体或抗pd-l1抗体或抗pd-l2抗体)或者抗血管发生剂(例如贝伐珠单抗)。所述活性成分以对于目的用途有效的量合适地组合存在。可制备持续释放制剂。持续释放制剂的合适实例包括含有抗体的固体疏水聚合物的半渗透基质,所述基质呈成形物品,例如薄膜或微囊形式。关于药物制剂的其它组分,还可以参见wo2015/153513中公开的那些。vi.组合产品在一些实施方案中,本发明还提供了组合产品,其包含本发明的抗体或其抗原结合片段,以及或其片段或其免疫缀合物,以及一种或多种其它治疗剂(例如化疗剂、其他抗体、细胞毒性剂、疫苗、抗感染活性剂等)。在一些实施方案中,其它抗体例如抗pd-1抗体或抗pd-l1抗体或抗pd-l2抗体。在一些实施方案中,所述组合产品用于预防或治疗肿瘤。在一些实施方案中,肿瘤为癌症,例如胃肠道癌症,例如胃癌、直肠癌、结肠癌、结肠直肠癌等;或皮肤癌,例如恶性黑素瘤。在一些实施方案中,所述组合产品用于预防或治疗感染,例如细菌感染、病毒感染、真菌感染、原生动物感染等。viii.治疗方法和用途在本文中,术语“个体”或“受试者”可互换地使用,是指哺乳动物。哺乳动物包括但不限于驯化动物(例如,奶牛、绵羊、猫、犬和马)、灵长类(例如,人和非人灵长类如猴)、兔和啮齿类(例如,小鼠和大鼠)。特别地,受试者是人。在本文中,术语“治疗”指意欲改变正在接受治疗的个体中疾病之天然过程的临床介入。想要的治疗效果包括但不限于防止疾病出现或复发、减轻症状、减小疾病的任何直接或间接病理学后果、防止转移、降低病情进展速率、改善或缓和疾病状态,以及缓解或改善预后。在一方面中,本发明涉及在受试者中增强机体的免疫应答的方法,所述方法包括向所述受试者施用有效量的本文所述的任何抗lag-3抗体或其片段,或包含所述抗体或片段的免疫缀合物、多特异性抗体,或药物组合物。在一些实施方案,将本发明的抗lag-3抗体或其抗原结合部分施用于携带肿瘤的受试者,刺激抗肿瘤免疫应答。在另一些实施方案中,将本发明的抗体或其抗原结合部分施用于携带感染的受试者,刺激抗感染免疫应答。在另一方面中,本发明涉及治疗受试者肿瘤,例如癌症的方法,所述方法包括向所述受试者施用有效量的本文所述的任何抗lag-3抗体或其片段,或包含所述抗体或片段的免疫缀合物、多特异性抗体,或药物组合物。在一些实施方案中,本文所述的肿瘤,例如癌症,包括但不限于实体瘤、血液学癌(例如,白血病、淋巴瘤、骨髓瘤)及其转移性病灶。在一个实施方案中,癌症是实体瘤。实体瘤的例子包括恶性肿瘤,例如,多个器官系统的肉瘤和癌(例如,腺癌),如侵袭肺、乳腺、淋巴、胃肠道或结直肠、生殖器和生殖泌尿道(例如,肾细胞、膀胱细胞、膀胱细胞)、咽、cns(例如,脑细胞、神经细胞或神经胶质细胞)、皮肤(例如,黑素瘤)、头部和颈部(例如,头颈鳞状细胞癌(hncc))和胰的那些。例如,黑素瘤、结肠癌、胃癌、直肠癌、肾细胞癌、乳腺癌(例如,不表达一种、两种或全部雌激素受体、孕酮受体或her2/neu的乳腺癌,例如,三阴性乳腺癌)、肝癌、肺癌(例如,非小细胞肺癌(nsclc)(例如,具有鳞状和/或非鳞状结构的nsclc)或小细胞肝癌)、前列腺癌、头部或颈部癌(例如,hpv+鳞状细胞癌)、小肠癌和食道癌。血液学癌的例子包括但不限于白血病(例如,髓样白血病、淋巴样白血病或慢性淋巴细胞白血病(cll))、淋巴瘤(例如,霍奇金淋巴瘤(hl)、非霍奇金淋巴瘤(nhl)、弥漫性大b细胞淋巴瘤(dlbcl)、t细胞淋巴瘤或套细胞淋巴瘤(mcl))和骨髓瘤,例如,多发性骨髓瘤。癌症可以处于早期、中期或晚期或是转移性癌。在一个实施方案中,癌症是胃肠道癌症如结肠癌,或皮肤癌如恶性黑素瘤等。在另一方面中,本发明涉及治疗受试者感染性疾病,例如慢性感染的方法,所述方法包括向所述受试者施用有效量的本文所述的任何抗lag-3抗体或其片段,或包含所述抗体或片段的免疫缀合物、多特异性抗体,或药物组合物。在一个实施方案中,所述感染是病毒感染。在一些实施方案中,所述感染性疾病是由于病毒感染引起的。致病性病毒的一些例子包括(甲型、乙型和丙型)肝炎病毒、(甲型、乙型和丙型)流感病毒、hiv、疱疹病毒(例如,vzv、hsv-1、hav-6、hsv-ii、cmv、epsteinbarr病毒+)、腺病毒、黄病毒、艾柯病毒、鼻病毒、柯萨奇病毒、冠状病毒、呼吸道合胞体病毒、腮腺炎病毒、轮状病毒、麻疹病毒、风疹病毒、细小病毒、痘苗病毒、htlv病毒、登革病毒、乳头状瘤、软疣病毒、脊髓灰质炎病毒、狂犬病病毒、jc病毒和虫媒脑炎病毒。适于用本发明的抗lag-3的抗体或其片段、免疫缀合物和多特异性抗体预防或治疗的疾病可进一步参见wo2015/138920、wo2016/028672、wo2015/042246等。一些实施方案中,本文所述的方法还包括向所述受试者联合施用一种或多种疗法(例如治疗方式和/或其它治疗剂)。在一些实施方案中,治疗方式包括手术治疗和/或放射疗法。在一些实施方案中,除了施用本发明抗体外,本发明方法还包括施用至少一种其它的免疫刺激性抗体,例如抗pd-1抗体、抗pd-l1抗体、和/或抗ctla-1抗体,这些抗体可以是例如全人源的、嵌合的、或人源化的抗体。在另一些实施方案中,其它治疗剂选自化疗剂、pd-1轴结合拮抗剂(例如抗pd-1抗体或抗pd-l1抗体或抗pd-l2抗体)或者抗血管发生剂(例如贝伐珠单抗)。在一些实施方案中,pd-1轴结合拮抗剂包括但不限于pd-1结合拮抗剂,pd-l1结合拮抗剂和pd-l2结合拮抗剂。"pd-1"的备选名称包括cd279和sleb2。"pd-l1"的备选名称包括b7-h1、b7-4、cd274和b7-h。"pd-l2"的备选名称包括b7-dc、btdc和cd273。在一些实施方案中,pd-1、pd-l1和pd-l2是人pd-1、pd-l1和pd-l2。在一些实施方案中,pd-1结合拮抗剂是抑制pd-1结合其配体结合配偶的分子。在一个具体方面,pd-1配体结合配偶是pd-l1和/或pd-l2。在另一个实施方案中,pd-l1结合拮抗剂是抑制pd-l1结合其结合配偶的分子。在一个具体方面,pd-l1结合配偶是pd-1和/或b7.1。在另一个实施方案中,pd-l2结合拮抗剂是抑制pd-l2结合其结合配偶的分子。在一个具体方面,pd-l2结合配偶是pd-1。拮抗剂可以是抗体,其抗原结合片段、免疫粘附素、融合蛋白或寡肽。在一些实施方案中,pd-1结合拮抗剂是抗pd-1抗体(例如人抗体,人源化抗体,或嵌合抗体)。在一些实施方案中,抗pd-1抗体选自下组:mdx-1106(nivolumab,opdivo),merck3475(mk-3475,pembrolizumab,keytruda)和ct-011(pidilizumab)。在一些实施方案中,抗pd-1抗体是mdx-1106。在一些实施方案中,抗pd-1抗体是nivolumab(cas注册号:946414-94-4)。在优选的实施方案中,抗pd-1抗体是本文所述的“antibodyd”。在进一步的一些实施方案中,单独或与pd-1轴结合拮抗剂组合的抗lag-3抗体或其片段还能与一种或多种其它疗法例如治疗方式和/或其它治疗剂组合施用。在一些实施方案中,治疗方式包括外科手术(例如肿瘤切除术);放射疗法(例如,外粒子束疗法,它涉及其中设计照射区域的三维适形放射疗法)、局部照射(例如,指向预选靶或器官的照射)或聚焦照射等。在一些实施方案中,本发明的抗lag-3抗体或其片段可以与化疗或化疗剂联合施用。在一些实施方案中,本发明的抗lag-3抗体或其片段可以与放疗或放疗剂联合施用。在一些实施方案中,本发明的抗lag-3抗体或其片段可以与靶向疗法或靶向治疗剂联合施用。在一些实施方案中,本发明的抗lag-3抗体或其片段可以与免疫疗法或免疫治疗剂,例如单克隆抗体联合施用。本发明的抗体(以及包含其的药物组合物或免疫缀合物,以及任何另外的治疗剂)可以通过任何合适的方法给药,包括肠胃外给药,肺内给药和鼻内给药,并且,如果局部治疗需要,病灶内给药。肠胃外输注包括肌内、静脉内、动脉内、腹膜内或皮下给药。在一定程度上根据用药是短期或长期性而定,可通过任何适合途径,例如通过注射,例如静脉内或皮下注射用药。本文中涵盖各种用药时程,包括,但不限于,单次给药或在多个时间点多次给药、推注给药及脉冲输注。为了预防或治疗疾病,本发明的抗体的合适剂量(当单独或与一种或多种其他的治疗剂组合使用时)将取决于待治疗疾病的类型、抗体的类型、疾病的严重性和进程、所述抗体是以预防目的施用还是以治疗目的施用、以前的治疗、患者的临床病史和对所述抗体的应答,和主治医师的判断力。所述抗体以一次治疗或经过一系列治疗合适地施用于患者。在上述本发明方法中,可以替代本发明抗体或抗原结合部分,施用本发明的组合物、多特异性抗体或免疫缀合物。或者,在这些方法中,除了施用本发明抗体或抗原结合部分,还可以进一步施用本发明的组合物、多特异性抗体或免疫缀合物。再一方面,本发明提供本发明抗lag-3抗体、组合物、免疫缀合物、多特异性抗体在制备用于前述方法(例如用于治疗)的药物中的用途。ix.用于诊断和检测的方法和组合物再一方面,本发明涉及检测样品中lag-3的方法和试剂盒,其中所述方法包括:(a)将所述样品与本发明抗体或其抗原结合片段或免疫缀合物接触;和(b)检测所述抗体或其抗原结合片段或免疫缀合物和lag-3蛋白之间复合物的形成。在一些实施方案中,样品来自癌症患者,例如皮肤癌患者。所述检测可以是体外的或体内的。术语“检测”用于本文中时,包括定量或定性检测,示例性的检测方法可以涉及免疫组织化学、免疫细胞化学、流式细胞术(例如,facs)、抗体分子复合的磁珠、elisa测定法、pcr-技术(例如,rt-pcr)。在某些实施方案中,生物样品是血、血清或生物来源的其他液体样品。在某些实施方案中,生物样品包含细胞或组织。在一些实施方案中,生物样品来自过度增生性或癌性病灶。在某些实施方案中,待检测的lag-3是人lag-3。在一个实施方案中,抗lag-3抗体被用于选择适合利用抗lag-3抗体的治疗的受试者,例如其中lag-3是用于选择所述受试者的生物标记物。在一个实施方案中,可以使用本发明抗体诊断癌症或肿瘤,例如评价(例如,监测)对象中本文所述疾病(例如,过度增生性或癌性疾病)的治疗或进展、其诊断和/或分期。在某些实施方案中,提供标记的抗lag-3抗体。标记包括但不限于,被直接检测的标记或部分(如荧光标记、发色团标记、电子致密标记、化学发光标记和放射性标记),以及被间接检测的部分,如酶或配体,例如,通过酶促反应或分子相互作用。示例性标记包括但不限于,放射性同位素32p、14c、125i、3h和131i,荧光团如稀土螯合物或荧光素及其衍生物,罗丹明及其衍生物,丹酰(dansyl),伞形酮(umbelliferone),荧光素酶(luceriferase),例如,萤火虫荧光素酶和细菌荧光素酶(美国专利号4,737,456),荧光素,2,3-二氢酞嗪二酮,辣根过氧化物酶(hr),碱性磷酸酶,β-半乳糖苷酶,葡糖淀粉酶,溶解酶,糖类氧化酶,例如,葡萄糖氧化酶,半乳糖氧化酶,和葡萄糖-6-磷酸脱氢酶,杂环氧化酶如尿酸酶和黄嘌呤氧化酶,以及利用过氧化氢氧化染料前体的酶如hr,乳过氧化物酶,或微过氧化物酶(microperoxidase),生物素/亲和素,自旋标记,噬菌体标记,稳定的自由基,等等。描述以下实施例以辅助对本发明的理解。不意在且不应当以任何方式将实施例解释成限制本发明的保护范围。本发明下面实施例涉及6个示例性抗体(adi-26818,adi-26822,adi-26836,adi-31798,adi-31815及adi-31836),这些抗体的cdr区、轻链可变区和重链可变区、轻链和重链的氨基酸序列,以及对应的核苷酸序列在本申请的表1-8部分列出。另外,上述本发明示例抗体的轻链恒定区、重链恒定区、轻链可变区和重链可变区的序列编号如表9所示。实施例实施例1.抗人lag-3的抗体筛选确定母抗体酵母展示技术筛选抗lag-3全人源抗体基于酵母的抗体展示(yeast-basedantibodypresentation)文库(adimab),按照现有的方法(wo2009036379;wo2010105256;w02012009568)进行扩增,其中每个库的多样性达到1×109。简言之,前两轮的筛选使用miltenyi公司的macs系统进行磁性激活细胞分选。首先,将文库的酵母细胞(~1×1010细胞/文库)分别在facs洗涤缓冲液中(磷酸盐缓冲液,含有0.1%牛血清蛋白)室温孵化15分钟,缓冲液中含有100nm生物素标记的人lag-3抗原(acrobiosystems,目录号la3-h5255-1mg)。使用50ml预冷的facs洗涤缓冲液洗一次,再用40ml相同洗涤缓冲液重悬细胞,并加入500μl链霉亲和素微珠(miltenyils)于4℃孵化15分钟。1000rpm离心5min弃去上清后用5mlfacs洗涤缓冲液重悬细胞,将细胞溶液加到miltenyils柱中。加样完成后,用facs洗涤缓冲液洗柱3次,每次3ml。从磁性区域取下miltenyils柱,用5ml生长培养基洗脱,收集洗脱的酵母细胞并在37℃过夜生长。使用流式细胞仪进行下一轮的分选:将经过macs系统筛选获得的大约1×108的酵母细胞用facs缓冲液洗三次,于含有低浓度生物素(100-1nm)标记的人lag-3抗原中室温下培养。弃去培养液,细胞用facs洗涤缓冲液洗两次之后,将细胞与lc-fitc(fitc标记的抗人免疫球蛋白kappa轻链抗体,southernbiotech)(1:100稀释)混合,并与sa-633(链霉亲和素-633,molecularprobes)(1:500稀释)或sa-pe(链霉亲和素-pe,sigma)(1:50稀释)试剂混合,4℃下培养15分钟。用预冷的facs洗涤缓冲液洗脱两次,并重悬于0.4ml缓冲液中,将细胞转移到带滤器的分离管中。使用facsaria(bdbiosciences)分选细胞。将通过筛选获得的表达抗人lag-3抗体的酵母细胞在30℃下震荡诱导48小时以表达抗人lag-3的抗体。诱导结束之后,1300rpm离心10min去除酵母细胞,收获上清液。使用proteina对上清液中的抗人lag-3抗体进行纯化,ph2.0醋酸溶液洗脱,收获抗人lag-3抗体,抗体纯度>95%。经筛选获得抗体adi-26818、adi-26822及adi-26836。实施例2抗人lag-3抗体的亲和力优化为了获得更高亲和力的抗人lag-3抗体,我们通过以下方法对抗体adi-26818、adi-26822及adi-26836进行了优化。vhmut筛选该方法是通过常规的错配pcr的方法向抗体重链区域引入突变。pcr过程中,通过使用1um高突变的碱基类似物dptp和8-oxo-dgtp,从而将碱基错配概率提高至约0.01bp。获得的错配pcr的产物通过同源重组的方法构建入含有重链恒定区的载体中。通过这种方法,在包括lag-3抗原滴度、未标记抗原竞争以及使用母抗体竞争的筛选压力下,我们获得了库容量为1×107的次级库。通过facs方法进行了3轮成功筛选。cdrh1/cdrh2筛选把vhmut方法获得的子代抗体的cdrh3基因构建入1×108多样性的cdrh1/cdrh2基因库中,并对其进行了3轮筛选。第一轮使用macs方法,而第二、三轮使用facs方法,对抗体抗原结合物进行亲和力加压,筛选出最高亲和力的抗体。经过以上亲和力成熟过程,我们获得了亲和力提高的抗人lag-3单克隆抗体adi-31798、adi-31815和adi-31836。实施例3.hek293细胞中的表达和纯化根据本领域常规方法,从表达上述抗人lag-3抗体的酵母细胞获得编码抗lag-3抗体的基因dna,并根据常规方法将该基因dna克隆到新的表达载体(ptt5)。将含有目标抗体基因的上述表达载体与转染试剂pei(polysciences)按照生产产商提供的方案瞬时转染培养的人肾胚细胞293细胞(invitrogen)。转染后,弃去培养基并用新鲜的培养基把细胞稀释到4×106/ml。在37℃,5%co2的条件下培养细胞7天,每48小时流加新鲜培养基。7天后,1300rpm离心20min。取上清液,用proteina纯化上清液,使抗体的纯度>95%。获得具有igg4-paafc部分(seqidno:68)的igg4抗体。在hek293细胞中表达并且纯化实施例中使用的下述对照抗体:对照抗体25f725f7是在hek293细胞中瞬时表达的人lag-3抗体,其序列与美国专利us20170137514a1中的抗体“25f7”的序列相同。具有igg4-paafc部分(seqidno:68)的25f7抗体的全长重链和轻链如seqidno:55和seqidno:56所示。实施例4:本发明抗lag-3抗体的亲和力测定采用生物光干涉测量(fortebio)测定法测定本发明上述6个示例抗体结合人lag-3(hlag-3)的平衡解离常数(kd)。fortebio亲和力测定按照现有的方法(estep,p等人,highthroughputsolutionbasedmeasurementofantibody-antigenaffinityandepitopebinning.mabs,2013.5(2):p.270-8)进行。简言之,传感器在分析缓冲液中线下平衡30分钟,然后线上检测60秒建立基线,在线加载如上所述获得的经纯化的抗体至ahq传感器(fortebio)上进行fortebio亲和测量。再将具有加载的抗体的传感器暴露于100nm的lag-3抗原中作用5分钟,之后将传感器转移至分析缓冲液解离5分钟用于解离速率测量。使用1:1结合模型进行动力学的分析。在如以上测定法所述进行的实验中,adi-26818、adi-26822、adi-26836、adi-31798、adi-31815、adi-31836以及对照抗体25f7亲和力如表3所示。表10:通过生物光干涉测量本发明抗体的结合动力学可见,本发明上述6个示例抗体均显示极高的亲和力,其中adi-31798、adi-31815及adi-31836具有比25f7更高的亲和力。实施例5:本发明抗lag-3抗体与人lag-3的结合在基于流式细胞术的测定法中测量本发明的上述6个示例抗体与人lag-3的结合。通过转染携带克隆至多克隆位点mcs的人lag-3cdna(sinobiological)的pcho1.0载体(invitrogen),产生过表达人lag-3的293细胞(293-hlag-3细胞)。将293-hlag-3细胞(0.2×106个细胞)与不同浓度的实验抗体(adi-26818、adi-26822、adi-26836、adi-31798、adi-31815、adi-31836及对照抗体25f7)混合(抗体稀释方法为:最高抗体浓度为500nm,三倍稀释在含0.1%牛血清白蛋白(bsa)的pbs中,总共测试了8个浓度)。冰上孵育30分钟。然后将细胞洗涤至少两次,加入1:100稀释的二抗(pe标记的羊抗人igg抗体,southernbiotech,终浓度为5μg/ml),冰上(避光)孵育30分钟。将细胞洗涤至少两次并通过流式细胞术进行分析。在accuric6系统(bdbiosciences)上进行流式细胞术检测,并根据其mfi拟合浓度依赖的曲线。adi-26818、adi-26822和adi-26836结合hek293细胞上过表达的hlag-3,ec50值分别为1.181nm、1.500nm和1.437nm,与对照抗体25f7与hek293细胞上过表达的hlag-3的结合能力相当(对照抗体25f7的ec50值为3.339nm)(参见图1)。在如以上测试法所述进行的实验中,亲和力优化的抗hlag-3抗体adi-31798、adi-31815及adi-31836结合hek293细胞上过表达的hlag-3,ec50值分别为0.201nm、1.293nm和0.562nm,优于对照抗体25f7与hek293细胞上过表达的hlag-3的结合能力(ec50值3.339nm)。(参见图2)实施例6.本发明抗lag-3抗体对人lag-3配体mhcii与lag-3相互作用的阻断通过流式细胞术测量adi-31798、adi-31815及adi-31836阻断人lag-3与细胞表面的mhcii(hla)结合的能力。通过转染携带克隆至mcs的人hla-dr(sinobiological)的pcho1.0载体(invitrogen),产生过表达人hla-dr的cho细胞(cho-dr细胞)。将抗原rhlag3蛋白(hufc)(sinobiological)稀释至40nm,50μl/孔。加入不同浓度的抗体(adi-31798、adi-31815及adi-31836和对照抗体25f7,从最高浓度80nm开始进行3倍梯度稀释,共8个稀释梯度),50μl/孔,于pbs冰上孵育30min,抗原终浓度20nm,抗体最高终浓度40nm。将cho-dr细胞调节至3×105cell/孔,100μl/孔。细胞于300g离心5min,弃上清,重悬于抗原抗体混合液。冰上孵育30min,加pbs100μl/孔,300g离心5min,pbs清洗1次,加1:100稀释的100μl山羊抗人igg-pe(southernbiotech)/孔,冰浴20min,加pbs100μl/孔,300g离心5min,pbs清洗1次。用100μlpbs重悬,细胞流式仪检测细胞荧光信号值。实验结果表明,adi-31798、adi-31815及adi-31836均可以有效阻断lag-3和其配体mhcii(hla-dr)的结合,其阻断能力和对照抗体25f7相当。具体而言,adi-31798、adi-31815及adi-31836阻断人lag-3与mhcii(hla-dr)的结合的能力的ic50分别为4.701nm、3.575nm及6.657nm。对照抗体25f7阻断人lag-3与mhcii(hla-dr)的结合的能力的ic50为5.141nm。(参见图3)实施例7.抗体与激活的t细胞结合实验人cd4+t细胞被激活后其表面会表达lag-3蛋白,本研究通过流式细胞术测量adi-31798、adi-31815、adi-31836和激活的人cd4+t细胞的结合能力。按照磁珠/cd4+t细胞=1:1的比例向cd4+t细胞中加入抗cd3/cd28磁珠(gibco)刺激3天,调节细胞密度至1×106个/ml,分装第一孔150μl/孔,其他孔100μl/孔,第一列孔加抗体,终浓度10nm,混匀,吸取50μl入下一列孔,以此类推。每个样品做3个复孔。冰浴30min,400g离心5min,pbs清洗2次,添加1:100稀释的pe-抗人fc抗体50μl,冰浴30min,400g离心5min,pbs清洗2次,用60μlpbs重悬,通过流式细胞术进行分析。在accuric6系统(bdbiosciences)上进行流式细胞术,并根据其mfi拟合浓度依赖的曲线。实验结果表明,adi-31798、adi-31815及adi-31836能和激活的人cd4+t细胞结合,ec50值分别为0.00595nm、0.0128nm和0.0127nm,结合能力优于对照抗体25f7(对照抗体的ec50值为0.0356nm)(参见图4)。实施例8.本发明抗lag-3抗体的抗肿瘤活性本研究采用a375(atcc)人的恶性黑素瘤皮肤癌细胞在nog小鼠上测定抗lag-3抗体的抗肿瘤作用。预先静脉注射人的pbmc(allcells),然后采用皮下接种的方式建立a375荷瘤小鼠模型,成瘤后分组,给予不同抗体的治疗,监测给药期间各组小鼠肿瘤体积和体重变化,给药频率为2次/周,给药2周,共给药5次。监测频率均为2次/周,连续监测4周,给药剂量和方式如下所述。给药结束后计算相对肿瘤抑制率(tgi%),计算公式如下:tgi%=100%*(h-igg对照组肿瘤体积–治疗组肿瘤体积)/(h-igg对照组肿瘤体积–h-igg对照组给药前肿瘤体积),其中h-igg对照组给药前肿瘤体积平均值为71mm3。小鼠:nog小鼠,雌性,7-8周(肿瘤细胞接种时的小鼠周龄),体重17.6-24.2g,购自北京维通利华实验动物技术有限公司。小鼠在到达后驯化7天,随后开始研究。细胞:人的皮肤癌细胞a375(atcc#crl-1619)购自atcc,并严格按照atcc要求进行常规传代培养用于后续体内实验。离心收集细胞,在无菌pbs中重悬细胞并调整细胞密度为30×106个/ml。nog小鼠已经静脉注射了人的pbmc后,右侧背部剃毛,皮下注射a375细胞0.2ml/只。肿瘤细胞接种7天后检测各只小鼠瘤体积,挑选出瘤平均体积在70-71mm3范围内的小鼠按瘤体积随机分组。按如下给药方式,检测抗lag-3抗体单独使用或与抗pd-1抗体联合使用的抗肿瘤活性。给药:将小鼠分为四组(每组6只小鼠),每组分别皮下注射如下剂量的抗体:(1)人igg,20mg/kg;(2)抗pd-1抗体(antibodyd,pct/cn2016/094122),10mg/kg;(3)lag-3(adi-31798),10mg/kg;(4)lag-3(adi-31798),10mg/kg+抗pd-1抗体(antibodyd),10mg/kg。抗pd-1抗体“antibodyd”为pct/cn2016/094122中公开的抗人抗pd-1抗体。人igg为获自equitech-bio的人igg制备物。在肿瘤细胞接种后的第7天、第10天、第14天、第17天和第21天,分别用如上四组抗体为每组小鼠按如上剂量给药。分析:在整个研究期间每周测量两次肿瘤和体重,当肿瘤达到端点时(肿瘤体积>3000mm3)或当小鼠具有>20%体重减轻时,使小鼠安乐死。采用游标卡尺测定肿瘤的最大长轴(l)和最大宽轴(w),肿瘤体积按如下公式计算:v=l×w2/2。将来自每组的小鼠的肿瘤尺寸与时间作图。使用方差分析(anova)来确定统计显著性。<0.05的p值被视为在所有分析中具有统计显著性。实验结果见表11和图5,可见本申请的抗lag-3单克隆抗体adi-31798和抗pd-1单克隆抗体“antibodyd”联合使用时与igg对照(equitech-bio)及这两个抗体分别使用相比,能显著抑制肿瘤的生长。表11第24天肿瘤抑制率当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1