一种含人转铁蛋白抗原表位序列的嵌合体抗原受体的制作方法
本发明属于生物技术领域,具体涉及一种含人转铁蛋白的抗原表位序列的嵌合体抗原受体。
背景技术
免疫疗法正成为治疗癌症的一种非常有前景的方法。t细胞或t淋巴细胞,我们的免疫系统的武装部队不断寻找外来抗原,并从正常细胞中区分异常(癌症或感染细胞)。用car基因修饰t细胞是设计肿瘤特异性t细胞的最常见方法。靶向肿瘤相关抗原(taa)的car-t细胞可以注入患者中(称为过继性细胞转移或act),其代表着有效过继免疫治疗方法。与化疗或抗体相比,car-t技术的优势在于重编程的工程化t细胞可以在患者体内增殖并持续存在。
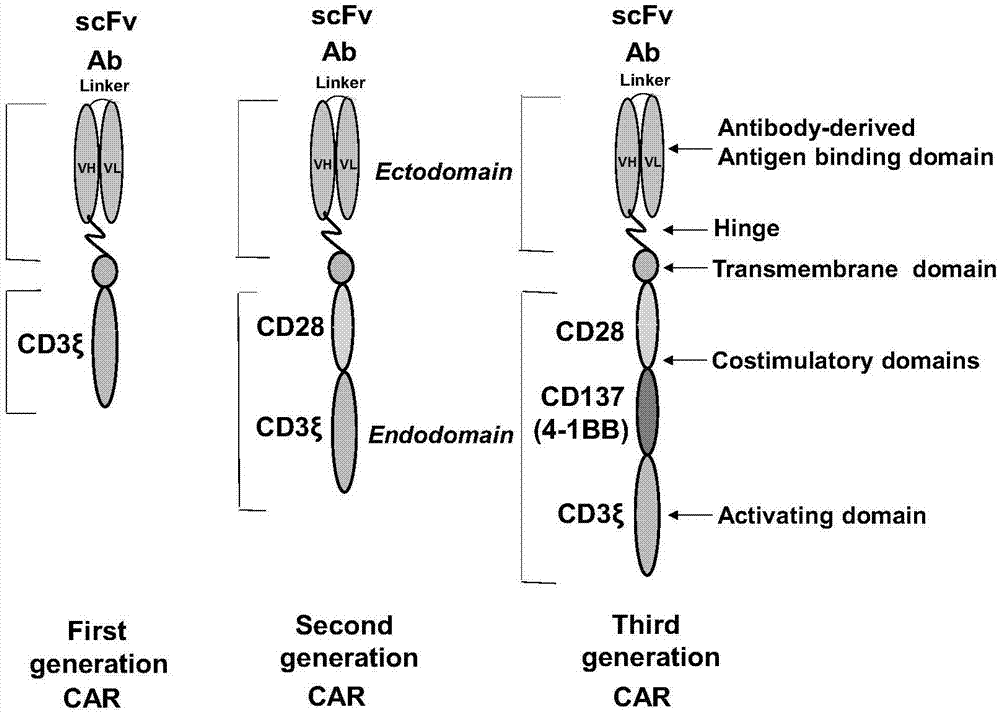
car(嵌合抗原受体)通常由单链抗体衍生的单链可变片段(scfv)组成,其单链可变片段可通过铰链连接,然后将跨膜结构域链接到可变数目的胞内信号传导结构域上:单细胞激活cd3-zeta结构域;和cd28、cd137(4-1bb)或其他共刺激结构域,与cd3-zeta结构域串联(cd27信号结构域也用于取代cd28或cd137结构域)(图1)。
car的演化从第一代(没有共刺激域)到第二代(有一个共刺激域)到第三代(有几个共刺激域)。具有多个共刺激区域的car(所谓的第三代car)的产生会导致细胞溶解活性增加,并显著改善了抗肿瘤活性增强的car-t细胞的持久性。
转铁蛋白是与铁结合的转运蛋白,其可结合与阴离子结合的两个fe3+离子。它负责将铁从吸收和血红素降解的位点转移到储存和利用的位点。血清转铁蛋白还可能在刺激细胞增殖中发挥进一步的作用。转铁蛋白由肝脏表达并分泌在血浆中。
技术实现要素:
本发明提供一种含人转铁蛋白的抗原表位序列的嵌合体抗原受体,其中涉及的术语定义如下:
如本文所用,“嵌合抗原受体(car)”是指含有能够结合抗原的胞外结构域的融合蛋白,一个来自多肽的跨膜结构域,其不同于胞外结构域来源的多肽,以及至少一个胞内域。“嵌合抗原受体(car)”有时称为“嵌合受体”、“t体”或“嵌合免疫受体(cir)”。“能够结合抗原的胞外结构域”是指任何可以结合某种抗原的寡肽或多肽。“胞内结构域”是指任何已知作为传递信号并可以引起细胞中的生物过程的激活或抑制的结构域的寡肽或多肽。
如本文所用,“结构域”是指多肽中的一个区域,其折叠成独立于其他区域的特定结构。
如本文所用,转铁蛋白抗原表位(tf)是多肽人转铁蛋白基序的15个氨基酸(tf抗体结合抗原表位):序列为knpdpwaknlnekdy(序列idno:5),它是用于结合转铁蛋白抗体的抗原表位。tf是人转铁蛋白的564至578个氨基酸(蛋白质序列可以在uniprotup02787中获得;http://www.uniprot.org/uniprot/p02787)。它可以与蛋白质的c端或n端融合,或者插入蛋白质的胞外结构域。2tf、3tf、4tf和5tf分别是tf的15个氨基酸序列重复2-5次。1/2tf是tf的后半部分,即knlnekdy(序列idno:12)。如本文所用,“tf序列”包括tf、1/2tf和2-5tf,例如2tf和3tf。
如本文所用,“单链可变片段(scfv)”是指一种从抗体中提取的单链多肽,其能保持与抗原结合的能力。scfv包括通过重组dna技术形成的抗体多肽,其中免疫球蛋白重链(h链)和轻链(l链)片段的fv可变区经由间隔区序列连接。制备scfv的各种方法为本领域技术人员所熟知。
如本文所用,“肿瘤抗原”是指具有抗原性的生物分子,其表达会引起癌症。
发明人已发现将tf序列添加到scfv的car上的n-末端或c-末端,或者在vh和vl之间具有优于传统car的优点。在car上添加tf序列可以通过使用抗转铁蛋白或tf的抗体使其易于检测car阳性细胞。在car上添加tf序列还可以在体内追踪car-t细胞,其可用于诊断成像,并检测cart细胞的持久性和寿命。向cd19-car、cd22-car和bcma-car添加tf序列会使car-t细胞更安全,细胞因子分泌更少。
本发明涉及嵌合抗原受体融合蛋白,其从n端到c端包括:
(i)包含vh和vl的单链可变片段(scfv),其中scfv具有针对肿瘤抗原的活性,
(ii)跨膜结构域,
(iii)至少一个共刺激结构域,
和(iv)激活结构域;
其中,其融合蛋白包括一个tf序列(tf,1/2tf或2-5tf),其在n端到vh或v1(或scfv),或在vh和vl之间,或在c端到scfv的位点,即在vl或vh与跨膜结构域之间。
在一个实施方案中,肿瘤抗原由以下组成:bcma(cd269,tnfrsf17),cd19,cd22,vegfr-2,cd4,cd20,cd30,cd22,cd25,cd28,cd30,cd33,cd47,cd52,cd56,cd80,cd81,cd86,cd123,cd171,cd276,b7h4,cd133,egfr,gpc3;pmsa,cd3,ceacam6,c-met,egfrviii,erbb2/her-2,erbb3/her3,erbb4/her-4,epha2,igf1r,gd2,o-acetylgd2,o-acetylgd3,ghrhr,ghr,flt1,kdr,flt4,cd44v6,cd151,ca125,cea,ctla-4,gitr,btla,tgfbr2,tgfbr1,il6r,gpl30,lewisa,lewisy,tnfr1,tnfr2,pd1,pd-l1,pd-l2,hvem,mage-a,mesothelin,ny-eso-1,psma,rank,ror1,tnfrsf4,cd40,cd137,tweak-r,ltpr,lifrp,lrp5,muc1,tcra,tcrp,tlr7,tlr9,ptch1,wt-1,robol,a,frizzled,ox40,cd79b,和notch-1-4。
在优选实施方案中,肿瘤抗原是cd19或cd22。
在一个实施方案中,共刺激结构域由cd28,4-1bb,gitr,icos-1,cd27,ox-40和dap10组成。优选共刺激结构域是cd28。
优选激活结构域是cd3ζ(cd3z或cd3)。
其跨膜结构域可以来自天然多肽,也可以是人工设计的。源自天然多肽的跨膜结构域可以从任何膜结合蛋白或跨膜蛋白中获得。例如,可以使用t细胞受体α或者β链,cd3.zeta,cd28,cd3.epsilon.,cd45,cd4,cd5,cd8,cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137,icos,cd154或gitr的跨膜结构域。人工设计的跨膜结构域是主要包含疏水残基多肽,如亮氨酸和缬氨酸。在跨膜结构域的合成中,最好在每个末端都能发现苯丙氨酸、色氨酸和缬氨酸三联体。可以任意在跨膜结构域和细胞内结构域之间排列短寡肽接头或多肽接头,例如具有2至10个氨基酸长度的接头。尤其可以使用具有甘氨酸-丝氨酸连续序列的接头序列。
tf序列的插入增加了嵌合抗原受体(car)t细胞的功能活性,并且更有效且安全地攻击肿瘤细胞。
本发明cd19-tf-car,cd19-1/2tf-car,cd19-2tf-car,cd22-tf-car和bcma-tf-car如图2a-2c所示。在附图中,tf序列(tf或1/2tf或2tf)位于scfv的c-末端,然而,tf也可以位于scfv的n-末端,或者位于scfv的n-末端,或者在vh和vl之间。tf抗原表位序列需要在胞外结构域中,而不在胞内结构域中,以便被抗tf-抗体识别。图2a-2c以cd19-car、cd22-car和bcma-car为对照。gm-csf作为cd19-car和cd22car构建体的前导序列。cd8前导信号序列用于bcma-car。1/2tf;tf或2xtf在cd19scfv、cd22scfv和bcma的scfv末端,由重链可变片段;轻链可变片段;和一个链接器组成。tm是跨膜结构域;cd28是cd28共激活结构域。cd19scfv具有vl-接头-vh结构。cd22scfv和bcmascfv具有vh-接头-vl结构。bcma-car具有cd8铰链而不是cd28铰链,如在cd19和cd22car上。使用来自bcma,ab克隆a和bcmaab,克隆b的bcmascfv。为简单起见,使用四种bcma:bcma-a、bcma-tf、bcma-b、bcma-b-tf-标记为bcma和bcma-tf。
cd19和cd22细胞表面抗原在许多类型的血液学癌症中高度表达。bcma是一种b细胞成熟抗原,其在多发性骨髓瘤(mm)中过表达(cd269,tnfsr17)。本发明提供了几种新的构建体。cd19-tf-car构建体具有与cd19-car类似的活性,但在临床上具有优势,因为它允许在构建期间用tf-共轭珠和具有tf抗体的体内成像细胞来选择cd19+/-car细胞,并且它可以用于许多其他应用中。cd19-tf-car-t可用于临床。如上所述,cd22-tf-car和bcma-tf-car在临床使用中也具有相同的优点。bcma-tf-car可用于治疗多发性骨髓瘤。所有三种构建体都表明细胞因子分泌减少,这表明在临床上增加了安全性。
本发明提供了编码上述car的核酸。编码car的核酸可以从指定car的氨基酸序列通过常规方法易于制备。对于每个结构域的氨基酸序列,编码氨基酸序列的碱基序列可以从上述ncbirefseqid或genbenk登录号获取,并且本发明的核酸使用标准分子生物学和/或化学程序。例如,基于碱基序列,可以合成核酸,并且可以通过使用聚合酶链式反应(pcr)从cdna文库获得的dna片段来制备本发明的核酸。
本发明的核酸可以作为活性成分用于治疗例如癌症如血癌(白血病)、实体瘤等。尽管给药途径不那么受限制,本发明的核酸作为活性成分,可以通过例如注射或输注等非肠道、皮内、肌内、皮下、腹膜内、鼻内、动脉内、静脉内、瘤内或传入淋巴管中给药。
可将编码本发明car的核酸插入载体中,并将载体导入细胞中。例如,可以使用逆转录病毒载体(包括逆转录病毒载体、慢病毒载体、假型载体)、腺病毒载体、腺伴随病毒(aav)载体、猿猴病毒载体、牛痘病毒载体或仙台病毒载体、艾巴氏病毒(ebv)载体和hsv载体。作为病毒载体,优选使用缺乏具有复制能力的病毒载体,以免在感染细胞中自我复制。
例如,当使用逆转录病毒载体时,本发明可通过基于载体所具有的ltr序列和包装信号序列,选择合适的包装细胞并使用该包装细胞制备逆转录病毒颗粒。包装细胞包括pg13(atcccrl-10686)、pa317(atcccrl-9078)、gp+e-86和gp+envam-12和psi-crip。还可以使用具有高转染效率的293细胞或293t细胞来制备逆转录病毒颗粒。基于逆转录病毒所产生的许多种逆转录病毒载体和可用于包装逆转录病毒载体的包装细胞可从许多商业公司获得。
本发明的细胞通过car与特定抗原结合,从而将信号传输到细胞中,并激活细胞。表达car的细胞激活因宿主细胞的种类和car的胞内结构域而不同,例如,可以以细胞因子的释放,细胞增殖速度的改善,细胞表面分子等作为指标。例如,从激活的细胞释放细胞毒性细胞因子(肿瘤坏死因子、淋巴毒素等)导致表达抗原的靶细胞的破坏。另外,细胞因子的释放或细胞表面分子的改变会刺激其他免疫细胞,例如b细胞、树突细胞、nk细胞和巨噬细胞。
表达car的细胞可用作疾病的治疗剂。治疗剂包含表达car作为活性成分的细胞,并且包含合适的赋形剂。赋形剂包括上述组合物的药学上可接受的赋形剂,所述赋形剂包括本发明的核酸作为活性成分、各种细胞培养基和等渗氯化钠。
本发明人已产生了针对血液恶性肿瘤(白血病、淋巴瘤和骨髓瘤)的cd19-tf-cart细胞和cd22-tf-cart细胞,其对过度表达cd19或cd22的癌细胞具有高杀伤活性。本发明人证明了用cd19-tf慢病毒构建体转染的t细胞具有有效转染效率。通过使用稳定过表达cd19抗原的宫颈癌细胞系hela的实时细胞毒性测定,发明人证明了cd19-tf-car-t细胞和cd22-tf-car-t细胞对癌细胞具有高细胞毒活性。
在人类中插入tf序列不会产生不利的免疫应答。在生产过程中,cd19-tf-cart细胞、cd22-tf-car-t细胞和bcma-tf-cart细胞可通过流式细胞术或通过tf-偶联的磁珠分选,以富集产生具有较高活性的细胞毒性细胞。这种改进方法可用于产生其他肿瘤抗原靶点的其他car。
使用天然杀伤细胞(nk-92和原代人类自然杀伤细胞)可将同样的策略应用于car构建体。
重新研发兔单克隆tf-抗体。该抗体可以人源化并用于临床。
可以在制造过程中使用cd19-tf-cart细胞、cd22-tf-cart细胞和bcma-tf-cart细胞,其中富集细胞与记忆t细胞亚群一起选择,以增加t细胞产生效力和细胞毒性。
(i)双重cd19-tf-cart细胞和cd22-tf-cart细胞,(ii)双重cd19-tf-cart细胞和bcma-tf-cart细胞的组合疗法(用具有两个car的构建体或通过共同给予两种car或共转导两种car)可用于增加car-t细胞的单次治疗活性。
用双特异性cd19-cd22-tf-car-t或双特异性bcma-加其它scfv针对任何mm标志物cd38、cd319、cd138、cd33car-t细胞的组合疗法可用于增加car-t的单次细胞治疗活性。
用cd19-tfcar和化疗或免疫检查点抑制剂(pd-1,ctla-4和其他)的联合治疗可用于增加car的单次活性。
当与cd19car和cd22cart细胞比较时,cd19-tf-cart细胞和cd22-tf-cart细胞分泌显著较少的细胞因子(ifn-γ、il-2、il-6)。
当与bcma-cart细胞比较时,针对多发性骨髓瘤细胞,bcma(克隆a和b-tf-cart细胞分泌显著较少的细胞因子。
双重或双特异性cd19/cd22-tf-cart细胞可以杀伤raji白血病细胞并分泌更少的细胞因子。
双重或双特异性bcma-tf和mm抗原(cd138、cd38、cd319、cd138)cart细胞可杀死多发性骨髓瘤并分泌更少的细胞因子。
针对靶向癌细胞,cd19-tf和cd22-tf慢病毒car或bcma和其他mm抗原的共转染会导致car-t细胞的产生,其使分泌具有相同或更少的细胞因子。
tf序列可用于产生具有上述活性的car-t细胞。
附图说明
图1是第一代、第二代和第三代car结构示意图;
其中左图为第一代结构(无共刺激结构域);中间为第二代(一个共刺激结构域cd28或4-bb);右图为第三代car(两个或几个共刺激结构域);该图来自golubovskaya,wu,cancer,2016;
图2是cd19-tf-car、cd22-tf-car和bcma-tf-car的结构示意图;
以cd19-car、cd22-car和bcma-car为对照;gm-csf作为cd19-car和cd22car构建体的前导序列;cd8前导信号序列用于bcma-car;1/2tf、tf或2xtf在cd19scfv、cd22scfv和bcma的scfv末端,由重链可变片段;轻链可变片段;和一个链接器组成;tm是跨膜结构域;cd28是cd28共激活结构域;cd19scfv具有vl-接头-vh结构;cd22scfv和bcmascfv具有vh-接头-vl结构;bcma-car具有cd8铰链而不是cd28铰链,如在cd19和cd22car上;使用来自bcma,ab克隆a和bcmaab,克隆b的bcmascfv;为简单起见,使用四种bcma:bcma-a、bcma-tf、bcma-b、bcma-b-tf-标记为bcma和bcma-tf;
图3是针对15个氨基酸tf表位检测cd19和cd22-tf-car表达所产生的tf抗体图;
其中:用tf-pe抗体(x轴)和cd3-apc抗体进行的facs分析(y轴),结果显示大于20%cd19和cd22-tf-car-t细胞在扩增14天时为tf+阳性;
图4是cd19-阳性hela宫颈癌细胞的实时细胞毒性测定(rtca)图;
其中效应细胞与靶细胞按10∶1比例使用,t细胞、mock-car-t细胞为hela-cd19-posirive细胞的阴性对照细胞;
图5是d19-阳性和cd22-阳性raji淋巴瘤细胞的实时细胞毒性测定结果图;
图6是cd19和cd19-tf-car-t细胞分泌的ifn-γ的elisa图;
其中:e:t比例为10∶1,*p<0.01cd19-tf相对于cd19-car-t细胞;细胞因子的分泌水平归一化为car表达的水平;
图7是cd22-tf和cd22-car-t细胞分泌的ifn-γ的elisa图;
图8是cd19-tf-car-t细胞和cd19-car-t细胞分泌il-2的elisa图;
图9是cd19-tf-car-t细胞和cd19-car-t细胞分泌il-6的elisa图;
图10是cd19-1/2tf-和cd19-2tf-car与cd19-car细胞相对于靶向hela-cd19细胞的细胞毒活性检测图;
图11是cd19-1/2tf-和cd19-2tf-car与cd19-car相对于靶向raji细胞的细胞毒活性检测图;
图12是bcma-tf-car-t细胞和bcma-car-t细胞分泌il-2的elisa图。
具体实施方式
以下实例进一步阐述了本发明。这些实例只是为了阐述本发明,而不应被解释为限制。
实施例1
本实施例进行car构建体:
将小鼠fmc63抗-cd19scfv(kochenderfer等(2009),i.immunother,32:689-702)插入到第二代car中,其含有gm-csf信号肽、铰链区、跨膜结构域,cd28共刺激结构域和cd3zeta激活结构域;这个car在这里称为cd19car。将tf序列(knpdpwaknlnekdy,seqidno:5)插入scfv和铰链区之间的cd19car中;这个car在这里称为cd19-tfcar。cd22scfv的vh和vl取自m971人cd22ab(专利us20110020344a1)。使用特异细胞内蛋白质的scfv代替fmc63scfv;这个car在这里称为模拟car。bcmascfv来自promabbcma抗体。具有特异细胞内蛋白质的scfv(因此不与完整细胞反应)的“模拟”car以相同方式构建,并作为阴性对照car。
实施例2
car序列构建:
cd19-car、cd19-tfcar各片段的氨基酸序列;cd22和cd22-tf;如序列表所示,在我们实验中使用bcma和bcma-tf构建体。每个片段使用具有至少95%同源性的氨基酸序列替换。
其中人gm-csf信号肽如idno:1序列所示。
fmc63抗-cd19scfv(vl-连接-vh)中vl序列如idno:2序列所示,连接如idno:3序列所示,vh如idno:4序列所示,在我们的构建体中,在vh后有3个aaa氨基酸。tf序列如果存在,在vh或vl之后(scfv),如序列idno:5所示。cd28铰链序列如idno:6所示。跨膜域tm28如序列idno:7所示。共刺激域cd28序列如idno:8所示。激活结构域cd3-zeta序列idno:9所示,插入到scfv和cd19特异性car的铰链区之间。
cd19-tfcar序列如idno:10所示,其中tf是粗体加下划线,cd19scfv是斜体字体。
在某些情况下,使用更短的tf8氨基酸,叫做1/2tf,其序列如idno12所示。cd19-1/2tf-car序列id为no13,1/2tf序列为粗体加下划线。
cd19-2tf序列>通过使用cd19scfv后的两个tf序列产生,序列id为no14,
将两个tf序列间隔开并用粗体下划线标记:
cd22-tfcar通过使用cd22m971scfv产生cd22-tfcar序列idno15:tf为粗体并加下划线;人类gm-csf信号肽;cd22scfv包含vh-ggggsx3接头,vl以斜体显示。
bcma-克隆a-tf序列idno16,通过使用bcma克隆a(promabbiotechnologies)scfv产生<bcma-tfcar>序列idno16:tf为粗体加下划线,含有bcmascfv的vh-ggggsx3接头和vl以斜体显示。car含有cd8前导序列,用斜线下划线表示,cd8铰链序列用下划线表示。bcma-tfcar如图2c所示。
bcma-克隆b-tf序列idno17:用bcma克隆b(promabbiotechnologies)scfv来产生<bcma-tfcar>序列seqidno17:tf为粗体加下划线,bcmascfv含有vh-ggggsx3接头和vl以斜体显示。car含有cd8前导序列,用斜线下划线表示,cd8铰链序列用下划线表示。
实施例3
编码car慢病毒:
合成编码car的dna,并由synobiological(中国北京)将其亚克隆到第三代慢病毒载体中,ef1a为启动子。所有car慢病毒构建体双向测序以确认car序列。并用于慢病毒生产。将1000万个生长停滞的hek293ft细胞(赛默飞世尔)接种到t75瓶中并培养过夜,然后用calphos转染试剂盒(ppackh1lentivectorpackagingmix)(systembiosciences,paloalto,ca)和10μg每种慢病毒载体转染(takara,mountainview,ca)。第二天用新鲜培养基更换培养基,48小时后收集含慢病毒的培养基。2100g离心30分钟,利用培养基清除细胞碎片。以112000g离心100分钟收集病毒颗粒,悬浮于aimv培养基中,等体积分装并在-80℃冷冻。根据说明书和7900ht热循环仪(thermofisher),使用lenti-xqrt-pcr试剂盒(takara)通过定量rt-pcr确定病毒制备物小佳。慢病毒效价>1x108pfu/ml。
实施例4
car-t细胞的产生和扩增:
将pbmc以1x106个细胞/ml悬浮于含有10%fbs和300u/mlil-2(thermofisher)的aimv-albumax培养基(thermofisher)中,与等量(1∶1比例)的cd3/cd28dynabeads(thermofisher)混合,并在未处理的24孔板(每孔0.5ml)中培养。在24和48小时,以5的感染复数(moi)和1μltransplus转染增强子(alstem)将慢病毒加入到培养物中。在接下来t细胞两周增殖中,每2-3天计数一次细胞,并向培养物中加入具有300u/mlil-2的新鲜培养基,以保持细胞密度为1-3×106个细胞/ml。
实施例5
流式细胞术:
为了测量car表达,将0.5百万个细胞悬浮于100μl缓冲液(含有0.5%bsa的pbs)中,并在冰上用1μl人血清(jacksonimmunoresearch,westgrove,pa)孵育10分钟。然后加入1μl别藻蓝蛋白(apc)标记的抗-cd3(ebioscience,sandiego,ca)和2μl藻红蛋白(pe)标记的抗tf或其同种型对照抗体,并将细胞冰浴30分钟。用3ml缓冲液冲洗细胞,然后悬浮在缓冲液中并在facscalibur(bdbiosciences)上获得。分析细胞cd3染色与tf染色或同种型对照染色。
实施例6
产生稳定的hela-cd19细胞系:
为了产生稳定表达人cd19的hela细胞,合成了编码人cd19开放阅读框的dna,并且使用synobiological将其亚克隆到pcd510慢病毒载体(systembiosciences)中。如上所述,制备含有载体的慢病毒。用moi为5的慢病毒感染hela细胞,并在1μg/ml嘌呤霉素存在下培养以产生抗性细胞,在此称为hela-cd19。通过流式细胞术使用cd19抗体(biolegend)确认cd19的表达。
实施例7
实时细胞毒性测定(rtca):
基于阻抗的实时细胞分析(rtca)icelligence系统(aceabiosciences),将附着靶细胞(hela或hela-cd19)以1x104个细胞/孔接种到96孔e板(aceabiosciences,sandiego,ca)过夜。第二天,除去培养基,并用含有10%fbs±1×105效应细胞(car-t细胞或非转染t细胞)的aimv-albumax培养基替代,一式三份。利用rtca系统再监测e板中的细胞2-3天,并随时间绘制阻抗图。细胞溶解计算为(不含效应细胞的靶细胞的阻抗-效应细胞对靶细胞的阻抗)×100/不含效应细胞的靶细胞的阻抗。对于非附着靶细胞(raji),首先用抗cd40抗体(aceabiosciences)涂e-板,以结合cd40+raji细胞。然后每孔接种1×104个raji细胞,并如上所述进行rtca测定。
实施例8
细胞因子诱导测定:
将靶细胞(raji或hela-cd19)与效应细胞(car-t细胞或非转染t细胞)以1∶1的比例(各1×104个细胞)在200μl含有10%fbs的aimv-albumax培养基铺在u底96孔板中培养,一式三份。16小时后,将最上面的150μl培养基转移到v底96孔板中,并300g离心5分钟,以沉淀残留细胞。将最上面的120μl上清液转移至新的96孔板中,并根据说明书使用thermofisher试剂盒通过elisa分析人ifn-γ和il-2水平。
实施例9
统计分析:
利用prism软件(graphpad,sandiego,ca)分析数据并绘图。两组之间的比较由非配对student′st检验。p<0.05为是显著的。
实施例10
通过流式细胞术使用新promab′s兔tf抗体进行的结果显示t细胞与cd19-car或cd22慢病毒的高效转导,并表达cd19或cd22tfscfv。
promab研发了几种针对15个氨基酸肽生产的tf抗体knpdpwaknlnekdy(人转铁蛋白的564至578个氨基酸)蛋白质序列可在uniprotup02787中获得;http://www.uniprot.org/uniprot/p02787.
以下显示了用于在转铁蛋白内生产tf抗体的15个氨基酸多肽(粗体,下划线)
将tf肽序列与载体klh(匙孔血蓝蛋白)蛋白偶联,以更有效使兔子免疫,通过elisa选择最佳克隆,从兔子收集pbmc并用于克隆和生成文库,通过酵母显示和facs分析,以及标记的15个氨基酸肽生产单克隆tf抗体。。
实施例11
tf抗体检测car内的tf表位序列:
利用cd19-tf和cd22-tf-car-t细胞使用最好的tf克隆(ab#13和#75)来分析facs(图3)。如例5中所述进行分析facs。用两种不同兔单克隆tf抗体有效检测cd19-tf和cd22-tfcar-t细胞(图3),结果显示大于20%cd19和cd22-tf-car-t细胞在扩增14天时为tf+阳性。用tf抗体比用fab抗体染色(未显示)要好得多。因此,tf抗体可用于临床的tf-阳性car-t细胞的分选和成像。
实施例12
针对cd19阳性hela-cd19细胞,cd19-tf-car-t细胞表现出的高细胞毒性。
实时高灵敏度细胞毒性测定证明针对cd19阳性hela细胞,cd19-tf-car-t细胞表现出高活性(图4),效应细胞与靶细胞按10∶1比例使用。t细胞、mock-car-t细胞为hela-cd19-posirive细胞的阴性对照细胞。结果显示cd19-tf特异性杀死hela-cd19阳性细胞以及cd19-car-t细胞。cd22和cd22-tf特异性杀死hela-cd22靶细胞(未显示)。
实施例13
cd19-tf-car-t细胞和cd22-tf19-car-t细胞杀死raji(cd19阳性和cd22阳性)淋巴瘤细胞:
接下来,针对抗cd19和cd22抗原阳性的raji淋巴癌细胞,我们确定了cd19-tf-car-t细胞的高细胞毒性(图5)。针对内源性表达cd19的raji细胞,cd19-tfcar-t具有高度细胞毒性(图5)。在raji细胞中,并未观察到cd19-tf和cd19-car-t细胞之间活性的显著差异(未显示)。
实施例14
cd19-tf比cd19-car-t细胞分泌显著更少的ifn-γ:
针对raji细胞,我们测定了cd19和cd19-tf-car-t细胞分泌的ifn-γ的elisa(图6)。cd19-tfcar-t细胞比cd19-car-t细胞分泌著着更少的ifn-γ(图6)。在hela-cd19细胞中,也观察到相对于cd19-car-t细胞,cd19-tf细胞分泌的ifn-γ减少(cd19-tf细胞等于6128pg/ml;cd19-car细胞等于8868.3pg/ml-t细胞)。
实施例15
cd22-tf比cd22-car-t细胞分泌显著更少的ifn-γ:
针对靶向raji细胞,cd22-tf分泌的ifn-γ水平显著低于cd22-car-t细胞(图7)。
实施例16
针对raji细胞,cd19-tf比cd19-car-t细胞分泌更少的il-2和il-6:
在raji细胞中,cd19-tf-car-t细胞比cd19-car-t细胞分泌较少的il-2(图8)和il-6(图9)。针对raji细胞,cd22-car-t和cd22-tfcar-t细胞分泌非常低的il-2和il-6(未显示)。
实施例17
针对靶向hela-cd19细胞和raji细胞,cd19-1/2tf-和cd19-2tf-car与cd19-car具有相同的细胞毒活性:
如图2所示,为了分析更长和更短tf序列是否会产生与cd19-car具有相同的细胞毒活性,我们使用cd19-1/2tf(seqidno13)和cd19-2xtf(seqidno14)检测cd19阳性靶细胞。对于靶向hela-cd19细胞(图10)和淋巴瘤raji细胞(图11),cd19-1/2tf-和cd19-2tf-car-t细胞均具有与cd19-car-t细胞同样的细胞毒性。这表明tf组合可用于产生具有与亲本cd19-car-t细胞相同细胞毒活性的car-t细胞。
实施例18
bcma-tf-car-t细胞比bcma-car-t细胞分泌显著更少的il-2:
对于bcma-b-car-t细胞,在rpmi8226靶细胞中观察到bcma-tf-car-t细胞(bcma-a-tf和bcma-b-tf)分泌的il-2和il-6减少(图12)。
双cd19加cd22或bcma加mm标记(cs-1,cd138,cd38)-car-t可用更少的细胞因子分泌更有效安全地杀死靶癌细胞。
- 还没有人留言评论。精彩留言会获得点赞!