一种探针的用途的制作方法
本发明属于分析检测领域,具体涉及一种探针的用途。
背景技术
锌离子是生物体内一种必不可少的微量元素,广泛的存在于细胞和体液中,在生长发育、生殖、神经信号传递、基因录入、核酸识别、细胞生长调节、凋亡等生理过程中锌离子具有重要作用。锌离子的摄入量过多或不足都会使生物体的生长发育紊乱,引起多种疾病,如食欲下降、免疫力低下、糖尿病、前列腺癌等疾病都与锌离子失衡有关。因此,开发和研究新型的锌离子检测方法对于生物科学和环境科学都有着重要的意义。
技术实现要素:
本发明是针对现有技术存在的不足提供一种锌离子探针及合成方法和应用。
本发明的目的可以通过以下技术方案实现:
一种锌离子探针,该探针的结构式如下:
一种上述的锌离子探针的制备方法,反应路线如下:
具体包括以下步骤:
第一步:该方法以化合物ⅰ为原料,在弱碱性催化剂的作用下与氯乙酰氯进行反应,得到化合物ⅱ;
在一些实施例方案中:第一步反应所用的溶剂为二氯甲烷、四氢呋喃、甲苯。第一步反应所用的弱碱性催化剂为二甲氨基吡啶、吡啶和三乙胺中的任意一种。第一步反应温度为-10~0℃。
在一些更为具体的实施方案中:化合物ⅰ与弱碱性催化剂的摩尔比为1:1-1:5。
第二步:在碘化钾为催化剂,在缚酸剂存在的条件下,化合物ⅱ与水杨醛腙进行反应,得到化合物ⅲ。
在一些实施例方案中:第二步反应所用的溶剂为乙腈、乙醇、二氯甲烷。第二步反应所用的缚酸剂为碳酸钾、碳酸钠和三乙胺中的至少一种。第二步反应温度为加热回流温度。
在一些更为具体的实施方案中:化合物ⅱ与缚酸剂的摩尔比为1:1-1:10。
本发明技术方案中:上述的探针作为检测锌离子的应用。
本发明的有益效果:
本发明合成方法简单,易于工业化生产,作为探针分子检测锌离子检出限低且选择性高。
附图说明
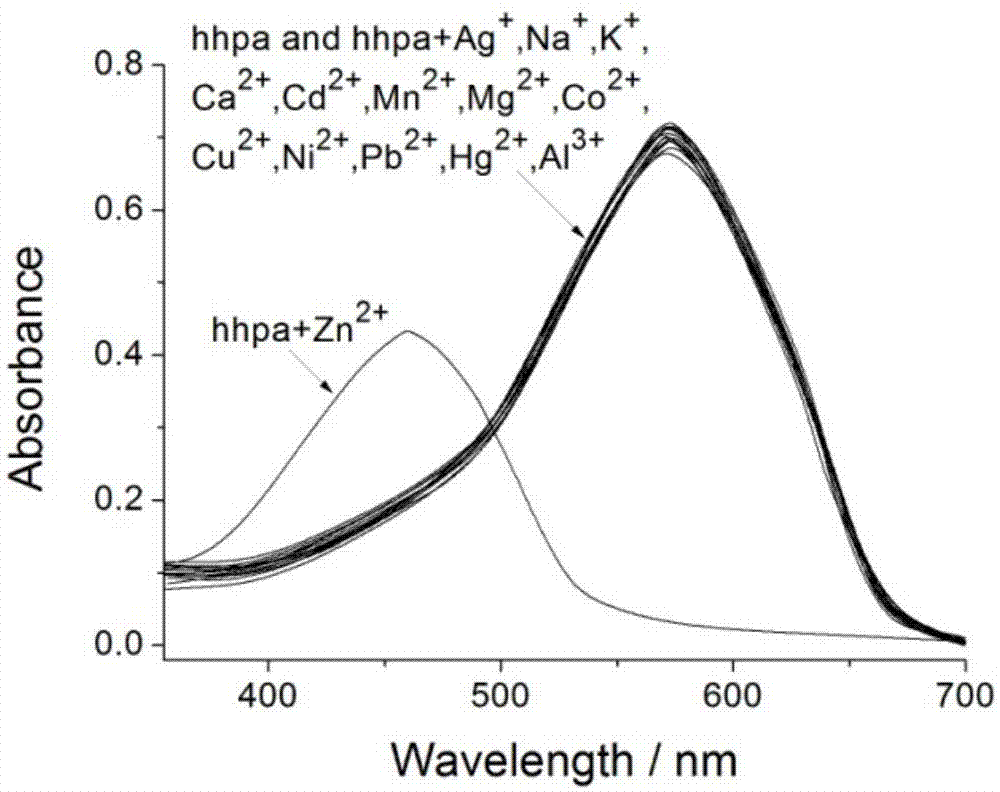
图1是探针分子hhpa对zn2+的选择性吸收光谱识别。
图2为zn2+对探针分子hhpa的吸收光谱滴定图。
图3是探针分子hhpa对zn2+的选择性荧光光谱识别。
图4为zn2+对探针分子hhpa的荧光光谱滴定图。
图5为当溶液中有其它共存金属离子时对探针hhpa选择性识别zn2+的影响图。
图6为zn2+与探针分子hhpa反应时间对溶液荧光强度的影响图;
图7为探针分子hhpa在不同zn2+浓度溶液中的荧光强度。
具体实施方式
下面结合实施例对本发明做进一步说明,但本发明的保护范围不限于此:
实施例1
在250ml三颈烧瓶中依次加入吩噁嗪-3-胺(1.98g,10mmol)、100ml二氯甲烷和4-二甲氨基吡啶(1.22g,10mmol),在冰盐水浴中充分冷却,然后用恒压漏斗将20ml溶有氯乙酰氯(1.13g,10mmol)的二氯甲烷溶液缓慢的滴加到充分搅拌的三颈烧瓶中,控制三颈烧瓶中的反应液温度不要超过0℃,滴加完成后,继续在冰盐水浴中反应2h。反应完成后,用0.1mol/l的naoh溶液调节反应液的ph值到9左右。然后用二氯甲烷(3×25ml)萃取反应液,合并有机相并用水(3×25ml)洗,再用无水na2so4干燥过夜。过滤后将滤液旋蒸,除去有机溶剂,得到蓝绿色固体产物ⅱ2.54g,产率:92.7%,纯度:99.36%。元素分析:(%)forc14h11n2o2cl:计算值:c61.21;h4.04;n10.20,实测值:c61.43;h4.18;n10.07。
ir(kbr),ν,cm-1:3462,3397,1638,1329,1287,1209,1117,1083,921,848,741,718。
1hnmr(500mhz,cdcl3,tms):δ=7.73(s,1h),7.45(s,1h),7.24(d,j=7.2,1h),6.83(t,j=7.2,1h),6.72-6.68(m,2h),6.61-6.57(m,2h),6.42(s,1h),4.31(s,2h)ppm.
在100ml的烧瓶中,将化合物ⅱ(1.37g,5mmol)、碘化钾(0.83mg,0.005mmol)和无水碳酸钾(1.38g,5mmol)溶于40ml的乙腈中,在回流和搅拌的条件下,用恒压漏斗缓慢滴加溶有水杨醛腙(0.68g,5mmol)的15ml的乙腈溶液,控制在1h滴完。滴加完成后继续回流反应20h,反应结束后将反应液冷却至室温,并将反应液倒入水中。然后用二氯甲烷(3×25ml)萃取,合并有机相,再用饱和nacl溶液(3×25ml)洗涤。有机相用无水na2so4干燥过夜。过滤后将滤液旋蒸,除去有机溶剂,得到粗产物。将此粗产物过硅胶柱提纯(乙酸乙酯:石油醚=1:5),蒸干溶剂得蓝绿色固体产物ⅲ(hhpa)1.72g,产率:92.0%,纯度:99.43%。
元素分析:(%)forc21h18n4o3:计算值:c67.37;h4.85;n14.96,实测值:c67.51;h4.83;n14.78。
ir(kbr),ν,cm-1:3413,1624,1406,1338,1276,1251,1210,1127,1064,961,917,854,731,662,618。1hnmr(500mhz,cdcl3,tms):10.23(s,1h),8.61(s,1h),8.41(t,j=7.2,1h),7.71(s,1h),7.43(s,1h),7.41-7.35(m,2h),7.23-7.19(m,3h),6.85(t,j=7.2,1h),6.72-6.67(m,2h),6.62-6.57(m,2h),6.42(s,1h),4.25(d,j=7.2,2h)ppm.
实施例2
在250ml三颈烧瓶中依次加入吩恶嗪-3-胺(1.98g,10mmol)、100ml四氢呋喃和3ml吡啶,在冰盐水浴中充分冷却,然后用恒压漏斗将20ml溶有氯乙酰氯(1.13g,10mmol)的二氯甲烷溶液缓慢的滴加到充分搅拌的三颈烧瓶中,控制三颈烧瓶中的反应液温度不要超过0℃,滴加完成后,继续在冰盐水浴中反应2h。反应完成后,用0.1mol/l的naoh溶液调节反应液的ph值到9左右。然后用二氯甲烷(3×25ml)萃取反应液,合并有机相并用水(3×25ml)洗,再用无水na2so4干燥过夜。过滤后将滤液旋蒸,除去有机溶剂,得到蓝绿色固体产物ⅱ2.50g,产率:91.2%,纯度:99.27%。
在100ml的烧瓶中,将化合物ⅱ(1.37g,5mmol)、碘化钾(0.83mg,0.005mmol)和无水碳酸钠(2.12g,10mmol)溶于40ml的乙醇中,在回流和搅拌的条件下,用恒压漏斗缓慢滴加溶有水杨醛腙(0.68g,5mmol)的15ml的乙腈溶液,控制在1h滴完。滴加完成后继续回流反应20h,反应结束后将反应液冷却至室温,并将反应液倒入水中。然后用二氯甲烷(3×25ml)萃取,合并有机相,再用饱和nacl溶液(3×25ml)洗涤。有机相用无水na2so4干燥过夜。过滤后将滤液旋蒸,除去有机溶剂,得到粗产物。将此粗产物过硅胶柱提纯(乙酸乙酯:石油醚=1:5),蒸干溶剂得蓝绿色固体产物ⅲ(hhpa)1.69g,产率:90.4%,纯度:99.31%。
实施例3
在250ml三颈烧瓶中依次加入吩恶嗪-3-胺(1.98g,10mmol)、100ml甲苯和7ml三乙胺,在冰盐水浴中充分冷却,然后用恒压漏斗将20ml溶有氯乙酰氯(1.13g,10mmol)的二氯甲烷溶液缓慢的滴加到充分搅拌的三颈烧瓶中,控制三颈烧瓶中的反应液温度不要超过0℃,滴加完成后,继续在冰盐水浴中反应2h。反应完成后,用0.1mol/l的naoh溶液调节反应液的ph值到9左右。然后用二氯甲烷(3×25ml)萃取反应液,合并有机相并用水(3×25ml)洗,再用无水na2so4干燥过夜。过滤后将滤液旋蒸,除去有机溶剂,得到蓝绿色固体产物ⅱ2.46g,产率:89.8%,纯度:98.77%。
在100ml的烧瓶中,将化合物ⅱ(1.37g,5mmol)、碘化钾(0.83mg,0.005mmol)和7ml三乙胺溶于40ml的二氯甲烷中,在回流和搅拌的条件下,用恒压漏斗缓慢滴加溶有水杨醛腙(0.68g,5mmol)的15ml的乙腈溶液,控制在1h滴完。滴加完成后继续回流反应20h,反应结束后将反应液冷却至室温,并将反应液倒入水中。然后用二氯甲烷(3×25ml)萃取,合并有机相,再用饱和nacl溶液(3×25ml)洗涤。有机相用无水na2so4干燥过夜。过滤后将滤液旋蒸,除去有机溶剂,得到粗产物。将此粗产物过硅胶柱提纯(乙酸乙酯:石油醚=1:5),蒸干溶剂得蓝绿色固体产物ⅲ(hhpa)1.63g,产率:87.2%,纯度:99.27%。
性质部分
1、吸收光谱实验
探针分子hhpa对zn2+的吸收光谱识别
如图1所示,在10ml浓度为0.1mmol/l探针分子hhpa溶液中分别加入10μl浓度为0.5mol/l(5倍摩尔量)的金属离子溶液(ag+、na+、k+、ca2+、cd2+、mn2+、mg2+、co2+、cu2+、ni2+、pb2+、hg2+、al3+、zn2+)。实验中所使用的溶液体系均为乙腈/水(v/v=1/2)的混合溶液,吸收光谱在岛津uv-2450型紫外分光光度计上测定。由图1可以看出探针分子在乙腈/水(v/v=1/2)的混合溶液中自身的吸收在580nm左右,当我们向探针分子溶液中加入过量的金属离子后,我们发现只有在加入zn2+后,原来位于580nm处的吸收峰消失,而在460nm处有一个新的新的吸收峰出现,蓝移了120nm,溶液的颜色也由蓝色变为黄色,而当在探针分子溶液中加入其它金属离子时,则没有这一现象的发生,这说明该探针分子的吸收光谱对zn2+有着独特的响应。
如图2所示,在10ml浓度为0.1mmol/l探针hhpa溶液中依次加入0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95、1.0、1.2、1.5倍摩尔量的zn2+。实验中所使用的溶液体系均为乙腈/水(v/v=1/2)的混合溶液,吸收光谱在岛津uv-2450型紫外分光光度计上测定。由图2可以看出,随着zn2+的加入,溶液的吸收波长逐渐由580nm蓝移至460nm,当zn2+加入量达到探针分子1倍摩尔量之后,溶液的吸收波长不再移动,且吸收峰的强度基本保持不变。这说明探针分子hhpa与zn2+是1:1配位的。
2、荧光光谱实验
探针分子hhpa对zn2+的荧光识别
如图3所示,将探针分子ddpb溶于乙腈/水(v/v=1/2)的混合溶液中,配制成浓度为10μmol/l的溶液,在此溶液中分别加入5倍摩尔量的金属离子(ag+、na+、k+、ca2+、cd2+、mn2+、mg2+、co2+、cu2+、ni2+、pb2+、hg2+、al3+、zn2+)。激发波长为460nm,测定溶液的荧光光谱。从图3中可以看出,探针分子溶液在665nm处有一个较弱荧光发射峰,在加入过量的zn2+后,溶液在665nm处弱荧光发射峰消失,而在585nm处出现一个很强的荧光发射峰,而加入其它金属离子则没有这一现象,这说明该探针分子对zn2+表现出非常强的荧光选择识别性。实验中所使用的溶液体系均为乙腈/水(v/v=1/2)的混合溶液,荧光光谱在amincobowmanseries2荧光光谱仪上测得。
如图4所示,在10μmol/l的探针分子hhpa的乙腈/水(v/v=1/2)的混合溶液中,分别加入0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95、1.0、1.2、1.5倍摩尔量的zn2+。在460nm处激发,测量溶液的发射光谱,如图所示随着zn2+的浓度增加,665nm处弱荧光发射峰逐渐减弱最终消失,而在585nm处出现一个新的荧光发射峰,并且在zn2+加入量达到1倍摩尔量之后585nm处的发射峰强度基本不再增加。
如图5所示,在10μmol/l的探针分子hhpa的乙腈/水(v/v=1/2)的混合溶液中,分别加入溶有10倍摩尔量的金属离子(ag+、na+、k+、ca2+、cd2+、mn2+、mg2+、co2+、cu2+、ni2+、pb2+、hg2+、al3+),在激发波长460nm,发射波长585nm处,测量溶液的荧光强度,然后再在上述溶液中加入10倍摩尔量的zn2+,在激发波长460nm,发射波长585nm处,测量溶液的荧光强度,从图5中可以看出,当溶液中大量存在其他金属离子时,探针分子hhpa对zn2+的选择性识别并不受影响。
如图6所示,在10μmol/l的探针分子hhpa的乙腈/水(v/v=1/2)的混合溶液中,加入2倍摩尔量的zn2+。在激发波长460nm,发射波长585nm处,分别在0、1、2、3、4、5、6、7、8、9、10分钟时记录溶液的荧光强度。如图6所示,在探针分子hhpa溶液中加入zn2+2分钟后,荧光发射强度即达到最大值,且随着时间延长基本保持不变。
如图7所示,分别在10ml浓度为0.2-2μmol/l(以0.05μmol/l浓度递增)的zn2+乙腈/水(v/v=1/2)的混合溶液中加入0.1ml浓度为1mmol/l的hhpa溶液,在激发波长460nm,发射波长585nm处,测量溶液的荧光强度。从图中可以看出当zn2+浓度在0.2-1.1μmol/l范围内呈现出良好的线性关系(r2=0.9988),使用3σiupac标准计算所得的检测限为1.26×10-7mol/l。
- 还没有人留言评论。精彩留言会获得点赞!