一种检测常见益生菌丰度的试剂盒的制作方法
本发明涉及一种检测常见益生菌丰度的试剂盒。
背景技术:
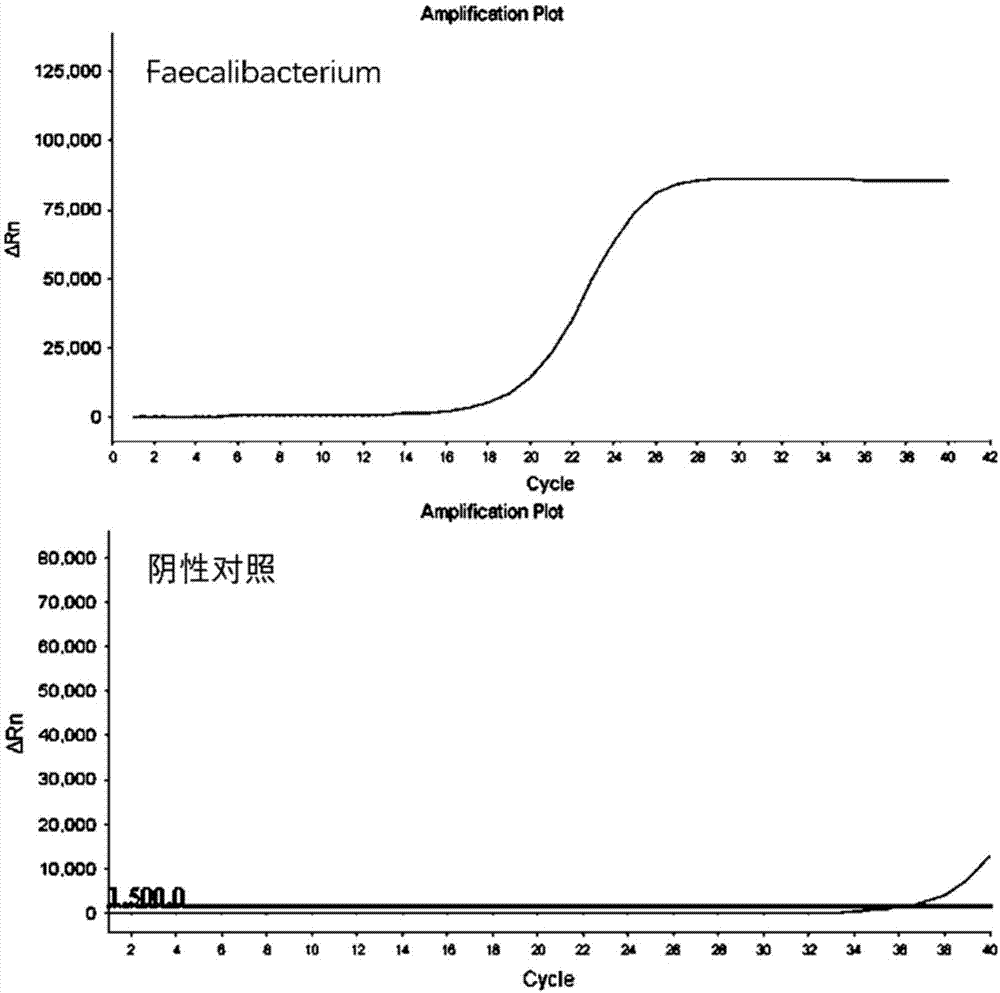
:肠道菌群大约包括两千多种菌。肠道菌群构成与生活习惯,饮食和宿主的基因密切相关,个体间存在着较大的差异。厚壁菌门,拟杆菌门,放线菌门,这三个门在人体肠道菌群中占支配地位,厌氧菌如拟杆菌属、真杆菌属、双歧杆菌属、梭菌属、消化链球菌属等占了肠道菌群的主要部分,而兼性厌氧菌如乳酸杆菌属、肠球菌属、链球菌属、肠杆菌属等只占了很小的一部分。肠道菌群与宿主构成动态平衡的微生态系统,参与多种生理活动:参与营养物质消化吸收,酵解纤维素、低聚糖等产生可吸收的短链脂肪酸等;参与营养物质合成,合成维生素b族,维生素k、叶酸等;参与免疫调节,肠道菌群在机体免疫发育过程中发挥着重要作用,保持机体免疫功能处于一个适度的活跃状态;参与神经调控,肠道菌群代谢产物中含有γ氨基丁酸与五羟色胺等神经递质,通过肠脑轴调控神经系统功能;参与生长发育与衰老,肠道菌群随着年龄的增长而发生着动态变化;构成肠道黏膜的保护屏障,肠道菌群维持肠道微生态平衡,形成生物屏障,抵御致病菌的侵袭。通过检测肠道菌群的组成情况,可以对个体肠道菌群的评估、干预提供可靠的判断依据。目前检测肠道菌群方法主要包括16srrna测序及荧光定量pcr鉴定。16s测序通过16s通用引物扩增后通过二代测序方法鉴定肠道菌群的丰度,优点是通量较大,准确性高,缺点是操作时间长、建库流程复杂、周期较长、成本较高。荧光定量pcr肠道菌群丰度,通过设计特异性的引物对特定的dna序列进行扩增,灵敏度、特异性高,缺点是通量较小,且引物特异性需要得到保障,优点是成本较低,实验周期较短、且成本较低。肠道菌群组成复杂,且很多菌株极其接近,直接使用荧光pcr对肠道菌群进行扩增,往往存在特异性差,扩增效率低下,现有技术中缺乏可以应对这种复杂样本的引物。如何高通量低成本地检测常见肠道菌群丰度,是一项具有挑战性的工作。技术实现要素:本发明的目的在于克服现有技术的不足,提供一种高通量、低成本的常见肠道菌群丰度检测试剂盒。本发明所采取的技术方案是:一种检测肠道常见益生菌丰度的引物组,包括如下序列:faecalibacterium:上游序列:ggtcttcggattgtaaactcctg(seqidno:1)下游序列:gtaattccggacaacgcttgtg(seqidno:2)lactobacillus:上游序列:gtggaactccatgtgtagcgg(seqidno:3)下游序列:ggcggaaaccctccaacac(seqidno:4)bifidobacterium:上游序列:cgggtgagtaatgcgtgacc(seqidno:5)下游序列:tgataggacgcgacccca(seqidno:6)akkermansiamuciniphila:上游序列:cggcacatgatactgcgagac(seqidno:7)下游序列:tcagttaatgtccaggaacccg(seqidno:8)总菌:上游序列:cctacgggaggcagcag(seqidno:9)下游序列:attaccgcggctgctgg。(seqidno:10)一种检测肠道常见益生菌丰度的试剂盒,包括pcr反应体系,其引物组如上所示。作为上述试剂盒的进一步改进,pcr反应体系为qpcr反应体系。作为上述试剂盒的进一步改进,qpcr反应体系的组成为:成分体积(μl)荧光染料5正向引物(2.5μm)0.5反向引物(2.5μm)0.5模板dna(2ng/μl)1udg酶0.01水补足至10μl。作为上述试剂盒的进一步改进,荧光染料为lightcycler480sybrgreenimaster。作为上述试剂盒的进一步改进,pcr的程序包括:作为上述试剂盒的进一步改进,72℃时收集荧光。一种测定肠道常见益生菌丰度的方法,包括:1)提取粪便微生物基因组dna作为模板dna;2)使用权利要求1所述的引物组对模板dna进行扩增;3)根据扩增结果确定肠道常见益生菌丰度。作为上述方法的进一步改进,qpcr反应体系的组成为:成分体积(μl)荧光染料5正向引物(2.5μm)0.5反向引物(2.5μm)0.5模板dna(2ng/μl)1udg酶0.01水补足至10μl。作为上述方法的进一步改进,荧光染料为lightcycler480sybrgreenimaster。作为上述方法的进一步改进,pcr的程序包括:本发明的有益效果是:本发明的引物,扩增特异性好,扩增效率高,可以从复杂的肠道微生物菌群总dna中特异性扩增出相应的益生菌,其结果与成熟的方法相同。本发明的试剂盒,可以实现对常见益生菌的快速、直观的检测,缩短了检测周期,降低了检测成本。附图说明图1是faecalibacterium及其阴性对照的qpcr曲线;图2是lactobacillus及其阴性对照的qpcr曲线;图3是akkermansiamuciniphila及其阴性对照的qpcr曲线;图4是bifidobacterium及其阴性对照的qpcr曲线;图5是总菌及其阴性对照的qpcr曲线;图6是不同扩增产物的凝胶电泳结果;图7分别是faecalibacterium和lactobacillus扩增产物的熔解曲线;图8分别是akkermansiamuciniphila、bifidobacterium和总菌扩增产物的熔解曲线;图9是对照组扩增产物的凝胶电泳结果。具体实施方式发明人通过一系列研究,创造性针对常见肠道菌群16s或其它特异基因设计了一系列引物,并改进实验条件,对pcr扩增步骤进行分步优化,实现对常见肠道菌群的准确检测,检测结果快速、直观、方便进对个体肠道菌群的评估。下面结合实施例,对本发明的技术进行进一步的说明。引物设计难点在于找到细菌基因中具有特异性的序列,细菌的种属复杂,各个种属之间存在着或远或近的亲缘关系,譬如同一个科或属的细菌序列存在着极大的同源性,因此设计的引物往往存在着非特异性的扩增,不能达到特异扩增目标产物的效果。本发明人通过自有技术,从大量的数据中分析并设计、筛选出特异性最好及扩增效率最高的引物,这些引物具有特异性高,没有非特异性扩增的特点,pcr操作本身是较为成熟的,条件根据引物本身的条件而变化。下面结合实施例,进一步说明本发明的技术方案。实施例1:引物序列:faecalibacterium:上游序列:ggtcttcggattgtaaactcctg下游序列:gtaattccggacaacgcttgtglactobacillus:上游序列:gtggaactccatgtgtagcgg下游序列:ggcggaaaccctccaacacbifidobacterium:上游序列:cgggtgagtaatgcgtgacc下游序列:tgataggacgcgaccccaakkermansiamuciniphila:上游序列:cggcacatgatactgcgagac下游序列:tcagttaatgtccaggaacccg总菌:上游序列:cctacgggaggcagcag下游序列:attaccgcggctgctgg。qpcr反应体系的组成为:成分体积(μl)荧光染料5正向引物(2.5μm)0.5反向引物(2.5μm)0.5模板dna(2ng/μl)1udg酶0.01水补足至10μl荧光染料为lightcycler480sybrgreenimaster。粪便微生物基因组dna处理和常见肠道菌定量流程提取粪便微生物基因组dna并调整其浓度为2ng/μl;按照qpcr反应体系组成,在光学96孔pcr板中配制qpcr反应体系。每个样本5对引物,每对引物2个反应孔,共10个反应孔。每个pcr板做5个阴性对照(每对引物一个阴性对照);在荧光定量pcr仪上进行pcr,pcr的程序包括:72℃收集荧光qpcr结束,将baseline置于扩增曲线对数增长期前期,得到各个孔的ct值,去掉数据不可用的孔(ct值大于30,扩增效率低等),求出同一样本的相同引物做的重复孔的ct值的平均值,用总菌引物得到的平均ct值减去待测菌引物的平均ct值,得到δct值,2δct(2的δct次方)即为待测菌占总菌的比例。标准品浓度梯度:标准品浓度梯度ng/μl,总菌标准品为四种标准品混合按照1:1:1:1混合。引物扩增效果的验证扩增结束后,按如下程序测定其熔解曲线,实验结果:图1~5分别是faecalibacterium、lactobacillus、akkermansiamuciniphila、bifidobacterium和总菌及其阴性对照的qpcr曲线。从图中可以看出,引物具有很好的扩增效率。将标准品梯度稀释,稀释成为1ng/μl,0.1ng/μl,0.01ng/μl,0.001ng/μl,后进行qpcr观察其线性程度,如下表,可见梯度稀释后引物ct值的线性度很好,证明引物在各个浓度条件下均具有良好的扩增效果。pcr产物进行凝胶电泳结果如图6所示,其中fae代表faecalibacterium,lac代表lactobacillus,akk代表akkermansiamuciniphila,bif代表bifidobacterium。从图中可以看出,扩增产物条带单一、清晰,说明扩增产物具有很高的纯度,所使用的引物具有很好的特异性。扩增产物的熔解曲线如图7和图8所示。从图中可以看出,faecalibacterium、lactobacillus、akkermansiamuciniphila、bifidobacterium和总菌的溶解曲线峰都非常单一,引物特异性好。对比例:发明人根据常规方法,针对上述菌群的16srna保守序列设计引物并进行扩增,所使用的引物序列如下:faecalibacterium:上游序列:agatggcctcgcgtccga(seqidno:11)下游序列:ccgaagaccttcttcctcc(seqidno:12)lactobacillus:上游序列:agcagtagggaatcttcca(seqidno:13)下游序列:caccgctacacatggag(seqidno:14)bifidobacterium:上游序列:gggtggtaatgccggatg(seqidno:15)下游序列:taagccatggactttcacacc(seqidno:16)akkermansiamuciniphila:上游序列:gtcatgtgggagcaaattaaaaag(seqidno:17)下游序列:gtatcatgtgccgtccgcg(seqidno:18)扩增产物的凝胶电泳结果如图9所示。从图中可以清楚地看出扩增结果中具有明显的非特异性条件,说明常规方法设计得到的引物特异差,扩增结果不可靠,无法用于常见益生菌的丰度检测。sequencelisting<110>人和未来生物科技(长沙)有限公司<120>一种检测常见益生菌丰度的试剂盒<130><160>18<170>patentinversion3.5<210>1<211>23<212>dna<213>人工引物<400>1ggtcttcggattgtaaactcctg23<210>2<211>22<212>dna<213>人工引物<400>2gtaattccggacaacgcttgtg22<210>3<211>21<212>dna<213>人工引物<400>3gtggaactccatgtgtagcgg21<210>4<211>19<212>dna<213>人工引物<400>4ggcggaaaccctccaacac19<210>5<211>20<212>dna<213>人工引物<400>5cgggtgagtaatgcgtgacc20<210>6<211>18<212>dna<213>人工引物<400>6tgataggacgcgacccca18<210>7<211>21<212>dna<213>人工引物<400>7cggcacatgatactgcgagac21<210>8<211>22<212>dna<213>人工引物<400>8tcagttaatgtccaggaacccg22<210>9<211>17<212>dna<213>人工引物<400>9cctacgggaggcagcag17<210>10<211>17<212>dna<213>人工引物<400>10attaccgcggctgctgg17<210>11<211>18<212>dna<213>人工引物<400>11agatggcctcgcgtccga18<210>12<211>19<212>dna<213>人工引物<400>12ccgaagaccttcttcctcc19<210>13<211>19<212>dna<213>人工引物<400>13agcagtagggaatcttcca19<210>14<211>17<212>dna<213>人工引物<400>14caccgctacacatggag17<210>15<211>18<212>dna<213>人工引物<400>15gggtggtaatgccggatg18<210>16<211>21<212>dna<213>人工引物<400>16taagccatggactttcacacc21<210>17<211>24<212>dna<213>人工引物<400>17gtcatgtgggagcaaattaaaaag24<210>18<211>19<212>dna<213>人工引物<400>18gtatcatgtgccgtccgcg19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1