活性肽、重组载体、重组细胞、药物组合物及其制备方法和应用与流程
本发明涉及生物
技术领域:
,特别是涉及一种活性肽、重组载体、重组细胞、药物组合物及其制备方法和应用。
背景技术:
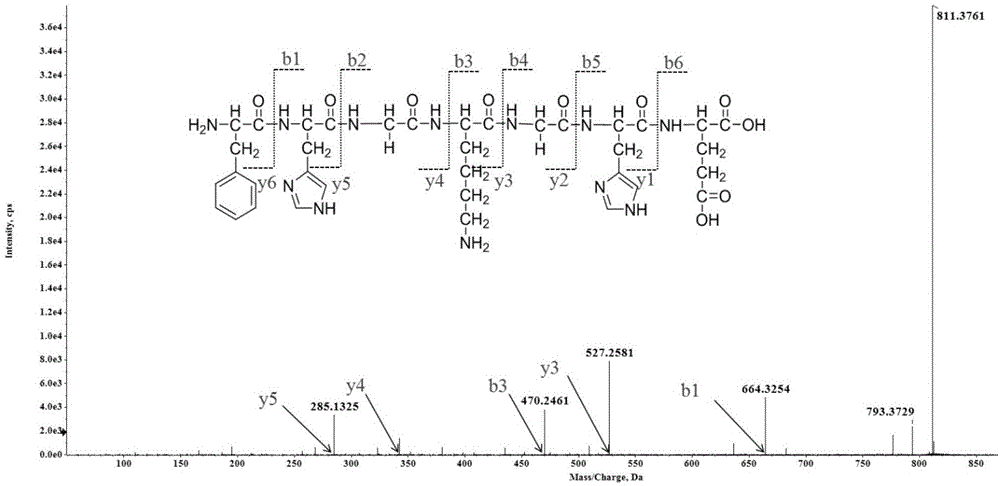
:正常生命过程中生物体会不断地产生自由基,适量的自由基可维持生物体的正常生理代谢,但是过量的自由基会导致细胞组织受到肿瘤胁迫,肿瘤系统和抗肿瘤系统失衡,从而导致机体组织细胞中蛋白和核酸等生物大分子发生损伤,进而引发癌症的产生,对人体健康造成极大损害。因此,有效的抗肿瘤物质进行抗肿瘤对于维护机体健康具有极其重要的作用。近年来,肿瘤化疗取得了相当的进步,肿瘤患者生存时间明显延长,特别是对白血病、恶性淋巴瘤等治疗有了突破,但对危害人类生命健康最严重的、占恶性肿瘤90%以上的实体瘤的治疗未能达到满意的效果。目前,非小细胞肺癌(non-smallcelllungcancer,nsclc)是全球癌症患者死亡的主要原因,对于进展期的nsclc一线治疗是以铂类为基础的化疗,新一代的化疗药物对nsclc转移性患者的疗效有所提高,中位生存期为8~9个月,1年生存率为40%。但是,化疗对人体具有较大的副作用。目前,在医学上有多种抗nsclc的药物,但这些药物大多具有不同程度的副作用,不宜长期服用。技术实现要素:基于此,有必要提供一种能够抑制非小细胞肿瘤细胞增殖且安全性较高的活性肽。一种活性肽,所述活性肽含有氨基酸序列如seqidno.1所示的短肽。上述活性肽含有phe-his-gly-lys-gly-his-glu,使得该活性肽能够有效地抑制非小细胞肿瘤细胞增殖,且该活性肽无毒副作用,安全性较高。经试验验证,该活性肽能够提高非小细胞肺癌细胞内ros(活性氧簇),降低非小细胞肺癌细胞内线粒体膜电位,抑制非小细胞肺癌细胞增殖,促进非小细胞肺癌细胞凋亡,以达到抗非小细胞肺癌的目的。一种重组载体,含有上述所述短肽的编码序列。在其中一个实施例中,所述编码序列如seqidno.2所示的核苷酸序列;或所述编码序列为与seqidno.2所示核苷酸序列具有80%同源性的核苷酸序列;或所述编码序列为由seqidno.2所示核苷酸序列中一个或多个碱基被缺失、替代或增加得到的核苷酸序列。一种重组细胞,所述重组细胞含有编码上述所述的活性肽的核苷酸;或者,所述重组细胞含有上述所述的重组载体。一种药物组合物,包括活性组分,所述活性组分包括上述所述的活性肽。上述所述的活性肽、上述所述的重组载体、上述所述的重组细胞或上述所述的药物组合物在制备抑制非小细胞肺癌细胞增殖的药物中的应用。上述所述的活性肽、上述所述的重组载体、上述所述的重组细胞或上述所述的药物组合物在制备预防或治疗非小细胞肺癌的药物中的应用。上述所述的活性肽在制备食品或保健品中的应用。上述所述的活性肽的制备方法,其特征在于,包括如下步骤:从石金钱龟中分离得到所述活性肽;或通过化学合成方法合成所述活性肽。在其中一个实施例中,所述从石金钱龟中分离得到所述活性肽包括如下步骤:将石金钱龟肉酶解,得到酶解物;及采用有机溶剂对所述酶解物进行萃取,得到所述活性肽。附图说明图1为实施例1的活性肽的质谱图;图2为实施例1的活性肽的高效液相色谱图;图3为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞的凋亡作用的facs分析的散点对比图;图4为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞的凋亡比例的柱状统计图;图5为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞的细胞周期的影响的facs分析对比图;图6为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞的细胞周期的影响的柱状对比图;图7为表示con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞内ros含量的对比图;图8为mclo-12-3组的肿瘤细胞内ros随培养时间的变化曲线图;图9为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞内线粒体膜电位下降的细胞比例的对比图;图10为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中caspase9、cleavedcaspase9、caspase3、cleavedcaspase3及cleavedparp蛋白相对表达量的电泳对比图;图11为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中caspase9、cleavedcaspase9、caspase3、cleavedcaspase3及cleavedparp蛋白相对表达量的柱状对比图;图12为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中trxr、trx、ask及p-ask1蛋白相对表达量的电泳对比图;图13为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中trxr、trx、ask及p-ask1蛋白相对表达量的柱状对比图;图14为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中jnk、p-jnk、p38、p-p38、erk1/2及p-erk1/2蛋白相对表达量的电泳对比图;图15为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中jnk、p-jnk、p38、p-p38、erk1/2及p-erk1/2蛋白相对表达量的柱状对比图。具体实施方式为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。一实施方式的活性肽含有氨基酸序列如seqidno.1所示的短肽。具体地,seqidno.1所示的氨基酸序列为phe-his-gly-lys-gly-his-glu。其中,phe表示苯丙氨酸,缩写为f。his表示组氨酸,缩写为h。lys表示赖氨酸,缩写为k。glu表示谷氨酸,也简写为e。gly表示甘氨酸,缩写为g。由于蛋白编码序列的多态性及变异,天然存在的蛋白质会出现基因突变,编码序列中碱基被缺失、替代或增加,或氨基酸的缺失、插入、取代或其它变异,从而导致蛋白质的氨基酸序列出现一个或多个氨基酸被缺失、替代或增加。因此,存在着一些生理和生物活性上基本等同于无变异蛋白质的蛋白。这些结构不同于相应的蛋白质,但与该蛋白质没有明显的功能差异的多肽或蛋白称为功能等同变异体。功能等同的变异体同样适用于通过缺失、插入和突变等人工手段改变一个或多个密码子,从而向一种蛋白质的氨基酸序列中导入这类变异而制成的短肽。尽管这样能获得更多不同形式的变异体,但所得的变异体作为功能等同变异体的前提是其生理活性基本等同于原始无变异蛋白质的活性。一般的,功能等同变异体的编码序列是同源的,因此,由至少一种改变(如蛋白质的编码序列中一个或多个碱基的缺失、插入或取代或者蛋白质的氨基酸序列中有一个或多个氨基酸缺失、插入或取代)所得的多肽或蛋白一般具有功能上等同于所述蛋白质的活性。因此,由上述氨基酸序列组成的短肽,如果其构成的活性肽没有明显的功能差异,也包括在本发明的范围内。在具体实施例中,活性肽具有如下结构式:在其中一个实施例中,活性肽的氨基酸序列如seqidno.1所示。该活性肽的肽链较短,易于吸收和利用。上述活性肽能够抑制非小细胞癌细胞增殖,能够在制备抑制非小细胞肺癌细胞增殖的药物中的应用,同时,该活性肽能够提高非小细胞肺癌细胞内ros,降低非小细胞肺癌细胞内线粒体膜电位,抑制非小细胞肺癌细胞增殖,促进非小细胞肺癌细胞凋亡,以达到抗非小细胞肺癌的目的,进而能够应用于制备预防或治疗非小细胞肺癌的药物中。此外,由于该活性肽具有抑制非小细胞癌细胞增殖、预防或治疗非小细胞肺癌等作用能够应用于食品、保健品及药物中。其中,ros(reactiveoxygenspecies,活性氧簇)。ros是生物有氧代谢过程中的一种副产品,包括氧离子、过氧化物和含氧自由基等。细胞中存在过多的ros能够导致细胞快速凋亡。一实施方式的食品包括上述活性肽。上述活性肽作为食用添加剂,以增强食品的保健功能。在其中一个实施例中,食品为片剂、胶囊、粉剂、颗粒剂、丸剂、糖浆剂、溶液剂、混悬剂或气雾剂。在其中一个实施例中,食品中活性肽的质量百分含量为5%~10%。一实施方式的保健品包括上述活性肽。上述活性肽作用活性成分,以使保健品具有较优的抗肿瘤功效。在其中一个实施例中,保健品呈凝胶状或水剂状。在其中一个实施例中,保健品还包括辅料基质。辅料基质选自单糖、寡糖、多糖、氨基酸、防腐剂、ph调节剂及抗nsclc助剂中的至少一种。其中,抗nsclc助剂包括维生素c、维生素e、辅酶q、谷胱甘肽、胡萝卜素及甜菜碱中的至少一种。在其中一个实施例中,保健品中活性肽与辅料基质的质量比为3:97~5:95。一实施方式的重组载体含有短肽的编码序列。在其中一个实施例中,短肽的编码序列为如seqidno.2所示的核苷酸序列。具体地,seqidno.2所示的核苷酸序列为5’-uuccauggcaagggacacgag-3’。在其中一个实施例中,短肽的编码序列为与seqidno.2所示核苷酸序列具有80%同源性的核苷酸序列。在其中一个实施例中,短肽的编码序列为由seqidno.2所示核苷酸序列中一个或多个碱基被缺失、替代或增加得到的核苷酸序列。进一步地,短肽的编码序列为由seqidno.2所示核苷酸序列中一个或多个碱基被其兼并碱基替代得到的核苷酸序列。需要说明的是,由上述核苷酸序列编码的短肽,如果其构成的活性肽没有明显的功能差异,也包括在本研究的范围内。在其中一个实施例中,重组载体为重组表达载体或重组克隆载体。在其中一个实施例中,重组载体含有纯化标签。通过设置纯化标签,有利于活性肽的分离纯化。进一步地,纯化标签为his标签、gst标签或sumo标签。需要说明的是,纯化标签不限于上述指出纯化标签,其他常见的纯化标签也可以作用重组载体的纯化标签。在其中一个实施例中,重组载体包括基因工程载体。编码上述活性肽的核苷酸插入基因工程载体中。进一步地,基因工程载体为pet-32a载体、pgex-6p-1载体、ppic-9k载体或ppic-zα载体。需要说明的是,基因工程载体不限于上述指出基因工程载体,其他常见的基因工程载体也可以作用重组载体的基因工程载体。上述重组载体能够较好地保存编码上述活性肽的核苷酸,有利于活性肽的表达,以能够用于制备抑制非小细胞肺癌细胞增殖的药物,并且能够应用于制备预防或治疗非小细胞肺癌的药物。一实施方式的重组细胞能够表达上述活性肽。在其中一个实施例中,重组细胞含有编码上述活性肽的核苷酸。在其中一个实施例中,重组细胞含有上述重组载体。在其中一个实施例中,重组细胞为克隆编码上述活性肽的核苷酸的细胞。在其中一个实施例中,重组细胞为表达编码上述活性肽的核苷酸的细胞。在其中一个实施例中,重组细胞包括受体细胞。编码上述活性肽的核苷酸或上述重组载体位于受体细胞内。在其中一个实施例中,受体细胞为大肠杆菌、酿酒酵母、毕赤酵母、动物细胞或植物细胞。进一步地,受体细胞为大肠杆菌dh5α、大肠杆菌top10、大肠杆菌orgami(de3)、毕赤酵母gs115或毕赤酵母smd1168。需要说明的是,受体细胞不限于上述指出受体细胞,其他常见的受体细胞也可以作用重组细胞的受体细胞。上述重组细胞能够克隆或表达上述活性肽,使得能够大规模的制备该活性肽,并且通过重组细胞定向表达该活性肽,以能够获得纯度较高的活性肽,进而有利于活性肽的应用,因此,上述重组细胞能够用于制备抑制非小细胞肺癌细胞增殖的药物,并且能够应用于制备预防或治疗非小细胞肺癌的药物。一实施方式的药物组合物,包括活性组分,活性组分包括上述活性肽。在其中一个实施例中,药物组合物还包括药物载体。药物载体用于负载活性组分。在其中一个实施例中,药物载体包括溶剂、聚合物及脂质体中的至少一种。溶剂用于溶解或悬浮活性组分。溶剂包括无菌水、生理盐水及医用上常用非水性溶剂中的一种。其中,医用上常用非水性溶剂例如可以是乙醇。聚合物用于增强活性短肽的水溶性及稳定性。聚合物包括聚赖氨酸、聚赖氨酸改性物、聚乙烯亚胺、聚乙烯亚胺改性物、壳聚糖、聚乳酸及明胶中的至少一种。其中,聚赖氨酸的改性物例如可以是聚赖氨酸的水溶性改性物。聚乙烯亚胺的改性物例如可以是聚乙烯亚胺的水溶性改性物。脂质体用于包裹活性短肽,增强其稳定性。脂质体包括胆固醇及卵磷脂中的至少一种。其中,卵磷脂选自豆卵磷脂及蛋黄卵磷脂中的至少一种。具体地,豆卵磷脂例如可以为大豆卵磷脂。在其中一个实施例中,载体还包括稀释剂及赋形剂中的至少一种。稀释剂用于稀释活性组分。稀释剂包括淀粉、糖、纤维素及无机盐中的至少一种。具体地,淀粉例如可以为支链淀粉。糖例如可以为麒麟菜多糖。纤维素例如可以为甘蔗纤维素。无机盐例如可以为氯化钠。赋形剂用于使药物组合物呈片剂、半固体制剂或液体制剂等形态。需要说明的是,药物组合物不限于为上述指出形态,还可以为其他形态,例如可以是片剂、胶囊、粉剂、颗粒剂、丸剂、糖浆剂、溶液剂、混悬剂或气雾剂。在其中一个实施例中,赋形剂包括黏合剂、填充剂及润滑剂中的至少一种。通过包括该赋形剂,以使药物组合物呈片剂。在其中一个实施例中,赋形剂包括软膏剂的基质部分或霜剂的基质部分。通过包括该赋形剂,以使药物组合物呈半固体制剂。在其中一个实施例中,赋形剂包括防腐剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、着色剂中的至少一种。通过包括该赋形剂,以使药物组合物呈液体制剂。在其中一个实施例中,药物组合物中,活性组分与药物载体的质量比为1:60~1:99。可选地,药物组合物中,活性组分与药物载体的质量比为1:80~1:85。进一步地,药物组合物中,活性组分与药物载体的质量比为1:90~1:95。更进一步地,药物组合物中,活性组分与药物载体的质量比为1:97~1:99。在其中一个实施例中,药物组合物还包括辅助组分。辅助组分包括维生素c、维生素e、辅酶q、谷胱甘肽、胡萝卜素及甜菜碱中的至少一种。通过添加辅助组分,以增强药物组合物抗非小细胞肺癌的能力。需要说明的是,辅助组分不限于上述指出的组分,还可以包括具有其他辅助功效的物质,例如可以是具有抗炎活性的物质。具体地,具有抗炎活性的物质例如可以是蒲公英提取物。在其中一个实施例中,辅助组分与活性组分的质量比为85:1~99:1。上述药物组合物含有活性肽,以能够有效地抑制非小细胞癌细胞增殖,而能够应用于制备抑制非小细胞肺癌细胞增殖的药物,同时,该药物组合物能够提高非小细胞肺癌细胞内ros,降低线粒体膜电位,促进非小细胞肺癌细胞凋亡,以达到抗非小细胞肺癌的目的,进而能够应用于制备预防或治疗非小细胞肺癌的药物。一实施方式的活性肽可以从石金钱龟中分离得到,也可以通过化学合成方法合成。一实施方式的从石金钱龟中分离得到活性肽包括如下操作s110~s120:s110、将石金钱龟肉酶解,得到酶解物。具体地,s110包括如下操作s111~s112:s111、向石金钱龟肉糜加入水混合,得到肉糜水。在其中一个实施例中,石金钱龟肉糜为石金钱龟肉粉碎后得到。在其中一个实施例中,水为去离子水或超纯水。在其中一个实施例中,酶为碱性蛋白酶。进一步地,酶为郑州市伟丰生物科技有限公司的2017-jd-0812碱性蛋白酶。更进一步地,酶的终浓度为400u/ml~800u/ml。肉糜水与酶的混合物的ph为7.45~10。酶解温度为35℃~50℃。酶解时间为2h~5h。在其中一个实施例中,在向肉糜水中加入酶进行酶解之后,还包括如下操作:对酶解后的肉糜水进行灭酶处理;灭酶结束后,离心收集上清;将上清进行干燥,得到酶解物。具体地,对酶解后的肉糜水进行灭酶处理的操作具体为:将酶解后的肉糜水放入85℃~95℃下灭酶10min~30min。离心收集上清的操作中,离心转速为8000r/min~10000r/min。离心时间为10min~20min。将上清进行干燥的方式为冷冻干燥。将酶解物干燥至含水量为0.1%~0.25%。其中,含水量即为酶解物中水的质量百分含量。需要说明的是,干燥的方式不限于冷冻干燥,还可以为其他干燥方式,例如风干。s120、采用有机溶剂对酶解物进行萃取,得到活性肽。具体地,将酶解物与有机溶剂混合,萃取,得到水相层;将水相层进行纯化,得到活性肽。其中,水相层即为含有活性肽的溶液。需要说明的是,若水相层中活性肽的纯度能够满足实际需求的话,对水相层进行纯化的操作可以省略。在其中一个实施例中,酶解物与有机溶剂的体积比为1:3~1:10。在其中一个实施例中,有机溶剂选自乙酸乙酯及丙酮中的至少一种。在其中一个实施例中,萃取的时间为15min~30min。在其中一个实施例中,将酶解物与有机溶剂混合,萃取,得到水相层的操作具体为:将酶解物、有机溶剂与水混合,萃取,得到水相层。通过将酶解物、有机溶剂与水混合,更有利于萃取的进行。其中,水为去离子水或超纯水。更具体地,将450g~550g的酶解物、3150ml~3850ml的乙酸乙酯与900ml~1100ml的水混合,萃取,得到水相层。进一步地,重复萃取至少三次;将每次萃取得到的水相层合并,以进行纯化。可选地,将500g的酶解物、3500ml的乙酸乙酯和1000ml的水混合,萃取,重复四次,得到水相层。在其中一个实施例中,将水相层进行纯化的操作具体为:将水相层进行干燥;将干燥后的水相层进行色谱法分离,得到活性肽。具体地,将水相层进行干燥的操作中,干燥的方式为真空低温冷冻干燥。需要说明的是,干燥的方式不限于冷冻干燥,还可以为其他干燥方式,例如风干。将干燥后的水相层进行色谱法分离的方法为hplc,即高效液相色谱法(highperformanceliquidchromatography)。具体地,hplc的条件为:色谱柱为cosmosil5c18,流动相为体积百分含量为25%的乙腈的水溶液,流速为0.5ml/min~1.5ml/min,检测波长为220nm,进样量为100μl。需要说明的是,若水相层的浓度能够满足色谱法分离的需要时,对水相层进行干燥的操作可以省略。通过上述活性肽的制备方法可以得到天然的活性肽,且活性肽的纯度较高。一实施方式的活性肽的制备方法,包括如下步骤:通过化学合成方法合成活性肽。在其中一个实施例中,化学合成方法为多肽固相合成法。进一步地,化学合成方法为boc固相合成法或fmoc固相合成法。其中,boc为叔丁氧羰基。boc固相合成法中以易酸解的boc基团作为n-α-保护基团。fmoc为9-芴甲氧羰基。fmoc固相合成法中以易酸解的fmoc基团作为n-α-保护基团。上述活性肽的制备方法,工艺简单、操作方便,且能够制备纯度较高的活性肽。以下为具体实施例部分。以下实施例中,如无特别说明,未注明具体条件的实验方法,通常按照常规条件,例如参见萨姆布鲁克、ef弗里奇、t曼尼阿蒂斯等(金冬雁,黎孟枫等译)所著的分子克隆实验指南[m](北京:科学出版社,1992)中所述的条件或者试剂盒生产厂家推荐的方法实现。实施例中所使用的试剂均为市售。如未特别说明,以下实施例中,fmoc-his-oh、fmoc-gly-oh、fmoc-lys-oh、fmoc-his-oh与fmoc-glu-oh均购于阿拉丁试剂公司。nsclc肿瘤细胞a549的保藏号为jnu-12-980。dmem培养基购于碧云天生物科技有限公司。酶为郑州市伟丰生物科技有限公司的2017-jd-0812的碱性蛋白酶。实施例1本实施例的活性肽的制备过程如下:(1)向200g的石金钱龟肉糜加入2500ml的超纯水混合,得到肉糜水。向肉糜水中加入700u/ml的碱性蛋白酶于45℃、ph为8.0下酶解3h,将酶解后的肉糜水放入85℃下灭酶10min,灭酶结束后,9000r/min离心10min收集上清;将上清进行干燥至含水量为0.1%,得到酶解物。(2)将500g的酶解物、3500ml的乙酸乙酯和1000ml的超纯水混匀,静置萃取25min,收集水相层,重复萃取四次,将四次萃取收集的水相层混合进行真空低温冻干,得到干燥后的水相层。(3)将干燥后的水相层进行色谱法分离,得到活性肽。将干燥后的水相层进行色谱法分离的条件为:色谱柱为cosmosil5c18,流动相为体积百分含量为30%的乙腈的水溶液,流速为1ml/min,检测波长为220nm,进样量为100μl。实施例2本实施例的活性肽的制备过程如下:(1)取100mg的fmoc-phewangresin(苯丙氨酸预装树脂,购于阿拉丁公司且货号为2018-01-225-nu)置于固相合成管中,加入25ml的n,n-二甲基甲酰胺(dmf)后静置使预装树脂充分溶胀,滤去溶剂,再加入5ml的含有质量百分含量为20%的哌啶的dmf溶液,振荡后滤出溶剂,得到处理后的树脂。(2)将8mg的fmoc-his-oh(购于阿拉丁公司且货号为2018-01-225-n22)、5mg的1-羟基苯并三唑、3mg的o-苯并三氮唑-四甲基脲六氟磷酸酯溶于20ml的dmf中,在加入30mg的n,n-二异丙基乙胺混匀后避光,得到活化的fmoc-his-oh。将活化后的fmoc-his-oh加入步骤(1)得到的处理后的树脂中,常温下氮气吹动搅拌20min,过滤,采用dmf和二氯甲烷依次洗涤沉淀,去除溶剂,得到第一反应物。(3)按照步骤(2)的操作活化fmoc-gly-oh,得到活化的fmoc-gly-oh;按照步骤(2)的操作,将活化的fmoc-gly-oh加入第一反应物中,得到第二反应物。按照步骤(2)的操作活化fmoc-lys-oh,得到活化的fmoc-lys-oh;按照步骤(2)的操作,将活化后的fmoc-lys-oh加入第二反应物中,得到第三反应物。按照步骤(2)的操作,将活化后的fmoc-gly-oh加入第三反应物中,得到第四反应物。按照步骤(2)的操作,将活化后的fmoc-his-oh加入第四反应物中,得到第五反应物。按照步骤(2)的操作活化fmoc-glu-oh,得到活化的fmoc-glu-oh;按照步骤(2)的操作,将活化后的fmoc-glu-oh加入第五反应物中,得到第六反应物。(4)用无水乙醇洗涤第六反应物,固液分离,将上清液依次进行旋转蒸发浓缩、冷冻干燥,得到活性肽。测试:1、采用高效液相色谱对实施例1~2的活性肽的纯度进行测定,并采用质谱对实施例1的活性肽进行鉴定。其中,高效液相色谱测定条件为:bostongreenods-aq色谱柱(250*4.6mm);以体积百分含量为0.1%的三氟乙酸的水溶液为流动相a,以体积百分含量为0.1%的三氟乙酸的乙腈溶液为流动相b,流动相a与流动相b的体积比为75:25;流速为1ml/min;检测波长为220nm;进样量10μl;标准品为苯丙氨酸;质谱测定条件:esi正离子模式,毛细管电压为3kv,锥孔电压为50v,萃取电压为5v,脱溶剂温度为350℃,雾化气流为350l/h。测定结果详见表1和图1~2。表1表示的是实施例1~2的活性肽的纯度。图1为实施例1的活性肽的质谱图。图2为实施例1的活性肽的高效液相色谱图。表1实施例1~2的活性肽的纯度实施例1实施例2纯度(%)96.596.8从图1~2可以看出,实施例1的活性肽的氨基酸序列为phe-his-gly-lys-gly-his-glu,其结构式如下:从表1可以看出,实施例1~2得到的活性肽的纯度均在96%以上,说明上述实施方式的活性肽的制备方法能够获得具有较高纯度的活性肽。2、测定活性肽对nsclc肿瘤细胞a549细胞的影响(1)实验共分为四组,分别为对照组(即con组)、实验组1(即mclo-12-1组)、实验组2(即mclo-12-2组)、实验组3(即mclo-12-3组),每组三个平行实验。(2)将nsclc肿瘤细胞a549(以下简称肿瘤细胞)接种于dmem培养基中于37℃进行培养。其中,在实验组1~3的dmem培养基中分别添加10.7μg/ml、21.4μg/ml、42.8μg/ml的实施例1的活性肽,对照组的dmem培养基中未额外添加物质。培养时间为48h。(3)采用流式细胞仪(即facs)对步骤(2)中四组培养后的肿瘤细胞进行检测,测定结果详见图3~6。其中,图3为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞的凋亡作用的facs分析的散点对比图;图4为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞的凋亡比例的柱状统计图,图4中的“*”表示显著性差异小于0.05,图4中的“**”表示显著性差异小于0.01;图5为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞的细胞周期的影响的facs分析对比图;图6为活性肽对四组培养后的肿瘤细胞的细胞周期的影响的柱状图,图6中的“*”表示显著性差异小于0.05。凋亡和坏死的总和是指凋亡早期、凋亡晚期和坏死的总和。细胞比例指已处于相应条件下的细胞占总细胞的比例;例如,凋亡早期情况下的细胞比例为20%表示已处于凋亡早期状态的细胞占总细胞的比例为20%;g2/m情况下的细胞的比例为10%表示处于g2/m期的细胞占总细胞的10%。从图3~4可以看出,活性肽能够较为明显地促进细胞凋亡。实验组1~3的凋亡和坏死的总和的细胞凋亡比例分别比对照组提高26.3%、61.2%、80.8%。随着活性肽的添加量的增加,促进细胞凋亡的能力越强。从图5~6可以看出,活性肽能够较为明显地将肿瘤细胞阻滞于细胞周期的g0/g1期,实验组1~3的肿瘤细胞处于g0/g1期比例分别与对照组增加1.9%、9.0%、11.8%。随着活性肽的添加量的增加,对细胞周期的阻滞能力越强。综上,上述实施方式的活性肽能够抑制肿瘤细胞的增殖,促进肿瘤细胞凋亡。(4)测定步骤(2)中四组培养后的肿瘤细胞内ros及线粒体膜电位的变化,同时,测定实验组3的肿瘤细胞培养至0h、2h、4h、8h、12h、24h、48h时ros的变化。测定结果详见图7~9;图7为表示con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞内ros含量的对比图,图7中的“*”表示显著性差异小于0.05,“**”表示显著性差异小于0.01;图8为肿瘤细胞内ros随培养时间的变化曲线图,图8中的“*”表示显著性差异小于0.05;图9为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞内线粒体膜电位下降的细胞比例的对比图,图9中的“*”表示显著性差异小于0.05,图9中的“**”表示显著性差异小于0.01。其中,ros活性氧检测试剂盒(购于碧云天生物科技有限公司)测定肿瘤细胞的ros的变化,即采用dcfh-da法;由于dcfh-da(即2',7'-dichlorodihydrofluoresceindiacetate,2',7'-二氯荧光黄双乙酸盐)能够经细胞内酯酶水解而穿过细胞膜产生dcfh,ros能够氧化dcfh而转化为具有荧光的dcf,因此,检测dcf的荧光能够反应ros的水平;采用流式细胞仪测定肿瘤细胞内线粒体膜电位,并计算线粒体膜电位下降的细胞比例。从图7可以看出,实验组1~3的dcf的荧光强度高于对照组,说明活性肽的加入能够提高肿瘤细胞内的ros的量,进而能够促进肿瘤细胞的凋亡;对照组、实验组1、实验组2及实验组3的dcf的荧光强度逐渐增加,说明随着活性肽的添加量的增加,肿瘤细胞内的ros的量逐渐增加,促进肿瘤细胞凋亡的效果逐渐增强。从图8可以看出,随着培养时间的延长,dcf的荧光强度先增加再降低,其中,培养至24h的dcf的荧光强度最强,说明培养至24h时活性肽的促进肿瘤细胞内的ros量增加的作用最强。从图9可以看出,实验组1~3的线粒体膜电位下降的细胞比例高于对照组,说明活性肽的加入能够降低肿瘤细胞内的线粒体膜电位,进而能够促进肿瘤细胞的凋亡;对照组、实验组1、实验组2及实验组3的线粒体膜电位下降的细胞比例逐渐增加,说明随着活性肽的添加量的增加,线粒体膜电位下降的细胞比例逐渐增加,促进肿瘤细胞凋亡的效果逐渐增强。综上,上述实施方式的活性肽能够提高肿瘤细胞中的ros的量,促进肿瘤细胞的线粒体膜电位下降,进而促进肿瘤细胞凋亡。(5)测定活性肽对肿瘤细胞内与细胞凋亡通路相关的蛋白表达的影响。具体地,采用westernblot测定步骤(2)中四组培养后的肿瘤细胞内与细胞凋亡通路相关的蛋白表达。测定结果详见图10~15。图10为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中caspase9、cleavedcaspase9、caspase3、cleavedcaspase3及cleavedparp蛋白相对表达量的电泳对比图;图11为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中caspase9、cleavedcaspase9、caspase3、cleavedcaspase3及cleavedparp蛋白相对表达量的柱状对比图;图12为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中trxr、trx、ask及p-ask1蛋白相对表达量的电泳对比图;图13为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中trxr、trx、ask及p-ask1蛋白相对表达量的柱状对比图;图14为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中jnk、p-jnk、p38、p-p38、erk1/2及p-erk1/2蛋白相对表达量的电泳对比图;图15为con组、mclo-12-1组、mclo-12-2组、mclo-12-3组的肿瘤细胞中jnk、p-jnk、p38、p-p38、erk1/2及p-erk1/2蛋白相对表达量的柱状对比图。从图10~11可以看出,实验组1~3的caspase9与caspase3的表达量均低于对照组,且随着活性肽的添加量的增加,caspase9与caspase3的表达量均逐渐降低;实验组1~3的cleavedcaspase9、cleavedcaspase3及cleavedparp的表达量均高于对照组,且随着活性肽的添加量的增加cleavedcaspase9、cleavedcaspase3及cleavedparp的表达量均逐渐增加。从图12~13可以看出,实验组1~3的trxr、trx与ask的表达量均低于对照组,且随着活性肽的添加量的增加,trxr、trx与ask的表达量均逐渐降低;实验组1~3的p-ask1的表达量高于对照组,且随着活性肽的添加量的增加,p-ask1的表达量逐渐增加。从图14~15可以看出,实验组1~3的jnk、p38及erk1/2的表达量均低于对照组,且随着活性肽的添加量的增加,jnk、p38及erk1/2的表达量均逐渐降低;实验组1~3的p-jnk、p-p38及p-erk1/2的表达量高于对照组,且随着活性肽的添加量的增加,p-jnk、p-p38及p-erk1/2的表达量均逐渐增加。综上,上述活性肽活性肽能够提高非小细胞肺癌细胞内ros,降低非小细胞肺癌细胞内线粒体膜电位,抑制非小细胞肺癌细胞增殖,促进非小细胞肺癌细胞凋亡,以达到抗非小细胞肺癌的目的。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。序列表<110>深圳凯联健康生物科技有限公司<120>活性肽、重组载体、重组细胞、药物组合物及其制备方法和应用<160>2<170>siposequencelisting1.0<210>2<211>7<212>prt<213>人工序列(artificialsequence)<400>2phehisglylysglyhisglu15<210>2<211>21<212>rna<213>人工序列(artificialsequence)<400>2uuccauggcaagggacacgag21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1