一种用于抑制TCF12基因的siRNA分子的制作方法
本发明属于生物医药领域,具体涉及一种用于抑制tcf12基因的sirna分子及其在制备抗肿瘤药物中的用途。
背景技术:
卵巢癌是女性生殖器官常见的恶性肿瘤之一,发病率仅次于子宫颈癌和子宫体癌而列居第三位。卵巢癌中以上皮癌最多见,其次是恶性生殖细胞癌,卵巢上皮癌患者死亡率却占各类妇科肿瘤的首位,对妇女生命造成严重威胁。由于卵巢的胚胎发育、组织解剖及内分泌功能较复杂,早期症状不典型,术前鉴别卵巢肿瘤的组织类型及良恶性相当困难,卵巢上皮癌极易发生转移和侵袭,患者术中发现肿瘤局限于卵巢的仅占30%,早期诊断是一大难题。卵巢恶性肿瘤尤其是上皮癌难以早期发现,病因不明,除遗传性卵巢癌外,没有一级预防措施,目前主张早诊早治,争取早期发现病变,有关早期诊断的研究正在进行中。
tcf12基因是碱性螺旋-环-螺旋(basichelix-loop-helix,bhlh)e蛋白家族成员,可以识别e-box序列canntg(thorsen等人,bmcgenomics.2011,12:505;chen等人,jbiolchem.2013,288:9001-9010)。该基因编码的蛋白在多种组织和细胞中表达,包括骨骼肌、在胸腺、b细胞和t细胞,并可能通过与其他bhlhe-蛋白形成异源二聚参与调控种系特异性基因的表达。该基因有多种不同的转录剪接变异体,但这些变异体全长的性质尚未确定。
tcf12基因编码产物(tcf12,也称htf4或heb)是螺旋-环-螺旋(hlh)蛋白家族的一个成员(zhang等人,nucleicacidsres.1991,19:4555;hu等人,mol.cellbiol.1992,12,1031-1042)。根据组织分布、反应能力、和dna结合特异性(massari等人,mol.cellbiol.2000,20,429-440),hlh蛋白被分为七类。i类蛋白,由tcf3(e12,e47)、tcf4(e2-2)和tcf12(htf4)基因编码,由于其dna(e-box)结合能力也被称为e蛋白。这些蛋白质在许多组织中广泛表达并可形成同源或异源二聚体。ii类蛋白,包括myod、myogenin和twist,可以与i类成员形成异源二聚体,并显示组织特异性表达模式。iii蛋白,包含一个亮氨酸拉链结构域和hlh结构域,并包括myc转录因子家族。第iv类成员包括一个蛋白家族如mad、max和mxi,可与myc形成二聚体。v类蛋白质缺乏基本区域,因此不能直接结合dna。i类和ii类成员为显性负因子。vi类成员在其基本区域有一个脯氨酸,vii类蛋白按其hlh-pas结构域划分,成员包括如缺氧诱导因子1α和芳香烃受体。tcf12可以和肌形成蛋白、e12和itf12形成同源寡聚体或杂低聚物,并能与ptf-1、runx1t1[12]和tcf调节子id1(jones-mason等人,immunity.2012,36:348-361)。
tcf12已被证明在神经元分化中起作用,在一些肿瘤中表达上调,如神经胶质瘤、黑色素瘤、结肠癌、口腔癌、胆囊癌及胰腺癌。有研究报道tcf12与肿瘤转移和浸润关系密切(lee等人,jbiolchem.2012,287:2798-2809.)。研究提示,tcf12可以作为抑制肿瘤的靶向分子之一。
rna干扰(rnainterference,rnai)是生物界中一种既古老且在进化上又高度保守的现象,是由双链rna(double-strandedrna,dsrna)诱发的、同源mrna高效特异性降解的基因转录后沉默。小干扰rna(sirna)是rnai的效应分子,由两条互补的rna单链构成,长21~23个核苷酸(nt)。由于rnai技术可以特异性剔除或关闭特定基因的表达,所以技术广泛地应用于功能基因组学研究、传染性疾病以及抗病毒、抗肿瘤治疗的研究中。近几年,rna干扰(rnainterfering,rnai)作为一个新的基因治疗技术,其在抗病毒、抗肿瘤和抗炎症等医药领域应用前景广阔,得到了迅速发展,部分rna药物已进入临床试验阶段,为疑难杂症尤其是多因素的疾病如癌症、病毒感染开辟了全新的治疗途径。2016年12月23日,美国食品和药物管理局fda批准了首个用于治疗脊髓性肌萎缩的rna药物spinraza(nusinersen)的上市申请,标志着rna药物正式加入药物大军,成为继化学药物、生物蛋白药物之后的第三大新药类型。目前国际上已有数十种sirna药物进入临床阶段。rnai药物现已被证实在多种病毒感染性疾病和肿瘤的治疗中具有极大的潜力,是理想的阻断基因表达的治疗手段。
技术实现要素:
为了得到能有效治疗肿瘤比如卵巢癌的rnai药物,发明人以tcf12基因为靶点,设计并筛选出数百种sirna分子,发现其中一些能够特异性地抑制tcf12表达,其中有两组sirna分子能有效地抑制tcf12基因。因此,本发明的第一个目的在于提供一种用于抑制tcf12基因的sirna分子,其由如下序列的正义链和反义链组成:
正义链:5’-cagugauauacauaguuuann-3’(seqidno:1),
反义链:5’-uaaacuauguauaucacugnn-3’(seqidno:2),
其中,正义链和反义链中的n相同或者不同,并且各自独立地是胞嘧啶c、尿嘧啶u、鸟嘌呤g、腺嘌呤a、脱氧胞嘧啶dc、脱氧鸟嘌呤dg、脱氧腺嘌呤da或脱氧胸腺嘧啶dt;n代表n的个数,n是0、1或2。
在一种实施方式中,所述n为0,即
正义链:5’-cagugauauacauaguuua-3’(seqidno:3),
反义链:5’-uaaacuauguauaucacug-3’(seqidno:4)。
该sirna分子是该组sirna分子的主干序列。
在另一种优选的实施方式中,所述n为dt,n为2,即
正义链:5’-cagugauauacauaguuuadtdt-3’(seqidno:5),
反义链:5’-uaaacuauguauaucacugdtdt-3’(seqidno:6)。
本发明的第二个目的在于提供上述sirna分子在制备用于抑制tcf12表达的药物中的用途。
可选地,上述药物是抗肿瘤药物。
优选地,所述药物是治疗卵巢癌药物。
其中sirna分子可以作为有效成分用于抑制卵巢癌细胞的生长、转移,或者促进卵巢癌细胞的凋亡。
在一种优选的实施方式中,上述药物是适用于注射的剂型或凝胶剂。
优选地,上述药物还包含必要的佐剂。
体外实验证明,本发明提供的sirna分子可特异性地下调tcf12基因表达,达到抑制卵巢癌细胞生长、转移以及促进癌细胞凋亡的技术效果。
附图说明
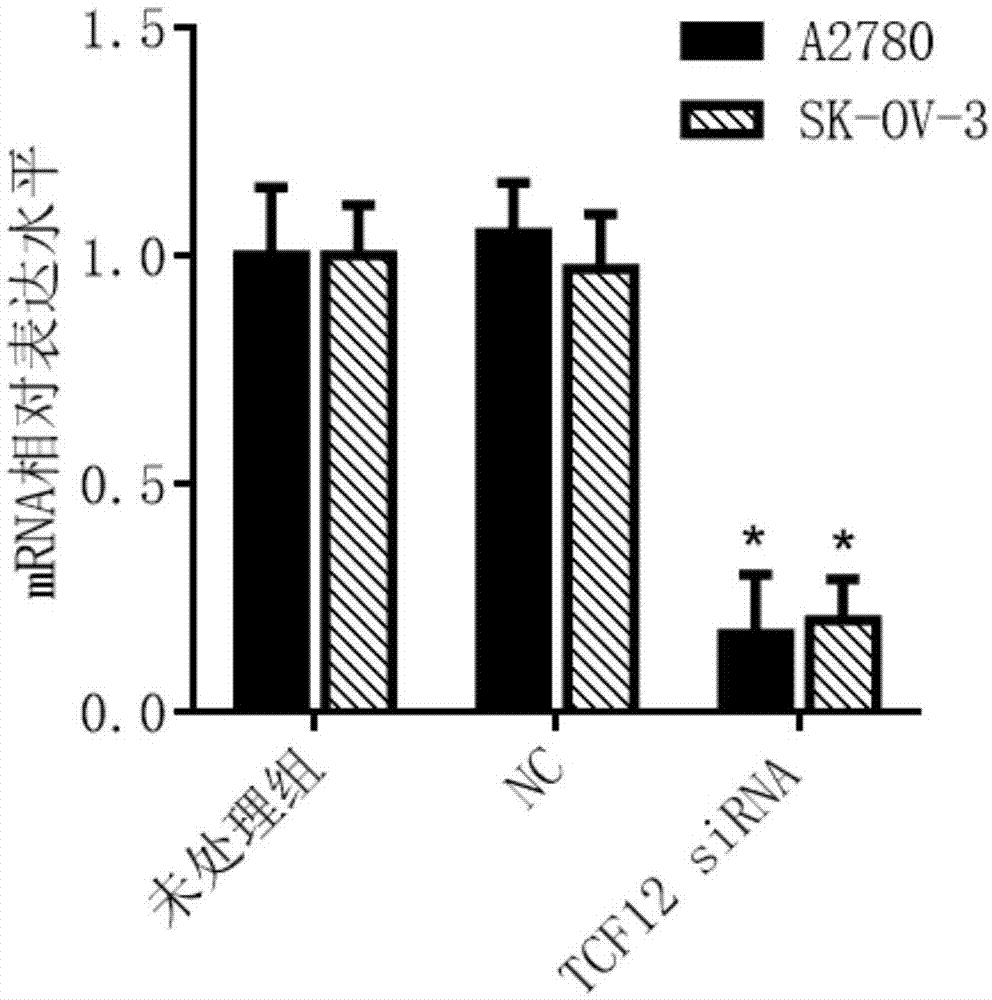
图1是本发明的sirna抑制a2780和sk-ov-3卵巢癌细胞中tcf12靶基因mrna表达水平的柱状图。与阴性对照组nc相比,sirna显著抑制了tcf12基因的mrna表达水平,其中*p<0.05。
图2a是本发明的sirna抑制a2780和sk-ov-3卵巢癌细胞中tcf12蛋白质表达水平的凝胶电泳照片。图2b是相应的柱状图。图2a和图2b显示,与阴性对照组nc相比,sirna显著抑制了tcf12蛋白质表达水平,其中*p<0.05。
图3是本发明的sirna抑制a2780卵巢癌细胞增殖的生长曲线图。与阴性对照组nc相比,sirna在48h、72h显著抑制了细胞的生长,其中*p<0.05。
图4是本发明的sirna抑制sk-ov-3卵巢癌细胞增殖的生长曲线图。与阴性对照组nc相比,sirna在48h、72h显著抑制了细胞的生长,其中*p<0.05。
图5是本发明的sirna抑制a2780和sk-ov-3卵巢癌细胞迁移的结果图。与阴性对照组nc相比,sirna显著抑制了细胞的侵袭,其中*p<0.05。
图6是本发明的sirna抑制a2780和sk-ov-3卵巢癌细胞侵袭的结果图。与阴性对照组nc相比,sirna显著抑制了细胞的侵袭,其中*p<0.05。
图7是本发明的sirna促进a2780和sk-ov-3卵巢癌细胞凋亡的结果图。与阴性对照组nc相比,sirna显著促进了细胞的凋亡,其中*p<0.05。
具体实施方式
以下结合具体实施例对本发明做进一步详细说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
本发明人发现了一种sirna分子,由正义链seqidno:1和反义链seqidno:2组成的双链sirna分子,可以特异性靶向tcf12基因,阻断tcf12基因的mrna转录,阻止基因的翻译,从而根本上抑制tcf12的表达,最终达到抑制肿瘤的目的。
在本文中,有时为了描述简便,会将tcf12蛋白质与其编码基因(dna)名称混用,本领域技术人员应能理解它们在不同描述场合表示不同的物质。例如,tcf12基因指的是编码tcf12蛋白质的基因dna。
在本文中,术语“sirna”、“sirna序列”、“sirna分子”、“双链sirna”、或“双链sirna分子”可以互换,它们表示的意思和范围相同。其中,sirna是正义链和反义链退火形成的双链结构。
sirna分子的制备可采用多种方法,比如:化学合成法、体外转录、酶切长链dsrna、载体表达rna、pcr合成rna表达元件等,这些方法的出现为研究者提供了可选择的空间,可以更好地获得基因沉默效率。
本发明的药物的剂型可以为多种形式,只要适合于相应疾病的给药、并且恰当地保持rna分子的活性。比如,对于注射用给药系统,剂型可以是冻干粉。该药物也可以是凝胶剂。
任选地,上述药物剂型中可以包含任何药学上可接受的载体及佐剂,只要其适合于相应的给药体系、并且恰当地保持rna分子的活性。
为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。本领域技术人员应当理解,下述实施例仅用于阐明本发明,并非是对本发明进行限制。
实施例
本文中的sirna和pcr引物由百奥迈科生物技术有限公司合成。
实施例1sirna合成及细胞转染
1.细胞培养
人卵巢癌细胞株sk-ov-3和a2780(南通大学附属医院保藏)在含10%胎牛血清的dmem培养基(美国thermofisherscientific公司)中,于37℃、5%co2培养箱中培养。
2.设计并合成sirna分子
设计并合成靶向tcf12基因的sirna序列,如下:
正义链:5’-cagugauauacauaguuuadtdt-3’(seqidno:5),
反义链:5’-uaaacuauguauaucacugdtdt-3’(seqidno:6)。
该sirna具有正义链和反义链。分别将正义链和对应的反义链退火成sirna双链,转染前配置成浓度为20μm。
另外,设计并合成了与人基因不同源的sirna作为阴性对照的nc(negativecontrol),其序列为:
正义链:5’-uucuccgaacgugucacgudtdt-3’(seqidno:7);
反义链:5’-acgugacacguucggagaadtdt-3’(seqidno:8)。
该nc具有正义链和反义链。分别将正义链和对应的反义链退火成nc双链,转染前配置成浓度为20μm。
3.用sirna转染细胞
将步骤1所得细胞按1.5×105个/孔铺到96孔细胞培养板(美国sigma-aldrich公司)中,并在含10%胎牛血清的dmem培养基中,于37℃、5%co2培养箱中培养过夜。用细胞转染试剂
实施例2实时定量pcr检测mrna表达水平
按实施例1的方法将sirna转染细胞,细胞转染48h后,收集细胞,用rna提取试剂trizol(美国thermofisherscientific公司)按其说明书进行细胞总rna的提取。
用基因特异性引物检测样本中tcf12基因mrna的表达水平,同时扩增看家基因β-actin作为内参对照。每个样本同时扩增tcf12基因和内参基因β-actin,每个反应做3个平行。用one-stepqrt-pcrkit(美国thermofisherscientific公司)进行定量pcr反应,建立反应体系为:4μlrna模板,12.5μl的2×sybrgreenonestepmix,上游引物(10μm)和下游引物(10μm)各0.5μl,0.5μl的50×rt/taqmix,用无rnase的水补足体系至25μl。混合均匀后,置于实时定量pcr仪器中反应,反应条件为:42℃反转录30min,95℃预变性10min,95℃变性20sec,58℃退火30sec,72℃延伸30sec,循环45次。
检测tcf12基因的实时定量pcr引物:
上游引物为:5’-ctaatgaagatgaggatt-3’(seqidno:9);
下游引物为:5’-gatgaagaataaggagtt-3’(seqidno:10)。
检测看家基因β-actin的实时定量pcr引物:
上游引物为:5’-cctggcacccagcacaat-3’(seqidno:11);
下游引物为:5’-gggccggactcgtcatac-3’(seqidno:12)。
反应结束后,导出数据用2-δδct法分析实验结果并作图。如图1所示,与阴性对照nc相比,sirna均显著抑制了卵巢癌细胞a2780和sk-ov-3中tcf12基因的mrna表达水平。比如,在a2780和sk-ov-3细胞中sirna抑制tcf12的mrna水平分别达到83%和80%,均显著抑制了其mrna表达水平,差异均有统计学意义(p<0.05)。
实施例3westernblot检测蛋白表达水平
按实施例1的方法,将细胞按1.5×106个/孔铺到6孔板中,细胞生长24h后至约75%的汇合度进行细胞转染。细胞转染48h后,用预冷的细胞蛋白裂解液(美国promega公司)裂解细胞,置于4℃中,10,000rpm离心20min,取上清稀释后进行聚丙烯酰胺凝胶电泳,并将蛋白转印到聚偏氟乙烯(pvdf)膜上(美国merck公司),并用5%脱脂牛奶室温进行封闭2h,然后用兔抗人tcf12单克隆抗体(美国abcam公司,1:200稀释),鼠抗人β-actin单克隆抗体(美国abcam公司,1:200稀释)作为内参。tbst洗涤后,再用辣根过氧化物酶偶联的二抗孵育(tcf12用羊抗兔igg-hrp,1:1000稀释;β-actin用羊抗鼠igg-hrp,1:2000稀释),用tbst洗涤3次(5min/次)。用beyoeclplus试剂盒(碧云天公司)检测,结果参见图2a和图2b。
如图2a和图2b所示,与阴性对照nc相比,sirna显著抑制了卵巢癌细胞a2780和sk-ov-3中tcf12蛋白质表达水平。比如,在a2780和sk-ov-3细胞中sirna抑制tcf12蛋白质的水平分别达到67%和55%,均显著抑制了其蛋白表达水平,均差异有统计学意义(p<0.05)。
实施例4细胞增殖检测
按实施例1的方法进行细胞培养和sirna转染。转染前待细胞汇合度达到约80%时,将对数生长期的细胞铺到96孔细胞培养板中,重复3个孔,作为未转染的样本(即转染0h的样本)。分别取转染24h、48h和72h后的各实验组的细胞进行mtt细胞增殖测定,所述测定方法为:将混合的100μldmem和10μlmtt(美国promega公司)加入到每个孔中,培养箱孵育4h,在波长570nm处用酶标仪(美国bio-tek公司)测定od值,制作生长曲线。
如图3和图4所示,与阴性对照nc相比,在a2780和sk-ov-3细胞中,sirna抑制了细胞的增殖,尤其是在48h和72h抑制效果显著。
实施例5细胞迁移检测
按实施例1的方法将卵巢癌细胞a2780和sk-ov-3分别铺到24孔细胞培养板中并培养24h后进行转染,细胞转染48h后用dmem培养进行重悬,调整浓度至1.5×106个细胞/ml。transwell板(美国sigma-aldrich公司)内室先用dmem培养基预孵育1h,上室和下室用8μm的聚碳酸酯膜隔开。将100μl的细胞重悬液与600μl含10%pbs的dmem培养基或者条件培养基(上述48h处理的细胞培养基上清)加到每个上室中。24h后,留在上室中的细胞用棉签去除,迁移到下室中的细胞用10%甲醛固定30sec。最后,细胞用0.5%结晶紫染色4min,随后用pbs缓冲液洗3遍。细胞在200倍放大视野中计数,每个条件下计数5个视野。算出迁移细胞数,制作柱形图。
如图5所示,与阴性对照nc相比,sirna显著抑制了a2780和sk-ov-3细胞的迁移,差异有统计学意义(p<0.05)。
实施例6细胞侵袭检测
按实施例1的方法将卵巢癌细胞a2780和sk-ov-3分别铺到24孔细胞培养板中培养24h后进行转染,细胞转染48h后用dmem培养进行重悬,调整浓度至1.5×106个细胞/ml。transwell板(美国sigma-aldrich公司)内室用dmem培养基预孵育1h,上室和下室用包被有50μl的matirgel(0.5mg/ml,美国bd公司)的8μm的聚碳酸酯膜隔开。将100μl的细胞重悬液与600μl含10%pbs的dmem培养基或者条件培养基(上述48h处理的细胞培养基上清)加到每个上室中。24h后,留在上室中的细胞用棉签去除,迁移到下室中的细胞用10%甲醛固定30sec。最后,细胞用0.5%结晶紫染色4min,随后用pbs缓冲液洗3遍。细胞在200倍放大视野中计数,每个条件下计数5个视野。算出侵袭细胞数,制作柱形图。
如图6所示,与阴性对照nc相比,sirna显著抑制了细胞sk-ov-3和a2780细胞的侵袭,差异有统计学意义(p<0.05)。
实施例7细胞凋亡检测
按实施例1的方法进行细胞培养和sirna转染。
用annexinv-fitc凋亡测定试剂盒(美国sigam-aldrich公司)进行细胞凋亡检测分析。卵巢癌细胞sk-ov-3和a2780转染48h后,用0.25%胰酶消化和pbs缓冲液洗两遍。1.5×105个细胞用500μl结合缓冲液重悬,并按操作说明用5μl的annexinv-fitc染色,然后加入5μl的碘化丙啶(pi)溶液并室温避光孵育15min。不同实验组细胞用流式细胞仪(美国bd公司)进行细胞凋亡分析,计算细胞凋亡率,制作柱形图。
如图7所示,与阴性对照nc相比,sirna显著促进了a2780和sk-ov-3细胞的凋亡,差异有统计学意义(p<0.05)。
由上述实验可见,靶向tcf12的sirna表现出高效抑制tcf12表达的活性;sirna分子(seqidno:5-6)可以抑制a2780和sk-ov-3细胞的增殖、迁移、侵袭,并显著促进a2780和sk-ov-3卵巢癌细胞的凋亡,因而具有应用于抗肿瘤、尤其是卵巢癌治疗的潜力。
序列表
<110>南通大学附属医院
<120>一种用于抑制tcf12基因的sirna分子
<130>shpi1812124
<160>12
<170>siposequencelisting1.0
<210>1
<211>20
<212>rna
<213>人工序列()
<400>1
cagugauauacauaguuuan20
<210>2
<211>20
<212>rna
<213>人工序列()
<400>2
uaaacuauguauaucacugn20
<210>3
<211>19
<212>rna
<213>人工序列()
<400>3
cagugauauacauaguuua19
<210>4
<211>19
<212>rna
<213>人工序列()
<400>4
uaaacuauguauaucacug19
<210>5
<211>21
<212>rna
<213>人工序列()
<400>5
cagugauauacauaguuuadd21
<210>6
<211>21
<212>rna
<213>人工序列()
<400>6
uaaacuauguauaucacugdd21
<210>7
<211>21
<212>rna
<213>人工序列()
<400>7
uucuccgaacgugucacgudd21
<210>8
<211>21
<212>rna
<213>人工序列()
<400>8
acgugacacguucggagaadd21
<210>9
<211>18
<212>dna
<213>人工序列()
<400>9
ctaatgaagatgaggatt18
<210>10
<211>18
<212>dna
<213>人工序列()
<400>10
gatgaagaataaggagtt18
<210>11
<211>18
<212>dna
<213>人工序列()
<400>11
cctggcacccagcacaat18
<210>12
<211>18
<212>dna
<213>人工序列()
<400>12
gggccggactcgtcatac18
- 还没有人留言评论。精彩留言会获得点赞!
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺