前列腺特异性膜抗原的小分子抑制剂的制备方法与流程
本发明涉及医学技术领域,特别涉及一种前列腺特异性膜抗原的小分子抑制剂的制备方法。
背景技术:
前列腺癌(prostatecancer)是威胁男性健康最常见的肿瘤之一。近年来,其在我国的发病率明显上升,已成为所有恶性肿瘤中发病率增速最快的病种,大城市更成为“重灾区”。前列腺特异性膜抗原(psma)几乎在所有的前列腺癌细胞表面过度表达,且在低分化、转移性和雄激素非依赖型前列腺癌细胞中的表达进一步增加,因此,psma对于前列腺癌的诊断和治疗是一个极具有吸引力的靶点。
文献(nucl.med.biol.,2017,48,69-75)报道了一种靶向psma的化合物及其制备方法。通过固相合成法,以wang树脂与赖氨酸衍生物连接后,利用1,1’-羰基二咪唑(cdi)引入脲基,然后再连接上谷氨酸衍生物构建lys-urea-glu基本骨架结构,随后利用缩合试剂依次连接上6-氨基己酸和6-氨基烟酸衍生物,最后在三氟乙酸条件下脱除各保护基以及wang树脂,经高效液相色谱纯化得目标化合物,具体反应式如下:
上述文献虽然报道了此类化合物的制备路线,但是没有具体的制备方法的描述。而且,化合物中涉及的两个手性碳的具体构型也没有标示。
专利us2008193381a1公开了一种靶向psma的小分子抑制剂核心结构lys-urea-glu的制备方法。该方法以三光气与氨基酸衍生物的氨基反应原位生成异氰酸酯,然后再与另一氨基裸露的氨基酸反应构建脲基结构,具体反应式如下:
专利wo2015069932a1和wo2018035380a1公开了另一种lys-urea-glu的制备方法。该方法以谷氨酸衍生物psma1为起始原料,与1,1’-羰基二咪唑(cdi)反应引入脲基结构,然后用三氟甲磺酸甲酯(meotf)活化羰基咪唑后与赖氨酸衍生物psma3反应制备lys-urea-glu结构,即psma4,具体反应式如下:
与三光气法构建脲基结构相比,羰基咪唑法具有反应条件温和,操作简便的优点。但不足之处在于该方法属于两步两锅法,而三光气法属于两步一锅法,即增加了psma2的后处理过程。尽管如此,羰基咪唑法的优势还是很明显的。
针对现有技术中靶向psma的小分子是抑制剂的核心结构lys-urea-glu的制备方法存在的不足,本领域技术人员一直在寻找解决的方法。
技术实现要素:
本发明的目的在于提供一种前列腺特异性膜抗原的小分子抑制剂的制备方法,以解决使用现有技术中靶向psma的小分子是抑制剂的核心结构lys-urea-glu的制备方法存在的不足。
为解决上述技术问题,本发明提供一种前列腺特异性膜抗原的小分子抑制剂的制备方法,所述前列腺特异性膜抗原的小分子抑制剂的制备方法包括:
s1:以谷氨酸衍生物和赖氨酸衍生物为起始原料,利用羰基咪唑法一锅制备式(ⅰ)小分子抑制剂的式(ⅳ)核心结构lys-urea-glu,
s2:将式(ⅳ)核心结构lys-urea-glu通过连接链与具有99mtc螯合能力的hynic相连接后脱除保护基,以得到式(ⅰ)小分子抑制剂,
可选的,在所述的前列腺特异性膜抗原的小分子抑制剂的制备方法中,s1中,当所述谷氨酸衍生物为l-谷氨酸二叔丁酯盐酸盐,所述赖氨酸衍生物为n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐时,s1包括:
s11:以n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐和l-谷氨酸二叔丁酯盐酸盐为起始原料,在有机碱的作用下,通过1,1’-羰基二咪唑构建脲基结构,得到式(ⅰ)小分子抑制剂的式(ⅳ)核心结构lys-urea-glu,式(ⅳ)核心结构lys-urea-glu的氨基保护基为cbz。
可选的,在所述的前列腺特异性膜抗原的小分子抑制剂的制备方法中,s11中,通过改变有机碱和调整反应温度实现一锅法制备得到式(ⅰ)小分子抑制剂的式(ⅳ)核心结构lys-urea-glu的结构。
可选的,在所述的前列腺特异性膜抗原的小分子抑制剂的制备方法中,所述有机碱为2~5当量的三乙胺、二异丙基乙胺、1,8-二氮杂二环十一碳-7-烯(dbu)或者1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)。
可选的,在所述的前列腺特异性膜抗原的小分子抑制剂的制备方法中,所述有机碱为三乙胺或者二异丙基乙胺时,反应温度范围为30℃~40℃;
有机碱为1,8-二氮杂二环十一碳-7-烯(dbu)或者1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)时,反应温度为室温。
可选的,在所述的前列腺特异性膜抗原的小分子抑制剂的制备方法中,有机碱为1,8-二氮杂二环十一碳-7-烯(dbu)或者1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)时,反应温度范围为30℃~40℃。
可选的,在所述的前列腺特异性膜抗原的小分子抑制剂的制备方法中,s2包括:
s21:boc-6肼基烟酸与连接链6-氨基己酸苄酯或其盐通过肽缩合试剂构建酰胺键,以得到式(ⅱ)化合物,所述式(ⅱ)化合物的羧基保护基为bn,
s22:式(ⅳ)核心结构lys-urea-glu和式(ⅱ)化合物在同一反应体系中同时分别脱除氨基保护基cbz和羧基保护基bn,并通过肽缩合试剂构建酰胺键,以得到式(ⅲ)化合物,
s23:式(ⅲ)化合物在三氟乙酸的作用下脱除保护基,得到式(ⅰ)小分子抑制剂。
可选的,在所述的前列腺特异性膜抗原的小分子抑制剂的制备方法中,s11,s21~s23过程的反应式如下:
在本发明所提供的前列腺特异性膜抗原的小分子抑制剂的制备方法中,通过以谷氨酸衍生物和赖氨酸衍生物为起始原料,利用羰基咪唑法一锅制备式(ⅰ)小分子抑制剂的式(ⅳ)核心结构lys-urea-glu;将式(ⅳ)核心结构lys-urea-glu通过连接链与具有99mtc螯合能力的hynic相连接后脱除保护基,以得到式(ⅰ)小分子抑制剂。基于本发明的制备方法制备的前列腺特异性膜抗原的小分子抑制剂(即式(ⅰ)小分子抑制剂)如果被放射性核素99mtc标记,则能够作为分子影像探针在临床上用于前列腺癌的诊断,具有潜在的临床应用价值。
附图说明
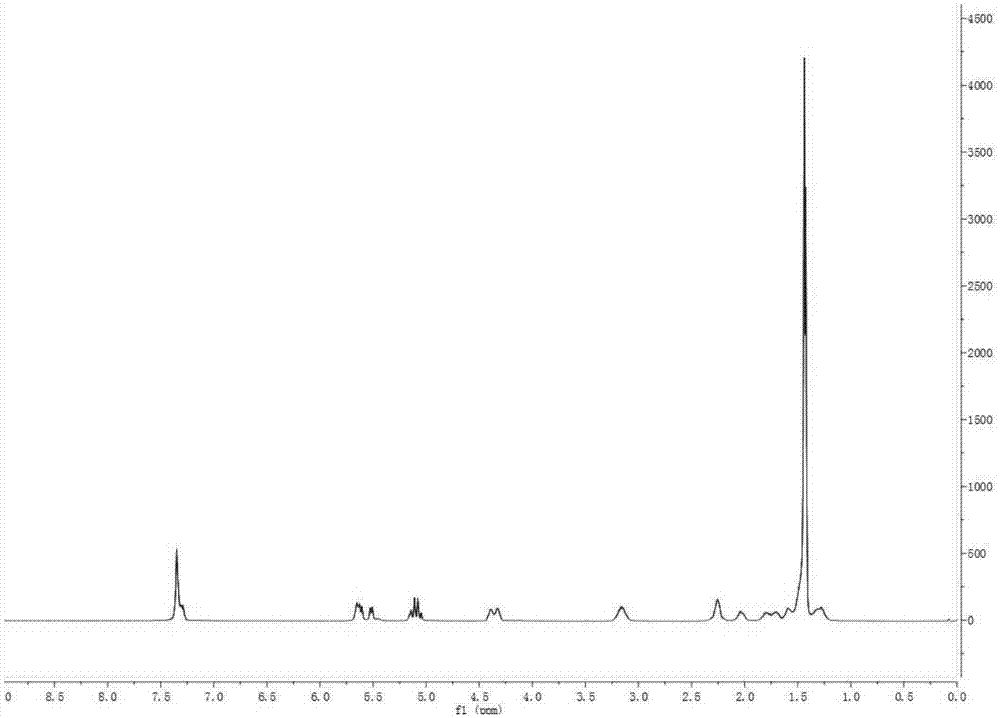
图1为式(ⅳ)核心结构lys-urea-glu的1h-nmr谱;
图2为式(ⅱ)化合物的1h-nmr谱;
图3为式(ⅲ)化合物的1h-nmr谱;
图4为式(ⅰ)小分子抑制剂的1h-nmr谱。
具体实施方式
以下结合附图和具体实施例对本发明提出的前列腺特异性膜抗原的小分子抑制剂的制备方法作进一步详细说明。根据下面说明和权利要求书,本发明的优点和特征将更清楚。需说明的是,附图均采用非常简化的形式且均使用非精准的比例,仅用以方便、明晰地辅助说明本发明实施例的目的。
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。需要说明的是,本实施例中所提供的图示仅以示意方式说明本发明的基本构想,遂图式中仅显示与本发明中有关的组件而非按照实际实施时的组件数目、形状及尺寸绘制,其实际实施时各组件的型态、数量及比例可为一种随意的改变,且其组件布局型态也可能更为复杂。
为使本发明的目的、特征更明显易懂,下面结合附图对本发明的具体实施方式作进一步的说明,然而,本发明可以用不同的形式实现,不应认为只是局限在所述的实施例。
本发明的前列腺特异性膜抗原的小分子抑制剂的制备方法具体包括如下步骤:
s1:以谷氨酸衍生物和赖氨酸衍生物为起始原料,利用羰基咪唑法一锅制备式(ⅰ)小分子抑制剂(即前列腺特异性膜抗原的小分子抑制剂)的式(ⅳ)核心结构lys-urea-glu,
进一步地,s1中,当所述谷氨酸衍生物为l-谷氨酸二叔丁酯盐酸盐,所述赖氨酸衍生物为n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐时,s1包括:
s11:以n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐和l-谷氨酸二叔丁酯盐酸盐为起始原料,在有机碱的作用下,通过1,1’-羰基二咪唑构建脲基结构,得到式(ⅰ)小分子抑制剂的式(ⅳ)核心结构lys-urea-glu,式(ⅳ)核心结构lys-urea-glu的氨基保护基为cbz。可以通过改变有机碱和调整反应温度实现一锅法制备得到式(ⅰ)小分子抑制剂的式(ⅳ)核心结构lys-urea-glu。优选的,所述有机碱为2~5当量的三乙胺、二异丙基乙胺、1,8-二氮杂二环十一碳-7-烯(dbu)或者1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)。
其中,所述有机碱为三乙胺或者二异丙基乙胺时,反应温度范围为30℃~40℃;有机碱为1,8-二氮杂二环十一碳-7-烯(dbu)或者1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)时,反应温度为室温。当然,反应温度不局限于室温,在反应温度范围为30℃~40℃时,可以促进反应的进行。
具体而言,将1当量n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐溶于干燥的二氯甲烷中,加入1~5当量的三乙胺或者二异丙基乙胺和1~2当量的1,1'-羰基二咪唑,室温搅拌10min~1h后。加入1~1.5当量的l-谷氨酸二叔丁酯盐酸盐,于0~50℃搅拌1~5h,或者先加入1~2当量的1,8-二氮杂二环十一碳-7-烯(dbu)或者1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)并室温搅拌10min~1h,再加入1~1.5当量的l-谷氨酸二叔丁酯盐酸盐,与0~50℃搅拌1~5h,制备得到式(ⅳ)核心结构lys-urea-glu,即本专利中多次提及的靶向psma的小分子抑制剂的核心结构lys-urea-glu。优化的,将1当量n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐溶于干燥的二氯甲烷中,加入2~3当量的三乙胺和1~1.1当量的1,1'-羰基二咪唑,室温搅拌20min~30min后,加入1~1.5当量的1,8-二氮杂二环十一碳-7-烯(dbu)并室温搅拌20min~30min,再加入1~1.1当量的l-谷氨酸二叔丁酯盐酸盐,30~4050℃搅拌2~3h。
s2:将式(ⅳ)核心结构lys-urea-glu通过连接链与具有99mtc螯合能力的hynic相连接后脱除保护基,以得到式(ⅰ)小分子抑制剂,
具体的,s2包括如下步骤:
s21:boc-6肼基烟酸与连接链6-氨基己酸苄酯或其盐通过肽缩合试剂构建酰胺键,以得到式(ⅱ)化合物,所述式(ⅱ)化合物的羧基保护基为bn,
具体的,将1当量的boc-6-肼基烟酸和1~3当量的6-氨基己酸苄酯或其盐混悬于干燥的二氯甲烷或者dmf中,加入1~5当量的三乙胺或者二异丙基乙胺和肽缩合剂,室温搅拌2~24h,制备得到式(ⅱ)化合物。肽缩合剂可以使用但不局限于dcc、edci、hatu、pyoap、hobu、n-羟基丁儿酰亚胺和t3p等。我们尝试了dcc、edci、hatu和t3p等缩合剂。
优化的,将1当量的boc-6肼基烟酸与2当量的6-氨基己酸苄酯或其盐混悬于干燥的二氯甲烷,加入3~4当量的二异丙基乙胺和1.1~2当量的hatu或者t3p,室温搅拌4~8h。
s22:式(ⅳ)核心结构lys-urea-glu和式(ⅱ)化合物在同一反应体系中同时分别脱除氨基保护基cbz和羧基保护基bn,并通过肽缩合试剂构建酰胺键,以得到式(ⅲ)化合物,
s23:式(ⅲ)化合物在三氟乙酸的作用下脱除保护基,得到式(ⅰ)小分子抑制剂。
具体的,将1当量式(ⅳ)核心结构lys-urea-glu和1当量式(ⅱ)化合物溶于甲醇或者乙醇中,加入0.05~0.2当量的催化剂如pd/c或者雷尼镍,氢气氛围下同时脱除式(ⅳ)核心结构lys-urea-glu的氨基保护基cbz和式(ⅱ)化合物的羧基保护基bn。随后过滤除去催化剂并蒸干溶剂,残余物溶解于干燥的二氯甲烷或者dmf,加入1~5当量的有机碱如三乙胺或者二异丙基乙胺和1~2当量的肽缩合试剂如dcc、edci、hatu、hobt、pyoap或者t3p等,室温搅拌1~24h,从而制备式(ⅲ)化合物。
将式(ⅲ)化合物溶解于10~50%三氟乙酸的二氯甲烷的溶液中,0~30℃搅拌1~24h,脱除氨基保护基boc和羧基保护基叔丁基从而制备得到式(ⅰ)小分子抑制剂。
其中,s11,s21~s23过程的反应式如下:
为了较好的理解本发明,下面以具体实例进行阐述。
式(ⅳ)核心结构lys-urea-glu的制备,请参阅图1及如下路线。
将n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐(3.0g,8.05mmol,1.0eq.)和cdi(1.4g,8.86mmol,1.1eq.)溶于二氯甲烷(20ml),加入三乙胺(2.0g,20.13mmol,2.5eq.),室温搅拌30min。加入dbu(1.3g,8.86mmol,1.1eq.),室温搅拌30min后,加入l-谷氨酸二叔丁酯盐酸盐(2.6g,8.86mmol,1.1eq.),加热回流3h。二氯甲烷稀释后,依次用5%硫酸氢钾溶液和饱和氯化钠溶液洗涤,无水硫酸钠干燥后,硅胶柱层析(pe:ea=3:1~2:1),得3.99g无色透明粘稠液体,收率79.8%。1hnmr(400mhz,cdcl3)δ7.38–7.28(m,5h),5.69–5.58(m,2h),5.52(d,j=7.8hz,1h),5.19–4.99(m,2h),4.40–4.32(m,2h),3.25–3.07(m,2h),2.30–2.21(m,2h),2.07–2.01(m,1h),1.87–1.65(m,2h),1.64–1.54(m,2h),1.44(s,18h),1.42(s,9h),1.36–1.26(m,3h);esi-ms:622.4[m+h]+,666.4[m+hcoo]-。
式(ⅳ)核心结构lys-urea-glu还可以通过如下方法制备:
将n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐(1.0g,2.68mmol,1.0eq.)和cdi(478.0mg,2.95mmol,1.1eq.)溶于二氯甲烷(6ml),加入dmap(66.0mg,0.54mmol,0.2eq.)和三乙胺(678.0mg,6.7mmol,2.5eq.),室温搅拌30min。加入dbu(448.8mg,2.95mmol,1.1eq.),室温搅拌10min后,加入l-谷氨酸二叔丁酯盐酸盐(872.6mg,2.95mmol,1.1eq.),加热回流3h。二氯甲烷稀释后,依次用5%硫酸氢钾溶液和饱和氯化钠溶液洗涤,无水硫酸钠干燥后,硅胶柱层析(pe:ea=3:1~2:1),得1.17g无色透明粘稠液体,收率70.2%。
式(ⅳ)核心结构lys-urea-glu还可以通过如下方法制备:
将n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐(1.0g,2.68mmol,1.0eq.)和cdi(478.0mg,2.95mmol,1.1eq.)溶于二氯甲烷(6ml),加入二异丙基乙胺(866.0mg,6.7mmol,2.5eq.),室温搅拌30min。加入dbu(448.8mg,2.95mmol,1.1eq.),室温搅拌10min后,加入l-谷氨酸二叔丁酯盐酸盐(872.6mg,2.95mmol,1.1eq.),加热回流3h。二氯甲烷稀释后,依次用5%碳酸氢钠水溶液、5%硫酸氢钾溶液和饱和氯化钠溶液洗涤,无水硫酸钠干燥后,硅胶柱层析(pe:ea=2:1),得1.20g无色透明粘稠液体,收率72.2%。
式(ⅳ)核心结构lys-urea-glu还可以通过如下方法制备:
将n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐(1.0g,2.68mmol,1.0eq.)和cdi(478.0mg,2.95mmol,1.1eq.)溶于二氯甲烷(6ml),加入dmap(66.0mg,0.54mmol,0.2eq.)和三乙胺(678.0mg,6.7mmol,2.5eq.),室温搅拌30min。加入dbu(448.8mg,2.95mmol,1.1eq.),室温搅拌10min后,加入l-谷氨酸二叔丁酯盐酸盐(872.6mg,2.95mmol,1.1eq.),室温搅拌10h。二氯甲烷稀释后,依次用5%碳酸氢钠水溶液、5%硫酸氢钾溶液和饱和氯化钠溶液洗涤,无水硫酸钠干燥后,硅胶柱层析(pe:ea=2:1),得0.68g无色透明粘稠液体,收率40.8%。
式(ⅳ)核心结构lys-urea-glu还可以通过如下方法制备:
将n'-苄氧羰基-l-赖氨酸叔丁酯盐酸盐(1.0g,2.68mmol,1.0eq.)和cdi(478.0mg,2.95mmol,1.1eq.)溶于二氯甲烷(6ml),加入二异丙基乙胺(1.73g,13.4mmol,5.0eq.),室温搅拌30min。加入l-谷氨酸二叔丁酯盐酸盐(872.6mg,2.95mmol,1.1eq.),加热回流3h。二氯甲烷稀释后,依次用5%碳酸氢钠水溶液、5%硫酸氢钾溶液和饱和氯化钠溶液洗涤,无水硫酸钠干燥后,硅胶柱层析(pe:ea=2:1),得0.85g无色透明粘稠液体,收率51.0%。
式(ⅱ)化合物的制备,请参阅图2及如下路线:
将boc-6-肼基烟酸(381.0mg,1.5mmol,1.0eq.)和6-氨基己酸苄酯(663mg,3mmol,2.0eq.)混悬于二氯甲烷(6ml),加入二异丙基乙胺(1ml,6.0mmol,4.0eq.),滴加50%的t3p/乙酸乙酯溶液(1.8ml,3.0mmol,2.0eq.),室温搅拌过夜。加入10ml水并搅拌10min后分出有机相,无水硫酸钠干燥后硅胶柱层析(pe:ea=1:2)得513.6mg无色透明粘稠液体,收率74.8%。1hnmr(400mhz,cdcl3)δ8.47(s,1h),7.89(d,j=7.2hz,1h),7.34(s,5h),7.07(s,1h),6.62–6.60(m,2h),5.10(s,2h),3.37(d,j=5.8hz,2h),2.36(t,j=7.0hz,2h),1.71–1.53(m,4h),1.46(s,9h),1.39–1.26(m,3h);esi-ms:457.3[m+h]+,455.3[m-h]-。
式(ⅱ)化合物还可以通过如下方法制备:
将boc-6-肼基烟酸(127.0mg,0.5mmol,1.0eq.)和6-氨基己酸苄酯(220mg,1mmol,2.0eq.)混悬于二氯甲烷(2ml),依次加入二异丙基乙胺(350μl,2.0mmol,4.0eq.)和hatu(380mg,1.0mmol,2.0eq.),室温搅拌过夜。减压浓缩并硅胶柱层析(pe:ea=1:2)得150.3mg无色透明粘稠液体,收率65.6%。
式(ⅱ)化合物还可以通过如下方法制备:
将boc-6-肼基烟酸(127.0mg,0.5mmol,1.0eq.)和6-氨基己酸苄酯(110mg,0.5mmol,1.0eq.)混悬于二氯甲烷(2ml),依次加入二异丙基乙胺(350μl,2.0mmol,4.0eq.)和hatu(380mg,1.0mmol,2.0eq.),室温搅拌过夜。减压浓缩并硅胶柱层析(pe:ea=1:2)得68mg无色透明粘稠液体,收率29.7%。
式(ⅱ)化合物还可以通过如下方法制备:
将boc-6-肼基烟酸(664.0mg,0.5mmol,1.0eq.)和6-氨基己酸苄酯对甲苯磺酸盐(1.02g,2.6mmol,1.0eq.)混悬于二氯甲烷(10ml),依次加入二异丙基乙胺(1.0g,7.8mmol,3.0eq.)和hatu(1.09g,2.9mmol,1.1eq.),室温搅拌过夜。减压浓缩并硅胶柱层析(pe:ea=1:2)得450mg无色透明粘稠液体,收率37.6%。
式(ⅲ)化合物的制备,请参阅图3及如下路线。
将式(ⅳ)核心结构lys-urea-glu(0.62g,1mmol,1.0eq.)和式(ⅱ)化合物(0.45g,1mmol,1.0eq.)溶于甲醇(3ml),加入pd/c(45mg,4%m/m),接入一氢气球,室温搅拌过夜(约12h),lc-ms显示反应完全,反应液经硅藻土抽滤,滤液浓缩,甲苯带两次除水。
将残余物溶解于二氯甲烷(8ml),往上述反应瓶中依次加入hatu(418.3mg,1.1mmol,1.1eq.)和dipea(387.8mg,3mmol,3.0eq.),室温搅拌过夜。减压浓缩,硅胶柱层析(dcm:meoh=20:1),得670mg白色固体,收率80.1%。1hnmr(400mhz,cdcl3)δ8.62(s,1h),8.03(s,1h),7.55(br,1h),7.42–7.31(m,2h),6.67(d,j=8.7hz,1h),6.61(br,1h),6.00(d,j=7.1hz,1h),5.89(d,j=7.9hz,1h),4.37–4.22(m,4h),3.47–3.35(m,2h),3.22–3.04(m,2h),2.33–2.28(m,2h),2.17(t,j=6.6hz,2h),2.09–2.00(m,1h),1.84–1.74(m,1h),1.65–1.55(m,6h),1.44–1.42(m,36h),1.36–1.25(m,6h);esi-ms:836.5[m+h]+,834.5[m-h]-。
式(ⅲ)化合物还可以通过如下方法制备:
将式(ⅳ)核心结构lys-urea-glu(450mg,0.72mmol,1.0eq.)溶于甲醇(5ml),加入10%的pd/c(22.5mg,5%m/m),接入一氢气球,室温搅拌过夜(约12h),lc-ms显示反应完全,反应液经硅藻土抽滤,滤液浓缩,甲苯带两次除水。将残余物溶解于二氯甲烷(6ml)往上述反应瓶中依次加入fmoc-6-氨基己酸(280mg,0.79mmol,1.1eq.)、hatu(300mg,0.79mmol,1.1eq.)和dipea(376μl,2.16mmol,3.0eq.),室温搅拌过夜。减压浓缩后硅胶柱层析纯化(pe:ea=1:1~1:2)得400mg白色固体4a,收率67.1%。1hnmr(400mhz,cdcl3)δ7.76(d,j=7.5hz,2h),7.60(d,j=7.4hz,2h),7.39(t,j=7.4hz,2h),7.30(t,j=7.4hz,2h),6.19(s,1h),5.44(d,j=7.8hz,2h),5.07(s,1h),4.51–4.15(m,5h),3.41–3.05(m,4h),2.34–2.28(m,2h),2.19(tj=6.9hz,2h),2.10–2.02(m,1h),1.90–1.79(m,1h),1.70–1.62(m,2h),1.56–1.49(m,4h),1.47–1.39(m,27h),1.37–1.18(m,6h);esi-ms:823.5[m+h]+,867.5[m+hcoo]-。
将式(ⅳ)核心结构lys-urea-glua(400mg,0.49mmol)溶解于乙腈(3ml),向上述溶液中加入1.5ml二乙胺,室温搅拌30min,lc-ms显示反应完全。减压浓缩,二氯甲烷和甲苯各共沸两次,油泵真空干燥2h。将上述胺溶解于干燥二氯甲烷(3ml),依次加入boc-6-肼基烟酸(136.8mg,0.54mmol,1.1eq.)、hatu(205.3mg,0.54mmol,1.1eq.)和dipea(190mg,1.47mmol,3.0eq.),室温搅拌过夜。反应液减压浓缩,硅胶制备薄层板纯化(dcm:meoh=15:1),得160mg白色固体,收率39.4%。esi-ms:836.5[m+h]+,834.5[m-h]-。
式(ⅰ)小分子抑制剂的制备,请参阅图4及如下路径:
将中间体1(100mg)溶于2mldcm中,加入2mltfa并室温搅拌2h。减压浓缩,油泵抽干,高效液相色谱纯化,得38.8mg白色固体,收率57.2%。1hnmr(400mhz,d2o)δ8.28(d,j=1.3hz,1h),8.07(dd,j=9.4,1.9hz,1h),6.99(d,j=9.5hz,1h),4.21(dd,j=9.0,5.1hz,1h),4.11(dd,j=8.6,4.9hz,1h),3.34(t,j=6.8hz,2h),3.12(t,j=6.6hz,2h),2.46(t,j=7.3hz,2h),2.20(t,j=7.1hz,2h),2.17–2.08(m,1h),1.99–1.87(m,1h),1.81–1.68(m,1h),1.67–1.51(m,5h),1.50–1.38(m,2h),1.38–1.24(m,4h);esi-ms:568.3[m+h]+,295.2[m+h+na]2+/2,566.3[m-h]-。
综上,在本发明所提供的前列腺特异性膜抗原的小分子抑制剂的制备方法中,通过以谷氨酸衍生物和赖氨酸衍生物为起始原料,利用羰基咪唑法一锅制备式(ⅰ)小分子抑制剂的式(ⅳ)核心结构lys-urea-glu;将式(ⅳ)核心结构lys-urea-glu通过连接链与具有99mtc螯合能力的hynic相连接后脱除保护基,以得到式(ⅰ)小分子抑制剂。基于本发明的制备方法制备的前列腺特异性膜抗原的小分子抑制剂(即式(ⅰ)小分子抑制剂)如果被放射性核素99mtc标记,则能够作为分子影像探针在临床上用于前列腺癌的诊断,具有潜在的临床应用价值。
上述描述仅是对本发明较佳实施例的描述,并非对本发明范围的任何限定,本发明领域的普通技术人员根据上述揭示内容做的任何变更、修饰,均属于权利要求书的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!