一株能稳定分泌抗副溶血弧菌TLH的单克隆抗体细胞株的制作方法
本发明属于细胞工程领域,具体涉及一株能稳定分泌抗副溶血弧菌tlh单克隆抗体的杂交瘤细胞株(igg)及其应用。
背景技术:
副溶血弧菌的快速检测、有效鉴定成为了预防海产品副溶血弧菌感染疾病发生最为关键的技术,也是今后避免此类事件再次发生的根本解决途径。副溶血弧菌外分泌的不耐热溶血毒素(tlh)是一个很重要的毒素分子,具有典型的溶血活性。值得重视的是,无论是临床分离的,还是从环境中分离得到的,tlh基因几乎存在于所有的副溶血弧菌中。因此,tlh可以作为副溶血弧菌的一个分子靶标来进行副溶血弧菌的分子检测。本研究以tlh为研究对象,主要采用杂交瘤技术和酶联免疫技术开展海洋副溶血弧菌的定量检测,在制备出的高特异性、高亲和力单克隆抗体的基础上,研究开发出针对海洋副溶血弧菌的可靠、快速、高灵敏度的抗体检测体系。本项目建立的海洋副溶血弧菌的检测体系,对于推进无公害水产品进程、克服国外技术壁垒、扩大水产品出口、降低人民群众对食品安全的忧虑、保证海洋食品安全、以及稳定社会秩序具有举足轻重的作用。
免疫分析法(immuno-analysis)是近十多年来发展起来的新方法,是将抗原抗体反应与灵敏的检测系统结合而成的一种分析方法,具有特异性好,灵敏度高,操作技术简单,成本低,对样品的纯度要求不高等优点,特别适合于大批量样本的检测,近年来被广泛普及应用于各种毒素的检测。所以,近十几年来用于生物毒素检测的酶联免疫吸附法(enzyme-linkedimmunosorbentassay,elisa)方法得到迅速发展。
目前对副溶血弧菌tlh的免疫检测研究报道很少。未见基于单克隆抗体(igg)的副溶血弧菌tlh的免疫分析。因此,建立一个快速、简便和灵敏的基于免疫学方法检测副溶血弧菌是势在必行的。基于以上情况,本研究发展基于单克隆抗体(igg)副溶血弧菌tlh的检测方法。本项目重点采用单克隆抗体、elisa检测技术,开展副溶血弧菌的检测与鉴定、力求在较短时间内建立起针对副溶血的快速、准确、灵敏、可信度高、科学性强、能适应我国国情、符合国际惯例的检测技术体系。
技术实现要素:
本发明目的是提供一株能稳定分泌抗副溶血弧菌tlh的单克隆抗体(igg)的杂交瘤细胞株。
本发明首先提供一株杂交瘤细胞株3g11,分类命名为抗副溶血弧菌tlh单克隆抗体杂交瘤细胞株,已于2018年11月9日在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号是:cgmccno.16700,地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
其次提供一种由所述杂交瘤细胞株3g11产生的单克隆抗体(igg)。
所述单克隆抗体的制备方法,是将杂交瘤细胞株3g11,通过制备腹水和纯化,获得单克隆抗体(igg)。
本发明还提供了所述杂交瘤细胞株3g11产生的单克隆抗体的应用,是将杂交瘤细胞株3g11产生的单克隆抗体(igg)用于检测副溶血弧菌tlh。
所述杂交瘤细胞株3g11产生的单克隆抗体的应用,是将所述的单克隆抗体配制在检测副溶血弧菌tlh的免疫试剂盒中。
所述的杂交瘤细胞3g11产生的单克隆抗体的制备方法是:表达纯化tlh的重组蛋白作为小鼠免疫用抗原和检测用抗原。小鼠免疫后,将血清效价达到1:16000的小鼠脾细胞与sp2/0用50%peg1450按照常规方法进行融合;用含20%胎牛血清的hatrpmi-1640培养基筛选融合细胞,用融合表达的抗原包被酶标板进行elisa检测;将阳性孔细胞进行多次有限稀释法克隆化后获得可稳定分泌抗ω-ctxmviia单克隆抗体的杂交瘤细胞株3g11。将此细胞株以1×106/只的量注射到用液体石蜡预致敏过的balb/c小鼠的腹腔中,一周后观察小鼠,待小鼠服部明显膨大且腹腔皮肤有紧张感时抽取腹水(腹水中含大量的杂交瘤细胞株3g11分泌的单克隆抗体)。12000r/min离心30min后取上清,-20℃保存。
本发明以原核表达纯化tlh重组抗原(mbp-tlh)为免疫抗原和检测抗原(his6-tlh)包被酶标板。通过ielisa法筛选获得一株阳性杂交瘤细胞3g11,该杂交瘤细胞株分泌单克隆抗体(igg)为建立副溶血弧菌tlh免疫检测方法奠定了基础。
本发明的优点在于:
目前的检测方法存在设备昂贵、对样品的纯度要求高、操作复杂、需要经过专业培训的人员操作等缺点,因此不适合推广。而本研究使用的免疫分析法,具有特异性好(详见图7),灵敏度高,操作技术简单,成本低,对样品的纯度要求不高等优点,特别适合于大批量样本的检测,并且还未有基于高亲和力单克隆抗体(igg)的副溶血弧菌tlh免疫分析的报道。
附图说明
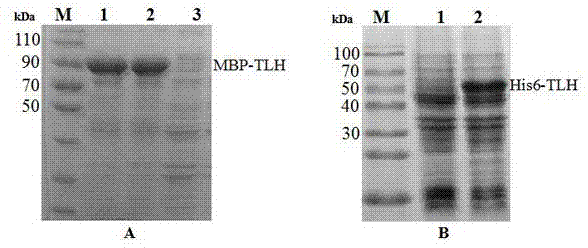
图1是本发明重组抗原的表达与纯化电泳图。a:泳道m:中分子量蛋白markers;泳道1-2:重组蛋白tlh表达产物;泳道3:空载体对照表达产物;b:泳道m:中分子量蛋白markers;泳道1:空载体对照表达产物;泳道2:重组蛋白tlh表达产物。
图2是本发明免疫小鼠血清效价测定。
图3是本发明细胞融合结果。a:融合的杂交瘤生长状态(4天);b:融合的杂交瘤生长状态(7天);c:融合的杂交瘤生长状态(9天)。
图4是本发明抗体纯化结果鉴定。泳道m:中分子量蛋白markers;泳道1:腹水总蛋白;泳道2:纯化的igg抗体。
图5是本发明杂交瘤细胞株染色体分析。
图6是本发明单克隆抗体亲和力检测结果。
图7是本发明单克隆抗体间接ielisa特异性分析结果。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
本发明的杂交瘤细胞株3g11,分类命名为抗副溶血弧菌tlh单克隆抗体杂交瘤细胞株,已于2018年11月9日在中国微生物菌种保藏管理委员会普通微生物中心保藏,地址:北京市朝阳区北层西路1号院3号,中国科学院微生物研究所,保藏编号是:cgmccno.16700。
实施例1本发明单克隆抗体的制备与鉴定
1、抗原载体构建
1)在ncbi的genebank数据库中找到tlh基因序列,使用premier5.0在线软件,设计可扩增tlh基因的两个引物。由于pbd-his-mbp和pet28a载体含有ecori、hindⅲ这两个限制性酶切位点,为了保证载体与目的基因的连接,所以在上下游引物添加了ecori、hindⅲ限制性酶切位点。经过软件的调试,及考虑了一些错配、tm(meltingtemperature)等因素,最后确定引物序列如下:
primer-f:ttagaattcatgatgaaaaaaacaatcacac(ecori);
primer-r:attaagcttgttgttgctactttctagc(hindiii)。
2)根据软件设计的tlh基因引物及其所要注意的一些因素,经过多次的调整和预实验,最终确定基因tlh的最适pcr反应体系如下:
pcrmixture25μl
primer-f0.5μl
primer-r0.5μl
templatedna2μl
ddh2o22μl
pcr循环条件为:94℃,5min;94℃,45s;47℃,50s;72℃,1min,30个循环;72℃,5min。
pcr产物用1%的琼脂糖凝胶电泳检测后,根据目的条带的位置进行切胶回收,其具体操作步骤可按试fermentas公司剂盒说明书进行。
3)重组质粒pbd-his-mbp-tlh的构建
从ncbi的genebank数据库中获取mbp的基因序列,通过人工合成该基因片段,通过kpni和nhei酶切位点直接插入到pet28a载体中,构建的载体命名为pbd-his-mbp载体;将处理好的tlh基因插入到同样经过ecori和hindiii双酶切处理的pbd-his-mbp载体中,用t4-dna连接酶连接过夜,从而得到了重组质粒pbd-his-mbp-tlh。转入e.colibl21(de3)感受态细胞,涂布于lb+amp平板上,获得重组表达菌株bl21(de3)/pbd-his-mbp-tlh。
4)重组质粒pet28a-tlh的构建
将处理好的tlh基因插入到同样经过ecori和hindiii双酶切处理的pet28a载体中,用t4-dna连接酶连接过夜,从而得到了重组质粒pet28a-tlh。转入e.colibl21(de3)感受态细胞,涂布于lb+amp平板上,获得重组表达菌株bl21(de3)/pet28a-tlh。
5)重组质粒的筛选、检测
挑取lb+amp平板上的单菌落,接种于lb+amp的液体培养基于37℃摇床培养8h,将菌体送去测序鉴定。
2、tlh的重组抗原的表达与纯化
1)菌株bl21(de3)/pbd-his-mbp-tlh和bl21(de3)/pet28a-tlh活化与蛋白表达,取1ml上述每种新鲜菌液分别接种于100mllb液体培养基(100μg/mlamp),37℃、180r/min摇床震荡培养约3h。待菌液od600nm约为0.8,加入100μl1.0mol/l的iptg,16℃、180r/min震荡摇床过夜培养。
2)mbp-tlh融合蛋白切胶纯化
将10ml过夜表达的bl21(de3)/pbd-his-mbp-tlh菌液分装于1.5ml离心管,4℃、8000r/min离心10min。弃上清,加上样缓冲液将菌体重悬,充分混匀,用沸水煮10min,12000r/min离心10min。取上清10μl/每孔,进行sds-page电泳,结果如图1a所示。考马斯亮蓝染色后切下目的蛋白条带,充分研磨,收集粉末即为免疫抗原。
3)his6-tlh融合蛋白纯化
将100ml过夜表达的bl21(de3)/pet28a-tlh菌液分装于50ml离心管,4℃、8000r/min离心10min。弃上清,加buffera将菌体重悬,用超声破碎仪破碎,工作5s,暂停10s,直至菌液由浑浊变澄清。将超声破碎后的菌液4℃、10000r/min离心10min。离心后收集上清加入buffera平衡过的ni2+-nta亲和层析柱,静置后流出柱内液体,然后用bufferb缓慢流过柱子洗去杂蛋白。加入bufferc将目的蛋白洗脱出来,收集流出液。纯化所得蛋白进行sds-page电泳,如图1b所示。
3、单克隆抗体的制备
1)小鼠免疫
以完全抗原mbp-tlh免疫6-8周龄雌性balb/c小鼠。
第一次免疫:取完全抗原mbp-tlh100μg稀释于pbs缓冲液(500μl),并与等体积弗氏完全佐剂混匀,用注射器抽吸乳化完全后,对balb/c小鼠进行皮下多点注射。第二次免疫:两周后对小鼠进行二次免疫,取完全抗原mbp-tlh75μg稀释于pbs缓冲液(500μl),并与等体积弗氏不完全佐剂混匀,用注射器抽吸乳化完全后,对balb/c小鼠进行皮下多点注射。第三次免疫:两周后对小鼠进行三次免疫,方法同第二次。免疫一周后尾部取血,以his6-tlh完全抗原包被酶标板,间接elisa检测血清效价。若效价达到1:16000的小鼠脾细胞可用于融合实验,如图2所示。若未达到效价的小鼠可继续按照常规方法免疫,直至效价达到为止。加强免疫:取血清效价达到1:16000的小鼠,融合前3天取完全抗原mbp-tlh用生理盐水稀释混匀后每只50μg的量腹腔注注射balb/c小鼠;
2)免疫血清效价测定
采用ielisa方法进行小鼠血清效价的测定,实验方法如下:
(1)获得血清:从小鼠尾部静脉取血,获得血液于37℃水浴30min。之后12000r/min离心15min,用移液枪吸取上层血清。
(2)包被:用包被缓冲液稀释his6-tlh蛋白至终浓度为5μg/ml,100µl/孔加样。37℃孵育2h。
(3)洗涤:用1×pbs洗板3次,200µl/孔,洗完后拍干。
(4)封闭:加入4%pbsm封闭液,200µl/孔,37℃孵育2h。
(5)一抗:重复步骤(3),用封闭液稀释抗体,稀释如下(1:1000、1:2000、1:4000、1:8000、1:16000、1:32000、1:64000)。100µl/孔,37℃孵育1h。并用未免疫小鼠血清作为阴性对照。
(6)二抗:重复步骤(3),hrp酶标羊抗鼠igg用封闭液按1:8000稀释,100µl/孔,37℃孵育1h。
(7)显色:重复步骤(3),加入tmb显色缓冲液,100μl/孔,37℃孵育15min。
(8)终止:最后加入2mol/lh2so4,50μl/孔。酶标仪测定od450nm值。
3)细胞融合
将加强免疫3天后的小鼠颈椎脱臼处死,解剖取脾脏。将1×108个脾细胞与1×107个sp2/0细胞混合,1000r/min离心7min后弃上清,将离心管里细胞沉淀弹松散。37℃水浴条件下,1min内缓慢加入1ml预热的peg1450溶液。静置1min后,缓慢加入40ml1640培养基终止融合。37℃培养箱静置10min。1000r/min离心7min,弃上清,将细胞沉淀重悬于100ml预热的hat培养基。将融合细胞加入已有饲养细胞的96孔培养板,100μl每孔。放入37℃二氧化碳培养箱培养。每天观察一次,查看是否有污染以及融合情况,融合一星期后更换hat培养基,换液量为一半。
4)阳性杂交瘤细胞的筛选
用间接elisa法筛选细胞培养上清,选择od值较高的阳性孔用有限稀释法进行克隆化2-3次,直至阳性率为100%为止。最后获得能稳定分泌单克隆抗体的杂交瘤细胞株3g11,如图3所示。从图中可以看出,在倒置显微镜下观察到该杂交瘤细胞株的细胞状态良好,细胞增殖速度快,折光性好,细胞孔中背景很干净。然后将该细胞株扩大培养后冻存。
5)腹水的制备与纯化
将杂交瘤细胞株3g11以1×106/只的量注射到石蜡致敏过的雌性balb/c小鼠腹腔中,一周后观察小鼠,待小鼠腹部膨大且有紧张感时抽取腹水,离心后分为三层(由下向上依次为细胞沉淀,含有大量单克隆抗体的澄清透亮层,脂质层),然后取其澄清透亮的中间层。该细胞分泌的抗体属于igg1型抗体,利用proteing亲和层析介质法从腹水中纯化单克隆抗体,接着用10%sds-page凝胶电泳检测验证抗体的纯度,如图4所示。从图中可以看出,纯化后的抗体在40-50kda处和25-30kda处有明显的条带,分别对应igg抗体的重链和轻链,而且几乎没有杂带,表明proteing亲和层析介质法纯化igg抗体效果很好,然后将纯化的单克隆抗体于-20℃保存。
4、单克隆抗体的特性鉴定
1)染色体分析:用0.1%秋水仙素(0.25μmol/l)处理对数生长期细胞,培养4-6h后悬起细胞,1000r/min离心10min,弃上清,加入37℃预热的0.075mol/lkcl10ml重悬细胞,37℃温箱静置15-20min;在细胞悬液中加入1ml新配制的甲醇-冰醋酸(3:1)固定液,混匀后室温静置5min,1000r/min离心10min,弃上清;向细胞沉淀中再加入5ml固定液,缓慢地重悬混匀细胞,室温固定20-30min,1000r/min离心10min,弃上清,再加入5ml的固定液对细胞固定过夜。次日早上,1000r/min离心10min,弃上清。再加入200-300μl的固定液,将细胞轻轻地吹起,混匀。在冰冻的载玻片上滴加1-2滴细胞悬液,立即吹散,自然干燥,用新配制1:10giemsa磷酸缓冲液染色10-15min,蒸馏水冲洗,晾干后镜检,显微照相与核型分析。如图5所示,用0.1%秋水仙素对阳性杂交瘤细胞3g11进行处理后,染色并显微镜下观测,计算处于分裂中期的杂交瘤细胞的染色体数目为103±4条,杂交瘤细胞的染色体数目接近于两个亲本的染色体数目之和,证明该阳性杂交瘤细胞为骨髓瘤细胞与脾细胞融合而成。
2)单克隆抗体亲和力测定
根据beatty的方法,用ielisa进行单克隆抗体亲和力常数kaff的测定。用包被缓冲液将his6-tlh稀释成10、5、2.5μg/ml包被在elisa酶标板中。用5%pbsm将纯化后的单克隆抗体倍比稀释作一抗,加入酶标孔。其余步骤同以上ielisa检测。
计算出,每一个抗原浓度在ic50对应的抗体浓度,按照下面公式可以计算出抗体亲和力常数。
式中:[ab]表示抗原浓度为[ag]时,在ic50处的抗体浓度;
[ab]t表示抗原浓度[ag]t时,在ic50处的抗体浓度;
n=[ag]/[ag]t;
测定结果如图6所示,利用origin8.0软件进行拟合曲线的制作,根据各曲线中的ic50,按照亲和常数测定公式技算出抗体的亲和力为1.76×109l/mol,为高亲和力抗体。
3)单克隆抗体特异性ielisa特异性分析
用ielisa检测方法进行测定。将his6-tlh、gfp、klh、ova、bsa这5种蛋白抗原按用包被缓冲液稀释至终浓度为5μg/ml进行包被,单克隆抗体作为一抗按1:8000稀释,hrp酶标羊抗鼠igg为二抗,按1:8000稀释加入,其余具体操作步骤同ielisa法。所得数据统计如图7。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
sequencelisting
<110>福建农林大学
<120>一株能稳定分泌抗副溶血弧菌tlh的单克隆抗体细胞株
<130>2
<160>2
<170>patentinversion3.3
<210>1
<211>31
<212>dna
<213>人工序列
<400>1
ttagaattcatgatgaaaaaaacaatcacac31
<210>2
<211>28
<212>dna
<213>人工序列
<400>2
attaagcttgttgttgctactttctagc28
- 还没有人留言评论。精彩留言会获得点赞!