诱导脐带间充质干细胞成软骨分化的培养方法,以及该方法所用的培养基与流程
本发明涉及细胞诱导培养
技术领域:
,具体而言,涉及一种诱导脐带间充质干细胞成软骨分化的培养方法,以及该方法所用的培养基。
背景技术:
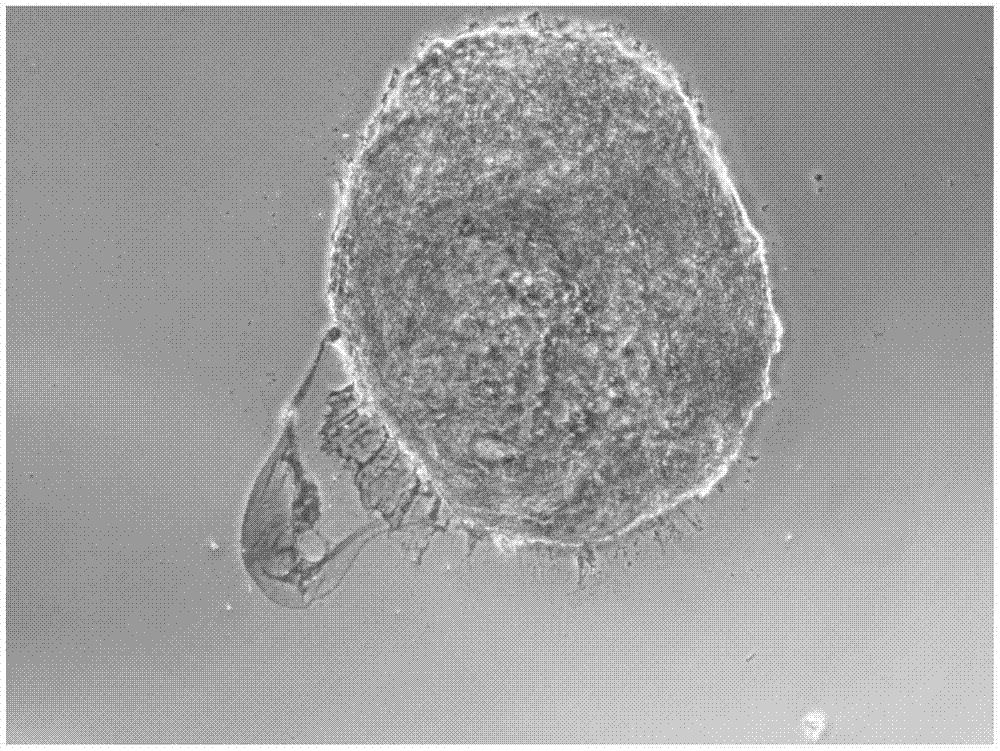
:间充质干细胞(mesenchymalstemcells,msc)是中胚层来源的、具有高度自我更新能力和多向分化潜能的多能干细胞。事实上,msc广泛存在于全身多种组织中,几乎来源于机体所有的组织器官,如骨髓、骨膜、脂肪组织、牙髓、滑膜、脐带、胎盘、羊水及胎儿组织等。不同来源的间充质干细胞具有相似的形态,表达相同的表面标记,具有相似的生物学特性方面,如可在体外培养扩增,并能在特定条件下分化为包括神经细胞、成骨细胞、软骨细胞、肌肉细胞、脂肪细胞在内的多组织系统的细胞。msc除了具有多向组织细胞分化能力之外,还在造血、免疫炎症反应、血管新生等人体重要功能中起重要调节作用。脐带间充质干细胞是指存在于新生儿脐带组织中的一种多功能干细胞。脐带间充质是一类低免疫原性细胞,且具有很强的免疫调节功能。脐带间充质干细胞拥有msc的全部特性,并且含量丰富,易于分离培养。与其他来源的msc相比,uc-msc更原始,是介于胚胎干细胞和成体干细胞之间的干细胞,其增殖和分化能力比胚胎干细胞低,但明显高于成体干细胞。脐带间充质干细胞具有多分化潜能,在特定的诱导条件下,uc-msc不仅能分化为骨、软骨、脂肪、肌腱等中胚层细胞,而且能够向内胚层组织细胞(如心肌细胞、肝细胞)和外胚层组织细胞(如神经细胞)分化。uc-msc不具致瘤性,能在不同的诱导条件及合适的体内生长微环境中,安全地定向分化为不同的组织细胞系,具有修复各种组织和器官的能力。mscs被诱导分化成软骨细胞是一个受多种因素控制的复杂过程,受多种细胞因子和激素的调控。转化生长因子β(tgf-β)是发现最早的能够诱发软骨生成的生物活性分子,不但能促进软骨细胞的增殖,还能刺激ⅱ型胶原和蛋白多糖的表达,提高mscs分化成软骨的能力。胰岛素在软骨组织工程中也具有十分重要的意义,外源性胰岛素可促进软骨细胞的有丝分裂和细胞外基质的ⅱ型胶原及gag合成。地塞米松(dex)是一种长效肾上腺糖皮质激素,糖皮质激素是体外诱导人mscs分化成软骨细胞所必需的。dex能够直接与糖皮质激素受体结合,上调聚集蛋白聚糖、皮连蛋白及ⅺ型胶原基因的表达,诱导mscs向软骨细胞分化,并且能够加强的作用。一些其他的生物活性因子和化学药品也能促进msc的成软骨分化,如骨形态发生蛋白(bmps)、催乳素(prl)、血管内皮生长因子(vegf)、脯氨酸、丙酮酸钠等都已被证实具有有效提升mscs分化成软骨细胞的能力。脐带间充质干细胞的成软骨分化是一个多因素控制的过程,需要优化多种组分比例。现有诱导技术诱导分化率比较低,时间周期长,需要14~28天左右才能形成软骨,而且不能有效地使所有间充质干细胞都分化为软骨细胞,从而导致诱导后的软骨密度低,不够致密,软骨品质差,去分化速度快,不利于以后在组织工程中的使用。有鉴于此,特提出本发明。技术实现要素:本发明的主要目的在于通过优化脐带间充质干细胞诱导分化为软骨过程中诱导分化组分,提高脐带间充质干细胞分化为软骨细胞的速度和比率,提高诱导后软骨细胞的品质。为了实现本发明的上述目的,特采用以下技术方案:本发明涉及一种诱导脐带间充质干细胞成软骨分化的培养基,其由基础培养基中至少额外添加如下组分得到:tgf-β37~13ng/ml、地塞米松0.07~0.13μmol/l、抗坏血酸酯40~60μg/ml、1×its0.7~1.3w/v%、l-脯氨酸30~50μg/ml以及丙酮酸钠0.7~1.3mmol/l。根据本发明的另一方面,本发明还涉及一种诱导脐带间充质干细胞成软骨分化方法,包括:使用如上所述的培养基培养脐带间充质干细胞。与现有技术相比,本发明的有益效果为:本发明通过优化诱导组分,并搭配特定的培养方法,提高了诱导速度,7天后即可形成坚硬密实的软骨,接种的所有间充质干细胞都可分化会软骨细胞,分化率提高。诱导后的软骨小球,质地密实,经特异性染色显示,均充分分化为软骨细胞。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明一个实施例中在培养d7时整个软骨小球染色照片;图2为本发明一个实施例中在培养d7时小球染色局部照片;图3为本发明一个实施例中在培养d14时整个软骨小球染色照片;图4为本发明一个实施例中在培养d14时小球染色局部照片。具体实施方式本发明涉及一种诱导脐带间充质干细胞成软骨分化的培养基,其由基础培养基中至少额外添加如下组分得到:tgf-β37~13ng/ml、地塞米松0.07~0.13μmol/l、抗坏血酸酯40~60μg/ml、1×its0.7~1.3w/v%、l-脯氨酸30~50μg/ml以及丙酮酸钠0.7~1.3mmol/l。在一些实施方式中,其由基础培养基中至少额外添加如下组分得到:tgf-β38~12ng/ml、地塞米松0.08~0.12μmol/l、抗坏血酸酯45~55μg/ml、1×its0.8~1.2w/v%、l-脯氨酸35~45μg/ml以及丙酮酸钠0.8~1.2mmol/l。在一些实施方式中,其由基础培养基中至少额外添加如下组分得到:tgf-β310ng/ml、地塞米松0.1μmol/l、抗坏血酸酯50μg/ml、1×its1w/v%、l-脯氨酸40μg/ml以及丙酮酸钠1mmol/l。在一些实施方式中,所述基础培养基为dmem高糖培养基。高糖的dmem培养基含有葡萄糖4000mg/l~5000mg/l,高糖培养基适合于脐带间充质干细胞向软骨细胞的分化。根据本发明的另一方面,本发明还涉及一种诱导脐带间充质干细胞成软骨分化方法,包括:使用如上所述的培养基培养脐带间充质干细胞。在一些实施方式中,用于接种的脐带间充质干细胞为p3~p5代,细胞汇合度为70%~80%且状态良好的细胞经消化后收集得到;此培养阶段的脐带间充质干细胞生长迅速,利于分化培养。在一些实施方式中,所述消化所采用的胰酶浓度为0.20%~0.30%;还可以选择0.25%。在一些实施方式中,在消化完成,清洗细胞后,将细胞移至透气尖底细胞培养管中,离心后去除上层液体。在一些实施方式中,在培养时,细胞的接种量为每500μl培养基接种(1~9)×105个细胞;在一些实施方式中,细胞的接种量为每500μl培养基接种(2~8)×105个细胞;或3×105个、5×105个、7×105个细胞。在一些实施方式中,所述培养的时间为13~15天,还可以选择14天;在一些实施方式中,从第7天开始,每2~4天换液一次。下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例11.诱导组分名称组分tgf-β37ng/ml地塞米松0.07μmol/l抗坏血酸酯40μg/ml1×its1.3%l-脯氨酸30μg/ml丙酮酸钠1.3mmol/l2.诱导培养基的配制1)诱导分化的基础培养基为dmem高糖培养基。2)以配制100ml完全诱导培养基计算诱导组分tgf-β3、地塞米松、抗坏血酸酯、1×its、l-脯氨酸、丙酮酸钠的用量,用无菌0.5mlep管分装好,-20℃保存。所有组分避光保存。3)配制时将所需体积的dmem高糖培养基、地塞米松、抗坏血酸酯、1×its、l-脯氨酸、丙酮酸钠取出,溶化后混合,配成预混液,可4℃保存5-7d。4)临用前加入tgf-β3,配成完全培养基,完全培养基尽量在24h内用完。3.诱导分化步骤1)取t75瓶接种的,p3-p5代长满至70-80%且状态良好的脐带间充质干细胞一瓶,移液管吸去培养基,加入2mlpbs轻轻旋转冲洗掉剩余培养基。2)加入1ml提前室温平衡的0.25%的胰酶,轻轻旋转使胰酶均匀分布。平放静止1-2min左右,举起培养瓶在灯下肉眼观察贴壁的细胞是否斑驳脱落。如消化过程较慢,可轻轻拍打培养瓶侧壁,通过震动加速细胞脱落。3)细胞基本全部脱落后,加入1ml血清,旋转混合终止胰酶的消化作用。加入10mlpbs收集细胞,将收集的细胞转移到50ml离心管内。再次加入10mlpbs,旋转培养瓶,收集剩余细胞。4)置于离心机中,配平,1000rpm离心5min,轻轻吸去上清液。加入20mlpbs再次1000rpm离心5min,小心吸走上清液。5)10mlpbs重悬细胞,用细胞计数板计数,计算出细胞密度。6)取5×105的脐带间充质干细胞于15ml透气尖底细胞培养管中,500-600rpm低速离心5min,小心吸走上层pbs。7)取500μl完全诱导培养基,沿管壁缓慢加入,将细胞培养管轻轻置于co2培养箱中,隔夜培养。d1,可见细胞培养管底部形成一个乳白色的细胞球。d2,小心吸去细胞培养管内的培养液,加入新鲜培养液500μl。d5,再一次换液。d7,即可看到细胞球已非常致密,结实,表面光滑明亮。8)d7-d14,可继续每3天换液一次,在此期间任意时间也可进行冰冻切片,染色,考察细胞的成软骨分化结果。实施例21.诱导组分名称组分tgf-β313ng/ml地塞米松0.13μmol/l抗坏血酸酯60μg/ml1×its0.7%l-脯氨酸50μg/ml丙酮酸钠0.7mmol/l2.诱导培养基的配制同实施例1。3.诱导分化步骤同实施例1。实施例31.诱导组分2.诱导培养基的配制同实施例1。3.诱导分化步骤同实施例1。实施例41.诱导组分名称组分tgf-β310ng/ml地塞米松0.1μmol/l抗坏血酸酯50μg/ml1×its1%l-脯氨酸40μg/ml丙酮酸钠1mmol/l2.诱导培养基的配制同实施例1。3.诱导分化步骤同实施例1。实验例对实施例4培养分化所得的软骨组织进行切片鉴定。一、d7切片取已诱导7d的脐带间充质干细胞软骨小球1个,用pbs浸泡,冲洗干净。将小球置于冰冻切片机标本拖上,覆盖一层冰冻包埋剂,置于冰冻切片机冷冻至密实。将切片厚度设置为8μm,切片,切到软骨小球后,用组织标本专用载玻片收取切片。切片用4%中性甲醛固定30min,流水轻轻冲洗。滴加阿利新蓝染色液,使软骨细胞被全部覆盖,室温避光染色30min。流水轻轻冲洗干净,显微镜下观察,拍照。拍照结果如图1和图2所示。阿利新蓝染色部分显示的是软骨组织中的蛋白聚糖,是软骨细胞的主要特征组分,是成软骨分化的可靠标志物。可以看到7d染色,脐带间充质干细胞已全部分化成软骨细胞,且质地紧实,小球中间很少看到空隙。说明本诱导方案具有非常高的诱导效率,诱导时间能大大缩短。二、d14切片过程同d7。拍照结果如图3和图4所示。d14染色显示,小球质地更加密实,说明诱导培养基能够持续诱导软骨细胞的分化。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1