一种能表达舞毒蛾USP基因dsRNA的植物表达载体的构建方法及其应用与流程
本发明涉及分子生物学领域,具体涉及一种表达dsrna的植物表达载体的构建方法及其应用。
背景技术:
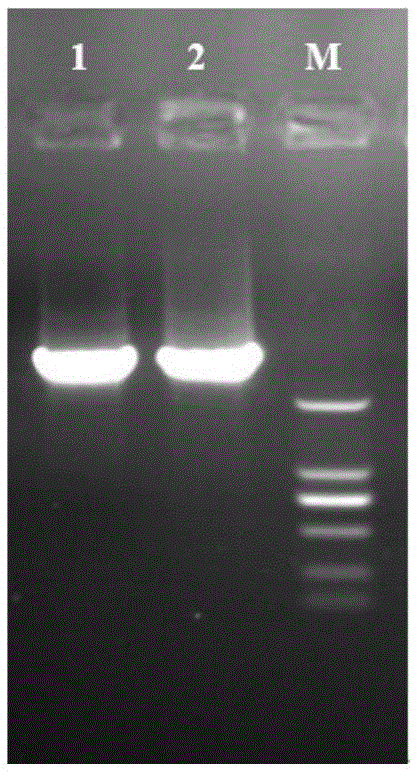
:舞毒蛾是一种重要农林食叶害虫,具有分布范围较广、取食植物种类较多等特点,在我国各地几乎均有分布,造成经济损失较大,一直以来是森林保护工作中的重点防治对象之一。在舞毒蛾的防治手段中化学农药依旧是主要的防治方法。化学农药的长时间、高频率、使用量不断的增加,导致了严重的“3r”问题(即抗药性、再增猖撅、残留)出现并逐渐引起关注。随着科学研究支持力度的加大,推动了分子生物学技术的快速发展,并使其被广泛应用于多种害虫的生理机制研究及防治,利用rnai技术控制害虫的危害已成为植物保护工作者研究的热点。技术实现要素:本发明是要解决现有舞毒蛾的化学防治存在抗药性和污染环境的问题,提供一种能表达舞毒蛾usp基因dsrna的植物表达载体的构建方法及其应用。本发明提供一种能表达舞毒蛾usp基因dsrna的植物表达载体的构建方法,构建过程中采用能够表达基因dsrna的中间载体进行构建。进一步的,所述能够表达基因dsrna的中间载体的构建方法为:先将phannibal载体上的35s-pdk-ocs片段与pcambia2300植物表达载体链接后形成能够表达基因dsrna的pcambia2300-pdk中间载体。具体的,通过将usp目的基因片段分别正反向插入到所述pcambia2300-pdk中间载体的pdk内含子的左右侧,形成以pcambia2300载体为表达载体的干扰载体片段gene-pdk-gene,构建成能够表达uspdsrna的植物表达载体pcambia2300-gene-pdk-gene重组质粒。其中usp基因和pcambia2300-pdk中间载体均含有kpni--kpni和xbai--bamhi两组内切酶酶切位点。重组子具有可用于筛选的氨苄青霉素和卡那抗性基因。进一步的,在usp目的基因片段插入pcambia2300-pdk中间载体之前,采用kpni--kpni和xbai--bamhi两组内切酶分别对质粒和usp目的基因片段进行双酶切。本发明还提供表达舞毒蛾usp基因dsrna的植物表达载体在舞毒蛾害虫防治中的应用。进一步的,将含有usp目的片段的pcambia2300-gene-pdk-gene重组载体进行84k杨遗传转化,获得转基因84k杨植株。所述转基因84k杨植株能够显著抑制舞毒蛾幼虫usp基因的表达,干扰舞毒蛾幼虫的生长发育,并对舞毒蛾幼虫具有致死作用,并且舞毒蛾幼虫对于表达uspdsrna植株叶片表现出拒食性,表达uspdsrna植株具有一定的抗虫性。本发明的有益效果:蜕皮激素和保幼激素作为昆虫体内两类非常重要的激素家族,共同调节着昆虫发育过程中复杂的蜕皮和变态两大生理反应。已发现在多种昆虫体内,超气门蛋白(usp)能够与蜕皮激素受体(ecr)组成异源二聚体,在蜕皮激素信号转导过程中具有重要功能。本发明提供一种能够表达舞毒蛾usp基因dsrna的植物表达载体pcambia2300-gene-pdk-gene重组质粒,进一步通过农杆菌介导法将其导入84k杨,获得表达uspdsrna的84k杨转化植株。将转化植株进行害虫舞毒蛾防治中的应用,严重干扰舞毒蛾重要保幼-蜕皮发育相关基因usp的表达,usp表达显著降低,引起舞毒蛾幼虫发育受阻,甚至引起死亡,并且表达uspdsrna植株叶片具有一定的抗虫性。本发明提供能够表达usp基因dsrna的转基因84k杨植株应用于舞毒蛾害虫的防治。将能够表达usp基因dsrna的转基因84k杨植株叶片喂食舞毒蛾幼虫后,表现拒食现象,与对照处理相比,高效沉默了舞毒蛾的靶标基因usp基因,致使舞毒蛾幼虫鲜重增长速率显著低于对照组,并出现死亡现象。取食转基因植株叶片严重阻碍了舞毒蛾幼虫的正常生长发育,为绿色环境友好型农林害虫防治提供新的思路和实践技术。附图说明图1为35s-pdk-ocs序列扩增;其中m:2000bpdnamarker;1-2:35s-pdk-ocsfragments;图2为载体pcambia2300-pdkpcr扩增;其中m:2000bpdnamarker;1-6:pcrfragments;图3为分别带有kpni和xbai/bamhiusp片段pcr序列扩增;其中m:2000bpdnamarker;1:uspfragment(1177kpnif/r);2:usp-3fragment(1177xbai-f/bamhi-r);图4为pcambia2300-gene-pdk重组质粒pcr序列扩增;其中m:2000bpdnamarker;1-5:pcrfragments(p1177-f/p1177-r);图5为pcambia2300-gene-pdk-gene重组质粒pcr序列扩增;其中m:2000bpdnamarker;1-5:pcrfragments(p1177check-f/pphan-seq-r);图6为pcambia2300-gene-pdk-gene融合表达载体分别用kpni和xbai--bamhi两组内切酶进行酶切检测;其中m:2000bpdnamarker;1:enzymedigestionbykpni;2:enzymedigestionbyxbai—bamhi;图7为具有抗性的转基因植株;图8为pcr检测具有抗性的转化植株;其中m:2000bpdnamarker;1~4:转化植株;5:对照植株;图9为转基因植株对舞毒蛾usp基因表达量的影响;图10为转基因植株对舞毒蛾幼虫鲜重的影响;图11为舞毒蛾幼虫对普通84k杨的取食结果;图12为舞毒蛾幼虫对转基因84k杨的取食结果。具体实施方式本发明技术方案不局限于以下所列举具体实施方式,还包括各具体实施方式间的任意组合。具体实施方式一:本实施方式能表达舞毒蛾usp基因dsrna的植物表达载体的构建方法,构建过程中采用能够表达基因dsrna的中间载体进行构建。具体实施方式二:本实施方式与具体实施方式一不同的是:所述能够表达基因dsrna的中间载体的构建方法为:先将phannibal载体上的35s-pdk-ocs片段与pcambia2300植物表达载体链接后形成能够表达基因dsrna的pcambia2300-pdk中间载体。其它与具体实施方式一相同。具体实施方式三:本实施方式与具体实施方式二不同的是:通过将usp目的基因片段分别正反向插入到所述pcambia2300-pdk中间载体的pdk内含子的左右侧,形成以pcambia2300载体为表达载体的干扰载体片段gene-pdk-gene,构建成能够表达uspdsrna的植物表达载体pcambia2300-gene-pdk-gene重组质粒;其中usp基因和pcambia2300-pdk中间载体均含有kpni--kpni和xbai--bamhi两组内切酶酶切位点。其它与具体实施方式二相同。具体实施方式四:本实施方式与具体实施方式三不同的是:在usp目的基因片段插入pcambia2300-pdk中间载体之前,采用kpni--kpni和xbai--bamhi两组内切酶分别对质粒和usp目的基因片段进行双酶切。其它与具体实施方式三相同。具体实施方式五:本实施方式表达舞毒蛾usp基因dsrna的植物表达载体在舞毒蛾害虫防治中的应用。具体实施方式六:本实施方式与具体实施方式五不同的是:将含有usp目的片段的pcambia2300-gene-pdk-gene重组载体进行84k杨遗传转化,获得转基因84k杨植株。其它与具体实施方式五相同。下面对本发明的实施例做详细说明,以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实施例。实施例1:表达usp基因dsrna的植物表达载体pcambia2300-gene-pdk-gene的重组构建构建干扰载体时,先将phannibal载体上的35s-pdk-ocs片段与pcambia2300植物表达载体链接后形成pcambia2300-pdk中间载体,其次将目的基因分别正反向插入到pdk内含子的左右侧,形成以pcambia2300载体为表达载体的干扰载体片段gene-pdk-gene,构建成pcambia2300-gene-pdk-gene质粒。具体实施方案如下,(一)35s-pdk-ocs片段的pcr扩增首先进行35s-pdk-ocs(2919bp)目的片段的pcr扩增,用于扩增的正向引物(p1129f5’-caatttcacacaggaaacag-3’)和反向引物(p1129r5’-cagatttaggtgacactatag-3’)序列分别设计于phannibal载体saci上游60bp和phannibal载体psti下游60bp。pcr扩增产物进行2%琼脂糖凝胶电泳检测(图1),用胶回收试剂盒(omega)回收该目的片段。(1)pcr反应体系:(2)pcr反应程序:98℃预变性,5min;循环为98℃变性,10s;55℃退火,30s;68℃延伸,3min;共30个循环;68℃延伸5min。(二)融合表达载体pcambia2300-pdk的构建将35s-pdk-ocs片段分别用saci和psti内切酶进行酶切后,与同样用saci--psti酶切的载体pcambia2300进行体外连接,并将连接产物转化大肠杆菌dh5α感受态细胞。将转化出来的单菌落通过摇菌后用引物(p1129check-f正向引物:5’-cttctaaatggattgac-3’;p1129check-r反向引物:5’-caatcagtaaattgaacggag-3’)进行菌液pcr鉴定,序列大小约350bp,pcr扩增产物进行2%琼脂糖凝胶电泳检测(图2)。将经过菌液pcr鉴定的阳性菌液进行测序和质粒抽提,备用。连接体系见下:(三)pcambia2300-gene-pdk-gene载体的构建(1)usp目的片段的pcr扩增按照invitrogen公司trizolrna动植物组织总rna提取试剂操作说明进行舞毒蛾幼虫总rna提取,对所提取的rna进行dna消化,紫外分光光度计及电泳检测rna,选取质量合格的rna按照takara公司primescripttmrt-pcrkit(型号drr014a)反转录试剂盒操作步骤进行cdna第一链的合成。以cdna第一链为模板进行usp-3目的片段p1177的pcr扩增,用于扩增正向插入片段(pdk左侧)的引物两端需添加酶切位点kpni,引物序列为正向引物p1177kpni-f5’-ggggtaccgtcaattggaccagactac-3’,反向引物p1177kpni-r5’-ggggtacccacgccaaacatttctgatac-3’;用于扩增反向插入片段(pdk右侧)的引物两端需添加酶切位点xbai和bamhi,引物序列为正向引物p1177xbai-f5’-gctctagagtcaattggaccagactac-3’,反向引物p1177bamhi-r5’-cgggatcccacgccaaacatttctgatac-3’。476bp的usp-3目的片段pcr扩增产物进行2%琼脂糖凝胶电泳检测(图3)。(2)usp目的片段的正向插入,形成pcambia2300-gene-pdk重组载体将kpni酶切的usp目的基因与同样用kpni酶切的中间载体pcambia2300-pdk进行体外连接及转化。将转化出来的单菌落通过摇菌后用引物(正向引物p1177-f:5’-cttctaaatggattgac-3’;反向引物p1177-r:5’-caatcagtaaattgaacggag-3’)进行菌液pcr鉴定,2%琼脂糖凝胶电泳结果如图4所示。将经过菌液pcr鉴定的阳性菌液送去上海生工进行pcr扩增测序,正向引物phan-check-f35s:cactatccttcgcaagac,反向引物phan-check-r:catactaattaacatcac,和质粒抽提,备用。(3)usp目的片段的反向插入,形成pcambia2300-gene-pdk-gene重组载体将用xbai--bamhi酶切的usp目的基因与同样用xbai--bamhi酶切的插入正向序列的pcambia2300-gene-pdk载体进行体外连接,并转化。将转化出来的单菌落通过摇菌后用引物(正向引物为p1177check-f:5’-gtggagtcgtctcgcatg-3’,反向引物phan-seq-r:5’-gtaaggatctgagctac-3’)进行菌液pcr鉴定,检测序列大小约350bp,2%琼脂糖凝胶电泳结果如图5所示。将经过菌液pcr鉴定的阳性菌液送去上海生工进行pcr扩增测序,正向引物p1129check-f:5’-cttctaaatggattgac-3’,反向引物phan-seq-r:5’-gtaaggatctgagctac-3’,和质粒抽提,备用。(4)pcambia2300-gene-pdk-gene重组质粒进行酶切检测将从农杆菌中抽提出的pcambia2300-gene-pdk-gene融合表达载体分别用kpni和xbai--bamhi两组内切酶进行酶切,并将产物进行凝胶电泳检测(图6)。实施例2:pcambia2300-gene-pdk-gene进行84k杨的遗传转化通过含有重组质粒的eha105菌液侵染84k杨叶片,进过共培养、选择培养、继代培养和生根培养获得具有抗性的转基因植株(图7)。选取具有抗性植株的叶片,提取基因组dna。进一步设计特异性引物(正向引物:phan-check-f35s:cactatccttcgcaagac;反向引物phan-check-r:catactaattaacatcac),通过pcr扩增特异性目的基因来鉴定阳性植株。获得大小为635bp的pcr产物,于0.8%琼脂糖凝胶电泳检测(图8)。实施例3:转基因84k杨对舞毒蛾防治的效果(1)转基因84k杨对舞毒蛾靶标基因usp表达的影响选取长势一致、健康的3龄12h舞毒蛾幼虫放于直径为9cm,高为15cm的养虫瓶内,喂食转基因杨树叶片,一个养虫瓶放入5条幼虫,以非转基因杨树叶片为对照,重复30次,分别于12、24、36、48和72h选取活泼的幼虫提取总rna,经dnasei(promega)消化dna,采用primescripttmrt试剂盒(takara)合成cdna,将合成cdna稀释成100μl,用作实时荧光定量rt-pcr模板。实时荧光定量pcr使用试剂盒sybrgreenreal-timepcrmastermixplus(toyobo)。内参基因为actin、ef1α、tub,引物序列见表1。实时荧光定量pcr反应体系为:10μl2×sybrpremixextaq酶、正向和反向引物(10μmol/l)各1μl、2μlcdna模板,加去离子水补足20μl;反应条件为:94℃30s,然后进行44个循环:94℃12s,59℃30s,72℃40s,最后81℃1s读板。每处理重复3次,用2-δδct方法进行基因的表达量分析(图9)。表1实时荧光定量rt-pcr相关引物序列基因正向引物序列(5’-3’)反向引物序列(5’-3’)actinatgttagtatgatcgagcgtatcggcatgatctgaggagcatcttef1αtttgccttccttgcgctcaacatgtaaagcagctgatcgtgggttubaatgcaagaaagccttgcgcctatgaaggaggtcgacgagcaaauspgtcaattggaccagactactacggtgacatcggttgcataa分别提取取食1、2、3号转基因植株叶片12、24、36、48和72h的3龄幼虫提取总rna并利用试刻盒反转录,利用rt-qpcr进行usp基因在各时间点的相对表达量的测定。结果如图9所示(图9中表示野生型,表示t1,表示t2,表示t3;其中t1、t2、t3分别为能够表达uspdsrna的转化84k杨的三种株系),舞毒蛾3龄幼虫取食转基因84k杨树叶片后,通过rt-qpcr检测发现取食12、24、36、48和72h后幼虫体内目标mrna表达水平均有不同程度的降低。取食1号转基因植株叶片在36huspmrna表达水平最低,为对照的89.03%。取食2号转基因植株叶片在24、48、72h时uspmrna表达水平较低,分别为对照的74.77%和65.43%和72.18%。取食3号转基因植株叶片,usp基因表达量在36、48h较低,分别为对照的77.11%和73.96%,而在12、72h其表达量均高于对照组。(2)转基因84k杨对舞毒蛾幼虫生长鲜重测定为了解舞毒蛾幼虫持续取食转基因杨树叶片是否可以加强其干扰效果,通过连续喂食舞毒蛾幼虫转基因84k杨进行了测定。选取长势一致、健康的3龄12h舞毒蛾幼虫测量单头重量后放于直径为9cm,高为15cm的养虫瓶内,喂食f2代转基因杨树叶片,一个养虫瓶放入5条幼虫,以非转基因杨树叶片为对照,重复30次,连续6天称量幼虫体重,观察统计死亡率。结果如图10所示(表示野生型,表示t2,t2为能够表达uspdsrna的转化84k杨的一种株系),3龄幼虫连续取食转基因植株叶片6d幼虫鲜重有所减少,并出现具有死亡现象,在连续喂食6d后,转基因处理组幼虫死亡率为16.67%,对照组幼虫死亡率为3.33%。(3)舞毒蛾幼虫对转基因84k杨的取食变化为了解转基因杨树叶片是否会影响舞毒蛾幼虫的取适量,选取长势一致、健康的3龄12h舞毒蛾幼虫放于直径为9cm,高为1.5cm的平皿中,选取大小较为一致的f2代转基因杨树叶片进行喂食,一个平皿放入1条幼虫,以非转基因杨树叶片为对照,重复30组,观察幼虫对叶片的取食情况。结果如图11和图12所示:3龄幼虫取食转基因植株叶片面积远小于对照组。序列表<110>菏泽学院<120>一种能表达舞毒蛾usp基因dsrna的植物表达载体的构建方法及其应用<160>24<210>1<211>20<212>dna<213>人工序列<220><223>引物p1129f<400>1caatttcacacaggaaacag20<210>2<211>21<212>dna<213>人工序列<220><223>引物p1129r<400>2cagatttaggtgacactatag21<210>3<211>17<212>dna<213>人工序列<220><223>p1129check-f正向引物<400>3cttctaaatggattgac17<210>4<211>21<212>dna<213>人工序列<220><223>p1129check-r反向引物<400>4caatcagtaaattgaacggag21<210>5<211>27<212>dna<213>人工序列<220><223>正向引物p1177kpni-f<400>5ggggtaccgtcaattggaccagactac27<210>6<211>29<212>dna<213>人工序列<220><223>反向引物p1177kpni-r<400>6ggggtacccacgccaaacatttctgatac29<210>7<211>27<212>dna<213>人工序列<220><223>正向引物p1177xbai-f<400>7gctctagagtcaattggaccagactac27<210>8<211>29<212>dna<213>人工序列<220><223>反向引物p1177bamhi-r<400>8cgggatcccacgccaaacatttctgatac29<210>9<211>17<212>dna<213>人工序列<220><223>正向引物p1177-f<400>9cttctaaatggattgac17<210>10<211>21<212>dna<213>人工序列<220><223>反向引物p1177-r<400>10caatcagtaaattgaacggag21<210>11<211>18<212>dna<213>人工序列<220><223>正向引物phan-check-f35s<400>11cactatccttcgcaagac18<210>12<211>18<212>dna<213>人工序列<220><223>反向引物phan-check-r<400>12catactaattaacatcac18<210>13<211>18<212>dna<213>人工序列<220><223>正向引物为p1177check-f<400>13gtggagtcgtctcgcatg18<210>14<211>17<212>dna<213>人工序列<220><223>反向引物phan-seq-r<400>14gtaaggatctgagctac17<210>15<211>18<212>dna<213>人工序列<220><223>正向引物phan-check-f35s<400>15cactatccttcgcaagac18<210>16<211>18<212>dna<213>人工序列<220><223>反向引物phan-check-r<400>16catactaattaacatcac18<210>17<211>24<212>dna<213>人工序列<220><223>actin正向引物<400>17atgttagtatgatcgagcgtatcg24<210>18<211>21<212>dna<213>人工序列<220><223>actin反向引物<400>18gcatgatctgaggagcatctt21<210>19<211>22<212>dna<213>人工序列<220><223>ef1α正向引物<400>19tttgccttccttgcgctcaaca22<210>20<211>22<212>dna<213>人工序列<220><223>ef1α反向引物<400>20tgtaaagcagctgatcgtgggt22<210>21<211>22<212>dna<213>人工序列<220><223>tub正向引物<400>21aatgcaagaaagccttgcgcct22<210>22<211>22<212>dna<213>人工序列<220><223>tub反向引物<400>22atgaaggaggtcgacgagcaaa22<210>23<211>22<212>dna<213>人工序列<220><223>usp正向引物<400>23gtcaattggaccagactactac22<210>24<211>19<212>dna<213>人工序列<220><223>usp反向引物<400>24ggtgacatcggttgcataa19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1