靶向抑制Wnt/β-catenin信号活性的多肽及其用途的制作方法
本发明属于生物
技术领域:
,具体涉及一种多肽及其在制备治疗和预防肿瘤药物中的应用。
背景技术:
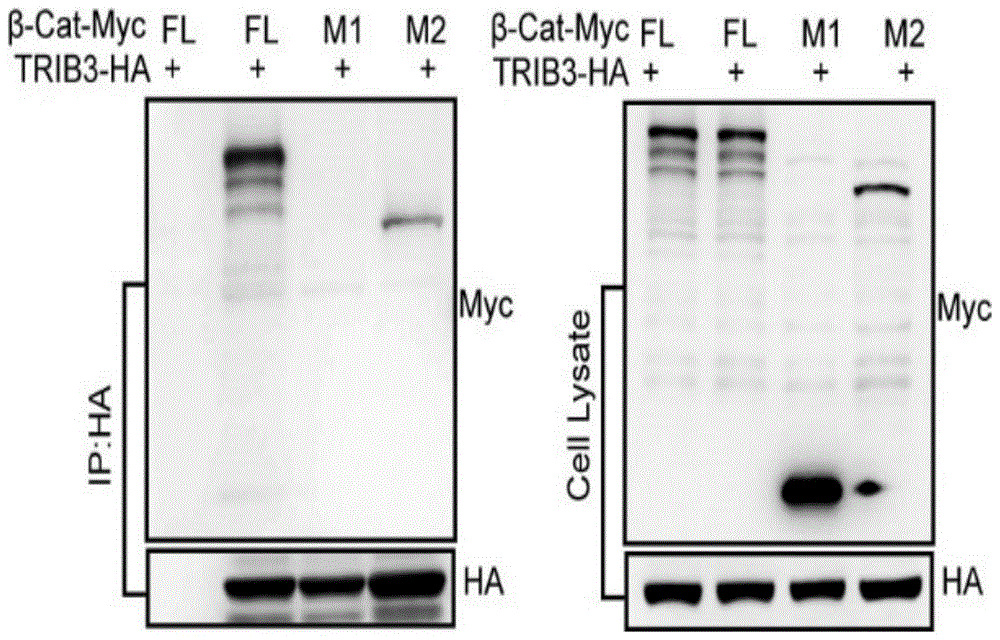
:wnt/β-catenin信号通路于多种肿瘤(结肠癌、肝癌、肺癌、胰腺癌、胶质瘤及乳腺癌)中都存在异常活化,在肿瘤发生、肿瘤增殖、肿瘤转移、肿瘤休眠、肿瘤免疫、肿瘤耐药及维持肿瘤干性等方面都发挥促进作用。β-catenin作为该信号通路的效应分子,通常会被其降解复合物成员axin-2、apc及gsk-3β等磷酸化,进而进入泛素化途径降解。而当wnt信号异常激活时,β-catenin降解复合物成员解体,细胞浆内堆积的β-catenin会转位位进入细胞核内与lef/tcf家族形成转录复合物,共同促进多种致癌因子的转录,从而促进肿瘤的发展进程。目前,针对该通路的靶向抑制剂主要包括小分子药物、抗体类药物、rna干扰药物及天然产物。在为期三十多年的研究中,除少数药物进入临床试验外,多数药物仍处于临床前研究当中,尚未见靶向药物上市。在研药物作用类型主要分为四种:抑制配基wnt-3a与细胞膜表面受体lrp5/6及frizzled的结合;降低β-catenin的蛋白表达水平;抑制β-catenin的细胞核转位;抑制细胞核内β-catenin/tcf转录复合物的活性。由于wnt-3a与受体结合这一过程并不是导致β-catenin升高的唯一因素,如在多种结肠癌中β-catenin本身或者其降解复合物组分apc的突变是诱导该通路异常激活的关键步骤,所以第一类药物普适性不强。第二类药物主要为gsk-3β、axin-2、pka等β-catenin降解复合物成员的激动剂,同样由于β-catenin等上游信号蛋白的突变,使这种类型药物的应用也存在局限性;此外由于β-catenin在生理状态下维持细胞膜及细胞骨架的正常结构,故下调β-catenin的蛋白水平可能存在较大风险。所以对β-catenin的调控重心应该放在抑制β-catenin入核或抑制其在细胞核内转录复合物的活性这两个方面。目前由于入核抑制剂的靶向专一性不强,使这类药物的开发难度大大增加。而一些打断β-catenin及转录辅因子tcf4相互作用的化合物或多肽药物直接作用于该信号通路的下游分子,靶向性强、副作用小,具有良好的抑制肿瘤发生和发展的成药前景。但由于β-catenin与tcf4蛋白相互作用面积过大,小分子药物的介入不能起到较好的打断作用。技术实现要素:本发明所要解决的技术问题是针对wnt/β-catenin信号通路调控机制复杂,药物研发进程缓慢,缺乏抑制β-catenin转录激活活性的有效药物,提供一种通过打断β-catenin/trib3相互作用进而减弱β-catenin/tcf4转录活性的多肽及其在制备治疗和预防肿瘤的药物中的应用。该多肽的氨基酸序列为seqidno.1所示的序列,具体序列如下:arm7:leu-his-tyr-gly-leu-pro-val-val-val-lys-leu-leu-his-pro-pro本发明的氨基酸序列还包括在其他位置出现氨基酸替换,缺失或添加,且能与trib3特异性结合的寡肽序列。本发明的多肽及其衍生物用于靶向治疗与trib3相关的疾病。基于发明人的研究工作,本发明提供下述的技术方案。本发明提供的技术方案之一是:一种能与trib3特异性结合靶向抑制β-catenin转录活性的多肽及其多肽衍生物、其特征在于,所述多肽的氨基酸序列为seqidno.1所示的序列,具体序列为leu-his-tyr-gly-leu-pro-val-val-val-lys-leu-leu-his-pro-pro,或其任何位置进行氨基酸替换、缺失或添加得到的有相同功能的序列;所述的多肽衍生物为所述多肽与细胞穿膜肽(细胞穿膜肽是一类能携带大分子物质进入细胞的短肽,其穿膜能力不依赖经典的胞吞作用)连接所形成的嵌合肽,。本发明提供的技术方案之二是:本发明技术方案之一所述的多肽及其多肽衍生物在制备靶向抑制β-catenin转录活性的药物中的应用,以及所述多肽在制备治疗和/或预防肿瘤的药物中的应用。所述的肿瘤为本领域常规的肿瘤。较佳的是结肠癌、肝癌、肺癌、胰腺癌及乳腺癌。所述肠癌为本领域常规的肠癌,较佳的为结肠癌或直肠癌;所述的肝癌为本领域常规的肝癌,较佳的为原发性肝癌或继发性肝癌;所述的肺癌为本领域常规的肺癌,较佳的为非小细胞肺癌或小细胞肺癌;所述胰腺癌为本领域常规的胰腺癌,较佳的为胰腺导管腺癌、胰腺腺泡细胞癌;所述乳腺癌为本领域常规的乳腺癌,较佳的为非浸润性乳腺癌、早期浸润性乳腺癌、浸润性特殊类型乳腺癌或浸润性非特殊类型乳腺癌。所述预防是本领域常规的预防,较佳的指存在可能的肿瘤因素时,使用后防止或降低肿瘤的产生。所述治疗时本领域常规的治疗,较佳的指减轻肿瘤的程度,或者治愈肿瘤使之正常化,或者减缓肿瘤的进程。本发明提供的技术方案之三是:一种药物组合物,其含有所述的靶向抑制β-catenin转录活性多肽或其多肽衍生物作为活性成分。所述的活性成分是指具有预防或治疗肿瘤功能的化合物。在所述药物组合物中,所述靶向抑制β-catenin转录活性的多肽可以单独作为活性成分或和其他具有抗肿瘤活性的化合物一起作为活性成分。本发明所述的药物组合物的给药途径较佳的为注射给药或口服给药。所述注射给药较佳的包括静脉注射、肌肉注射、腹腔注射、皮内注射或皮下注射等途径。所述的药物组合物为本领域常规的各种剂型,较佳的为固体、半固体或液体的形式,可以为水溶液、非水溶液或混悬液,更佳的为片剂、胶囊、颗粒剂、注射剂或输注剂等。较佳地,本发明所述的药物组合物还包括药学上可接受的载体或赋形剂。所述的载体或赋形剂为本领域常规药用载体或赋形剂,所述的载体或赋形剂可以为任意合适的生理学或药学上可接受的药物辅料。所述的药物辅料为本领域常规的药物辅料,较佳的包括药学上可接受的赋形剂、填充剂或稀释剂等。更佳地,所述的药物组合物包括0.01~99.99%的上述多肽和0.01~99.99%的药用载体或赋形剂,所述百分比为占所述药物组合物的质量百分比。较佳地,所述的药物组合物的施用量为有效量,所述有效量为能够缓解或延迟疾病、退化性或损伤性病症进展的量。所述有效量可以以个体基础来测定,并将部分基于待治疗症状和所寻求结果的考虑。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。有益技术效果:本发明的多肽能够抑制β-catenin转录活性,下调wnt/β-catenin通路活性,从而应用于治疗和预防肿瘤的药物的制备中。所制备的药物在治疗肿瘤疾病中,具有疗效显著,毒副作用少,使用安全的优点。附图说明图1:将β-catenin全长质粒、m1及m2分别与ha-trib3质粒共转染进工具细胞293t中。24小时后收集细胞,免疫共沉淀法结果表明,β-catenin全长及m2截短与trib3有相互作用。图2:将β-cateninm2-gfp、m3-gfp、m4-gfp、m5-gfp及m6-gfp质粒共转染进工具细胞293t中。24小时后收集细胞,免疫共沉淀法结果表明,β-cateninm4截短与trib3有相互作用。图3:将trib3蛋白包被于biacorecm5芯片上,将多肽arm7以及arm8按照倍比稀释的方式配制成10μm-0.3nm16个不同浓度,分别进样进行检测。结果表明arm7与trib有更强的亲和力。其中,a:arm7与trib3结合的亲和力曲线,kd=650±120nm,rmax(ru)=149.4±23;b:arm8与trib3结合的亲和力曲线,kd=4±120mm,rmax(ru)=35±2.1。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。实施例中所述的pbs,指浓度为0.1m,ph值为7.2的磷酸盐缓冲液。实施例中所述的室温为本领域常规的室温,较佳地为15~30℃。实验结果用均值±标准误表示,经参数或者非参数方差检验,经比较p<0.05认为有显著性差异,p<0.01认为有极其显著性差异。实施例1:免疫共沉淀法确认β-catenin中与trib3有相互作用的结构域。免疫共沉淀试剂如下:裂解液a液:0.6057gtris碱,1.7532gnacl,0.1017gmgcl2·6h2o,0.0742gedta,10ml甘油,10ml10%np40,加去离子水至150ml,用hcl调ph值至7.6,定容至191ml,充分混匀,0.45μm滤膜过滤,4℃储存。裂解液b液:200μl2mβ-磷酸甘油,4ml2.5mnaf,2ml8mmnavo3,2ml100mmpmsf,200μl1mdtt,1mg/ml的leu、pep及apr各200μl,总体积共9ml。母液于-20℃储存。使用前,将b液中各成分的母液解冻,分别按上述组成比例加入a液中并混匀。proteina/gplus-agarose购自美国santacruz公司。具体操作步骤如下:首先用分子克隆的方法将β-catenin全长基因进行截短突变,分为m11-140aa及m2141-781aa两段,用pcr的方式扩增并构建到带有ddk/myc标签的pcmv-6载体当中。然后将β-catenin全长质粒、m1及m2分别与ha-trib3质粒共转染进工具细胞293t中。24小时后收集细胞,以免疫共沉淀裂解液裂解细胞,收获细胞总蛋白约4-10mg,将各组蛋白调整至相同浓度。每组蛋白各取200μg,留作细胞裂解液input作为对照。剩余蛋白加入2μgha抗体或者与ha抗体种属相同的normaligg,同时加入10μlproteina/gplus-agarose充分重悬,4℃缓慢旋转摇动过夜。4℃、3000rpm离心5min,小心吸除上清,宁可留下少量上清也不能吸到agarose。加入0.5ml免疫共沉淀洗液,混匀,冰浴静置1min,4℃、3000rpm离心30sec,小心吸除上清。重复洗涤5次,最后一次离心前静置5min。小心吸除上清,加入20-30μl2×sds凝胶加样缓冲液,混匀,95℃变性3min,迅速转移至冰浴冷却。12000rpm室温离心2min,上清即为沉淀的蛋白样品,取部分或全部进行sds-聚丙烯酰胺凝胶电泳。western结果显示,m2结构域与trib3有相互作用(图1)。为了进一步缩小结构域范围,我们将m2结构域进行截短突变,分为m2141-781aa、m3141-390aa、m4391-519aa、m5520-665aa及m6666-781aa,用pcr的方式进行扩增,并构建到带有gfp标签的pegfp-c1载体当中。然后将m2、m3、m4、m5及m6分别与ha-trib3质粒共转染进工具细胞293t中。24小时后收集细胞,用上述方法进行处理。最终western结果显示m4与trib3有相互作用(图2)。实施例2:用表面等离子共振的方法筛选与trib3蛋白结合的肽段。用i-tasser网站分析与trib3存在相互作用的结构域m4结构域,发现其包含有8条α螺旋肽,用多肽固相合成仪进行肽段合成,此过程由北京赛百盛基因有限公司进行。实施例整个筛选过程在表面等离子共振仪biacoret200中进行。筛选方法如下:1.将纯化的蛋白trib3(购自北京义翘神州公司)通过氨基偶联到cm5芯片上(购自ge公司),10μl/min的流速洗去未结合的蛋白,并且平衡芯片表面2小时。将不同浓度的200μl多肽片段(200,100,50,25,12.5nm)自动进样,整个过程在25℃进行。所使用的缓冲液为hbs-ep缓冲液(0.01mhepes,0.15mnacl,3mmedta,0.005%表面活性剂)。用biacoret200上机进行surfacetest测定,发现arm1-arm-6均与trib3蛋白无结合,进一步具体分析arm7及arm8的亲和力,用自带分析软件模拟不同浓度多肽与trib3的结合曲线,得出一条与trib3结合能力较强的多肽(图3):arm7:leu-his-tyr-gly-leu-pro-val-val-val-lys-leu-leu-his-pro-pro。kd=650±120nm,rmax(ru)=149.4±23。实施例3elisa方法验证肽段arm7与蛋白trib3的结合。具体操作步骤如下:1.将人trib3蛋白及牛血清白蛋白(bsa)用pbs稀释至10μg/ml,每孔添加100μl,4℃包被96孔elisa板过夜。2.用含有0.1%tween-20pbs洗三次。用200μl封闭液(10%牛血清pbs)包板,37℃包被2h。3.倒掉包被液,对应加入1μg/ml多肽arm7溶液200μl,同时设置阳性对照孔,加入200μl1μg/mlβ-catenin蛋白溶液,37℃孵育1h。4.用含有0.1%tween-20pbs洗五次。每孔加入100μl用封闭液1:4000稀释后的抗trib3单克隆抗体,室温孵育1h。5.用含有0.1%tween-20pbs洗六次。配制底物显色液(100mmol/l乙酸钠ph6.0,每50ml缓冲液加入10μl30%过氧化氢,100μg/mltmb),每孔加入100μl,室温孵育5min。每孔加入50μl0.1m稀硫酸,终止反应。6.结果以样品孔的od450反应,见表1。结果表明arm7肽段与trib3蛋白有较高的亲和力。表1多肽与trib3的亲和力arm7(elisa数值)β-catenin(elisa数值)2.433.142.623.162.343.06实施例4竞争elisa的方法验证肽段arm7可以竞争trib3与β-catenin蛋白的结合。具体操作步骤如下:1.将人trib3蛋白及牛血清白蛋白(bsa)用pbs稀释至10μl/ml,每孔添加100μl,4℃包被96孔elisa板过夜。2.用含有0.1%tween-20pbs洗三次。用200μl封闭液(10%牛血清pbs)包板,37℃包被2h。3.倒掉包被液,对应加入1μg/mlβ-catenin蛋白溶液200μl,37℃孵育1h。4.用含有0.1%tween-20pbs洗五次。每孔加入100μl封闭液作为对照及100μl用封闭液稀释的辣根过氧化氢酶标记的多肽arm7,室温孵育1h。5.用含有0.1%tween-20pbs洗六次。配制底物显色液(100mmol/l乙酸钠,ph6.0,每50ml缓冲液加入10μl30%过氧化氢,100μg/mltmb),每孔加入100μl,室温孵育5min。每孔加入50μl0.1m稀硫酸,终止反应。6.结果以样品孔的od450反应,见表2。结果表明arm7可以竞争trib3与β-catenin蛋白的结合。表2多肽竞争trib3与β-catenin蛋白的结合arm7(elisa数值)bsa(elisa数值)p值2.670.10<0.00012.590.152.530.16实施例5双荧光素酶报告基因实验验证多肽pep2-arm7抑制β-catenin的转录激活活性。将肽段arm7连接上细胞穿膜肽pep2(序列为hlyvspw),组成新的衍生物pep2-arm7,此肽段由赛百盛基因技术有限公司进行合成,纯度>98%。具体步骤如下:1.向12孔板中汇合度为60%的hct-8结肠癌细胞、hepg-2肝癌细胞、a549肺癌细胞、sw1990胰腺癌细胞及mda-mb-231乳腺癌细胞中共转染反应β-catenin/tcf4转录活性的质粒topflash及阴性对照质粒prl-tk,或其突变质粒fopflash及阴性对照质粒作为整个实验的阴性对照实验。2.转染12小时后,向细胞中加入10μmpep2-arm7或对照肽。3.12小时后,向每孔加入各250μl裂解液,15min后收集上清10μl加入至白色96孔板中,加入50μl荧光素酶底物,进行波长测定,再加入50μlstopbuffer,再次进行波长测定。4.第一次与第二次数值比值即为荧光素酶活性,结果见表3-7。结果表明pep2-arm7可以在hct-8结肠癌细胞、hepg-2肝癌细胞、a549肺癌细胞、sw1990胰腺癌细胞及mda-mb-231乳腺癌细胞中降低β-catenin/tcf4的转录活性。表3多肽在hct-8细胞中抑制β-catenin/tcf4的转录活性对照肽pep2-arm7p值topflash2554±2341232±560.0003fopflash103±3105±2表4多肽在a549细胞中抑制β-catenin/tcf4的转录活性对照肽pep2-arm7p值topflash2743±1451352±360.0002fopflash93±578±2表5多肽在hepg2细胞中抑制β-catenin/tcf4的转录活性对照肽pep2-arm7p值topflash2954±1561426±140.0001fopflash107±389±2表6多肽在sw1990细胞中抑制β-catenin/tcf4的转录活性对照肽pep2-arm7p值topflash2683±1271325±100.0002fopflash101±383±1表7多肽在mda-mb-231细胞中抑制β-catenin/tcf4的转录活性对照肽pep2-arm7p值topflash2784±241232±250.0003fopflash129±383±3实施例6细胞计数实验验证多肽pep2-arm7抑制肿瘤细胞的生长具体操作步骤如下:1.收集对数生长期的hct-8结肠癌细胞、hepg-2肝癌细胞、a549肺癌细胞、sw1990胰腺癌细胞及mda-mb-231乳腺癌细胞调整细胞浓度,制成浓度为15万个/ml的细胞悬液。2.将1ml步骤1所制得的细胞悬液加入12孔板进行培养(其中hepg2、hct-8和mda-mb-231细胞所用培养基为dmem培养基,a549、sw1990细胞所用培养基为rpmi1640培养基,均购自invitrogen公司;培养温度为37℃,培养基体积为1ml),12小时后换成新的培养基,并且分别加入1μg/ml对照肽及pep2-arm7。每隔一天进行传代一次,并进行计数。实验结果见表8。结果说明多肽pep2-arm7能够抑制肿瘤细胞的生长。表8多肽抑制肿瘤细胞的生长实施例7:细胞划痕实验验证多肽抑制肿瘤细胞划痕后的愈合具体操作步骤如下:1.先用记号笔在6孔板背后,用直尺比着划横线,横穿过孔。2.在每个孔中分别加入5×105个肿瘤细胞,37℃孵育箱培养过夜后细胞贴壁。该肿瘤细胞为对数生长期的结肠癌细胞hct-8、肝癌细胞hepg2、肺癌细胞a549、胰腺癌细胞sw1990和乳腺癌细胞mda-mb-231。3.第二天用枪头比着直尺,尽量垂直于背后的横线进行划痕,枪头要垂直。4.用pbs洗细胞3次,去除划下的细胞,加入新的培养基,同时各加入1μg/ml对照肽及pep2-arm7。5.然后放入37℃、5%(v/v)co2培养箱培养,24小时后取样拍照。实验结果见表9。表9的结果说明,损伤修复面积比越大说明肿瘤细胞的迁移能力越强,细胞划痕后愈合能力越强。因此多肽pep2-arm7可以降低肿瘤细胞划痕后的愈合能力。表9多肽抑制肿瘤细胞的迁移实施例8:transwell实验验证多肽pep2-arm7可以抑制肿瘤细胞的侵袭能力。具体操作步骤如下:1.从-20℃冰箱取出100x纤维粘连蛋白储液,融化后配成1x工作液,取出30μl迅速涂布在8μm孔径transwell小室外侧,使其铺满孔的底部。2.从-20℃冰箱取出matrigel,融化后稀释8倍取40μl迅速加入8μm孔径transwell小室内侧,使其快速铺满孔的底部。将凝固后的小室放入24孔板的小孔中,下室加入800μl完全培养基。3.收集对数生长期的hct-8、肝癌细胞hepg2、肺癌细胞a549、胰腺癌细胞sw1990和乳腺癌细胞mda-mb-231。然后调整细胞浓度,制成1000万细胞/ml的细胞悬液。4.小室内加入100μl细胞悬液,同时加入1μg/ml对照肽及pep2-arm7。5.然后移培养板于co2培养箱中37℃进行培养。6.培养12-24h后,对细胞集落进行结晶紫染色,用显微镜拍照。结果见表10。结果显示多肽pep2-arm7可以明显抑制肿瘤细胞的侵袭能力。表10多肽抑制肿瘤细胞的侵袭实施例9肿瘤皮下生长实验验证多肽抑制肿瘤细胞在小鼠体内的生长操作步骤如下:1.实验耗材及试剂:灭菌ep管1.5ml,15ml离心管,枪头,滤网(100目),脱脂棉球,镊子数把,酒精棉球,无菌1ml注射器,500ml烧杯(灭菌,用前照紫外),pbs(过滤),胰酶,血清。2.实验动物及分组:4-6周龄雄性裸鼠20只(购自北京维通利华实验动物有限公司),随机分为2组:pep2-arm7组及多肽对照组,每组10只。3.细胞制备:将贴壁培养的荧光素酶标记的细胞用胰酶消化,到达胰酶消化时间后(此时细胞状态应为单细胞且刚好贴壁不掉),吸掉胰酶。用含有1%血清的pbs按2ml/皿终止,将细胞吹下,移至10ml离心管中,1000g离心5min。弃上清,pbs重悬,过100目滤网一次;细胞计数,按照细胞:matrigel=6:4比例与matrigel混匀,调整细胞终浓度至5x105/ml。该肿瘤细胞为对数生长期的肺癌细胞a549、结肠癌细胞hct-8、胰腺癌细胞sw1990、乳腺癌细mda-mb-231和肝癌细胞hepg2。4.肿瘤细胞接种:100μl细胞悬液接种于裸鼠右上腹部近腋下皮下。5.肿瘤生长观察:皮下注射肿瘤细胞后一周用多肽进行治疗(4mg/kg体重,每周两次),游标卡尺纪录肿瘤大小。肿瘤体积=(长×宽×宽)/2;实验结果以mean±sem表示,并采用ttest检验多肽组与对照肽组间的差异。接种肿瘤后4周,各组小鼠皮下肿瘤体积如表11-表15所示,肿瘤体积越大表明肿瘤生长越快,因此多肽pep2-arm7能抑制肿瘤细胞在小鼠体内生长。表11.多肽抑制结肠癌细胞hct-8在小鼠体内生长多肽名称肿瘤体积(mm3)p值对照2013.4±145.3pep-arm71005.4±135.6<0.0001表12.多肽抑制肺癌细胞a549在小鼠体内生长多肽名称肿瘤体积(mm3)p值对照2415.4±123.5pep-arm71023.2±126.3<0.0001表13.多肽抑制肝癌细胞hepg2在小鼠体内生长多肽名称肿瘤体积(mm3)p值对照2247.2±142.6pep-arm71102.5±123.2<0.0001表14.多肽抑制胰腺癌细胞sw1990在小鼠体内生长多肽名称肿瘤体积(mm3)p值对照3214.2±127.5pep-arm71642.2±145.2<0.0001表15.多肽抑制乳腺癌细胞mda-mb-231在小鼠体内生长多肽名称肿瘤体积(mm3)p值对照2733.2±110.3pep-arm71345.3±123.2<0.0001在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。序列表<110>中国医学科学院药物研究所<120>靶向抑制wnt/β-catenin信号活性的多肽及其用途<130>p18011b<150>2018101131959<151>2018-02-05<160>1<170>siposequencelisting1.0<210>1<211>16<212>prt<213>人(human)<400>1leuhistyrglyleuprovalvalvallysleuleuleuhispropro151015当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1