一种具有ACE抑制活性的银杏果蛋白肽及其制备方法与流程
本发明涉及一种具有ace抑制活性的银杏果蛋白肽的制备方法,属于农产品精深加工技术领域。
背景技术:
据世界卫生组织估计,每年有1750万人死于心血管疾病,而高血压是心血管疾病防治的重点。目前使用的降血压药物如卡托普利和依那普利由于咳嗽、皮疹和头痛等不良反应而受到限制。然而,心血管疾病的发病率不断增加,需要一些新的、安全的替代品,如食品衍生活性肽。生物活性肽是构成天然氨基酸的一系列序列不同多肽的总称。它们具有多种生物功能,如抗氧化、免疫促进、激素调节、抗菌、抗血栓、抗病毒、抗高血压等。而降血压肽,又称血管紧张素转换酶抑制肽,是从食物蛋白中分离出的一类具有显著降血压功效的多肽短链物质。多肽的体外降压活性主要是通过测定血管紧张素转化酶(ace)的抑制活性来确定的。血管紧张素转化酶(ace)是一种位于细胞膜上的二肽基羧肽酶,是调节血压的关键分子。降血压肽由于具有较高的食品安全性和生物利用度,是开发功能性肽类药物和功能性食品添加剂的潜在选择。
技术实现要素:
本发明的目的在于提供一种具有ace抑制活性的银杏果蛋白肽的制备方法。
为实现上述目的及其他相关目的,本发明提供的技术方案是:一种具有ace抑制活性的银杏果蛋白肽,由以下氨基酸残基组成:精氨酸-缬氨酸-苯丙氨酸-天冬氨酸-甘氨酸-丙氨酸-缬氨酸(rvfdgav)。
为实现上述目的及其他相关目的,本发明提供的技术方案是:一种具有ace抑制活性的银杏果蛋白肽的制备方法,包括下列步骤:
步骤1;对银杏果粉进行浸泡脱脂,得到脱脂银杏果粉;
步骤2:采用碱溶酸沉法提取脱脂银杏果粉中的蛋白质,得到的提取液透析后冻干,得到银杏蛋白;
步骤3:将蛋白配置成水溶液,加入碱性蛋白酶进行酶解,酶解结束后灭酶,然后离心取上清液,得到银杏蛋白酶解液;
步骤4:对银杏蛋白酶解液进行超滤处理,收集超滤透过液并冻干,得到银杏蛋白水解物;
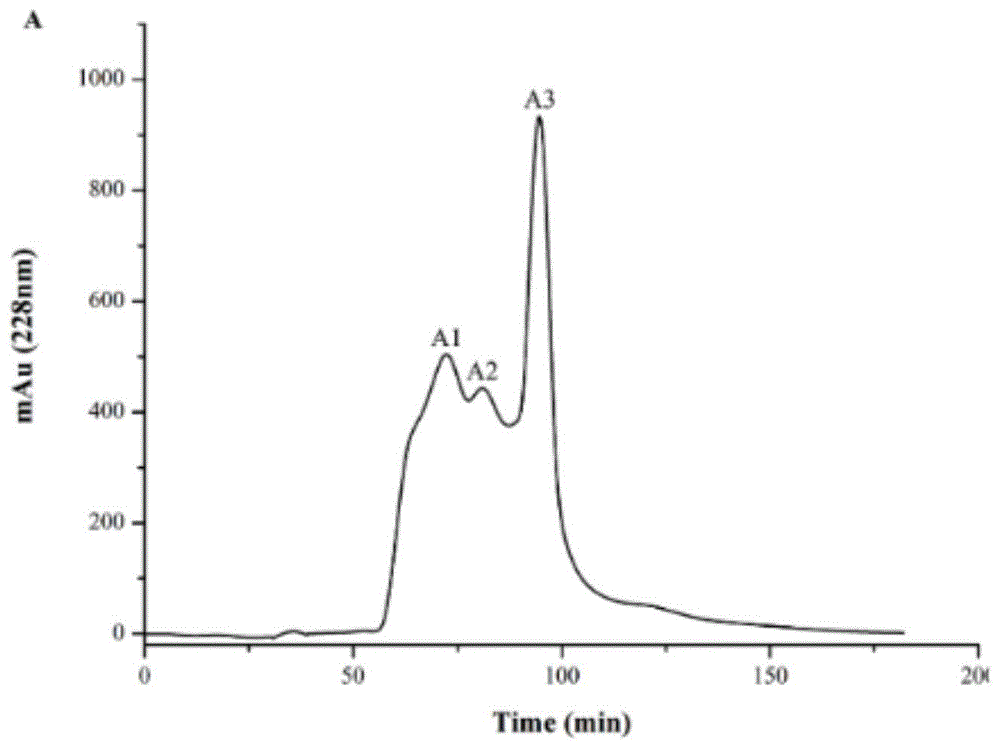
步骤5:将银杏蛋白水解物配制成银杏蛋白水解物水溶液,以葡聚糖凝胶为层析介质对银杏蛋白水解物溶液进行层析,收集保留时间为87.36-102.23min的样品;
步骤6:将步骤5得到的样品先脱盐,然后进行冻干,再重新溶解于三氟乙酸水溶液中,然后采用c18反相色谱柱,流动相a为体积分数为0.1%甲酸水溶液,流动相b为含质量分数为0.1%甲酸的乙腈水溶液,其中乙腈的体积分数为84%;色谱柱以a溶液平衡后,样品由自动进样器上样,检测波长228nm;收集出峰时间25.46min的洗脱液,获得具有具有ace抑制活性的银杏果蛋白肽溶液;质谱分析结果表明,该银杏蛋白肽的氨基酸序列为:苏氨酸-天冬酰胺-亮氨酸-天冬氨酸-色氨酸-酪氨酸。
优选的技术方案为:步骤1中,将银杏果粉浸泡于乙酸乙酯中进行脱脂,脱脂结束后抽滤除去溶剂,干燥后得到脱脂银杏果粉;所述银杏果粉的粒径小于或等于40-80目。
优选的技术方案为:步骤2中,脱脂银杏果粉溶于蒸馏水中,并调ph值至10,搅拌过夜,离心后取上清液,然后调上清液的ph值至4.62,再次离心,弃上清液取沉淀,沉淀物在蒸馏水中透析后冻干,得到脱脂银杏蛋白。
优选的技术方案为:步骤3中,将脱脂银杏蛋白配置成蛋白水溶液,调ph值至10,然后加入碱性蛋白酶,48-52℃保温3.5-4.5h。
优选的技术方案为:步骤4中,采用截留分子量为3000da的超滤膜对银杏蛋白酶解液进行超滤处理。
优选的技术方案为:步骤5中,使用g-15葡聚糖凝胶柱对对银杏蛋白水解物溶液进行层析,收集保留时间为87.36-102.23min的样品,超纯水为洗脱液,流速为1ml/min,上样浓度为80mg/ml。
由于上述技术方案运用,本发明与现有技术相比具有的优点是:
本发明制备的银杏蛋白肽,其血管紧张素转化酶(ace)抑制活性高,氨基酸序列中不存在半胱氨酸残基,不需要添加保护活性肽的添加剂,制备工艺简单,成本低,产品质量高,适合工业化生产。
附图说明
图1为银杏果蛋白酶解物经葡聚糖凝胶层析图。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
请参阅图1。须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
样品ace抑制活性检测方法:
将底物马尿酰-组氨酸-亮氨酸(hhl,5mm)和样品溶于0.1m硼酸盐缓冲液(ph8.3,含有0.3mnacl)中。然后,取50μl的样品和150μl的底物加入到离心管中,混合后在37℃的水中预热5min。之后加入0.1u的ace溶液,37℃孵育60min。反应结束时加入1m盐酸250μl终止反应,溶液经0.45μm滤膜过滤后,在intsilods-3(25×4.6mm,5μm粒径)上进行反相高效液相色谱分析。流动相为蒸馏水:乙腈=75:25(v/v,0.1%三氟乙酸),流速0.5ml/min,检测波长为228nm。以卡托普利为阳性对照,蒸馏水为空白对照,测定其抑制活性(%)如下:
ace抑制活性(%)=[(a-b)/a]×100;
a是空白对照时马尿酸的峰面积,b为含样品时马尿酸的峰面积。
实施例1:一种具有ace抑制活性的银杏果蛋白肽的制备方法
(1)原料预处理:将500g新鲜银杏果进行脱壳,脱种皮处理,切碎,置于45℃恒温干燥箱中干燥24h,粉碎处理后过60目筛。
(2)脱脂:取220g银杏果粉,加入400ml乙酸乙酯进行浸泡,每10min搅拌一次,浸泡2h,抽滤除去溶剂,干燥,得到脱脂银杏粉;
(3)银杏蛋白提取:取200g脱脂银杏粉溶于蒸馏水中,料液比1:15,ph调为10.0,搅拌过夜,8000g离心20min,取上清,再调ph至4.62,8000g离心20min,弃上清取沉淀,沉淀物以蒸馏水为透析液,透析后冻干,得银杏蛋白。
(4)酶解:配制200ml质量分数为3%的银杏蛋白水溶液,置于50℃水浴溶解,ph调为10.0,等待5min,加入碱性蛋白酶(酶活4000u),酶解4h,期间加入naoh溶液,保持溶液ph为10.0不变,酶解结束后,煮沸5min灭酶,降温后ph调回中性,并离心。
(5)超滤:取150ml酶解液进行超滤,截留量为3kda,将超滤组分不断收集,冷冻干燥。
(6)凝胶层析:将步骤(5)的产物配制成水溶液,使用g-15葡聚糖凝胶柱对超滤物进行进一步纯化,超纯水为洗脱液,流速为1ml/min,上样量为350mg,上样体积为4ml,上样浓度为80mg/ml,收集保留时间87.36-102.23min的层析液。
(7)将样品先过deae纤维素柱层析脱盐,然后冻干,重新溶解于体积分数为0.1%的三氟乙酸溶液中。然后采用c18反相色谱柱,流动相a为0.1%甲酸水溶液,流动相b为含0.1%甲酸的乙腈水溶液(乙腈为84%)。色谱柱以95%的a溶液平衡后,样品由自动进样器上样,检测波长228nm,流速1ml/min。收集出峰时间25.46min的洗脱液,得到降血压(具有ace抑制活性的)银杏果蛋白肽溶液。a溶液即“流动相a”-0.1%甲酸水溶液,取0.1ml甲酸与99.9ml蒸馏水混合;流动相b-0.1%甲酸的乙腈水溶液,其中乙腈的体积分数为84%。先将乙腈与水按照84:16的体积比混合配制成乙腈水溶液,再取0.1ml甲酸与99.9ml乙腈水溶液混合。
(8)测定洗脱液的ace抑制活性,并液质联用检测蛋白肽的氨基酸序列。
ace抑制活性检测结果为69.86%(1mg/ml),液质联用检测分析25.46min峰物质的组成序列为:精氨酸-缬氨酸-苯丙氨酸-天冬氨酸-甘氨酸-丙氨酸-缬氨酸(rvfdgav)。
实施例2:一种具有ace抑制活性的银杏果蛋白肽的制备方法
(1)原料预处理:将700g新鲜银杏果进行脱壳,脱种皮处理,置于恒温干燥箱中进行干燥30h,粉碎处理后过80目筛。
(2)脱脂:取350g银杏果粉,加入100ml乙酸乙酯进行浸泡,每10min搅拌一次,浸泡2h,抽滤除去溶剂,干燥,得到脱脂银杏粉;
(3)提蛋白:取300g脱脂银杏粉溶于蒸馏水中,料液比1:18,ph调为10,置于磁力搅拌器上搅拌6h,离心,取上清,再进行酸沉,离心,冷冻干燥得到银杏蛋白。
(4)酶解:配制250ml3%蛋白溶液置于45℃中溶解,ph调为10.0,加入碱性蛋白酶3500u,酶解5h,期间,加入naoh溶液,保持溶液ph为10.0不变,酶解结束后,煮沸10min灭酶,降温后ph调回7,并离心,冷冻干燥。
(5)超滤:取200ml酶解液进行超滤,截留量为3kda,将超滤组分不断收集,冷冻干燥。
(6)凝胶层析:上样量为800mg,上样体积为10ml,收集保留时间87.36-102.23min的层析液。
(7)将样品脱盐和冻干后,重新溶解于0.1%三氟乙酸溶液中。采用c18反相色谱柱,流动相a为0.1%甲酸水溶液,流动相b为含0.1%甲酸的乙腈水溶液(乙腈为84%)。色谱柱以95%的a溶液平衡后,样品由自动进样器上样,检测波长228nm,流速1ml/min。收集出峰时间25.46min的洗脱液;
(8)测定洗脱液的ace抑制活性,并液质联用检测蛋白肽的氨基酸序列。
ace抑制活性检测结果为67.92%(1mg/ml),液质联用检测分析25.46min峰物质的组成序列为:精氨酸-缬氨酸-苯丙氨酸-天冬氨酸-甘氨酸-丙氨酸-缬氨酸(rvfdgav)。
实施例3:一种具有ace抑制活性的银杏果蛋白肽的制备方法
一种具有ace抑制活性的银杏果蛋白肽,由以下氨基酸残基组成:精氨酸-缬氨酸-苯丙氨酸-天冬氨酸-甘氨酸-丙氨酸-缬氨酸(rvfdgav)。
制备方法包括下列步骤:
步骤1;对银杏果粉进行浸泡脱脂,得到脱脂银杏果粉;
步骤2:采用碱溶酸沉法提取脱脂银杏果粉中的蛋白质,得到的提取液透析后冻干,得到银杏蛋白;
步骤3:将蛋白配置成水溶液,加入碱性蛋白酶进行酶解,酶解结束后灭酶,然后离心取上清液,得到银杏蛋白酶解液;
步骤4:对银杏蛋白酶解液进行超滤处理,收集超滤透过液并冻干,得到银杏蛋白水解物;
步骤5:以葡聚糖凝胶为层析介质对银杏蛋白水解物水溶液(80mg/ml)进行层析,收集保留时间为87.36-102.23min的样品;
步骤6:将步骤5得到的样品先过deae纤维素柱层析脱盐,然后进行冻干,再重新溶解于体积分数0.1%三氟乙酸水溶液中,然后采用c18反相色谱柱,流动相a为质量分数为0.1%甲酸水溶液,流动相b为含质量分数为0.1%甲酸的乙腈水溶液,其中乙腈的体积分数为84%;色谱柱以a溶液平衡后,样品由自动进样器上样;收集出峰时间25.46min的洗脱液,获得具有ace抑制活性的银杏果蛋白肽溶液。a溶液即“流动相a”-0.1%甲酸水溶液,取0.1ml甲酸与99.9ml蒸馏水混合;流动相b-0.1%甲酸的乙腈水溶液,其中乙腈的体积分数为84%。先将乙腈与水按照84:16的体积比混合配制成乙腈水溶液,再取0.1ml甲酸与99.9ml乙腈水溶液混合。
优选的实施方式为:步骤1中,将银杏果粉浸泡于乙酸乙酯中进行脱脂,脱脂结束后抽滤除去溶剂,干燥后得到得到脱脂银杏果粉;所述银杏果粉的粒径小于或等于40目。
优选的实施方式为:步骤2中,脱脂银杏果粉溶于蒸馏水中,并调ph值至10.0,搅拌过夜,离心后取上清液,然后调上清液的ph值至4.62,再次离心,弃上清液取沉淀,沉淀物在蒸馏水中透析后冻干,得到脱脂银杏蛋白。
优选的实施方式为:步骤3中,将脱脂银杏蛋白配置成蛋白水溶液,调ph值至10,然后加入碱性蛋白酶,48℃保温3.5h。
步骤4中,采用截留分子量为3000da的超滤膜对银杏蛋白酶解液进行超滤处理。
优选的实施方式为:步骤5中,使用g-15葡聚糖凝胶柱对银杏蛋白水解物进行进一步纯化,超纯水为洗脱液,流速为1ml/min,上样浓度为80mg/ml。
实施例4:一种具有ace抑制活性的银杏果蛋白肽的制备方法
(1)预处理:将新鲜银杏仁脱壳、去皮之后,切碎,置于45℃烘箱烘干,再进行粉碎,过50目筛;
(2)脱脂:采用乙酸乙酯进行浸泡,每10min搅拌一次,浸泡2h,抽滤除去溶剂,干燥,得到脱脂银杏粉;
(3)银杏蛋白提取:脱脂银杏粉溶于蒸馏水中,并调ph为10.0,搅拌过夜,离心,取上清,ph调成4.62,再次离心,弃上清取沉淀,沉淀物透析后冻干,得银杏蛋白;
(4)酶解:将银杏蛋白配置成3%的蛋白溶液,调节ph为10.0,加入碱性蛋白酶并调节酶活至4000u,50℃保温4h;
(5)超滤:采用截留分子量为3000da的超滤膜进行超滤,收集超滤透过液并冻干;
(6)凝胶层析:使用g-15葡聚糖凝胶柱对超滤物进行进一步纯化,超纯水为洗脱液,流速为1ml/min,上样浓度为80mg/ml,收集保留时间87.36-102.23min的层析液;
(7)液相色谱分离功能肽:将样品脱盐和冻干后,重新溶解于0.1%三氟乙酸溶液中。采用c18反相色谱柱,流动相a为0.1%甲酸水溶液,流动相b为含0.1%甲酸的乙腈水溶液(乙腈为84%)。色谱柱以95%的a溶液平衡后,样品由自动进样器上样,检测波长228nm,流速1ml/min。收集出峰时间25.46min的洗脱液,获得具有ace抑制活性的银杏果蛋白肽溶液;
(8)质谱分析结果表明,该银杏蛋白肽的氨基酸序列为:精氨酸-缬氨酸-苯丙氨酸-天冬氨酸-甘氨酸-丙氨酸-缬氨酸(rvfdgav)。
以上所述者仅为用以解释本发明之较佳实施例,并非企图具以对本发明做任何形式上之限制,是以,凡有在相同之发明精神下所作有关本发明之任何修饰或变更,皆仍应包括在本发明意图保护之范畴。
- 还没有人留言评论。精彩留言会获得点赞!