用于循环肿瘤细胞分选的微流控芯片的制作方法
本实用新型涉及一种微流控芯片,具体地说是一种用于循环肿瘤细胞筛选的微流控芯片。
背景技术:
相关研究已经证实:癌症患者行肿瘤根治术后,血中的循环肿瘤细胞在癌症复发及转移当中起重要作用,因此研究循环肿瘤细胞有助于彻底阻断癌症的转移与复发途径,具有重要临床价值及意义。但由于循环肿瘤细胞稀少、生物稳定性差等原因,如何高效提取循环肿瘤成为热点问题。目前,循环肿瘤细胞提取主要分为阳性富集法及阴性富集法。阳性富集法即通过不同手段识别循环肿瘤细胞表面特异性抗原(通常为EpCAM),从而达到提取细胞的目的。但是,循环肿瘤细胞表面抗原并非持续表达,当其发生上皮间质样变时常会丢失EpCAM,从而导致阳性富集法失败。阴性富集法则通过排除无关细胞而达到富集循环肿瘤细胞的目的,而现有的阴性富集法,主要为物理过筛法或密度梯度离心配合传统免疫磁珠法,其目的细胞丢失严重,效率低下。
随着微流控技术对细胞生物学影响的不断加深,以及其在集成样品预处理和血液成分分析中的优势,使其可以更温和、快速、一致地操控和分选活细胞,有利于更准确高效地提取血液等体液样品中的信息,非常适用于血细胞、癌细胞等体细胞的检测。近年来,国内外学者在肿瘤细胞的微流控分选领域中取得了一系列的成就,微流控芯片技术正逐步成为细胞分选的主要工具,应用微流控芯片有望实现高效率、高纯度的循环肿瘤细胞检测。
微流控芯片的结构直接影响到循环肿瘤细胞的筛选效率,并且目前在利用微流控芯片筛选肿瘤细胞的过程中,由于芯片结构等设计极易造成肿瘤细胞被破坏,使得富集效果变差,无法进行下一步培养及药敏试验,使研究受限。例如,目前广泛使用的一种正性富集鱼骨形微流控芯片,采用抗原抗体结合法捕获循环肿瘤细胞,细胞与芯片结合后,需破坏芯片后将细胞分离,且由于细胞与抗体不可逆结合,在收集单个细胞时,无法避免将细胞撕裂,从而破坏细胞活性,失去下游试验可能。
如何解决上述现有技术中的问题,仍然是本领域技术人员研究的热点。
技术实现要素:
本实用新型所要解决的技术问题在于提供一种可高效快速富集筛选循环肿瘤细胞,并且可以保持富集的肿瘤细胞不被破坏、保持最大活性的微流控芯片。
为了实现上述目的,本实用新型采用如下技术方案:
一种用于循环肿瘤细胞分选的微流控芯片,包括进样部、至少一个微柱阵列区和出样部;所述微柱阵列区一端与进样部连通,另一端与出样部连通;所述进样部包括血液样本进样口;所述出样部包括目的细胞收集口和废液收集口;其中,所述微柱阵列区包括至少一个由若干微柱构成的微柱矩阵和目的细胞收集通道,所述目的细胞收集通道沿血流方向设置位于所述微柱矩阵的一侧并与所述目的细胞收集口连通;所述微柱矩阵按照与血流方向呈1.5~2.5度夹角向目的细胞收集通道一侧倾斜设置;所述微柱的横截面为卵形,所述卵形的直径为28~33μm,所述卵形的对称直径为20~25μm;所述血流方向相邻两微柱的卵心距为40~45μm,所述垂直于血流方向的相邻两微柱的卵心距为60~65μm。
其中较优地,所述微柱阵列区的数量是两个。
其中较优地,所述微柱阵列区的两端设有栅状结构区,所述微柱矩阵设置在两栅状结构区之间。
其中较优地,所述进样部还包括缓冲液进液口。
其中较优地,所述血液样本进样口通过血液样本进样管与所述微柱阵列区端部连通;所述缓冲液进液口通过缓冲液进液管同时与所述血液样本进样管和所述微柱阵列区连通。
其中较优地,所述血液样本进样管为弧型管。
其中较优地,所述血液样品进样管内设有栅状结构。
其中较优地,所述缓冲液进液管内设有栅状结构。
其中较优地,所述目的细胞收集口通过目的细胞收集管与微柱阵列区端部连通;所述废液收集口通过废液收集管与所述微柱阵列区端部连通。
其中较优地,所述目的细胞收集管为弧型管。
本微流控芯片的结构设计可以使细胞分选过程通过物理方法实现,细胞流经芯片只与微柱发生弹性碰撞后不同大小的细胞通过预设路径流向各自的收集口,直接收集的细胞无其余操作损伤,通过免疫荧光染色可见通过本实用新型得到的白细胞及循环肿瘤细胞结构完整、活性高,便于进行下一步研究。
附图说明
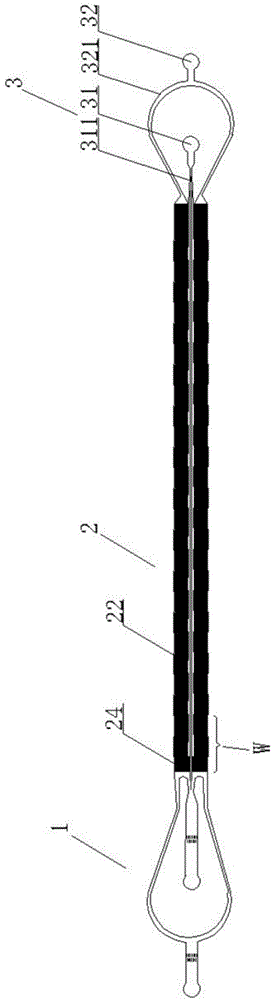
图1为本实用新型的整体结构示意图;
图2为本实用新型的进样部结构示意图;
图3为图1中W区放大图即微柱矩阵结构示意图;
图4为本实用新型的出样部结构示意图;
图5为本实用新型的微柱放大图;
图6为本实用新型的操作步骤原理图;
图7为免疫荧光染色后的白细胞及循环肿瘤细胞。
具体实施方式
如图1至图5所示,本实用新型提供了一种用于循环肿瘤细胞分选的微流控芯片,包括进样部1、两个微柱阵列区2和出样部3;微柱阵列区2在实际生产使用过程中可以根据需要设置数量,至少要有一个微柱阵列区,本实施例中采用两个。两个微柱阵列区的设计不仅可以提高目的细胞的筛选效率。
微柱阵列区2的一端与进样部1连通,另一端与出样部3连通。进样部1包括血液样本进样口11和缓冲液进液口12。出样部3包括目的细胞收集口31和废液收集口32。血液样本进样口11通过血液样本进样管111与微柱阵列区2端部连通;缓冲液进液口12通过缓冲液进液管121同时与血液样本进样管111和微柱阵列区2连通。血液样本进样管111为弧型管,此设计的目的是减少流体阻力。为了防止异物进入芯片,血液样品进样管111内设有栅状结构112。缓冲液进液管121内同样设有栅状结构122,目的是为了防止义务进入芯片。目的细胞收集口31通过目的细胞收集管311与微柱阵列区2端部连通,目的细胞收集管311为弧型管。废液收集口32通过废液收集管321与微柱阵列区2端部连通。
微柱阵列区2包括至少一个由若干微柱21构成的微柱矩阵22。在本实用新型的一个实施例中,每个微柱阵列区2设有十三个微柱矩阵22;每个微柱矩阵22包括五十七列微柱,每列微柱为十三行,共计七百四十一个微柱。微柱矩阵22中的微柱数量可根据实际需要设置。本实用新型中,微柱矩阵的设置可以将目的细胞成功的导入细胞收集通道并流入目的细胞收集口。微柱阵列区2还包括一个目的细胞收集通道23,该目的细胞收集通道23沿血流方向设置位于微柱矩阵22的一侧并与所述目的细胞收集口31连通。微柱矩阵22按照与血流方向呈1.5~2.5夹角向目的细胞收集通道23一侧倾斜设置。
在本实用新型的一个实施例中,微柱矩阵22与水平方向呈1.7度夹角(图中标示为F)。微柱阵列区2的两端还设有栅状结构区24,若干微柱矩阵22设置在两栅状结构区24之间。栅状结构区24的设置目的是保证流体按照一定方向进入芯片,并防止异物进入芯片。
微柱21的横截面为卵形,卵形的直径B推荐范围为28~33μm,卵形的对称直径A推荐为20~25μm;血流方向相邻两微柱的卵心距C推荐为40~45μm,垂直于血流方向的相邻两微柱21的卵心距D推荐为60~65μm。上述数值范围为可行且较佳的数值范围,在本实用新型的一个实施例中,采用的优选数据为:卵形的直径B推荐范围为31μm,卵形的对称直径A推荐为23μm;血流方向相邻两微柱的卵心距C推荐为41μm,垂直于血流方向的相邻两微柱21的卵心距D推荐为62μm。
如图6所示,本实用新型的使用方法为:
(1)将患者全血与新型全血CD45磁珠混合孵育(图中a所示),将全血中白细胞与磁珠结合。
(2)步骤(1)与磁珠结合后的全血由血液样本进样口11进入芯片,同时缓冲液b由缓冲液进液口12进入芯片。在微流控芯片的微柱阵列区2中大于分选临界半径的大物质(与磁珠结合的白细胞及循环肿瘤细胞)与微柱21阵列碰撞后发生侧向位移,可向目的细胞收集通道一侧汇聚,而小于分选临界半径的小物质(红细胞及血小板等干扰细胞)在与微柱21阵列碰撞后并不发生侧移,按照其原流向流过阵列;本实用新型微柱的结构、尺寸及微柱之间的距离决定了该微柱矩阵的阵列临界偏转半径为4~5μm。即大于5μm的细胞会沿阵列向上偏转,小于5μm的细胞将会沿原有方向流动,不会改变流动方向。目的细胞收集口收集目的细胞c(与磁珠结合的白细胞及循环肿瘤细胞),废液d由废液收集口排出(红细胞及血小板等干扰细胞)。
(3)将步骤(2)得到的目的细胞c通过特定磁场e去除已与磁珠结合的白细胞,从而得到高纯度循环肿瘤细胞f。所得循环肿瘤细胞在筛选富集过程高效快速,且整个操作过程中不破坏循环肿瘤细胞,使收集得到的循环肿瘤细胞活性极高,有利于后期的检测。
采用本微流控芯片,通过物理方法分选细胞,细胞流经芯片只与微柱发生弹性碰撞,后可直接收集,无其余操作损伤,图7为免疫荧光染色后的白细胞及循环肿瘤细胞,可见利用本微流控芯片得到的细胞结构完整、活性高,便于进行下一步研究。
- 还没有人留言评论。精彩留言会获得点赞!