突变型2-脱氧-青蟹肌糖合酶的制作方法
本公开文本涉及例如经修饰的2-脱氧-青蟹肌糖(2-deoxy-scyllo-inosose)(以下称为“doi”)合酶、编码该经修饰的doi合酶的基因、包含该基因的表达盒、含有该表达盒的载体、含有该载体的转化体、使用了该转化体制造经修饰的doi合酶的方法、及doi的制造方法。
背景技术:
塑料、洗涤剂等人们日常生活中身边的制品大多以化石资源作为原料进行制造。作为它们的化工产品原料的六元碳环化合物通过石油化学工业从原油进行生产。但是,在利用从石油制造化学制品原料的以往的石油化学工艺时,存在产生作为有限资源的石油的枯竭及伴随其的价格高涨、由于排放大量的二氧化碳而导致地球变暖等地球规模的问题的顾虑。
作为具有六元碳环骨架的手性化合物的doi是用于合成医药、农药、氧化抑制剂、香料等各种有用化学品的非常重要的中间原料。doi可合成转变为儿茶酚、杜醌等二元酚、羟基氢醌。例如,kakinuma等,tetrahedronletters,2000,vol.41,p.1935公开了将doi合成转变为儿茶酚。儿茶酚用于神经系统医药品等的原料、食品香料原料、头发护理商品等的抗氧化剂等,氢醌用于止血剂、镇痛剂等的原料、美白剂等化妆品,是世界性高需求的物质。doi还可转变为作为拟糖的卡巴葡萄糖(carbaglucose),是用途广泛的中间原料。例如,日本特开2005-053899号公报公开了以doi作为原料来合成卡巴葡萄糖。
已发现,对起始糖类进行碳环化的酶是参与生物合成多种作为临床医学上重要的化学治疗剂的氨基糖苷系抗生素(含2-脱氧链霉胺)的过程的酶之一。由属于丁酰苷菌素产生菌环状芽孢杆菌(bacilluscirculans)的微生物纯化得到的该酶以葡萄糖-6-磷酸作为底物、以烟酰胺腺嘌呤二核苷酸(nad+)作为辅酶,催化多阶段的反应,最终生物合成doi。kudo等,j.antibiot.,1999,vol.52,p.559及日本特开2000-236881号公报记载了从属于环状芽孢杆菌的微生物克隆其doi合酶基因(对催化将葡萄糖-6-磷酸转变为doi的反应的酶进行编码的btrc),在大肠杆菌内使该基因表达、纯化从而大量得到重组doi合酶。此外,日本特开2014-064513号公报公开了通过使己糖激酶或多聚磷酸葡萄糖激酶、和doi合酶作用于葡萄糖的两步酶反应、或者使doi合酶作用于葡萄糖-6-磷酸的一步酶反应能够合成doi。此外,hirayama等,j.antibiot.,2005,vol.58,p.766公开了来源于弗氏链霉菌(streptomycesfradiae)的doi合酶,subba等,mol.cells,2005,vol.20,p.90公开了来源于核糖苷链霉菌(streptomycesribosidificus)的doi合酶,kharel等,arch.biochem.biophys.,2004,vol.429,p.204公开了来源于卡那霉素链霉菌(streptomyceskanamyceticus)的doi合酶,unwin等,j.antibiot.,2004,vol.57,p.436公开了来源于棘孢小单胞菌(micromonosporaechinospora)的doi合酶,kharel等,femsmicrobiol.lett.,2004,vol.230,p.185公开了来源于黑暗链霉菌(streptomycestenebrarius)的doi合酶,hirayama等,j.antibiot.,2006,vol.59,p.358公开了来源于印度斯坦异壁链霉菌(streptoalloteichushindustanus)的doi合酶。
除此以外,日本特开2013-135697号公报公开了具有特定氨基酸序列的耐热性doi合酶,tamegai等,biosci.biotechnol.biochem.,2010,vol.74,p.1215记载了环状芽孢杆菌的doi合酶相关蛋白btrc2的作用。国际公开第2006/109479号及kogure等,j.biotechnol.,2007,vol.129,p.502公开了包含doi合酶的基因的表达盒,还尝试了通过细胞内糖代谢工程修饰来增加产量。国际公开第2010/053052号公开了doi产生大肠杆菌,其至少具有蔗糖非pts基因群中编码蔗糖水解酶(csca)的基因,并且被赋予2-脱氧-青蟹肌糖(doi)生产系统或对该系统进行了强化,优选还具有糖摄入能力强化系统。
技术实现要素:
发明所要解决的课题
上述的专利文献及非专利文献中记载的技术并未尝试通过修饰doi合酶的氨基酸序列来增强doi合酶活性。为了构建能够使用doi合酶高效地生产doi的系统,通过对酶加以修饰来增强酶活性也是有效的手段。若能够提高doi的生产效率,则能够更廉价地在短时间内大量生产doi。作为提高酶活性的方法,有修饰酶中与底物结合的活性中心的氨基酸、选择高活性的酶的方法。另外,还有在体外对编码目标酶的基因快速进行人工诱变、从多个突变基因群中筛选编码被修饰为具有目标活性的酶的基因的进化工程方法。后一种方法已被应用于对洗涤剂用酶、生物降解性塑料生产用酶等的修饰,但其对doi合酶加以修饰的应用尚属未知。
本申请的发明人着眼于doi合酶的活性,想到了存在下述的可能性:通过使用具有提高的doi合成活性的doi合酶将葡萄糖-6-磷酸高效地转变为doi,从而能够在短时间内制造大量的doi。鉴于上述情况,本公开文本涉及的一个实施方式的课题为,提供具有比包含序列号1的氨基酸序列的野生型doi合酶更高的doi合成活性的经修饰的doi合酶、编码该经修饰的doi合酶的基因、包含该基因的表达盒、含有该表达盒的载体、含有该载体的转化体、使用了该转化体制造经修饰的doi合酶的方法、及doi的制造方法。
用于解决课题的手段
本申请的发明人为了解决上述课题而反复进行了深入研究,结果,通过使用进化工程方法,成功地将doi合酶修饰为doi合成活性更高的酶。另外,使用含有编码通过该方法得到的经修饰的酶的基因的转化体,成功地比以往更高效地制造了doi。
根据本公开文本,提供以下的(1)~(9)。
(1)多肽,其在下述(a1)或(a2)的氨基酸序列中具有下述(a)~(e)中的至少1个氨基酸突变:
(a1)序列号1的氨基酸序列;
(a2)氨基酸序列,其是具有从葡萄糖-6-磷酸生成2-脱氧-青蟹肌糖的酶活性的多肽的氨基酸序列,且与序列号1的氨基酸序列具有80%以上的序列同一性;
(a)与序列号1的氨基酸序列的n末端起第14位的天冬酰胺残基在比对上对应的氨基酸残基被取代为苏氨酸的氨基酸突变;
(b)与序列号1的氨基酸序列的n末端起第37位的酪氨酸残基在比对上对应的氨基酸残基被取代为苯丙氨酸的氨基酸突变;
(c)与序列号1的氨基酸序列的n末端起第290位的丙氨酸残基在比对上对应的氨基酸残基被取代为苏氨酸的氨基酸突变;
(d)与序列号1的氨基酸序列的n末端起第293位的色氨酸残基在比对上对应的氨基酸残基被取代为精氨酸的氨基酸突变;
(e)与序列号1的氨基酸序列的n末端起第319位的组氨酸残基在比对上对应的氨基酸残基被取代为精氨酸的氨基酸突变。
(2)如前述(1)所述的多肽,其在所述(a1)或(a2)的氨基酸序列中具有所述(d)及所述(e)的氨基酸突变中的至少一者。
(3)如前述(1)所述的多肽,其中在所述(a1)或(a2)的氨基酸序列中具有所述(d)的氨基酸突变、和选自所述(a)、(b)、(c)及(e)中的至少1个氨基酸突变。
(4)多核苷酸,其具有编码前述(1)~前述(3)中任一项所述的多肽所具有的氨基酸序列的碱基序列。
(5)表达盒,其包含前述(4)所述的多核苷酸、连接在所述多核苷酸的上游的启动子序列、及连接在所述多核苷酸的下游的终止子序列。
(6)载体,其含有前述(5)所述的表达盒。
(7)利用前述(6)所述的载体转化而得的转化体。
(8)具有从葡萄糖-6-磷酸生成2-脱氧-青蟹肌糖的酶活性的多肽的制造方法,所述方法包括培养前述(7)所述的转化体的工序。
(9)2-脱氧-青蟹肌糖的制造方法,其包括下述工序:通过使前述(1)~前述(3)中任一项所述的多肽、前述(7)所述的转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物与葡萄糖或葡萄糖-6-磷酸接触,将葡萄糖或葡萄糖-6-磷酸转变为2-脱氧-青蟹肌糖。
发明效果
根据本公开文本,可提供具有比包含序列号1的氨基酸序列的野生型doi合酶更高的doi合成活性的经修饰的doi合酶、编码该经修饰的doi合酶的基因、包含该基因的表达盒、含有该表达盒的载体、含有该载体的转化体、使用了该转化体制造经修饰的doi合酶的方法、及doi的制造方法。
附图说明
[图1]为示出能由doi合成转变的芳香族化合物的图。
[图2]为示出δpgiδzwfδpgm株的图,其是对糖酵解系统的磷酸葡萄糖异构酶基因(pgi)、戊糖磷酸途径的葡萄糖-6-磷酸脱氢酶基因(zwf)、及通向糖原生物合成途径的磷酸葡萄糖变位酶基因(pgm)进行基因破坏、以使doi合酶(由btrc基因编码的蛋白)优先利用葡萄糖-6-磷酸的方式进行代谢工程修饰而得到的。
[图3a]为示出从使用了易错pcr的突变型doi合酶基因克隆文库的制备到doi高产doi合酶基因突变克隆的分离(1、2、3级筛选)为止的工序中的、突变型doi合酶基因克隆文库的制备的图。
[图3b]为示出从使用了易错pcr的突变型doi合酶基因克隆文库的制备到doi高产doi合酶基因突变克隆的分离为止的工序中的、1级筛选的图。
[图3c]为示出从使用了易错pcr的突变型doi合酶基因克隆文库的制备到doi高产doi合酶基因突变克隆的分离为止的工序中的、2级筛选的图。
[图3d]为示出从使用了易错pcr的突变型doi合酶基因克隆文库的制备到doi高产doi合酶基因突变克隆的分离为止的工序中的、3级筛选的图。
[图4]为示出pgadp的结构的图。
[图5]为示出pgadp-mbtrc的结构的图。
[图6]为示出在对含有pgadp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(◆)和含有pgadp-mbtrc中之一(后判明为pgadp-btrc(w293r))的大肠杆菌gi724δpgiδzwfδpgm株(■)的培养(2×yt+2%葡萄糖+2%甘露糖醇、50ml、30℃)中、培养基中doi产量的时间曲线(timecourse)的图。
[图7]为示出(左)野生型doi合酶(wt)、(右)突变型doi合酶(w293r)的doi合酶活性的图。
[图8]为示出示在对含有pgadp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(◆)、含有pgadp-btrc(w293r)的大肠杆菌gi724δpgiδzwfδpgm株(■)、含有pgadp-mbtrc(后判明为pgadp-btrc(w293r/n14t))的大肠杆菌gi724δpgiδzwfδpgm株(▲)、含有pgadp-mbtrc(后判明为pgadp-btrc(w293r/y37f))的大肠杆菌gi724δpgiδzwfδpgm株(×)、含有pgadp-mbtrc(后判明为pgadp-btrc(w293r/a290t))的大肠杆菌gi724δpgiδzwfδpgm株(+)、含有pgadp-mbtrc(后判明为pgadp-btrc(w293r/h319r))的大肠杆菌gi724δpgiδzwfδpgm株(·)的培养(2×yt+2%葡萄糖+2%甘露糖醇、50ml、30℃)中、培养基中doi产量的时间曲线的图。
[图9]为示出自左起为野生型doi合酶(wt)、突变型doi合酶(w293r)、突变型doi合酶(w293r/n14t)、突变型doi合酶(w293r/y37f)、突变型doi合酶(w293r/a290t)、突变型doi合酶(w293r/h319r)的doi合酶活性的图。
[图10]为示出pgapp-btrc(w293r/h319r)的结构的图。
[图11]为示出pgapp-btrc的结构的图。
[图12a]为示出在对含有pgapp-btrc的大肠杆菌g1724δpgiδzwfδpgm株(■)和含有pgapp-btrc(w293r/h319r)的大肠杆菌gi724δpgiδzwfδpgm株(▲)的培养(2×yt+5%葡萄糖+5%甘露糖醇、50ml、30℃)中培养基浊度的时间曲线的图。
[图12b]为示出在对含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(■)和含有pgapp-btrc(w293r/h319r)的大肠杆菌gi724δpgiδzwfδpgm株(▲)的培养(2×yt+5%葡萄糖+5%甘露糖醇、50ml、30℃)中、培养基中葡萄糖浓度的时间曲线的图。
[图12c]为示出在对含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(■)和含有pgapp-btrc(w293r/h319r)的大肠杆菌gi724δpgiδzwfδpgm株(▲)的培养(2×yt+5%葡萄糖+5%甘露糖醇、50ml、30℃)中、培养基中甘露糖醇浓度的时间曲线的图。
[图12d]为示出在对含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(■)和含有pgapp-btrc(w293r/h319r)的大肠杆菌gi724δpgiδzwfδpgm株(▲)的培养(2×yt+5%葡萄糖+5%甘露糖醇、50ml、30℃)中、doi产量的时间曲线的图。
[图13]为示出pgapp-btrc(h319r)的结构的图。
[图14a]为示出在对含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(■)和含有pgapp-btrc(h319r)的大肠杆菌gi724δpgiδzwfδpgm株(▲)的培养(2×yt+3%葡萄糖+4%甘露糖醇、30ml、30℃)中、培养基浊度的时间曲线的图。
[图14b]为示出在对含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(■)和含有pgapp-btrc(h319r)的大肠杆菌gi724δpgiδzwfδpgm株(▲)的培养(2×yt+3%葡萄糖+4%甘露糖醇、30ml、30℃)中、培养基中葡萄糖浓度的时间曲线的图。
[图14c]为示出在对含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(■)和含有pgapp-btrc(h319r)的大肠杆菌gi724δpgiδzwfδpgm株(▲)的培养(2×yt+3%葡萄糖+4%甘露糖醇、30ml、30℃)中、培养基中甘露糖醇浓度的时间曲线的图。
[图14d]为示出在对含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(■)和含有pgapp-btrc(h319r)的大肠杆菌gi724δpgiδzwfδpgm株(▲)的培养(2×yt+3%葡萄糖+4%甘露糖醇、30ml、30℃)中、doi产量的时间曲线的图。
[图15]为示出pgapp-btrc(w293r)-csca-glf的结构的图。
[图16]为示出pgapp-btrc(w293r/n14t)-csca-glf的结构的图。
[图17]为示出pgapp-btrc(w293r/h319r)-csca-glf的结构的图。
[图18a]为示出含有pgapp-btrc(w293r)-csca-glf的大肠杆菌mg1655δpgiδzwf株中的doi产量(▲)、葡萄糖浓度(·)、果糖浓度(◆)、木糖浓度(■)的时间曲线的图。
[图18b]为示出含有pgapp-btrc(w293r/n14t)-csca-glf的大肠杆菌mg1655δpgiδzwf株中的doi产量(▲)、葡萄糖浓度(·)、果糖浓度(◆)、木糖浓度(■)的时间曲线的图。
[图18c]为示出含有pgapp-btrc(w293r/h319r)-csca-glf的大肠杆菌mg1655δpgiδzwf株中的doi产量(▲)、葡萄糖浓度(·)、果糖浓度(◆)、木糖浓度(■)的时间曲线的图。
具体实施方式
根据本公开文本,可提供具有比包含序列号1的氨基酸序列的野生型doi合酶更高的doi合成活性的经修饰的doi合酶、编码该经修饰的doi合酶的基因、包含该基因的表达盒、含有该表达盒的载体、含有该载体的转化体、使用了该转化体制造经修饰的doi合酶的方法、及doi的制造方法。
根据本公开文本涉及的经修饰的doi合酶,可通过高doi合成活性来提高doi生产速度,能够短时间且高效地将葡萄糖-6-磷酸转变为doi。根据本公开文本涉及的经修饰的doi合酶的制造方法,通过使经修饰的doi合酶基因在宿主细胞中表达,能够制造doi合成活性高的经修饰的合酶。另外,根据本公开文本涉及的doi的制造方法,能够利用该经修饰的doi合酶基因,高效地从葡萄糖制造doi。
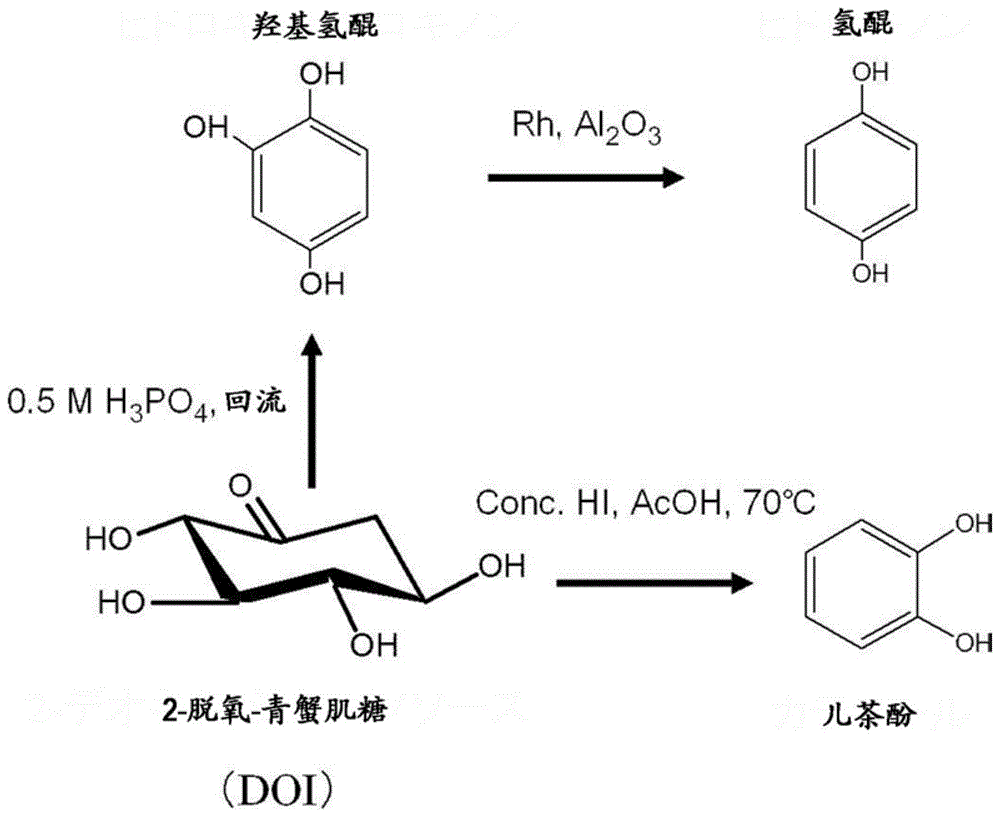
如前文所述,doi可合成转变为儿茶酚、氢醌等二元酚、羟基氢醌(参见图1)。根据本公开文本中的一个实施方式,能够简便且大量地高效制造被期待作为医药品、工业品的制造原料而广泛普及的doi。也可利用如此制造的doi来制造例如被期待作为医药品、工业品的制造原料而广泛普及的1,2,4-三羟基苯。
<修饰doi合酶>
本公开文本涉及的经修饰的doi合酶是在下述(a1)或(a2)的氨基酸序列中具有以下的(a)~(e)中至少1个氨基酸突变的多肽:
(a1)序列号1的氨基酸序列;
(a2)氨基酸序列,其是具有从葡萄糖-6-磷酸生成2-脱氧-青蟹肌糖的酶活性的多肽的氨基酸序列,且与序列号1的氨基酸序列具有80%以上的序列同一性;
(a)与序列号1的氨基酸序列的n末端起第14位的天冬酰胺残基在比对上对应的氨基酸残基被取代为苏氨酸的氨基酸突变;
(b)与序列号1的氨基酸序列的n末端起第37位的酪氨酸残基在比对上对应的氨基酸残基被取代为苯丙氨酸的氨基酸突变;
(c)与序列号1的氨基酸序列的n末端起第290位的丙氨酸残基在比对上对应的氨基酸残基被取代为苏氨酸的氨基酸突变;
(d)与序列号1的氨基酸序列的n末端起第293位的色氨酸残基在比对上对应的氨基酸残基被取代为精氨酸的氨基酸突变;
(e)与序列号1的氨基酸序列的n末端起第319位的组氨酸残基在比对上对应的氨基酸残基被取代为精氨酸的氨基酸突变。
这样的具有特定氨基酸残基的取代的经修饰的doi合酶具有基于该氨基酸残基的取代而提高的doi合成活性。本公开文本涉及的经修饰的doi合酶可被认为是具有向(a1)或(a2)的氨基酸序列导入下述(a)~(e)中至少1个氨基酸突变而得到的氨基酸序列的多肽,但该表述中“向(a1)或(a2)的氨基酸序列导入下述(a)~(e)中至少1个氨基酸突变”仅是为了对最终的氨基酸序列进行限定而使用的,其并不限定作为起点的氨基酸序列和实际的序列修饰操作过程。
序列号1的氨基酸序列是来源于环状芽孢杆菌的doi合酶的氨基酸序列,由btrc基因编码。经修饰的doi合酶具有与序列号1的氨基酸序列不同的氨基酸序列,在本公开文本中也被称为突变型doi合酶。序列号1的氨基酸序列示于以下表1。
[表1]
从葡萄糖-6-磷酸生成2-脱氧-青蟹肌糖的酶活性可如下测定:使包含50mm磷酸盐缓冲液(ph7.7)、5mm葡萄糖-6-磷酸、5mmβ-nad+、0.2mmcocl2·6h2o、及作为测定对象的doi合酶10μg的溶液于46℃反应5分钟,在反应后对反应溶液进行苯酚/氯仿处理,除去蛋白质,将离心后的水层组分10μl作为试样,通过hplc定量doi,算出活性。另外,将doi合酶1mg每1分钟合成的doi的量作为比活性。hplc的条件如下:
色谱柱:phenomenexkinetexxb-c18
洗脱缓冲液:h2o/甲醇(80/20);
流量:0.7ml/分钟;
柱温:40℃;
检测:uv262nm;
进样量:2μl。
另外,氨基酸序列的序列同一性可使用例如blast(注册商标,nationallibraryofmedicine)程序基于默认参数进行评价。
另外,所谓(a1)或(a2)的氨基酸序列中与序列号1的氨基酸序列的特定位点的氨基酸残基在比对上对应的氨基酸残基,是指利用例如blast(注册商标,nationallibraryofmedicine)程序(默认参数)将序列号1的氨基酸序列与(a1)或(a2)的氨基酸序列进行比对时发现与序列号1中的特定位点的氨基酸残基对应的、(a1)或(a2)的氨基酸序列中的氨基酸残基。
前述(a2)的氨基酸序列所具有的与序列号1的氨基酸序列的序列同一性可以是85%以上、或90%以上、或95%以上的序列同一性。
此处,前述(a2)的氨基酸序列也可以是在序列号1的氨基酸序列中具有不丧失doi合酶活性的范围内的序列修饰的氨基酸序列。即,可以是针对序列号1的氨基酸序列在不丧失doi合酶活性的范围内进行序列修饰而得到的氨基酸序列。作为这样的修饰,可举出氨基酸残基的插入、缺失、取代及向氨基酸序列n末端或c末端或这两者额外添加氨基酸残基。存在氨基酸残基的插入、缺失及取代中一者以上的情况下,就插入、缺失及取代各自而言,在存在的情况下可以为例如1~30个氨基酸残基、或者1~20个氨基酸残基、或者1~10个氨基酸残基、或者1~5个氨基酸残基,氨基酸残基的插入、缺失及取代的总数可以为例如1~50个氨基酸残基、或者1~30个氨基酸残基、或者1~10个氨基酸残基、或者1~5个氨基酸残基。另外,作为添加在末端的氨基酸残基的数量,在存在的情况下,每一个末端可以为例如1~50个氨基酸残基、或者1~30个氨基酸残基、或者1~10个氨基酸残基、或者1~5个氨基酸残基。这样的额外添加的氨基酸残基可形成用于向细胞外分泌等的信号序列。作为信号序列的例子,可举出大肠杆菌的ompa信号序列等。
前述(a)~(e)的氨基酸突变均是使doi合酶活性上升的氨基酸突变。本公开文本涉及的经修饰的doi合酶可仅具有前述(a)~(e)的氨基酸突变中的任一个,也可具有其中的2个以上。例如,经修饰的doi合酶可具有前述(a)~(e)的氨基酸突变中的2个,也可具有3个,也可具有4个,也可具有5个。一个实施方式中,经修饰的doi合酶具有(d)及(e)的氨基酸突变中的至少1个,这种情况下还可具有(a)~(c)的氨基酸突变中的至少1个。其他实施方式中,经修饰的doi合酶具有(d)的氨基酸突变,且还具有(a)、(b)、(c)及(e)的氨基酸突变中的至少1个。另一其他实施方式中,经修饰的doi合酶具有(d)的氨基酸突变,且还具有(a)、(b)、及(e)的氨基酸突变中的至少1个。这种情况下还可具有(c)的氨基酸突变。另一其他实施方式中,经修饰的doi合酶具有(d)的氨基酸突变,且还具有(a)及(e)的氨基酸突变中的至少1个。这种情况下还可具有(b)及(c)的氨基酸突变中的至少1个。另一其他实施方式中,经修饰的doi合酶具有(d)的氨基酸突变及(e)的氨基酸突变。这种情况下还可具有(a)~(c)的氨基酸突变中的至少1个。
另外,与序列号1的氨基酸序列具有80%以上的序列同一性、且具有从葡萄糖-6-磷酸生成2-脱氧-青蟹肌糖的酶活性的多肽在与酶功能相关的结构方面具有与序列号1的氨基酸高度相似的结构,因此,对于这样的多肽而言,上述的(a)~(e)的氨基酸突变各自也起到使doi合酶活性上升的效果。
如上所述,通过具有(a)~(e)的氨基酸突变中的1个以上,能够得到具有提高的doi合酶活性的经修饰的doi合酶。经修饰的doi合酶优选具有比具有序列号1的氨基酸序列的doi合酶(本公开文本中也称为野生型doi合酶)更高的doi合成活性。相对于具有序列号1的氨基酸序列的doi合酶而言,经修饰的doi合酶优选具有1.1倍以上高的doi合成活性,更优选具有1.2倍以上高的doi合成活性,更优选具有1.3倍以上高的doi合成活性,更优选具有1.4倍以上高的doi合成活性,更优选具有1.5倍以上高的doi合成活性,更优选具有1.6倍以上高的doi合成活性,更优选具有1.7倍以上高的doi合成活性,进一步优选具有1.8倍以上高的doi合成活性。
上述(a)~(e)的氨基酸突变是通过doi合酶的进化工程修饰而得到的。
<doi合酶的进化工程修饰>
所谓进化工程修饰,是指在体外对编码目标蛋白质的基因进行人工诱变、筛选出被改造为具有期望性质的蛋白质,从而对该目标蛋白质分子加以修饰的技术。
向目标酶基因导入随机突变可通过对保有目标酶基因的微生物实施烷基化试剂(n-甲基-n’-硝基-n-亚硝基胍等)处理、核酸碱基的氧化性脱氨基化试剂(亚硝酸等)处理、放射线(紫外线、x射线等)照射、或利用pcr的随机突变导入来进行。
利用pcr的随机突变的导入可通过下述的易错pcr来实施:将含有目标酶基因的dna片段作为模板,在使该基因扩增的过程中、在降低了利用dna聚合酶的dna复制的正确性的条件下进行pcr反应,使扩增后的dna序列中积累错误。易错pcr中,通过向反应溶液中添加锰离子、或破坏4种脱氧核糖核酸(dntp)的各浓度的平衡,从而能够降低dna聚合酶的正确性,导入突变。
例如,通过易错pcr使来源于环状芽孢杆菌的doi合酶基因(btrc)突变时,将具有该基因的质粒(例如,国际公开第2006/109479号中记载的plex-btrc)、dna片段作为模板,利用用于扩增该基因的引物,在使dna聚合酶的正确性降低的条件下实施pcr即可。作为使dna聚合酶的正确性降低的条件,可举出后述的实施例1中记载的条件等。
另外,通过导入随机突变得到的经修饰的酶基因群可将针对所期望的性质是否具有提高的功能作为指标来进行筛选。例如,可测定经修饰的酶基因群所表达的修饰酶群的doi合成活性,筛选doi合成活性较之突变导入前而言得以提高的经修饰的酶。如此,能够得到针对所期望的性质具有提高的活性的经修饰的酶。通过向编码得到的经修饰的酶的基因中进一步导入随机突变、与上述同样地进行筛选,从而能够得到针对所期望的性质具有进一步提高的活性的修饰酶。
通过进化工程修饰,即使不清楚酶中的活性中心的位置,仍然能够得到具有提高的性质的经修饰的酶。另外,对于上述提高而言,若利用进化工程修饰,则能够基于事先不清楚与功能的关系的氨基酸残基位点处的氨基酸突变或其组合来累积性地实现。因此,本公开文本涉及的doi合酶所具有的修饰、及由此带来的doi合成活性的提高是本领域技术人员预料不到的。
<编码经修饰的doi合酶的基因>
本公开文本涉及的编码经修饰的doi合酶的基因可以是编码前述经修饰的doi合酶的任意的核酸。可使编码特定的氨基酸序列的核酸的核苷酸序列在密码子的简并范围内变化。这种情况下,从基因的表达效率的观点考虑,优选使用成为重组微生物的宿主的微生物中使用频率高的密码子。根据本公开文本,可提供具有编码经修饰的doi合酶所具有的氨基酸序列的碱基序列的多核苷酸。
需要说明的是,基因的核苷酸序列也可根据所要编码的氨基酸序列、基于密码子表进行设计。设计的核苷酸序列可通过利用基因重组技术对已知的核苷酸序列进行修饰来得到,也可通过化学合成核苷酸序列来得到。
作为对核苷酸序列加以修饰的方法,可举出例如位点特异性突变法(kramer,w.和frita,h.j.,methodsinenzymology,vol.154,p.350(1987))、重组pcr法(pcrtechnology,stocktonpress(1989))、化学合成特定部分的dna的方法、对基因进行羟基胺处理的方法、对保有基因的菌株进行紫外线照射处理、或用亚硝基胍、亚硝酸等化学药剂进行处理的方法、使用市售的突变导入试剂盒的方法等。
为了表达在目标基因中随机地具有突变的基因,可利用各种宿主·载体系统。作为宿主·载体系统,可利用细菌、酵母等系统,但只要能够高效地表达、制造随机地具有突变的基因即可,没有特别限定。将得到的导入突变后的pcr片段与具有表达所需的启动子、终止子、且能够在宿主内表达的表达载体连接,导入宿主。
<经修饰的doi合酶基因表达盒>
本公开文本涉及的基因表达盒只要能够使编码前述的经修饰的doi合酶的基因在后述的宿主细胞内表达即可,没有特别限定。基因表达盒不仅包含编码经修饰的doi合酶的核酸序列,还可包含例如启动子、增强子、rbs(核糖体结合序列)、终止子等中的1种以上。基因表达盒优选不仅包含编码经修饰的doi合酶的核酸序列,还在该核酸序列的上游包含启动子,以及在该核酸序列的下游包含终止子。例如,在以大肠杆菌作为宿主细胞的蛋白质的大量表达系统中,可采用在编码经修饰的doi合酶的dna序列的上游侧(5’末端侧)连接启动子、增强子、及rbs(核糖体结合位点)等的dna序列、并在编码经修饰的doi合酶的dna序列的下游侧(3’末端侧)连接例如终止子的dna序列而成的构成。上述各要素只要是在大肠杆菌内发挥所期望的功能的序列即可,没有特别限定。启动子中有组成性表达的启动子及诱导性表达的启动子。本公开文本涉及的doi基因表达盒中,可使用任一类型的启动子。另外,将大肠杆菌作为宿主细胞时,可使用能利用iptg(异丙基硫代半乳糖苷)等诱导物质来诱导表达的启动子。
作为一例,在利用大肠杆菌的情况下,作为前述启动子的例子,可举出乳糖操纵子的启动子、色氨酸操纵子的启动子、前2种的融合启动子、λ噬菌体的启动子、甘油醛-3-磷酸脱氢酶基因启动子、谷氨酸脱羧酶基因启动子、gada启动子、乙醇脱氢酶(adh1)启动子等。终止子没有特别限定,可利用例如rrn终止子、aspa终止子等。
另外,作为核糖体结合位点的例子,可举出夏因-达尔加诺(shine-dalgarno)(sd)序列的aggag等。作为增强子,可使用已知的增强子。
<经修饰的doi合酶基因表达载体>
本公开文本涉及的经修饰的doi合酶基因表达载体只要是具有编码前述的经修饰的doi合酶的基因、且能够使所述基因在后述的宿主细胞内表达的表达载体即可,没有特别限定。修饰doi合酶基因表达载体优选含有前述经修饰的doi合酶基因表达盒。
作为一例,在利用大肠杆菌的情况下,为了高效地表达基因而构建了各种表达载体。可构建在乳糖操纵子的启动子、色氨酸操纵子的启动子、前2种的融合启动子、λ噬菌体的启动子、甘油醛-3-磷酸脱氢酶基因启动子、谷氨酸脱羧酶基因启动子、gada启动子、乙醇脱氢酶(adh1)启动子等的下游连接突变处理基因、并在该基因的下游连接终止子而成的经修饰的doi合酶表达载体。终止子可利用rrn终止子、aspa终止子等,但没有特别限定。
作为载体,基于能够在宿主细胞内自主增殖的噬菌体或质粒、作为基因重组用途而构建的载体是合适的。作为噬菌体,例如在以大肠杆菌(escherichiacoli)作为宿主细胞时,可举出lambdagt10、lambdagt11等。另外,作为质粒,例如在以大肠杆菌作为宿主细胞时,可举出pbtrp2、pbtac1、pbtac2(boehringermannheim公司制)、pkk233-2(pharmacia公司制)、pse280(invitrogen公司制)、pgemex-1(promega公司制)、pqe-8、pqe-30(qiagen公司制)、pbluescriptiisk(+)、pbluescriptiisk(-)(stratagene公司制)、pet-3(novagen公司制)、puc18、pstv28、pstv29、puc118(宝酒造公司制)、plex(invitrogen公司制)、pqe80l(qiagen公司制)、pbr322等。
经修饰的doi合酶基因表达载体也可具有用于使编码经修饰的doi合酶的dna转录的启动子。作为启动子的例子,可举出上述的启动子。另外,经修饰的doi合酶基因表达载体也可含有核糖体结合序列。作为核糖体结合序列的例子,可举出夏因-达尔加诺(shine-dalgarno)序列,优选使用将sd序列与起始密码子之间调节为适当的距离(例如6~18个核苷酸)的质粒。
为了高效地进行转录及翻译,目标蛋白质的n末端也可与表达载体所编码的其他蛋白质的n末端部分进行融合。
虽然目标蛋白质的表达未必需要终止子,但期望紧邻结构基因之后配置终止子。
克隆时,可使用用于切出所插入的dna的限制性内切酶对前述那样的载体进行切割而得到载体dna片段,但不必使用与用于切出所插入的dna的限制性内切酶相同的限制性内切酶。使待插入的dna片段与载体dna片段结合的方法只要是使用已知的dna连接酶的方法即可,例如在待插入的dna片段的粘性末端和载体dna片段的粘性末端的退火后,通过使用合适的dna连接酶来制作所插入的dna片段与载体dna片段的重组dna。根据需要,也可在退火后移入微生物等宿主细胞,利用生物体内的dna连接酶制作重组dna。
为了将本公开文本涉及的重组dna导入宿主细胞,可利用sambrook,j.等,“分子克隆实验指南第三版(molecularcloning:alaboratorymanual,3rdedition)”,冷泉港实验室(coldspringharborlaboratorypress),(2001)等中记载的分子生物学、生物工程、及基因工程的领域中已知的常规方法。可举出例如使用感受态细胞的方法、使用电穿孔的方法。
通过将如此制得的表达载体导入能够复制、维持前述表达载体的宿主内,可得到表达经修饰的doi合酶基因的转化体。接下来,通过验证得到的转化体所表达的doi合酶的性质,对该酶的修饰进行验证。
<转化体>
本公开文本涉及的转化体是含有本公开文本涉及的经修饰的doi合酶基因表达载体的转化体。
作为用于制备转化体的宿主细胞,只要是重组dna能够稳定且自主性地增殖、并且外源性dna的性状能够表达的宿主细胞即可。宿主细胞优选为微生物的细胞。前述微生物的细胞可以是真核生物(例如酵母)的细胞,也可以是原核生物的细胞。作为宿主细胞的例子,可举出大肠杆菌(escherichiacoli)的细胞,但不特别限定于大肠杆菌的细胞,可使用埃希氏菌属细菌的细胞、枯草芽孢杆菌(bacillussubtilis)等芽孢杆菌属细菌的细胞、假单胞菌属细菌等细菌类的细胞、酵母属、毕赤酵母属、假丝酵母菌等酵母类的细胞、曲霉属等的丝状菌类的细胞等。
宿主细胞优选为大量蓄积作为doi合酶的底物的葡萄糖-6-磷酸的宿主细胞。作为这样的宿主细胞,有例如将大肠杆菌中编码葡萄糖磷酸异构酶的pgi基因破坏而得到的菌株(例如,国际公开第2006/109479号中记载的大肠杆菌gi724δpgi株)、将大肠杆菌中pgi基因及编码葡萄糖-6-磷酸脱氢酶的zwf基因破坏而得到的菌株(例如,国际公开第2010/053052号中记载的大肠杆菌mg1655δpgiδzwf株)、以及将大肠杆菌中pgi基因、zwf基因及编码磷酸葡萄糖变位酶的pgm基因破坏而得到的菌株(参见图2)(例如,国际公开第2006/109479号中记载的大肠杆菌gi724δpgiδzwfδpgm株)。
宿主细胞优选为具有编码从葡萄糖生成葡萄糖-6-磷酸的酶的基因、例如glk的细胞。
另外,宿主细胞可被进一步赋予将细胞外的葡萄糖直接摄入细胞内的能力,为此,可进一步导入例如葡萄糖转运促进蛋白基因。作为葡萄糖转运促进蛋白基因,有例如来源于运动发酵单胞菌的glf等。另外,宿主细胞可被进一步赋予提高的利用果糖及蔗糖的能力,为此,可进一步导入例如蔗糖水解酶基因。作为蔗糖水解酶基因,有例如来源于大肠杆菌o-157的csca等。作为具有这样的基因的载体的例子,有国际公开第2010/053052号中记载的质粒载体pgap-btrc-csca-glf等。
作为将重组dna移入宿主细胞的方法,例如在宿主细胞为大肠杆菌时,可使用基于钙处理的感受态细胞法、电穿孔法等。作为感受态细胞,可利用大肠杆菌dh5α的感受态细胞等。通过培养如此得到的转化体,能够稳定地生产经修饰的doi合酶。前述转化体的培养条件与原本的宿主微生物的培养条件相同,可使用已知的条件。
该转化体的培养可任意地使用各种碳源、氮源、无机盐类及有机营养源。作为碳源,可利用例如葡萄糖、蔗糖、糖蜜、油脂等。作为氮源,可举出例如氨、氯化铵、硫酸铵、磷酸铵等铵盐、以及蛋白胨、肉提取物、酵母提取物等。作为无机盐类,可举出例如磷酸二氢钾、磷酸氢二钾、磷酸镁、硫酸镁、氯化钠等。作为其他有机营养源,可举出例如甘氨酸、丙氨酸、丝氨酸、苏氨酸、脯氨酸等氨基酸、维生素b1、维生素b12、维生素c等维生素等。
只要是适量含有碳源、氮源、无机物及其他营养素的培养基,则可使用合成培养基或天然培养基中的任何培养基。作为培养基的例子,可举出例如lb液体培养基、rm液体培养基、2×yt液体培养基、l琼脂培养基、rmm液体培养基等。或者也可以是lb琼脂平板等。需要说明的是,在利用含有筛选标记的表达载体进行转化而成的转化体的培养中,例如,前述筛选标记为耐药性时,使用含有与其对应的药剂的培养基,前述筛选标记为营养缺陷性时,使用不含与其对应的营养素的培养基。
培养条件基于培养基的种类、培养方法而适当选择即可,只要是转化体生长的条件则没有特别限定。
培养温度为该转化体能够生长的温度即可。培养时的ph为该转化体能够生长的ph即可。培养时间只要是能够高效地生产doi合酶的时间即可,没有特别限定。
培养温度可以为例如20℃~45℃的范围内的温度,可以为25℃~35℃的范围内的温度,也可以为24℃~37℃的范围内的温度。培养基的ph在例如4~8的范围中选择即可,可以为5~8的范围,也可以为6.5~8的范围。根据微生物的种类,可以进行好氧培养,也可以进行厌氧培养。
培养时间可以为例如1小时~7天,可以为6小时~60小时,也可以为12小时~30小时。培养时间可以以经修饰的doi合酶的产生量成为最大的方式进行设定。例如,好氧条件下,一边以ph为6以上且8以下的ph、温度为25℃以上且40℃以下的范围内的温度对ph和温度适当地进行控制,一边进行培养的情况下,培养所需的时间可设为48小时以内。培养时间也可以为0.5小时~30小时的范围内。
培养可在含有前述培养成分的液体培养基中使用振荡培养、通气搅拌培养、连续培养或补料分批培养(fed-batchculture)等通常的培养方法进行。
将得到的转化体在能够产生doi的条件下培养,调查培养液中的doi的产量情况。例如,doi的产量情况可使用气相色谱质谱联用仪、高效液相色谱仪进行调查。这样的产量分析可参考kogure等,j.biotechnol.,2007,vol.129,p.502进行。
上述中,针对doi的产量情况观察到变化的转化体,提取该转化体所具有的表达载体,确定编码该酶的基因的碱基序列。接下来,将该酶的推定氨基酸序列与野生型酶的氨基酸序列进行比较,能够确定哪个氨基酸有助于对该酶性质的修饰。
在性质经修饰的酶的推定氨基酸序列上发现多个氨基酸取代时,可使用位点特异性突变导入法将任意的1个氨基酸取代为其他氨基酸,调查各氨基酸取代对于酶性质的修饰具有何种程度的贡献。
上述得到的突变型酶的酶学性质可通过将各突变型酶分离·纯化后调查比活性、底物特异性、最适温度、最适ph等,与野生型酶进行比较,由此验证酶的性质的变化。
对于转化体所产生的经修饰的doi合酶而言,也可直接采集培养物中的含有转化体的培养液而利用。另外,还可利用过滤或离心分离等手段从得到的培养物中采集转化体而利用。可使用机械性方法或溶菌酶等酶学方法将采集的转化体破坏、另外根据需要添加乙二胺四乙酸(edta)等螯合剂及/或表面活性剂而将多肽进行可溶化,以溶液的形式分离采集。
<经修饰的doi合酶的制造方法>
本公开文本涉及的具有doi合成活性的多肽(经修饰的doi合酶)的制造方法包括培养本公开文本涉及的转化体的工序。关于用于培养转化体的培养基及培养条件、培养方法等如本公开文本涉及的转化体的说明中所述。培养条件只要是宿主细胞进行生长、且能够产生具有doi合成活性的蛋白质的条件即可,没有特别限定。
通过培养本公开文本涉及的转化体,本公开文本涉及的载体上的编码经修饰的doi合酶的基因进行表达,生成经修饰的doi合酶。例如,通过在合适的培养基中、好氧条件下、ph6~8的范围内的ph、温度25℃~40℃的范围内的温度下培养48小时以内,从而能够得到经修饰的doi合酶。
生成的经修饰的doi合酶为包含于转化体的细胞(例如大肠杆菌的菌体)内及培养基中至少一者的状态。可在不对该转化体的细胞及培养基进行纯化的情况下直接用于doi合成反应,或者也可从培养基中纯化经修饰的doi合酶。此时,通过将细胞破碎或溶解,还可回收细胞内的经修饰的doi合酶。或者,可通过离心分离等将细胞从培养基中分离,将该分离的细胞用于doi合成反应,或者可将该细胞干燥、冷冻或冷冻干燥进行保存。或者,可将分离的细胞破碎或溶解,将释放的doi合酶直接用于doi合成反应,或者可将释放的doi合酶纯化。酶的纯化可在适当调节的条件下使用离心分离、盐析、脱盐、色谱法、电泳、超滤等常规纯化方法。也可通过例如使用了裂解缓冲液的细胞的溶解、将doi合酶固定至ni-nta琼脂糖、及基于洗脱缓冲液的洗脱来对doi合酶进行纯化。
<doi的制造方法>
本公开文本涉及的doi制造方法包括下述工序:通过使本公开文本涉及的经修饰的doi合酶、本公开文本涉及的转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物与葡萄糖或葡萄糖-6-磷酸接触,从而将葡萄糖或葡萄糖-6-磷酸转变为doi。
所谓转化体的培养物,是指培养转化体而得到的、包含细胞和周围的培养基等的产物。也可不使用培养物,而是将例如预先制备的经干燥或冷冻的转化体的细胞直接添加至反应体系。
用于得到转化体的培养物的培养基、培养条件、培养方法等与可用于上述的转化体的培养的培养基、培养条件、培养方法等相同。培养条件只要是宿主细胞进行生长、且能够产生具有doi合成活性的蛋白质的条件即可,没有特别限定。
另外,所谓前述转化体的处理物,是指在不丧失转化体所产生的经修饰的doi合酶的活性的范围内、对转化体进行任意的处理而得到的产物。作为这样的处理,可举出例如包括选自由加热处理、冷却处理、机械性破坏、超声波处理、冻融处理、干燥处理、加压或减压处理、浸透压处理、自体分解、表面活性剂处理及酶处理(例如细胞溶解处理)组成的组中的1种以上的处理等。即使转化体自身由于这样的处理而死亡,只要该转化体所产生的酶的活性残留,则仍然可用于反应。
所谓前述培养物的处理物,是指在不丧失转化体所产生的经修饰的doi合酶的活性的范围内、对转化体的培养物进行任意的处理而得到的产物。作为这样的处理,可举出包括选自由加热处理、冷却处理、细胞的机械性破坏、超声波处理、冻融处理、干燥处理、加压或减压处理、浸透压处理、细胞的自体分解、表面活性剂处理、酶处理(例如细胞破坏处理)、细胞分离处理、纯化处理及提取处理组成的组中的1种以上的处理。例如,可将转化体的细胞从培养基等中分离,将被分离的细胞添加至反应体系。这样的分离可使用过滤或离心分离等手段。或者,可实施用于将经修饰的doi合酶从夹杂物中分离的纯化处理,将含有通过该纯化处理得到的酶的溶液添加至反应体系。或者,可将使用甲醇、乙腈等有机溶剂或有机溶剂与水的混合溶剂对培养物进行提取而得到的提取物添加至反应体系。这样的纯化物或提取物也可不含有转化体的细胞。即使该转化体的细胞不存在,只要酶的活性残留,则仍然可用于反应。
上述那样的细胞的破碎或者溶解处理可通过按照溶菌酶处理、冻融、超声波破碎等已知的方法将转化体的细胞膜破坏来进行。
本公开文本涉及的转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物与葡萄糖或葡萄糖-6-磷酸的接触优选在以下这样的条件下进行。
接触优选在含有作为底物的葡萄糖或葡萄糖-6-磷酸的溶液中进行。当然,溶液可含有葡萄糖和葡萄糖-6-磷酸这二者。从反应的效率等考虑,反应优选在nad、nadp等辅酶的存在下进行。
对于反应条件而言,只要上述反应进行即可,没有特别限定。例如,溶液的ph只要可维持经修饰的doi合酶的酶活性即可,没有特别限定,例如,反应时的ph优选为4.0~9.0的范围内的ph,优选为5.0~8.0的范围内的ph,更优选为6.0~8.0的范围内的ph。溶液的温度也只要可维持经修饰的doi合酶的酶活性即可,没有特别限定,优选为10℃~50℃的范围内的温度,更优选为20℃~45℃的范围内的温度,进一步更优选为30℃~42℃的范围内的温度。
作为溶液的介质,可使用水或水性介质、有机溶剂或者水或水性介质与有机溶剂的混合液。作为水性介质,可使用例如磷酸缓冲液、hepes(n-2-羟乙基哌嗪-n-乙磺酸)缓冲液、tris[三(羟甲基)氨基甲烷]盐酸缓冲液等缓冲液。作为有机溶剂,只要是不阻碍反应的有机溶剂即可,可使用例如丙酮、乙酸乙酯、二甲基亚砜、二甲苯、甲醇、乙醇、丁醇等。或者,溶液可以是液体培养基。
本公开文本涉及的转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物与葡萄糖或葡萄糖-6-磷酸的接触优选在振荡或搅拌下进行。例如,这样的接触可在溶液中进行。例如,可向含有前述转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物的溶液中以底物溶液的形态或以固体的形态添加葡萄糖或葡萄糖-6-磷酸。
在反应开始时或反应中途,为了将反应液的ph维持为合适的范围,可添加酸、碱。作为可添加至反应溶液中的碱的例子,可举出将氢氧化锂、氢氧化钠、氢氧化钾等碱金属氢氧化物、以及氢氧化铵、氢氧化钙、磷酸氢二钾、磷酸氢二钠、焦磷酸钾、氨等溶解于水、使液性为碱性的物质。作为可添加至反应溶液的酸的例子,可举出盐酸、硫酸、硝酸、乙酸、磷酸等。
上述接触可在例如空气气氛下进行,也可在脱氧气氛下进行。脱氧气氛可通过利用非活性气体的置换、减压、沸腾、或将它们组合而实现。至少利用非活性气体的置换、即、使用非活性气体气氛是合适的。作为上述非活性气体,可举出例如氮气、氦气、氩气、二氧化碳等,优选为氮气。
优选的实施方式中,所使用的转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物含有前述经修饰的doi合酶。因此,通过前述接触,反应溶液中共存的前述经修饰的doi合酶发挥作用,以高生产效率生产doi。需要说明的是,前述转化体的处理物或前述培养物的处理物并非必须含有存活状态的前述转化体,但从能够通过代谢而持续性地供给参与反应的物质的观点考虑,优选含有存活状态的前述转化体。
对于转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物的添加时机而言,可以在反应开始时一并添加,也可以在反应中分开或连续地添加。同样地,成为原料的葡萄糖或葡萄糖-6-磷酸也可以在反应开始时一并添加,也可以在反应中分开或连续地添加。
葡萄糖或葡萄糖-6-磷酸在反应溶液中的浓度可以为例如0.1质量%~20质量%,或者0.5质量%~15质量%,或者2质量%~10质量%。
作为使前述转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物与葡萄糖或葡萄糖-6-磷酸接触的方法,可举出下述方法:将前述转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物添加至含有葡萄糖或葡萄糖-6-磷酸的溶液,一边搅拌一边使反应进行的方法;将前述转化体的培养物、或者前述转化体或前述培养物的处理物添加至含有葡萄糖或葡萄糖-6-磷酸的溶液,一边振荡一边使反应进行的方法;将前述转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物与吡哆醇或其盐在溶液中充分地混和,然后静置使反应进行的方法;等等。从反应效率的观点考虑,可优选举出将前述转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物添加至含有葡萄糖或葡萄糖-6-磷酸的溶液中、一边搅拌一边使反应进行的方法。
作为可用于反应的反应容器,没有特别限定。优选的是,所述反应容器能够以将添加的前述转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物与含有吡哆醇或其盐的溶液充分混合的方式进行搅拌,并且具有温度调节功能,从而保持在经修饰的doi合酶的最适温度范围内。
对于前述转化体、前述转化体的培养物、或者前述转化体或前述培养物的处理物与葡萄糖或葡萄糖-6-磷酸的接触时间(反应时间)而言,只要可维持经修饰的doi合酶的酶活性即可,没有特别限定,可以为例如30分钟~100小时,或者2小时~50小时。另外,反应可批量式进行,可半批量式(在反应中途逐次添加底物及前述微生物、前述培养物或前述处理物中的一者或两者)进行,也可连续式进行。半批量式、连续式的情况下,因为进行供给新的原料及前述转化体、前述培养物或前述处理物中的一者或两者等操作,所以反应时间的上限没有特别限定。例如,可连续地添加葡萄糖或葡萄糖-6-磷酸。
一个实施方式中,doi的制造方法包括在培养基中培养本公开文本涉及的转化体的工序。培养基优选为液体培养基,另外,优选含有葡萄糖或葡萄糖-6-磷酸。为通过csca的导入等提高了果糖利用能力的转化体时,培养基还可含有果糖。关于可使用的培养基及培养条件、培养方法等,可应用上述的可用于转化体的培养的培养基、培养条件、培养方法等。例如,可使用2×yt液体培养基等。也可向这样的培养基中添加葡萄糖或葡萄糖-6-磷酸,使得培养基中含有所期望的浓度的葡萄糖或葡萄糖-6-磷酸。培养温度可以为例如25℃~35℃的范围内的温度,培养时间可以为例如5小时~30小时。葡萄糖或葡萄糖-6-磷酸在培养基中的浓度可以为例如0.1质量%~20质量%,或者0.5质量%~15质量%,或者1.5质量%~10质量%。通过这样的培养,可基于转化体的存在而产生doi。
在用于生产doi的培养(以下也称为主培养)之前,可对转化体进行预培养。用于预培养的培养基也可以是与用于doi生产的培养中所使用的培养基不同的培养基。培养基的差异可以是基础培养基的差异,也可以是葡萄糖或葡萄糖-6-磷酸的浓度的差异。关于用于预培养的培养基、培养条件、培养方法等,可应用上述的可用于转化体的培养中的培养基、培养条件、培养方法等。用于预培养的培养基也可以是不含葡萄糖和葡萄糖-6-磷酸的培养基。作为用于预培养的培养基的例子,可举出rm液体培养基、rmm液体培养基,但也可以是2×yt液体培养基。预培养进行至转化体的状态稳定即可,预培养时间可以为例如3小时~48小时、或者8小时~30小时。预培养后的转化体可以连同培养基直接添加至用于主培养的培养基,也可在通过离心处理等将转化体从用于预培养的培养基中分离后添加至用于主培养的培养基。通常,主培养的培养液量可以是大于预培养的培养液量的培养用量,例如以体积计为10倍以上、或者20倍以上。
主培养可批量式进行,可半批量式(在反应中途逐次添加葡萄糖或葡萄糖-6-磷酸)进行,也可连续式(连续地添加葡萄糖或葡萄糖-6-磷酸)进行。半批量式、连续式的情况下,因为进行供给新的原料等操作,所以反应时间的上限没有特别限定。
上述的方法中,通过以葡萄糖或葡萄糖-6-磷酸作为原料、使用本公开文本涉及的转化体或前述培养物、或者前述转化体或前述培养物的处理物,能够以高生产效率制造doi。通过上述的方法得到的doi可转变为例如儿茶酚而用于神经系统医药品等的原料、食品香料原料、头发护理商品等的抗氧化剂等,可转变为氢醌而用于止血剂、镇痛剂等的原料、美白剂等化妆品等。通过将使用上述的方法得到的doi脱水,可得到1,2,4-三羟基苯(thb)。通过进一步将使用上述的方法得到的thb的羟基进行缩水甘油醚化,可得到1,2,4-三缩水甘油基氧基苯(1,2,4-triglycidyloxybenzene)(tgb)。tgb的耐热性优异,且在常温为低粘度的液状,可在电子部件的密封材料、电路基材、粘合剂、涂覆材料、涂料、复合材料的基体树脂等广泛范围内利用。
需要说明的是,本说明书中的术语“工序”并非仅指独立的工序,即使在无法与其他工序明确区分的情况下,只要能够实现该工序所期望的目的,则也包含在本术语中。另外,本说明书中使用“~”示出的数值范围表示将“~”的前后所记载的数值分别作为最小值及最大值包含在内的范围。
本说明书中,提到组合物中的各成分的量时,在属于组合物中的各成分的物质存在多种的情况下,只要没有特别说明,则表示组合物中存在的该多种物质的总量。
实施例
以下,通过实施例具体地说明实施方式,但本公开文本并非基于这些实施例来限定其技术范围。需要说明的是,实施例中,只要没有特别说明,则表示物质的含量或添加量的“%”含义为“质量%”。
(实施例1)
<利用易错pcr的突变型doi合酶基因克隆文库的构建>
从使用了易错pcr的突变型doi合酶基因克隆文库的制备到doi高产doi合酶基因突变克隆的分离(1、2、3级筛选)为止的工序示于图3a~图3d。
通过易错pcr向编码序列号1所示的来源于环状芽孢杆菌的doi合酶的氨基酸序列的基因(btrc)中随机地导入突变。以含有btrc基因全长的质粒plex-btrc(国际公开第2006/109479号中记载的、将编码来源于环状芽孢杆菌的doi合酶的42kda亚基的btrc基因插入载体plex(invitrogen)的多克隆位点即ndei-xbai位点而得到的质粒)作为模板,使用相当于在btrc基因的起始密码子上游添加sali限制性内切酶位点而得到的核苷酸序列的序列号2所示的引物1(5’-acgcgtcgacatgacgactaaacaaatttg-3’)、和相当于在btrc基因的终止密码子上游添加psti限制性内切酶位点而得到的核苷酸序列的序列号3所示的引物2(5’-aaaactgcagttacagcccttcccgga-3’),在使dna聚合酶的正确性降低的条件(表2)下实施pcr,由此在不限定突变位点的情况下向btrc基因整个区域导入随机突变。
[表2]
易错pcr反应条件
对于pcr而言,于94℃保持2分钟30秒后,以于94℃下20秒的热变性、于50℃下25秒的退火、于72℃下1分钟1o秒的dna延伸的反应作为1个循环,实施30个循环,进一步于72℃保持3分钟,将得到的pcr扩增产物保持于4℃。
对上述pcr扩增得到的dna片段用苯酚/氯仿进行处理,离心分离,将上清液进行乙醇沉淀,回收dna片段。使用限制性内切酶sali和psti消化所回收的dna片段,通过琼脂糖凝胶电泳进行纯化·分离,获得突变型doi合酶基因的dna片段。
然后,构建用于使突变型doi合酶基因的dna片段在宿主细胞(大肠杆菌)中表达的表达载体。将plex载体(invitrogen)作为模板,使用序列号4所示的引物3(5’-atggtaccgagctcggatcc-3’)、和相当于在5’侧添加xbai限制性内切酶位点而得到的核苷酸序列的序列号5所示的引物4(5’-ctagtctagactaggagataatttatcaccgcag-3’),实施pcr扩增。pcr扩增使用了kod聚合酶(toyobo)。pcr的反应条件为:于94℃保持2分钟后,以于94℃下30秒的热变性、于52℃下30秒的退火、于68℃下1分钟的dna延伸的反应作为1个循环,实施30个循环,进一步于68℃保持2分钟,将得到的pcr扩增产物保持于4℃。对上述pcr扩增得到的dna片段用苯酚/氯仿进行处理,离心分离,将上清液进行乙醇沉淀,回收dna片段。使用限制性内切酶sali和xbai消化所回收的dna片段,通过琼脂糖凝胶电泳进行纯化·分离,获得表达载体的dna片段。
然后,作为用于使突变型doi合酶基因的dna片段在宿主细胞(大肠杆菌)中表达的启动子,获得了gada启动子。gada启动子具体而言如下获得。将大肠杆菌的染色体dna作为模板,使用相当于在5’侧添加xbai限制性内切酶位点而得到的核苷酸序列的序列号6所示的引物5(5’-ctagtctagagtcgtttttctgct-3’)、和相当于在5’侧添加sali限制性内切酶位点而得到的核苷酸序列的序列号7所示的引物6(5’-acgcgtcgacttcgaactccttaaatttatttgaaggc-3’),实施pcr扩增。pcr扩增使用了kod聚合酶(toyobo)。pcr的反应条件为:于94℃保持2分钟后,以于94℃下30秒的热变性、于50℃下30秒的退火、于68℃下1分钟的dna延伸的反应作为1个循环,实施30个循环,进一步于68℃保持2分钟,将得到的pcr扩增产物保持于4℃。对上述pcr扩增得到的dna片段用苯酚/氯仿进行处理,离心分离,将上清液进行乙醇沉淀,回收dna片段。使用限制性内切酶sali和xbai消化所回收的dna片段,通过琼脂糖凝胶电泳进行纯化·分离,获得gada启动子的dna片段。
然后,使用2×ligationmix,使上述中扩增得到的表达载体的dna片段与gada启动子的dna片段于16℃反应30分钟进行连接,从而将gada启动子的dna片段插入表达载体的dna片段,获得表达载体pgadp(图4)。
使用限制性内切酶sali和psti消化通过上述操作得到的表达载体pgadp,通过琼脂糖凝胶电泳进行纯化·分离,连接并插入突变型doi合酶基因的dna片段,由此得到突变型doi合酶基因(mbtrc)的分子群。
将通过上述操作获得的分子群转化至大肠杆菌dh5α的感受态细胞,构建突变型doi合酶基因克隆文库。
(实施例2)
<doi高产doi合酶基因突变克隆的分离>
从通过上述操作获得的突变型doi合酶基因克隆文库中提取突变型doi合酶基因文库(pgadp-mbtrc,图5),转化至高水平蓄积作为doi合酶的底物的葡萄糖-6-磷酸的大肠杆菌gi724δpgi株(国际公开第2006/109479号及kakinuma等,tetrahedronletters,2000,vol.41,p.1935中记载的、将大肠杆菌gi724株中的pgi基因破坏而得到的菌株)的感受态细胞。在l琼脂培养基(1%胰蛋白胨、0.5%酵母提取物、0.5%nacl、2%琼脂、100μg/ml氨苄青霉素)中培养转化细胞,将生长的克隆作为doi合酶基因突变克隆的分离的筛选对象。
1级筛选中,首先,将得到的筛选对象克隆接种于各装有rm液体培养基(2%酪蛋白氨基酸、1%甘油、0.6%na2hpo4、0.3%kh2po4、0.05%nacl、0.1%nh4cl、1mmmgcl2、100μg/ml氨苄青霉素)1ml的深孔板(96孔圆底),于30℃振荡24小时,进行预培养。然后,分别将10μl预培养液接种于各装有1级筛选用2×yt液体培养基(1.6%胰蛋白胨、1%酵母提取物、0.5%nacl、1%葡萄糖、100μg/ml氨苄青霉素)1ml的深孔板(96孔圆底),于30℃振荡15小时,进行主培养。将离心分离主培养后的培养液并除去了菌体所得到的上清液10μl、灭菌蒸馏水90μl、甲醇100μl、肟化试剂nbha(20mg/ml)混合,于60℃进行1小时肟化反应。肟化反应后,在减压浓缩离心机中干固,再次溶解于甲醇200μl中后,在表3的条件下进行hplc分析,确定doi浓度,筛选较之具有野生型doi合酶基因的克隆而言doi产量更多的候选克隆。
[表3]
doi定量测定中的hplc分析条件
以1级筛选中得到的候选克隆作为对象,实施2级筛选。2级筛选中,将1级筛选中得到的候选克隆接种于各装有rm液体培养基3ml的试管,于30℃振荡24小时,进行预培养。然后,将预培养液接种于各装有2级筛选用2×yt液体培养基(1.6%胰蛋白胨、1%酵母提取物、0.5%nacl、2%葡萄糖、100μg/ml氨苄青霉素)50ml的500ml三角烧瓶中,使得浊度od600=0.1,于30℃振荡36小时,进行主培养。针对将主培养开始0、12、24、36小时后的培养液离心分离并除去菌体而得到的上清液10μl,实施与1级筛选中的doi浓度测定操作同样的操作,从而利用hplc确定doi浓度,筛选较之具有序列号1的氨基酸序列的野生型doi合酶基因的克隆而言doi产量更多的候选克隆。
以2级筛选中得到的候选克隆作为对象,实施3级筛选。从2级筛选得到的克隆中纯化分离质粒载体,转化至高水平蓄积作为doi合酶的底物的葡萄糖-6-磷酸的大肠杆菌gi724δpgiδzwfδpgm株(国际公开第2006/109479号及kakinuma等,tetrahedronletters,2000,vol.41,p.1935中记载的、将大肠杆菌gi724株中的pgi基因、zwf基因及pgm基因破坏而得到的菌株)的感受态细胞。在l琼脂培养基(1%胰蛋白胨、0.5%酵母提取物、0.5%nacl、2%琼脂、100μg/ml氨苄青霉素)中培养转化细胞,将生长的克隆用于3级筛选。3级筛选中,首先,将得到的筛选对象克隆接种于各装有rmm液体培养基(2%酪蛋白氨基酸、0.5%甘露糖醇、0.6%na2hpo4、0.3%kh2po4、0.05%nacl、0.1%nh4cl、1mmmgcl2、100μg/ml氨苄青霉素)3ml的试管,于30℃振荡24小时,进行预培养。然后,将预培养液接种于各装有3级筛选用2×yt液体培养基(1.6%胰蛋白胨、1%酵母提取物、0.5%nacl、2%葡萄糖、2%甘露糖醇、100μg/ml氨苄青霉素)50ml的500ml带隔板三角烧瓶,使得浊度od600=0.1,于30℃振荡36小时,进行主培养。针对将主培养开始0、12、24、36小时后的培养液离心分离并除去菌体而得到的上清液10μl,实施与1级筛选中的doi浓度测定操作同样的操作,从而利用hplc确定doi浓度,筛选较之具有序列号1的氨基酸序列的野生型doi合酶基因的克隆而言doi产量更多的候选克隆(图6)。图6中,◆所表示的数据系列为基于具有序列号1的氨基酸序列的野生型doi合酶基因的克隆的doi产量,■所表示的数据系列为基于较之具有野生型doi合酶基因的克隆而言doi产量更多的候选克隆的doi产量。
(实施例3)
<突变型doi合酶基因的碱基序列的分析>
为了确定doi合酶基因的突变点,对上述3级筛选中得到的克隆的doi合酶基因进行碱基序列分析。分析用引物使用序列号8所示的引物7(5’-ggagccaaccgaagaacc-3’)、序列号9所示的引物8(5’-ctagtctagagtcgtttttctgct-3’)、序列号10所示的引物9(5’-acctgatgcccgaacatg-3’)、序列号11所示的引物10(5’-agatcgaatccgggtccg-3’)合计4种引物,利用beckmancoulterinc制的dtcsquickstartkit,进行pcr反应,利用beckmancoulterinc制的ceq8000遗传分析仪分析该反应试样。分析的结果是,doi合酶基因(btrc)的自起始密码子起第877位的t被碱基取代为a。即,n末端起第293位的色氨酸被氨基酸取代为精氨酸。如此,获得了编码较之序列号1的氨基酸序列的野生型doi合酶而言提高了doi生产率的突变型doi合酶的基因(btrc(w293r))。
(实施例4)
<野生型及突变型doi合酶的生产及纯化>
将含有序列号1的氨基酸序列的野生型doi合酶的质粒载体plex-btrc(记载于国际公开第2006/109479号)作为模板,使用相当于在btrc基因的起始密码子上游添加bamhi限制性内切酶位点而得到的核苷酸序列的序列号12所示的引物11(5’-cgcggatccatgacgactaaacaaattt-3’)、和相当于在btrc基因的终止密码子上游添加hindiii限制性内切酶位点而得到的核苷酸序列的序列号13所示的引物12(5’-cccaagcttttacagcccttccccgatc-3’),利用pcr法扩增btrc基因的核苷酸序列,与大肠杆菌重组蛋白质高表达载体pqe80l(qiagen)连接,转化至大肠杆菌dh5α,得到质粒pqe80l-btrc。通过与pqe80l载体连接,可生产组氨酸标签序列与doi合酶融合而成的重组doi合酶。通过离心来回收作为重组蛋白质使doi合酶高水平表达的大肠杆菌,然后悬浮于裂解缓冲液(500mm磷酸盐缓冲液(ph7.7)、300mmnacl、0.2mmcocl2·6h2o)中。将悬浮液置于超声波破碎机中,将大肠杆菌破碎后,通过离心将重组doi合酶回收至上清液。将上清液和与组氨酸标签序列特异性结合的ni-nta琼脂糖混合,使doi合酶与ni-nta琼脂糖结合,然后加入洗涤缓冲液(500mm磷酸盐缓冲液(ph7.7)、30mm咪唑、0.2mmcocl2·6h2o)进行洗涤,离心,弃去上清液。向结合有重组doi合酶的ni-nta琼脂糖中加入洗脱缓冲液(50mm磷酸盐缓冲液(ph7.7)、200mm咪唑、0.2mmcocl2·6h2o),将重组doi合酶洗脱,从而能够纯化高纯度的重组doi合酶。
同样地,针对突变型doi合酶(btrc(w293r)),将上述中获得的含有突变型doi合酶(btrc(w293r))的质粒载体作为模板,使用相当于在btrc基因的起始密码子上游添加bamhi限制性内切酶位点而得到的核苷酸序列的序列号12所示的引物11(5’-cgcggatccatgacgactaaacaaattt-3’)、和相当于在btrc基因的终止密码子上游添加hindiii限制性内切酶位点而得到的核苷酸序列的序列号13所示的引物12(5’-cccaagcttttacagcccttccccgatc-3’),利用pcr法来扩增btrc(w293r)基因的核苷酸序列,与大肠杆菌重组蛋白质高水平表达载体pqe80l(qiagen)连接,转化至大肠杆菌dh5α,得到质粒pqe80l-btrc(w293r)。通过同样的方法生产、纯化重组突变型doi合酶。
(实施例5)
<野生型及突变型doi合酶的活性测定>
使用葡萄糖-6-磷酸、nad+测定实施例4中纯化的野生型及突变型doi合酶的酶活性。分析的反应溶液的组成为50mm磷酸盐缓冲液(ph7.7)、5mm葡萄糖-6-磷酸、5mmβ-nad+、0.2mmcocl2·6h2o、野生型或突变型doi合酶10μg,使其于46℃反应5分钟。反应后,对反应溶液进行苯酚/氯仿处理,除去蛋白质,将离心后的水层组分10μl作为试样,通过使用了用于实施例2中1级筛选中的doi浓度测定的hplc的方法来定量doi,算出活性。另外,将doi合酶1mg每1分钟合成的doi的量作为比活性。突变型doi合酶(w293r)的doi合酶活性较之序列号1的氨基酸序列的野生型doi合酶的活性而言,为1.5倍高的活性(图7)。
(实施例6)
为了获得进一步提高了doi生产率的突变型doi合酶基因,将含有突变型doi合酶基因(w293r)的质粒作为模板,通过实施例1所示的易错pcr法,构建新的突变型doi合酶基因克隆文库。接下来,实施实施例2的doi合酶基因突变克隆的分离中示出的1、2、3级筛选,获得较之含有突变型doi合酶基因(w293r)的克隆而言进一步提高了doi生产率的克隆(图8)。图8中,◆所表示的数据系列表示含有pgadp-btrc的大肠杆菌gi724δpgiδzwfδpgm株的doi产量,■所表示的数据系列表示含有pgadp-btrc(w293r)的大肠杆菌gi724δpgiδzwfδpgm株的doi产量,▲所表示的数据系列、×所表示的数据系列、+所表示的数据系列、及·所表示的数据系列表示含有各自不同的突变型doi合酶基因的大肠杆菌gi724δpgiδzwfδpgm株的doi产量。
然后,与实施例3的突变型doi合酶基因的碱基序列的分析同样地实施碱基序列分析,结果,如表4所示,得到了以下的4种突变型doi合酶基因。
doi合酶基因(btrc)的自起始密码子起第877位的t被碱基取代为a,从而序列号1的n末端起第293位的色氨酸被氨基酸取代为精氨酸,且doi合酶基因(btrc)的自起始密码子起第41位的a被碱基取代为c,从而序列号1的n末端起第14位的天冬酰胺被氨基酸取代为苏氨酸的突变型doi合酶基因(btrc(w293r/n14t))。
doi合酶基因(btrc)的自起始密码子起第877位的t被碱基取代为a,从而序列号1的n末端起第293位的色氨酸被氨基酸取代为精氨酸,且doi合酶基因(btrc)的自起始密码子起第110位的a被碱基取代为t,从而序列号1的n末端起第37位的酪氨酸被氨基酸取代为苯丙氨酸的突变型doi合酶基因(btrc(w293r/y37f))。
doi合酶基因(btrc)的自起始密码子起第877位的t被碱基取代为a,从而序列号1的n末端起第293位的色氨酸被氨基酸取代为精氨酸,且doi合酶基因(btrc)的自起始密码子起第868位的g被碱基取代为a,从而序列号1的n末端起第290位的丙氨酸被氨基酸取代为苏氨酸的突变型doi合酶基因(btrc(w293r/a290t))。
doi合酶基因(btrc)的自起始密码子起第877位的t被碱基取代为a,从而序列号1的n末端起第293位的色氨酸被氨基酸取代为精氨酸,且doi合酶基因(btrc)的自起始密码子起第956位的a被碱基取代为g,从而序列号1的n末端起第319位的组氨酸被氨基酸取代为精氨酸的突变型doi合酶基因(btrc(w293r/h319r))。
[表4]
突变型doi合酶其因的变异位点
针对含有野生型doi合酶基因克隆、含有具有w293r突变的突变型doi合酶基因的克隆、及表4所示的各克隆的doi产量(示于图8),在以下的表5中示出了数值。
[表5]
表中的数值表示培养基中的doi浓度(g/l)。doi浓度表示为3次测定的平均值,括号内的数值表示标准偏差。
然后,与实施例4同样地生产、纯化上述4种(btrc(w293r/n14t))、(btrc(w293r/y37f))、(btrc(w293r/a290t))、(btrc(w293r/h319r))突变型doi合酶。然后,与实施例5同样地实施野生型doi合酶和各突变型doi合酶的分析,对活性进行比较,结果如下:
突变型doi合酶(w293r/n14t)的doi合酶活性较之序列号1的氨基酸序列的野生型doi合酶的活性而言,为1.92倍高的活性(图9);
突变型doi合酶(w293r/y37f)的doi合酶活性较之序列号1的氨基酸序列的野生型doi合酶的活性而言,为1.57倍高的活性(图9);
突变型doi合酶(w293r/a290t)的doi合酶活性较之序列号1的氨基酸序列的野生型doi合酶的活性而言,为1.45倍高的活性(图9);
突变型doi合酶(w293r/h319r)的doi合酶活性较之序列号1的氨基酸序列的野生型doi合酶的活性而言,为1.83倍高的活性(图9);
以上4种突变型doi合酶基因均较之序列号1的氨基酸序列的野生型doi合酶而言活性更高。
(实施例7)
<导入了突变型doi合酶基因(btrc(w293r/h319r))的转化体的doi发酵生产率>
构建用于使突变型doi合酶基因(btrc(w293r/h319r))的dna片段在宿主细胞(大肠杆菌)中表达的表达载体。具体而言,将plex载体(invitrogen)作为模板,使用序列号4所示的引物3(5’-atggtaccgagctcggatcc-3’)、和在5’侧具有bamhi限制性内切酶位点的序列号14所示的引物13(5’-cgcggatccgagataatttatcaccgcag-3’),实施pcr扩增。pcr扩增使用了kod聚合酶(toyobo)。pcr的反应条件为:于94℃保持2分钟后,以于94℃下30秒的热变性、于50℃下30秒的退火、于68℃下1分钟的dna延伸的反应作为1个循环,实施30个循环,进一步于68℃保持2分钟,将得到的pcr扩增产物保持于4℃。对上述pcr扩增得到的dna片段用苯酚/氯仿进行处理,离心分离,将上清液进行乙醇沉淀,回收dna片段。使用限制性内切酶bamhi和psti消化所回收的dna片段,通过琼脂糖凝胶电泳纯化·分离,获得表达载体的dna片段。
然后,作为用于使突变型doi合酶基因(btrc(w293r/h319r))的dna片段在宿主细胞(大肠杆菌)中表达的启动子,获得了gapa启动子。gapa启动子具体而言如下获得。将大肠杆菌的染色体dna作为模板,使用在5’侧具有bamhi限制性内切酶位点的序列号15所示的引物14(5’-cgcggatccgcgggaagagtgaggcgagtc-3’)、和在5’侧添加有磷酸基的序列号16所示的引物15(5’-atattccaccacctatttg-3’),实施pcr扩增。pcr扩增使用了kod聚合酶(toyobo)。pcr的反应条件为:于94℃保持2分钟后,以于94℃下30秒的热变性、于50℃下30秒的退火、于68℃下1分钟的dna延伸的反应作为1个循环,实施30个循环,进一步于68℃保持2分钟,将得到的pcr扩增产物保持于4℃。对上述pcr扩增得到的dna片段用苯酚/氯仿进行处理,离心分离,将上清液进行乙醇沉淀,回收gapa启动子的dna片段。
然后,将含有突变型doi合酶基因(btrc(w293r/h319r))的质粒作为模板,使用在5’侧添加有磷酸基的序列号17所示的引物16(5’-atgacgactaaacaaatttgttttgcgg-3’)、和在5’侧具有psti限制性内切酶位点的序列号18所示的引物17(5’-aaaactgcagttacagcccttcccggatc-3’),实施pcr扩增。pcr扩增使用了kod聚合酶(toyobo)。pcr的反应条件为:于94℃保持2分钟后,以于94℃下30秒的热变性、于50℃下30秒的退火、于68℃下1分钟的dna延伸的反应作为1个循环,实施30个循环,进一步于68℃保持2分钟,将得到的pcr扩增产物保持于4℃。对上述pcr扩增得到的dna片段用苯酚/氯仿进行处理,离心分离,将上清液进行乙醇沉淀,回收突变型doi合酶基因(btrc(w293r/h319r))的dna片段。
然后,使用2×ligationmix,使上述中扩增得到的gapa启动子的dna片段与突变型doi合酶基因(btrc(w293r/h319r))的dna片段于16℃反应30分钟。将如此得到的连接(ligation)产物作为模板,使用序列号15所示的引物14和序列号18所示的引物17,实施pcr扩增。pcr扩增使用了kod聚合酶(toyobo)。pcr的反应条件为:于94℃保持2分钟后,以于94℃下30秒的热变性、于50℃下30秒的退火、于68℃下1分钟的dna延伸的反应作为1个循环,实施30个循环,进一步于68℃保持2分钟,将得到的pcr扩增产物保持于4℃。对上述pcr扩增得到的dna片段用苯酚/氯仿进行处理,离心分离,将上清液进行乙醇沉淀,回收dna片段。使用限制性内切酶bamhi和psti消化回收的dna片段,通过琼脂糖凝胶电泳纯化·分离,获得表达载体的dna片段。将该dna片段连接并插入上述的表达载体的dna片段,得到质粒pgapp-btrc(w293r/h319r)(图10)。另外,通过同样的方法得到插入有序列号1的氨基酸序列的野生型doi合酶基因的pgapp-btrc(图11)。
纯化分离质粒pgapp-btrc(w293r/h319r)及pgapp-btrc,转化至高水平蓄积作为doi合酶的底物的葡萄糖-6-磷酸的大肠杆菌gi724δpgiδzwfδpgm株(记载于国际公开第2006/109479号及kakinuma等,tetrahedronletters,2000,vol.41,p.1935)的感受态细胞。将转化细胞接种于装有2×yt液体培养基(1.6%胰蛋白胨、1%酵母提取物、100μg/ml氨苄青霉素)3ml的试管,于30℃振荡24小时,进行预培养。然后,将预培养液接种于各装有评价培养用2×yt液体培养基(1.6%胰蛋白胨、1%酵母提取物、0.5%nacl、5%葡萄糖、5%甘露糖醇、100μg/ml氨苄青霉素)50ml的500ml带隔板三角烧瓶,使得浊度od600=0.1,于30℃振荡60小时,进行主培养。针对将主培养开始0、12、24、36、48、60小时后的培养液离心分离、除去菌体而得到的上清液10μl,实施与实施例2中1级筛选中的doi浓度测定操作同样的操作,从而利用hplc确定doi浓度。另外,也一同测定菌体的浊度、培养基中的葡萄糖浓度、甘露糖醇浓度。菌体浊度使用分光光度计于600nm测定吸光度,葡萄糖浓度使用和光纯药工业株式会社制的葡萄糖cii-testwako进行测定,甘露糖醇浓度使用magazyme公司制的甘露糖醇分析试剂盒进行测定。
图12a中示出了培养基的浊度的时间曲线,图12b中示出了培养基中的葡萄糖浓度的时间曲线,图12c中示出了培养基中的甘露糖醇浓度的时间曲线,以及,图12d中示出了doi产量的时间曲线。含有pgapp-btrc(w293r/h319r)的大肠杆菌gi724δpgiδzwfδpgm株(图12a~图12d中的▲所表示的数据系列)显示出含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(图12a~图12d中的■所表示的数据系列)的约2倍的doi生产速度。
(实施例8)
<导入了突变型doi合酶基因(btrc(h319r))的转化体的doi发酵生产率>
构建用于使突变型doi合酶基因(btrc(h319r))的dna片段在宿主细胞(大肠杆菌)中表达的表达载体。将插入有序列号1的氨基酸序列的野生型doi合酶基因的pgapp-btrc(图11)作为模板,使用序列号19所示的引物18(5’-ttccattatttaatccgcgataacaagagg-3’)和序列号20所示的引物19(5’-cctcttgttatcgcggattaaataatggaa-3’),实施pcr扩增。pcr扩增使用了kod聚合酶(toyobo)。pcr的反应条件为:于94℃保持2分钟后,以于98℃下15秒的热变性、于55℃下30秒的退火、于68℃下6分钟的dna延伸的反应作为1个循环,实施20个循环,进一步于68℃保持3分钟,将得到的pcr扩增产物保持于4℃。使用限制性内切酶dpni消化上述pcr扩增得到的dna片段,转化至大肠杆菌dh5α,得到质粒pgapp-btrc(h319r)(图13)。
纯化分离质粒pgapp-btrc(h319r)及pgapp-btrc,转化至高水平蓄积作为doi合酶的底物的葡萄糖-6-磷酸的大肠杆菌gi724δpgiδzwfδpgm株(记载于国际公开第2006/109479号及kakinuma等,tetrahedronletters,2000,vol.41,p.1935)的感受态细胞。将转化细胞接种于装有2×yt液体培养基(1.6%胰蛋白胨、1%酵母提取物、100μg/ml氨苄青霉素)3ml的试管,于30℃振荡24小时,进行预培养。然后,将预培养液接种于各装有评价培养用2×yt液体培养基(1.6%胰蛋白胨、1%酵母提取物、0.5%nacl、3%葡萄糖、4%甘露糖醇、100μg/ml氨苄青霉素)30ml的200ml带隔板三角烧瓶,使得浊度od600=0.1,于30℃振荡48小时,进行主培养。针对将主培养开始o、12、24、36、48小时后的培养液离心分离、除去菌体而得到的上清液10μl,实施与实施例2中1级筛选中的doi浓度测定操作同样的操作,从而利用hplc确定doi浓度。另外,也一同测定菌体的浊度、培养基中的葡萄糖浓度、甘露糖醇浓度。菌体浊度使用分光光度计于600nm测定吸光度,葡萄糖浓度使用和光纯药工业株式会社制的葡萄糖cii-testwako进行测定,甘露糖醇浓度使用magazyme公司制的甘露糖醇分析试剂盒进行测定。
图14a中示出了培养基的浊度的时间曲线,图14b中示出了培养基中的葡萄糖浓度的时间曲线,图14c中示出了培养基中的甘露糖醇浓度的时间曲线,以及,图14d中示出了doi产量的时间曲线。含有pgapp-btrc(h319r)的大肠杆菌gi724δpgiδzwfδpgm株(图14a~图14d中的▲所表示的数据系列)显示出含有pgapp-btrc的大肠杆菌gi724δpgiδzwfδpgm株(图14a~图14d中的■所表示的数据系列)的约1.2倍的doi生产速度。
(实施例9)
<导入了突变型doi合酶基因(btrc(w293r/n14t)、(w293r/h319r))的转化体的发酵罐中的doi发酵生产率评价>发酵罐的培养中使用了与实施例8不同的宿主和表达载体。宿主使用了高水平蓄积作为doi合酶底物的葡萄糖-6-磷酸的大肠杆菌mg1655δpgiδzwf株(国际公开第2010/053052号中记载的、将大肠杆菌mg1655株中的pgi基因及zwf基因破坏而得到的菌株)。另一方面,关于表达载体,如下所述地进行制备。
将含有doi合酶基因(btrc)的质粒载体pgap-btrc-csca-glf(国际公开第2010/053052号中记载的、将gadph启动子、环状芽孢杆菌的doi合酶基因btrc、来源于大肠杆菌o-157株的蔗糖水解酶基因csca及来源于运动发酵单胞菌的葡萄糖转运促进蛋白质基因glf的表达单元组入pbr322(genbank登录号j01749)而得到的质粒载体)作为模板,使用序列号21所示的引物20(5’-cattacaggcttttaaataaaatcggg-3’)、序列号22所示的引物21(5’-taaaagcctgtaatgggcggacacgtc-3’),实施pcr扩增。pcr扩增使用了primestarmaxdnapolymerase(takara)。pcr的反应条件为:以于98℃下10秒的热变性、于55℃下15秒的退火、于72℃下40秒的dna延伸反应作为1个循环,实施30个循环。将上述扩增得到的pcr产物转化至大肠杆菌dh5α,得到含有突变型doi合酶基因(btrc(w293r))的质粒载体pgapp-btrc(w293r)-csca-glf。(图15)
将含有突变型doi合酶基因(btrc(w293r))的质粒载体pgapp-btrc(w293r)-csca-glf作为模板,使用序列号23所示的引物22(5’-tgttttacctttgcattcggcgaacat-3’)、序列号24所示的引物23(5’-tgcaaaggtaaaacaccggtccgcaaa-3’),实施pcr扩增。pcr扩增使用了primestarmaxdnapolymerase(takara)。pcr的反应条件为:以于98℃下10秒的热变性、于58℃下15秒的退火、于72℃下40秒的dna延伸反应作为1个循环,实施30个循环。将上述扩增得到的pcr产物转化至大肠杆菌dh5α,得到含有突变型doi合酶基因(btrc(w293r/n14t))的质粒载体pgapp-btrc(w293r/n14t)-csca-glf。(图16)
另外,将含有突变型doi合酶基因(btrc(w293r))的质粒载体pgapp-btrc(w293r)-csca-glf作为模板,使用序列号25所示的引物24(5’-ttaatccgcgataacaagaggggctac-3’)、序列号26所示的引物25(5’-ttatcgcggattaaataatggaagat-3’),实施pcr扩增。pcr扩增使用了primestarmaxdnapolymerase(takara)。pcr的反应条件为:以于98℃下10秒的热变性、于54.4℃下15秒的退火、于72℃下40秒的dna延伸反应作为1个循环,实施30个循环。将上述扩增得到的pcr产物转化至大肠杆菌dh5α,得到含有突变型doi合酶基因(btrc(w293r/h319r)的质粒载体pgapp-btrc(w293r/h319r)-csca-glf。(图17)
使用monarch(注册商标)plasmidminiprepkit(newenglandbiolabs)纯化分离质粒pgapp-btrc(w293r)-csca-glf及质粒pgapp-btrc(w293r/n14t)-csca-glf、pgapp-btrc(w293r/h319r)-csca-glf,转化至高水平蓄积作为doi合酶的底物的葡萄糖-6-磷酸的大肠杆菌mg1655δpgiδzwf株(记载于国际公开第2010/053052号)的感受态细胞,在含有氨苄青霉素100μg/ml的lb琼脂平板中于37℃培养一夜,由此得到分别含有3种质粒pgapp-btrc(w293r)-csca-glf、pgapp-btrc(w293r/n14t)-csca-glf、pgapp-btrc(w293r/h319r)-csca-glf的3种mg1655δpgiδzwf株。
针对分别含有3种质粒pgapp-btrc(w293r)-csca-glf、pgapp-btrc(w293r/n14t)-csca-glf、pgapp-btrc(w293r/h319r)-csca-glf的mg1655δpgiδzwf株,实施使用了发酵罐的doi生产率评价。
作为预培养,向各装有lb培养基(1%hipolypeptonn、0.5%酵母提取物、0.5%nacl、0.01%feso4·7h2o)100g的500ml带隔板三角烧瓶中加入100mg/ml的氨苄青霉素0.1ml,将分别含有3种质粒pgapp-btrc(w293r)-csca-glf、pgapp-btrc(w293r/n14t)-csca-glf、pgapp-btrc(w293r/h319r)-csca-glf的3种mg1655δpgiδzwf株以0.1ml接种于不同的上述带隔板三角烧瓶,以120rpm、于28℃搅拌培养一夜。
将装有培养基成分1(0.2%k2hpo4、0.2%kh2po4、0.01%feso4·7h2o、0.03%adekanol)350g的1l培养槽(able公司制造培养槽bml-01kp3)灭菌,加入培养基成分2(10%(nh4)2so4、4.6%nh4cl、4.6%mgso4·7h2o)15g、50%玉米浆5g、50%植酸700μl,接种预培养液10g,开始培养。在培养开始的同时,以0.13g/分钟的速度流加试剂糖液(21%glc、21%fru、1%xyl)30小时。试剂糖液是将葡萄糖溶液、果糖溶液、木糖溶液各自分别高压蒸汽灭菌后混合而制成的。
在大气压下、通气量0.5l/分钟、搅拌速度800rpm、培养温度30℃、ph6.0(使用12.5%氨溶液调节)的条件下培养32小时。将培养开始0、8、24、27、32小时后的培养液离心分离、除去菌体而得到的上清液用灭菌蒸馏水稀释100倍,使用过滤器(millex-gv、0.22μm、pvdf、4mm)过滤,按照表7的条件,利用hplc测定doi、葡萄糖、果糖、木糖浓度。
图18a中示出了含有pgapp-btrc(w293r)-csca-glf的mg1655δpgiδzwf株中的doi产量(▲)、葡萄糖浓度(·)、果糖浓度(◆)、木糖浓度(■)的时间曲线,图18b中示出了含有pgapp-btrc(w293r/n14t)-csca-glf的mg1655δpgiδzwf株中的doi产量(▲)、葡萄糖浓度(·)、果糖浓度(◆)、木糖浓度(■)的时间曲线,图18c中示出了含有pgapp-btrc(w293r/h319r)-csca-glf的mg1655δpgiδzwf株中的doi产量(▲)、葡萄糖浓度(·)、果糖浓度(◆)、木糖浓度(■)的时间曲线。
表6中示出了分别含有3种质粒pgapp-btrc(w293r)-csca-glf、pgapp-btrc(w293r/n14t)-csca-glf、pgapp-btrc(w293r/h319r)-csca-glf的mg1655δpgiδzwf株的第32小时的doi浓度。即,表6示出了含有pgapp-btrc(w293r)-csca-glf的大肠杆菌mg1655δpgiδzwf株、含有pgapp-btrc(w293r/n14t)-csca-glf的大肠杆菌mg1655δpgiδzwf株、含有pgapp-btrc(w293r/h319r)-csca-glf的大肠杆菌mg1655δpgiδzwf株各自的培养32小时后的doi浓度。
[表6]
对于第32小时的doi浓度而言,含有pgapp-btrc(w293r)-csca-glf的mg1655δpgiδzwf株中为56.6g/l,含有pgapp-btrc(w293r/n14t)-csca-glf的mg1655δpgiδzwf株中为30.6g/l,含有pgapp-btrc(w293r/h319r)-csca-glf的mg1655δpgiδzwf株中为70.5g/l。
因此,含有pgapp-btrc(w293r/h319r)-csca-glf的mg1655δpgiδzwf株显示出含有pgapp-btrc(w293r)-csca-glf的mg1655δpgiδzwf株的约1.2倍的doi生产率。
[表7]
doi定量测定中的hplc分析条件
将于2017年3月27日提出申请的日本专利申请2017-061572的全部公开内容作为参考并入本说明书中。另外,本说明书中记载的所有文献、专利申请及技术标准作为参考援引至本说明书中,各个文献、专利申请及技术标准作为参考被引入的情况与具体且分别地记载的程度相同。
- 还没有人留言评论。精彩留言会获得点赞!