使用在体外选择的生物RNA支架来产生用于可遗传编码的生物传感器的稳健小分子结合适体的制作方法
相关申请本申请要求在2016年12月12日提交的美国临时专利申请号62/432,879的优先权益,出于所有目的,所述申请的内容特此以引用的方式整体并入本文。关于联合发起的研究或开发的声明本发明在国家科学基金会(nationalsciencefoundation)授予的基金号cmmiche1150834的政府资助下完成。政府享有本发明的某些权利。
背景技术:
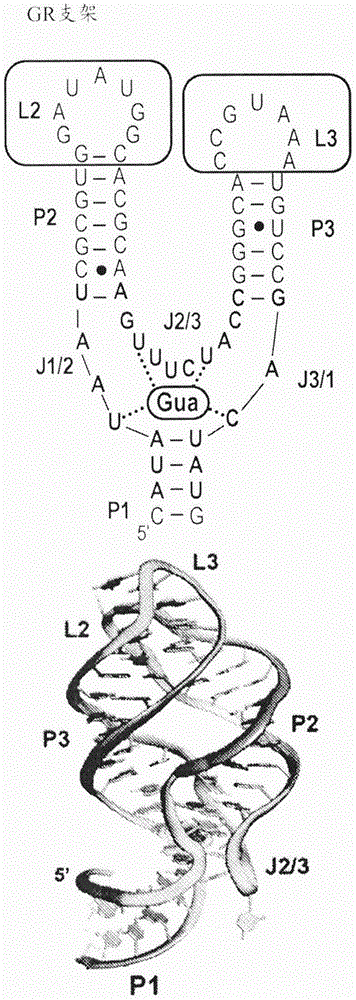
:变构rna装置越来越多地被视为能够监测酶进化、优化工程化代谢途径、促进发现新基因的重要工具和基于核酸的治疗剂的调节剂。然而,开发这些平台的一个瓶颈是在细胞环境中稳健地起作用的小分子结合rna适体的可用性。虽然适体可以通过体外选择针对几乎任何期望的靶标来产生,但是许多这些基于rna的适体不能容易地整合到装置中或者不能在细胞环境中可靠地起作用。因此,仍然需要适体和用于开发适体的方法。技术实现要素:本文描述了一种使用衍生自核糖开关和小核酶的支架的新方法。在一个示例性方面,在此应用于5-羟色氨酸的此方法产生适体,其容易通过结构支架来鉴定和表征。支架的性质使这些rna易于与读出结构域偶联以工程化在体外和细胞环境中起作用的核酸装置。在一个方面,提供了一种寡核苷酸文库,其包含多个不相同的寡核苷酸。所述文库的单个寡核苷酸包含含有螺旋结构域的第一序列、含有第一发夹结构域的第二序列,和含有第二发夹结构域的第三序列,其中所述螺旋结构域、第一发夹结构域和第二发夹结构域形成含有配体结合结构域的寡核苷酸结体,并且其中所述文库包含多个不相同的配体结合结构域。在一个实施方案中,每个螺旋结构域独立地是完全互补的螺旋,其任选地包含一个或多个选自由以下组成的组的不稳定核苷酸:错配碱基对、g·u摆动碱基对和凸起。在一个实施方案中,每个螺旋结构域是完全互补的螺旋。在一个实施方案中,每个第一发夹结构域独立地包含一个或多个选自由以下组成的组的不稳定核苷酸:错配碱基对、g·u摆动碱基对和凸起,并且/或者每个第二发夹结构域独立地包含一个或多个选自由以下组成的组的不稳定核苷酸:错配碱基对、g·u摆动碱基对和凸起。在一个实施方案中,螺旋结构域的长度为至少4至10个碱基对,或长度为至少10个碱基对。在一个实施方案中,寡核苷酸是寡核糖核苷酸。在一个实施方案中,寡核苷酸单个地包含具有根据式i的一系列连锁序列的序列:p1-j1/2-p2-l2-p2′-j2/3-p3-l3-p3′-j3/1-p1′(i),其中“-”代表键,p1和p1′形成螺旋,p2、l2和p2′形成第一发夹,p3、l3和p3′形成第二发夹并且j1/2、j2/3和j3/1一起形成寡核苷酸结体。在一个实施方案中,j2/3包含t-环基序。在一个实施方案中,t-环基序包含序列uugaa,任选地其中t-环的鸟苷与j3/1中的胞苷形成watson-crick碱基对。在一个实施方案中,螺旋结构域具有第一末端和第二末端,并且第一末端靠近寡核苷酸结体,并且第二末端连接至基于寡核苷酸的读出模块。在一个实施方案中,基于寡核苷酸的读出模块是荧光的,例如broccoli荧光团结合适体,或基于开关的读出模块,例如pbue开关。在一个实施方案中,基于寡核苷酸的读出模块是基于寡核糖核苷酸的读出模块。在一个实施方案中,单个寡核苷酸与枯草芽孢杆菌(bacillussubtilis)xpt-pbux鸟嘌呤核糖开关序列具有序列对应性,其在寡核苷酸结体内包含约23个可变核苷酸残基,或者单个寡核苷酸与霍乱弧菌(vibriocholera)vc2环状二-gmp核糖开关序列具有序列对应性,其在寡核苷酸结体内包含约21个可变核苷酸残基,或者单个寡核苷酸与曼氏血吸虫(schistosomamansoni)锤头状核酶序列具有序列对应性,其在寡核苷酸结体内包含约21个可变核苷酸残基。在一个实施方案中,寡核苷酸结体是n向结体,其中n是2、3、4或5,或者其中n是2,或者其中n是3,或者其中n是4,或者其中n是5。在一个实施方案中,文库包含约421至约423个不相同的成员。在另一方面,提供了一种包含多个不相同的寡核苷酸的寡核苷酸文库。所述文库的单个寡核苷酸包含含有螺旋结构域的第一序列、含有第一发夹结构域的第二序列,和含有第二发夹结构域的第三序列,其中所述螺旋结构域、第一发夹结构域和第二发夹结构域形成包含预选的配体结合结构域的寡核苷酸结体,并且其中所述文库包含多个不相同的配体结合结构域。在一个实施方案中,每个螺旋结构域独立地是完全互补的螺旋,其任选地包含一个或多个选自由以下组成的组的不稳定核苷酸:错配碱基对、g·u摆动碱基对和凸起。在一个实施方案中,每个螺旋结构域是完全互补的螺旋。在一个实施方案中,每个第一发夹结构域独立地包含一个或多个选自由以下组成的组的不稳定核苷酸:错配碱基对、g·u摆动碱基对和凸起,并且/或者每个第二发夹结构域独立地包含一个或多个选自由以下组成的组的不稳定核苷酸:错配碱基对、g·u摆动碱基对和凸起。在一个实施方案中,螺旋结构域的长度为至少4至10个碱基对或长度为至少10个碱基对。在一个实施方案中,寡核苷酸是寡核糖核苷酸。在一个实施方案中,单个寡核苷酸包含具有根据式i的一系列连锁序列的序列:p1-j1/2-p2-l2-p2′-j2/3-p3-l3-p3′-j3/1-p1′(i),其中“-”代表键,p1和p1′形成螺旋,p2、l2和p2′形成第一发夹,p3、l3和p3′形成第二发夹,并且j1/2、j2/3和j3/1一起形成寡核苷酸结体。在一个实施方案中,j2/3包含t-环基序。在一个实施方案中,t-环基序包含序列uugaa,任选地其中t-环的鸟苷与j3/1中的胞苷形成watson-crick碱基对。在一个实施方案中,螺旋结构域具有第一末端和第二末端,并且第一末端靠近寡核苷酸结体,并且第二末端连接至基于寡核苷酸的读出模块。在一个实施方案中,基于寡核苷酸的读出模块是荧光的,例如是broccoli荧光团结合适体,或基于开关的读出模块,例如pbue开关。在一个实施方案中,基于寡核苷酸的读出模块是基于寡核糖核苷酸的读出模块。在一个实施方案中,单个寡核苷酸包含与枯草芽孢杆菌xpt-pbux鸟嘌呤核糖开关序列具有序列对应性的序列,其在寡核苷酸结体内包含约23个可变核苷酸残基,或者单个寡核苷酸包含与霍乱弧菌vc2环状二-gmp核糖开关序列具有序列对应性的序列,其在寡核苷酸结体内包含约21个可变核苷酸残基,或者单个寡核苷酸包含与曼氏血吸虫锤头状核酶序列具有序列对应性的序列,其在寡核苷酸结体内包含约21个可变核苷酸残基。在一个实施方案中,寡核苷酸结体是n向结体,其中n是2、3、4或5,或者其中n是2,或者其中n是3,或者其中n是4,或者其中n是5。在一个实施方案中,预选的配体结合位点包括用于选自由以下组成的组的化合物的结合位点:氨基酸、肽、核碱基、核苷、核苷酸、金属离子、神经递质、激素、活性药物成分及其衍生物。在一个实施方案中,预选的配体结合位点包括用于选自由以下组成的组的配体的结合位点:氨基酸、核碱基、核苷、核苷酸、神经递质、激素及其衍生物。在一个实施方案中,预选的配体结合位点包括用于选自由以下组成的组的至少一种配体的结合位点:5-羟基-l-色氨酸、l-色氨酸、血清素和5-羟基-l-色氨酸-甲酰胺。在一个实施方案中,配体是5-羟基-l-色氨酸或血清素中的至少一种。在又另一方面,提供了一种选择多种不相同的配体结合寡核苷酸的方法。所述方法包括在适合于配体结合的条件下使包含多个寡核苷酸的寡核苷酸文库与配体接触的步骤,其中单个寡核苷酸包含含有螺旋结构域的第一序列、含有第一发夹结构域的第二序列,和含有第二发夹结构域的第三序列,其中螺旋结构域、第一发夹结构域和第二发夹结构域形成寡核苷酸结体;以及以空间可寻址方式来划分寡核苷酸文库的步骤,使得得以选择多个不相同的配体结合寡核苷酸,其中具有寡核苷酸结体的寡核苷酸还包含配体结合结构域,并且其中寡核苷酸文库的配体结合结构域包含可变核苷酸残基。在一个实施方案中,所述方法还包括在接触步骤与分配步骤之间的步骤,所述步骤包括用游离配体溶液竞争性地划分寡核苷酸文库。附图说明从以下结合附图对说明性实施方案的详细描述,将更全面地理解本发明的前述和其他特征和优点。专利或申请文件含有至少一幅彩色附图。在提出请求并支付必要费用后,本事务所将提供具有一张或多张彩色附图的本专利或专利申请公布的副本。图1a显示了gr支架。gr支架衍生自枯草芽孢杆菌xpt-pbux鸟嘌呤核糖开关的适体结构域。适体由三个成对的(p)区域组成,所述三个成对的(p)区域通过三向结体的连接(j)区域连接,所述三向结体包含鸟嘌呤(gua,品红色)结合位点(虚线代表直接的rna-配体相互作用)。青色勾画的核苷酸是随机选择的核苷酸。p2和p3的末端环(l2和l3,绿色框)参与组织结构域的三级相互作用。下面是rna(pdbid4fe5)的三维结构,其具有相同的着色方案,强调配体结合位点与随机化核苷酸之间的空间关系。图1b显示了cdg支架。cdg支架的二级(顶部)和三级结构(底部)衍生自适体结构域霍乱弧菌vc2环状二-gmp核糖开关(pdbid3iwn)。标记和着色方案如图1a中所述。图1c显示了hh支架。hh支架的二级(顶部)和三级结构(底部)衍生自曼氏血吸虫锤头状核酶(pdbid3zp8)。标记和着色方案如图1a中所述。图2a显示了5-羟基-l-色氨酸的化学结构。图2b显示了从第7轮gr-ssiii选择得到的序列的距离矩阵的无根系统发育树表示。序列分为三个主要簇,它们是独立着色的。所述距离表示为树的两个节点之间每个位点发生了多少次取代的最大似然估计(mle)(条作为比例而示出)。图2c显示了从第7轮gr-gsi选择得到的序列的距离矩阵的无根系统发育树表示。分析代表性序列的四个簇以独立颜色显示(图例在右侧示出);黑色区域代表树的未分析的簇和区域。图2d显示了从gr选择得到的六个观察到的簇的共变模型;颜色与图2b和图2c一致。虚线对应于随机化的支架区域,并且连接l2和l3的线表示簇,其中支持三级相互作用的序列得以保持。图3a显示了与天然xpt鸟嘌呤核糖开关相比,引物延伸法分析选择性2′-羟基酰化反应(“shape”)化学探测三种序列(5htp-i、-ii和-iii)的结果。为清楚起见,显示了对应于j2/3链和l3的凝胶区域(完整凝胶在补充图4a中显示)。虽然所有三种rna都显示出j2/3内或附近的rna骨架的化学反应性的配体依赖性降低,但只有5htp-ii保留了l3中反应性的特征热点,这指示其在xpt鸟嘌呤核糖开关中与l2的相互作用形成。图3b是在5htp存在和不存在下5htp-ii的shape探测的配体依赖性差异强度的定量,揭示大多数反应性变化定位于结体。l3信号的增强表明结体中的配体结合与三级结构形成之间的联系。图3c显示了在具有(左侧)和没有(右侧)5′和3′扩增盒的情况下,5htp与5htp-ii结合的等温滴定量热法(itc)分析,证明这些区域不影响配体结合。图3d显示了与5-羟色氨酸(品红色)复合的5htp-ii适体的晶体结构。绿色突出显示亲本支架的l2-l3相互作用(图1a),并且青色指示在起始rna文库中随机化的核苷酸。图3e显示了图(b)中定量的shape反应性数据在晶体结构上的叠加,强调了rna骨架动力学中的配体依赖性变化与结构之间的关系。图4a显示了5htp-ii适体中5htp的结合口袋。三向结体内的5htp结合口袋形成一组氢键相互作用,其接合5-羟色氨酸中的每个极性官能团,除了羧酸酯基团中的一个氧原子成为固定化合物的酰胺以外。此外,通过堆叠5htp的羟吲哚环与j2/3中的腺嘌呤碱基(a48和a49)之间的相互作用来稳定复合物。图4b显示了5htp-ii适体中5htp的结合口袋。5htp-ii适体(绿色)中结合口袋的核心是t-环,其与来自trnaphe(橙色)和硫胺素焦磷酸(tpp)核糖开关(青色)的t-环几乎完美地叠加。在三个实施例的每一个中,t4和t5位置处的两个嘌呤之间的空间(t1-5编号指示t-环基序内的核苷酸位置)使得能够嵌入芳环。图5a显示了基于5htp适体的生物传感器在大肠杆菌中起作用。野生型5htp-ii适体在5htp存在下特异性激活broccoli报告分子的荧光。在t=0分钟时,向培养基中加入2mm5htp。图5b显示了野生型5htp-ii适体在l-色氨酸存在下不特异性激活broccoli报告分子的荧光。在t=0分钟时,向培养基中加入5mml-色氨酸。图5c显示了5htp-ii适体(a48u)的5htp结合口袋中的单点突变也在荧光团存在下消除荧光。在t=0分钟时,向培养基中加入2mm5htp。图5d显示了在5htp存在下野生型5htp-ii-broccoli传感器的荧光诱导的单细胞迹线。在t=0分钟时,向培养基中加入2mm5htp。图5e显示了在l-色氨酸存在下野生型5htp-ii-broccoli传感器的荧光诱导的单细胞迹线。在t=0分钟时,向培养基中加入5mml-色氨酸。图5f显示了在5htp存在下不能结合的5htp-iia48u构建体的荧光诱导的单细胞迹线。在t=0分钟时,向培养基中加入2mm5htp。图6a显示了基于5htp-iv适体的人工5htp/血清素“开启”核糖开关的二级结构。5htp-iv适体以虚线框出,并且实线框出的核苷酸对应于直接参与替代结构形成的核苷酸。图6b显示了核糖开关的定量单转换转录反应,证明在加入5htp、血清素或5htp-nhme后稳健的抗终止作用。转录反应的凝胶图像显示在右侧,显示出从终止(t)到通读(rt)产物的配体依赖性转变。用l-色氨酸进行的类似滴定未能产生通读转录。图7a显示了使用gsi逆转录酶从第7轮cdg选择得到的序列的距离矩阵的无根系统发育树表示。产生5htp适体的簇以红色突出显示。所述距离表示为树的两个节点之间每个位点发生了多少次取代的最大似然估计(mle)(条作为比例而示出)。图7b显示了5htp-vii适体的共变模型;实线红线对应于随机化的生物支架区域,并且连接l2和p3的线表示三级相互作用。图7c显示了使用gsi逆转录酶从第7轮hh选择得到的序列的距离矩阵的无根系统发育树表示。产生5htp-viii适体的簇以紫色突出显示;黑色区域代表树的未分析的簇和区域。图7d显示了5htp-viii适体的共变模型;实线紫色线对应于随机化的生物支架区域,连接p2和l3的线表示三级相互作用。图8a显示了通过第7轮选择在生物支架中显著的突变积累,其中在3′端的一些位置在使用superscriptiii(lifetechnologies)的初始选择中实现大于90%的突变频率。对于二级和三级结构(p2和p3)至关重要的序列元件中也存在强烈的突变积累倾向。图8b显示了使用开发的ii组内含子rt(gsi-iic)的修改的选择方案显示gr生物支架中积累突变量的减少,特别是在p2和p3区域。这允许保留设计在序列中的结构元件。图8c显示了在第7轮cdg/gsi选择中随着核苷酸位置而变化的观察到的错误频率。图8d显示了在第7轮hh/gsi选择中随着核苷酸位置而变化的观察到的错误频率。图9a显示了在5htp不存在和存在的情况下5htp-iv、-v和-vi适体的shape分析。侧面的条突出显示j2/3和l3区域,证明三向结体中的不同的配体依赖性保护,以及为l2-l3相互作用所特有的在l3中的特征反应性热点的存在。图9b显示了cdg支架5htp结合适体的shape分析。原始凝胶在j1/2和j2/3中显示出明显的配体依赖性修饰。亲本vc2rna在四环对接位点处显示p3中的配体依赖性保护,而5htp-vii适体在螺旋的相对侧显示配体依赖性修饰。另外,在无关配体存在下,rna均未显示出任何修饰。图9c显示了hh支架5htp结合适体的shape分析。原始凝胶在j1/2和j2/3中显示出明显的配体依赖性修饰。j2/3的变化主要定位于预测的t-环基序的3和4位。另外,如果保持结构,则在亲本rna中对接到p2的p3的末端环(l3)显示出配体依赖性保护。左侧显示了随着凝胶距离而变化的条带的整合。图10a显示了在2σ处轮廓化的模型周围的5htp-ii/5htp复合物的2fo-fc电子密度图。rna的所有区域都由电子密度很好地定义,使得残基和骨架的放置明确无误。青色核苷酸在原始rna文库中随机化,并且5htp以橙色显示。图10b显示了在1σ处轮廓化的5htp-ii/5htp复合物的配体结合口袋的复合省略,显示出支持配体(5htp)和相邻的六胺铱(irhex)的放置的明显密度。图10c显示了在1σ处轮廓化的5htp-ii/5htp复合物的5htp结合口袋的最终2fo-fc电子密度图。图11a显示了源自hh/gsi选择的最稠密的簇的5htp-viii适体的j2/3的变异分析的r2r图。图11b显示了5htp-viii适体的j2/3的变异分析,比较了在生物rna1中发现的t-环(上图)和含有5htp-viii适体的簇的变化模式。图12显示了5htp-broccoli生物传感器的构建方案。broccoli二级结构中的红色核苷酸表示形成dfhbi平台的g四联体,并且绿色核苷酸表示spinach与broccoli之间的差异。图13是显示本发明的新型支架适体的设计的图解摘要。图14a是5htp和l-dopa的可遗传编码的生物传感器的二级结构的示意图,其中gr-支架适体(青色)通过通信模块(橙色,cm;在底部的序列)与荧光适体(broccoli,绿色)偶联并用trna支架(黄色)在体内稳定。图14b和图14c描绘了对于使用2到5个碱基对的cm来与broccoli偶联的一系列gr-支架适体,观察到的配体诱导的荧光的热图(顶部)和相对于trna/broccoli对照的配体结合的传感器的亮度(底部)。图14d和图14e描绘了大肠杆菌中相同传感器的性能的热图。图15a和图15b显示了野生型5gr-ii适体在5htp存在下特异性激活broccoli报告分子的荧光,但在l-色氨酸存在下没有这样的作用。图15c显示了5gr-ii适体(a48u)的5htp结合口袋中的单点突变也在荧光团存在下消除荧光。图15d、图15e和图15f描绘了在5htp、l-色氨酸存在下的野生型5gr-ii-broccoli传感器和在5htp存在下的不能结合的5gr-iia48u构建体的荧光诱导的单细胞迹线。在t=0分钟时,向培养基中加入2mm5htp或5mml-色氨酸。图16a显示了亲本枯草芽孢杆菌xpt鸟嘌呤核糖开关和5gr-11rna在所有骨架原子上的叠加。鸟嘌呤核糖开关(pdb4fe5)以红色显示,并且其配体次黄嘌呤以品红色显示。5gr-ii适体以蓝色显示,并且其配体5htp以绿色显示。图16b显示了仅使用p2和p3中的骨架原子叠加两个rna。图16c描绘了包含l2-l3相互作用核心的两个碱基四联体的叠加图,显示了建立此三级相互作用的各个碱基相互作用的完全保留。图17a至图17d描绘了初始rna文库的序列和二级结构。绿色框突出显示用于启动的恒定区,并且黄色框突出显示每个支架特定的条形码。在起始文库中随机化的核苷酸位置以青色突出显示。图17a描绘了使用supcrscriptiiirt进行选择的鸟嘌呤核糖开关适体(gr)rna文库的序列。图17b描绘了用于使用gsi-iicrt选择的grrna文库的序列。图17c描绘了二环gmp核糖开关适体(cg)文库的序列。图17d描绘了锤头状核酶(hr)文库的序列。图18a至图18c描绘了选择性结合3,4-二羟基苯丙氨酸(l-dopa)的支架适体的选择。图18a描绘了多巴胺(1)和l-dopa(2)的化学结构。图18b描绘了衍生自针对l-dopa的第7轮gr-gsi-iic选择的序列的距离矩阵的无根系统发育树表示。将代表性序列并入荧光生物传感器的四个簇以独立颜色显示。黑色区域代表树的未分析的簇和区域。图18c描绘了四个簇的共变模型,其颜色与图(b)的颜色一致。注意,dgr-iiimfe结构具有替代的二级结构,如果正确的话,所述结构可以消除三级环-环相互作用。图19描绘了gr支架5htp结合适体的shape分析。此图显示了用于产生图4a的凝胶的完整测序区域。图20描绘了gr支架5htp结合适体的shape分析。图4a中所示的测序凝胶的完整且未改变的图像(对应于j2/3和l3的区域被裁剪以产生图4a)。描绘了在不存在和存在5htp的情况下的5gr-iv、-v和-vi适体的shape分析。侧面的条突出显示j2/3和l3区域,证明了3wj中的不同的配体依赖性保护以及为l2-l3相互作用所特有的在l3中的特征反应性热点的存在。图21描绘了cg支架5htp结合适体的shape分析。原始凝胶(插图)在j1/2和j2/3中显示明显的配体依赖性修饰。亲本vc2rna在四环对接位点处显示p3中的配体依赖性保护,而5cg-i适体在螺旋的相对侧显示配体依赖性修饰。另外,在无关配体存在下,rna均未显示出修饰。在底部显示了随着凝胶距离而变化的条带的整合。归一化和分配后,配体依赖性变化仍然明显(彩色星号),特别是在j1/2中。图22描绘了hr支架5htp结合适体的shape分析。原始凝胶(右侧)在j1/2和j2/3中显示明显的配体依赖性修饰。j2/3的变化主要定位于预测的t-环基序的3和4位。另外,如果保持结构,则在亲本rna中对接到p2的p3的末端环(l3)显示出配体依赖性保护。左侧显示了随着凝胶距离而变化的条带的整合。归一化和分配后,配体依赖性变化仍然明显(彩色星号)。注意,在亲本锤头状rna的等同位点处(顶部绿色星号)没有背景切割。图23描绘了作为g-区块合成的本发明的工程化传感器。“n”代表a、c、g和t的组成各自为大约25%的位置。rna适体和传感器序列作为其等同的dna序列给出。broccoli传感器的单独结构域用颜色编码以表示trna支架(灰色)、dfhbi-1t结合broccoli适体(黄色)、通信模块(青色)和gr支架适体(红色)。具体实施方式产生具有新的调节和感测能力的合成rna和/或dna元件的方法通过体外选择来有力地实现,并且可用的合成适体池目前很大。然而,只有少数小分子结合rna适体已经转变为其同源配体或其他rna装置的有效且广泛使用的细胞内生物传感器。体外结合与细胞内活性之间的这种差异是有问题的,表明当前的选择策略不能容易地获得能够在细胞环境中稳健起作用的小分子结合rna适体。虽然小分子结合rna的体内选择策略可能在产生具有细胞能力的适体方面更成功,但这些方法目前尚未广泛实用。因此,当前的策略继续依赖于延长的工作流程,其结合了传统的体外选择和串联的、应用特异性选择以增强功能。与合成适体不同,天然核糖开关的小分子结合结构域已经在细胞环境中进化并且包含超出配体结合位点的额外特征,其包括高保真折叠和与下游调节开关通信以产生可检测输出的能力。这些适体是高度模块化和稳健的,在广泛细菌物种中观察到并且与作用于转录、翻译、选择性剪接和mrna稳定性的不同调节结构域相互作用。因此,它们在与引发输出(例如基因调节)的相邻结构域或序列的通信机制方面是高度灵活的。这些适体已在合成应用中取得成功,并已用于验证合成rna工具。虽然已经进行了大量努力来鉴定和表征天然适体,但由于难以调节的内源性效应配体池,它们在其多样性和应用中具有固有的限制。为了应对这些困难,本文提供了在天然rna适体和小的溶核核酶中发现的复现性结构折叠,其可以使用体外选择进行重编程以容纳广泛的小分子结合位点,同时保持亲本的稳健的折叠和高度稳定的结构特性及其使用方法。先前已经使用部分结构化的rna文库来选择小分子结合适体,但是这些简单的发夹和螺旋不具有形成类似于天然适体的高级结构的潜力。通过随机化四膜虫(tetrahymena)核酶p456结构域中的末端环来选择具有非常有限活性的rna连接酶核酶,证明可以获得支架文库的核酶。然而,p456结构很大(160个核苷酸)并且限于i组自剪接内含子的ic1和ic2亚类。因此,它可能不适合作为培养在广泛细胞环境中有活性的多种小分子结合适体的通用平台。使用衍生自两种不同核糖开关适体结构域和核酶的支架,获得了选择性结合5-羟色氨酸(5htp)和/或血清素(5ht)的多组适体。虽然每个支架都提供了独特的识别解决方案,但它们都集中在相似的结合亲和力上并且排斥化学相关的l-色氨酸。这些适体通过结构性支架而倾向于偶联到荧光和基于开关的读出模块。虽然筛选策略在不同程度上取得了成功,但使用此方法容易实现的适体的多样性使得能够实现更灵活的策略,并且实施实际rna装置所需的体外表征更少。基于rna的装置越来越多地被视为合成生物学中潜在的稳健且可预测的工具。与基于蛋白质的替代品相比,rna具有一组独特的特征,包括顺式调节能力、可预测的二级结构和小的遗传足迹。在rna装置中更受追捧的能力之一是在没有其他蛋白质因子的情况下感测外部刺激并调节遗传或表型反应的能力。努力的重点是创造合成的核糖开关、适体酶和荧光rna传感器,但是部分地由于rna感测结构域的有限可用性,它们的潜力尚未完全实现。本文提供的组合物和方法令人惊讶地证明,使用天然进化的核糖开关或核酶作为用于选择的支架可以产生能够在体外和细胞环境中起作用的稳健的感测结构域,与迄今为止最好的人工和天然适体相当。本文描述的组合物和方法的关键优势是在平行选择中使用多个支架以获得一套适体。虽然衍生自不同支架的适体对5htp具有相似的亲和力和对l-色氨酸的选择性,但是关于它们通过p1螺旋与读出结构域通信的能力,它们明显具有不同的特性,p1螺旋是所有支架的共同特征。不受理论束缚,假设这是由于配体与域间(p1)螺旋之间的空间关系的变化,这是在选择中不能完全控制的特征。在生物核糖开关中,配体直接接触或诱导rna中的构象变化,其涉及将适体连接至下游调节开关的p1螺旋。使用一套适体,可以采用组合方法快速筛选具有所需特性的传感器,而无需广泛的适体表征或装置优化。通常,传统的体外选择仅产生单个小分子结合适体,并且rna装置的开发需要筛选许多通信模块和衔接子序列,同时将传感适体留作固定节点。利用支架选择方法,一组不同的适体可以组合偶联于一组通信模块,并快速筛选具有所需活性的变体。以这种方式,这种方法应消除rna装置和传感器开发中的关键瓶颈。值得注意的是,虽然在本研究中在每个选择中只关注于最稠密的簇用于表征和传感器设计,但在每个选择中,有许多簇包含替代序列,可以进一步丰富初始的适体池以开发下游应用。此选择策略的第二个强大优点是由寡核苷酸结体结构(例如,三向结体)的三级相互作用提供的细胞环境中的稳健折叠。这些适体中的每一个都具有经历广泛生物进化的折叠,并且特别地,组织三向结体核心的远端三级相互作用是高度稳定的。嘌呤核糖开关的l2-l3相互作用和环状二-gmp核糖开关支架的四环-四环受体都能够在其他rna结构环境以外稳定地形成。这使得这些元件能够潜在地引导初始文库的所有成员的折叠,使得群体中的绝大多数包含规定的二级和三级结构。错误折叠通常是传统合成适体的重要问题,当rna元件与另一个rna偶联或置于较大rna的背景下时,这个问题可能大大加剧。由于在典型的选择方案中对于高保真折叠没有显著的选择压力,因此在起始文库中提供此信息可以是通向稳健折叠rna的途径。尽管本文举例说明了三向结体支架,但天然核糖开关和核酶的多样性可以为此方法提供进一步的原料。在三向结体家族中,存在广泛的序列,其改变三个螺旋的取向、连接区域的大小,以及远端三级相互作用的性质,从而可以为特定配体或传感器提供优异支架。此外,基于同源配体的性质,其他折叠可以易于结合靶小分子。例如,支架结合5htp的另一种选择是赖氨酸核糖开关适体结构域,其包含容纳配体结合位点并将其定位成与p1螺旋相邻的五向结体。较大的配体可以更容易地被黄素单核苷酸或钴胺素核糖开关衍生的支架容纳,而诸如nadh的二核苷酸可以容易地被其他二环核苷酸适体之一容纳。因此,本文所述的支架选择方法具有促进开发强大新工具的潜力,这些工具用于在使用rna装置的广泛应用中监测和响应细胞环境中的小分子。通常,与本文所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学和蛋白质和核酸化学和杂交结合使用的命名法是本领域公知和常用的那些命名法。本文提供的方法和技术通常根据本领域熟知,并且如在整个本说明书中引用和讨论的各种一般和更具体的参考文献中所述的常规方法进行,除非另有说明。酶促反应和纯化技术是根据制造商说明书,如本领域中通常所实现或如本文所述来进行。与本文所述的分析化学、合成有机化学以及医学和药物化学结合使用的命名法和实验室程序和技术是本领域熟知和常用的那些。标准技术用于化学合成、化学分析、药物制备、配制和递送以及患者的治疗。除非本文另有定义,否则本文使用的科学和技术术语具有本领域普通技术人员通常理解的含义。如果存在任何潜在的歧义,本文提供的定义优先于任何字典或外在定义。除非上下文另有需要,否则单数术语应包括复数且复数术语应包括单数。除非另外说明,否则“或”的使用意指“和/或”。术语“包括(including)”以及其他形式(诸如“包括(includes)”和“包括(included)”)的使用不具有限制性。为了更容易理解本发明,首先定义某些术语。术语“适体”和“适体结构域”是指短的单链dna、rna或肽序列,其以高特异性和亲和力来特异性结合各种分子靶标,诸如小分子、蛋白质、核酸、细胞、组织等。适体通常是高度特异性的、大小相对较小,并且是非免疫原性的。与抗体相似,适体通过识别特定的三维结构与其靶标相互作用,因此也称为“化学抗体”。相比于蛋白质抗体,dna或rna适体基于其寡核苷酸特性提供独特的化学和生物学特征。术语“核糖开关”是指通常在mrna的5′-非翻译区中发现的元件,其通过直接结合小分子配体以顺式方式对转录物发挥其调节控制。典型的核糖开关包含两个不同的功能结构域:适体结构域,其采用紧凑的三维折叠来为配体结合口袋提供支架;和表达平台,其包含与转录或翻译机构相互作用的二级结构开关。通过这两个结构域之间的重叠区域(称为转换序列)实现调节,这两个结构域的配对指导rna折叠成表达平台中代表mrna的开启和关闭状态的两个互斥结构之一。在某些示例性实施方案中,优选的核糖开关是枯草芽孢杆菌xpt-pbux鸟嘌呤核糖开关(在本文中称为“gr”)或霍乱弧菌vc2环状二-gmp核糖开关(在本文中称为“cdg”)。术语“核酶”是指作为酶起作用并且能够催化特定生化反应的rna分子,与蛋白质酶的作用相似。核酶类包括gir1分支核酶、glms核酶、i组自剪接内含子、ii组自剪接内含子、发夹核酶、锤头状核酶和hdv核酶。在某些示例性实施方案中,优选的核酶是曼氏血吸虫锤头状核酶(在本文中称为“hh”)。术语“合成rna剂”、“合成dna剂”、“生物传感器”和“支架”是指本文所述的核酸传感装置,其包含衍生自天然存在的适体的二级和三级结构支架,例如衍生自核糖开关和核酶。本发明的“合成rna剂”、“合成dna剂”、“生物传感器”或“结构支架”包括螺旋结构域、第一发夹结构域和第二发夹结构域,以及含有配体结合结构域的寡核苷酸结体。本发明的生物传感器可以包括n向结体,其中n为2、3、4或5。在某些实施方案中,本发明的生物传感器包含具有根据式i的一系列连接组分的序列:(i)p1-j1/2-p2-l2-p2′-j2/3-p3-l3-p3′-j3/1-,其中“-”代表键,“p1”和“p1′”形成螺旋,“p2”、“l2”和“p2”形成第一发夹,“p3”、“l3”和“p3′”形成第二发夹,并且“j1/2”、“j2/3”和“j3/1”一起形成寡核苷酸结体。(参见例如图1。)在某些实施方案中,本发明的生物传感器包含“读出”模块,通过所述模块可以确定模块对配体的特异性和/或亲和力。“读出”可以是视觉上可检测的,例如荧光读出,例如像,broccoli,或者可以是基于核糖开关的读出或基于寡核苷酸的读出,如本文进一步描述的。术语“螺旋结构域”是指两个或更多个多核苷酸,它们例如通过氢键、hoogsteen键或反向hoogsteen键结合在一起,从而形成双螺旋或三螺旋结构。术语“发夹结构域”是指多核苷酸与其自身碱基配对的能力,使得多核苷酸的5′末端和3′末端彼此接近并且通过多核苷酸的非杂交部分连接,从而形成环结构。术语“寡核苷酸结体”是指支架的两个、三个、四个或五个区域,其形成配体结合位点,例如gua结合位点。(参见例如图1。)术语“寡核苷酸文库”是指合成寡核苷酸序列的集合,每个序列包含本发明的结构支架,其中每个结构支架至少包括螺旋结构域、第一发夹结构域和第二发夹结构域,以及含有配体结合结构域的寡核苷酸结体。在某些示例性实施方案中,提供了用于筛选与本发明的生物传感器结合的配体或测试化合物的测定。本发明的测试化合物可以使用本领域已知的组合文库方法中多种方法中的任一种获得,包括:生物文库;空间可寻址的平行固相或溶液相文库;需要反卷积的合成文库方法;“一珠一化合物”文库方法;和使用亲和色谱法选择的合成文库方法。生物文库方法仅限于肽文库,而其他四种方法适用于肽、非肽寡聚体或化合物的小分子文库(lam,k.s.(1997)anticancerdrugdes.12:145)。术语“核苷”是指具有与核糖或脱氧核糖共价连接的嘌呤或嘧啶碱基的分子。示例性核苷包括腺苷、鸟苷、胞苷、尿苷和胸苷。另外的示例性核苷包括肌苷、1-甲基肌苷、假尿苷、5,6-二氢尿苷、核糖胸苷、2n-甲基鸟苷和2,2n,n-二甲基鸟苷(也称为“稀有”核苷)。术语“核苷酸”是指具有一个或多个磷酸基团的核苷,所述磷酸基团在酯键中与糖部分连接。示例性核苷酸包括核苷一磷酸、二磷酸和三磷酸。术语“多核苷酸”和“核酸分子”在本文中可互换使用,并且是指通过5′与3′碳原子之间的磷酸二酯键连接在一起的核苷酸聚合物。术语“rna”或“rna分子”或“核糖核酸分子”是指核糖核苷酸的聚合物(例如,2、3、4、5、10、15、20、25、30或更多个核糖核苷酸)。术语“dna”或“dna分子”或“脱氧核糖核酸分子”是指脱氧核糖核苷酸的聚合物。dna和rna可以天然合成(例如,分别通过dna复制或dna转录)。rna可以进行转录后修饰。dna和rna也可以化学合成。dna和rna可以是单链的(即分别是ssrna和ssdna)或多链的(例如,双链的,即分别是dsrna和dsdna)。“mrna”或“信使rna”是指定一条或多条多肽链的氨基酸序列的单链rna。当核糖体与mrna结合时,此信息在蛋白质合成期间被翻译。术语“核苷酸类似物”或“改变的核苷酸”或“修饰的核苷酸”是指非标准核苷酸,包括非天然存在的核糖核苷酸或脱氧核糖核苷酸。示例性核苷酸类似物在任何位置被修饰,以改变核苷酸的某些化学特性,但仍保留核苷酸类似物执行其预期功能的能力。可被衍生化的核苷酸的位置的实例包括5位,例如5-(2-氨基)丙基尿苷、5-溴尿苷、5-丙炔尿苷、5-丙烯基尿苷等;6位,例如6-(2-氨基)丙基尿苷;腺苷和/或鸟苷的8-位,例如8-溴鸟苷、8-氯鸟苷、8-氟鸟苷等。核苷酸类似物还包括脱氮核苷酸,例如7-脱氮腺苷;o-和n-修饰的(例如,烷基化的,例如n6-甲基腺苷,或另外如本领域已知的)核苷酸;和其他杂环修饰的核苷酸类似物,诸如描述于herdewijn,antisensenucleicaciddrugdev.,2000年8月10(4):297-310中的那些类似物。核苷酸类似物还可以包含对核苷酸的糖部分的修饰。例如,2′oh-基团可以被选自h、or、r、f、cl、br、i、sh、sr、nh2、nhr、nr2、coor或or的基团取代,其中r是取代的或未取代的c1-c6烷基、烯基、炔基、芳基等。其他可能的修饰包括在美国专利号5,858,988和6,291,438中描述的修饰。核苷酸的磷酸基团也可以被修饰,例如通过用硫取代磷酸基团的一个或多个氧(例如硫代磷酸酯),或通过进行允许核苷酸执行其预期功能的其他取代,诸如在例如eckstein,antisensenucleicaciddrugdev.2000年4月10(2):117-21,rusckowski等人antisensenucleicaciddrugdev.2000年10月10(5):333-45,stein,antisensenucleicaciddrugdev.2001年10月11(5):317-25,vorobjev等人antisensenucleicaciddrugdcv.2001年4月11(2):77-85和美国专利号5,684,143中描述的取代。某些上述修饰(例如,磷酸基团修饰)优选降低例如在体内或体外包含所述类似物的多核苷酸的水解速率。在某些示例性实施方案中,可检测标记可以用于检测本文所述的一种或多种寡核苷酸和/或多核苷酸。可检测标记物的实例包括各种放射性部分、酶、辅基、荧光标记物、发光标记物、生物发光标记物、金属颗粒、蛋白质-蛋白质结合对、蛋白质-抗体结合对等。荧光蛋白的实例包括但不限于黄色荧光蛋白(yfp)、绿色荧光蛋白(gfp)、青色荧光蛋白(cfp)、伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺荧光素、丹磺酰氯、藻红蛋白等。生物发光标记物的实例包括但不限于荧光素酶(例如,细菌、萤火虫、叩头虫等)、荧光素、水母发光蛋白等。具有视觉上可检测信号的酶系统的实例包括但不限于半乳糖苷酶、葡萄糖醛酸酶、磷酸酶、过氧化物酶、胆碱酯酶等。可识别的标记物还包括放射性化合物,诸如125i、35s、14c或3h。可识别的标记物可从各种来源商购获得。在许多综述中描述了荧光标记及其与核苷酸和/或寡核苷酸的连接,包括haugland,handbookoffluorescentprobesandresearchchemicals,第9版(molecularprobes,inc.,eugene,2002);keller和manak,dnaprobes,第2版(stocktonpress,newyork,1993);eckstein编,oligonucleotidesandanalogues:apracticalapproach(irlpress,oxford,1991);和wetmur,criticalreviewsinbiochemistryandmolecularbiology,26:227-259(1991)。适用于本发明的特定方法在以下参考样本中公开:美国专利号4,757,141、5,151,507和5,091,519。在一个方面,一种或多种荧光染料用作标记的靶序列的标记,例如,如美国专利号5,188,934所公开的(4,7-二氯荧光素染料);美国专利号5,366,860(光可分解的罗丹明染料);美国专利号5,847,162(4,7-二氯罗丹明染料);美国专利号4,318,846(醚取代的荧光素染料);美国专利号5,800,996(能量转移染料);lee等人;美国专利号5,066,580(黄嘌呤染料);美国专利号5,688,648(能量转移染料);等等。如下列专利和专利公开中所公开的,也可以用量子点进行标记:美国专利号6,322,901、6,576,291、6,423,551、6,251,303、6,319,426、6,426,513、6,444,143、5,990,479、6,207,392、2002/0045045和2003/0017264。如本文所用,术语“荧光标记”包括通过一种或多种分子的荧光吸收和/或发射特性传递信息的信号传导部分。这些荧光特性包括荧光强度、荧光寿命、发射光谱特征、能量转移等。术语“寡核苷酸”是指核苷酸和/或核苷酸类似物的短聚合物。术语“rna类似物”或“dna类似物”是指与对应的未改变或未修饰的dna或rna相比具有至少一个改变或修饰的核苷酸但保留与对应的未改变或未修饰的dna或rna相同或相似性质或功能的多核苷酸(例如,化学合成的多核苷酸)。如上所讨论,与具有磷酸二酯键的rna或dna分子相比,寡核苷酸可以通过导致rna或dna类似物的更低水解速率的键来连接。例如,类似物的核苷酸可以包括亚甲基二醇、亚乙基二醇、氧甲硫基、氧乙硫基、氧羰基氧基、二氨基磷酸酯、氨基磷酸酯和/或硫代磷酸酯键。优选的rna或dna类似物包括糖和/或骨架修饰的核糖核苷酸和/或脱氧核糖核苷酸。此类改变或修饰还可以包括添加非核苷酸材料,诸如添加到rna或dna的一个或多个末端或内部(在rna或dna的一个或多个核苷酸处)。如本文所用,术语“分离的rna”或“分离的dna”是指当通过重组技术产生时基本上不含其他细胞材料或培养基的rna或dna分子,或者当化学合成时基本上不含化学前体或其他化学品的rna或dna分子。术语“体外”具有其本领域公认的含义,例如涉及纯化的试剂或提取物,例如细胞提取物。术语“体内”也具有其本领域公认的含义,例如涉及生物体中的活细胞,例如永生化细胞、原代细胞、细胞系和/或细胞。如本文所用,术语“转基因”是指任何核酸分子,其通过技术插入细胞中,并成为从细胞发育的生物体基因组的一部分。这种转基因可以包括对转基因生物体来说部分或完全异源(即外源)的基因,或者可以代表与生物体的内源基因同源的基因。术语“转基因”还意指包含一种或多种选定的核酸序列(例如dna)的核酸分子,所述核酸序列编码在转基因生物体(例如动物)中表达的一种或多种工程化rna前体,所述转基因对转基因动物来说部分或完全异源,即外源,或与转基因动物的内源基因同源,但被设计成在不同于天然基因的位置插入动物基因组中。转基因包括一种或多种启动子和表达所选核酸序列所必需的任何其他dna,诸如内含子,所有这些都与所选序列可操作地连接,并且可以包括增强子序列。“参与”疾病或病症的基因包括如下基因,其正常或异常的表达或功能影响或引起所述疾病或病症或所述疾病或病症的至少一种症状。如本文所用,术语“样本群体”是指包括统计学上显著数量的个体的个体群体。例如,样本群体可以包括50、75、100、200、500、1000或更多个体。在特定实施方案中,样本群体可以包括至少共享共同疾病表型(例如,功能获得性病症)或突变(例如,功能获得性突变)的个体。如本文所用,术语“杂合度”是指群体内在特定基因座处(例如,在snp处)是杂合的(例如,含有两个或更多个不同等位基因)的个体的分数。可以使用本领域技术人员熟知的方法计算样本群体的杂合度。短语“检查基因在细胞或生物体中的功能”是指检查或研究由此产生的表达、活性、功能或表型。如本文所用,术语“稀有核苷酸”是指不经常发生的天然存在的核苷酸,包括不经常发生的天然存在的脱氧核糖核苷酸或核糖核苷酸,例如天然存在的不是鸟苷、腺苷、胞嘧啶或尿苷的核糖核苷酸。稀有核苷酸的实例包括但不限于肌苷、1-甲基肌苷、假尿苷、5,6-二氢尿苷、核糖胸苷、2n-甲基鸟苷和2,2n,n-二甲基鸟苷。术语“工程化”,如在工程化rna前体或工程化核酸分子中,指示在自然界中未发现前体或分子,因为前体或分子的全部或部分核酸序列由人类创造或选择。一旦创造或选择,序列可以被细胞内的机制复制、翻译、转录或以其他方式加工。因此,在细胞内从包含工程化核酸分子的转基因产生的rna前体是工程化rna前体。如本文所用,术语“键强度”或“碱基对强度”是指寡核苷酸双链体的相对链上的核苷酸(或核苷酸类似物)对之间相互作用的强度,主要归因于所述核苷酸(或核苷酸类似物)之间的h-键合、范德华相互作用等。如本文所用,术语“不稳定核苷酸”是指能够与第二核苷酸或核苷酸类似物形成碱基对的第一核苷酸或核苷酸类似物,使得碱基对具有比常规碱基对(即,watson-crick碱基对)更低的键强度。在某些实施方案中,不稳定核苷酸能够与第二核苷酸形成错配碱基对。在其他实施方案中,不稳定核苷酸能够与第二核苷酸形成摆动碱基对。在又其他实施方案中,不稳定核苷酸能够与第二核苷酸形成模糊碱基对。在又另一个实施方案中,不稳定核苷酸能够形成凸起,其中不稳定核苷酸不与第二核苷酸配对。如本文所用,术语“碱基对”是指寡核苷酸双链体的相对链上的核苷酸(或核苷酸类似物)对之间的相互作用,主要归因于所述核苷酸(或核苷酸类似物)之间的h-键合、范德华相互作用等。如本文所用,术语“键强度”或“碱基对强度”是指碱基对的强度。如本文所用,术语“错配的碱基对”是指由非互补或非watson-crick碱基对组成的碱基对,例如,不是正常的互补g:c、a:t或a:u碱基对。如本文所用,术语“模糊碱基对”(也称为非区分碱基对)是指由通用核苷酸形成的碱基对。如本文所用,术语“通用核苷酸”(也称为“中性核苷酸”)包括具有某种碱基(“通用碱基”或“中性碱基”)的那些核苷酸(例如某些不稳定核苷酸),当形成碱基对时,这种碱基不显著区分互补多核苷酸上的碱基。通用核苷酸主要是疏水性分子,由于堆叠相互作用,其可以有效地群集成反平行双链核酸(例如,双链dna或rna)。通用核苷酸的碱基部分通常包含含氮芳族杂环部分。如本文所用,术语“足够的互补性”或“足够程度的互补性”意指寡核苷酸序列足够互补以结合所需的靶寡核苷酸。本发明的各种方法包括涉及与“适合的对照”(本文中可互换称为“适当的对照”)比较值、水平、特征、特性、性质等的步骤。“适合的对照”或“适当的对照”是本领域普通技术人员熟悉的可用于比较目的的任何对照或标准。在一个实施方案中,“适合的对照”或“适当的对照”是在如本文所述进行方法前确定的值、水平、特征、特性、性质等。例如,可以在将本发明的合成rna剂或dna剂引入细胞或生物体中之前,确定转录速率、mrna水平、翻译速率、蛋白质水平、生物活性、细胞特性或性质、基因型、表型等。在另一个实施方案中,“适合的对照”或“适当的对照”是在表现例如正常特征的细胞或生物.体(例如,对照或正常细胞或生物体)中确定的值、水平、特征、特性、性质等。在又另一个实施方案中,“适合的对照”或“适当的对照”是预先确定的值、水平、特征、特性、性质等。可以将本发明的合成rna剂或dna剂直接引入细胞(即,经细胞内)中,或者在细胞外引入生物体的内腔、间隙空间、循环中,口服引入或者可以通过在含有核酸的溶液中浸浴细胞或生物体来引入。血管或血管外循环、血液或淋巴系统以及脑脊髓液都是可以引入合成rna剂或dna剂的位点。本发明的合成rna剂或dna剂可以使用本领域中已知的核酸递送方法引入,包括注射含有核酸的溶液、用rna剂覆盖的粒子进行轰击、在rna剂的溶液中浸泡细胞或生物体,或者在rna剂的存在下对细胞膜进行电穿孔。也可以使用本领域中已知的用于将核酸引入细胞中的其他方法,诸如脂质介导的载体转运、化学品介导的转运,和阳离子型脂质体转染(诸如磷酸钙)等。合成rna剂或dna剂可以与发挥以下一种或多种活性的其他组分一起引入:增强细胞对核酸的吸收,或以其他方式增加对靶基因的抑制。引入核酸的物理方法包括注射含有生物传感器的溶液、用生物传感器覆盖的粒子进行轰击、在生物传感器溶液中浸泡细胞或生物体或者在生物传感器存在下对细胞膜进行电穿孔。包装到病毒粒子中的病毒构建体会同时实现表达构建体到细胞中的有效引入和由表达构建体编码的rna的转录。可以使用本领域已知的用于将核酸引入细胞的其他方法,诸如脂质介导的载体转运、化学品介导的转运(诸如磷酸钙)等。因此,rna可以与发挥以下一种或多种活性的组分一起引入:增强细胞的rna吸收、抑制单链的退火、使单链稳定或以其他方式增加靶基因的抑制。可将合成rna剂或dna剂直接引入细胞中(即,细胞内),或者在细胞外引入生物体的内腔、间隙空间、循环中,口服引入,或者可以通过在含有rna或dna的溶液中浸浴细胞或生物体来引入。血管或血管外循环、血液或淋巴系统以及脑脊髓液都是可以引入rna或dna的位点。靶细胞可以来自生殖系或体细胞、全能或多能、分裂或非分裂、实质或上皮、永生化或经过转化的细胞等。所述细胞可以是干细胞或分化的细胞。分化的细胞类型包括脂肪细胞、成纤维细胞、肌细胞、心肌细胞、内皮细胞、神经元、神经胶质、血细胞、巨核细胞、淋巴细胞、巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、白细胞、粒细胞、角化细胞、软骨细胞、成骨细胞、破骨细胞、肝细胞和内分泌或外分泌腺的细胞。可以引入的合成rna剂或dna剂的量应使每一细胞递送至少一个拷贝。较高的物质剂量(例如,每一细胞至少5、10、100、500或1000个拷贝)可以产生更有效的抑制;较低剂量也可以用于特定应用。在一个示例性方面,本发明的生物传感器的功效针对其特异性调节细胞中靶标的转录、翻译、选择性剪接和/或mrna稳定性的能力来进行测试。可以用本文所述的一种或多种生物传感器转染细胞。测量靶dna、靶rna(例如mrna)和/或靶蛋白的选择性减少。可以将靶dna、rna或蛋白质的减少与在生物传感器不存在的情况下或在不靶向dna、rna或蛋白质的生物传感器存在的情况下的靶dna、rna或蛋白质的水平进行比较。可以测定外源引入的dna、rna或蛋白质用于比较目的。当利用已知对标准转染技术具有一定抗性的神经元细胞时,可能希望通过被动吸收引入生物传感器。如本文所用,“治疗(trcatment)”或“治疗(treating)”定义为对患有疾病或病症、具有疾病或病症的症状或者有发展疾病或病症倾向的患者施加或施用治疗剂(例如,合成rna剂或dna剂),或者对来自所述患者的分离的组织或细胞系施加或施用治疗剂,以达到治疗、治愈、减轻、缓解、改变、补救、改善、改进或影响所述疾病或病症、所述疾病或病症的症状或患病倾向的目的。在一个方面,本发明提供了一种用于通过向受试者施用治疗剂(例如合成rna剂或dna剂或载体或编码其的转基因)来预防受试者的疾病或病症的方法。有患疾病的风险的受试者可以例如通过诊断或预测中的任一种或其组合来鉴定。预防剂的施用可以在疾病或病症特征性症状的表现之前发生,使得预防疾病或病症,或者可替代地,延迟其进展。本发明另一方面涉及治疗性治疗受试者的方法,即,改变疾病或病症的症状发作的方法。在一个示例性实施方案中,本发明的调节方法涉及使表达病症的细胞与对一种或多种靶序列具有特异性的治疗剂(例如,合成rna剂或dna剂或载体或编码其的转基因)接触,使得实现了与靶序列的序列特异性相互作用。这些方法可以在体外(例如,通过将细胞与所述剂一起培养)或可替代地在体内(例如,通过对受试者施用所述剂)进行。对于预防性和治疗性治疗方法两者,此类治疗均可以基于从药物基因组学领域获得的知识特别定制或修改。如本文所用,“药物基因组学”是指应用基因组技术,诸如对临床研究中和市场上的药物进行基因测序、统计遗传学和基因表达分析。更具体地,所述术语是指有关患者的基因如何确定其对药物的反应(例如,患者的“药物反应表型”或“药物反应基因型”)的研究。因此,本发明另一方面提供了用于根据个体的药物反应基因型利用本发明的靶基因分子或靶基因调节剂定制个体的预防性或治疗性治疗的方法。药物基因组学使得临床医生或医师能够将预防性或治疗性治疗靶向能从所述治疗获得最大益处的患者,并且避免治疗将经历药物相关毒副作用的患者。治疗剂可以在适当的动物模型中进行测试。例如,可以在动物模型中使用如本文所述的合成rna剂或dna剂(或表达载体或编码其的转基因),以确定用所述剂的治疗的功效、毒性或副作用。可替代地,可以在动物模型中使用治疗剂以确定这种剂的作用机制。例如,可以在动物模型中使用剂以确定用这种剂的治疗的功效、毒性或副作用。可替代地,可以在动物模型中使用一种剂以确定这种剂的作用机制。含有本发明的合成rna剂或dna剂的药物组合物可以施用给被诊断为患有病症或有患病风险的任何患者。在一个实施方案中,患者被诊断为患有病症,并且患者在其他方面通常健康状况良好。例如,患者未患绝症,并且患者在诊断后可能至少活过2、3、5或更多年。可以在诊断后立即对患者进行治疗,或者可以延迟治疗直至患者出现更多使人衰弱的症状。在另一个实施方案中,患者尚未达到疾病的晚期。合成rna剂或dna剂可以小于约1.4mg/kg体重,或小于10、5、2、1、0.5、0.1、0.05、0.01、0.005、0.001、0.0005、0.0001、0.00005或0.00001mg/kg体重的单位剂量施用,以及每kg体重小于200nmol的rna剂(例如,约4.4×1016拷贝),或每kg体重小于1500、750、300、150、75、15、7.5、1.5、0.75、0.15、0.075、0.015、0.0075、0.0015、0.00075、0.00015nmol的合成rna剂或dna剂施用。例如,单位剂量可以通过注射(例如,静脉内或肌肉内、鞘内或直接注射到脑中)、吸入剂量或局部施加来施用。特别优选的剂量小于2、1或0.1mg/kg体重。将合成rna剂或dna剂直接递送至器官的剂量可以为每个器官约0.00001mg至约3mg,或优选地每个器官约0.0001-0.001mg,每个器官约0.03-3.0mg,每只眼睛约0.1-3.0mg或每个器官约0.3-3.0mg。剂量可以是有效治疗或预防病症的量。在一个实施方案中,单位剂量的施用频率低于每天一次,例如少于每2、4、8或30天一次。在另一个实施方案中,单位剂量不以一定频率(例如,不是固定频率)施用。例如,单位剂量可以一次施用。在一个实施方案中,有效剂量与其他传统治疗方式一起施用。在一个实施方案中,向受试者施用合成rna剂或dna剂的初始剂量和一个或多个维持剂量。一个或多个维持剂量通常低于初始剂量,例如小于初始剂量的一半。维持方案可以包括每天用0.01μg至1.4mg/kg体重,例如每天用10、1、0.1、0.01、0.001或0.00001mg/kg体重范围内的一个或多个剂量治疗受试者。维持剂量优选地每5、10或30天施用不超过一次。此外,治疗方案可以持续一段时间,所述时间段将根据特定疾病的性质、其严重程度和患者的总体状况而变化。在优选的实施方案中,剂量可以每天递送不超过一次,例如每24、36、48或更多小时不超过一次,例如每5或8天不超过一次。在治疗之后,可以针对病情变化和疾病状态的症状的缓解来监测患者。如果患者对当前剂量水平没有显著反应,则可以增加化合物的剂量,或者如果观察到疾病状态的症状的缓解,如果疾病状态已被消除,或者如果观察到不希望的副作用,则可以减少剂量。根据需要或在特定情况下认为合适,有效剂量可以以单剂量或以两个或更多个剂量施用。如果需要促进重复或频繁输注,可以建议植入递送装置,例如泵、半永久性支架(例如,静脉内、腹膜内、脑池内或囊内)或储库。在一个实施方案中,药物组合物包含多种合成rna剂或dna剂种类。在另一个实施方案中,合成rna剂或dna剂种类具有相对于天然存在的靶序列与另一种类不重叠且不相邻的序列。在另一个实施方案中,多种合成rna剂或dna剂种类对不同的天然存在的靶标是特异性的。在另一个实施方案中,多种合成rna剂或dna剂种类靶向两种或更多种靶序列(例如,两种、三种、四种、五种、六种或更多种靶序列)。成功治疗后,可能希望对患者进行维持疗法以防止疾病状态复发,其中本发明的化合物以维持剂量施用,所述维持剂量在每kg体重0.01μg至100g范围内(参见美国专利号6,107,094)。合成rna剂或dna剂组合物的浓度是足以有效治疗或预防病症或调节人体生理状况的量。施用的合成rna剂或dna剂的浓度或量将取决于对所述剂确定的参数和施用方法,例如,经鼻、经颊或经肺。例如,鼻用制剂往往需要一些成分的低得多的浓度,以避免刺激或烧伤鼻腔。有时希望将口服制剂稀释多达10-100倍,以提供合适的鼻用制剂。某些因素可以影响有效地治疗受试者所需的剂量,所述因素包括但不限于所述疾病或病症的严重程度、此前的治疗、所述受试者的一般健康状况和/或年龄以及存在的其他疾病。此外,用治疗有效量的合成rna剂或dna剂治疗受试者可以包括单次治疗,或优选地可以包括一系列治疗。还应了解用于治疗的合成rna剂或dna剂的有效量可以在具体治疗过程中增加或降低。剂量的变化可以从如本文所述的诊断测定的结果来产生并且变得明显。例如,可以在施用合成rna剂或dna剂组合物后监测受试者。基于来自监测的信息,可以施用额外量的合成rna剂或dna剂组合物。给药取决于待治疗的疾病病况的严重性和反应性,其中治疗过程持续若干天至若干个月,或者直至实现治愈或达成疾病状态的减少。最佳给药时程可以从患者体内药物积累的测量值计算。本领域的普通技术人员可以容易地确定最佳剂量、给药方法和重复率。最佳剂量可以根据个别化合物的相对效力而改变,并且通常可以基于发现在体外和体内动物模型中有效的ec50进行估算。本发明涉及以上所述的剂用于如下所述的预防性和/或治疗性治疗的用途。因此,本发明的调节剂(例如合成rna剂或dna剂)可以并入适于施用的药物组合物中。此类组合物通常包含核酸分子、蛋白质、抗体或调节性化合物和药学上可接受的载体。如本文所用,表述“药学上可接受的载体”旨在包括任何及所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等,这些都与药物的施用相容。此类介质和剂用于药物活性物质的用途是本领域熟知的。除非任何常规介质或剂与活性化合物不相容,否则考虑在组合物中使用它们。补充活性化合物也可以并入组合物中。本发明的药物组合物被配制成与它的预期施用途径相容。施用途径的实例包括肠胃外,例如静脉内(iv)、真皮内、皮下(sc或sq)、腹膜内、肌肉内、口服(例如,吸入)、经皮(局部)和经粘膜施用。用于肠胃外、真皮内或皮下施加的溶液或悬浮液可以包含以下组分:无菌稀释剂,诸如注射用水、盐水溶液、不挥发性油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗细菌剂,诸如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,诸如抗坏血酸或亚硫酸氢钠;螯合剂,诸如乙二胺四乙酸;缓冲液,诸如乙酸盐、柠檬酸盐或磷酸盐;和用于调整张力的试剂,诸如氯化钠或右旋糖。可以用酸或碱,诸如盐酸或氢氧化钠调整ph。肠胃外制剂可以封闭在由玻璃或塑料制得的安瓿、一次性注射器或多剂量小瓶中。适用于可注射用途的药物组合物包含无菌水溶液(在水溶性的情况下)或分散体,以及用于无菌可注射溶液和分散体的即时制备的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、cremophoreltm(basf,parsippany,n.j.)或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物必须无菌并且应是流体,达到存在容易的可注射性的程度。它在制造和储存条件下必须稳定且必须防止诸如细菌和真菌的微生物的污染作用。载体可以是溶剂或分散介质,所述溶剂或分散介质含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其合适的混合物。可以例如通过使用包衣(诸如卵磷脂)、通过在分散体的情况下保持所需要的粒径以及通过使用表面活性剂来保持适当的流动性。预防微生物作用可以通过各种抗细菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等)来实现。在许多情况下,将优选在组合物中包含等渗剂,例如糖、多元醇(诸如甘露醇、山梨糖醇)、氯化钠。通过在组合物中包含延迟吸收的剂(例如单硬脂酸铝和明胶)可以引起可注射组合物的吸收延长。无菌可注射溶液可以通过将所需量的活性化合物与(根据需要)上文所列成分中的一种或成分的组合并入适当的溶剂中,随后进行过滤灭菌来制备。一般而言,分散体通过将活性化合物并入无菌媒介物中来制备,所述媒介物含有碱性分散体介质和所需的来自上文所列的那些成分的其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其产生活性成分加来自其前述无菌过滤溶液的任何另外所需成分的粉末。口服组合物通常包含惰性稀释剂或可食用载体。它们可以封闭在明胶胶囊中或压制成片剂。出于口服治疗性施用的目的,活性化合物可以与赋形剂合并且以片剂、锭剂或胶囊形式使用。也可以使用流体载体制备用作漱口药的口服组合物,其中流体载体中的化合物口服施加且漱口并吐出或吞咽。可以包含药学上相容的粘合剂和/或辅料作为组合物的一部分。片剂、丸剂、胶囊剂、锭剂等可以含有任何以下成分或具有相似性质的化合物:粘合剂,诸如微晶纤维素、黄蓍胶或明胶;赋形剂,诸如淀粉或乳糖,崩解剂,诸如海藻酸、羟基乙酸淀粉钠(primogel)或玉米淀粉;润滑剂,诸如硬脂酸镁或sterotes;助流剂,诸如胶体二氧化硅;增甜剂,诸如蔗糖或糖精;或调味剂,诸如薄荷、水杨酸甲酯或橙味调味剂。对于通过吸入施用,化合物以气雾剂喷雾形式递送,所述气雾剂喷雾来自压力容器或含有合适的推进剂(例如,气体,诸如二氧化碳)的分配器,或喷雾器。全身性施用也可以通过经粘膜或经皮手段来进行。对于经粘膜或经皮施用,在制剂中使用适合于待渗透的屏障的渗透剂。此类渗透剂在本领域中通常是已知的,并且例如对于经粘膜施用,包括清洁剂、胆汁盐和梭链孢酸衍生物。可以通过使用鼻喷雾剂或栓剂来实现经粘膜施用。对于经皮施用,将活性化合物配制成本领域中通常已知的软膏剂、油膏剂、凝胶或霜剂。化合物也可以被制备成栓剂(例如,利用常规的栓剂基质,诸如可可脂和其他甘油酯)或保留灌肠剂形式供直肠递送。合成rna剂或dna剂也可以使用本领域已知的方法通过转染或感染施用,包括但不限于mccaffrcy等人(2002),nature,418(6893),38-9(水动力转染);xia等人(2002),naturebiotechnol.,20(10),1006-10(病毒介导的递送);或putnam(1996),am.j.healthsyst.pharm.53(2),151-160,erratumatam.j.hcalthsyst.pharm.53(3),325(1996)中描述的方法。合成rna剂或dna剂也可以通过适于施用核酸剂(诸如dna疫苗)的方法施用。这些方法包括基因枪、生物注射器(bioinjector)和皮肤贴剂以及无针方法,诸如美国专利号6,194,389中公开的微粒dna疫苗技术,和美国专利号6,168,587中公开的利用粉末形式疫苗的哺乳动物经皮无针疫苗接种技术。另外,鼻内递送是可能的,尤其如hamajima等人(1998),clin.immunol.immunopathol.,88(2),205-10中所述。还可以使用脂质体(例如,如美国专利号6,472,375中所述)和微胶囊化。也可以使用生物可降解的可靶向微粒递送系统(例如,如美国专利号6,471,996中所述)。在一个实施方案中,活性化合物用保护化合物免于从身体迅速消除的载体制备,所述载体诸如控制释放制剂,包括植入物和微胶囊化递送系统。可以使用可生物降解、生物相容的聚合物,诸如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯以及聚乳酸。用于制备此类制剂的方法对于本领域技术人员来说是明显的。这些材料也可以从alzacorporation和novapharmaceuticals,inc.商业获得。脂质体悬浮液(包括具有针对病毒抗原的单克隆抗体的靶向受感染细胞的脂质体)也可以用作药学上可接受的载体。这些都可以根据本领域技术人员已知的方法,例如美国专利号4,522,811中所述的方法制备。为施用方便和剂量均匀配制剂量单位形式的口服或肠胃外组合物是特别有利的。如本文所用的剂量单位形式是指适合作为待治疗受试者的单一剂量的物理上不连续单位;各单位含有经计算产生与需要的药物载体相关联的所需治疗效果的预定量的活性化合物。本发明的剂量单位形式的规格由活性化合物的独特特征和待实现的特定治疗效果,以及在配制这种用于治疗个体的活性化合物的技术中固有的局限性来决定并且直接依赖于这些因素。在细胞培养物或实验动物中,可以通过标准药学程序确定此类化合物的毒性和治疗功效,例如,确定ld50(对群体的50%致死的剂量)和ed50(对群体的50%治疗有效的剂量)。毒性作用与治疗作用之间的剂量比为治疗指数,并且其可以表示为ld50/ed50的比率。优选表现出大治疗指数的化合物。虽然可以使用表现出毒副作用的化合物,但应小心设计使此类化合物靶向到受影响组织的部位的递送系统,以便使对未受感染的细胞的潜在损害减到最小,并由此减少副作用。从细胞培养物测定和动物研究中获得的数据可以用于配制用于人类的剂量范围。此类化合物的剂量优先处于包括具有很少毒性或没有毒性的ed50的循环浓度的范围内。剂量可以取决于所采用的剂型和所利用的施用途径而在这个范围内变化。对于本发明方法中使用的任何化合物,治疗有效剂量最初可以由细胞培养物测定来估计。可以在动物模型中配制剂量,以达到包括如在细胞培养物中所确定的ec50(即,达到半数最大反应的测试化合物的浓度)的循环血浆浓度范围。这一信息可以用于更准确地确定人中的有用剂量。血浆中的水平可以例如通过高效液相色谱法来测量。所述药物组合物可以与可选的施用说明书一同被包含于容器、包装或分配器中。如本文所定义,治疗有效量的合成rna剂或dna剂(即,有效剂量)取决于所选的合成rna剂或dna剂。例如,可以施用在大约1μg至1000mg范围内的单一剂量;在一些实施方案中,可以施用10、30、100或1000μg。在一些实施方案中,可以施用1-5g组合物。组合物可以每天施用一次或多次到每周施用一次或多次;包括每隔一天一次。本领域技术人员应理解,某些因素可能影响有效治疗受试者所需的剂量和时程,这些因素包括但不限于,疾病或病症的严重程度、先前的治疗、受试者的一般健康状况和/或年龄以及存在的其他疾病。此外,用治疗有效量的合成rna剂或dna剂治疗受试者可以包括单次治疗,或优选地可以包括一系列治疗。本发明的核酸分子可以例如使用本领域中已知的方法(包括但不限于xia等人,(2002),同上文中所述的那些方法)插入表达构建体中,例如病毒载体、逆转录病毒载体、表达盒或质粒病毒载体。表达构建体可以通过例如吸入、口服、静脉内注射、局部施用(参见美国专利号5,328,470)或通过立体定向注射(参见例如,chen等人(1994),proc.natl.acad.sci.usa,91,3054-3057)递送给受试者。递送载体的药物制剂可以包括在可接受的稀释剂中的载体,或者可以包括其中包埋有递送媒介物的缓慢释放基质。可替代地,在可以由重组细胞完整产生整个递送载体(例如,逆转录病毒载体)的情况下,药物制剂可以包含一个或多个产生基因递送系统的细胞。递送途径可以取决于患者的病症。在某些示例性实施方案中,可以通过iv或sc施用向受试者施用本发明的合成rna剂或dna剂。除了本发明的合成rna剂或dna剂外,还可以向患者施用第二疗法,例如姑息疗法和/或疾病特异性疗法。第二疗法可以是,例如,症状性的(例如,用于缓解症状),保护性的(例如,用于减缓或停止疾病进展),或恢复性的(例如,用于逆转疾病过程)。通常,本发明的合成rna剂或dna剂可以通过任何合适的方法施用。如本文所用,局部递送可以指合成rna剂或dna剂直接施加于身体的任何表面,包括眼睛、粘膜、体腔表面或任何内表面。局部施用的制剂可以包括经皮贴剂、软膏、洗剂、乳膏、凝胶、滴剂、喷雾剂和液体。常规药物载体、水性、粉末或油性基质、增稠剂等可以是必需或希望的。局部施用也可以用作选择性地将合成rna剂或dna剂递送至受试者的表皮或真皮,或其特定层或下层组织的手段。用于鞘内或心室内施用的组合物可以包含无菌水溶液,其也可以含有缓冲液、稀释剂和其他合适的添加剂。用于鞘内或心室内施用的组合物优选地不包含转染试剂或除了例如与合成rna剂或dna剂连接的亲脂性部分之外的另外的亲脂性部分。用于肠胃外施用的制剂可以包含无菌水溶液,其也可以含有缓冲液、稀释剂和其他合适的添加剂。心室内注射可以通过例如附着于储库的心室内导管来促进。对于静脉内使用,应控制溶质的总浓度以使制剂等渗。本发明的合成rna剂或dna剂可以通过肺部递送施用给受试者。肺部递送组合物可以通过吸入分散体来递送,使得分散体内的组合物可以到达肺部,在那里它可以容易地通过肺泡区域直接吸收到血液循环中。肺部递送对于全身递送和对于治疗肺部疾病的局部递送都可以是有效的。肺部递送可以通过不同方法实现,包括使用雾化、气溶胶化、胶束和基于干粉的制剂。使用液体喷雾器、基于气溶胶的吸入器和干粉分散装置可以实现递送。计量剂量装置是优选的。使用雾化器或吸入器的一个好处是最小化污染的可能性,因为这些装置是独立的。例如,干粉分散装置递送可以容易地配制成干粉的药物。合成rna剂或dna剂组合物可以自身或与合适的粉末载体组合而稳定地作为冻干或喷雾干燥的粉末储存。用于吸入的组合物的递送可以通过给药定时元件来介导,所述给药定时元件可以包括定时器、剂量计数器、时间测量装置或时间指示器,当将所述给药定时元件结合到所述装置中时能够在施用气溶胶药物期间实现患者的剂量跟踪、顺应性监测和/或剂量触发。可用作载体的药物赋形剂的类型包括稳定剂,诸如人血清白蛋白(hsa),填充剂,诸如碳水化合物、氨基酸和多肽;ph调节剂或缓冲液;盐,诸如氯化钠;等等。这些载体可以呈结晶或无定形形式,或者可以是两者的混合物。特别有价值的填充剂包括相容的碳水化合物、多肽、氨基酸或其组合。合适的碳水化合物包括单糖,诸如半乳糖、d-甘露糖、山梨糖等;二糖,诸如乳糖、海藻糖等;环糊精,诸如2-羟丙基-β-环糊精;和多糖,诸如棉子糖、麦芽糖糊精、葡聚糖等;糖醇,诸如甘露醇、木糖醇等。优选的一组碳水化合物包括乳糖、海藻糖、棉子糖麦芽糖糊精和甘露醇。合适的多肽包括阿斯巴甜。氨基酸包括丙氨酸和甘氨酸,优选甘氨酸。合适的ph调节剂或缓冲液包括由有机酸和碱制备的有机盐,例如柠檬酸钠、抗坏血酸钠等;柠檬酸钠是优选的。本发明的合成rna剂或dna剂可以通过口服和鼻腔递送施用。例如,通过这些膜施用的药物具有快速起效,提供治疗性血浆水平,避免肝首过代谢,并避免药物暴露于恶劣的胃肠(gi)环境。另外的优点包括容易进入膜位点,使得可以容易地施加、定位和去除药物。在一个实施方案中,通过口服或鼻腔递送施用的合成rna剂或dna剂已被修饰为能够穿过血脑屏障。在一个实施方案中,通过植入装置分配包含合成rna剂或dna剂的组合物的单位剂量或测量剂量。所述装置可以包括监测受试者体内的参数的传感器。例如,所述装置可以包括泵,诸如渗透泵,并且任选地包括相关的电子器件。合成rna剂或dna剂可以包装在病毒天然衣壳中或由其衍生的化学或酶促产生的人造衣壳或结构中。在某些其他方面,本发明提供了试剂盒,其包括含有合成rna剂或dna剂的药物制剂的合适容器。在某些实施方案中,药物制剂的各个组分可以在一个容器中提供。可替代地,可能希望将药物制剂的组分分别置于两个或更多个容器中,例如一个用于合成rna剂或dna剂制剂的容器,和至少另一个用于载体化合物的容器。所述试剂盒可以以许多不同的配置来包装,诸如一个或多个容器在单个盒子中。可以组合不同的组分,例如,根据试剂盒提供的说明书。可以根据本文描述的方法来将组分组合,例如,以制备和施用药物组合物。所述试剂盒还可以包括递送装置。本领域技术人员应易于了解,本文所述的方法的其他合适修改和适应可以在不脱离本文公开的实施方案的范围的情况下使用合适的等效物来进行。现已详细描述某些实施方案,通过参考以下实施例将对其有更明确的理解,所述实施例仅出于说明目的包括在内而不意图具有限制性。除非另外定义,否则本文所用的所有技术和科学术语均具有与由本发明所属领域的普通技术人员通常所理解的相同的含义。尽管在实践或测试本发明时可以使用与本文所述的那些方法和材料相似或等效的方法和材料,但以下描述了合适的方法和材料。本文提到的所有公布、专利申请、专利和其他参考文献以引用的方式整体并入。如有矛盾,以包括定义在内的本说明书为准。另外,材料、方法和实例仅是说明性的而非意图具有限制性。实施例实施例1:使用来自生物rna的信息来架设选择文库检查具有多螺旋填充(即,三级折叠)的小生物rna指示两种可以被认为是特权支架的复现结构。第一种是h型假结,其广泛存在于生物rna中,包括病毒mrna中的小核酶核糖体移码元件,以及天然和合成适体。然而,从设计的角度来看,这种折叠很难设计。另一种是三向结体(3wj),所述三向结体由远程三级相互作用支持,这种相互作用在结体的周围组织螺旋排列。此折叠更适合于并入适体的rna装置的设计,因为其将可设计的螺旋元件(称为p1螺旋)定位在通常容纳在结体中的配体结合位点附近。在三向结体折叠组中,有大量潜在的候选物选择可以用于架设初始序列文库以用于体外选择。本文举例说明了三种:枯草芽孢杆菌xpt-pbux鸟嘌呤核糖开关(本文称为“gr”)的适体结构域,霍乱弧菌vc2环状二-gmp核糖开关(本文称为“cdg”)和曼氏血吸虫锤头状核酶(本文称为“hh”)的适体结构域(图1)。在这些亲本rna支架的每一个中,所述结体承载p1螺旋附近的关键生物活性,所述p1螺旋可以充当读出结构域的二级结构桥。起始文库被设计成保留支架的整体二级和三级结构,同时在结体中随机化足够数量的核苷酸以确保足够的池多样性,从而使得优胜者出现。结体的连接链中的所有核苷酸(每个位置处四个核苷酸的相等群体),以及在结体附近的每个螺旋中的至少一个碱基对被随机化(图1)。对于gr支架,这产生了23个随机化核苷酸位置的初始文库,其等于约7×1013个序列的文库大小(423个序列);cdg和hh含有相似水平的多样性(21个随机化核苷酸位置,等于约4×1012个序列的文库大小;421个序列)。理论上,此序列数在具有至少五倍冗余的rna的初始池中充分表示。虽然这比针对典型选择所推荐的多样性低得多,但是已经从具有更有限的序列空间采样的起始池获得了新的适体。三个支架被整合到具有特定设计特征的文库盒中。含有支架序列的初始和末端碱基的每个支架的p1螺旋在所有文库中被替换为含有螺旋的结构化扩增盒,所述扩增盒基于针对rna结构的引物延伸法分析选择性2′-羟基酰化反应(“shape”)化学探测来开发的扩增盒来设计(图17)。这确保了复制所必需的恒定区被构建并且不太可能被并入选择的适体中。为了进一步最小化恒定区参与配体结合位点形成的可能性,将p1螺旋延伸至至少10个碱基对。编码初始起始文库的dna模板的完整序列在表1和图23中给出。表1.寡核苷酸和模板的序列。a“n”代表a、c、g和t的组成各自为大约25%的位置。brna适体和传感器序列作为其等同的dna序列给出。支架选择的另一个复杂问题是病毒逆转录酶(rt)的低保真度。mmlvrt的工程化以改进热稳定性和加工性来产生此酶的最常用形式降低了其已经较低的保真度。在支架的保守序列中错误并入或缺失核苷酸容易破坏使整体折叠稳定的三级相互作用。通过rt更有效地扩增缺乏结构的rna,这可以在每轮选择的复制步骤中引入显著的偏差,这部分可能导致在选择中观察到的“小基序的暴政”现象。为了解决这个问题,采用最近表征的衍生自来自嗜热生物嗜热脂肪土芽孢杆菌(geobacillusstearothermophilus)(gsi-iic-mrf或“gsi”)的移动ii组内含子的rt,其在高达70℃(相对于ssiii的55℃)下保持活性并且具有固有的比mmlv衍生的rt更高的保真度。为了比较,使用衍生自mmlv(superscriptiii或“ssiii”)的rt以及gsi进行gr支架选择。实施例2:针对5htp的支架选择产生许多潜在的适体选择的目标是5-羟基-l-色氨酸(5htp;图2a),血清素的直接生物合成前体,其通过其羧酸酯基团固定在固体基质上。对每个文库进行七轮选择,对l-色氨酸进行反选择,并在后几轮中进行越来越严格的洗涤程序。在ssiii选择中,采用常规selex方案,其中在除去非结合rna的竞争性洗脱之前的早期几轮中广泛洗涤亲和柱。最初在第四轮中观察到竞争性洗脱,并且在第六轮中以总输入rna的>50%达到峰值。gsi选择使用比通常推荐的方案较不严格的方案,其中在竞争性洗脱下留在柱上的大约最终10%的总rna在最初的四轮中被收集用于扩增以在增加洗涤严格性之前保持池中的序列多样性。选择的细节在实施例6-8和表2中给出。表2:每个循环的选择条件.*每次洗涤构成3个柱体积的缓冲液在保持序列多样性和最小化早期随机事件的过程中,依靠下一代测序(ngs)和下游生物信息学分析的组合来揭示潜在的适体并阐明选择的关键特征。对于每个选择,从最后一轮获得>200,000个rna读段,并且对所得序列进行聚集并产生最大似然树。对使用gr支架的ssiii和gsi选择进行比较揭示了几个重要特征。gr/ssiii选择的距离矩阵清楚地显示仅少数分离的簇,并且在每个簇内,序列具有高度的内部相关性(图2b)。大多数(>80%)序列聚集成三个不同的序列相关家族,称为5htp-i、-ii和-iii(图2d),其余聚集成难以解释的小群体。这是典型的传统selex,其中通常鉴定单个分离物,并且进一步诱变和选择是获得共变信息所必需的。相比之下,gr/gsi选择产生更多样化的簇,其具有更高的序列采样,这些序列填充主要簇之间的区域(图2c和2d)。使用gsi的cdg和hh选择在它们的序列空间中具有相似的多样性,具有许多潜在的适体(图7)。虽然传统的选择方法通常依赖于过度选择以促进发现具有有限序列信息的适体,但保留优胜者的多样性和ngs的序列分析允许更全面地分析保守性和共变模式,有助于确定共有适体序列。在gr-支架l-dopa选择中观察到相似的结果(图18)。来自产生经验证的5htp适体的每个簇的250个序列的子集在本文中进一步描述。出乎意料的是,除了ssiii选择的有限序列多样性之外,还观察到缺失和点突变的大量积累,使得在最后一轮中没有回收保留支架恒定区的完全同一性的序列。其中两个簇,5htp-1和5htp-iii(图2d),在支架的l2或l3中具有缺失,所述l2或l3对于形成嘌呤核糖开关的环-环相互作用是必需的。此外,5htp-iii成员含有在产生完全替代性二级结构的潜力的选择过程中获得的若干点缺失。此序列的最小自由能(mfe)和共变分析表明二级结构与l-色氨酸适体(包含双向结体的适体;majerfeld和yarus,nucleicacidsresearch,2005,33,5482-5493)的共有序列一致,进一步表明支架未在5htp-iii家族中维持。5htp-ii是维持设计到文库中的三级结构所必需的序列要求的唯一主要簇,并且是ssiii与gsi选择之间共享的唯一丰富序列。相比于使用ssiii的选择,gsi选择表现出在支架的恒定区中积累的少量突变,指示支架的稳健维持(图8)。为了鉴定具有高适体潜力的序列,单独比对来自每个池的十个最稠密的簇,预测mfe结构,并产生共变模型。这允许产生通过选择所呈现的主要共有序列的信息丰富的视图。由于gr/ssiii实验被高度过度选择,因此选择来自三个主要簇中的每一个的最丰富的序列用于进一步验证。对于gsi选择,选择来自一个或多个簇的其共有mfe结构与亲本支架一致的优势序列。实施例3:最密集的簇保留支架结构并以高选择性结合5htp结构支架极大地促进了所得适体的结构和相互作用特征的验证。使用n-甲基靛红酸酐(“nmia”)对rna结构进行化学探测(一种称为“shape”的技术),揭示了亲本支架的二级和三级结构以及适体中依赖配体的结构变化是否被保留。在gr/ssiii选择中,5htp-i和5htp-ii适体在三向结体元件内配体存在下nmia反应性模式发生局部变化,与此为配体结合位点一致(图3a,图19)。然而,5htp-iii在恒定区中显示j2/3外的变化,与先前描述的色氨酸适体的预测结构和l-trp结合位点一致(majerfeld和yarus)。使用l3中独特的、与配体无关的nmia反应特征来评估gr支架的保留,这种特征仅在l3与l2相互作用时存在(stoddard等人,rna,2008,14,675-684)。5htp-ii是表现出此特征的来自ssiii选择的三个簇的唯一序列。相反,来自gr/gsi选择的所有测试序列具有此三级结构特征(图9a和20)。这些数据强烈指示gr/ssiii选择产生三种不同的适体,其中仅5htp-ii保留结构支架,而gr/gsi选择产生维持支架的多种解决方案。虽然gr/gsi分离物的5htp依赖性特征比5htp-ii和亲本适体的特征弱,但定量揭示它们以类似方式定位于结体(图3b)。cdg/gsi和hh/gsi选择的shape表征显示新类型适体的配体依赖性变化和类似于亲本支架的总体反应性模式(图9b、图9c、图21和图22)。通过等温滴定量热法(itc)评估这些适体对5htp和一组化学上相似的化合物的亲和力和选择性。重要的是,对于所有测试的适体,5′-和3′-盒序列不是5htp结合所必需的,从而指示中性序列的成功设计(图3c)。此分析出现了几种趋势。首先,两种不保留亲本支架的适体(5htp-i、-iii)不区分5htp和l-色氨酸(表3),这是基于细胞的应用的关键要求。其次,保留三向结体支架的大多数适体对5htp的亲和力高于具有破坏支架的适体,并且都强烈排斥l-色氨酸。这指示支架的结构对于产生选择性结合口袋,同时保持与结合氨基酸的其他合成和天然适体相当的亲和力是重要的。5htp-i和5htp-iii在5htp与血清素之间显示出强烈的区别,这意味着主链原子被直接识别。相比之下,许多保留支架的适体与n-甲基-5-羟基-l-色氨酸酰胺结合的亲和力是5htp的2至4倍高。此外,它们结合血清素,即5htp的脱羧产物,表明对结合中主链原子的要求较低(表3)。因此,这些适体中的一些可能是优异的血清素传感器。来自gsi选择的最引人注目的特点是,尽管来自每个选择的优势适体具有不同的支架结构,但是它们集中在高度相似的结合亲和力和选择性概况上,揭示三向结体是用于容纳5htp结合口袋的稳健折叠。总之,这些数据显示,不同的寡核苷酸结体,诸如三向结体结构变体,能够找到用于5htp识别的稳健解决方案。表3.适体对5htp和相关化合物的亲和力a在25℃下在含有10mmmgcl2的缓冲液中进行所有测量。b无法检测到。实施例4:5gr-ii适体的结构分析揭示复现的rna基序用于5htp结合为了进一步证明本文所述的支架选择策略保留了亲本rna的折叠并阐明rna如何可以识别5htp,与5htp复合的5htp-ii的结构以分辨率确定(图3d,代表性电子密度图如图10所示,并且晶体学统计数据在表4中给出。)此结构与亲本xpt鸟嘌呤核糖开关适体在残基19-77中的所有骨架原子上以的r.m.s.d.在整体上叠加,其中p1相对于结合口袋和变化的结体区域的不同角度产生偏差的主要来源(图16a至图16c)。在l2-l3三级相互作用中,碱基-碱基相互作用的模式和骨架几何形状在两个rna之间几乎相同(在残基31-39、61-67中的所有原子上,r.m.s.d.)。因此,在选择过程中,gr支架在整体上和局部保持完整。表4.晶体学数据和细化统计数据。*括号中的值是针对分辨率最高的壳。5htp-ii的配体结合口袋位于三向结体内,所述三向结体具有与亲本rna完全不同的局部结构。直接配体接触主要由j2/3中的核苷酸,使用常见的rna结构模块,即t-环来介导(图4a)。j2/3的前五个核苷酸形成规范的t-环结构,其几乎完全与trnaphet-环叠加(对于骨架残基,r.m.s.d.)。通过与d-环的长程watson-crick配对来稳定trnat-环中的3位对于活性是至关重要的。5htp-ii在t-环的g47与j3/1的c75之间具有相似的相互作用。5htp-iit-环容纳在4位与5位之间堆叠的5htp,其方式与trnat-环如何容纳来自d-环的嵌入嘌呤是类似的,并且与其核糖开关的硫胺素焦磷酸(tpp)识别相似(图4b)。虽然t-环直接负责配体识别,但来自所有三个随机区域的核苷酸涉及局部结构,这种局部结构有助于形成稳定t-环的紧密结体。鉴于支持t-环的这一组复杂的相互作用,分离的t-环很可能不结合5htp。5htp-ii的晶体结构产生了对其他支架适体进行的5htp识别的额外见解。gr/gsi选择中最丰富的簇5htp-iv也包含t-环的uugaa特征。然而,所述基序被单个核苷酸3′移位,可能导致三向结体内的替代取向,如5htp-ii与5htp-iv之间j1/2和j3/1中的显著序列差异所示。在hh选择中,最稠密的簇(5htp-viii)的最丰富序列也包含j2/3中t-环的保守uugaa序列。5htp-viii适体的此区域的序列变异分析揭示了仅以轻微偏差与生物t-环的保守模式匹配的保守模式(图11)。这表明t-环基序可能是用于通过rna识别小平面化合物的稳健模块。虽然cdg选择的rna中没有明确可识别的t-环,但结合参数几乎完全匹配其他两种选择,这表明了相似的识别模式。实施例5:支架适体可以容易地并入稳健的小分子传感装置中利用支架选择技术证明能够产生折叠良好、高度结构化的且特异性的rna适体,因此测试了其产生功能性合成rna生物传感器的能力。为了产生这些装置,使用了通过短螺旋元件将小分子结合适体与荧光团结合模块连接的策略。来自每个文库的先导候选适体与broccoli荧光团结合适体偶联,其中两个螺旋变体(通信模块称为“a”和“u”,图12)连接两个适体。这产生一组rna,这些rna能够在体外以几个数量级以不同的输出荧光动态范围来感测5htp和/或血清素(表5和表6)。当存在配体时,许多这些传感器能够产生与在相同条件下单独未缀合的broccoli适体的荧光水平相等或更大的荧光水平。相对于通过broccoli荧光监测的分离的适体的kd,降低的表观f50(定义为引起半数最大荧光响应所需的配体浓度)是所述系统固有的。然而,几种支架适体在其kd与f50之间仅显示~10倍的差异。总体而言,这与文献中天然核糖开关适体结构域的实例相比是有利的,所述天然核糖开关适体结构域的kd与f50的差异可以接近1000倍,当灵敏度或配体毒性是核糖开关应用中的限制因素时,需要考虑这一重要特征。表5.基于broccoli的5htp/血清素传感器的体外性能a在25℃下在含有5mmmgcl2的缓冲液中进行所有测量。b无法检测到。表6:5htp-broccoli传感器的性能a定义为(饱和配体下的荧光/不存在配体时的荧光);灰色阴影表示显示出强大性能的传感器。b定义为(最大传感器荧光/分离的broccoli适体荧光)*100。c定义为引发半数最大荧光响应所需的配体浓度。在上述装置中,5htp-ii(a)能够特异性地感测大肠杆菌中的5htp。这种遗传编码的传感器在向丰富化学成分限定的培养基中生长的大肠杆菌中加入2mm5htp(10分钟)后产生荧光的快速诱导,其中大约80%的细菌在20分钟内显示出可观察到的响应(图5)。荧光信号完全取决于结合5htp的rna装置。当l-色氨酸包含在培养基中时或当传感器在t-环模块中含有点突变(a48u),所述点突变消除配体与分离的适体的结合(数据未示出)时,没有观察到信号增益。此外,在5htp存在下相对荧光的增加与基于活细胞中天然核糖开关适体结构域的稳健环状二核苷酸传感器相当。重要的是,这些观察结果与非天然适体在荧光传感器背景下与天然适体相比具有降低的细胞内性能的说法相反(you,pnas(2015)112:21,e2756-2765)。挑选出来的支架5htp适体也与来自天然核糖开关表达平台的工程化模块二级开关偶联以产生基因调控元件。使用其中适体的p1螺旋和表达平台直接偶联的偶联策略,通过将5htp-iv传感器和pbue“开启”开关平台融合来工程化精确的配体依赖性转录调节剂(图6a)。所得的rna元件能够以与分离的适体结构域相同的特异性概况在体外激活转录通读,并具有与天然核糖开关一致的动态范围(图6b);令人惊讶的是,l-trp完全不能实现通读转录。同样,kd与t50之间的差异并非微不足道(对于血清素为6倍,对于5htp为22倍),但反映了天然核糖开关的观察趋势,其中适体的热力学性质并不总是决定其与衔接子序列通信的能力。实施例6:根据示例性实施方案的支架适体将broccoli适体与trna支架偶联以稳定生物传感器以用于基于细胞的应用。将四种不同的gr-支架5htp适体偶联至四个不同长度的通信模块(2至5个a-u和u-a碱基对;图14a),并且测试每种所得生物传感器以配体依赖性方式发荧光的能力。在体外(图14b;表7和表8)和大肠杆菌(图14d;表9和表10)中评估每个传感器相对于分离的broccoli适体的荧光和最大亮度的配体依赖性倍数变化。为了能够在体外快速筛选候选物,将生物传感器转录并直接用于荧光测定,无需进一步纯化。这些数据揭示三个适体(5gr-ii、-iv和-v)产生的传感器可以在体外和细胞环境中检测5htp和/或血清素,5gr-ii显示出在荧光和最大亮度的组合倍数增加方面的最佳性能。为了进一步证明支架适体的潜力,使用活细胞成像来可视化使用5gr-ii/cm-4生物传感器通过大肠杆菌进行的5htp吸收。单细胞的荧光成像揭示了在向丰富化学成分限定的培养基中生长的大肠杆菌中加入2mm5htp后的快速荧光诱导,其中大约80%的细菌在20分钟内显示出可观察到的响应(图15a、图15d)。荧光信号完全取决于结合5htp的rna装置;当l-色氨酸包含在培养基中时(图15b、图15e)或当传感器在t-环模块中含有点突变(a48u),所述点突变消除配体与分离的适体的结合(图15c、图15f)时,,没有观察到可检测的信号增益。在5htp存在下观察到的相对荧光的增加与基于活细胞中的天然核糖开关适体结构域的稳健的环状二核苷酸传感器相当。这些结果与合成适体与天然适体相比具有降低的细胞内性能的先前说法相反,并且在此显示多种合成适体能够在变构荧光rna的背景下在大肠杆菌内起作用。上述5htp生物传感器使用挑选出来的适体的生物化学和生物物理分析的知识来设计。然而,用于快速开发生物传感器的最佳工作流程将能够使用仅从选择物的计算分析得到的信息来设计候选rna。为了证明支架适体结合了在没有实验表征的情况下能够进行生物传感器工程化的设计原理,上述生物传感器策略用于衍生自l-dopa选择的四种适体。在将这些适体并入变构荧光传感器之前,这些适体中的任一种均未以任何方式被验证。在体外(图14c;表7和表8)和在大肠杆菌中(图14e;表9和表10)用l-dopa和多巴胺筛选所得的生物传感器揭示了两种在两种情况下起作用的适体(dg-i和dg-ii)。表7.荧光gr-支架适体的体外倍数诱导适体配体cm-2cm-3cm-4cm-55gr-ii5htpa3.5±0.1b5.1±0.22.5±0.11.2±0.15gr-iv5htp14±13.5±0.74.1±0.22.7±0.25gr-v5htp13±111±17.4±0.41.8±0.15gr-vi5htp0.9±0.11.2±0.10.9±0.11.1±0.15gr-ii血清素1.5±0.13.7±0.11.8±0.11.1±0.15gr-iv血清素16±15.5±1.14.2±0.23.2±0.25gr-v血清素11±18.9±0.87.3±0.61.3±0.25gr-vi血清素0.7±0.11.4±0.20.8±0.11.1±0.1dgr-i3,4-dhf2.4±0.26.4±0.62.3±0.21.5±0.1dgr-ii3,4-dhf2.3±0.43.8±0.81.2±0.11.1±0.1dgr-iii3,4-dhf1.3±0.11.4±0.11.6±0.11.1±0.2dgr-iv3,4-dhf1.9±0.11.7±0.14.3±0.21.3±0.1dgr-i多巴胺3.5±0.67.9±0.92.5±0.21.5±0.1dgr-ii多巴胺4.6±0.84.2±1.11.3±0.11.1±0.1dgr-iii多巴胺1.2±0.11.4±0.11.7±0.11.0±0.1dgr-iv多巴胺2.6±0.12.0±0.18.0±0.31.3±0.1a配体浓度为2mm。b倍数诱导(fi)计算为(总荧光,+配体)/(总荧光,-配体)。将误差报告为三次独立实验的平均值的标准误差。表8.荧光gr-支架适体相对于亲本broccoli的体外亮度适体配体cm-2cm-3cm-4cm-55gr-ii5htpa54±1075±1489±1697±205gr-iv5htp5.9±1.40.4±0.110±219±45gr-v5htp13±33.4±0.55.7±1.35.5±1.05gr-vi5htp1.0±0.112±214±343±85gr-ii血清素22±354±963±988±175gr-iv血清素7±20.6±0.111±323±55gr-v血清素11±22.7±0.26.2±1.33.8±0.55gr-vi血清素0.8±0.113±112±345±9dgr-i3,4-dhf0.5±0.18.9±0.76.7±1.122±4dgr-ii3,4-dhf1.3±0.711±44.7±1.117±1dgr-iii3,4-dhf3.3±0.225±415±261±11dgr-iv3,4-dhf11±347±835±578±10dgr-i多巴胺0.8±0.112±17.7±1.625±6dgr-ii多巴胺2.6±1.312±45.1±1.019±2dgr-iii多巴胺3.1±0.225±416±256±11dgr-iv多巴胺15±453±966±1176±9a适体配体浓度为2mm。b百分比亮度计算为(总荧光传感器,+配体)/(总荧光broccoli,+配体)。将误差报告为三次独立实验的平均值的标准误差。表9.荧光gr-支架适体的体内倍数诱导适体配体cm-2cm-3cm-4cm-55gr-ii5htpa0.9±0.12.6±0.35.3±0.23.1±0.455gr-iv5htp1.0±0.21.7±0.71.4±0.151.9±0.555gr-v5htp1.2+0.21.4±0.21.6±0.20.9±0.15gr-vi5htp0.9±0.11.1±0.11.1±0.11.4±0.15gr-ii血清素1.0±0.11.8±.13.0±0.42.5±0.35gr-iv血清素1.0±0.10.9±0.12.6±0.76.9±1.25gr-v血清素1.1±0.11.7±0.41.8±0.20.7±0.15gr-vi血清素1.0±0.21.6±0.11.6±0.11.9±0.2dgr-i多巴胺0.7±0.10.9±0.31.6±0.62.7±0.5dgr-ii多巴胺0.6±0.11.0±0.43.1±0.82.9±0.5dgr-iii多巴胺0.6±0.10.4±0.20.7±0.10.8±0.1dgr-iv多巴胺1.7±0.90.7±0.21.3±0.10.9±0.5a配体浓度为2mm。b倍数诱导(fi)计算为(总荧光,+配体)/(总荧光,-配体)。将误差报告为三次独立实验的平均值的标准误差。表10.相对于亲本broccoli适体的荧光gr-支架适体的体内亮度适体配体cm-2cm-3cm-4cm-55gr-ii5htpa0.4±0.12±0.320±227±25gr-iv5htp0.4±0.10.7±0.40.7±0.20.9±0.35gr-v5htp0.5±0.10.4±0.10.8±0.10.8±0.15gr-vi5htp0.4±0.10.7±0.10.6±0.17±0.45gr-ii血清素0.4±0.12.2±0.115±225±65gr-iv血清素0.5±0.10.4±0.11.5±0.34.8±0.85gr-v血清素0.7±0.10.6±0.11.0±0.20.8±0.15gr-vi血清素0.4±0.11.3±0.11.1±0.39.7±0.3dgr-i多巴胺0.7±0.10.3±0.10.8±0.52±1dgr-ii多巴胺0.4±0.10.7±0.33±13±2dgr-iii多巴胺0.5±0.10.2±0.10.6±0.13±1dgr-iv多巴胺0.4±0.10.4±0.21±0.33±2a配体浓度为2mm。b百分比亮度计算为(总荧光传感器,+配体)/(总荧光broccoli,+配体)。将误差报告为三次独立实验的平均值的标准误差。实施例7:讨论基于rna的装置正朝着成为合成生物学的强大工具的方向发展,这是由与基于蛋白质的替代品相比的一组独特的特征来推动的,包括顺式调节能力、可预测的二级结构和小的遗传足迹。努力的重点是创造合成的核糖开关、适体酶和荧光rna传感器,但是在很大程度上由于在此类装置的环境中起作用的小分子受体的有限可用性,它们的潜力尚未完全实现。在本文提出的工作中,已经设计了一种策略,其利用天然进化的核糖开关和核酶的二级和三级结构构架来架设通过体外选择产生的小分子结合口袋。重要的是,除了从最后一轮选择的高通量测序获得的信息之外不使用任何信息,使用此方法选择用于l-dopa的适体与荧光适体模块偶联以产生在细胞环境中起作用的可遗传编码的生物传感器。本文所述的方法和组合物的一个关键优势是在平行选择中使用多个支架以获得一套适体。这与本领域中已知的传统选择显著不同,其中从简单的随机化池可再现地生成相同的解决方案子集,所述简单的随机化池显著地限制了传感器的多样性和发展。虽然衍生自不同支架的适体对5htp具有相似的亲和力和对l-色氨酸的选择性,但是关于它们通过p1螺旋与读出结构域通信的能力,它们明显具有不同的特性,p1螺旋是所有支架的共同特征。在生物核糖开关中,配体直接接触或诱导rna中的构象变化,其涉及将适体连接至下游调节开关的p1螺旋。不受科学理论的束缚,假设不同适体的传感器性能差异部分地由于配体与域间(p1)螺旋之间的空间关系的变化,这是在选择中不能完全控制的特征。然而,与深度选择不同,在此呈现的支架选择方法通过约束可能的配体位置而强烈将选择朝向有利的配体/p1取向偏转。利用一套适体,可以采用组合方法快速筛选传感器,而无需广泛的适体表征或装置优化,如本文多巴胺传感器开发所代表的(图19)。从源自深度选择的适体开发rna装置需要彻底表征以及通信模块的广泛筛选,同时由于缺乏多样性而将传感适体留作固定的、不可改变的节点。利用本文所述的支架选择方法和组合物,一组不同的适体可以组合偶联至一组通信模块,并快速筛选具有所需活性的变体,如l-dopa选择所证明的。以这种方式,本文提供的方法和组合物应通过缓解其开发中的关键瓶颈来促进rna装置和传感器的有利开发。值得注意的是,虽然在本研究中在每个选择中只关注于最稠密的簇用于表征和传感器设计,但在每个选择中,有许多簇包含替代序列,可以进一步丰富初始的适体池以开发下游应用。本文所述的选择方法和组合物的第二个强大优点是由在三向结体结构的三级相互作用提供的细胞环境中稳健折叠的可能性。这些适体中的每一个都具有经历广泛生物进化的折叠。此外,组织三向结体核心的远端三级相互作用可以是高度稳定的。嘌呤核糖开关的l2-l3相互作用和环状二-gmp核糖开关支架的四环-四环受体都能够在其他rna结构环境以外稳定地形成。相比之下,组织曼氏血吸虫锤头状核酶的长程相互作用是动态的,这是关于所选支架的多样性的另一方面。支架中存在稳健的二级和三级结构使得这些元件能够潜在地引导初始文库的所有成员的折叠。相比之下,在选择期间rna错误折叠和或在最终适体中存在多个mfe结构通常是传统深度选择的重要问题。由于在典型的选择方案中对于高保真折叠没有显著的选择压力,因此在起始文库中提供此信息可以是通向稳健折叠rna的途径。虽然选择三向结体支架作为本研究的重点,但天然核糖开关和核酶的多样性可以为此方法提供进一步的原料。在三向结体家族中,存在广泛的序列,其改变三个螺旋的取向、连接区域的大小,以及远端三级相互作用的性质,从而可以为特定配体或传感器提供优异支架。此外,基于同源配体的性质,其他折叠可以易于结合靶小分子。例如,支架结合5htp的另一个合理选择是赖氨酸核糖开关适体结构域。较大的配体可以更容易地被黄素单核苷酸或钴胺素核糖开关衍生的支架识别,而诸如nadh的二核苷酸可以容易地被二环核苷酸适体中的一种容纳。由于已发现天然rna适体识别化学上不同的小分子,利用其结构来选择新型适体有可能促进开发强大的新工具,用于在广泛应用中监测和响应细胞环境中的小分子。实施例8:文库构建对于每个支架,从其晶体结构中鉴定围绕配体结合位点或亲本rna的活性位点的壳内的核苷酸(gr,pdbid4fe5;cdg,pdbid3iwn;hh,pdbid3zd5)。对应的位置在跨越整个适体结构域的dna超聚物(dnaultramer)中随机化,其具有用于逆转录和扩增的保守侧翼序列(integrateddnatechnologies;本研究中使用的所有核酸的序列在表1中提供)。使用标准taqpcr条件将ssdna转化为dsdna模板用于转录,其中在每个100μlpcr反应中使用~2x10-12moldna(对应于~1012个单独序列)并且使用t7位点附加和rt-pcr引物来扩增15个循环。在含有40mmtris-hcl,ph8.0,25mmdtt,2mm亚精胺,0.01%tritonx-100,4mm每种rntpph8.0,0.08单位无机磷酸酶(sigma-aldrich,冻干粉末)和0.25mg/mlt7rna聚合酶的12.5ml转录反应中转录大约1x1014个序列,并在37℃下孵育4小时。然后将转录样品在-20℃下在75%乙醇中沉淀,粒化,并在300μl甲酰胺、3ml8m尿素和300μl0.5medtaph8.0的溶液中重构。用变性的8%,29∶1丙烯酰胺∶双丙烯酰胺凝胶纯化全长rna。在通过uv遮蔽观察后从凝胶上切下产物rna,并在0.3mnaoacph5.0中洗脱,然后交换并在0.5xte中储存。实施例9:5htp亲和柱基质的合成对于衍生化柱,将3ml床体积的eah琼脂糖4b(gehealthcare)用二甲基甲酰胺(dmf)脱水。将10μmol的fmoc-5-羟基-l-色氨酸和10μmol的六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(pybop)溶解在1mldmf中,并添加到具有20μmoln,n-二异丙基乙胺(dipea)的脱水柱中并在室温下搅拌孵育2小时。然后排干柱基质并用dmf充分洗涤。通过在大约1mldmf中加入1mmol乙酸酐和1mmoldipea将未反应的琼脂糖胺乙酰化,并在室温下混合1小时。将柱排出乙酰化混合物并用dmf洗涤,然后使用20%v/v哌啶/dmf进行fmoc脱保护。通过测量脱保护级分中fmoc的浓度来确定柱上的氨基酸浓度(a301nm=8000m-1cm-1)。此方法每ml树脂产生大约0.5-1mm脱保护的氨基酸。对于反选择,除了省略产生乙酰化琼脂糖的配体偶联步骤外,eah琼脂糖制备完全相同。实施例10:体外选择对于使用superscriptiii逆转录酶(gr/ssiii)的gr支架选择,在选择缓冲液(10mmna-hepes,ph7.0,250mmnacl,50mmkcl,10mmmgcl2,0.1mg/mltrna)中平衡350μl乙酰化琼脂糖并且将在350μl选择缓冲液中的1nmol文库rna在室温下搅拌孵育30分钟。除去施加的溶液,用350μl选择缓冲液洗涤柱基质一次。将合并的溢流和洗涤物(总共750μl)加入到预平衡的5htp-衍生的琼脂糖4b柱中并孵育45分钟。然后将柱排干并用选择缓冲液洗涤三次,然后用选择缓冲液中的10mm5htp洗脱(在350μl中两次孵育1小时;总洗脱体积为700μl)。然后将洗脱的级分在0.5mlultracel10kdmwco过滤器(millipore)中浓缩至50μl,并在0.3m乙酸钠(ph5.0),5μg糖原中乙醇沉淀,并使其达到75%乙醇的最终浓度,然后在-70℃下储存30分钟。表2中提供了每个循环的条件的细节。为了将竞争性洗脱的rna转化为新的rna群,将洗脱级分用乙醇沉淀,在4℃下以13000×g粒化,倾析,并在真空下干燥。将干燥的颗粒用0.7mm每种dntp、7μmrt-pcr引物重构,并使总体积达到14μl,然后加热至65℃持续5分钟并在冰上孵育10分钟。然后将所述溶液加入到总体积为20μl的含有5mmdtt和200单位superscriptiii(lifetechnologies)的1xsuperscriptiii第一链缓冲液(5x:250mmtris-hcl,ph8.3,375mmkcl,15mmmgcl2)中,然后在54℃下延伸15分钟。使用标准taqdna聚合酶条件,在500μl的总体积中pcr扩增整个20μl逆转录溶液。然后通过将100μlpcr反应添加至1ml含有40mmtris-hcl,ph8.0,25mmdtt,2mm亚精胺,0.01%tritonx-100,4mm每种rntpph8.0,0.08单位无机磷酸酶和0.25mg/ml的t7rna聚合酶的转录反应来转录扩增的池,并在37℃下孵育2小时。在相似条件下进行针对32p标记的rna的100μl转录反应,不同之处在于utp、ctp和gtp的rntp降低至2mm,而atp降低至200μm和~100μci32p-atp。如上所述凝胶纯化转录样品,相应地调整凝胶加载条件。使用gsi逆转录酶的选择如上所述进行,具有以下变化。用于选择的缓冲液含有降低的镁浓度和更多生理学相关的单价阳离子:25mmna-hepes,ph7.0,150mmkcl,50mmnacl,3mmmgcl2)。用gsi-iic-mrf逆转录酶代替superscriptiii。gsi-iicmrf逆转录酶在大肠杆菌中表达并如所述纯化(mohr等人,rna,2013,19,958-970)。将沉淀的rna颗粒置于1.25mmdntp和20μmrt-pcr引物中,然后在65℃变性,在4℃退火,并在60℃下平衡。然后使溶液达到1xgsi-iic-mrf缓冲液条件(10mmnacl,1mmmgcl2,20mmtriscl,ph7.5,1mmdtt),总体积为20μl,并加入足够的酶以在60℃下延伸。如上所述进行pcr。实施例11:高通量测序和生物信息学分析进行标准pcr以附加为退火到流动池所需的illumina杂交序列。用正向测序引物和含有不同的12个核苷酸条形码的独特反向引物扩增每个文库(序列在表1中给出)。使用v3试剂盒在miseq(illumina)上用定制的读取和索引引物对样品进行150个循环的测序。使用来自qiime的脚本对所得的序列进行解复用、修剪和质量过滤(caporaso等人,nat.methods,2010,7,335-336)。修剪p1茎以外的所有序列信息,并且在分析中仅使用每个核苷酸的含有phred得分>20的序列。然后,通过usearch(edgar,bioinformatics,26,2460-2461)对每个文库的所得的fasta格式文件进行聚集,产生以90%同一性聚集的种子序列;任何包含单个序列的簇都被丢弃。然后将前十最稠密的簇映射回到其原始序列文件,并且随机抽取250个单独序列作为每个簇的代表性样本用于进一步分析。使用muscle比对每个簇中的序列(edgar,nar,2004,32,1792-1797)并使用cmfinder分析所得的比对(yao等人,bioinformatics,2006,22,445-452)。r2r(weinberg和breaker,bmcbioinformatics,2011,12,3)以其默认设置运行,以生成映射到最小自由能(mfe)二级结构的序列保守图。实施例12:nmia化学探测如前所述制备rna(edwards等人,methodsmol.biol.,2009,535,135-163)。加入位于rna的5′和3′末端侧翼的结构盒以促进逆转录,并使用建立的方案在25℃下进行nmia修饰(wilkinson等人,nat.protoc.,2006,1,1610-1616)。在100mmna-hepes,ph8.0,100mmnacl和6mmmgcl2中以100nm探测rna。如所指示,配体浓度为500μm。通过safa(das等人,rna,2005,11,344-354)和imagej(nih)分析凝胶图像。实施例13:等温滴定量热法(itc)将测试的所有rna交换到ssiii选择缓冲液(10mmna-hepes,ph7.0,250mmnacl;50mmkcl;10mmmgcl2)中,并在10kdmwco过滤器(emdmillipore)中洗涤三次。将配体从干燥固体直接提取到结合缓冲液中,并在nanodrop2000(thermoscientific)上,使用5-羟基吲哚部分在275nm下8000mol-1cm-1的消光系数来建立浓度。将rna稀释至50-100μm之间,并以rna浓度的大约10倍来滴定配体。使用microcalitc200微量热仪(gehealthcare)在25℃下使用建立的方案进行滴定(gilbert和batey,methodsmol.biol.,2009,540,97-114)。分析数据并用origin5.0软件套件(originlaboratories)进行拟合。实施例14:5htp-ii/5htp复合物的结构确定如前所述制备用于结晶的rna(edwards等人,methodsmol.biol.,2009,535,135-163)。将rna在amiconultra1510kmwco过滤器(emdmillipore,inc.)中浓缩并交换到0.5xt.e.缓冲液中。通过混合2μlrna∶配体复合物(1∶1)和3.5μl母液(8-14%2-甲基-2,4-戊二醇,40mm二甲胂酸钠ph5.5,4mmmgcl2,12mmnacl,80mmkcl和4-9mm钴六胺)获得衍射质量晶体,进行微接种,并在22℃下孵育1-3天。在收集数据之前,晶体不需要进一步冷冻保护并在液氮中快速冷冻。使用rigakur-axisiv图像板系统,使用cukα辐射在100k下收集数据,并使用d*trek进行索引和调整(pflugrath,actacrystallogr.dbiol.crystallogr.,1999,55,1718-1725)。还在家用x射线源上收集通过用1-11mm六胺铱替代六氯化钴制备的重原子衍生物的数据。使用具有反常散射的单同晶置换(siras)方法确定相。autosol(adams等人,actacrystallogr.dbiol.crystallogr.,2010,66,213-221)用于找到12个铱原子,然后用于计算相。所得的实验密度图显示rna骨架和螺旋的明确特征,并用于构建模型。在phenix(adams等人,actacrystallogr.dbiol.crystallogr.,2010,66,213-221)中的几轮细化之间,在coot(emsley和cowtan,actacrystallogr.dbiol.crystallogr.,2004,60,2126-2132)中没有配体的情况下迭代地构建初始模型。在将5htp构建到模型中之前,rna模型经历了几轮细化和模拟退火。在构建的这一时点,结合口袋中存在明显的配体密度,这允许配体的可靠放置和取向。通过复合省略图验证配体和碱基的放置(图10b)。基于fo-fc差异图中的峰大小,在配体放置后最后几轮细化中水的放置自动化。使用molprobity(chen等人,2010,actacrystallogr.dbiol.crystallogr.,2010,66,213-221)和最终模型统计(rwork和rfree分别为21.9%和26.2%)判断,所得的模型具有良好的几何形状。所有晶体学数据和模型统计数据在表4中给出。实施例15:体外broccoli传感器测定如上所述制备rna,在10kmwcoamiconultra(millipore)中进行另外0.5xt.e.缓冲液洗涤,以最大限度地减少金属离子的携带。所有rna传感器均在含有80mmtris-hcl,ph7.4,150mmkcl和50mmnacl的缓冲液中的0.5μmrna和10μm(z)-4-(3,5-二氟-4-羟基亚苄基)-1,2-二甲基-1h-咪唑-5(4h)-酮(dfhbi)的浓度下进行测定。混合缓冲液、配体、镁(表6中给出的浓度)和dfhbi,然后加入rna,并使所有反应在室温下孵育30分钟。通过将200μl反应体积置于greiner96孔平底黑色荧光板(thermoscientific)中并在tecaninfinitem200pro板读数器中读数来测量dfhbi荧光。样品在460nm激发,并且荧光发射测量为506nm与510nm之间的平均信号。通过将随着配体浓度而变化的观察到的荧光拟合到两态模型来确定引起半数最大荧光响应的配体浓度。工程化传感器合成为g-区块(图23中给出的传感器序列;integrateddnatechnologies),并使用标准分子克隆技术克隆在pet30b中的xbai与blpi位点之间。对所有所得的质粒进行序列验证。对于t7rna聚合酶转录反应,使用标准pcr反应使用1μm外引物(5’:ggccgtaatacgactcactataggagcccggatagctcagtcggtagagcag,3’:tggcgcccgaacagggacttgaaccctgga)通过pcr产生dna模板。将模板直接加入到体外转录反应中(参见上文),并使rna合成在37℃下进行2小时。来自上述转录反应的rna直接用于测定而无需进一步纯化。在含有50μl体外转录反应,10μl10x测量缓冲液(1x:50mmk-hepes,ph7.5,10mmmgcl2,150mmkcl,50mmnacl),30μmdfhbi-1t和2mm配体(用于加配体反应)的100μl反应中监测每个传感器的活性。将反应在室温下孵育30分钟,并通过将90μl反应体积置于greiner96孔平底黑色荧光板(thermoscientific)中并在tecaninfinitem200pro板读数器中读数来测量dfhbi荧光。样品在460nm激发,并且荧光发射测量为506nm与510nm之间的平均信号。对于所有实验,在存在和不存在配体的情况下进行trna-支架的broccoli适体的阳性对照,其也用作相对亮度的参考。通过将dfhbi-1t加配体反应的荧光值除以单独的dfhbi-1t条件的荧光值来计算倍数诱导。所有实验一式三份进行,并以平均值的标准误差(s.e.m.)报告定量数据。实施例16:体外broccoli传感器测定在诱导型对照下,用含有传感器的pet30b衍生的质粒转化大肠杆菌onestar(de3)细胞(thermofisher),接种到补充有50μg/ml卡那霉素的lb琼脂上,并在37℃下孵育大约16小时。挑取个体菌落并在5ml补充有50μg/ml卡那霉素的lb中生长过夜(大约16小时)以使培养物达到饱和。对于筛选实验,将5μl饱和过夜培养物加入到5ml补充有50μg/ml卡那霉素的lb中,并在37℃下生长至对数中期(od600为大约0.4-0.6)。为了诱导单独的broccoli适体或broccoli/核糖开关适体融合构建体的表达,在每种培养物中加入iptg至1mm的最终浓度,然后在37℃下再生长2小时。然后通过离心使细胞粒化,并用5ml补充有mgso4(终浓度为5mm)和卡那霉素(终浓度为50μg/ml)的1xm9盐洗涤一次。洗涤后,通过离心使细胞粒化,重悬于250μl上述m9培养基中并分成两个100μl等分试样。在一半等分试样中,加入dfhbi-1t至110μl的最终体积中50μm的最终浓度。在另一半等分试样中,加入dfhbi-1t至110μl的最终体积中50μm的最终浓度,并且加入配体(5htp、5hp或多巴胺)至1mm的最终浓度。然后将细胞在37℃下孵育30分钟以允许吸收每种化合物。孵育30分钟后,将100μl每个等分试样移液到greiner96孔黑色微孔板中并在冰上冷却30分钟。对于荧光测量,在472nm的激发波长和520nm发射波长下监测dfhbi-1t。定量数据代表来自三个生物重复试验的平均荧光值±平均值的标准误差(s.e.m.),其使用pet30b空载体对照进行背景校正。通过将暴露于配体的细胞的平均荧光值除以没有配体的细胞的平均荧光来计算倍数诱导。实施例17:5htp的细胞内荧光成像如所述制备dna和培养物(paige等人,science,2012,335,1194)。简言之,将trna/broccoli融合序列克隆到诱导型t7启动子下游的xbai和blpi位点之间的pet30b中。将序列验证的质粒转化到bl21(de3)star细胞(invitrogcn)中,并将单菌落在补充有50μg/ml卡那霉素的luria肉汤(lb)中生长过夜。过夜培养物用于以1∶1000稀释度接种新鲜lb/卡那霉素培养基,并且培养物在37℃下生长至od600=0.4-0.6,然后用1mmiptg诱导并在37℃下生长2-4小时。将200μl所得培养物离心,倾析,并重悬于2ml补充有50μg/ml卡那霉素、5mmmgso4和1mmiptg的m9最小盐培养基中。将200μl重悬的培养物转移到96孔聚-d-赖氨酸包被的玻璃底板(mattek)中,并在37℃下孵育1小时。然后除去培养基,用m9/卡那霉素/1mmiptg培养基洗涤孔,然后加入200μlm9培养基、1mmiptg和400μmdfhbi-1t(lucerna)。使用andorixon3897emccd在nikonti-e显微镜上使用60x油物镜、激发滤光片472/30、二向色镜490(长通道)和发射滤光片520/40拍摄实时荧光图像,并用fiji(schindelin等人,nat.methods,2012,9,676-682)分析。实施例18:单转换体外转录测定如前所述转录dsdna模板(trausch等人,structure,2011,19,1413-1423)。简言之,将50ngdna模板在37℃下在12.5μl2x转录缓冲液(140mmtris-hcl,ph8.0,140mmnacl,0.2mmedta,28mmβ-巯基乙醇和70mg/mlbsa)、2.5μl50mmmgcl2、100-200μci的32p-atp和0.25单位的大肠杆菌rna聚合酶σ70全酶(epicenterbiotechnologies)中孵育10分钟,每次反应达到23μl。然后通过添加7.5μl反应缓冲液(165μm每种rntp,0.2mg/ml肝素和所需配体浓度)开始平衡反应,并在37℃下孵育15分钟,然后用8m尿素猝灭。然后在8%变性page上分离反应,干燥,并在磷成像仪屏幕上曝光。然后在imagej(nih)中进行凝胶的定量,并且数据拟合到两态模型。登录号坐标和结构因子已经以登录号4zaq保存在rscb蛋白质数据库中。以引用方式并入贯穿本申请中所引用的所有文献(包括参考文献、发布的专利、公布的专利申请以及共同未决的专利申请)的内容特此以引用的方式明确整体并入。除非另外定义,否则本文所用的全部技术和科学术语的含义与本领域的普通技术人员通常理解的含义是一致的。等效方案本领域技术人员将仅使用常规实验即会认识到或能够确定本文中所述的特定实施方案的许多等效方案。此类等效方案旨在由以下权利要求书涵盖。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1