用于制备(±)-2-(二氟甲基)-1-(烷氧基羰基)-环丙烷甲酸和(±)-2-(乙烯基)-1-(烷氧基羰基)-环丙烷甲酸的酶促方法与流程
相关申请
本申请要求2017年2月1日提交的美国临时专利申请序列号62/453,246的优先权权益,其内容在此通过引用并入。
背景
合成复杂的生物活性分子是有挑战性的、昂贵的且耗时的。合成具有良好非对映选择性水平的化合物甚至更有挑战性。这样做通常涉及分离或合成非对映体富集的中间体,其立体化学可以在所需的后续合成转化中保留。
合成生物活性分子中的有用中间体的实例是(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸。在过去,该中间体如方案1中所示使用水解方法从(±)-2-(二氟甲基)环丙烷-1,1-二甲酸二乙酯合成,这产生适度的非对映选择性:
方案1:(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸的合成。
需要新的合成方法来以更高水平的非对映选择性构建对映体富集的二氟烷基环丙基和乙烯基烷基环丙基酯。
发明概述
在某些实施方案中,本发明涉及根据反应方案a的方法:
其中r1是(c1-c6)烷基;
r2是-cf2h或-ch=ch2;且
所述第一酶是bstee酯酶的突变体。
在进一步实施方案中,本发明涉及根据反应方案b的方法:
其中r1是(c1-c6)烷基;
r2是-cf2h;且
所述第二酶选自alcalase®2.4l、esperase®8.0l和savinase®16.0l。
本发明进一步提供了多肽,其包含相对于seqidno:2具有至少两个氨基酸取代的氨基酸序列,其中所述氨基酸序列包含t25h的第一突变和l92h的第二突变。
附图简述
图1是bstee酯酶的家族树。与bstee酯酶密切相关的酶具有相似的氨基酸序列,且因此在本文所述的非对映选择性方法中可以与bstee酯酶类似地发挥功能。
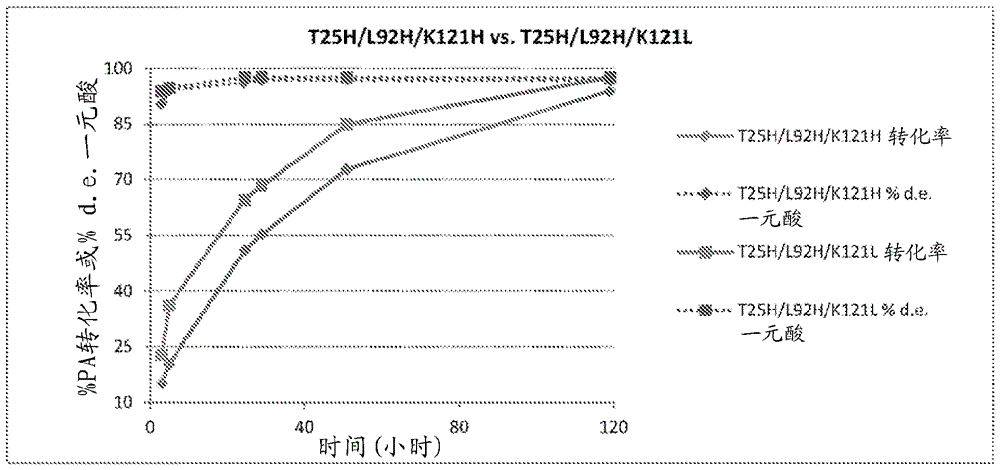
图2含有两个图表,其显示突变体t25h/l92h和t25h/l92h/k121h相比于嗜热脂肪芽孢杆菌(b.stearothermophilus)野生型酯酶的转化率和非对映选择性(%d.e.)的比较。反应条件:200mmnahpo4ph8,250rpm,40℃,10g/l底物,10ml反应体积和1mg/ml每种酶的澄清裂解物。
图3是显示突变体t25h/l92h和t25h/l92h/k121h相比于嗜热脂肪芽孢杆菌野生型酯酶的转化率和非对映选择性(%d.e.)的比较的图表。反应条件:200mmnahpo4ph8,250rpm,40℃,10g/l底物,10ml反应体积和1mg/ml每种酶的澄清裂解物。
发明详述
i.概览
在某些实施方案中,本发明涉及通过非对映选择性酶促水解合成非对映体富集的化合物(诸如((±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸)的方法。本发明方法比已知方法更有效,因为(i)它们不涉及合成外消旋物和分离非对映异构体,和(ii)它们产生具有高水平的非对映体富集的化合物。本文所述的发明还涉及实现这种转化的活性和非对映选择性突变酶。本发明的突变酶表现出相比于野生型酶的改进的特性,包括增加的对期望底物的活性,抑制的不期望的非对映异构体的产生,和对期望的对映异构体对的个别异构体大致等效的活性,产生非对映体富集的外消旋物。
本文所述的非对映选择性酶促水解通过提高产物产率和非对映选择性、同时消除对某些处理步骤的需要而提供相比于已知方法的优点。例如,本文所述的方法消除已知方法中利用的两个mtbe浆化步骤。本文呈现的改进方法实现例如化学合成的更高通量。
在某些实施方案中,本发明涉及经由(1r,2r)-1-((叔丁氧基羰基)氨基)-2-(二氟甲基)环丙烷甲酸合成药物物质的方法,如方案2中所示。在某些实施方案中,或者,药物物质可以经由((±)-2-(乙烯基)-1-(乙氧基羰基)环丙烷甲酸的中间性合成。
方案2:(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸的结构及其向药物物质的转化。
在某些实施方案中,外消旋二酯起始材料根据方案3的方法产生。本文所述的非对映选择性酶促水解将二酯起始材料转化为期望产物,非对映体富集的(±)-2-(二氟甲基)-1-(烷氧基羰基)环丙烷甲酸,如方案4中所表明。
方案3:(±)-2-(二氟甲基)环丙烷-1,1-甲酸二乙酯的合成
方案4:(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸的合成。
在某些实施方案中,所述方法提高分离的中间体的加工性。
在某些实施方案中,本文所述的方法提高水解反应的非对映选择性。
在某些实施方案中,本文所述的方法提高水解反应的产物产率。
ii.定义
下面列出的是用于描述本发明的各种术语的定义。除非在特定情况下另有限制,否则当术语在整个本说明书和权利要求中单独地或作为较大组的一部分使用时,这些定义适用于所述术语。
烃基取代基中的碳原子数可以通过前缀“cx-cy”指示,其中x是取代基中碳原子的最小数目,且y是取代基中碳原子的最大数目。“(cx)烷基”指示由x个碳原子构成的烷基基团。
如本文所用的术语“烷基”是指通常含有1至20个碳原子的饱和、直链或支链烃基。例如,“c1-c6烷基”或“c1-c8烷基”分别含有1至6个,或1至8个碳原子。烷基取代基的实例包括但不限于甲基、乙基、丙基、异丙基、正丁基、叔丁基、新戊基、正己基、庚基、辛基取代基等。
如本文所用,术语“盐”包括“药学上可接受的盐”,其在合理的医学判断的范围内,适合用于与人和其他脊椎动物、优选哺乳动物的组织接触,而没有过度的毒性、刺激、变应性应答等,并且与合理的利益/风险比相称。药学上可接受的盐是本领域众所周知的。例如,s.m.berge等人在j.pharmaceuticalsciences,66:1-19(1977)中详细描述了药学上可接受的盐。此类盐可以在分离和纯化如本文所述的反应产物的过程中原位制备,或单独制备,诸如通过使游离碱官能团与合适的酸、诸如有机酸反应。药学上可接受的盐的实例包括但不限于盐酸盐、氢溴酸盐、磷酸盐、硫酸盐、高氯酸盐、乙酸盐、马来酸盐、酒石酸盐、柠檬酸盐、琥珀酸盐或丙二酸盐。其他药学上可接受的盐包括但不限于己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖醛酸盐、乳酸盐、月桂酸盐、十二烷基硫酸盐、苹果酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、硫酸盐、硫氰酸盐、对甲苯磺酸盐、十一酸盐、戊酸盐等。代表性的碱金属或碱土金属盐包括钠盐、锂盐、钾盐、钙盐或镁盐等。适当时,另外的药学上可接受的盐包括与抗衡离子结合的铵、季铵和胺阳离子,所述抗衡离子诸如卤化物、氢氧化物、羧酸盐、硫酸盐、磷酸盐、硝酸盐、具有1至6个碳原子的烷基、磺酸盐和芳基磺酸盐。
如本文所用,术语“对映体富集的”意指对映体的混合物,其中两种对映体之一以较大量存在(例如,具有大于约90%、大于约95%、优选大于约98%、最优选大于99%的对映体过量(ee))。该术语还涵盖对映体纯的化合物。
如本文所用,术语“非对映体富集的”意指非对映异构体的混合物,其中非对映异构体之一以较大量存在(例如,具有大于约90%、大于约95%、优选大于约98%、最优选大于99%的非对映体过量(de))。该术语还涵盖非对映异构纯的化合物。
本发明的各个方面在本文进一步详细描述。
iii.示例性方法和用途
结合以下说明性方法将更好地理解本发明的化合物和方法,通过所述说明性方法可以制备本发明的化合物。应当理解,呈其任何变型的本文所述的任何反应,可以与呈其任何变型的本文所述的其他反应中的一种或多种顺序组合,基本上与方案中所示的顺序类似。
在某些实施方案中,本发明涉及方法,其包括根据反应方案a的反应性拆分:
其中r1是(c1-c6)烷基;
r2是-cf2h或-ch=ch2;且
所述第一酶是bstee酯酶的突变体。
在某些实施方案中,r1是(c6)烷基。或者,r1可以是(c5)烷基、(c4)烷基、(c3)烷基(诸如正丙基或异丙基)、乙基或甲基。在某些实施方案中,r1是乙基。
在某些实施方案中,r2是-cf2h。在替代实施方案中,r2是-ch=ch2。
在某些实施方案中,bstee酯酶的突变体包含t25h的第一突变,l92h的第二突变,和选自k121r、k121y、k121h、k121d、k121l、m126f、m126v、m126i、m126q、m194l、m194a、l166n、l166m、i170n和i170q的第三突变。
在某些此类实施方案中,所述第三突变选自k121r、k121y、k121h、k121d、k121l、m126v、m126i、m126q、m194l和l166m。在进一步此类实施方案中,所述第三突变选自k121y、k121h、k121d、k121l、m126v、m126i、m126q和l166m。在某些实施方案中,所述第三突变选自k121y、k121h、k121d和k121l。
在某些实施方案中,所述第一酶的装载量与起始材料相比为约50wt%至约200wt%,例如,与起始材料相比为约50wt%,约60wt%,约70wt%,约80wt%,约90wt%,约100wt%,约110wt%,约120wt%,约130wt%,约140wt%,约150wt%,约160wt%,约170wt%,约180wt%,约190wt%或约200wt%,优选约100wt%。
在某些实施方案中,所述第一溶剂包含一种或多种有机溶剂。例如,所述溶剂可以包含庚烷和甲基叔丁基醚。
在某些实施方案中,所述第一溶剂进一步包含水性缓冲液。
在某些实施方案中,所述水性缓冲液是柠檬酸钠或乙酸钙的水溶液,例如,浓度为约0.05m至约2.0m,例如,约0.05m,约0.06m,约0.07m,约0.08m,约0.09m,约0.10m,约0.11m,约0.12m,约0.13m,约0.14m,约0.15m,约0.2m,约0.3m,约0.4m,约0.5m,约0.6m,约0.7m,约0.8m,约0.9m,约1.0m,约1.1m,约1.2m,约1.3m,约1.4m,约1.5m,约1.6m,约1.7m,约1.8m,约1.9m或约2.0m。在某些实施方案中,所述浓度为约0.1m。
在某些实施方案中,所述第一溶剂进一步包含碱。在某些实施方案中,所述碱是二(烷基)胺,诸如二(环烷基)胺或二(芳烷基)胺。在某些实施方案中,所述碱是二(环己基)胺或二(苄基)胺。
在某些实施方案中,所述第一ph为约5至约10,例如,约5,约5.25,约5.5,约5.75,约6,约6.25,约6.5,约6.75,约7.0,约7.25,约7.5,约7.75,约8.0,约8.25,约8.5,约8.75,约9.0,约9.25,约9.5,约9.75或约10.0。在某些实施方案中,所述第一ph为约5至约6.5。在某些实施方案中,所述第一ph为约5.75。
在某些实施方案中,所述第一温度为约10℃至约60℃,例如,约15℃,约20℃,约25℃,约30℃,约35℃,约40℃,约45℃,约50℃,约55℃或约60℃。在某些实施方案中,所述第一温度为约20℃。
在某些实施方案中,所述第一时间段为约2h至约8h,例如,约2h,约4h,约6h,约8h。或者,所述第一时间段为约2h至约48h,例如,约2h,约4h,约6h,约8h,约10h,约12h,约14h,约16h,约18h,约20h,约22h,约24h,约26h,约28h,约30h,约32h,约34h,约36h,约38h,约40h,约42h,约44h,约46h或约48h。
在某些实施方案中,所述方法进一步包括使反应方案a的反应产物与碱接触以获得化合物的盐。
在某些此类实施方案中,所述碱是二(烷基)胺,诸如二(环烷基)胺或二(芳烷基)胺。优选地,所述碱是二(环己基)胺或二(苄基)胺。
在某些实施方案中,所述反应产物的非对映体过量为大于约90%。在进一步实施方案中,所述反应产物的非对映体过量为大于约95%。
在某些实施方案中,本发明涉及方法,其包括根据反应方案b的反应性拆分:
其中r1是(c1-c6)烷基;
r2是-cf2h或-ch=ch2,优选-cf2h;且
所述第二酶选自alcalase®2.4l、esperase®8.0l和savinase®16.0l。
alcalase®2.4l、esperase®8.0l和savinase®16.0l各自可得自novozymes。在方案b中描绘的反应的某些实施方案中,所述第二酶是alcalase®2.4l。
alcalase®是枯草杆菌蛋白酶类型,一种来自地衣芽孢杆菌(bacilluslicheniformis)的蛋白酶。alcalase®充当酯酶,使得其能够催化一些酯的立体选择性水解并催化氨基酯(包括杂环氨基酯)的水解。
savinase®是来自芽孢杆菌属物种的蛋白酶,并且是丝氨酸内肽酶(endopeptodase)。其可以在碱性条件下催化一些酯以及应变酰胺(strainedamides)的立体选择性水解。
esperase®是具有广泛特异性的内肽酶(主要是枯草杆菌蛋白酶a),与其他微生物丝氨酸蛋白酶相比,其在碱性条件和高温下表现良好。应用包括内部肽键的水解。esperase®的特征在于在高温和高ph下的优异性能。
在某些实施方案中,所述第二酶的装载量与方案b中的起始材料相比为约50wt%至约200wt%,例如,与方案b中的起始材料相比为约50wt%,约60wt%,约70wt%,约80wt%,约90wt%,约100wt%,约110wt%,约120wt%,约130wt%,约140wt%,约150wt%,约160wt%,约170wt%,约180wt%,约190wt%,或约200wt%,优选约120wt%至约140wt%,或约130wt%。
在某些实施方案中,所述第二溶剂包含水性缓冲液。在某些实施方案中,所述水性缓冲液是碳酸氢钠和/或碳酸钠的水溶液,例如,浓度为约0.05m至约2.0m,例如,约0.05m,约0.06m,约0.07m,约0.08m,约0.09m,约0.10m,约0.11m,约0.12m,约0.13m,约0.14m,约0.15m,约0.2m,约0.3m,约0.4m,约0.5m,约0.6m,约0.7m,约0.8m,约0.9m,约1.0m,约1.1m,约1.2m,约1.3m,约1.4m,约1.5m,约1.6m,约1.7m,约1.8m,约1.9m或约2.0m。在某些实施方案中,所述浓度为约0.1m。
在某些实施方案中,所述第二溶剂进一步包含有机溶剂。可用于本发明的方法中的示例性有机溶剂包括丙酮、乙腈、二甲基甲酰胺、二氧杂环己烷、乙醇、异丙醇和二甲基亚砜。在一些优选实施方案中,方案b的反应方法中使用的有机溶剂是丙酮。在某些实施方案中,所述有机溶剂为所述第二溶剂的总体积的近似5%至近似75%。例如,所述有机溶剂可以是相对于所述第二溶剂的总体积的约5体积%、10体积%、15体积%、20体积%、25体积%、30体积%、35体积%、40体积%、45体积%、50体积%、55体积%、60体积%、65体积%或70体积%。在一些实施方案中,所述有机溶剂为所述第二溶剂的总体积的近似5%-20%,优选10%。
在某些实施方案中,所述第二ph为约5至约10,例如,约5,约5.25,约5.5,约5.75,约6,约6.25,约6.5,约6.75,约7.0,约7.25,约7.5,约7.75,约8.0,约8.25,约8.5,约8.75,约9.0,约9.25,约9.5,约9.75或约10.0。在某些实施方案中,所述第二ph为约7.5至约9。在某些实施方案中,所述第一ph为约8.0。
在某些实施方案中,所述第二温度为约10℃至约60℃,例如,约15℃,约20℃,约25℃,约30℃,约35℃,约40℃,约45℃,约50℃,约55℃或约60℃。在某些实施方案中,所述第二温度为约40℃。
在某些实施方案中,所述第二时间段为约2h至约8h,例如,约2h,约4h,约6h,约8h。或者,所述第二时间段为约2h至约48h,例如,约2h,约4h,约6h,约8h,约10h,约12h,约14h,约16h,约18h,约20h,约22h,约24h,约26h,约28h,约30h,约32h,约34h,约36h,约38h,约40h,约42h,约44h,约46h或约48h。
在某些实施方案中,本发明涉及包括本文所述的步骤中的两个或更多个的方法。例如,本发明可以涉及包括方案a和方案b的方法的方法。
在某些实施方案中,本发明涉及本文所述的任何化合物在制备药物中的用途。
本文方案中的结构中变量的定义与本文描述的式中相应位置的那些相应。
本文所述的化合物含有一个或多个不对称中心,且因此产生对映异构体、非对映异构体和其他立体异构形式,对于氨基酸,在绝对立体化学的方面,其可以被定义为(r)-或(s)-,或(d)-或(l)-。光学异构体可以通过上述程序或者通过拆分外消旋混合物而从它们各自的光学活性前体制备。拆分可以在拆分剂存在的情况下,通过色谱法或通过重复结晶或通过本领域技术人员已知的这些技术的一些组合来进行。关于拆分的进一步细节可见于jacques,等人,enantiomers.racemates,andresolutions(johnwiley&sons,1981)。
合成的化合物可以从反应混合物分离,并且通过方法诸如柱色谱、高压液相色谱或重结晶进一步纯化。如技术人员可以理解,合成本文的式的化合物的另外的方法对于本领域普通技术人员是显而易见的。此外,可以以交替顺序或次序进行各个合成步骤以得到期望化合物。另外,本文描述的溶剂、温度、反应持续时间等仅用于举例说明的目的,并且本领域普通技术人员将认识到反应条件的变化可以产生本发明的期望产物。可用于合成本文所述的化合物的合成化学转化和保护基团方法(保护和去保护)是本领域已知的,并且包括,例如,诸如以下中描述的那些:r.larock,comprehensiveorganictransformations,vchpublishers(1989);t.w.greene和p.g.m.wuts,protectivegroupsinorganicsynthesis,第2版,johnwileyandsons(1991):l.fieserandm.fieser,fieserandfieser'sreagentsfororganicsynthesis,johnwileyandsons(1994);和l.paquette,编,encyclopediaofreagentsfororganicsynthesis,johnwileyandsons(1995)及其后续版本。
iv.多肽
在某些实施方案中,本发明提供了多肽,其为bstee酯酶的突变体及其酶促活性片段。在一些实施方案中,所述多肽是bstee酯酶的变体或其酶促活性片段。全长、野生型嗜热脂肪芽孢杆菌(bstee)酯酶的示例性dna序列如下:
野生型嗜热脂肪芽孢杆菌(bstee)酯酶的dna序列的翻译产生具有seqidno:2的序列的多肽:
因此,在某些实施方案中,本发明的方法中使用的bstee酯酶的突变体的氨基酸序列与seqidno:2具有至少50%同源性,至少55%同源性,至少60%同源性,至少65%同源性,至少70%同源性,至少75%同源性,至少80%同源性,至少82%同源性,至少84%同源性,至少86%同源性,至少88%同源性,至少90%同源性,至少91%同源性,至少92%同源性,至少93%同源性,至少94%同源性,至少95%同源性,至少96%同源性,至少97%同源性,至少98%同源性,或至少99%同源性。
在其他实施方案中,本发明提供了多肽,其包含:
相对于seqidno:2具有至少两个氨基酸取代的氨基酸序列,其中所述氨基酸序列包含t25h的第一突变和l92h的第二突变。
在又还有其他实施方案中,本发明提供了多肽,其包含:
与seqidno:2具有至少95%同源性且相对于seqidno:2具有至少两个氨基酸取代的氨基酸序列,其中所述氨基酸序列包含t25h的第一突变和l92h的第二突变。
在某些此类实施方案中,所述多肽包含选自以下的第三氨基酸取代:k121r、k121y、k121h、k121d、k121l、m126f、m126v、m126i、m126q、m194l、m194a、l166n、l166m、i170n和i170q。
在某些此类实施方案中,所述第三氨基酸取代选自k121r、k121y、k121h、k121d、k121l、m126v、m126i、m126q、m194l和l166m。
在进一步实施方案中,所述第三氨基酸取代选自k121y、k121h、k121d、k121l、m126v、m126i、m126q和l166m。
在又进一步实施方案中,所述第三氨基酸取代选自k121y、k121h、k121d和k121l。
在某些实施方案中,野生型嗜热脂肪芽孢杆菌(bstee)酯酶的dna序列具有seqidno:3的序列:
seqidno:3的dna序列的翻译产生具有seqidno:4的序列的多肽。t25h、l92h和k121l突变以粗体、下划线字体指示:
在某些实施方案中,本发明的方法中使用的bstee酯酶的突变体包含选自以下的突变的集合:
和t25h/l92h/k121n。
在进一步实施方案中,本发明的方法中使用的bstee酯酶的突变体包含选自以下的突变的集合:
t25f/l92h;t25f/l92h/i170q;t25f/i170q;l166h;t25f;t25h;t25f/k121y/l166m;t25h/k121h;i170n;l166m;f24c/t25f;t25n;和i92h。
在进一步实施方案中,本发明的方法中使用的bstee酯酶的突变体包含以下突变中的一种或多种:
野生型残基突变体残基
实施例
本发明通过以下实施例进一步举例说明,所述实施例不应被解释为以任何方式进行限制。本文描述的实施例和发现是代表性的。因此,本文实施例部分中描述的研究和结果可用作指导。
实施例1:非对映选择性酶促水解
实施例1a:筛选能够非对映选择性酶促水解的酶
使用实验室规模的水解反应在相同条件和均一取样程序下将酶变体针对野生型酶和其他酶变体进行比较。反应条件和样品时机的均一性允许跨变体在每个时间点(即4小时)的速率和选择性的相对比较。使用传统的感受态大肠杆菌发酵条件(25℃,250rpm,50mlinvotrogenmagicmedia#k6803,来自过夜培养物的1%接种物,表达24小时)表达每种突变体。通过离心总共50ml体积收获细胞培养物,随后将细胞沉淀重悬浮于5ml200mmnahpo4缓冲液(ph8)中。将细胞悬浮液超声处理(3x30s)以裂解细胞并离心以沉淀细胞碎片(以6000rpm,35min)。将所得的5ml澄清的裂解物用作筛选反应中的活性酶溶液。
通过将5ml200mmnahpo4缓冲液(ph8)和100µl(±)-2-(二氟甲基)环丙烷-1,1-甲酸二丙酯(最终浓度为近似10g二酯/l)合并而在20ml小瓶中制备反应物。将5ml澄清的裂解物添加至每个反应物中(t=0小时),并将反应物在40℃下用菱形磁力搅拌棒以250rpm搅拌进行孵育。在2、4和18小时取500μl的反应等分试样用于分析。将等分试样与3滴20%hcl溶液合并,并萃取至1mlmtbe中。通过手性正相hplc分析有机相以测定转化率和选择性。(柱:phenomenexlux3µmcellulose-2;250mmx4.6mm;20℃;流动相:庚烷/iproh/tfaa,98.5/1.5/0.1;流速:0.7ml/min;注入:20µl;检测器:uv210nm)。选择的突变体的比较可见于表1中。
表1–(±)-2-(二氟甲基)环丙烷-1,1-甲酸二乙酯至(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸的非对映选择性水解的酶促组。
由于变体活性显著提高,利用更严格的活性测定来提供高活性突变体之间的高分辨率。在相同的程序中实施表达,以产生50ml沉淀。倾析沉淀后,将细胞重悬浮于5ml200mmnahpo4缓冲液(ph8)中。将细胞悬浮液超声处理(10秒开,10秒关,总共1分钟)以裂解细胞并离心以沉淀细胞碎片(以9000rpm,15min)。使用标准bradfordcommassieproteinassay测量所得的5ml澄清的裂解物的可溶性蛋白含量。通过蛋白测量将裂解物添加归一化,以导致在20ml小瓶中的10ml(200mmnahpo4缓冲液,ph8)缓冲溶液中的1mg/ml总蛋白的最终浓度。将100μl(±)-2-(二氟甲基)环丙烷-1,1-甲酸二丙酯(最终浓度为近似10g二酯/l)添加至每个反应物中(t=0小时),并将反应物在40℃下用菱形磁力搅拌棒以250rpm搅拌进行孵育。在1、3、5和24.5小时取500μl的反应等分试样用于分析。将等分试样与3滴20%hcl溶液合并,并萃取至1mlmtbe中。通过手性正相hplc分析有机相以测定转化率和选择性。(柱:phenomenexlux3µmcellulose-2;250mmx4.6mm;20℃;流动相:庚烷/iproh/tfaa,98.5/1.5/0.1;流速:0.7ml/min;注入:20µl;检测器:uv210nm)。选择的突变体的比较可见于表2中。
表2–(±)-2-(二氟甲基)环丙烷-1,1-甲酸二乙酯至(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸的非对映选择性水解的另外的酶促组。
*随着%转化率增加,%e.e.朝向0%减少。
实施例1b:野生型和突变型bstee酯酶在酶促水解中的比较
新变体酶;包括高选择性三重变体t25h/l92h/k121l(在表2中鉴定),当在以下方法中应用时,在产生(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸二环己胺盐中表现出相比于野生型嗜热脂肪芽孢杆菌酯酶(方案5)提高的选择性和活性,导致增加的产率和改进的加工时间:
步骤1:三重变体酶(即t25h/l92h/k121l)催化外消旋-环丙基二乙酯((±)-2-(二氟甲基)环丙烷-1,1-甲酸二乙酯)的选择性水解。在搅拌反应器中,外消旋-环丙基二乙酯用悬浮于ph8的磷酸钠缓冲液中的工程改造的嗜热脂肪芽孢杆菌酯酶澄清的裂解物处理。在通过添加15%碳酸氢钠溶液将ph控制至8的情况下,搅拌反应物,直至反应完成,导致选择性水解成外消旋-df酸酯,其中不期望的非对映异构体产生率为<3%。通过萃取至mtbe中而从水性缓冲液回收外消旋-df酸酯。
步骤2:将萃取的外消旋-df酸酯在mtbe:庚烷中转化为(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸二环己胺盐,将其作为固体回收。步骤1一元酸的高d.e.允许在单一步骤中进行该回收,而不需要再浆化或重结晶。
改进的酶变体t25h/l92h/k121l可以以近似80-90%产生(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸二环己胺盐,其质量和手性纯度足以满足工艺要求。野生型变体会产生不适合用于工艺中的一元酸酯的不平衡分布。
方案5:通过野生型bstee酶酶促合成外消旋-df酸酯。
方案6:通过bstee变体t25h/l92h/k121l酶促合成(±)-2-(二氟甲基)-1-(乙氧基羰基)环丙烷甲酸二环己胺盐。
实施例1c:突变体bstee质粒的制备
通过quikchange™pcr扩增将突变并入期望质粒中。通过利用agilientquikchange引物设计工具设计对应于每种期望突变的dna引物。通过合并0.5µldmso、0.5µl浓度为10μm的每种引物、1µl50µg/ml的模板质粒、1µl20mmdntp(5mm每种核苷酸)、2.5µl10xdna聚合酶缓冲液、18.5µl超纯水、0.5µldna聚合酶来制备pcr反应物。pcr反应进行以下温度循环程序;95℃持续3分钟,[循环开始]95℃持续30秒,55℃持续1分钟,68℃持续8分钟,[从“循环开始”重复15次]68℃持续10分钟,4℃保持。扩增后,将亲本dna用2µldpni在37℃下消化4小时,其中在完成后80℃加热失活20分钟。使用标准转化程序将0.5µlpcr产物转化于bl21(de3)感受态细胞中,并铺板至lb+kan(50µg/ml)选择性平板上。
实施例2:非对映选择性酶促水解的比例放大
利用30g二乙酯起始材料(1),遵循实施例1a的程序。所得材料(2a)符合纯度(≥97面积%)和非对映异构体(≤1.50面积%)的产品规格。
从中试规模发酵的酶制备
使用常规生长和表达程序和iptg诱导在55l发酵容器中实现酶表达。将所得的细胞(28l,以近似20%湿细胞重量)通过碟式离心机以10,000xg用12分钟的共振时间进行沉淀。通过在缓冲液中以1:1v/v的比率用50mmnahpo4缓冲液(ph8)搅拌来重悬浮细胞。将细胞悬浮液通过均化器两次以裂解细胞。将所得产物流以10,000xg通过间歇式离心机30分钟以除去细胞碎片。将所得的流出物用作澄清的酶溶液,其中测量的bradford蛋白浓度为16.8mg/ml。
酶促水解
通过添加50mmnahpo4缓冲液(ph8)将16.8mg/ml的流出物进一步稀释至3mg/ml的蛋白浓度。所得溶液是ph7.2的500ml体积缓冲液中的3mg/ml蛋白,并且将其装入具有单个玻璃挡板的500mlchemglass反应器中。通过移液管将二酯底物(25.31g)装载至反应器中。用桨距搅拌器(pitchbladeagitator)以450rpm开始搅拌。持续监测反应ph并通过添加30%w/w碳酸氢钠将其控制至ph8。将容器夹套温度设定至47℃,以实现45℃的反应器内部温度。40.5小时后,反应已实现99.8%转化率(通过hplc),并且已经说明33.67ml碱。通过冷却至25℃处理反应。添加30ml50%w/whcl以将反应ph调节至1.69并搅拌30分钟。通过添加350mlmtbe来萃取反应物。将双相混合物以3200xg离心30分钟,以帮助分离并压缩碎屑层(raglayer)。倾析并保留有机层。将水层用添加200mlmtbe反萃取。合并所得的mtbe层,并通过旋转蒸发浓缩,以产生期望的一元酸混合物(25.314g,90.8%纯度),其中近似%pa非对映异构体为2.5%pa。
dcha盐形成
将df酸酯(5.05g,0.0243mol,1.0当量)装入干净、干燥的100ml3-颈烧瓶中,所述3-颈烧瓶配备有搅拌棒、回流冷凝器、氮气入口和温度探头。装入2.2ml叔丁基甲基醚[0.43ml/gdf酸酯]并开始搅拌。装入40.8ml正庚烷[8.08ml/gdf酸酯],并将溶液加热至75℃。在氮气下,经10分钟缓慢逐滴添加二环己胺(5.9ml,0.0294mol,1.2当量)。在该时段期间,反应的内容物形成均一的浆液。添加完成后,将所得浆液在75℃下搅拌1小时,且然后冷却至室温(23℃)。将浆液在室温下搅拌4小时,且然后冷却至8℃并保持2小时。将冷浆液过滤并用4.7ml的各1:1(根据体积)mtbe/庚烷[总共1.5ml/g预期的df酸酯dcha]的冷溶液洗涤3次。将过滤的固体在40℃下在真空下干燥,以得到作为白色粉末的df酸酯dcha(9.22g,0.73%非对映异构体,97.6面积%(通过hplc),89%产率)。
比较实施例2a:(±)-2-(二氟甲基)环丙烷-1,1-甲酸二乙酯(1)的非酶促水解。
将乙醇(3.79当量)和纯净水(5当量)装入干净的反应器中。在15-25℃下将(±)-2-(二氟甲基)环丙烷-1,1-甲酸二乙酯(1,1当量)装入混合物中。将反应物冷却至5℃并逐滴添加四丁基氢氧化铵(1当量)。搅拌2小时后,通过hplc对反应进行取样以确定水解的水平。进行四丁基氢氧化铵的进一步添加,直至剩余的二酯为<2%(通过hplc)。在0-10℃下将hcl(0.69当量)/水(6.9当量)装入反应器中以达到<3的ph。将mtbe(7.4当量)装入反应器中,并在15-25℃下搅拌30-60分钟。分离并保留有机相。将水相用mtbe(3.18当量)在15-25℃下并搅拌30-40分钟进行反萃取。对于水相分离有机层并与先前的萃取层合并。将有机层用盐水(3.44当量水,0.86当量nacl)洗涤,且然后用水(4.3当量)洗涤。将有机层分离并在<40℃下通过减压浓缩。将反应物冷却至15-25℃,并添加dcha(.845当量)。将反应物在回流下加热至55-59℃,持续1-2小时。将反应物冷却至15-25℃并保持>8小时。必要时添加庚烷(近似4.4当量),直至不期望的非对映异构体为<4%pa(通过hplc)。通过过滤捕获所得固体并用mtbe(1.5当量)冲洗。然后将固体在mtbe(4.24当量)中重复再浆化,随后进行相同的加热(55-59℃)和冷却和过滤程序,直至不期望的非对映异构体为<1.5%pa(通过hplc)。将所得的滤饼通过减压干燥以除去mtbe,产生期望的dcha外消旋盐(98%纯度,>97%d.e.,51-58%产率)。
比较实施例2a中概述的程序产生作为非对映异构体的混合物的产物(约60%d.e.化合物2a至2b),产率为约51%至56%。水解循环进行约24小时的过程。
相反,在实施例1a和2中例举的请求保护的本发明的方法提供以约98%d.e.和约85%产率的非对映体富集的产物2a。水解循环也进行约24小时的过程。
实施例3:在药物物质的途径中的酶促拆分
如方案2中所示,(±)-2a可通过胺化和拆分反应的集合转化为或并入药物物质。
示例性胺化反应显示于以下方案7中:
方案7:非对映体富集的(±)-2-(二氟甲基)-1-(烷氧基羰基)环丙烷甲酸的胺化。
胺化产物、外消旋氨基酯((±)-3)的拆分可以使用酶促拆分进行,如方案8中所示,并在以下合成程序中描述:
方案8:外消旋氨基酯((±)-3)的酶促拆分。
将氨基酯((±)-3)于丙酮中的溶液与碳酸氢钠/碳酸钠缓冲液的水溶液混合。添加alcalase®2.4l(1.3g/g(±)-3)并将混合物在40℃下搅拌。反应完成后,在水层中移除对映异构体(ss-4),并将产物(rr-3)萃取至mtbe中。可以在标准皂化程序下将产物(rr-3)转化为氨基酸(rr-4)。
通过引用并入
整个本申请中引用的所有参考文献(包括文献参考、授权专利、公开的专利申请和共同在审的专利申请)的内容在此以其整体通过引用明确地并入本文。除非另有定义,否则本文使用的所有技术和科学术语都符合本领域普通技术人员通常已知的含义。
等同方案
仅仅使用常规实验,本领域技术人员将认识到或者能够确定本文所述的本发明的特定实施方案的许多等同方案。下列权利要求旨在涵盖此类等同方案。整个本申请中引用的所有参考文献、专利和公开的专利申请以及专利申请的内容通过引用并入本文。
- 还没有人留言评论。精彩留言会获得点赞!
- 含离子液体共溶剂介质中制备(R)‑3,5‑双三氟甲基苯乙醇的方法与流程
- 一种邻二氟苯的合成方法与制造工艺
- 2,2,2‑三氟乙硫醇的合成的制造方法与工艺
- 2-氯-3-(甲基硫烷基)-N-(1-甲基-1H-四唑-5-基)-4-(三氟甲基)苯甲酰胺或其盐在耐受HPPD抑制剂除草剂的转基因作物植物的区域中防治不想要的植物的用途的制造方法与工艺
- (R)‑3,5‑双(三氟甲基)苯乙醇的生物制备方法与制造工艺
- 2-(2-吡啶)-6-(2-氯-3-三氟甲基苯甲酰基)-5,7,8-三氢吡啶并[4,3-d]嘧啶及其制备方法与制造工艺
- 一种1,3,4-噻二唑类化合物及其制备方法与制造工艺
- 一种1,3,4-噻二唑类化合物及其制备方法与制造工艺
- 一种阿瑞吡坦中间体及其制备方法与制造工艺
- 一类含4,4’‑二氟二苯甲基的不对称α‑二亚胺镍配合物、其中间体、制备方法及其应用与制造工艺