二氢喹啉酮的制作方法
本发明提供了与泛表达的e3连接酶蛋白cereblon(crbn)结合并改变crbne3泛素连接酶复合物的底物特异性从而导致内在下游蛋白分解的化合物。因此,本发明化合物可用于治疗各种癌症。
背景技术:
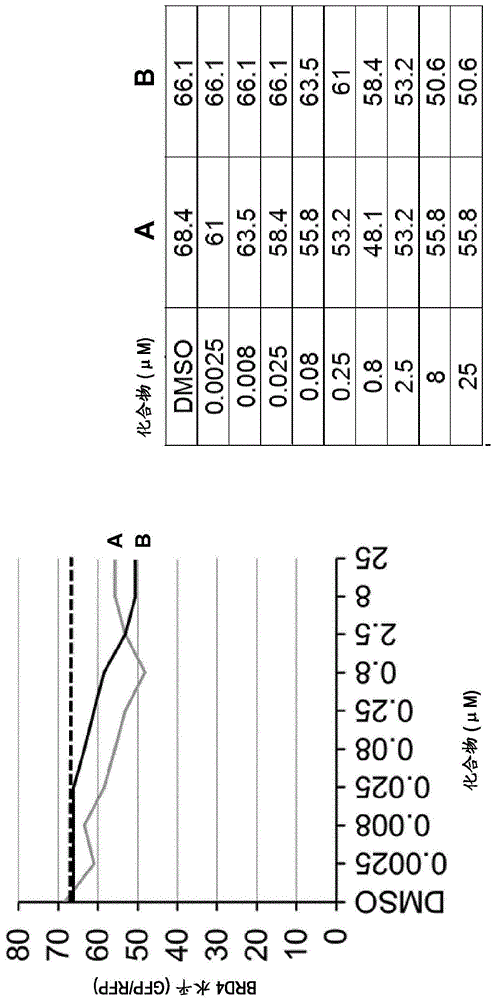
:在过去几年中,已经广泛研究了由小分子促进的目标蛋白质降解的领域1。蛋白质降解在各种细胞功能中起作用,即通过降解成小肽来调节调节蛋白质的浓度,以维持细胞的健康和生产力。cereblon是一种形成e3泛素连接酶复合体的蛋白质,该复合体泛素化其他各种蛋白质。cereblon被称为抗癌药物沙利度胺(thalidomide)类似物的主要靶标。cereblon的较高水平的表达与沙利度胺类似物在癌症治疗中的功效有关。us2003000088322、w020160331003、w020091316874、w020131497045、us72355626、ep1450107、ep2758888和w020090261079描述了某些二氢喹诺酮衍生物。近年来,一些双功能化合物已被描述为靶向普遍蛋白化的有用的调节剂,例如wo201302055710,wo201306356011,wo201310664312,wo201516084513,wo201601190614,wo201610551815,wo201700761216,wo201702431817和wo201711747318。但是,仍然持续需要对癌症的有效治疗。技术实现要素:本发明提供式a的二氢喹啉酮,或其药学上可接受的盐,其中取代基和变量如以下和权利要求中所述,或其药学上可接受的盐。本发明化合物可用于癌症的治疗性和/或预防性治疗。本发明的化合物还可以用作包含本发明的化合物作为e3泛素连接酶部分的双功能化合物的一部分,该部分连接到与靶蛋白结合的部分,这里靶蛋白最接近泛素连接酶以使所述蛋白质降解。具体实施方式本发明提供了式i的化合物及其药学上可接受的盐,上述化合物的制备,包含它们的药物及药物的制备以及上述化合物在癌症的治疗性和/或预防性治疗中的用途。不管所讨论的术语是单独出现还是与其他基团组合出现,本说明书中使用的通用术语的以下定义都适用。除非另有说明,否则本申请(包括说明书和权利要求书)中使用的以下术语具有以下给出的定义。必须注意,在说明书和所附权利要求书中使用的单数形式“一”、“一个/种”和“该”包括复数对象,除非上下文另外明确指出。单独或与其他基团组合的术语“氨基”是指nh2。单独或与其他基团组合的术语“c1-6-烷基”表示可以是直链或支链的、具有单个或多个分支的烃基,其中该烷基通常包含1至6个碳原子,例如,甲基(me)、乙基(et)、丙基、异丙基(i-丙基)、正丁基、i-丁基(异丁基)、2-丁基(仲丁基)、叔丁基(tert-丁基)、异戊基、2-乙基-丙基(2-甲基-丙基)、1,2-二甲基-丙基等。实例是甲基和异丙基。单独或与其他基团组合的术语“卤素-c1-6-烷基”是指如本文所定义的c1-6-烷基,其被一个或多个卤素,特别是1至5个卤素,更特别是1至3个卤素取代。特别的卤素是氟。特别的“卤素-c1-6-烷基”是氟-c1-6-烷基,并且特别的“卤素-c1-3-烷基”是氟-c1-3-烷基。实例是三氟甲基、二氟甲基、氟甲基等。单独或与其他基团组合的术语“羟基-c1-6-烷基”是指如本文所定义的c1-6-烷基,其被一个或多个羟基,特别是1个羟基取代。实例是-ch2oh、-ch2ch2oh等。单独或与其他基团组合的术语“羟基”是指oh。单独或与其他基团组合的术语“卤素”表示氯(cl)、碘(i)、氟(f)和溴(br)。特定的基团是f。单独或与其他基团组合的术语“杂芳基”是指具有单个4至8元环、特别是5至8元环的芳族碳环基团,或指包含6至14、特别是6至10个环原子且含有单独地选自n、o和s的1、2或3个杂原子的多个稠合环,该基团中至少一个杂环环是芳族的。实例是咪唑基、喹啉基、1,2,3,4,-四氢喹啉基、2,3-二氢-1h-吡咯并[2,3-b]吡啶基、苯并咪唑基、1h-吡唑基、吲哚啉基、吡啶基等。术语“杂环烷基”或“杂环基”表示4至9个环原子的单价饱和的或部分不饱和的单环或双环环系,其包含选自n、o和s的1、2或3个环杂原子,其余的环原子为碳。单环饱和的杂环烷基的实例是氮杂环丁烷基(azetidinyl)、吡咯烷基、四氢呋喃基、四氢噻吩基、吡唑烷基、咪唑烷基、噁唑烷基、异噁唑烷基、噻唑烷基、哌啶基、四氢吡喃基、四氢噻喃基、哌嗪基、吗啉基、硫代吗啉基、1,1-二氧代-硫代吗啉-4-基、氮杂环庚烷基(azepanyl)、二氮杂环庚烷基、高哌嗪基(homopiperazinyl)或氧杂氮杂环庚烷基(oxazepanyl)。双环饱和杂环烷基的实例是8-氮杂-双环[3.2.1]辛基、奎宁环基(quinuclidinyl)、8-氧杂-3-氮杂-双环[3.2.1]辛基、9-氮杂-双环[3.3.1]壬基、3-氧杂-9-氮杂-双环[3.3.1]壬基或3-硫杂-9-氮杂双环[3.3.1]壬基。部分不饱和杂环烷基的实例是二氢呋喃基、咪唑啉基、二氢-噁唑基、哌啶基、四氢吡啶基或二氢吡喃基。单独或与其他基团组合的术语“c1-6烷氧基”代表可以是直链或支链、具有单个或多个支链的-o-c1-6烷基,其中烷基通常包含1至6个碳原子,例如甲氧基(ome,meo)、乙氧基(oet)、丙氧基、异丙氧基(i-丙氧基)、正丁氧基、i-丁氧基(异丁氧基)、2-丁氧基(仲丁氧基)、叔丁氧基(tert-丁氧基)、异戊氧基(i-戊氧基)等。特别的“c1-6-烷氧基”是具有1至4个碳原子的基团。特定的基团是甲氧基。术语“芳基”表示包含6至10个碳环原子的单价芳族碳环状单环或双环环系。实例是苯基。类似“被r取代的a-b-x”的术语是指该部分的“x”部分被r取代。术语“药学上可接受的”表示可用于制备药物组合物的材料的属性,该药物组合物通常是安全的、无毒的,且在生物学上或其他方面不是不期望的,且对于兽用以及人类药学用途是可接受的。术语“药学上可接受的盐”是指适用于与人和动物的组织接触的盐。与无机酸和有机酸形成的合适盐的实例是,但不限于,乙酸、柠檬酸、甲酸、富马酸、盐酸、乳酸、马来酸、苹果酸、甲烷-磺酸、硝酸、磷酸、对甲苯磺酸、琥珀酸、硫酸(硫酸)、酒石酸、三氟乙酸等。具体的酸是甲酸、三氟乙酸和盐酸。特定的酸是盐酸、三氟乙酸和富马酸。术语“药学上可接受的辅助物质”是指与制剂的其他成分相容的载体和辅助物质,诸如稀释剂或赋形剂。术语“药物组合物”涵盖包含预定量或比例的特定成分的产品,以及直接或间接地以特定量组合特定成分产生的任何产品。特别地,它涵盖包含一种或多种活性成分的产品,和包含惰性成分的任选载体,以及直接或间接由任何两种或更多种成分的组合、络合或聚集或者由一种或多种成分的解离或者由一种或多种成分的其他类型的反应或相互作用产生的任何产品。“治疗有效量”是指当施用于受试者用于治疗疾病状态时足以对该疾病状态进行这种治疗的化合物的量。“治疗有效量”将取决于化合物、所治疗的疾病状态、所治疗的疾病的严重程度、受试者的年龄和相对健康状况、施用途径和形式、主治医生或兽医的判断以及其他因素而变化。当指代变量时,术语“如本文所定义”和“如本文所述”通过引用并入该变量的广义定义以及具体地、更具体地和最具体地定义,如果有的话。当涉及化学反应时,术语“处理”、“接触”和“反应”是指在适当条件下添加或混合两种或更多种试剂以产生所示的和/或所需的产物。应当理解,产生所示的和/或所需的产物的反应可能不一定直接由最初加入的两种试剂的组合直接产生,即,可能存在在最终导致形成所示的和/或所需的产品的混合物中生成的一种或多种中间体。术语“芳族的”表示如文献中所定义的芳香性的常规概念,特别是在iupac-《化学术语汇编》第二版,a.d.mcnaught&a.wilkinson(编辑),布莱克韦尔科学出版物,oxford(1997)中定义。术语“药学上可接受的赋形剂”表示没有治疗活性并且是无毒的任何成分,诸如用于配制药物产品的崩解剂、粘合剂、填充剂、溶剂、缓冲剂、张度剂、稳定剂、抗氧化剂、表面活性剂或润滑剂。每当化学结构中存在手性碳时,意图是与该手性碳相关的所有立体异构体均作为纯的立体异构体及其混合物被该结构所涵盖。本发明还提供了药物组合物,上述化合物的使用方法和制备方法。所有单独的实施方案可以组合。e1本发明涉及式a的化合物,或其药学上可接受的盐,其中y是ch2或nh,特别是ch2,x1是ch或n,x2是ch或n,x3是ch或n,且,如果x1、x2或x3中的一个是n,则其他两个是ch,r1各自独立地选自下组:i)-c(=o)-r6,ii)杂环基,iii)杂环基,被单独选自r10的1至2个取代基取代,iv)芳基,和v)芳基,被单独选自r9的1至2个取代基取代,r2是h,或r1和r2与它们连接的氮一起形成杂芳基,其能被单独选自r3的1至2个取代基取代,r3各自独立地选自下组:i)被1至2个选自r4的取代基取代的-(ch2)0-1-芳基,ii)-(ch2)0-1-芳基,iii)-(ch2)0-1-c3-7环烷基-芳基,iv)-(ch2)0-2-n(r3c)c(=o)-c1-6烷基,v)-(ch2)0-2-n(r3c)c(=o)-c3-7环烷基,vi)氨基-c1-6烷基,vii)-c(=o)n(r3a,r3b),viii)-c(=o)o-c1-6烷基,ix)-c1-6烷基,x)-c3-7环烷基,xi)-ch2-o-(ch2)0-1-芳基,xii)被1至2个选自r4的取代基取代的杂芳基,xiii)羟基-c1-6烷基,和xiv)未取代的杂芳基,r3a选自下组:i)h,和ii)c1-6烷基,r3b选自下组:i)h,ii)c1-6烷基,和iii)-c3-7环烷基,或r3a和r3b与它们连接的氮一起形成杂环烷基,r3c选自下组:i)h,和ii)c1-6烷基,r4选自下组:i)氨基,ii)-(ch2)0-2-n(r3c)c(=o)-c1-6烷基,iii)-c(=o)-c1-6烷基,iv)-c(=o)n(r3a,r3b),v)-c(=o)o-c1-6烷基,vi)c1-6烷氧基,vii)c1-6烷基,viii)卤代-c1-6烷基,ix)被选自r5的1至2个取代基取代的杂芳基,x)羟基-c1-6烷基,和xi)未取代的杂芳基,r5是c1-6烷基,r6选自下组:i)未取代的芳基,ii)未取代的杂芳基,和iii)被选自r7的1至2个取代基取代的杂芳基,r7选自下组:i)未取代的杂芳基,和ii)被选自r8的1至2个取代基取代的杂芳基,r8是c1-6烷基,r9选自下组:i)c1-6烷基,和ii)-c(=o)-c1-6烷基,r10选自下组:i)-c1-6烷基,和ii)-c(=o)o-c1-6烷基,该化合物用于癌症的治疗性和/或预防性治疗。e2本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,用于癌症的治疗性和/或预防性治疗,其中y是ch2。e3本发明的某个实施方案涉及如本文所述的式i的化合物,或其药学上可接受的盐,用于癌症的治疗性和/或预防性治疗,其中x1是ch或n,x2是ch或n,x3是ch或n,且,如果x1、x2或x3中的一个是n,则其他两个是ch,r1各自独立地选自下组:i)-c(=o)-r6,ii)杂环基,iii)杂环基,被单独选自r10的1至2个取代基取代,iv)芳基,和v)芳基,被单独选自r9的1至2个取代基取代,r2是h,或r1和r2与它们连接的氮一起形成杂芳基,其可被单独选自r3的1至2个取代基取代,r3各自独立地选自下组:i)被单独选自r4的1至2个取代基取代的-(ch2)0-1-芳基,ii)-(ch2)0-1-芳基,iii)-(ch2)0-1-c3-7环烷基-芳基,iv)-(ch2)0-2-n(r3c)c(=o)-c1-6烷基,v)-(ch2)0-2-n(r3c)c(=o)-c3-7环烷基,vi)氨基-c1-6烷基,vii)-c(=o)n(r3a,r3b),viii)-c(=o)o-c1-6烷基,ix)-c1-6烷基,x)-c3-7环烷基,xi)-ch2-o-(ch2)0-1-芳基,xii)被1至2个选自r4的取代基取代的杂芳基,xiii)羟基-c1-6烷基,和xiv)未取代的杂芳基,r3a选自下组:i)h,和ii)c1-6烷基,r3b选自下组:i)h,ii)c1-6烷基,和iii)-c3-7环烷基,或r3a和r3b与它们连接的氮一起形成杂环烷基,r3c选自下组:i)h,和ii)c1-6烷基,r4选自下组:i)氨基,ii)-(ch2)0-2-n(r3c)c(=o)-c1-6烷基,iii)-c(=o)-c1-6烷基,iv)-c(=o)n(r3a,r3b),v)-c(=o)o-c1-6烷基,vi)c1-6烷氧基,vii)c1-6烷基,viii)卤代-c1-6烷基,ix)被1至2个选自r5的取代基取代的杂芳基,x)羟基-c1-6烷基,和xi)未取代的杂芳基,r5是c1-6烷基,r6选自下组:i)未取代的芳基,ii)未取代的杂芳基,和iii)被1至2个选自r7的取代基取代的杂芳基,r7选自下组:i)未取代的杂芳基,和ii)被1至2个选自r8的取代基取代的杂芳基,r8是c1-6烷基,r9选自下组:i)c1-6烷基,和ii)-c(=o)-c1-6烷基,r10选自下组:i)-c1-6烷基,和ii)-c(=o)o-c1-6烷基,该化合物用于癌症的治疗性和/或预防性治疗。e4本发明的某个实施方案涉及如本文所述的式i的化合物,或其药学上可接受的盐,其中x1是ch或n,x2是ch或n,x3是ch或n,且,如果x1、x2或x3中的一个是n,则其他两个是ch,r1是-c(=o)-r6,r2是h,或r1和r2与它们连接的氮一起形成杂芳基,其可被单独选自r3的1至2个取代基取代,r3各自独立地选自下组:i)被1至2个选自r4的取代基取代的-(ch2)0-1-芳基,ii)-(ch2)0-1-芳基,iii)-c(=o)n(r3a,r3b),iv)-(ch2)0-2-n(r3c)c(=o)-c3-7环烷基,v)-(ch2)0-2-n(r3c)c(=o)-c1-6烷基,vi)-c(=o)o-c1-6烷基,vii)-(ch2)0-1-c3-7环烷基-芳基,viii)-c1-6烷基,ix)-c3-7环烷基,x)-ch2-o-(ch2)0-1-芳基,xi)被1至2个选自r4的取代基取代的杂芳基,xii)羟基-c1-6烷基,和xiii)未取代的杂芳基,r3a选自下组:i)h,和ii)c1-6烷基,r3b选自下组i)h,ii)c1-6烷基,和iii)-c3-7环烷基,或r3a和r3b与他们连接的氮一起形成杂环烷基,r3c选自下组:i)h,和ii)c1-6烷基,r4选自下组:i)未取代的杂芳基,ii)被1至2个选自r5的取代基取代的杂芳基,和iii)c1-6烷氧基,r5是c1-6烷基,r6选自下组:i)未取代的杂芳基,和ii)被1至2个选自r7的取代基取代的杂芳基,r7选自下组:i)未取代的杂芳基,和ii)被1至2个选自r8的取代基取代的杂芳基,r8是c1-6烷基,该化合物用于癌症的治疗性和/或预防性治疗。e5本发明的某个实施方案涉及本文描述的式i的化合物,或其药学上可接受的盐,其中r3各自单独地选自下组:i)被1至2个选自r4的取代基取代的-(ch2)0-1-芳基,ii)-(ch2)0-1-芳基,iii)-(ch2)0-1-c3-7环烷基-芳基,iv)-(ch2)0-2-n(r3c)c(=o)-c1-6烷基,v)-(ch2)0-2-n(r3c)c(=o)-c3-7环烷基,vi)氨基-c1-6烷基,vii)-c(=o)n(r3a,r3b),viii)-c(=o)o-c1-6烷基,ix)-c1-6烷基,x)-c3-7环烷基,xi)-ch2-o-(ch2)0-1-芳基,xii)被1至2个选自r4的取代基取代的杂芳基,xiii)羟基-c1-6烷基,和xiv)未取代的杂芳基,该化合物用于癌症的治疗性和/或预防性治疗。e6本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,其中r3各自单独地选自下组:i)h,ii)-c(=o)-c1-6烷基,iii)c(=o)-n(r9’,r10’),iv)-c(=o)o-c1-6烷基,v)-c1-6烷氧基,vi)-c1-6烷基,vii)-c1-6烷基-n(r11)-c(c=o)-r12,viii)-卤素,ix)-卤素-c1-6烷基,x)-羟基-c1-6烷基,xi)-n(r9’,r10’),和xii)-nh-c(=o)-c1-6烷基,其中r9’、r10’、r11和r12各自独立地选自h和c1-6烷基,该化合物用于癌症的治疗性和/或预防性治疗。e7本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,用于癌症的治疗性和/或预防性治疗,其中x1、x2和x3是ch。e8本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,用于癌症的治疗性和/或预防性治疗,其中x1是ch。e9本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,用于癌症的治疗性和/或预防性治疗,其中x2是ch。e10本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,用于癌症的治疗和/或预防性治疗,其中x3是ch。e11本发明的某个实施方案涉及本文所述的式i化合物或其药学上可接受的盐,用于癌症的治疗性和/或预防性治疗,该化合物选自下组:(rs)-n-(7-氧代-5,6,7,8-四氢-l,8-萘啶-3-基)-1,2,3,4-四氢萘-l-甲酰胺,2-((苄氧基)甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-(环丙烷甲酰胺)乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-乙酰胺基苯基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(2-乙酰基-3-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(2-乙酰基苯基)-n-甲基-1-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(2-氨基乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-(2-氨基苯基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(2-氟-5-甲氧基-苯基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(2-甲氧基-4-吡啶基)-n-甲基-l-(7-氧代-6,8-二氢-5h-l,8-萘啶-3-基)苯并咪唑-5-甲酰胺,2-(2-甲氧基苄基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-甲氧基吡啶-3-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-甲氧基吡啶-4-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(3-乙酰胺基-2-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(3-氨基-2-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(3-甲氧基苯基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(3-甲基咪唑-4-基)-n-(2-氧代-3,4-二氢-lh-喹啉-6-基)喹啉-4-甲酰胺,2-(4-甲氧基-6-甲基-2-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(4-甲氧基吡啶-2-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(5-氟-2-甲氧基-4-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(5-甲氧基-2-甲基-苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺,2-(6-甲氧基吡啶-2-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(6-甲氧基吡啶-3-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(羟基甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-[[2-甲氧基-4-(三氟甲基)苯基]甲基]-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺,2-[2-(羟基甲基)-4-吡啶基]-n-甲基-1-(2-氧代-3,4-二氢1h-喹啉-6-基)苯并咪唑-5-甲酰胺,2-[2-(羟基甲基)苯基]-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺,2-[4-(乙酰胺基甲基)苯基]-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺,2-苄基-n-甲基-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-环丙基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-乙基-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺,2-异丙基-n,n-二甲基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-甲酰胺,2-异丙基-n-甲基-l-(2-氧代-l,2,3,4-四氢喹唑啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-异丙基-n-甲基-l-(6-氧代-7,8-二氢-5h-l,5-萘啶-2-基)苯并咪唑-5-甲酰胺,2-异丙基-n-甲基-l-(7-氧代-6,8-二氢-5h-l,8-萘啶-3-基)苯并咪唑-5-甲酰胺,6-((2-氨基苯基)氨基)-3,4-二氢喹唑啉-2(lh)-酮,6-(1h-咪唑-1-基)-3,4-二氢-1,8-萘啶-2(1h)-酮,6-(2,3-二氢吡咯并[2,3-b]吡啶-l-羰基)-3,4-二氢-lh-l,8-萘啶-2-酮,6-(2,3-二氢吡咯并[2,3-b]吡啶-l-羰基)-3,4-二氢-lh-喹啉-2-酮,6-(2-异丙基-lh-苯并[d]咪唑-1-基)-3,4-二氢喹唑啉-2(lh)-酮,6-(3,4-二氢-2h-喹啉-1-羰基)-3,4-二氢-1h-1,8-萘啶-2-酮,6-(3,4-二氢-2h-喹啉-1-羰基)-3,4-二氢-1h-喹啉-2-酮,6-(5-(4-甲氧基苯基)-lh-咪唑-1-基)-3,4-二氢喹啉-2(lh)-酮,6-(5-苯基-1h-咪唑-1-基)-3,4-二氢喹啉-2(lh)-酮,6-(吲哚啉-1-羰基)-3,4-二氢-1h-1,8-萘啶-2-酮,6-(吲哚啉-1-羰基)-3,4-二氢-1h-喹啉-2-酮,7-(lh-咪唑-1-基)-3,4-二氢喹啉-2(lh)-酮,5-(甲基氨基甲酰基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-2-羧酸乙酯,2-(2-甲氧基吡啶-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-羧酸甲酯,2-[[5-(甲基氨基甲酰基)-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-2-基]甲基]苯甲酸甲酯,2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]吡啶-3-羧酸甲酯,2-异丙基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-羧酸甲酯,4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯,n-(l-乙酰基-4-哌啶基)-2-氧代-3,4-二氢lh-喹啉-6-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(lh-吡唑-4-基)-lh-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(1-苯基环丙基)-1h-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(喹啉-4-基)-1h-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-3,4-二氢-lh-喹啉-6-基)-2-[3-(三氟甲基)-4-吡啶基]苯并咪唑-5-甲酰胺,n-甲基-2-(吗啉-4-羰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,n-甲基-2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,n-甲基-2-[3-(甲基氨基甲酰基)-2-吡啶基]-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,和n-甲基-2-[2-(甲基氨基甲酰基)苯基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺。e12本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,其用于癌症的治疗性和/或预防性治疗,该化合物选自下组:2-(2-(环丙烷甲酰胺基)乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-((苄氧基)甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-甲氧基苄基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-甲氧基吡啶-4-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(羟基甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-苄基-n-甲基-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-环丙基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,5-(甲基氨基甲酰基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-2-羧酸乙酯,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(lh-吡唑-4-基)-lh-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(1-苯基环丙基)-1h-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(喹啉-4-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(3-甲基咪唑-4-基)-n-(2-氧代-3,4-二氢-lh-喹啉-6-基)喹啉-4-甲酰胺,2-乙基-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺,6-(5-苯基-lh-咪唑-1-基)-3,4-二氢喹啉-2(lh)-酮,6-咪唑-1-基-3,4-二氢-lh-喹啉-2-酮,n-甲基-2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺,和6-(lh-咪唑-1-基)-3,4-二氢-1,8-萘啶-2(lh)-酮。e13一种式i的化合物,或其药学上可接受的盐,其中x是ch或n,r1是-c(o)-r6,r2是h,或r1和r2与它们连接的氮一起形成杂芳基,其可被1至2个选自r3的取代基取代,r3选自下组:i)被1至2个选自r4的取代基取代的-(ch2)0-1-芳基,ii)-(ch2)0-1-芳基,iii)-c(=o)n(r3a,r3b),iv)-c(=o)o-c1-6烷基,v)-c(c3-7环烷基)-芳基,vi)c1-6烷基,vii)-c3-7环烷基,viii)-ch2-o-(ch2)0-1-芳基,ix)被1至2个选自r4的取代基取代的杂芳基,x)羟基-c1-6烷基,和xi)未取代的杂芳基,r3a选自下组:i)h,和ii)c1-6烷基,r3b选自下组:i)h,ii)c1-6烷基,和iii)-c3-7环烷基,或r3a和r3b与它们连接的氮一起形成杂环烷基,r4选自下组:i)未取代的杂芳基,ii)被1至2个选自r5的取代基取代的杂芳基,和iii)c1-6烷氧基,r5是c1-6烷基,r6选自下组:i)未取代的杂芳基,和ii)被1至2个选自r7的取代基取代的杂芳基,r7选自下组:i)未取代的杂芳基,和ii)被1至2个选自r8的取代基取代的杂芳基,r8是c1-6烷基,条件是排除6-咪唑-1基-3,4-二氢-lh-喹啉-2-酮。e14根据实施方案中的任一项的化合物,其中x是ch。e15根据实施方案中的任一项的化合物,其中r1和r2与它们连接的氮一起形成杂芳基,特别是咪唑基或苯并咪唑基,它们各自可被1至2个单独选自r3的取代基取代,其中r3各自独立地选自:i)被1至2个选自r4的取代基取代-(ch2)0-1-芳基,ii)-(ch2)0-1-芳基,iii)-c(=o)n(r3a,r3b),iv)-c(=o)o-c1-6烷基,v)-c(c3-7环烷基)-芳基,vi)-c1-6烷基,vii)-c3-7环烷基,viii)-ch2-o-(ch2)0-1-芳基,ix)被1至2个选自r4的取代基取代的杂芳基,x)羟基-c1-6烷基,和xi)未取代的杂芳基,r3a选自下组:i)h,和ii)c1-6烷基,r3b选自下组:i)h,ii)c1-6烷基,和iii)-c3-7环烷基,r4选自下组:i)未取代的杂芳基,ii)被1至2个选自r5的取代基取代的杂芳基,和iii)c1-6烷氧基,r5是c1-6烷基。e16根据实施方案中的任一项的化合物,其中r3选自下组:i)lh-吡唑基,ii)甲基咪唑基-喹啉基-,iii)甲氧基苄基,iv)甲氧基吡啶基,v)苄基,vi)-c(=o)n(h,me),vii)-c(=o)o-乙基,viii)-c(=o)n(h,环丙基),ix)-c(环丙基)-苯基,x)-ch2-ch2oh,和xi)-ch2-o-苄基,xii)环丙基,xiii)乙基,xiv)苯基,和xv)喹啉基。e17根据实施方案中任一项的化合物,其中r3是甲基咪唑基-喹啉基-。e18根据实施方案中任一项的化合物,或其药学上可接受的盐,选自下组:2-(2-(环丙烷甲酰胺基)乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-((苄氧基)甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-甲氧基苄基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-甲氧基吡啶-4-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(羟基甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-苄基-n-甲基-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-环丙基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,5-(甲基氨基甲酰基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-2-羧酸乙酯,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(lh-吡唑-4-基)-lh-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(1-苯基环丙基)-1h-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(喹啉-4-基)-lh-苯并[d]咪唑-5-甲酰胺,2-(3-甲基咪唑-4-基)-n-(2-氧代-3,4-二氢-lh-喹啉-6-基)喹啉-4-甲酰胺,2-乙基-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺,6-(5-苯基-lh-咪唑-1-基)-3,4-二氢喹啉-2(lh)-酮,6-咪唑-1-基-3,4-二氢-lh-喹啉-2-酮,和n-甲基-2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺。e19根据实施方案中任一项的式i的化合物,其为式ii的化合物,或其药学上可接受的盐,其中环是苯并咪唑基-5-甲酰亚胺,可被1至2个选自r3的取代基取代,r3各自独立地选自下组:i)被1至2个选自r4的取代基取代的-(ch2)0-1-芳基,ii)-(ch2)0-1-芳基,iii)-c(=o)o-c1-6烷基,iv)-c(c3-7环烷基)-芳基,v)c1-6烷基,vi)-c3-7环烷基,vii)-ch2-o-(ch2)0-2-芳基,viii)-c(=o)n(h,环丙基),ix)被1至2个选自r4的取代基取代的杂芳基,x)羟基-c1-6烷基,和xi)未取代的杂芳基,r4选自下组:i)未取代的杂芳基,ii)被1至2个选自r5的取代基取代的杂芳基,和iii)c1-6烷氧基,r5是c1-6烷基。e20根据实施方案中任一项的化合物,其中r3选自下组:i)1h-吡唑基,ii)甲基咪唑基-喹啉基-,iii)甲氧基苄基,iv)甲氧基吡啶基,v)苄基,vi)-c(=o)n(h,环丙基),vii)-c(=o)o-乙基,viii)-c(环丙基)-苯基,ix)-ch2-ch2oh,和x)-ch2-o-苄基,xi)环丙基,xii)乙基,和xiii)喹啉基。e21根据实施方案中任一项的化合物,其中r3选自下组:i)1h-吡唑基,ii)甲基咪唑基-喹啉基-,iii)甲氧基苄基,iv)甲氧基吡啶基,v)苄基,vi)-c(=o)o-乙基,vii)-c(环丙基)-苯基,viii)-ch2-ch2oh,和ix)-ch2-o-苄基,x)环丙基,xi)乙基,xii)苯基,和xiii)喹啉基。e22根据实施方案中任一项的化合物,其中r3是甲基咪唑基-喹啉基-。e23根据实施方案中任一项的式i的化合物,或其药学上可接受的盐,选自下组:2-(2-(环丙烷甲酰胺基)乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-((苄氧基)甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-甲氧基苄基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(2-甲氧基吡啶-4-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺,2-(羟基甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-苄基-n-甲基-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,2-环丙基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,5-(甲基氨基甲酰基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-2-羧酸乙酯,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(lh-吡唑-4-基)-lh-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(1-苯基环丙基)-1h-苯并[d]咪唑-5-甲酰胺,n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(喹啉-4-基)-lh-苯并[d]咪唑-5-甲酰胺,2-乙基-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺,6-咪唑-1-基-3,4-二氢-lh-喹啉-2-酮,和n-甲基-2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-5-甲酰胺。e24一种化合物,或其药学上可接受的盐,具有包含以下的化学结构:p-l-c其中l是接头基团,c是根据实施方案中任一项的式i的化合物,其中l化学连接到c;和p是与靶蛋白或靶多肽结合的蛋白靶部分,其中l化学连接到p。e25根据实施方案中任一项的化合物,其中l选自下组:i)-nhch2-(ch2)1-30-ch2nh-,和ii)-nh-(ch2ch2o)1-25-ch2ch2-nh-。e26根据实施方案中任一项的化合物,其中p是brd4抑制剂,特别地其中p是e27根据实施方案中任一项的化合物,选自下组:n-(10-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酰胺基)癸基)-2-(2-(1-甲基-lh-咪唑-5-基)喹啉-4-基)-1-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,n-(2-(2-(2-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酰胺基)乙氧基)乙氧基)乙基)-2-(2-(l-甲基-lh-咪唑-5-基)喹啉-4-基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺,和n-(5-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)戊基)-2-(2-(l-甲基-lh-咪唑-5-基)喹啉-4-基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺。e28本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,用作治疗活性物质。e29本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,用于癌症的治疗性和/或预防性治疗。e30本发明的某个实施方案涉及本文所述的式i的化合物,或其药学上可接受的盐,用于制备用于癌症的治疗性和/或预防性治疗的药物。e31本发明的某个实施方案涉及一种药物组合物,其包含本文所述的式i的化合物,或其药学上可接受的盐,和药学上可接受的辅助物质。e32本发明的某个实施方案涉及通过将本文所述的式i的化合物,或其药学上可接受的盐施用于患者来治疗性和/或预防性治疗癌症的方法。e33本发明的某个实施方案涉及本文所述的p-l-c化合物,或其药学上可接受的盐,用作治疗活性物质。e34本发明的某个实施方案涉及本文所述的p-l-c的化合物,或其药学上可接受的盐,用于癌症的治疗性和/或预防性治疗。e35本发明的某个实施方案涉及如本文所述的p-l-c的化合物,或其药学上可接受的盐,用于制备用于治疗性和/或预防性治疗癌症的药物。e36本发明的某个实施方案涉及一种药物组合物,其包含本文所述的p-l-c化合物,或其药学上可接受的盐,以及药学上可接受的辅助物质特别是惰性载体。e37本发明的某个实施方案涉及通过将本文所述的p-l-c化合物,或其药学上可接受的盐施,施用于患者来治疗性和/或预防性治疗癌症的方法。此外,本发明包括式i的化合物的所有光学异构体,即非对映异构体、非对映异构体混合物、外消旋混合物,其所有相应的对映异构体和/或互变异构体,以及它们的溶剂化物。式i或式p-l-c的化合物可以包含一个或多个不对称中心,因此可以以外消旋体、外消旋混合物、单一对映异构体、非对映异构体混合物和单个非对映异构体形式存在。取决于分子上各种取代基的性质,可以存在另外的不对称中心。每个这样的不对称中心将独立地产生两个光学异构体,并且意图是混合物中的以及作为纯的或部分纯化的化合物的所有可能的光学异构体和非对映异构体都包括在本发明中。本发明旨在涵盖这些化合物的所有此类异构形式。这些非对映异构体的独立合成或其色谱分离可以通过本文公开的方法的适当改进如本领域已知的来实现。它们的绝对立体化学可以通过结晶产物或结晶中间体的x射线晶体学测定,如果需要,用含有已知绝对构型的不对称中心的试剂将这些结晶产物或结晶中间体衍生化。如果需要,可以分离化合物的外消旋混合物,从而分离出各个对映异构体。可以通过本领域众所周知的方法进行分离,诸如将化合物的外消旋混合物与对映异构体纯的化合物偶联以形成非对映异构体混合物,然后通过标准方法诸如分级结晶或色谱分离各个非对映异构体。在提供光学纯对映异构体的实施方案中,光学纯对映异构体是指化合物包含按重量计>90%的所需异构体,特别是按重量计>95%所需的异构体,或更特别是按重量计>99%的所述异构体,所述重量百分比基于化合物的异构体的总重量。手性纯的或手性富集的化合物可以通过手性选择性合成或通过对映异构体的分离来制备。对映异构体的分离可以对最终产物或者可替代地对合适的中间体进行。式a、式i或式p-l-c的化合物可以根据实施例中所述的方案制备。起始原料是可商购的,或者可以根据已知方法制备。本发明的式a或i的化合物的制备可以以连续或会聚的合成路线进行。在以下方案1至8和65个具体实施例的描述中示出了本发明化合物的合成。进行反应和纯化所得产物所需的技能是本领域技术人员已知的。除非有相反指示,否则在以下方法描述中使用的取代基和指数具有本文前面给出的含义。更详细地,式a或式i的化合物可以通过以下给出的方法,通过实施例中给出的方法或通过类似方法来制备。各个反应步骤的合适反应条件是本领域技术人员已知的。然而,反应顺序不限于方案1至8中显示的顺序,取决于原料和它们各自的反应性,反应步骤的顺序可以自由地改变。起始原料可以商购获得,或者可以通过类似于以下给出的方法的方法、通过说明书或实施例中引用的参考文献中描述的方法或通过本领域已知的方法制备。方案1取代基如上所述,r是h、-c(o)nhme、-c(o)ome。步骤a或步骤a':可以通过1,2-氟-硝基-芳烃1和芳族胺化合物2之间的芳族亲核取代(snar)反应或通过1,2-氨基-硝基芳烃1′与芳族氯化物化合物2′之间的buchwald-hartwig反应获得硝基-氨基-芳烃化合物3。合适的1,2-氟-硝基-芳烃1的实例包括但不限于1-氟-2-硝基苯19、4-氟-n-甲基-3-硝基苯甲酰胺20、3-氟-n-甲基-4-硝基苯甲酰胺21、4-氟-3-硝基苯甲酸甲酯22、3-氟-4-硝基苯甲酸甲酯23。合适的芳族胺化合物2的实例包括但不限于6-氨基-3,4-二氢-1h-喹啉-2-酮24。snar反应是在极性非质子有机溶剂(诸如n-甲基-2-吡咯烷酮或n,n-二甲基甲酰胺)中,在有机碱(诸如n,n-二异丙基乙胺,三乙胺或n-甲基吗啉)的存在下于升高的温度下进行的。优选的条件是在n-甲基-2-吡咯烷酮中的n,n-二异丙基乙胺,在60至120℃下过夜。合适的1,2-氨基-硝基芳烃1'的实例包括但不限于4-氨基-3-硝基-苯甲酸酯25。合适的芳族卤化物化合物2'的实例包括但不限于6-氯-3,4-二氢-1h-1,5-萘啶-2-酮26。buchwald-hartwig反应是在诸如二噁烷、dme、thf、甲苯、dmf和dmso的溶剂中,在钯催化剂、配体和碱的存在下于升高的温度下进行的。优选的条件是在密封管中,催化的三(二亚苄基丙酮)二钯,4,5-双(二苯基膦基)-9,9-二甲基呫吨和碳酸铯,在120℃下加热12小时。步骤b:将硝基-氨基-芳烃化合物3还原为二氨基-芳烃4可以通过在常压或高压下、极性溶剂(诸如meoh、etoh、二噁烷、thf或它们的混合物)中、在催化剂(诸如pto2、pd-c或雷尼镍)的存在下用氢气氢化来完成。优选的条件是1个大气压氢气,在甲醇和thf的混合物中,在10%钯/炭的存在下,室温下,持续2至18小时。步骤c:在偏亚硫酸氢钠存在下,通过用醛5使二氨基-芳烃4环化,可以得到苯并咪唑6。环化反应在极性非质子有机溶剂(诸如n-甲基-2-吡咯烷酮或n,n-二甲基甲酰胺)中在高温下进行。优选的条件是n,n-二甲基甲酰胺,在80至120℃下,持续2至48小时。方案2取代基如本文所述,r3a和r3b彼此独立地是氢或甲基。步骤a:酯化合物7可通过用碱水溶液诸如氢氧化锂、氢氧化钠或氢氧化钾处理而被水解成羧酸8。水解反应在水和极性醚溶剂(诸如二噁烷、thf、dme或tbme)的混合物中,在室温或升高的温度下进行2至18小时。优选的条件是在室温下,1mlioh水溶液,在thf和meoh的混合物中,18小时。步骤b:酰胺键的形成可以通过在偶联剂(诸如dcc、edc、tbtu或hatu)的存在下,在有机碱(诸如三乙胺、n,n-二异丙基乙胺或n-甲基吗啉)的存在下,在卤化溶剂(诸如二氯甲烷或1,2-二氯乙烷)或醚溶剂(诸如乙醚、二噁烷、thf、dme或tbme)中或在极性非质子有机溶剂(诸如n-甲基-2-吡咯烷酮或n,n-二甲基甲酰胺)中,羧酸8与伯胺或仲胺9在室温或升高的温度下2至18小时的偶联反应来完成。优选的条件是hatu与n,n-二异丙基乙胺,在thf和n,n-二甲基甲酰胺的混合物中,在室温下,18小时。方案3x1和取代基r6如本文所述。步骤a:酰胺键的形成可以通过在偶联剂(诸如dcc、edc、tbtu或hatu)的存在下,在有机碱(诸如三乙胺、n,n-二异丙基乙胺或n-甲基吗啉)的存在下,在卤化溶剂(诸如二氯甲烷或1,2-二氯乙烷)或醚溶剂(诸如乙醚、二噁烷、thf、dme或tbme)中或在极性非质子有机溶剂(诸如n-甲基-2-吡咯烷酮或n,n-二甲基甲酰胺)中,羧酸12与合适的胺11在室温或升高温度下2至18小时的偶联反应来完成。合适的胺11的实例包括但不限于6-氨基-3,4-二氢喹啉-2(1h)-酮24和6-氨基-3,4-二氢-1,8-萘啶-2(1h)-酮。优选的条件是hatu与n,n-二异丙基乙胺,在n,n-二甲基甲酰胺中,在室温下,2至3小时。方案4取代基如上所述,q是br或i。步骤a:合适的芳基溴化物或芳基碘化物14与咪唑化合物15的ullmann偶联可以在升高温度下在溶剂(诸如dmf、乙腈、dmso、thf、dme、甲苯、1,4-二噁烷或其混合物)中用铜催化剂、二胺配体和碱(诸如k2co3、na2co3、cs2co3、k2hpo4、kotbu)处理来完成。合适的芳基卤化物化合物11的实例包括但不限于6-溴-3,4-二氢-1h-喹啉-2-酮27、6-碘-3,4-二氢-1h-喹啉-2-酮28或6-溴-3,4-二氢-1,8-萘啶-2(1h)-酮29。优选的条件是cui,六亚甲基四胺和碳酸钾,在dmf中,在130℃下,18至24小时。方案5取代基如上所述,r'是甲基或乙基。步骤a:硝基-酯化合物19可以通过咪唑化合物17与合适的氟-硝基-芳烃化合物18的芳族亲核取代(snar)反应获得。合适的氟-硝基-芳烃化合物18的实例包括但不限于:3-(5-氟-2-硝基苯基)丙酸乙酯30或3-(5-氟-2-硝基苯基)丙酸甲酯31。snar反应在无机碱诸如碳酸钠或碳酸钾的存在下,在极性非质子有机溶剂诸如n,n-二甲基甲酰胺中,在升高的温度下进行。优选的条件是碳酸钾,在n,n-二甲基甲酰胺中,130℃,在微波辐射下15分钟。步骤b:将硝基酯化合物19还原为氨基酯化合物20可以通过在极性溶剂(诸如meoh、etoh、二噁烷、thf或其混合物)中,在催化剂(诸如pto2、pd-c或雷尼镍)的存在下,在常压或升高压力下,用氢气氢化来实现。优选的条件是在1个大气压氢气下,在甲醇和thf的混合物中,在10%钯/炭的存在下,在室温下3小时。步骤c:二氢喹啉酮21可通过氨基酯20的环化获得。环化反应在碱诸如甲醇钠或乙醇钠的存在下,在醇溶剂诸如甲醇或乙醇中在升高的温度下进行。优选的条件是甲醇钠于乙醇中回流48小时。方案6取代基r如本文所述。步骤a:c-n键的形成可以通过在升高的温度下,在钯或铜催化剂、配体和碱的存在下,在溶剂(诸如二噁烷、dme、thf、甲苯、dmf和dmso)中,用氨基-喹啉酮23处理芳基溴化物22来完成,例如使用钯催化的buchwald-hartwig反应。优选的条件是根据hartwig和同事的方法的改进32,催化的三(二亚苄基丙酮)二钯,2-二环己基膦基-2',4',6'-三异丙基联苯和叔丁醇钠在密封管中,在100℃下加热1小时。方案7取代基r和r'如本文所述。步骤a:可以通过在偶联剂(诸如dcc、edc、tbtu或hatu)的存在下,在有机碱(诸如三乙胺、n,n-二异丙基乙胺或n-甲基吗啉)的存在下,在卤化溶剂(诸如二氯甲烷或1,2-二氯乙烷)或醚溶剂(诸如乙醚、二噁烷、thf、dme或tbme)中或在极性非质子有机溶剂(诸如n-甲基-2-吡咯烷酮或n,n-二甲基甲酰胺)中,在室温或升高的温度下2至18小时的羧酸25与合适的胺26之间的偶联反应完成酰胺键的形成。合适的胺26的实例包括但不限于吲哚啉33。优选的条件是hatu和n,n-二异丙基乙胺,在n,n-二甲基甲酰胺中,在室温下,2至3小时。方案8作为说明性实例,可以基于已知的brd4配体jq134制备靶向bet溴结构域brd4的降解剂化合物。该合成使用了相应的羧酸衍生物3135。步骤a:酯化合物7可通过用碱水溶液(诸如氢氧化锂、氢氧化钠或氢氧化钾)处理而被水解成羧酸8。水解反应在水和极性醚溶剂(诸如二噁烷、thf、dme或tbme)的混合物中,在室温或升高的温度下进行2至18小时。优选的条件是1mlioh水溶液,在thf和meoh的混合物中,在室温下,18小时。步骤b:可以通过羧酸8与带有末端胺官能度和末端boc保护的胺官能度的含接头的化合物28之间的偶联反应来完成酰胺键的形成。反应在偶联剂(诸如dcc、edc、tbtu或hatu)的存在下,在有机碱(诸如三乙胺、n,n-二异丙基乙胺,n-甲基吗啉或4-(n,n-二甲基氨基)吡啶)的存在下,在卤化溶剂(诸如二氯甲烷或1,2-二氯乙烷)或醚溶剂(诸如乙醚、二噁烷、thf、dme或tbme)中,在极性非质子有机溶剂(诸如n-甲基-2-吡咯烷酮或n,n-二甲基甲酰胺)中,在室温或升高的温度下进行2至18小时。优选的条件是hatu与n,n-二异丙基乙胺,在n,n-二甲基甲酰胺中,在室温下18小时。步骤c:可以在溶剂(诸如ch2cl2、chcl3、thf、etoac、meoh、etoh或h2o)中,用无机酸(诸如hcl、h2so4或h3po4)或有机酸(诸如cf3cooh、chcl2cooh、hoac或对甲苯磺酸),在0℃至回流温度下实现29的bocn保护基的去除。优选的条件是4mhcl水溶液,在二噁烷和etoac中,在室温下3小时。步骤d:可以通过在偶联剂(诸如dcc、edc、tbtu或hatu)的存在下,在有机碱(诸如三乙胺、n,n-二异丙基乙胺或n-甲基吗啉)的存在下,在卤化溶剂(诸如二氯甲烷或1,2-二氯乙烷)或醚溶剂(诸如乙醚、二噁烷、thf、dme或tbme)中,在极性非质子有机溶剂(诸如n-甲基-2-吡咯烷酮或n,n-二甲基甲酰胺)中,羧酸31与胺30在室温或升高温度下2至18小时的偶联反应来完成酰胺键的形成。优选的条件是hatu与n,n-二异丙基乙胺,在n,n-二甲基甲酰胺中,在室温下2小时。化合物的分离和纯化如果需要,本文所述的化合物和中间体的分离和纯化可以通过任何合适的分离或纯化步骤进行,诸如,例如过滤、萃取、结晶、柱色谱法、薄层色谱法、厚层色谱法、制备型低压或高压液相色谱法或这些步骤的组合。合适的分离和分离步骤的特定说明可参考下面的制备方法和实施例。然而,当然也可以使用其他等价的分离或隔离步骤。可以使用手性hplc分离式i的手性化合物的外消旋混合物。也可以使用手性hplc分离手性合成中间体的外消旋混合物。式i化合物的盐在式i化合物为碱性的情况下,它们可以转化为相应的酸加成盐。通过用至少化学计量的合适的酸和有机酸处理来完成转化,合适的酸诸如盐酸、氢溴酸、硫酸、硝酸、磷酸等,有机酸诸如乙酸、丙酸、乙醇酸、丙酮酸、草酸、苹果酸、丙二酸、琥珀酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。通常,将游离碱溶于惰性有机溶剂诸如乙醚、乙酸乙酯、氯仿、乙醇或甲醇等中,并将酸加入类似的溶剂中。温度保持在0℃至50℃之间。生成的盐会自发沉淀,或者可以用极性较小的溶剂从溶液中带出。在实施例中没有描述它们的制备,式i或式p-l-c的化合物以及所有中间产物可以根据类似的方法或根据本文阐述的方法来制备。起始原料是可商购的,本领域已知的或可以通过本领域已知的方法或与其类似的方法制备。应当理解,本发明中的通式i或通式p-l-c的化合物可以在官能团上衍生化以提供能够在体内转化回母体化合物的衍生物。附图说明图1.双荧光facs测定的数据表明,化合物降低brd4-egfp水平。曲线图(左图)和表(右图)中给出的值是gfp对rfp荧光的中值,虚线表示dmso条件下gfp对rfp的平均值。图2.免疫分析数据显示化合物处理后内源性brd4的降解。显示的值是信号峰面积,该峰面积归一化为上样对照(黏着斑蛋白),并表示为dmso的百分比。药理学测试式i或式p-l-c的化合物及其药学上可接受的盐具有有价值的药理学性质。根据下文给出的测试研究化合物。双荧光报告基因测定为了以中等通量测量哺乳动物细胞系统中的brd4蛋白丰度,基于1中所述的原理开发了双荧光报告基因系统。设计了含有与荧光标签融合的brd4编码序列(nm_058243.2)的瞬时表达载体。载体使用pd2610cmv骨架在atum(newark,ca,usa)合成,并按以下步骤构建:c末端版本brd4_egfp-ires-fresnorfp_nls,n末端版本egfp_brd4-ires-fresnorfp_nls,空载体对照egfp-ires-fresnorfp_nls。c末端版本用于报告基因测定,因为它具有最佳的检测窗口。将hek293a细胞(invitrogen,目录号r705-07)在dulbecco改良的eagle培养基(dmem)、10%胎牛血清、2mml-谷氨酰胺、1%青霉素/链霉素中培养。根据制造商的方案(invitrogen,carlsbad,ca,usa),用lipofectamine2000进行质粒的转染。转染后40小时,以40000/100ul/96孔平底的密度接种细胞,并在8小时后用化合物(dmso中的10mm储备液)以0至25μm的10点稀释度处理。处理16小时后,将细胞用pbs洗涤,重悬于accumax溶液(sigma-aldrich目录号a7089)中,并通过流式细胞仪(cytoflexs,beckmancoulter)进行分析。根据单个细胞的前向和侧向散射曲线对单个细胞进行门控,脉冲宽度用于排除双峰。每个样品采集至少20000个细胞。使用flowjovi0.1程序对brd4-egfp低/中细胞(<106fl1-a平均荧光强度(mfi))进行分析。得出一个因子以将brd4-egfp值归一化至rfp蛋白丰度对照(20xfl1a-gfp/fl11a-rfp),然后计算中位值和众数值并将其用于处理条件之间的比较。基于毛细管的免疫测定测量内源性brd4水平在允许定量内源性brd4水平的另一种测定中证实了所选化合物的生物活性(截止值为brd4-egfp水平降低>20%)。为此,将hek293a细胞(起源和培养条件参见上文)以400’000/300ul/48孔接种,并在6小时后用所示的化合物浓度处理。处理后16小时,将细胞用pbs洗涤,并在50ulurea溶解缓冲液(10mmtris-hclph8、2%chaps、7murea、0.4%dtt)中解解,该缓冲液补充有1x蛋白酶抑制剂混合物(completemini,roche)和1x磷酸酶抑制剂混合物(phosstop,sigma-aldrich)。然后根据制造商的方案(proteinsimple/bio-techne,sanjose,california,95134usa),通过基于peggysue或wes毛细管的免疫测定系统对样品进行分析。所使用的抗体是抗brd4(细胞信号传导,cst134401:50)和抗黏着斑蛋白(sigma,v9131,1:4000)。为了量化brd4蛋白水平,将峰信号面积归一化至黏着斑蛋白负载对照和dmso条件。此外,请参见yen等36。荧光直接结合方案原理通过监测直接模式下的荧光发射可以测量化合物对含有一或多种色氨酸的蛋白质的亲和力的测定。取决于蛋白质可用量的测量是在iss-pc1光子计数光谱荧光计上的比色杯中手动进行的,或者是在荧光板读取器设备上的孔板中自动进行的。通过使用针对配体浓度变化的限定的恒定蛋白质浓度,在选定的结合测定缓冲液中于20℃下进行荧光滴定。加入溶于dmso中的已知配体浓度的小等分试样,并在340nm处记录在280nm处激发的荧光。将荧光强度针对蛋白质稀释和滤波器效果进行校正(birdsalletal.37)。将校正后的荧光强度相对于配体浓度作图,并使用四参数s形函数拟合,使用质量作用定律(假定1:1蛋白质-配体络合物)从中计算平衡解离常数kd(eftink,199738)。方法1)优化测量参数以使蛋白质消耗最小化和使稀释效果和dmso含量最小化2)通过至少12个滴定步骤对蛋白质对配体的滴定测量以获得良好的s曲线拟合3)仅用配体重复相同的滴定测量以进行校正4)通过仅针对dmso的滴定检查一次蛋白质的稳定性5)借助uv分光光度计测定配体在280nm和340nm的摩尔消光系数6)使用excel模板校正测量的原始数据7)使用graphpadprism软件进行二次结合拟合和kd评估。实验细节蛋白批次#cereblon_17_13构建体名称hcereblon(m1-l442)_hddb1(m1-h1140)浓度2.54mg/mlmw180180da摩尔消光系数ε280=165045m-1·cm-1储存缓冲液20mmmesph6.5200mmnacl1mmtcep测定缓冲液50mmhepes7.4200mmnacl表1:蛋白质-缓冲液,参考化合物:沙利度胺,contergan,softenon设备iss-pcl激发波长[nm]280发射波长[nm]340比色杯hellma115f-qs体积[μl]500表2:设置蛋白质制备:蛋白体积[μl]缓冲液体积[μl]蛋白质浓度[m]1.8@2.54mg/ml498.25.0e-8表3:蛋白制剂表4:滴定步骤表5:实例对crbn蛋白质的亲和力药物组合物式i或式p-l-c的化合物和药学上可接受的盐可以用作治疗活性物质,例如以药物制剂的形式。药物制剂可以例如以片剂、包衣片剂、糖衣丸、硬和软明胶胶囊、溶液、乳剂或混悬剂的形式口服施用。然而,给药也可以例如通过直肠进行,以栓剂的形式,或者通过胃肠外形式进行,例如以注射溶液的形式。式i或式p-l-c的化合物及其药学上可接受的盐可以与药学上惰性的无机或有机载体一起加工以制备药物制剂。乳糖、玉米淀粉或其衍生物、滑石粉、硬脂酸或其盐等可以用作例如片剂、包衣片剂、糖衣丸和硬明胶胶囊的载体。用于软明胶胶囊的合适载体是例如植物油、蜡、脂肪、半固体和液体多元醇等。然而,取决于活性物质的性质,在软明胶胶囊的情况下,通常不需要载体。用于生产溶液和糖浆剂的合适载体是例如水、多元醇、甘油、植物油等。栓剂的合适载体是例如天然或硬化油、蜡、脂肪、半液体或液体多元醇等。此外,药物制剂可以含有药学上可接受的辅助物质,诸如防腐剂、增溶剂、稳定剂、润湿剂、乳化剂、甜味剂、着色剂、调味剂、用于改变渗透压的盐、缓冲剂、掩蔽剂或抗氧化剂。它们还可以含有其他有治疗上有价值的物质。本发明还提供了含有式i或式p-l-c的化合物或其药学上可接受的盐和治疗惰性载体的药物,以及其制备方法,该方法包括使一种或多种式i的化合物和/或其药学上可接受的盐,以及如果需要的话,一种或多种其他治疗上有价值的物质与一种或多种治疗惰性载体一起制成盖伦(galenical)施用形式。剂量可以在很宽的范围内变化,当然,在每种具体情况下都必须根据个人需要进行调整。在口服施用的情况下,成人的剂量可以为每天约0.01mg至约1000mg的通式i的化合物或相应量的其药学上可接受的盐。日剂量可以以单剂量或分剂量施用,此外,当发现有需要时也可以超过上限。以下实施例举例说明本发明而不是限制本发明,而仅作为其代表。药物制剂方便地含有约1mg至500mg,特别是1mg至100mg的式i或式p-l-c的化合物。根据本发明的组合物的实施例是:实施例a按常规方法制造以下组成的片剂:表6:可能的片剂组成制造程序1.混合成分1、2、3和4,然后用纯净水制粒。2.在50℃下干燥颗粒。3.使颗粒通过合适的研磨设备。4.加入成分5,混合三分钟;在合适的压制机上压制。实施例b-1制造以下组成的胶囊:表7:可能的胶囊成分组成制造程序1.在合适的混合器中将成分1、2和3混合30分钟。2.加入成分4和5,混合3分钟。3.填充到合适的胶囊中。首先将式a、式i或式p-l-c的化合物、乳糖和玉米淀粉在混合器中混合然后在粉碎机中混合。将混合物返回混合器;将滑石粉加入其中并充分混合。通过机器将混合物填充到合适的胶囊中,例如硬明胶胶囊。实施例b-2制造以下成分的软明胶胶囊:成分mg/胶囊式a、式i或式p-l-c的化合物5黄蜡8氢化的大豆油8部分氢化的植物油34大豆油110总计165表8:可能的软明胶胶囊成分组成成分mg/胶囊明胶75甘油85%32karion838(干物质)二氧化钛0.4氧化铁黄1.1总计116.5表9:可能的软明胶胶囊组成制造程序将式a、式i或式p-l-c的化合物溶于其他成分的热熔物中,并将混合物填充到适当尺寸的软明胶胶囊中。填充的软明胶胶囊根据常规程序进行处理。实施例c制造以下组成的栓剂:成分mg/栓剂式a、式i或式p-l-c的化合物15栓剂基质1285总计1300表10:可能的栓剂组成制造程序将栓剂基质在玻璃或钢制容器中融化,充分混合并冷却至45℃。然后,向其中加入细粉化的式a、式i或式p-l-c的化合物并搅拌直至其完全分散。将混合物倒入适当尺寸的栓剂模具中,冷却;然后将栓剂从模具中取出并单独包装在蜡纸或金属箔中。实施例d制造以下组成的注射液:成分mg/注射液式a、式i或式p-l-c的化合物3聚乙二醇400150乙酸适量,调节至ph5.0注射液用水调节至1.0ml表11:可能的注射液组成制造程序将式a、式i或式p-l-c的化合物溶解在聚乙二醇400和注射用水(部分)的混合物中。添加乙酸将ph调节至5.0。通过添加余量的水将体积调节至1.0ml。过滤溶液,适当过量地将其装入小瓶中并灭菌。实施例e制造以下成分的小袋:成分mg/小袋式i或式p-l-c的化合物50乳糖,细粉末1015微晶纤维素(avicelph102)1400羧甲基纤维素钠14聚乙烯吡咯烷酮k3010硬脂酸镁10调味添加剂1总计2500表12:可能的小袋组成制造程序将式a、i或式p-l-c的化合物与乳糖、微晶纤维素和羧甲基纤维素钠混合,并与聚乙烯吡咯烷酮在水中的混合物制粒。将颗粒与硬脂酸镁和调味添加剂混合,并装入小袋中。实验部分提供以下实施例以说明本发明。它们不应被视为限制本发明的范围,而仅是其代表。实施例1396-咪唑-1-基-3,4-二氢-1h-喹啉-2-酮可以购买标题化合物。实施例2n-甲基-2-[2-(2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺a)3-硝基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯向4-氟-3-硝基苯甲酸甲酯22(300mg)和6-氨基-3,4-二氢-1h-喹啉-2-酮24(244mg)于n-甲基-2-吡咯烷酮(3ml)中的搅拌溶液滴加n,n-二异丙基乙胺(395μl)。将反应混合物在60℃下加热过夜。tlc分析表明反应完成。然后将反应混合物冷却至室温,并用乙酸乙酯和水稀释。将所得混合物通过烧结玻璃过滤,得到为红色固体状的3-硝基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯(365mg,71%)。滤液用水洗涤3次,然后将有机层经na2so4干燥并真空浓缩,得到为红色固体状的3-硝基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯(441mg,86%)。ms(isp):342.1([m+h]+)。b)3-氨基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯向3-硝基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯(440mg)于甲醇(120ml)和thf(40ml)的搅拌悬浮液加入10%钯炭(69mg)。将反应混合物在室温下在氢气气氛下搅拌2小时。将反应混合物通过硅藻土过滤,用甲醇洗涤。然后将滤液真空浓缩,得到为灰色固体的3-氨基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯(351mg,88%)。ms(isp):312.1([m+h]+)。c)2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸甲酯在室温下向3-氨基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯(106mg)和2-(1-甲基-1h-咪唑-5-基)喹啉-4-甲醛40(88.9mg)于n,n-二甲基甲酰胺(4ml)中的搅拌溶液加入焦亚硫酸钠(129mg)。然后将反应混合物在80℃下加热2小时。tlc和lc-ms分析表明反应不完全。加入另一份焦亚硫酸钠(129mg),然后将反应混合物在120℃下加热5小时。tlc和lc-ms分析表明反应完成。然后将反应混合物冷却至室温,并倒入etoac/thf(1:1混合物)中。所得混合物依次用水和饱和盐水洗涤。然后分离有机相,经na2so4干燥,过滤,并真空浓缩,得到黄色无定形固体2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸甲酯(204mg,99%,88%纯度),其无需进一步纯化即可用于下一步。ms(isp):529.2([m+h]+)。d)2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸向2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸甲酯(203mg)于thf(2ml)和meoh(1ml)中的搅拌溶液滴加1mlioh水溶液(1.01ml)。将反应混合物在室温下搅拌过夜。随后的lc-ms显示反应完成。加入水,然后加入几滴1nnaoh水溶液直至ph为碱性。将混合物用etoac萃取两次。然后向水层加入5nhcl水溶液直至达到ph为1。将水层用thf/etoac(3:1)萃取两次。lc-ms分析表明有机层中没有残留的产物。将水层真空浓缩并将残余物冻干,得到为黄色固体的2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸(311mg,100%,56%纯度),其无需进一步纯化即可用于下一步。ms(isp):515.2([m+h]+)。e)n-甲基-2-[2-(2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺向2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸(310mg)、n,n-二异丙基乙胺(236μl)和甲胺(337μl,于thf中的2m溶液)于dmf(2ml)中的悬浮液加入hatu(308mg)。将反应混合物在室温下搅拌过夜。将所得黄色悬浮液通过烧结玻璃过滤。将滤液真空浓缩,并将残余物通过反相hplc纯化,得到为灰白色固体的n-甲基-2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(50mg,28%)。ms(isp):528.8([m+h]+)。实施例32-乙基-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例2,在步骤c中,使用丙醛41代替2-(1-甲基-1h-咪唑-5-基)喹啉-4-甲醛,获得标题化合物。白色固体。ms(isp):349.1([m+h]+)。实施例4n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(喹啉-4-基)-1h-苯并[d]咪唑-5-甲酰胺类似于实施例2,在步骤c中,使用喹啉-4-甲醛42代替2-(1-甲基-1h-咪唑-5-基)喹啉-4-甲醛,获得标题化合物。白色固体。ms(isp):448.3([m+h]+)。实施例53-(1-甲基-1h-咪唑-5-基)-n-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1-萘甲酰胺向6-氨基-3,4-二氢喹啉-2(1h)-酮24(35.4mg)和2-(1-甲基-1h-咪唑-5-基)喹啉-4-羧酸43(50.24mg)的混合物加入0.27mhatu于dmf(811μl)和n,n-二异丙基乙胺(69.3μl)中的溶液。将反应混合物在室温下搅拌2.5小时。lc-ms分析表明反应完成。将反应混合物通过反相hplc直接纯化。将收集的级分真空浓缩,并将残余物重悬于乙酸乙酯和水中。然后分离有机相,经na2so4干燥,过滤,并真空浓缩,得到为灰白色的3-(1-甲基-1h-咪唑-5-基)-n-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1-萘甲酰胺(39mg,50%)。ms(isp):398.6([m+h]+)。实施例62-苄基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺a)n-甲基-3-硝基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酰胺向4-氟-n-甲基-3-硝基苯甲酰胺20(500mg)于n-甲基-2-吡咯烷酮(5ml)中的搅拌溶液加入6-氨基-3,4-二氢喹啉-2(1h)-酮24(450mg)和n,n-二异丙基乙胺(489mg)。将反应混合物在80℃下加热3天。lc-ms分析表明反应不完全。将反应混合物在120℃下加热1天。将反应混合物冷却至室温,并加入乙酸乙酯(10ml)和水(3ml)。形成橙色沉淀。过滤收集沉淀物,用乙酸乙酯洗涤,真空干燥,得到为橙色固体的n-甲基-3-硝基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酰胺(825mg,96%)。ms(isp):341.0([m+h]+)。b)3-氨基-n-甲基-4-[(2-氧代-3,4-二氢-1h-喹啉-6-基)氨基]苯甲酰胺向n-甲基-3-硝基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酰胺(825mg)于甲醇(20ml)和thf(40ml)中的搅拌悬浮液加入10%钯炭(258mg)。将反应混合物在室温下在氢气气氛下搅拌15小时。将反应混合物通过硅藻土过滤,用甲醇洗涤。然后将滤液真空浓缩,得到为灰白色固体的3-氨基-n-甲基-4-[(2-氧代-3,4-二氢-1h-喹啉-6-基)氨基]苯甲酰胺(73mg,10%)。ms(isp):311.0([m+h]+)。c)2-苄基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺在室温下向3-氨基-n-甲基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基]苯甲酰胺(85mg)和2-苯基乙醛44(36.2mg)于n,n-二甲基甲酰胺(1ml)中的搅拌溶液加入焦亚硫酸钠(104mg)。然后将反应混合物在120℃下加热16小时。tlc和lc-ms分析表明反应完成。然后将反应混合物冷却至室温,并用etoac稀释。所得混合物用水洗涤。然后分离有机相,经na2so4干燥,过滤,并真空浓缩。通过快速色谱法(硅胶,10g,于二氯甲烷中的0%至10%甲醇)纯化残余物,得到为浅棕色固体的2-苄基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺(24mg,21%)。ms(isp):411.6([m+h]+)。实施例72-环丙基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤c中使用环丙烷甲醛45代替2-苯基乙醛获得标题化合物。灰色固体。ms(isp):361([m+h]+)。实施例82-((苄氧基)甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤c中使用2-(苄氧基)乙醛46代替2-苯基乙醛获得标题化合物。黄色固体。ms(isp):441.3([m+h]+)。实施例96-(lh-咪唑-l-基)-3,4-二氢-l,8-萘啶-2(lh)-酮向6-溴-3,4-二氢-1,8-萘啶-2(1h)-酮29(100mg)于dmf(2ml)中的溶液中加入1h-咪唑47(33mg)、cui(8.39mg)、六亚甲基四胺(6.17mg)和碳酸钾(123mg)。将反应混合物在130℃下加热22小时。反应混合物用水(40ml)和乙酸乙酯(20ml)稀释。分离两层,水层用乙酸乙酯(2×20ml)反萃取两次。合并的有机层经na2so4干燥,过滤并真空浓缩。残余物通过色谱法纯化(硅胶;12g;洗脱液:庚烷/乙酸乙酯=100/0至0/100,然后至10%meoh),得到为浅黄色固体的6-(lh-咪唑-l-基)-3,4-二氢-l,8-萘啶-2(lh)-酮(21.9mg,23%)。ms(isp):215.4([m+h]+)。实施例102-(2-甲氧基苄基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤c中使用2-(2-甲氧基苯基)乙醛48代替2-苯基乙醛,获得标题化合物。浅黄色固体。ms(isp):441.3([m+h]+)。实施例11n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(1-苯基环丙基)-1h-苯并[d]咪唑-5-羧酰胺类似于实施例6,在步骤c中使用1-苯基环丙烷-甲醛49代替2-苯基乙醛,获得标题化合物。浅黄色固体。ms(isp):437.5([m+h]+)。实施例12n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(1h-吡唑-4-基)-1h-苯并[d]咪唑-5-甲酰胺向甲基3-氨基-n-甲基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酰胺(80mg)于n,n-二甲基甲酰胺(1ml)中的搅拌溶液加入1h-吡唑-4-甲醛50(41.5mg)。在80℃下搅拌2小时后,加入焦亚硫酸钠(98mg),并将反应混合物在120℃下加热48小时。tlc和lc-ms分析表明反应完成。然后将反应混合物冷却至室温,并用etoac稀释。所得混合物用水洗涤。然后分离有机相,经na2so4干燥,过滤,并真空浓缩。将残余物在二氯甲烷中搅拌,过滤,用二氯甲烷洗涤,得到为浅棕色固体的n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-2-(1h-吡唑-4-基)-1h-苯并[d]咪唑-5-甲酰胺(47.8mg,48%)。ms(isp):387.2([m+h]+)。实施例132-(2-甲氧基吡啶-4-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤c中使用2-甲氧基异烟醛51代替2-苯基乙醛,获得标题化合物。浅黄色固体。ms(isp):428.3([m+h]+)。实施例146-(5-苯基-1h-咪唑-1-基)-3,4-二氢喹啉-2(1h)-酮a)3-(5-氟-2-硝基苯基)丙酸乙酯在搅拌下将lihmds(20.5ml,于thf中的1m溶液)加入到包含thf(200ml)的烧瓶中。将溶液冷却至-78℃,并缓慢加入乙酸乙酯(2ml)。搅拌30分钟后,在30分钟内滴加2-(溴甲基)-4-氟-1-硝基苯52(4g)溶于thf(100ml)的溶液。然后将反应混合物温热至室温,并继续搅拌另外2小时。用水淬灭反应,并将混合物用乙酸乙酯萃取3次。合并的有机相依次用水和饱和盐水洗涤,用mgso4干燥,过滤,并真空浓缩。粗物质通过快速色谱法(硅胶,洗脱液:于己烷中的0至10%乙酸乙酯)纯化,得到为黄色油的3-(5-氟-2-硝基苯基)丙酸乙酯(2.20g,53%产率)。ms(isp):242.1([m+h]+)。b)3-(2-硝基-5-(5-苯基-1h-咪唑-1-基)-苯基)丙酸乙酯向5-苯基-1h-咪唑53(100mg)于n,n-二甲基甲酰胺(2ml)中的搅拌溶液中依次加入3-(5-氟-2-硝基苯基)丙酸乙酯(184mg)和碳酸钾(201mg)。将反应混合物在微波合成器装置中在130℃下照射15分钟。lc/ms分析表明反应已完成。将反应混合物在乙酸乙酯和水之间分配。分离有机层,水相用乙酸乙酯萃取两次。合并的有机层经mgso4干燥,过滤,并真空浓缩。粗物质通过快速色谱法(硅胶,洗脱液:于二氯甲烷中的0至10%甲醇)纯化,得到为白色固体的3-(2-硝基-5-(5-苯基-1h-咪唑-1-基)-苯基)丙酸乙酯(98mg,产率39%)。ms(isp):366.2([m+h]+)。c)3-(2-氨基-5-(5-苯基-1h-咪唑-1-基)-苯基)丙酸乙酯向3-(2-硝基-5-(5-苯基-1h-咪唑-1-基)-苯基)丙酸乙酯(98mg)于甲醇(20ml)和thf(40ml)中的搅拌的悬浮液加入10%钯炭(10mg)。将反应混合物在室温下在氢气气氛下搅拌3小时。将反应混合物通过硅藻土过滤,用甲醇洗涤。然后将滤液真空浓缩,得到为灰白色的泡沫的3-(2-氨基-5-(5-苯基-1h-咪唑-1-基)-苯基)丙酸乙酯(90mg,100%)。ms(isp):336.96([m+h]+)。d)6-(5-苯基-1h-咪唑-1-基)-3,4-二氢喹啉-2(1h)-酮将3-(2-氨基-5-(5-苯基-1h-咪唑-1-基)-苯基)丙酸乙酯(90mg)的溶液在乙醇(1ml)中搅拌回流48小时。tlc分析表明反应不完全。冷却至室温后,加入甲醇钠(50mg),然后将混合物加热回流6小时。将反应混合物冷却至室温并真空浓缩。将残余物在ch2cl2/meoh(90:10)和水之间分配。分离有机层,经mgso4干燥,过滤,并真空浓缩。将残余物悬浮在ch2cl2中,并将混合物在室温下搅拌30分钟。通过过滤收集所得固体,得到为白色固体的6-(5-苯基-1h-咪唑-1-基)-3,4-二氢喹啉-2(1h)-酮(30mg,39%)。ms(isp):290.2([m+h]+)。实施例152-(羟甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺向2-(苄氧基甲基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(63mg,实施例8)于甲醇(3ml)中的搅拌悬浮液加入10%钯炭(20mg)。将反应混合物在70℃下和5巴下氢化18小时。将反应混合物冷却至室温,然后通过硅藻土过滤,用甲醇洗涤。然后将滤液真空浓缩,得到为白色结晶固体的2-(羟甲基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺(25.3mg,51%)。ms(isp):351.1([m+h]+)。实施例162-(2-(环丙烷甲酰胺基)乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺a)(2-(5-(甲基氨基甲酰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-2-基)乙基)氨基甲酸苄酯类似于实施例6,在步骤c中使用(3-氧代丙基)氨基甲酸苄酯54代替2-苯基乙醛获得标题化合物。浅黄色固体。ms(isp):498.1([m+h]+)。b)2-(2-氨基乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺向(2-(5-(甲基氨基甲酰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-2-基)乙基)氨基甲酸苄酯(194mg)于甲醇(4ml)中的搅拌悬浮液中加入10%钯炭(20mg)。将反应混合物在70℃和5巴下氢化18小时。将反应混合物通过硅藻土过滤,用甲醇洗涤。然后将滤液真空浓缩,得到为无色油的2-(2-氨基乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺(59mg,42%)。ms(isp):364.3([m+h]+)。c)2-(2-(环丙烷甲酰胺基)乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺向2-(2-氨基乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺(59mg)于二氯甲烷(2ml)中的的搅拌溶液中依次加入环丙烷羰基氯55(16.2μl)和三乙胺(45.3μl)。将反应混合物在室温下搅拌48小时。lc-ms分析表明反应完成。将反应混合物在二氯甲烷和水之间分配。有机层经mgso4干燥,过滤,并真空浓缩。粗物质通过快速色谱法(硅胶,洗脱液:于二氯甲烷中的0至10%甲醇)纯化,得到为白色固体的2-(2-(环丙烷甲酰胺基)乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺(6mg,7%,90%纯度)。ms(isp):432.1([m+h]+)。实施例175-(甲基氨基甲酰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-2-羧酸乙酯向甲基3-氨基-n-甲基-4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酰胺(80mg)于n,n-二甲基甲酰胺(1ml)中的搅拌溶液中加入2-氧代乙酸乙酯56(26.2μl)。在80℃下搅拌2小时后,加入焦亚硫酸钠(98mg),并将反应混合物在120℃下加热16小时。lc-ms分析表明反应不完全。加入另一等分的2-氧代乙酸乙酯56(26.2μl),并将反应混合物在120℃下搅拌4小时。然后将反应混合物冷却至室温,并用etoac稀释。所得混合物用水洗涤。然后分离有机相,经na2so4干燥,过滤,并真空浓缩。粗物质通过快速色谱法(硅胶,洗脱液:于二氯甲烷中的0至5%甲醇)纯化,得到为灰白色固体的5-(甲基氨基甲酰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-2-羧酸乙酯(26mg,26%)。ms(isp):393.1([m+h]+)。实施例182-(2-氨基乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺a)(2-(5-(甲基氨基甲酰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-2-基)乙基)氨基甲酸苄酯类似于实施例2,在步骤c中使用(3-氧代丙基)氨基甲酸苄酯54代替2-(1-甲基-1h-咪唑-5-基)喹啉-4-甲醛,在120℃下搅拌过夜不是5个小时,获得标题化合物。黄色固体。ms(isp):496.1([m+h]+)。b)2-(2-氨基乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺向(2-(5-(甲基氨基甲酰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-2-基)乙基)氨基甲酸苄酯(106.0mg)于甲醇(2ml)中的搅拌溶液中加入10%钯炭(22.7mg)。将反应混合物在室温下在氢气气氛下搅拌16小时。将反应混合物过滤,用甲醇洗涤。然后将滤液真空浓缩。将残余物悬浮在乙酸乙酯中,搅拌2小时。过滤悬浮液,并将固体真空干燥,得到为浅棕色固体的2-(2-氨基乙基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺(40mg,87%)。ms(isp):364.0([m+h]+)。实施例194-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯在氩气下向6-溴-3,4-二氢喹啉-2(1h)-酮57(50mg)和4-氨基苯甲酸甲酯58(43.5mg)于甲苯(1ml)中的溶液中依次加入三(二亚苄基丙酮)二钯(3.04mg)、2-二环己基膦基-2',4',6'-三异丙基联苯(5.27mg)和叔丁醇钠(31.9mg)。将反应混合物在100℃下搅拌1小时。在冷却至室温后,将反应混合物用乙酸乙酯稀释并用水洗涤。有机层经硫酸钠干燥,过滤并真空浓缩。残余物通过色谱法(硅胶,洗脱液:于二氯甲烷中的0至10%甲醇)纯化,得到为浅黄色固体的4-((2-氧代-1,2,3,4-四氢喹啉-6-基)氨基)苯甲酸甲酯(25.8mg,39.4%)。ms(isp):297.2([m+h]+)。实施例20n-甲基-2-(吗啉-4-羰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺在室温下在氩气下向5-(甲基氨基甲酰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-2-羧酸乙酯(22mg)于二噁烷(572μl)中的搅拌溶液中加入2m三乙基铝的甲苯溶液(112μl)。在室温下搅拌10分钟后,加入吗啉(19.5mg),然后将反应混合物在95℃下搅拌1小时。根据lc-ms,反应完成。用水(0.5ml)小心地淬灭反应混合物,然后真空浓缩溶剂。残余物通过色谱法(硅胶,洗脱液:于二氯甲烷中的0至10%甲醇)纯化,得到为浅黄色固体的n-甲基-2-(吗啉-4-羰基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺(19mg,78.2%)。ms(isp):434.2([μ+η]+)。实施例21(rs)-n-(7-氧代-5,6,7,8-四氢-1,8-萘啶-3-基)-1,2,3,4-四氢萘-1-甲酰胺类似于实施例5,使用6-氨基-3,4-二氢-1,8-萘啶-2(1h)-酮59代替6-氨基-3,4-二氢喹啉-2(1h)-酮,使用1,2,3,4-四氢萘-1-甲酸60代替2-(1-甲基-1h-咪唑-5-基)喹啉-4-羧酸,获得标题化合物。白色固体。ms(isp):322.2([m+h]+)。实施例222-(2-甲氧基吡啶-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-羧酸甲酯类似于实施例2步骤a至c,在步骤c中使用2-甲氧基异烟醛51代替2-(1-甲基-1h-咪唑-5-基)喹啉-4-甲醛,获得标题化合物。浅棕色固体。ms(isp):429.2([m+h]+)。实施例232-(6-甲氧基吡啶-2-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤c中使用6-甲氧基吡啶-2-甲醛61代替2-苯基乙醛,获得标题化合物。浅黄色固体。ms(isp):428.4([m+h]+)。实施例242-(6-甲氧基吡啶-3-基)-n-甲基-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤c中使用6-甲氧基烟醛62代替2-苯基乙醛,获得标题化合物。浅黄色固体。ms(isp):428.3([m+h]+)。实施例252-(4-甲氧基吡啶-2-基)-n-甲基-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤c中使用4-甲氧基吡啶-2-甲醛63代替2-苯基乙醛,获得标题化合物。浅黄色固体。ms(isp):428.3([m+h]+)。实施例262-(2-甲氧基吡啶-3-基)-n-甲基-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤c中使用2-甲氧基烟醛64代替2-苯基乙醛,获得标题化合物。浅黄色固体。ms(isp):428.3([m+h]+)。实施例276-(5-(4-甲氧基苯基)-1h-咪唑-1-基)-3,4-二氢喹啉-2(1h)-酮类似于实施例14,在步骤c中,使用5-(4-甲氧基苯基)-1h-咪唑65代替5-苯基-1h-咪唑,获得标题化合物。浅棕色固体。ms(isp):434.2([m+h]+)。实施例282-异丙基-n-甲基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-甲酰胺a)3-硝基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酸甲酯向6-氨基-3,4-二氢-1h-1,8-萘啶-2-酮59(1.1g)于n-甲基-2-吡咯烷酮(15ml)中的溶液中加入4-氟-3-硝基苯甲酸甲酯22(0.68g)和n,n-二异丙基乙胺(1.2ml)。将混合物在120℃下搅拌12小时。将反应混合物冷却至20℃,然后倒入水中。将获得的固体过滤,并将滤饼用乙酸乙酯洗涤,并真空干燥,得到为棕色固体的3-硝基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酸甲酯(320mg,24.5%)。ms(isp):343.1([m+h]+)。b)3-氨基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酸甲酯向3-硝基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酸甲酯(360mg)于甲醇(10ml)中的搅拌溶液中加入10%钯炭(100mg)。将反应混合物在室温在氢气气氛下搅拌12小时。将反应混合物过滤,用n,n-二甲基甲酰胺洗涤。然后将滤液真空浓缩,得到为棕色固体的3-氨基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酸甲酯(280mg,89%)。ms(isp):343.1([m+h]+)。c)2-异丙基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-羧酸甲酯向3-氨基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酸甲酯(130mg)和异丁醛66(28.21mg)的dmf(6ml)溶液中加入焦亚硫酸钠(81.8mg)。将反应混合物在110℃下搅拌1小时。将混合物倒入水中并用乙酸乙酯(3×10ml)萃取。将合并的有机层真空浓缩,得到为黄色油的2-异丙基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-羧酸甲酯(140mg,87.8%)。ms(isp):365.1([m+h]+)。d)2-异丙基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-羧酸将2-异丙基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-羧酸甲酯(120mg)溶解在thf/1m氢氧化锂水溶液(8.0ml)的1:1混合物中。在15℃下搅拌3小时后,将反应混合物用乙酸乙酯萃取3次。通过添加1nhcl水溶液将水层调节至ph2,然后真空浓缩,然后用制备型hplc纯化,得到为黄色固体的2-异丙基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-羧酸(17.8mg,17%)。ms(isp):351.2([m+h]+)。e)2-异丙基-n-甲基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-甲酰胺向2-异丙基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-羧酸(100mg)和hatu(67.72mg)于dmf(5ml)中的混合物中加入n,n-二异丙基乙胺(0.08ml)和甲胺67(0.15ml)。将反应混合物在15℃下搅拌12小时。将混合物倒入水中并用乙酸乙酯(3×10ml)萃取。合并的有机层经浓缩,并通过制备型hplc纯化,得到为黄色固体的2-异丙基-n-甲基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-甲酰胺(16.8mg,31.1%)。ms(isp):364.4([m+h]+)。实施例292-(2-甲氧基-4-吡啶基)-n-甲基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-甲酰胺a)n-甲基-3-硝基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酰胺向6-氨基-3,4-二氢-1h-1,8-萘啶-2-酮59(1.0g)于n-甲基-2-吡咯烷酮(5ml)中的溶液中加入4-氟-n-甲基-3-硝基-苯甲酰胺20(0.78g)和n,n-二异丙基乙胺(1.4ml)。将混合物在120℃下搅拌12小时。然后将反应混合物冷却至20℃并倒入水中。通过过滤收集得到的固体,滤饼用乙酸乙酯洗涤,真空干燥,得到为棕色固体的n-甲基-3-硝基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酰胺(290mg,19.7%)。ms(isp):342.1([m+h]+)。b)3-氨基-n-甲基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酰胺向n-甲基-3-硝基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酰胺(290mg)于甲醇(6ml)中的搅拌溶液中加入10%钯炭(100mg)。将反应混合物在室温下在氢气气氛下搅拌12小时。将反应混合物过滤,用n,n-二甲基甲酰胺洗涤。然后将滤液真空浓缩,得到为棕色固体的3-氨基-n-甲基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酰胺(180mg,63.7%)。ms(isp):312.3([m+h]+)。c)2-(2-甲氧基-4-吡啶基)-n-甲基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-甲酰胺向3-氨基-n-甲基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酰胺(120mg)和2-甲氧基吡啶-4-甲醛51(28.2mg)于dmf(6ml)中的溶液中加入焦亚硫酸钠(109mg)。将反应混合物在110℃下搅拌1小时。然后将混合物倒入水中,并用乙酸乙酯(3×10ml)萃取。将合并的有机层真空浓缩并通过制备型hplc纯化,得到为棕色固体的甲基2-(2-甲氧基-4-吡啶基)-n-甲基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-甲酰胺(63.8mg,38.6%)。ms(isp):429.3([m+h]+)。实施例302-(2-乙酰基苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺向4mhcl于二噁烷中的溶液中加入3-氨基-n-甲基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酰胺(200.0mg)和2-乙酰基苯甲酸68(126.95mg)。将反应混合物在110℃下搅拌12小时,然后真空浓缩,并通过制备型hplc纯化,得到为白色固体的2-(2-乙酰基苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(4.4mg,2.6%)。ms(isp):439.3([m+h]+)。实施例31n-甲基-2-[2-(甲基氨基甲酰基)苯基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺a)2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]苯甲酸类似于实施例6,在步骤c中使用2-甲酰基苯甲酸69代替2-苯基乙醛,获得标题化合物。黄色油。ms(isp):441.1([m+h]+)。b)n-甲基-2-[2-(甲基氨基甲酰基)苯基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例2步骤e,使用2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]苯甲酸代替2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸,获得标题化合物。白色固体。ms(isp):454.3([m+h]+)。实施例322-(3-甲氧基苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用3-甲氧基苯甲醛70代替2-苯基乙醛,获得标题化合物。白色固体。ms(isp):427.3([m+h]+)。实施例332-(5-甲氧基-2-甲基-苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用5-甲氧基-2-甲基-苯甲醛71代替2-苯基乙醛,获得标题化合物。白色固体。ms(isp):441.3([m+h]+)。实施例342-[4-(乙酰氨基甲基)苯基]-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用n-[(4-甲酰基苯基)甲基]乙酰胺72代替2-苯基乙醛,获得标题化合物。白色固体。ms(isp):468.3([m+h]+)。实施例352-(2-氟-5-甲氧基-苯基)-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用2-氟-5-甲氧基苯甲醛73代替2-苯基乙醛,获得标题化合物。白色固体。ms(isp):445.2([m+h]+)。实施例362-[2-(羟甲基)苯基]-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺a)2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]苯甲酸甲酯类似于实施例6,在步骤c中使用2-甲酰基苯甲酸甲酯74代替2-苯基乙醛,获得标题化合物。白色固体。ms(isp):455.1([m+h]+)。b)2-[2-(羟甲基)苯基]-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺在0℃下向2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]苯甲酸甲酯(120mg)于thf(10ml)中的冷却溶液中滴加dibal-h(0.24ml)。将反应混合物在15℃下搅拌24小时,然后加入饱和的酒石酸钾钠水溶液以淬灭反应,然后将混合物在15℃下搅拌1小时。将悬浮液过滤,将滤液浓缩并通过制备型hplc纯化,得到为黄色固体的2-[2-(羟甲基)苯基]-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(8mg,11.8%)。ms(isp):427.3([m+h]+)。实施例372-(2-乙酰胺基苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用n-(2-甲酰基苯基)乙酰胺75代替2-苯基乙醛,获得标题化合物。黄色固体。ms(isp):454.0([m+h]+)。实施例382-(2-氨基苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺向2-(2-乙酰氨基苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(570mg)于甲醇(10mg)中的混合物中加入碳酸铯(148mg)。将反应混合物在80℃下搅拌36小时,然后真空浓缩,并通过制备型hplc纯化,得到为黄色固体的2-(2-氨基苯基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(15.7mg)。ms(isp):412.3([m+h]+)。实施例392-(4-甲氧基-6-甲基-2-吡啶基)-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用4-甲氧基-6-甲基-吡啶-2-甲醛76代替2-苯基乙醛,获得标题化合物。黄色固体。ms(isp):442.3([m+h]+)。实施例402-[5-(甲基氨基甲酰基)-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]吡啶-3-羧酸甲酯类似于实施例6,在步骤c中使用2-甲酰基吡啶-3-羧酸甲酯77代替2-苯基乙醛,获得标题化合物。黄色固体。ms(isp):456.3([m+h]+)。实施例412-[[5-(甲基氨基甲酰基)-l-(2-氧代-3,4-二氢-lh-喹啉-6-基)苯并咪唑-2-基]甲基]苯甲酸甲酯类似于实施例6,在步骤c中使用2-(2-氧代乙基)苯甲酸甲酯78代替2-苯基乙醛,获得标题化合物。黄色固体。ms(isp):469.2([m+h]+)。实施例422-(3-乙酰氨基-2-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用n-(2-甲酰基-3-吡啶基)乙酰胺79代替2-苯基乙醛,获得标题化合物。黄色固体。ms(isp):455.3([m+h]+)。实施例432-(3-氨基-2-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用3-氨基吡啶-2-甲醛80代替2-苯基乙醛,获得标题化合物。黄色固体。ms(isp):413.3([m+h]+)。实施例442-(5-氟-2-甲氧基-4-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用5-氟-2-甲氧基-吡啶-4-甲醛81代替2-苯基乙醛,获得标题化合物。白色固体。ms(isp):446.3([m+h]+)。实施例45n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)-2-[3-(三氟甲基)-4-吡啶基]苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用3-(三氟甲基)吡啶-4-甲醛82代替2-苯基乙醛,获得标题化合物。黄色固体。ms(isp):466.2([m+h]+)。实施例462-[2-(羟甲基)-4-吡啶基]-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺a)(4-溴-2-吡啶基)甲氧基-三异丙基-硅烷向(4-溴-2-吡啶基)甲醇83(1g)和三异丙基甲硅烷基氯(2.05g)于n,n-二甲基甲酰胺(20ml)中的溶液中加入咪唑47(905mg)。将反应混合物在15℃下搅拌12小时,然后通过添加水淬灭。然后加入乙酸乙酯。分离各层,将有机层真空浓缩,并通过柱色谱法(sio2,石油醚/乙酸乙酯=50:1)纯化,得到为无色油的(4-溴-2-吡啶基)甲氧基-三异丙基-硅烷(2.6g,71%)。3/4nmr(400mhz,cdc13):δ=8.31(d,j=5.3hz,ih),7.77(d,j=1.0hz,ih),7.33(dd,j=1.8,5.3hz,ih),4.91(s,2h),1.24-1.16(m,3h),1.06(s,18h)b)2-(三异丙基甲硅烷氧基甲基)吡啶-4-甲醛在-70℃,氮气气氛下,向(4-溴-2-吡啶基)甲氧基-三异丙基-硅烷(2.4g)于干燥thf(30ml)中的溶液中加入n-buli溶液(2.93ml)。在-70℃下搅拌1小时后,向反应混合物中滴加干燥n,n-二甲基甲酰胺(0.76ml),并在10℃下继续搅拌2小时。通过加入饱和氯化铵水溶液淬灭反应,然后分离各层。有机层真空浓缩,并通过柱色谱法(sio2,石油醚/乙酸乙酯=10:1)纯化,得到为黄色油的2-(三异丙基甲硅烷氧基甲基)吡啶-4-甲醛(460mg,32.1%)。c)n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)-2-[2-(三异丙基甲硅烷氧基甲基)-4-吡啶基]苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用2-(三异丙基甲硅烷氧基甲基)吡啶-4-甲醛代替2-苯基乙醛,获得标题化合物。黄色油。ms(isp):584.3([m+h]+)。d)2-[2-(羟甲基)-4-吡啶基]-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺将n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)-2-[2-(三异丙基甲硅烷氧基甲基)-4-吡啶基]苯并咪唑-5-甲酰胺(130.0mg)于吡啶氟化氢(2.0ml)和thf(8ml)中的溶液在15℃下搅拌1小时。通过加入氢氧化铵水溶液将混合物的ph调节至8,然后分离各层。有机层经na2so4干燥,过滤,真空浓缩,并通过制备型hplc纯化,得到为黄色固体的2-[2-(羟甲基)-4-吡啶基]-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(17.2mg,32.9%产率)。ms(isp):428.3([m+h]+)。实施例472-[[2-甲氧基-4-(三氟甲基)苯基]甲基]-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用2-[2-甲氧基-4-(三氟甲基)苯基]乙醛84代替2-苯基乙醛,获得标题化合物。白色固体。ms(isp):509.4([m+h]+)。实施例482-(2-乙酰基-3-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺a)2-[2-(1-乙氧基乙烯基)-3-吡啶基]-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例6,在步骤c中使用2-(1-乙氧基乙烯基)吡啶-3-甲醛85代替2-苯基乙醛,获得标题化合物。黄色油。ms(isp):468.2([m+h]+)。b)2-(2-乙酰基-3-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺将2-[2-(1-乙氧基乙烯基)-3-吡啶基]-n-甲基-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(300mg)于2mhcl/乙腈的1:2混合物(12ml)中的溶液在110℃下搅拌1小时。通过加入饱和nahco3水溶液中和反应混合物,用乙酸乙酯(3×15ml)萃取。合并的有机相经na2so4干燥,过滤,真空浓缩,并通过制备型hplc纯化,得到为黄色固体的2-(2-乙酰基-3-吡啶基)-n-甲基-l-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺(20.4mg,26.3%)。ms(isp):440.3([m+h]+)。实施例49n-甲基-2-[3-(甲基氨基甲酰基)-2-吡啶基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺a)2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]哌啶-3-羧酸甲酯与实施例6类似,在步骤c中,使用2-甲酰基吡啶-3-羧酸甲酯77代替2-苯基乙醛,获得标题化合物。黄色油。ms(isp):456.3([m+h]+)。b)2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]吡啶-3-羧酸类似于实施例2步骤d,在步骤d中使用2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]哌啶-3-羧酸甲酯代替2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸甲酯,获得标题化合物。黄色油。ms(isp):442.1([m+h]+)。c)n-甲基-2-[3-(甲基氨基甲酰基)-2-吡啶基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-甲酰胺类似于实施例2的步骤e,使用2-[5-(甲基氨基甲酰基)-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-2-基]吡啶-3-羧酸代替2-[2-(3-甲基咪唑-4-基)-4-喹啉基]-1-(2-氧代-3,4-二氢-1h-喹啉-6-基)苯并咪唑-5-羧酸,获得标题化合物。白色固体。ms(isp):455.3([m+h]+)。实施例502-异丙基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-羧酸甲酯a)3-硝基-4-[(6-氧代-7,8-二氢-5h-1,5-萘吡啶-2-基)氨基]苯甲酸甲酯向6-氯-3,4-二氢-1h-1,5-萘啶-2-酮26(1.3g)于1,4-二噁烷(40ml)中的溶液中加入4-氨基-3-硝基-苯甲酸甲酯25(1.536g)、碳酸铯(4.639g)、4,5-双(二苯基膦基)-9,9-二甲基氧杂蒽(165mg)和三(二亚苄基丙酮)二钯(0)(130mg)。在氮气气氛下将反应混合物于120℃下搅拌12小时,然后加入水。然后通过过滤收集所得沉淀物,并真空干燥,得到为棕色固体的3-硝基-4-[(6-氧代-7,8-二氢-5h-1,5-萘吡啶-2-基)氨基]苯甲酸甲酯(800mg,31.2%)。ms(isp):343.1([m+h]+)。b)2-异丙基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-羧酸类似于实施例28步骤b-d,在步骤b中使用3-硝基-4-[(6-氧代-7,8-二氢-5h-1,5-萘吡啶-2-基)氨基]苯甲酸甲酯代替3-硝基-4-[(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)氨基]苯甲酸甲酯,获得标题化合物。棕色油。ms(isp):313.1([m+h]+)。c)2-异丙基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-羧酸甲酯类似于实施例28,在步骤e中使用2-异丙基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-羧酸代替2-异丙基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-羧酸,获得标题化合物。白色固体。ms(isp):365.4([m+h]+)。实施例512-异丙基-n-甲基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-甲酰胺a)2-异丙基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-羧酸类似于实施例28步骤d,使用2-异丙基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-羧酸甲酯代替2-异丙基-1-(7-氧代-6,8-二氢-5h-1,8-萘啶-3-基)苯并咪唑-5-羧酸甲酯,获得标题化合物。黄色固体。ms(isp):351.1([m+h]+)。b)2-异丙基-n-甲基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-甲酰胺向2-异丙基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-羧酸(100mg)于dmf(5ml)中的溶液中加入1-丙烷膦酸酐(264mg,0.42mmol)、三乙胺(0.12ml)和甲胺67(17.2mg)。将混合物在20℃下搅拌12小时,然后将反应混合物真空浓缩并通过制备型hplc纯化,得到为白色固体的2-异丙基-n-甲基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-甲酰胺(22mg,21.9%)。ms(isp):364.4([m+h]+)。实施例522-异丙基-n,n-二甲基-1-(6-氧代-7,8-二氢-5h-1,5-萘啶-2-基)苯并咪唑-5-甲酰胺类似于实施例51步骤b,使用二甲基86代替甲胺,获得标题化合物。黄色固体。ms(isp):378.4([m+h]+)。实施例537-(1h-咪唑-1-基)-3,4-二氢喹啉-2(1h)-酮向7-氨基-3,4-二氢喹啉-2(1h)-酮87(200mg)于甲醇(2ml)中的溶液中加入乙酸铵(190mg)、草醛(于水中的40%溶液,283μl)和甲醛(于水中36%,472μl)。将黄色溶液在95℃下搅拌4小时。然后将反应混合物冷却至室温并搅拌过夜。反应混合物用乙酸乙酯和饱和碳酸氢钠水溶液稀释,然后分离各层。有机层经硫酸钠干燥,过滤并真空浓缩。残余物通过色谱法(硅胶,洗脱液:于二氯甲烷中的0至10%甲醇)纯化,得到为浅黄色固体的7-(1h-咪唑-1-基)-3,4-二氢喹啉-2(1h)-酮(118mg,44.9%)。ms(isp):214.2([m+h]+)。实施例546-(吲哚啉-1-羰基)-3,4-二氢-1h-喹啉-2-酮向1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(902mg)和1-羟基苯并三唑(636mg)于n,n-二甲基甲酰胺(3ml)中的搅拌溶液中加入2-氧代-3,4-二氢-1h-喹啉-6-羧酸88(300mg)和吲哚啉33(0.23ml),然后将反应混合物在25℃下搅拌16小时。将反应物稀释于水(10ml)中,并用乙酸乙酯(2×5ml)萃取。将合并的有机相真空浓缩,残余物通过制备型hplc纯化,得到为黄色固体的6-(吲哚啉-1-羰基)-3,4-二氢-1h-喹啉-2-酮(14.4mg,3%)。ms(isp):307.2([m+h]+)。实施例556-(2,3-二氢吡咯并[2,3-b]吡啶-1-羰基)-3,4-二氢-1h-喹啉-2-酮类似于实施例54,使用2,3-二氢-1h-吡咯并[2,3-b]吡啶89代替吲哚啉,获得标题化合物。白色固体。ms(isp):294.1([m+h]+)。实施例566-(3,4-二氢-2h-喹啉-1-羰基)-3,4-二氢-1h-喹啉-2-酮在0℃下向2-氧代-3,4-二氢-1h-喹啉-6-羧酸(300mg)和1,2,3,4-四氢喹啉90(0.3ml)于乙腈(5ml)中的搅拌溶液中依次加入3-甲基吡啶(731mg)和甲磺酰氯(360mg)。将反应混合物加热至25℃,并在25℃下搅拌16小时。用水(5ml)稀释该溶液,并用乙酸乙酯(3×5ml)萃取。将合并的有机相经无水na2so4干燥,过滤,并真空浓缩。粗产物通过制备型hplc纯化,得到为黄色固体的6-(3,4-二氢-2h-喹啉-1-羰基)-3,4-二氢-1h-喹啉-2-酮。ms(isp):293.1([m+h]+)。实施例57n-(1-乙酰基-4-哌啶基)-2-氧代-3,4-二氢-1h-喹啉-6-甲酰胺类似于实施例54,使用1-乙酰基-4-氨基-哌啶91代替吲哚啉,获得标题化合物。白色固体。ms(isp):316.2([m+h]+)。实施例586-(吲哚啉-1-羰基)-3,4-二氢-1h-1,8-萘啶-2-酮a)7-氧代-6,8-二氢-5h-1,8-萘啶-3-羧酸将7-氧代-6,8-二氢-5h-1,8-萘啶-3-羧酸甲酯92(800mg)和氢氧化锂(185mg)溶解在thf/水的1:1混合物(16.0ml)中。在15℃下搅拌3小时后,将反应混合物用乙酸乙酯萃取两次。通过添加1nhcl水溶液将水层的ph调节至2,然后用乙酸乙酯萃取。分离有机层,经na2so4干燥,并真空浓缩,得到为黄色油的7-氧代-6,8-二氢-5h-1,8-萘啶-3-羧酸(200mg,24.8%)。ms(isp):193.1([m+h]+)。b)6-(吲哚啉-1-羰基)-3,4-二氢-1h-1,8-萘啶-2-酮类似于实施例54,使用7-氧代-6,8-二氢-5h-1,8-萘啶-3-羧酸代替加入的2-氧代-3,4-二氢-1h-喹啉-6-羧酸,获得标题化合物。黄色固体。ms(isp):294.2([m+h]+)。实施例596-(2,3-二氢吡咯并[2,3-b]吡啶-1-羰基)-3,4-二氢-1h-1,8-萘啶-2-酮类似于实施例54,使用2,3-二氢-1h-吡咯并[2,3-b]吡啶89代替吲哚啉,使用7-氧代-6,8-二氢-5h-1,8-萘啶-3-羧酸代替2-氧代-3,4-二氢-1h-喹啉-6-羧酸,获得标题化合物。白色固体。ms(isp):295.2([m+h]+)。实施例606-(3,4-二氢-2h-喹啉-1-羰基)-3,4-二氢-1h-1,8-萘啶-2-酮类似于实施例56,使用7-氧代-6,8-二氢-5h-1,8-萘啶-3-羧酸代替2-氧代-3,4-二氢-1h-喹啉-6-羧酸,得到标题化合物。黄色固体。ms(isp):308.2([m+h]+)。实施例616-(2-异丙基-1h-苯并[d]咪唑-1-基)-3,4-二氢喹唑啉-2(1h)-酮类似于实施例6,在步骤a中使用1-氟-2-硝基苯19代替4-氟-n-甲基-3-硝基苯甲酰胺和使用6-氨基-3,4-二氢喹唑啉-2(lh)-酮93代替6-氨基-3,4-二氢喹啉-2(1h)-酮,在步骤c使用异丁醛66代替2-苯基乙醛,获得标题化合物。白色固体。ms(isp):307.2([m+h]+)。实施例622-异丙基-n-甲基-1-(2-氧代-1,2,3,4-四氢喹唑啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺类似于实施例6,在步骤a中使用6-氨基-3,4-二氢喹唑啉-2(1h)-酮93代替6-氨基-3,4-二氢喹啉-2(1h)-酮,在步骤c中使用异丁醛66代替2-苯基乙醛,获得标题化合物。浅黄色固体。ms(isp):364.2([m+h]+)。实施例an-(10-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)癸基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺a)(10-(2-(2-(1-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺基)癸基)氨基甲酸叔丁基酯向2-(2-(1-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基(-1h-苯并[d]咪唑-5-羧酸(70mg)依次加入hatu(556μl,于dmf中的0.27m溶液)、(5-氨基戊基)氨基甲酸叔丁基酯94(35.8mg)和n,n-二异丙基乙基胺(95μl)。将该棕色溶液在室温下搅拌19小时。反应混合物通过反相hplc纯化。收集级分并冻干,得到为白色泡沫的(10-(2-(2-(1-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺基)癸基)氨基甲酸叔丁基酯(27mg,28%)。ms(isp):769.9([m+h]+)。b)n-(10-氨基癸基)-2-(2-(1-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺盐酸盐向(10-(2-(2-(1-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺基)癸基)氨基甲酸叔丁基酯(40mg,52μmol,当量:1)于etoac(500μl)中的搅拌溶液中加入4mhcl于二噁烷中的溶液(780μl)。将反应混合物在室温下搅拌3小时。lc/ms分析表明反应已完成。蒸发溶剂,得到为浅黄色泡沫的n-(10-氨基癸基)-2-(2-(1-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺盐酸盐(34.8mg,95%),其无需进一步纯化即可用于下一步。ms(isp):670([m+h]+)。c)n-(10-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)癸基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺向n-(10-氨基癸基-2-(2-(1-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺盐酸盐(34.8mg)和(s)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酸(23.7mg)的混合物中加入hatu(202μl,于dmf中的0.27m溶液)和n,n-二异丙基乙胺(34.5μl)。将反应混合物在室温下摇动2小时。lc/ms分析表明反应已完成。反应混合物通过反相hplc纯化。收集级分并冻干。将得到的泡沫在乙醚中搅拌,通过过滤收集随后的晶体,并真空干燥,得到为白色固体的n-(10-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)癸基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺(17mg,31%)。ms(isp):1051.4([m+h]+)。实施例bn-(5-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)戊基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢吲哚-6-基)-lh-苯并[d]咪唑-5-甲酰胺a)(5-(2-(2-(l-甲基-lh-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺基)戊基)氨基甲酸叔丁基酯类似于实施例a,在步骤a中使用(10-氨基癸基)氨基甲酸叔丁基酯95代替(5-氨基戊基)氨基甲酸叔丁基酯,获得标题化合物。灰白色泡沫。ms(isp):699.5([m+h]+)。b)n-(5-氨基戊基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺盐酸盐类似于实施例a,在步骤b中使用(5-(2-(2-(l-甲基-lh-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺基)戊基)氨基甲酸叔丁基酯代替(10-(2-(2-(1-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺基)癸基)氨基甲酸叔丁基酯,获得标题化合物,灰白色泡沫。ms(isp):599.4([m+h]+)。c)n-(5-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)戊基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺向n-(5-氨基戊基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺盐酸盐(34mg)和2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酸(27.3mg)的混合物中加入hatu(202μl,于dmf中的0.27m溶液)和n,n-二异丙基乙胺(34.5μl)。将反应混合物在室温下摇动2小时。lc/ms分析表明反应已完成。然后将反应混合物转移到分液漏斗中。加入乙酸乙酯/tbme(1:1)和水,得到粘性固体。除去水层和有机层后,通过溶于ch2cl2回收粘性固体。有机相经mgso4干燥,过滤并真空浓缩。粗物质通过快速色谱法(硅胶,10g,洗脱液:于二氯甲烷中的0至10%甲醇)纯化,得到为灰白色固体的n-(5-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)戊基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺(27mg,51%)。ms(isp):981.4([m+h]+)。实施例cn-(2-(2-(2-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)乙氧基)乙氧基)乙基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺a)(2s,4r)-l-((s)-2-乙酰胺基-3,3-二甲基丁酰基-4-羟基-n-((s)-2-羟基-2-苯基乙基)吡咯烷-2-甲酰胺类似于实施例a,在步骤a中使用(2-(2-(2-氨基乙氧基)乙氧基)乙基)氨基甲酸叔丁基酯96代替(5-氨基戊基)氨基甲酸叔丁基酯,获得标题化合物。白色泡沫。ms(isp):745.45([m+h]+)。b)n-(2-(2-(2-氨基乙氧基)乙氧基)乙基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺盐酸盐类似于实施例a,在步骤b中使用(2-(2-(2-(2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-1-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺基)乙氧基)乙氧基)乙基)氨基甲酸叔丁基酯代替(10-(2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-1,2,3,4-四氢喹啉-6-基)-1h-苯并[d]咪唑-5-甲酰胺基)癸基)氨基甲酸叔丁基酯,获得标题化合物。灰白色泡沫。ms(isp):645.48([m+h]+)。c)n-(2-(2-(2-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)乙氧基)乙氧基)乙基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺向n-(2-(2-(2-氨基乙氧基)乙氧基)乙基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺盐酸盐(44mg)和2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酸(32mg)的混合物中加入hatu(264μl,于dmf中的0.27m溶液)和n,n-二异丙基乙胺(44.1μl)。将反应混合物在室温下摇动2小时。lc/ms分析表明反应已完成。将反应混合物在二氯甲烷和水之间分配。分离有机相,经mgso4干燥,过滤,并真空浓缩。粗物质通过快速色谱法(硅胶,10g,洗脱液:于二氯甲烷中的0至10%甲醇)纯化,得到为灰白色固体的n-(2-(2-(2-(2-((6s)-4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][l,2,4]三唑并[4,3-a][l,4]二氮杂-6-基)乙酰胺基)乙氧基)乙氧基)乙基)-2-(2-(l-甲基-1h-咪唑-5-基)喹啉-4-基)-l-(2-氧代-l,2,3,4-四氢喹啉-6-基)-lh-苯并[d]咪唑-5-甲酰胺(11.7mg,18%)。ms(isp):1027.4([m+h]+)。1collinsetal.biochem.j.2017,474(1),1127-472us2003000088323w020160331004w020091316875w020131497046us72355627ep1450108ep2758889w0200902610710wo201302055711wo201306356012wo201310664313wo201516084514wo201601190615wo201610551816wo201700761217wo201702431818wo201711747319cas1493-27-220cas475216-25-221cas658700-20-022cas329-59-923cas185629-31-624cas22246-13-525cas3987-92-626cas1256795-00-227cas3279-90-128cas296759-29-029cas129686-16-430cas2369-11-131cas1493774-33-632j.am.chem.soc.1996,118,7217-721833cas496-15-134filippakopoulos,p.etal.nature2010,468,1067-107335cas202592-23-236yen,h.-c.s.,xu,q.,chou,d.m.,zhao,z.&elledge,s.j.globalproteinstabilityprofilinginmammaliancells.science2008,322,918-923,doi:10.1126/science.116048937birdsall,b.,king,r.w.,wheeler,m.r.,lewis,c.a.jr,goode,s.r.,dunlap,r.b.&roberts,g.c.anal.biochem.1983,132,353-36138eftink,methodsenzymol.1997,278,221-5739cas119924-94-640cas432517-57-241cas123-38-642cas4363-93-343cas432516-70-644cas122-78-145cas7051-34-546cas60656-87-347cas288-32-448cas33567-59-849cas21744-88-750cas35344-95-751cas72716-87-152cas82420-35-753cas670-95-154cas65564-05-855cas4023-34-156cas924-44-757cas3279-90-158cas619-45-459cas1378866-33-160cas1914-65-461cas269058-49-362cas65873-72-563cas16744-81-364cas71255-09-965cas35512-31-366cas78-84-267cas74-89-568cas577-56-069cas119-67-570cas591-31-171cas56724-09-572cas156866-50-173cas105728-90-374cas4122-56-975cas13493-47-576cas75358-79-177cas25230-59-578cas62723-81-379cas1207715-24-980cas55234-58-781cas884495-12-982cas1060801-92-483cas131747-45-084cas1823320-58-685cas2138266-81-486cas124-40-387cas22246-07-788cas88371-24-889cas1221503-20-390cas635-46-191cas160357-94-892cas1822623-53-993cas1260835-29-794cas51644-96-395cas216961-61-496cas153086-78-3当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种具有隔音功能的材料的制作方法
- 作为醛固酮合酶(cyp11b2或cyp11b1)抑制剂的新二氢喹啉-2-酮衍生物的制作方法
- 一种阿立哌唑的合成方法
- 一种乙氧基喹啉的生产方法
- 用作醛固酮合酶抑制剂的二氢喹啉-2-酮衍生物的制作方法
- 一种橡胶防老剂rd及其制备方法
- 7-{(3s,4s)-3-[(环丙基氨基)甲基]-4-氟吡咯烷-1-基}-6-氟-1-(2-氟乙基)-8-甲氧基 ...的制作方法
- 喹啉酮类化合物在抑制藻类生长中的应用以及用于抑制藻类生长的杀藻剂的制作方法
- 具有取代苯基硫属原子代低级烷基和导入酯结构的苯基作为取代基的新型1,2-二氢喹啉 ...的制作方法
- 一种噁嗪并喹啉酮c-3均三唑硫醚酮缩氨基硫脲衍生物及其制备方法和应用