mRNA及其制备方法和应用与流程
本发明属于mrna分子技术领域,具体涉及一种mrna及其制备方法和应用。
背景技术:
随着核酸技术的发展,基因治疗越来越成为医药行业的热点。作为一种重要的基因疗法,mrna药物越来越受到市场的青睐。mrna分子被递送到细胞内可产生各种蛋白,包括可溶性蛋白、膜蛋白和细胞内蛋白,尤其是可以产生传统制药方法五和获得的蛋白。与dna基因治疗相比,mrna是一种瞬时表达的工具,具有更好的生物安全性和成药性。随着分子生物学、基因工程、生物化学的发展和完善,人们可以在体外合成大量的mrna药物分子,这为基于mrna的基因疗法带来了巨大的机遇。
目前常见的mrna的合成方法为体外逆转录法,具体合成路线详见图1所示,即用t7、t3或sp6rna聚合酶转录带有其启动子的双链dna模板获得长单链mrna分子,通过优化转录反应体系中的mg2+、三磷酸核苷酸(rntp)的浓度,一个拷贝dna模板能产生几十到数百个拷贝的mrna分子,因此,该方法最大的有限是可以规模化合成大量的mrna产物,同时可以对mrna产物进行同位素标记或者荧光染料标记,并且转录长度不受限制等。但是同时这套合成方法也存在技术限制和缺点,其一就是价格昂贵,合成mrna长度超过100nt时,其合成效率会大幅度降低,其二是现有合成技术水平合成的mrna药物分子均一性不高,特别是在mrna产物3’端进行polya加尾反应时,由于不可控造成副产物序列增多,增加了纯化的难度,并会进一步导致高成本。此外,随着科研和市场的发展,以往的合成方法已经逐渐不能满足科研试验和药物研发对mrna的需求,越来越多的mrna生物研究和药物研发中需要用到毫克级甚至克级的mrna,与此同时对rna产品的质量、纯度也提出了更高的要求。
技术实现要素:
针对现有mrna药物分子合成方法合成效率低、副产物序列多、合成的分子均一性差、难以纯化等问题,本发明提供一种mrna的制备方法。
进一步地,本发明还提供上述mrna的制备方法获得的mrna及其用途。
为达到上述发明目的,本发明采用了如下的技术方案:
一种mrna的制备方法,包括以下步骤:
步骤s01.提供dna转录模板;
所述dna转录模板由正义链和反义链组成,其中,所述正义链包含启动子以及连接在所述启动子序列上的目标dna序列,所述启动子序列不含有终止密码子,所述目标dna序列与目标mrna序列相同,所述目标dna序列末端连接有聚多腺苷酸序列;
步骤s02.在rna聚合酶的作用下,对所述dna转录模板进行体外转录,在所述启动子序列的引导下,转录出mrna。
相应地,一种mrna,所述mrna采用如上所述的制备方法制备得到。
以及,一种生物药物,所述生物药物中含有mrna,所述mrna为如上所述的mrna。
本发明的有益效果在于:
相对于现有技术,本发明提供的mrna的制备方法,创造性地构建了mrna转录模板,先将腺嘌呤直接连在dna转录模板正义链的末端,提高转录稳定性,解决了现有mrna合成后再于3’端进行poly-a序列加尾反应时副产物序列增多而出现分子均一性差的问题,并且该制备方法还具有制备效率高、产物便于纯化等优势,可以极大的提高生产效率,降低生产成本。此外,采用本制备方法,可以合成具有高纯度的任意基因的mrna。
本发明提供的mrna,由于其是采用上述方法制备得到,因而其具有分子均一性好等特点,因此其质量、纯度相对于常规的mrna而言更高,能够极大的满足mrna生物研究和药物研发中对mrna毫克级甚至克级别的需求。
通过本发明的制备方法获得的mrna,分子均一性好,稳定性强,纯度高,具有良好的成药性和疗效。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为现有mrna的合成方法的合成线路示意图;
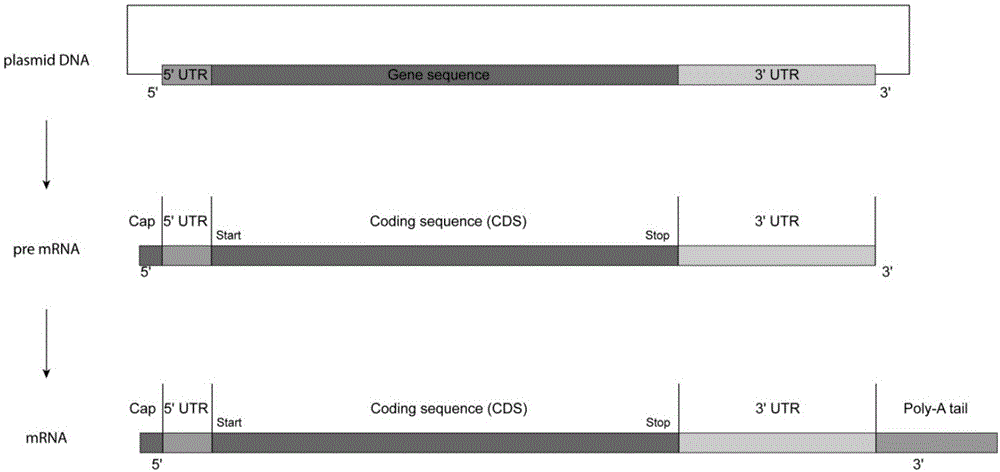
图2为本发明提供的mrna的制备方法的制备线路示意图;
图3为本发明实施例1和对比例1制备的mrna的分子均一性检测图谱;
图4为本发明对比例1制备的mrna(绿色荧光蛋白gfpmrna)转染293t细胞12h后的镜检图;
图5为本发明实施例1制备的mrna(绿色荧光蛋白gfpmrna)转染293t细胞12h后的镜检图;
图6为本发明实施例1和对比例1制备的mrna在皮肤组织修复的药物活性对比图;
其中,图示中plasmiddna表示质粒dna;5’utr表示5’端非转录区域;3’utr表示3’端非转录区域;genesequence表示基因序列;codingsequence(cds)表示编码序列;cap表示mrna帽子状结构;start表示启动子;stop表示终止密码子;poly-atail表示多聚腺苷酸尾;poly-asequence表示多聚腺苷酸序列。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明提供一种mrna的制备方法。
该mrna的制备方法包括以下步骤:
步骤s01.提供dna转录模板;
所述dna转录模板由正义链和反义链组成,其中,所述正义链包含启动子序列以及连接在所述启动子序列上的目标dna序列,所述启动子序列不含有终止密码子,所述目标dna序列与目标mrna序列相同,所述目标dna序列末端连接有聚多腺苷酸序列;
步骤s02.在rna聚合酶的作用下,对所述dna转录模板进行体外转录,在所述启动子序列的引导下,转录出mrna。
下面对本发明的技术方案做详细的解释说明:
步骤s01中,dna转录模板中,正义链上的启动子序列选自t3启动子序列、t7启动子序列、sp6启动子序列中的任一种。在体外转录中,这几类启动子的转录效率最高。
上述目标dna序列末端连接的聚多腺苷酸序列(poly-asequence)长度为100bp~300bp。如果长度过长,会影响mrna分子的翻译效果,长度过短,则会影响mrna分子的稳定性。
优选地,上述dna转录模板可以采用如下方式两种方式之一进行制备:
(1)合成所述dna转录模板的两条引物,pcr扩增得到dna转录模板。
(2)采用限制性内切酶线性化质粒dna模板获得所述dna转录模板。
上述方式(1)涉及的两条引物为:
forwardprimer:5’-taatacgactcactatagg-3’;
reserveprimer:5’-cttcctactcaggctttattcaaagacca-3’。
pcr扩增的条件为:
按下列组份配制pcr反应液
pfu(5u/μl)0.5μl;
10×pfupcrbuffer(mg2+plus)5μl;
dntpmixture(10mmeach)1μl;
模板dna(质粒5-20ng,基因组100-500ng)xμl;
引物1(forwardprimer):(20μm)1μl;
引物2(reserveprimer):(20μm)1μl;
灭菌蒸馏水upto50μl。
上述方式(2)中,限制性内切酶没有特别的要求,只要在poly-a序列下游的限制性内切酶均可以使用。所述质粒dna模板改造至pcdna3.1,在此基础上加入5’utr、3’utr以及poly-a序列。
对上述方式(1)和(2)获得的dna转录模板,还包括对其进行进一步的纯化处理。具体的纯化处理方法包括采用异丙醇对获得的dna转录模板进行沉淀处理,随后采用无内病毒素水溶解,由此得到纯化的dna转录模板,通过使用无内毒素水进行溶解,确保后期产物中不含有内毒素,从而达到成药的要求。
步骤s02中,rna聚合酶可以选自原核生物聚合酶,也可以选自真核生物聚合酶。
在进行体外转录时,以三磷酸核苷混合物(rntp)及其化学修饰物为原料。三磷酸核苷混合物中含有三磷酸腺苷(atp)、三磷酸鸟苷(gtp)、三磷酸胞苷(ctp)、三磷酸尿苷(utp)。
化学修饰物包括n6-甲基腺苷、肌苷、5甲基胞嘧啶核苷、假尿嘧啶核苷、5羟甲基胞嘧啶、n1甲基腺苷、mrna帽子状结构。
上述进行体外转录时,在37℃下反应4~6h。
由上述方法可以制备得到纯度高的任意基因的mrna。
本发明提供的mrna的制备方法,先将腺嘌呤直接连在dna转录模板正义链的末端,创造性的构建了mrna转录模板,解决了现有mrna合成后在3’端进行poly-a序列加尾(获得多聚腺苷酸尾)反应时副产物序列增多而出现分子均一性差的问题,并且该制备方法还具有制备效率高、产物便于纯化等优势,可以极大的提高生产效率,降低生产成本。
基于上述制备方法获得的mrna,本发明还提供一种生物材料,如生物药物,所述生物药物中含有mrna,所述mrna采用如上所述的mrna的制备方法制备得到,这些生物材料可以作为生物药物,用在细胞、组织、器官等的医疗中。
为了验证本发明mrna的制备方法,下面通过多个实验进行验证。
实施例1
实施例1提供一种绿色荧光蛋白质mrna(即gfpmrna)的制备方法,该制备方法包括以下步骤:
s11.在rnase-free的pcr管中,按次序加入下列成分:
注:所述dna模板为线性化的gfp质粒,其是在pcdna3.1质粒的基础上改造,并采用内切酶pmel酶切线性化得到;此为20μl反应体系的用量,其他反应体系,各成分的用量可按比例增减。
s12.37℃反应4-6h。
s13.75℃加热10min灭活rna聚合酶。
s14.取2μl产物电泳检测转录效果。
s15.在体外转录体系中加入1μlrnase-free的dnase去除模板dna(5u/μl)。
s16.37℃反应30min。
s17.用rnase-free水补水到100μl。
s18.用100μltris饱和酚-氯仿抽提一次去除残留的dnase和rna聚合酶。
s19.加入75%乙醇,充分震荡后12000rpm离心10min,弃上清。
s110.所得沉淀晾干后溶于rnase-free水中于-80℃长期保存。
对比例1
对比例1提供一种绿色荧光蛋白质mrna(即gfpmrna)的制备方法,该常规制备方法包括以下步骤:
d11.在rnase-free的pcr管中,按次序加入下列成分:
注:所述dna模板为线性化的gfp质粒,其是在pcdna3.1质粒的基础上改造,并采用内切酶pmel酶切线性化得到;
此为20μl反应体系的用量,其他反应体系,各成分的用量可按比例增减。
d12.37℃反应4-6h。
d13.75℃加热10min灭活rna聚合酶,取2μl产物电泳检测转录效果。
d14.加入4μlpolya聚合酶,20μl酶反应液,10μlmncl2和10μlatp,37℃反应1h。
d15.在体外转录体系中加入1μlrnase-free的dnase去除模板dna(5u/μl)。
d16.37℃反应30min。
d17.用rnase-free水补水到100μl。
d18.用100μltris饱和酚-氯仿抽提一次去除残留的dnase和rna聚合酶。
d19.加入75%乙醇,充分震荡后12000rpm离心10min,弃上清。
d110.所得沉淀晾干后溶于rnase-free水中于-80℃长期保存。
对实施例1和对比例1制备的mrna进行性能表征,具体包括产物分子均一性、翻译效率及药物活性。
(一).产物分子均一性表征
通过毛细管电泳对实施例1和对比例1得到的产物进行产物分子均一性的测定。具体结果如图3所示。
从图3可知,对比例1得到的产物分子分布较广,除了有目的mrna产物,还有大量的反应副产物,而实施例1中,仅目的mrna分子条带,无反应副产物产生,由此可知,本发明实施例1获得的mrna分子均一性高。
(二).翻译效率表征
对实施例1和对比例1得到的mrna进行翻译效率表征,具体是将得到的mrna分别对293t细胞进行转染,转染12h时进行镜检,具体结果如图4、5所示。
从图4可知,对比例1中传统合成方法合成的绿色荧光蛋白mrna转染293t细胞12h蛋白翻译结果;从图5可知,实施例1本发明合成方法合成的绿色荧光蛋白mrna转染293t细胞12h蛋白翻译结果。由此可见本发明的mrna的制备方法获得的绿色荧光蛋白mrna翻译效率更高。
(三).药物活性表征
分别对实施例1和对比例1获得的mrna对皮肤组织进行修复处理。具体为7-8周龄小鼠,用5mm直径生物取样器在皮肤上打孔,形成5mm直径的全皮层移除创口。实施例1,用本发明合成方法合成的mrna与转染试剂、纤维蛋白预混成胶状生物材料,涂于创口处以促进创口愈合。对比例1,用传统合成方法合成的mrna与转染试剂、纤维蛋白预混成胶状生物材料,涂于创口处以促进创口愈合,具体结果如图6所示。
从图6可知,将mrna分别加入到受伤的皮肤组织后,两者的皮肤组织没有差异,第3天观察实施例1与对比例2的皮肤创口均开始愈合,第14天观察实施例1皮肤创口已完全愈合而对比例1皮肤创口还未完全愈合。由此可见,本发明的制备方法制备的mrna在皮肤组织的修复过程中,药效更持久,并且疗效更好。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
-
 0访客 来自[中国] 2022年04月19日 09:31上海吉荧生物RNA合成专家
0访客 来自[中国] 2022年04月19日 09:31上海吉荧生物RNA合成专家