一种诱导脐带间充质干细胞向肾小管上皮细胞分化的方法与流程
本发明涉及生物技术领域,具体涉及一种诱导脐带间充质干细胞向肾小管上皮细胞分化的方法。
背景技术:
药物性肾损伤表现为急性肾小管损伤,甚至出现肾小管坏死,导致肾功能衰竭。治疗肾衰竭的方法通常采用透析和肾移植,由于肾源的不足和免疫排斥反应,治疗效果不佳。随着干细胞的深入研究,干细胞成为细胞治疗的首选供体来源。目前诱导干细胞定向分化的研究已取得了有意义的进展,如cn109022361a公开了通过分离筛选脐血cd34+cd126-细胞,并与脐带间充质干细胞共培养的方式诱导分化巨核祖细胞;cn108865986a公开了将间充质干细胞与滑膜细胞进行间接共培养,收获共培养后的间充质干细胞冻存,滑膜细胞与脐带间充质干细胞按照4:1的密度比例接种进行共培养后所获得的脐带间充质干细胞在相同的诱导条件下更易向软骨方向分化;cn107630003a公开了将脐带间充质干细胞用包括白皮杉醇和基本培养基的诱导培养基培养,定向分化得到神经样细胞。但脐带来源干细胞在体外向肾脏方向分化的诱导方法和机制的研究,鲜少报道。
文献(损伤性肾匀浆体外诱导大鼠骨髓间充质干细胞转分化效果及可能机制的研究.重庆医学.2016年03期)利用损伤性肾匀浆体外模拟急性肾损伤的微环境,探讨了骨髓间充质干细胞(bmsc)诱导转分化及其可能机制。方法:将体外培养的bmsc用10%大鼠缺血再灌注损伤肾匀浆上清液进行培养。7d后检测形态学改变、18型角蛋白(ck-18)、肝细胞生长因子(hgf)、骨形态发生蛋白-7(bmp-7)的相应表达水平。结果:损伤肾匀浆诱导7d后,骨髓间充质干细胞形态发生明显变化,并检测到ck-18阳性表达;同时被诱导的hgf和bmp-7表达水平明显升高。结论:损伤肾匀浆可诱导bmsc部分向肾小管上皮样细胞转分化,其可能机制是bmsc可能以旁分泌的形式产生了hgf和bmp-7等“肾脏保护因子”。文献(体外诱导骨髓间充质干细胞向肾小管上皮细胞的分化.中国组织工程研究与临床康复.2007年03期)公开了在缺血再灌注损伤大鼠肾脏匀浆及全反式维甲酸的联合诱导下,骨髓间充质干细胞可向肾小管上皮样细胞分化。文献(differentiationofmurineembryonicstemcellstowardrenallineagesbyconditionedmediumfromuretericbudcellsinvitro.生物化学与生物物理学报:英文版.2010年第7期)公开了es在无白血病抑制因子(lif)条件下培养形成拟胚体(eb),用不同浓度的ra(10-6m,10-7m,10-8m)和activin(1ng/ml,5ng/ml,10ng/ml)处理es6d,rt-pcr、brachyury和pax2免疫荧光染色、流式细胞检测、westernbloting对分化的细胞进行鉴定。分离培养小鼠13d胚胎肾脏ub细胞,分离的单细胞被荧光素标记的双花凝集素(fitc-dba)孵育后,流式分选输尿管芽阳性细胞,收集离体培养ub细胞的培养上清,经处理作为条件培养液,诱导已分化为中胚层的细胞,使其向着肾系方向分化。结果表明:10-7mra和10ng/mlactivin为es细胞分化中胚层的最佳诱导条件,中胚层分化率在72%。体外分离胚胎肾脏输尿管芽细胞,纯度达到69%。收集离体培养ub细胞的培养上清,作为条件培养液,诱导中胚层细胞向肾小管上皮细胞分化。免疫细胞化学结果表明在分化的细胞中,检测到了肾脏发育早期相关基因pax2、wt1和晚期相关基因pod、e-cadherin的表达,dba染色结果表明分化的细胞具有肾小管细胞的特征。但还未见高效的诱导脐带来源的间充质干细胞向肾小管上皮细胞分化的方法。
技术实现要素:
本发明的目的是针对现有技术中尚无高效地诱导脐带间充质干细胞向肾小管上皮细胞分化的方法,提供一种利用新型诱导培养基,高效诱导脐带间充质干细胞向肾小管上皮细胞分化的方法。采取的技术方案如下:
一种诱导脐带间充质干细胞向肾小管上皮细胞分化的方法,包括以下步骤:将脐带间充质干细胞使用诱导培养基培养,所述诱导培养基为lg-dmem培养基,并含有终体积分数(8-12)%fbs、终浓度10-8-10-6mra、终浓度9-11ng/ml黄芪甲苷、终浓度90-110u/ml青霉素、终浓度90-110u/ml链霉素、终体积分数(8-12)%ub细胞条件培养基。
较优选地,所述诱导培养基中,各成分的终浓度为:fbs终体积分数为10%,ra终浓度为10-7,黄芪甲苷终浓度为10ng/ml,青霉素终浓度为100u/ml,链霉素终浓度为100u/ml,ub细胞条件培养基终体积分数为10%。
较优选地,所述ub细胞条件培养基的制备方法为:将分离的原代ub细胞培养于dmem-fcs,(70-90)%汇合后,用dmem洗涤细胞,然后用不含fcs的dmem替换培养基,培养1-3天,离心,收集培养液,用过滤器过滤,即得所述ub细胞条件培养基。
较优选地,汇合度为80%时用dmem洗涤细胞并替换培养基;培养2天时收集培养液。
较优选地,所述过滤器为0.22毫米过滤器。
较优选地,培养条件为:置于37℃、体积分数5%co2、95%湿度的培养箱中培养。
本发明可实现以下有益效果:
1、实现体外诱导脐带来源间充质干细胞向肾小管上皮细胞方向分化,为肾脏疾病的细胞治疗提供细胞供体。
2、诱导培养基使用lg-dmem培养基,并加入了全反式维甲酸、表皮细胞生长因子、黄芪甲苷和ub细胞条件培养基进行诱导,相比于其他诱导培养基显著提高了诱导率。
附图说明
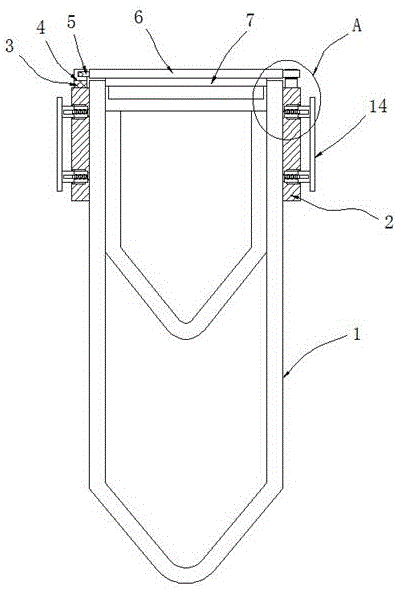
图1为本申请提出的离心管的主视结构示意图;
图2为本申请提出的离心管的第一固定座的俯视结构示意图;
图3为本申请提出的离心管的a部分结构示意图。
图中:1离心管本体、2固定臂、3第一固定座、4第一凹槽、5转动杆、6盖板、7密封盖、8固定杆、9第一磁片、10第二固定座、11第二磁片、12固定槽、13移动座、14固定板、15压簧槽、16滑杆、17压簧、18滑槽、19滑块、20转动槽、21转动块、22环形槽、23移动块、24第二凹槽。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,对本发明进行的各种修改和替换均视为本发明的技术范畴。
实施例1
1材料
定时妊娠小鼠来自上海斯莱克实验动物有限公司。
人脐带标本来自医院,产妇及家属对实验均知情同意,并经医院伦理委员会批准。
lg-dmem基础培养基购于hyclone公司,胎牛血清(fbs)、egf、ⅱ型胶原酶、透明质酸酶、dna酶购于gibco公司,全反式维甲酸(atra)、activin、青霉素、链霉素、黄芪甲苷购于sigma公司。
2方法
2.1胚胎肾组织的分离、表征和条件培养基的制备
根据阴栓的出现来确定小鼠妊娠日。在妊娠第13天,解剖孕鼠,分离出胚胎的后肾,用加入终浓度0.2%胶原酶(200u/mg,gibco)的含10%胎牛血清(gibco)的dmem培养基(gibco,gaithersburg,usa)(dmem-fcs)在37℃下孵育15min。然后用冰浴的dmem-fcs彻底洗涤后肾。用头端尖锐的细针从胶原酶消化的后肾分离输尿管芽(ub)和后肾间充质,保存于dmem-fcs,置于冰上,备用。离体的输尿管芽和后肾间充质部分用胰酶消化10min(0.05%,在0.5mmedta中,gibco)计数。单细胞悬浮液用dmem-fcs洗涤,然后加入pbs中低速离心,用能与输尿管芽特异性结合的双花扁豆凝集素(fitc-dba)(50mg/ml,sigma)37℃下孵育30min。此外,将单细胞悬浮液在含有1mn-乙酰半乳糖胺的fitc-dba中孵育。洗涤细胞,然后固定于4%多聚甲醛1h,用于细胞分选。此外,整个后肾间充质部分在胰酶消化后用胶原酶处理,总的细胞悬浮液用于fitc-dba结合评估。细胞数据(至少25,000/样本)通过bekton狄金森荧光激活细胞分类器(facs)获得,并使用flowjo软件(版本5.7.2)进行分析。ub细胞培养于dmem-fcs。80%汇合后,用dmem洗涤细胞,然后用不含fcs的dmem替换培养基。再将细胞培养2天以制备条件培养基。离心条件培养基以去除细胞碎片,用0.22毫米过滤器过滤,储存于-80℃备用。
2.2脐带来源间充质干细胞的分离、培养和鉴定
2.2.1人脐带标本的预处理
无菌条件下取正常足月剖腹产的近胎儿段脐带,用含100u/ml青霉素和100u/ml链霉素的pbs液充分洗涤去除脐动静脉中残余血渍;将脐带等分为0.5cm的脐带段后,仔细剔除动静脉,剪成1mm×1mm×1mm大小,剪碎过程中滴加lg-dmem培养液保持组织湿润;含100u/ml青霉素和100u/ml链霉素的pbs洗涤2次;取15ml离心管盛装脐带段,1段/离心管备用。
2.2.2酶解
向盛装脐带段的离心管中加入2倍体积的0.3%ⅱ型胶原酶、0.1%胰酶、0.02%edta、0.1%透明质酸酶和0.1%dna酶混合液,37℃恒温水浴箱中震荡消化;于消化后2h用含体积分数10%fbs、100u/ml青霉素和0.1g/l链霉素的lg-dmem培养基终止消化,1000r/min离心8min;弃上清,用含体积分数10%fbs、100u/ml青霉素和100u/ml链霉素的lg-dmem培养基重悬细胞,1000r/min离心5min;弃上清,用4ml含体积分数10%fbs、100u/ml青霉素和100u/ml链霉素的lg-dmem重悬细胞。
2.2.3细胞培养及细胞表型鉴定
将所得原代细胞接种到培养瓶中,置于37℃、体积分数5%co2、95%湿度的培养箱中孵育培养,3d后第1次换液,去除未贴壁细胞,以后每48h更换培养液。倒置显微镜下观察细胞的形态。待原代细胞长满至培养瓶底的80%左右,弃去培养液,pbs漂洗1次后,加37℃、0.25%胰蛋白酶-edta消化约2min,轻轻拍打瓶壁促进细胞从瓶底脱离,然后加入含体积分数10%fbs、100u/ml青霉素和100u/ml链霉素的lg-dmem培养基终止消化,收集吹打后所得细胞,以600g离心5min,弃上清,用培养液重悬,1∶2的比例进行传代接种,置于37℃、体积分数5%co2、95%湿度的培养箱中孵育培养,每2d换液1次。待细胞增殖并覆盖瓶底80%左右时,用同样方法消化传代。
2.2.4细胞表面标记物鉴定
分离所得细胞经含体积分数10%fbs和双抗的lg-dmem培养基培养传代3代后,取对数生长期第4代细胞,配制成1×109l-1悬液,用鼠抗人pe标记的cd73及同型对照10μl,4℃避光孵育30min,pbs液洗涤3次,10g/l多聚甲醛固定,流式细胞仪检测分析。
2.3脐带来源间充质干细胞的诱导分化和鉴定
2.3.1诱导分化
取第3代经流式仪鉴定后的脐带间充质干细胞,按5×105个/ml接种于预先放置盖玻片的6孔培养板中培养。将细胞分为四组,分别进行后续的分析。两组细胞分别标为(1)未诱导组:含体积分数10%fbs、100u/ml青霉素和100u/ml链霉素的lg-dmem培养基培养;(2)诱导组一:含体积分数10%fbs、10-7mra、10ng/mlactivin、100u/ml青霉素、100u/ml链霉素、体积分数10%ub细胞条件培养基的lg-dmem培养基;(3)诱导组二:含体积分数10%fbs、10-7mra、10ng/mlegf、100u/ml青霉素、100u/ml链霉素、体积分数10%ub细胞条件培养基的lg-dmem培养基;(4)诱导组三:含体积分数10%fbs、10-7mra、10ng/ml黄芪甲苷、100u/ml青霉素、100u/ml链霉素、体积分数10%ub细胞条件培养基的lg-dmem培养基;(5)诱导组四:含体积分数10%fbs、10-7mra、20ng/ml黄芪甲苷、100u/ml青霉素、100u/ml链霉素、体积分数10%ub细胞条件培养基的lg-dmem培养基。
2.3.2细胞形态学鉴定
诱导第0、4、6、8天,倒置显微镜下观察诱导组细胞的形态变化。
2.3.3wb检测诱导8d后细胞ck-18的表达
用pbs分别将诱导第8天的各诱导组及未诱导组细胞冲洗3次,每孔中加细胞裂解液1ml使细胞充分裂解,提取细胞总蛋白,并检测样品蛋白含量。将检测完后的蛋白制作成样品进行sds-page电泳,电泳结束后即转膜。转膜后将所转膜取出,将膜用pbs浸湿后,移至含有封闭液的平皿中,室温下脱色摇床上摇动封闭30min。将抗ck-18蛋白一抗用pbs-t(pbs,0.1%tween)稀释至适当浓度,室温下孵育1h后,用pbs-t在室温下脱色摇床上洗3次,每次20ml,10min。同上方法准备二抗稀释液并与膜接触,室温下孵育1h后,用tbst在室温下脱色摇床上洗3次,每次10min后,显色,拍照。actb为内参,利用scnimage软件测定各目的条带的净灰度值,与内参照actb条带值相比较。
2.3.4细胞流式检测
8d后通过细胞流式检测ck18细胞阳性率。具体方法为:将细胞重悬于100mlpbs中,加入一抗2ml,4℃摇床反应30min,再加入相应二抗1ml,4℃摇床,避光反应30min,pbs清洗3次经100目筛网过筛后上机检测。
3结果
3.1胚胎肾组织的分离、表征和条件培养基的制备
分离的ub被解离成单细胞悬浮液,与fitc-dba一起孵育,然后进行分析。结果分离的ub培养后呈现db阳性的同质细胞群,荧光染色强度比阴性对照大约1个对数单位。获取并分析了25,000个细胞的数据,显示72.3%的细胞群染色呈阳性。在妊娠第13天,小鼠后肾由ub和后肾间充质组成。通过光学显微镜检查发现,ub细胞形成带扩张壶腹的单个小管。所有ub细胞都能与db结合。
3.2脐带来源间充质干细胞的分离、培养和鉴定
倒置显微镜下观察细胞贴壁生长,呈梭形。对数生长期第4代细胞经流式细胞仪检测分析,人mscs标记抗原cd73阳性率为(92.5±2.8)%。
3.3脐带来源间充质干细胞的诱导分化和鉴定
3.3.1细胞形态学鉴定
诱导第8天,未诱导组细胞呈明显长梭形;各诱导组均有部分细胞形态变为短梭形、圆形或不规则形。
3.3.2wb检测诱导8d后细胞ck18的表达
wb检测诱导8d,各诱导组细胞的ck18表达呈阳性,净灰度值明显高于未诱导组(p>0.05),诱导组一、诱导组二、诱导组三和诱导组四的ck18表达净灰度值分别为未诱导组的46、75、156和113倍。
3.3.3细胞流式检测
细胞流式结果显示,诱导8d后,对照组ck-18阳性率为(6.5±0.4)%,而诱导组一、诱导组二、诱导组三和诱导组四的ck-18阳性率分别为(61.5±2.6)%、(69.8±3.0)%、(94.5±3.8)%和(81.3±3.7)%,较对照组明显升高(p>0.05)。其中诱导组三的ck-18阳性率最高,相比于其他组差异有统计学意义(p>0.05)。
实施例2
本申请的发明人在研发过程中,发现现有市售的离心管,在使用过程中,并不能有效的满足离心需求,比如现有市售的离心管一是往往采用分体式结构,管体与管盖通过螺纹旋转连接,如果管盖丢失或者遗忘,则无法使用该离心管,二是离心管在放置离心机中后因为尺寸的不同,容易在放置槽内晃动,不能很好的固定在离心机的放置槽内,容易造成离心管的损坏,为此申请人在试验过程中对离心管也作出了相应的创新,从而使得离心步骤满足本申请的需求。
参见图1至图3,改进后的离心管包括离心管本体1,离心管本体1的两侧均固定安装有固定臂2,两个固定臂2的其中一个的顶部固定安装有第一固定座3,第一固定座3的顶部开设有第一凹槽4,第一凹槽4内转动安装有转动杆5,转动杆5的一端延伸至第一凹槽4的外侧并固定安装有盖板6,盖板6的底端固定安装有密封盖7,密封盖7与离心管本体1相适配,盖板6远离转动杆5的一侧固定安装有固定杆8,固定杆8的底部固定安装有第一磁片9,两个固定臂2的另一个固定臂2的顶部固定安装有第二固定座10,第二固定座10的顶部开设有第二凹槽24,固定杆8活动安装在第二凹槽24内,第二凹槽24的底部内壁上固定安装有第二磁片11,第二磁片11与第一磁片9相适配,两个固定臂2相互远离的一侧均开设有固定槽12,固定槽12内滑动安装有移动座13,移动座13的一侧固定安装有固定板14,移动座13的另一侧开设有压簧槽15,压簧槽15内滑动安装有滑杆16,滑杆16的一端延伸至压簧槽15的外侧并固定安装在固定槽12的一侧内壁上,滑杆16的外侧套设有压簧17,通过离心管本体1、固定臂2、第一固定座3、第一凹槽4、转动杆5、盖板6、密封盖7、固定杆8、第一磁片9、第二固定座10、第二磁片11、固定槽12、移动座13、固定板14、压簧槽15、滑杆16、压簧17、滑槽18、滑块19、转动槽20、转动块21、环形槽22、移动块23和第二凹槽24的配合之下,转动盖板6,使得盖板6带动密封盖7转动,盖板6带动转动杆5在第一凹槽4内转动,转动杆5带动转动块21在转动槽20内转动,使得密封盖7活动安装在离心管本体1内,即可固定密封盖7在离心管本体1内的位置,同时盖板6带动固定杆8转动,固定杆8带动的第一磁片9转动,使得第一磁片9与第二磁片11相吸附,即可固定盖板6的位置,然后,按动固定板14,使得固定板14压动移动座13,使得移动座13在固定槽12内滑动,移动座13压动压簧17,使得压簧17发生弹性形变,当离心管本体1放入设备内后,松开固定板14,因为压簧17的弹性作用带动固定板14移动,即可通过固定板14将离心管本体1固定在设备中;改进后的离心管通过转动盖板6即可开关密封盖7,避免了密封盖7丢失而无法使用离心管本体1的问题,通过两个固定板14可以很好的将离心管本体1固定在设备的放置槽内,不会在设备内发生晃动,不会造成离心管本体1的损坏,进而确保样品能够得到有效的离心。
进一步的,压簧17的一端固定安装在移动座13的一侧,压簧17的另一端固定安装在固定槽12的一侧内壁上,固定槽12的两侧内壁上均开设有滑槽18,移动座13的两侧均固定安装有滑块19,滑块19滑动安装在滑槽18内,密封盖7的材质为硅橡胶,固定板14的材质pvc软胶,第一凹槽4的两侧内壁上均开设有转动槽20,转动杆5的两侧均固定安装有转动块21,转动块21转动安装在转动槽20内,转动槽20的内壁上开设有环形槽22,转动块21的外侧固定安装有移动块23,移动块23与环形槽22的侧壁滑动连接,通过离心管本体1、固定臂2、第一固定座3、第一凹槽4、转动杆5、盖板6、密封盖7、固定杆8、第一磁片9、第二固定座10、第二磁片11、固定槽12、移动座13、固定板14、压簧槽15、滑杆16、压簧17、滑槽18、滑块19、转动槽20、转动块21、环形槽22、移动块23和第二凹槽24的配合之下,转动盖板6,使得盖板6带动密封盖7转动,盖板6带动转动杆5在第一凹槽4内转动,转动杆5带动转动块21在转动槽20内转动,使得密封盖7活动安装在离心管本体1内,即可固定密封盖7在离心管本体1内的位置,同时盖板6带动固定杆8转动,固定杆8带动的第一磁片9转动,使得第一磁片9与第二磁片11相吸附,即可固定盖板6的位置,然后,按动固定板14,使得固定板14压动移动座13,使得移动座13在固定槽12内滑动,移动座13压动压簧17,使得压簧17发生弹性形变,当离心管本体1放入设备内后,松开固定板14,因为压簧17的弹性作用带动固定板14移动,即可通过固定板14将离心管本体1固定在设备中;本发明结构简单,操作方便,通过转动盖板6即可开关密封盖7,避免了密封盖7丢失而无法使用离心管本体1的问题,通过两个固定板14可以很好的将离心管本体1固定在设备的放置槽内,不会在设备内发生晃动,不会造成离心管本体1的损坏。
使用时:转动盖板6,使得盖板6带动密封盖7转动,盖板6带动转动杆5在第一凹槽4内转动,转动杆5带动转动块21在转动槽20内转动,使得密封盖7活动安装在离心管本体1内,即可固定密封盖7在离心管本体1内的位置,同时盖板6带动固定杆8转动,固定杆8带动的第一磁片9转动,使得第一磁片9与第二磁片11相吸附,即可固定盖板6的位置,然后,按动固定板14,使得固定板14压动移动座13,使得移动座13在固定槽12内滑动,移动座13压动压簧17,使得压簧17发生弹性形变,当离心管本体1放入设备内后,松开固定板14,因为压簧17的弹性作用带动固定板14移动,即可通过固定板14将离心管本体1固定在设备中,不会在设备内发生晃动,不会造成离心管本体1的损坏。
虽然,上文中已经用一般性说明、具体实施方式及实例,对本发明作了详尽的描述,但在本发明基础上,可以对本方法的判别模型作出一定的补充和优化。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!