用于细胞转染的受体转染微泡、配体转染微泡以及两段制导式细胞转染方法与流程
本申请属于细胞转染技术领域,具体涉及用于细胞转染的受体转染微泡、配体转染微泡以及两段制导式细胞转染方法。
背景技术:
基因治疗是最终解决因基因变异所引发疾病的最佳方式,而该方式最大的难点便是建立基因转染系统。目前常见的转染治疗载体分非病毒类载体以及病毒类载体两大类;其中非病毒载体主要为脂质体。
然而两者均存在应用缺陷,前者脂质转染效率低下,最高只能实现30%的转染效率,难以有效达到治疗的目的;后者病毒转染虽然效率高,但是存在致癌等的安全风险。因此,现有的转染技术需要进行相应的提升。
技术实现要素:
有鉴于此,本申请提供了用于细胞转染的受体转染微泡、配体转染微泡以及两段制导式细胞转染方法,以解决现有技术中存在的技术问题。
本申请为解决其技术问题而提供的受体转染微泡为:
一种用于细胞转染的受体转染微泡,包括受体微泡体,其特征在于:受体微泡体内包覆有经过了人工受体修饰的受体脂质体;人工受体为多肽链,可以通过静电吸引力和疏水相互作用,与具有相应结构的多肽链在转染时形成卷曲螺旋。
进一步地,在本申请提供的用于细胞转染的受体转染微泡中,受体微泡体内封装有惰性气体,比如全氟丙烷气体或sf6气体。
进一步地,在本申请提供的用于细胞转染的受体转染微泡中,受体微泡体为脂质微泡。
进一步地,在本申请提供的用于细胞转染的受体转染微泡中,受体脂质体为正电性脂质体。
进一步地,在本申请提供的用于细胞转染的受体转染微泡中,人工受体的氨基酸序列从n端到c端为:(kiaalkk)3。
本申请为解决其技术问题而提供的配体转染微泡为:
一种用于细胞转染的配体转染微泡,其特征在于:该用于细胞转染的配体转染微泡包括配体脂质体,配体脂质体内包载有需要转染的核酸,配体脂质体还经过了人工配体的修饰;人工配体为多肽链,可以通过静电吸引力和疏水相互作用,与具有相应结构的多肽链在转染时形成卷曲螺旋。
进一步地,本申请提供的用于细胞转染的配体转染微泡中,配体脂质体为正电性脂质体。
进一步地,本申请提供的用于细胞转染的配体转染微泡中,人工配体(23)的氨基酸序列从n端到c端为:(eiaalek)3。
本申请的另一方面,还提供了一种两段制导式细胞转染方法,包括:
受体-细胞结构形成步骤,采用低频率聚焦超声将前述任一技术方案中所记载的受体转染微泡在靶细胞表面击碎,释放出来的的人工受体通过靶细胞表面因声孔效应而出现的机械孔道,进而附着于靶细胞的表面,形成受体-细胞结构;
多肽结合转染步骤,将前述任一技术方案中所记载的配体转染微泡与受体-细胞结构混合,人工受体和人工配体通过静电吸引力和疏水相互作用而形成卷曲螺旋,同时释放出大量的键合能,需要转染的核酸在键合能的作用下跨越磷脂膜与细胞膜之间的能量壁垒,达到高效膜融合的转染效果。
进一步地,在本申请提供的两段制导式细胞转染方法中,人工受体的氨基酸序列从n端到c端为:(kiaalkk)3;人工配体的氨基酸序列从n端到c端为:(eiaalek)3。
本申请相比现有技术有益的技术效果:
膜融合脂质体具备制备方法简单,副作用小,融合特性高等特性,作为一种新型的载体系统,在基因变异问题治疗方面有着广阔的前景。通过生物仿生自组装的设计的拟病毒脂质微泡转染载体一方面模拟病毒通过膜融合的途径进行细胞转染,避免了病毒类转染载体可能存在的致癌等风险,另一方面大大提高了普通脂质载体的转染效率,达到了外层膜100%转染,内层膜超过80%的转染效率。
同时本申请提供的膜融合的脂质体由人工靶向修饰借由微泡做两段式制导转染方法。其中采用低频率聚焦超声将受体转染微泡在靶细胞表面击碎,释放出来的的受体多肽通过靶细胞表面因声孔效应而出现的机械孔道,进而附着于靶细胞的表面,形成受体-细胞结构;然后将配体转染微泡与受体-细胞结构混合,人工受体多肽和人工配体多肽因静电吸引和疏水作用而形成卷曲螺旋,同时释放出大量的键合能,需要转染的核酸在键合能的作用下跨越磷脂膜与细胞膜之间的能量壁垒,通过膜融合释药,达到了高效膜融合的转染效果。由此可知,本申请提供的用于细胞转染的受体转染微泡、配体转染微泡以及两段制导式细胞转染方法具有高效的转染效率以及低的致癌风险等技术优势。
为使本申请的技术方案及技术效果更加清楚、明确,以下结合说明书附图和具体实施方式对本申请公开的用于细胞转染的受体转染微泡、配体转染微泡以及两段制导式细胞转染方法的技术方案和技术效果进行详细说明。
附图说明
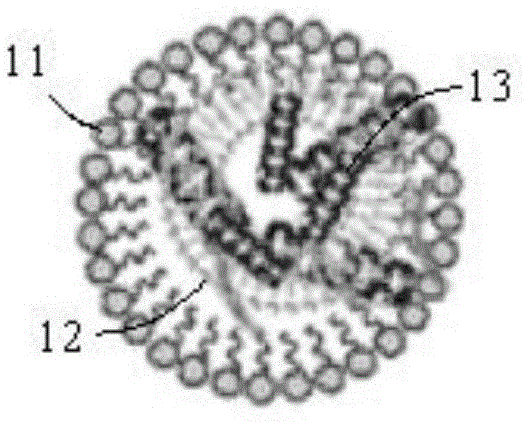
图1:用于细胞转染的受体转染微泡结构示意图;
图2:用于细胞转染的配体转染微泡结构示意图;
图3:两段制导式细胞转染方法实现原理图。
标识说明:
11-受体微泡体,12-受体脂质体,13-人工受体;
21-配体脂质体,22-核酸,23-人工配体。
具体实施方式
请参阅图1,本申请优选实施例中提供的用于细胞转染的受体转染微泡,结构上包括受体微泡体11,受体微泡体11内包覆有受体脂质体12,受体转染微泡为微米级别的脂质微泡,受体脂质体12为正电性脂质体,粒径为纳米级别。受体脂质体12经过了人工受体ra的修饰,人工受体ra为多肽链,其氨基酸序列从n端到c端为:(kiaalkk)3。
请参阅图2,本申请优选实施例中提供的用于细胞转染的配体转染微泡,结构上包括配体脂质体21,以及配体脂质体21内包载的需要转染的核酸22。配体脂质体21为正电性脂质体,并经过了人工配体la的修饰,人工配体la为多肽链,其氨基酸序列从n端到c端为:(eiaalek)3。
请参阅图3,基于优选实施例中公开的用于细胞转染的受体转染微泡、配体转染微泡而实现的两段制导式细胞转染方法包括以下步骤:
受体-细胞结构形成步骤,利用低频率聚焦超声将受体转染微泡在靶细胞表面击碎,受体转染微泡体内包覆有经过人工受体ra修饰的受体脂质体12,释放出来的的ra多肽通过靶细胞表面因声孔效应而出现的机械孔道,进而附着于靶细胞的表面,形成ra-细胞结构或受体-细胞结构;
多肽结合转染步骤,将配体转染微泡,也即经人工配体la修饰的脂质体包载核酸,与ra-细胞结构混合,ra多肽和la多肽因静电吸引力和疏水相互作用而互相结合,形成二聚体卷曲螺旋,同时释放出大量的键合能(>14kcal/mol),需要转染的核酸在键合能的作用下跨越磷脂膜与细胞膜之间的能量壁垒,通过膜融合释药,达到高效膜融合的转染效果。
其中,受体转染微泡是用脂质微泡将经过人工受体ra修饰的正电性的膜融合脂质体包覆形成,微泡内部同时包封有惰性气体,人工受体ra的氨基酸序列从n端到c端为:(kiaalkk)3,微泡的粒径为微米级,膜融合脂质体脂质体的粒径为纳米级;
配体转染微泡是用经过人工配体la修饰的正电性的膜融合脂质体将需要转染的核酸包载形成,人工配体la的氨基酸序列从n端到c端为:(eiaalek)3。
由于两段制导式细胞转染方法模拟病毒通过膜融合的途径而非内吞的途径进行细胞转染,避免了病毒类转染载体可能存在的致癌等风险,同时大大提高了普通脂质载体的转染效率,达到了外层膜100%转染,内层膜超过80%的高效转染效率。
以上结合说明书附图对本申请的优选实施例进行了详细阐述,应该说明的是,本申请的保护范围包括但不限于上述实施例;说明书附图中公开的具体结构也只是本申请的较佳实施方式而已,所述领域的技术人员还可以在此基础上开发出其他实施例,任何不脱离本申请创新理念的简单变形或等同替换,均涵盖于本申请,属于本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!