一种获取芳香族异戊烯基转移酶的发酵和一步纯化方法与流程
本发明涉及一种获取芳香族异戊烯基转移酶的发酵和一步纯化方法,特别涉及一种大肠杆菌中可溶性表达芳香族异戊烯基转移酶novq的方法以及其在生产维生素k2中的应用,属于生物技术领域。
背景技术:
可溶性芳香族异戊烯基转移酶(solublearomaticprenyltransferase)是很多生物合成过程中的关键酶,催化芳香族底物的异戊烯基化,进而形成多级代谢产物。可溶性异戊烯基转移酶的底物范围很广,如4-羟基苯丙酮酸,白藜芦醇和对香豆酸都可以被异戊烯基化,进而生成诸多有生理和药理活性的产物。
近年来,国内外对于放线菌来源的abba可溶性异戊烯基转移酶的研究报道较多,它们拥有相似的(n/d)dxxd结构,在制药学和理论医学上拥有广泛的应用。florencepojer等人(f.pojer,e.wemakor,b.kammerer,h.chen,c.t.walsh,s.m.li,l.heide,cloq,aprenyltransferaseinvolvedinclorobiocinbiosynthesis,procnatlacadsciusa,100(2003)2316-2321)将链霉菌来源的cloq在大肠杆菌中表达,获取可溶性的纯酶进行体外催化,可以得到多种异戊烯基化的产物,如新生霉素。该法使用了gst作为融合标签,但蛋白的表达量受限,且纯化手段较繁琐,得到的目标蛋白活性不高。
随着基因工程技术的发展,大肠杆菌已成为一种常见的异源表达菌株,它具有培养成本低,重组蛋白产量高,易于处理等明显的优势。然而,大肠杆菌表达系统存在一些缺点,例如,高水平的蛋白表达和不适当的表达条件将导致蛋白质的聚集和沉降,从而形成无活性的包涵体。将融合标签连接到重组蛋白的n末端是另一种增强目标蛋白溶解度的方法。通过将靶蛋白引导至细胞质或周质空间的特定位点,融合伴侣可以促进这些蛋白质的正确折叠。常用的融合标签包括麦芽糖结合蛋白(mbp),硫氧还蛋白(trxa)和谷胱甘肽s-转移酶(gst)。
mbp是一种由male基因克隆的融合蛋白,它可以准确定位周质空间,进而促进目标蛋白形成正确的二硫键,阻止其聚集形成包涵体。此外,通过添加相应的蛋白酶,mbp标签可以在目标蛋白纯化后被切割掉,从而可以保持目标蛋白的原始活力,提高蛋白的回收率。
技术实现要素:
本发明的目的在于提供一种表达芳香族异戊烯基转移酶的方法及生产维生素k2的方法。
为实现上述目的及其他相关目的,本发明提供的技术方案是:一种表达芳香族异戊烯基转移酶的方法,包括下列步骤:
步骤1:根据ncbi中查找到的mbp的序列,去掉终止密码子,在两端引入ncoi和hindiii两个酶切位点,设计得到引物,然后进行pcr扩增得到第一mbp片段;
步骤2:根据ncbi中查找到的mbp的序列,保留终止密码子,在两端引入ndei和kpni两个酶切位点,设计得到引物,然后进行pcr扩增得到第二mbp片段;
步骤3:使用限制性内切酶切割第一mbp片段和质粒pet28a,清洁回收后利用t4连接酶将第一mbp片段和质粒pet28a连接起来,得到载体pet28a-mbp;使用限制性内切酶切割第二mbp片段和质粒petduet-1,清洁回收后利用t4连接酶将第二mbp片段和质粒petduet-1连接起来,得到载体petduet-1-mbp;
步骤4:以链霉菌总dna为模板,使用引物f3和r3进行pcr扩增,经pcr纯化试剂盒纯化后得到片段3;以链霉菌总dna为模板,使用引物f4和r4进行pcr扩增,经pcr纯化试剂盒纯化后得到片段4;
f3:5’cccaagcttgagaatctttatttccaaggttctatgcccgcactcccgatgaat-3’;
r3:5’ataagaatgcggccgctcagtggtggtggtggtggtgtcgggcacctccggtgatc-3’;
f4:5’-catgccatggatgcccgcactcccgatgaat-3’;
r4:5’-cccaagctttcatcgggcacctccggtgatc-3’;
步骤5:使用限制性内切酶切割片段3和载体pet28a-mbp,清洁回收后利用t4连接酶将片段3和载体pet28a-mbp连接起来,得到芳香族异戊烯基转移酶促溶表达载体pet28a-mbp-novq;使用限制性内切酶切割片段4和载体petduet-1-mbp,清洁回收后利用t4连接酶将片段4和载体petduet-1-mbp连接起来,得到芳香族异戊烯基转移酶促溶表达载体petduet-1-mbp-novq;
步骤6:将芳香族异戊烯基转移酶促溶表达载体pet28a-mbp-novq转化入大肠杆菌dh5α中,扩增获取表达载体,将所述表达载体转入大肠杆菌bl21(de3),得到可溶性芳香族异戊烯基转移酶表达菌株大肠杆菌bl21(de3)-pet28a-mbp-novq,将芳香族异戊烯基转移酶促溶表达载体petduet-1-mbp-novq导入大肠杆菌dh5α中,扩增获取表达载体,将所述表达载体转入大肠杆菌rosetta(de3),得到第二种可溶性芳香族异戊烯基转移酶表达菌株大肠杆菌rosetta(de3)-petduet-1-mbp-novq;
步骤7:将大肠杆菌bl21(de3)-pet28a-mbp-novq单菌落,接种于lb液体培养基,培养得到活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液;吸取活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液接种于新的lb液体培养基中,培养至菌液od值为0.6-0.8,得到大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液;向所述大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液中加入异丙基硫代半乳糖苷,振荡培养3-4h后对发酵液离心除去培养基,得到大肠杆菌bl21(de3)-pet28a-mbp-novq菌体;向所述bl21(de3)-pet28a-mbp-novq菌体中加入pbs缓冲液,重悬菌体,然后使用超声破碎仪破碎细胞,得到的破碎液离心20min弃沉淀,得到的上清液即为含有mbp-novq融合蛋白的溶液;使用直链淀粉柱纯化含有mbp-novq融合蛋白的溶液,即得mbp-novq纯酶溶液;
步骤8:将大肠杆菌rosetta(de3)-petduet-1-mbp-novq单菌落,接种于lb液体培养基,培养得到活化后的大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌液;吸取活化后的大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌液接种于新的lb液体培养基中,培养至菌液od值为0.6-0.8,得到大肠杆菌rosetta(de3)-petduet-1-mbp-novq诱导前菌液;向所述大肠杆菌rosetta(de3)-petduet-1-mbp-novq诱导前菌液中加入异丙基硫代半乳糖苷,振荡培养3-4h后对发酵液离心除去培养基,得到大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌体;向所述rosetta(de3)-petduet-1-mbp-novq菌体中加入pbs缓冲液,重悬菌体,然后使用超声破碎仪破碎细胞,得到的破碎液离心弃沉淀,得到的上清液即为含有可溶性novq蛋白的溶液;使用ni-ntresin纯化含有novq蛋白的溶液,即得novq纯酶溶液;
步骤9:将大肠杆菌bl21(de3)-pet28a-mbp-novq单菌落,接种于lb液体培养基,培养得到活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液;吸取活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液接种于新的lb液体培养基中,培养至菌液od值为0.6-0.8,得到大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液;向所述大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液中加入异丙基硫代半乳糖苷,振荡培养3-4h后对发酵液离心除去培养基,得到大肠杆菌bl21(de3)-pet28a-mbp-novq菌体;向所述bl21(de3)-pet28a-mbp-novq菌体中加入pbs缓冲液,重悬菌体,然后使用超声破碎仪破碎细胞,得到的破碎液离心20min弃沉淀,得到的上清液即为含有mbp-novq融合蛋白的溶液;使用直链淀粉柱纯化含有mbp-novq融合蛋白的溶液,且在纯化过程中加入tev蛋白酶,得到酶切过的novq纯酶溶液。
优选的技术方案为:在步骤1中,根据ncbi中查找到的mbp,去掉终止密码子,在两端引入ncoi和hindiii两个酶切位点,设计得到引物f1和r1;以pmbp质粒为模板,使用引物f1和r1进行pcr扩增,经pcr纯化试剂盒纯化后得到第一mbp片段;
f1:5’-catgccatgggccaaaattgaagaaggta-3’;
r1:5’-cccaagcttggggtacctcagctgcccgcattagtct-3’;
优选的技术方案为:在步骤1中,根据ncbi中查找到的mbp,保留终止密码子,在两端引入ndei和kpni两个酶切位点,设计得到引物f2和r2;以pmbp质粒为模板,使用f2和r2进行pcr扩增,经pcr纯化试剂盒纯化后得到第二mbp片段;
f2:5’-ggaattccatatggccaaaattgaagaaggta-3’;
r2:5’-ggggtacctcagctgcccgcattagtctgc-3’;
为实现上述目的及其他相关目的,本发明提供的技术方案是:一种生产维生素k2的方法,将底物维生素k3和dmapp溶于甲醇,然后将mbp-novq纯酶溶液、novq纯酶溶液和酶切过的novq纯酶溶液中的至少一种加入,在温度条件为35-40℃条件下进行反应,反应结束后获得维生素k2;所述mbp-novq纯酶溶液、novq纯酶溶液和酶切过的novq纯酶溶液按照权利要求1~3任一权利要求制得。
由于上述技术方案运用,本发明与现有技术相比具有的优点是:
本发明利用麦芽糖结合蛋白mbp作为融合和共表达标签,能使原本在大肠杆菌体内以包涵体形式存在的novq蛋白转化为可溶性的novq蛋白,其活力也有所提高。通过添加mbp标签,纯化步骤得到了简化,使用与tev蛋白酶酶切相结合的一步纯化方法,大大增加了纯化效率,有广泛的应用前景。此外,利用维生素k3为底物生产维生素k2工艺过程简易,对体内实验和工业化规模生产有一定的意义和价值。
附图说明
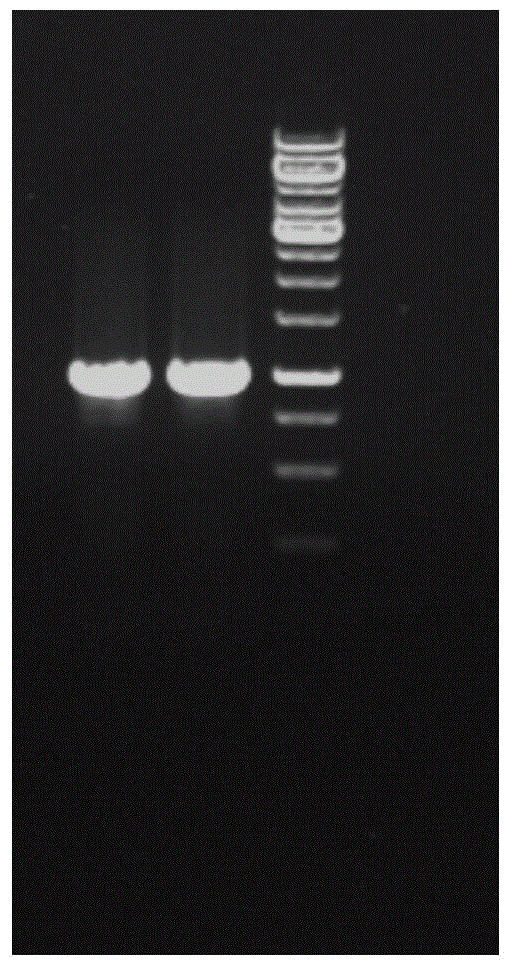
图1为novq基因pcr结果的电泳图。
图2为一步纯化法的酶切过的novq纯酶的电泳图。
图3为共表达和融合表达质粒构建示意图。
图4为mbp-novq表达检测。
图5为融合表达mbp-novq蛋白纯化。
图6为mbp-novq融合蛋白western的鉴定结果。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
请参阅图1-图6。须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
实施例1:一种获取芳香族异戊烯基转移酶的发酵和一步纯化方法
构建表达载体:
获取融合标签mbp基因:
在ncbi上查找mbp序列,根据序列设计两对引物:
f1:5’-catgccatgggccaaaattgaagaaggta-3’;
r1:5’-cccaagcttggggtacctcagctgcccgcattagtct-3’;
f2:5’-ggaattccatatggccaaaattgaagaaggta-3’;
r2:5’-ggggtacctcagctgcccgcattagtctgc-3’;
以pmbp质粒为模板,使用引物f1和r1进行pcr扩增,pcr扩增体系为:1μlpmbp质粒,分别加入10μm的引物各1μl,加入12.5μlpcrmix,加ddh2o补齐至25μl。扩增参数为94℃变性3min,94℃变性30s,54℃退火30s,72℃延长100s,72℃延长2min,30循环,经pcr纯化试剂盒纯化后得到片段1,纯化的方法和步骤具体采用pcr产物纯化试剂盒操作方法及步骤说明书。以pmbp质粒为模板,使用引物f2和r2进行pcr扩增,pcr扩增体系为:1μlpmbp质粒,分别加入10μm的引物各1μl,加入12.5μlpcrmix,加ddh2o补齐至25μl。扩增参数为94℃变性3min,94℃变性30s,56℃退火30s,72℃延长100s,72℃延长2min,30循环,经pcr纯化试剂盒纯化后得到片段2,纯化的方法和步骤具体采用pcr产物纯化试剂盒操作方法及步骤说明书。pcr扩增体系:2μl引物f和2μl引物r,25μlpfupcrmix,1μl模板,20μl去离子水,如图1所示,片段1的novq基因pcr结果,大小为1kb左右。
(2)获取异戊烯基转移酶novq基因
将雪白色链霉菌冻干粉(购买于中国药学微生物菌种保藏管理中心)加无菌生理盐水悬浮,吸取0.1ml涂布于高氏一号固体培养基上,28℃倒置培养5天。挑取白色的孢子,接种于100ml高氏一号液体培养基中,28℃,180rpm振荡培养3天,直至长出直径约2mm的菌丝球。培养液以4000g离心10min,沉淀用生理盐水洗涤,4000g离心10min,弃上清,重复2次,得到链霉菌菌丝体。使用ctab法提取菌丝体总dna。根据novq基因序列设计两对引物:
f3:5’cccaagcttgagaatctttatttccaaggttctatgcccgcactcccgatgaat-3’;
r3:5’ataagaatgcggccgctcagtggtggtggtggtggtgtcgggcacctccggtgatc-3’;
f4:5’-catgccatggatgcccgcactcccgatgaat-3’;
r4:5’-cccaagctttcatcgggcacctccggtgatc-3’;
以链霉菌总dna为模板,使用引物f3和r3进行pcr扩增,pcr扩增体系为:1μl链霉菌总dna,分别加入10μm的引物各1μl,加入12.5μlpcrmix,加ddh2o补齐至25μl。扩增参数为94℃变性3min,94℃变性30s,62℃退火30s,72℃延长80s,72℃延长2min,30循环,经pcr纯化试剂盒纯化后得到片段3;以链霉菌总dna为模板,使用引物f4和r4进行pcr扩增,pcr扩增体系为:1μl链霉菌总dna,分别加入10μm的引物各1μl,加入12.5μlpcrmix,加ddh2o补齐至25μl。扩增参数为94℃变性3min,94℃变性30s,55℃退火30s,72℃延长80s,72℃延长2min,32循环,经pcr纯化试剂盒纯化后得到片段4。pcr扩增体系:2μl引物f和2μl引物r,25μlpfupcrmix,1μl模板,20μl去离子水。
(3)目的片段与质粒连接
使用thermofisher限制性内切酶ncoi和hindiii处理片段1和pet28a-反应体系为50μl,其中ncoi和hindiii各1μl,反应buffer5μl,酶切片段10μl,去离子水33μl。酶切30min,加入loadingbuffer终止反应,琼脂糖凝胶电泳切胶回收,两者用t4连接酶连接,反应体系为t4连接酶1μl,反应buffer2μl,回收的片段15μl,回收的pet28a5μl,去离子水7μl,22℃处理4h,采用热激法将连接好的质粒转化进大肠杆菌dh5α中,涂布于卡那霉素浓度为50μg/ml的抗性平板上,挑取克隆进行菌液pcr-吸取1μl菌液,加入至100μl的蒸馏水中,混合均匀,吸取1μl作为菌液pcr的dna模板,选取pcr结果与片段1大小一致的克隆测序,得到表达载体pet28a-mbp;使用限制性内切酶ndei和kpni处理片段2和petduet-1,反应体系为50μl,其中ndei和kpni各1μl,反应buffer5μl,酶切片段10μl,去离子水33μl。酶切30min,加入loadingbuffer终止反应,琼脂糖凝胶电泳切胶回收,两者用t4连接酶连接,22℃处理4h,将连接好的质粒转化进大肠杆菌dh5α中,涂布于氨苄青霉素浓度为100μg/ml的抗性平板上,挑取克隆进行菌液pcr,选取阳性克隆测序,得到表达载体petduet-1-mbp。
使用限制性内切酶hindiii和noti处理片段3和pet28a-mbp,反应体系为50μl,其中hindiii和noti各1μl,反应buffer5μl,酶切片段10μl,去离子水33μl。酶切30min,加入loadingbuffer终止反应,琼脂糖凝胶电泳切胶回收,两者用t4连接酶连接,22℃处理4h,将连接好的质粒转化进大肠杆菌dh5α中,涂布于卡那霉素浓度为50μg/ml的抗性平板上,挑取克隆进行菌液pcr,选取阳性克隆测序,得到表达载体pet28a-mbp-novq;使用限制性内切酶ncoi和hindiii处理片段4和petduet-1-mbp,反应体系为50μl,其中ncoi和hindiii各1μl,反应buffer5μl,酶切片段10μl,去离子水33μl。酶切30min,加入loadingbuffer终止反应,琼脂糖凝胶电泳切胶回收,两者用t4连接酶连接,22℃处理4h,将连接好的质粒转化进大肠杆菌dh5α中,涂布于氨苄青霉素浓度为100μg/ml的抗性平板上,挑取克隆进行菌液pcr,选取阳性克隆测序,得到表达载体petduet-1-mbp-novq。
(4)表达载体转化大肠杆菌bl21(de3)和rosetta(de3)
利用热激法将表达载体pet28a-mbp-novq和petduet-1-mbp-novq分别转化进大肠杆菌bl21(de3)和rosetta(de3)中,使用卡那霉素浓度为50μg/ml的抗性平板和氨苄青霉素浓度100μg/ml的抗性平板筛选,经菌落pcr验证得到bl21(de3)-pet28a-mbp-novq和rosetta(de3)-petduet-1-mbp-novq表达菌株。
实施例2:获取可溶性芳香族异戊烯基转移酶纯酶mbp-novq蛋白
挑取阳性大肠杆菌bl21(de3)-pet28a-mbp-novq单菌落,接种于lb液体培养基,250ml摇瓶装液量为50ml,37℃,200rpm振荡培养18h,得到活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液;
吸取活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液500μl接种于新的lb培养基中,250ml摇瓶装液量为50ml,37℃,200rpm振荡培养至菌液od值为0.6-0.8,得到大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液;
向上述诱导前菌液中加入终浓度为0.5mm的iptg,22℃,180rpm振荡培养3-4h。将发酵液以6000g,5min离心除去培养基,得到大肠杆菌bl21(de3)-pet28a-mbp-novq菌体;
向bl21(de3)-pet28a-mbp-novq菌体中加入pbs缓冲液,添加量为400μl/ml菌体,重悬菌体,使用超声破碎仪破碎细胞,超声参数为:5s/3s,超声时间3-5min。破碎液以15000g离心20min,弃沉淀,上清即为含有mbp-novq融合蛋白的溶液;
使用直链淀粉柱纯化mbp-novq融合蛋白。破碎上清液缓慢加入层析柱,4℃,振荡结合1h,用4倍柱体积的柱洗涤缓冲液清洗直链淀粉柱,流速为0.5ml/min,然后用2倍柱体积的洗脱缓冲液洗柱,收集流出液,流速为0.3ml/min,重复2-3次,合并洗涤液,即为mbp-novq纯酶溶液。如图6所示,五号泳道就是mbp-novq融合蛋白western的鉴定结果。
实施例3:获取可溶性芳香族异戊烯基转移酶纯酶novq蛋白
(1)挑取阳性大肠杆菌rosetta(de3)-petduet-1-mbp-novq单菌落,接种于lb液体培养基,250ml摇瓶装液量为50ml,37℃,220rpm振荡培养16h,得到活化后的大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌液;
(2)吸取活化后的大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌液500μl接种于新的lb培养基中,250ml摇瓶装液量为50ml,37℃,220rpm振荡培养至菌液od值为0.6-0.8,得到大肠杆菌rosetta(de3)-petduet-1-mbp-novq诱导前菌液;
(3)向上述诱导前菌液中加入终浓度为0.3mm的iptg,20℃,180rpm振荡培养4h。将发酵液以6000g,5min离心除去培养基,得到大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌体;
(4)向rosetta(de3)-petduet-1-mbp-novq菌体中加入pbs缓冲液,添加量为400μl/ml菌体,重悬菌体,使用超声破碎仪破碎细胞,超声参数为:5s/3s,超声时间3-5min。破碎液以15000g离心20min,弃沉淀,上清即为含有mbp和novq蛋白的混合溶液;
(5)使用ni-ntaresin纯化novq蛋白。上清液上柱,流速为0.5ml/min,使用4倍柱体积的含10mm咪唑的洗杂缓冲液洗柱,使用4倍柱体积的含20mm咪唑的洗涤缓冲液洗柱,再用4倍柱体积的含40mm咪唑的清洗缓冲液洗柱,最后用8倍柱体积的含250mm咪唑的洗脱缓冲液洗柱,所得的洗脱液用透析袋脱盐,浓缩后即为novq纯酶溶液。
实施例4:获取可溶性芳香族异戊烯基转移酶纯酶novq蛋白
(1)挑取阳性大肠杆菌bl21(de3)-pet28a-mbp-novq单菌落,接种于lb液体培养基,250ml摇瓶装液量为50ml,37℃,200rpm振荡培养18h,得到活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液;
(2)吸取活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液500μl接种于新的lb培养基中,250ml摇瓶装液量为50ml,37℃,200rpm振荡培养至菌液od值为0.6-0.8,得到大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液;
(3)向上述诱导前菌液中加入终浓度为0.5mm的iptg,22℃,180rpm振荡培养3-4h。将发酵液以6000g,5min离心除去培养基,得到大肠杆菌bl21(de3)-pet28a-mbp-novq菌体;
(4)向bl21(de3)-pet28a-mbp-novq菌体中加入pbs缓冲液,添加量为400μl/ml菌体,重悬菌体,使用超声破碎仪破碎细胞,超声参数为:5s/3s,超声时间3-5min。破碎液以15000g离心20min,弃沉淀,上清即为含有mbp-novq融合蛋白的溶液;
(5)使用直链淀粉柱纯化novq蛋白。破碎上清液缓慢加入层析柱,4℃,振荡结合1h,用4倍柱体积的柱洗涤缓冲液清洗直链淀粉柱,流速为0.5ml/min,再加入2倍柱体积的洗涤缓冲液,此过程中,分3次加入1-2μltev蛋白酶,收集流出液,流速为0.3ml/min,重复2-3次,合并洗涤液,即为novq纯酶溶液。如图2所示,采用一步纯化法,最终蛋白纯度达90%以上。
纯酶novq蛋白用于体外催化,底物维生素k3和dmapp溶于甲醇,然后加入novq纯酶溶液,反应结束后反应液冻干,萃取后制得维生素k2。生产的维生素k2终浓度为0.3mm,dmapp终浓度为0.6mm,反应体系为400μl,反应温度为37℃,反应时间为24h;萃取有机试剂为甲醇,固液比为1:5,萃取温度为28℃,摇床转速为250rpm。
本发明克服了现有的技术问题,得到一种能表达可溶性芳香族异戊烯基转移酶(novq)的方法,使用一步纯化策略,大大提高了蛋白的纯化效率和回收率,进而生产维生素k2类等高附加值的产品。此外,本发明也实现了融合标签与novq蛋白的共表达,简化了蛋白纯化步骤,提高了蛋白活性。
本发明通过pcr扩增的方法从雪白色链霉菌(streptomycesniveus)中获取novq基因并在其n端添加tev酶切位点,然后通过酶切连接的方法将novq基因和mbp标签插入质粒pet28a和petduet-1中,蛋白表达后使用超声破碎仪破碎细胞,离心收取蛋白,纯化后进行体外催化。本发明使用的克隆菌株为大肠杆菌dh5α,表达菌株为大肠杆菌bl21(de3)和rosetta(de3)。
可溶性表达novq蛋白的菌株构建方法如下:
(1)在ncbi(nationalcenterforbiotechnologyinformation)中查找mbp的序列,去掉终止密码子,利用pcr扩增反应在mbp两端加上ncoi和hindiii两个酶切位点;保留终止密码子,利用pcr扩增反应在mbp两端加上ndei和kpni两个酶切位点。使用限制性内切酶切割mbp片段,pet28a和petduet-1,清洁回收后利用t4连接酶将mbp片段和质粒连接起来,得到芳香族异戊烯基转移酶促溶表达载体pet28a-mbp和petduet-1-mbp。
(2)获取雪白色链霉菌总dna,设计引物,pcr扩增得到novq蛋白的开放阅读框,利用pcr扩增反应在novq两端加上hindiii和noti两个酶切位点;利用pcr扩增反应在novq两端加上ncoi和hindiii两个酶切位点。使用限制性内切酶切割novq片段,pet28a-mbp和petduet-1-mbp,清洁回收后利用t4连接酶将novq片段和质粒连接起来,得到芳香族异戊烯基转移酶促溶表达载体pet28a28a-mbp-novq和petduet-1-mbp-novq。
实施例5:一种获取芳香族异戊烯基转移酶的发酵和一步纯化方法
重组的大肠杆菌的构建方法,包括以下步骤:
在ncbi(nationalcenterforbiotechnologyinformation)中查找mbp的序列,去掉终止密码子,利用pcr扩增反应在mbp两端加上ncoi和hindiii两个酶切位点;保留终止密码子,利用pcr扩增反应在mbp两端加上ndei和kpni两个酶切位点。使用限制性内切酶切割mbp片段,pet28a和petduet-1,清洁回收后利用t4连接酶将mbp片段和质粒连接起来,得到芳香族异戊烯基转移酶促溶表达载体pet28a-mbp和petduet-1-mbp。
获取雪白色链霉菌总dna,设计引物,pcr扩增得到novq蛋白的开放阅读框,利用pcr扩增反应在novq两端加上hindiii和noti两个酶切位点;利用pcr扩增反应在novq两端加上ncoi和hindiii两个酶切位点。使用限制性内切酶切割novq片段,pet28a-mbp和petduet-1-mbp,清洁回收后利用t4连接酶将novq片段和质粒连接起来,得到芳香族异戊烯基转移酶促溶表达载体pet28a28a-mbp-novq和petduet-1-mbp-novq。
将pet28a-mbp-novq和petduet-1-mbp-novq导入dh5α中,扩增获取足量的表达载体,将其转入大肠杆菌bl21(de3)和rosetta(de3),得到可溶性芳香族异戊烯基转移酶表达菌株。
所述重组的大肠杆菌用于可溶性异戊烯基转移酶novq,包括以下步骤:
将可溶性芳香族异戊烯基转移酶表达菌株接入培养基中,然后将活化后的菌液接入新的培养基中;
在活化后的菌液中加入诱导剂,诱导结束后离心获取菌体,加入pbs缓冲液重悬菌体;
超声破碎细胞,离心除去沉淀,上清即为含有novq蛋白的细胞破碎液,将其一步纯化即可得到高纯度可溶性芳香族异戊烯基转移酶novq。
纯酶novq蛋白用于体外催化,底物维生素k3和dmapp溶于甲醇,反应结束后反应液冻干,用有机试剂萃取,结果使用hplc和质谱检测。
培养基为lb培养基,装液量为10%;培养条件为:37℃,摇床转速180-220rpm,活化培养时间16-18h;抗生素终浓度为:氨苄青霉素100μg/ml,卡那霉素50μg/ml。
菌液od达到0.6-0.8时加入诱导剂,诱导剂为iptg,终浓度为0.5mm;诱导发酵条件为:22℃,摇床转速180rpm,诱导时间3-4h;离心参数为6000~8000g,离心时间5~10min;pbs缓冲液的添加量200μl/ml菌体。
超声参数为:5s/3s,超声时间3-5min;离心参数为12000~15000g,离心时间15~20min;纯化使用的是ni-ntaresin和直链淀粉树脂柱。
维生素k2终浓度为0.3mm,dmapp终浓度为0.6mm,反应体系为400μl,反应温度为37℃,反应时间为24h;萃取试剂为甲醇,固液比为1:5,萃取温度为28℃,摇床转速为250rpm;hplc流动相为甲醇:二氯甲烷(6:1)。
实施例6:一种获取芳香族异戊烯基转移酶的发酵和一步纯化方法
通过pcr扩增的方法从雪白色链霉菌(streptomycesniveus)中获取novq基因并在其n端添加tev酶切位点,然后通过酶切连接的方法将novq基因和mbp标签插入质粒pet28a和petduet-1中,蛋白表达后使用超声破碎仪破碎细胞,离心收取蛋白,纯化后进行体外催化。本发明使用的克隆菌株为大肠杆菌dh5α,表达菌株为大肠杆菌bl21(de3)和rosetta(de3)。
可溶性表达novq蛋白的菌株构建方法具体如下:
(1)在ncbi(nationalcenterforbiotechnologyinformation)中查找mbp的序列,去掉终止密码子,利用pcr扩增反应在mbp两端加上ncoi和hindiii两个酶切位点;保留终止密码子,利用pcr扩增反应在mbp两端加上ndei和kpni两个酶切位点。使用限制性内切酶切割mbp片段,pet28a和petduet-1,清洁回收后利用t4连接酶将mbp片段和质粒连接起来,得到芳香族异戊烯基转移酶促溶表达载体pet28a-mbp和petduet-1-mbp。
(2)获取雪白色链霉菌总dna,设计引物,pcr扩增得到novq蛋白的开放阅读框,利用pcr扩增反应在novq两端加上hindiii和noti两个酶切位点;利用pcr扩增反应在novq两端加上ncoi和hindiii两个酶切位点。使用限制性内切酶切割novq片段,pet28a-mbp和petduet-1-mbp,清洁回收后利用t4连接酶将novq片段和质粒连接起来,得到芳香族异戊烯基转移酶促溶表达载体pet28a28a-mbp-novq和petduet-1-mbp-novq。
(3)将pet28a-mbp-novq和petduet-1-mbp-novq导入dh5α中,扩增获取足量的表达载体,将其转入大肠杆菌bl21(de3)和rosetta(de3),得到可溶性芳香族异戊烯基转移酶表达菌株。
可溶性异戊烯基转移酶novq的表达及应用,包括以下步骤:
(1)将可溶性芳香族异戊烯基转移酶表达菌株接入培养基中,然后将活化后的菌液接入新的培养基中;
(2)在活化后的菌液中加入诱导剂,诱导结束后离心获取菌体,加入pbs缓冲液重悬菌体;
(3)超声破碎细胞,离心除去沉淀,上清即为含有novq蛋白的细胞破碎液,将其一步纯化即可得到高纯度可溶性芳香族异戊烯基转移酶novq。
(4)纯酶novq蛋白用于体外催化,底物维生素k3和dmapp溶于甲醇,反应结束后反应液冻干,用有机试剂萃取,结果使用hplc和质谱检测。
优选地,步骤(1)中的培养基为lb培养基,装液量为10%;培养条件为:37℃,摇床转速180-220rpm,活化培养时间16-18h;抗生素终浓度为:氨苄青霉素100μg/ml,卡那霉素50μg/ml。
优选地,步骤(2)中菌液od达到0.6-0.8时加入诱导剂,诱导剂为iptg,终浓度为0.5mm;诱导发酵条件为:22℃,摇床转速180rpm,诱导时间3-4h;离心参数为6000~8000g,离心时间5~10min;pbs缓冲液的添加量200μl/ml菌体。
优选地,步骤(3)中超声参数为:5s/3s,超声时间3-5min;离心参数为12000~15000g,离心时间15~20min;纯化使用的是ni-ntaresin和直链淀粉树脂柱。
优选地,步骤(4)维生素k2终浓度为0.3mm,dmapp终浓度为0.6mm,反应体系为400μl,反应温度为37℃,反应时间为24h;萃取试剂为甲醇,固液比为1:5,萃取温度为28℃,摇床转速为250rpm;hplc流动相为甲醇:二氯甲烷(6:1)。
本发明利用麦芽糖结合蛋白mbp作为融合和共表达标签,能使原本在大肠杆菌体内以包涵体形式存在的novq蛋白转化为可溶性的novq蛋白,其活力也有所提高。通过添加mbp标签,纯化步骤得到了简化,使用与tev蛋白酶酶切相结合的一步纯化方法,大大增加了纯化效率,有广泛的应用前景。此外,利用维生素k3为底物生产维生素k2工艺过程简易,对体内实验和工业化规模生产有一定的意义和价值。
实施例7:一种获取芳香族异戊烯基转移酶的发酵和一步纯化方法
一种表达芳香族异戊烯基转移酶的方法,包括下列步骤:
步骤1:根据ncbi中查找到的mbp的序列,去掉终止密码子,在两端引入ncoi和hindiii两个酶切位点,设计得到引物,然后进行pcr扩增得到第一mbp片段;
步骤2:根据ncbi中查找到的mbp的序列,保留终止密码子,在两端引入ndei和kpni两个酶切位点,设计得到引物,然后进行pcr扩增得到第二mbp片段;
步骤3:使用限制性内切酶切割第一mbp片段和质粒pet28a,清洁回收后利用t4连接酶将第一mbp片段和质粒pet28a连接起来,得到载体pet28a-mbp;使用限制性内切酶切割第二mbp片段和质粒petduet-1,清洁回收后利用t4连接酶将第二mbp片段和质粒petduet-1连接起来,得到载体petduet-1-mbp;
步骤4:以链霉菌总dna为模板,使用引物f3和r3进行pcr扩增,经pcr纯化试剂盒纯化后得到片段3;以链霉菌总dna为模板,使用引物f4和r4进行pcr扩增,经pcr纯化试剂盒纯化后得到片段4;
f3:5’cccaagcttgagaatctttatttccaaggttctatgcccgcactcccgatgaat-3’;
r3:5’ataagaatgcggccgctcagtggtggtggtggtggtgtcgggcacctccggtgatc-3’;
f4:5’-catgccatggatgcccgcactcccgatgaat-3’;
r4:5’-cccaagctttcatcgggcacctccggtgatc-3’;
步骤5:使用限制性内切酶切割片段3和载体pet28a-mbp,清洁回收后利用t4连接酶将片段3和载体pet28a-mbp连接起来,得到芳香族异戊烯基转移酶促溶表达载体pet28a-mbp-novq;使用限制性内切酶切割片段4和载体petduet-1-mbp,清洁回收后利用t4连接酶将片段4和载体petduet-1-mbp连接起来,得到芳香族异戊烯基转移酶促溶表达载体petduet-1-mbp-novq;
步骤6:将芳香族异戊烯基转移酶促溶表达载体pet28a-mbp-novq转化入大肠杆菌dh5α中,扩增获取表达载体,将所述表达载体转入大肠杆菌bl21(de3),得到可溶性芳香族异戊烯基转移酶表达菌株大肠杆菌bl21(de3)-pet28a-mbp-novq,将芳香族异戊烯基转移酶促溶表达载体petduet-1-mbp-novq导入大肠杆菌dh5α中,扩增获取表达载体,将所述表达载体转入大肠杆菌rosetta(de3),得到第二种可溶性芳香族异戊烯基转移酶表达菌株大肠杆菌rosetta(de3)-petduet-1-mbp-novq;
步骤7:将大肠杆菌bl21(de3)-pet28a-mbp-novq单菌落,接种于lb液体培养基,培养得到活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液;吸取活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液接种于新的lb液体培养基中,培养至菌液od值为0.6,得到大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液;向所述大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液中加入异丙基硫代半乳糖苷,振荡培养3h后对发酵液离心除去培养基,得到大肠杆菌bl21(de3)-pet28a-mbp-novq菌体;向所述bl21(de3)-pet28a-mbp-novq菌体中加入pbs缓冲液,重悬菌体,然后使用超声破碎仪破碎细胞,得到的破碎液离心20min弃沉淀,得到的上清液即为含有mbp-novq融合蛋白的溶液;使用直链淀粉柱纯化含有mbp-novq融合蛋白的溶液,即得mbp-novq纯酶溶液;
步骤8:将大肠杆菌rosetta(de3)-petduet-1-mbp-novq单菌落,接种于lb液体培养基,培养得到活化后的大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌液;吸取活化后的大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌液接种于新的lb液体培养基中,培养至菌液od值为0.6-0.8,得到大肠杆菌rosetta(de3)-petduet-1-mbp-novq诱导前菌液;向所述大肠杆菌rosetta(de3)-petduet-1-mbp-novq诱导前菌液中加入异丙基硫代半乳糖苷,振荡培养3-4h后对发酵液离心除去培养基,得到大肠杆菌rosetta(de3)-petduet-1-mbp-novq菌体;向所述rosetta(de3)-petduet-1-mbp-novq菌体中加入pbs缓冲液,重悬菌体,然后使用超声破碎仪破碎细胞,得到的破碎液离心弃沉淀,得到的上清液即为含有可溶性novq蛋白的溶液;使用ni-ntresin纯化含有novq蛋白的溶液,即得novq纯酶溶液;
步骤9:将大肠杆菌bl21(de3)-pet28a-mbp-novq单菌落,接种于lb液体培养基,培养得到活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液;吸取活化后的大肠杆菌bl21(de3)-pet28a-mbp-novq菌液接种于新的lb液体培养基中,培养至菌液od值为0.6,得到大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液;向所述大肠杆菌bl21(de3)-pet28a-mbp-novq诱导前菌液中加入异丙基硫代半乳糖苷,振荡培养3h后对发酵液离心除去培养基,得到大肠杆菌bl21(de3)-pet28a-mbp-novq菌体;向所述bl21(de3)-pet28a-mbp-novq菌体中加入pbs缓冲液,重悬菌体,然后使用超声破碎仪破碎细胞,得到的破碎液离心20min弃沉淀,得到的上清液即为含有mbp-novq融合蛋白的溶液;使用直链淀粉柱纯化含有mbp-novq融合蛋白的溶液,且在纯化过程中加入tev蛋白酶,得到酶切过的novq纯酶溶液。
优选的技术方案为:在步骤1中,根据ncbi中查找到的mbp,去掉终止密码子,在两端引入ncoi和hindiii两个酶切位点,设计得到引物f1和r1;以pmbp质粒为模板,使用引物f1和r1进行pcr扩增,经pcr纯化试剂盒纯化后得到第一mbp片段;
f1:5’-catgccatgggccaaaattgaagaaggta-3’;
r1:5’-cccaagcttggggtacctcagctgcccgcattagtct-3’;
优选的技术方案为:在步骤1中,根据ncbi中查找到的mbp,保留终止密码子,在两端引入ndei和kpni两个酶切位点,设计得到引物f2和r2;以pmbp质粒为模板,使用f2和r2进行pcr扩增,经pcr纯化试剂盒纯化后得到第二mbp片段;
f2:5’-ggaattccatatggccaaaattgaagaaggta-3’;
r2:5’-ggggtacctcagctgcccgcattagtctgc-3’;
一种生产维生素k2的方法,将底物维生素k3和dmapp溶于甲醇,然后将mbp-novq纯酶溶液、novq纯酶溶液和酶切过的novq纯酶溶液中的至少一种加入,在温度条件为35-40℃条件下进行反应,反应结束后获得维生素k2;所述mbp-novq纯酶溶液、novq纯酶溶液和酶切过的novq纯酶溶液按照上述技术方案制得。
以上所述者仅为用以解释本发明之较佳实施例,并非企图具以对本发明做任何形式上之限制,是以,凡有在相同之发明精神下所作有关本发明之任何修饰或变更,皆仍应包括在本发明意图保护之范畴。
序列表
<110>中国科学院合肥物质科学研究院
<120>一种获取芳香族异戊烯基转移酶的发酵和一步纯化方法
<130>20190312
<160>8
<170>patentinversion3.3
<210>1
<211>29
<212>dna
<213>artificial
<223>f1
<400>1
catgccatgggccaaaattgaagaaggta29
<210>2
<211>37
<212>dna
<213>artificial
<223>r1
<400>2
cccaagcttggggtacctcagctgcccgcattagtct37
<210>3
<211>32
<212>dna
<213>artificial
<223>f2
<400>3
ggaattccatatggccaaaattgaagaaggta32
<210>4
<211>30
<212>dna
<213>artificial
<223>r2
<400>4
ggggtacctcagctgcccgcattagtctgc30
<210>5
<211>54
<212>dna
<213>artificial
<223>f3
<400>5
cccaagcttgagaatctttatttccaaggt30
tctatgcccgcactcccgatgaat54
<210>6
<211>56
<212>dna
<213>artificial
<223>r3
<400>6
ataagaatgcggccgctcagtggtggtggt30
ggtggtgtcgggcacctccggtgatc56
<210>7
<211>31
<212>dna
<213>artificial
<223>f4
<400>7
catgccatggatgcccgcactcccgatgaat31
<210>8
<211>31
<212>dna
<213>artificial
<223>r4
<400>8
cccaagctttcatcgggcacctccggtgatc
- 还没有人留言评论。精彩留言会获得点赞!