一种青年猪胰岛细胞培养基及其使用方法与流程
本发明属于动物胰岛细胞培养技术领域,具体涉及一种青年猪胰岛细胞培养基及其使用方法。
背景技术:
i型糖尿病是全世界公认最具威胁的慢性代谢疾病之一,其特点为选择性免疫介导破坏胰岛β细胞,使患者终身需要外源性胰岛素治疗。该疾病晚期爆发各种并发症,将导致患者生活及经济负担的极具加重和高死亡率。自从埃德蒙顿方案成功实施后,胰岛移植受到举世瞩目。在总结全球的胰岛移植研究成果基础后,促进移植方法和免疫抑制方案的改进,为i型糖尿病患者带来了希望。人类胰腺胰岛同种异体移植已经被证实是一种可行的治疗i型糖尿病的方法。移植之后可以改善和控制患者血糖,减少对胰岛素的需求,并降低低血糖症发生几率。但人胰岛来源之困难,胰岛分离纯化技术之不完善,存在疾病传播之风险,使得人胰岛移植有很大的局限性。
猪胰岛素和人胰岛素十分相似,并且血糖调定点相近,作为人体胰岛替代品十分适合。青年猪胰岛相较成体猪免疫源性低,β细胞有一定的分裂潜能;青年猪胰腺虽然未完全的发育成熟,但是和新生猪比较,青年猪的胰腺体积与重量等都更大,胰岛的α-gal抗原表达比较弱,胰岛的成熟度也相对较高,因此可以获得大量成熟的胰岛细胞。从生理生化特性上来说更适合作为人胰岛的替代品。
现今猪胰岛细胞培养均采用cmrl1066,rpmi等细胞培养基,培养3-5天,维持胰岛的生长或诱导其定向分化。但这些使用方法以及培养基总是存在着很多缺陷,如:培养后胰岛细胞数量不稳定,纯化后获得的有活性功能的胰岛细胞量各不相同(2000ieq/g-4000ieq/g),培养的胰岛细胞纯度也存在差别(70-90%);培养过程中胰岛细胞因快速凋亡而细胞大量丢失,尤其是β细胞。培养过程的长短也是难以选择,培养时间短β细胞不能发育成熟,培养时间长又会有大量胰岛细胞因凋亡而数量减少,并且由于β细胞的凋亡使同等数量下的胰岛细胞中胰岛素分泌量的减少(insulin/dna值为<49.00miu/g)。此外,随着培养时间的延长,胰岛细胞团更易破碎,从而形成更小的胰岛细胞团(直径<50um)更易于凋亡,难以继续培养。时至今日也没有能够提供高纯度的有活性的并且稳定产量的青年猪胰岛细胞培养方法以及培养基,所以如何建立最优化的培养基成分以及培养方式成为青年猪胰岛细胞培养最迫切的问题。
技术实现要素:
本发明的目的是为临床异种移植提供一种高效且稳定的青年猪胰岛细胞团培养体系。
青年猪胰腺相比新生猪胰腺更加成熟,具有较成熟外分泌腺,从而导致分离培养过程中分泌丰富的消化酶,造成胰岛细胞损伤;因此在培养的过程中需添加酶类抑制剂,防止胰岛细胞团被消化酶等破坏。虽然,青年猪胰岛细胞团与新生猪胰岛细胞团相比,其得率及功能更具有优势,但由于青年猪胰岛团本身较成熟、体积相对较大,因此缺氧耐受能力要比新生猪胰岛细胞团差,故在后期培养中考虑额外添加抗氧化剂,以清除由于缺氧产生的过氧、超氧化物对细胞造成的损伤,以提高耐缺氧能力,减少因缺氧而引起的细胞损伤。
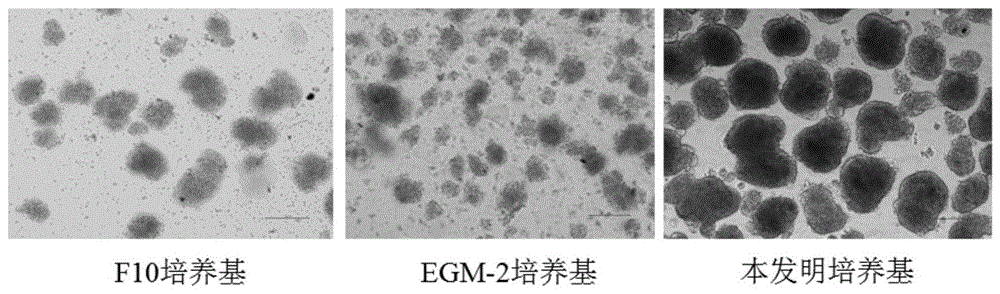
持续培养发现f10(含有尼克酰胺、谷氨酰胺等)、egm-2(含有丙酮酸钠、尼克酰胺等)和rpmi1640培养基分别培养青年猪胰岛细胞,其效果均未达到预期。培养3天胰岛细胞团无法成膜,且单细胞多,无法培养至第5天使其β细胞成熟(见图1)。
本发明的培养基是基础培养基m199中含有谷胱甘肽1-50mm,谷氨酰胺1-50mm,胰岛素转铁蛋白(its)0.01-1%,尼克酰胺1-50mm,水溶性维生素e0.1-20μm,肝素50-100u/l,4-(2-氨乙基)苯磺酰氟盐酸盐0.01-0.5mm,艾塞那肽0.01-0.1μm。
优选:是基本培养基中含有谷胱甘肽1-25mm,谷氨酰胺1-25mm,its0.01-0.5%,尼克酰胺1-25mm,水溶性维生素e0.1-10μm,肝素50-100u/l,4-(2-氨乙基)苯磺酰氟盐酸盐0.01-0.25mm,艾塞那肽0.05-0.1μm。
进一步优选:是基本培养基中含有谷胱甘肽2mm,谷氨酰胺2mm,its0.06%,尼克酰胺2mm,水溶性维生素e0.1μm,肝素100u/l,4-(2-氨乙基)苯磺酰氟盐酸盐0.2mm,艾塞那肽0.1μm。
进一步的,基本培养基m199中还含有猪血清,优选10%体积的猪血清。
所述的青年猪胰岛细胞培养基的使用方法:青年猪胰岛细胞在培养基中的接种浓度为5000-10000ieq/25-30ml,在37℃、5%co2、95%空气培养箱内培养。培养时细胞在第一天更换培养基和培养皿,此后每隔一天更换一次,培养至5-7天。
本发明的有益效果(以下数据来源于大量试验结果,并具有统计学意义):
同样胰岛当量(1×104ieq)培养5天,本发明培养基培养的活性胰岛细胞活率达到93.48±1.25%,高于一般培养(1640培养基)的胰岛细胞活率70.03±2.36%,且本发明培养基培养5天的胰岛细胞团颗粒直径大多大于100μm,细胞团包膜完整,破碎胰岛细胞团(直径<50μm)少于一般培养基(1640培养基)培养5天的胰岛细胞,更适用于移植。培养5天获得的胰岛细胞对葡萄糖刺激具有敏感的应答能力,其si指数为一般培养基(1640培养基)的2倍左右,并且培养5天的胰岛细胞中β细胞比例为80.13±1.69%,本发明培养7天的β细胞比例为85.96±1.56%,较一般培养(1640培养基)的比例高,证明本发明培养的胰岛细胞功能好,胰岛素分泌量明显增多(p<0.05),弥补了一般培养(1640培养基)的胰岛细胞因凋亡导致胰岛素分泌下降的不足。
本发明的优化培养基降低了细胞凋亡率,增加了细胞回收率,减少细胞凋亡数量,使培养后胰岛细胞团破碎减少,包膜更完整,胰岛较短时间培养的更成熟,相同胰岛细胞的胰岛素分泌量显著提升,建立了稳定高效,细胞获得量大,细胞高活性,高存活度,且细胞团大小合适的青年猪胰岛细胞培养体系。
本发明优势总结如下:
1、细胞凋亡下降,回收率增加;
2、胰岛细胞团破碎减少,细胞团包膜完整,更适于移植;
3、胰岛β细胞活力增加;
4、相同量的胰岛细胞胰岛素分泌量增加;
5、培养细胞有敏感葡萄糖刺激应答,功能比一般培养的胰岛细胞要成熟。
附图说明
图1为普通光学显微镜下检测f10培养基、egm-2培养基和本发明培养基分别培养3天的胰岛细胞团显微镜图像,放大倍数100×,图中标尺长度为200μm;
图2为普通光学显微镜下检测不同浓度的本发明培养基实施案例1,2,3分别培养3天的胰岛细胞团显微镜图像,放大倍数100×;
图3为dtz检测普通培养基(1640)和本发明培养基分别培养5天和7天的胰岛细胞团显微镜图像,放大倍数100×,图中标尺长度为200μm;
图4为ao/eb检测普通培养基(1640)和本发明培养基分别培养5天和7天的胰岛细胞团显微镜图像,放大倍数40×,图中标尺长度为400μm;
图5为对比案例1中培养5天胰岛细胞活率对比;
图6为对比案例2中培养5天胰岛细胞活率对比。
具体实施方式
以下结合实施例旨在进一步说明,而非限制本发明。
材料与试剂:50ml离心管(捷特)、15ml离心管(捷特)、10ml注射器、培养箱(赛默飞)、1640培养基、m199培养基、谷氨酰胺、谷胱甘肽、猪血清、hbss、抗生素(life)、dtz、ao/eb染色液、annexinv/pi试剂盒(life)、0.22μm滤器(merckmillipore)等。
上述试剂耗材无特殊说明,均购自sigma公司。
实施案例1,本发明培养基及培养方法试验
本发明于青年猪取胰腺术前腹腔注射10iu/kg肝素钠,本发明针对已分离纯化的青年猪胰岛细胞在培养基中的接种浓度为5000-10000ieq/25-30ml,培养基(m199培养基中添加谷胱甘肽25mm,谷氨酰胺25mm,its0.5%,尼克酰胺20mm,水溶性维生素e9μm,肝素60u/l,4-(2-氨乙基)苯磺酰氟盐酸盐0.25mm,艾塞那肽0.1μm。以及占培养基体积百分比10%的猪血清)于15cm不贴壁培养皿中,放置于37℃、5%co2、95%空气培养箱内培养,制备的细胞在第一天更换培养皿和培养基,此后每隔一天更换一次,于培养第5天和第7天收集细胞计数并做相关检测。
实施案例2
本发明于青年猪取胰腺术前腹腔注射10iu/kg肝素钠,本发明针对已分离纯化的青年猪胰岛细胞在培养基中的接种浓度为5000-10000ieq/25-30ml,培养基(m199培养基中添加谷胱甘肽50mm,谷氨酰胺50mm,its1%,尼克酰胺45mm,水溶性维生素e20μm,肝素50u/l,4-(2-氨乙基)苯磺酰氟盐酸盐0.01mm,艾塞那肽0.1μm。以及占培养基体积百分比10%的猪血清)于15cm不贴壁培养皿中,放置于37℃、5%co2、95%空气培养箱内培养,制备的细胞在第一天更换培养皿和培养基,此后每隔一天更换一次,于培养第5天和第7天收集细胞计数并做相关检测。
实施案例3
本发明于青年猪取胰腺术前腹腔注射10iu/kg肝素钠,本发明针对已分离纯化的青年猪胰岛细胞在培养基中的接种浓度为5000-10000ieq/25-30ml,培养基(m199培养基中添加谷胱甘肽2mm,谷氨酰胺2mm,its0.06%,尼克酰胺2mm,水溶性维生素e0.1μm,肝素100u/l,4-(2-氨乙基)苯磺酰氟盐酸盐0.2mm,艾塞那肽0.1μm以及占培养基体积百分比10%的猪血清)于15cm不贴壁培养皿中,放置于37℃、5%co2、95%空气培养箱内培养,制备的细胞在第一天更换培养皿和培养基,此后每隔一天更换一次,于培养第5天和第7天收集细胞计数并做相关检测。
结果:
本发明不同浓度培养基在3个实施案例中表现出了较好的培养效果(见图2)。胰岛细胞团培养3天后,细胞团成膜较好,单细胞少,细胞团直径约200μm。案例1和案例3中细胞团比案例2中的细胞团大,说明较高浓度的蛋白酶抑制剂对细胞团的成膜具有一定的保护作用。
实施例4,本发明于一般培养基(rpmi1640)培养效果对比,结果见表1。
实验检测手段:
细胞团计数:收集培养细胞,1000rpm离心1分钟,弃上清,生理盐水重悬,定容至50ml,取50μl悬液,双硫腙(dtz)染色,显微镜下计数,其数量乘以1000倍,即为总数。
活死细胞比例:取1500-2000ieq胰岛细胞团acutase酶消化为单个细胞,annexinv/pi染色后通过流式细胞仪对活细胞和死细胞计数。
胰岛素测量:市售化学发光试剂盒。
β细胞活力检测:取1500-2000ieq胰岛细胞acutase酶消化为单个细胞,newportgreen特异染β细胞,过流式细胞仪检测活性β细胞。
本发明实施案例3培养5天活性胰岛细胞活率达到93.48±1.25%,比一般培养的胰岛细胞(<75%)高;本发明培养7天活性胰岛细胞活率达到92.30±0.56%,远远高于一般培养基(<35%);本发明培养5天β细胞所占百分比80.13±1.69%,也比一般培养基(<76%)高;本发明培养7天β细胞所占百分比达到85.96±1.56%,比一般培养基(<35%)高;此外,本发明培养5天的si葡萄糖刺激指数(3.74±1.35)也远高于一般培养基(2.13±1.11)。
且本发明培养基培养5天的胰岛细胞团颗粒直径大多大于100μm,细胞团包膜完整,破碎胰岛细胞团(直径<50μm)少于一般培养基培养5天的胰岛细胞,更适合用于移植。如图3,将细胞同时用吖啶橙(ao)和溴化乙锭(eb)染色,活细胞在荧光显微镜488nm激发光下呈绿色荧光,死细胞在546nm激发光下呈红色荧光,图片为胰岛细胞分别在普通培养基与本发明改良培养基中培养5天和7天,放大40×的图片,由图4中可以看出,本发明培养基细胞团周边包膜完整,细胞团大小均匀,大部分直径在100-200nm,死细胞极少,叠加图片几乎看不到死细胞;普通培养基细胞团大小分布不均,包膜不完整,细胞团边缘不平滑,容易破碎为单个细胞而死亡。
表1胰岛细胞活率
表2β细胞含量
表3si值
对比案例1
针对已分离纯化的青年猪胰岛细胞在培养基中的接种浓度为5000-10000ieq/25-30ml,培养基(m199培养基中添加谷胱甘肽2mm,谷氨酰胺2mm,its0.06%,尼克酰胺2mm,水溶性维生素e0.1μm,肝素100u/l,4-(2-氨乙基)苯磺酰氟盐酸盐0.2mm,艾塞那肽0.1μm,抗坏血酸1mm以及占培养基体积百分比10%的猪血清)于15cm不贴壁培养皿中,放置于37℃、5%co2、95%空气培养箱内培养,制备的细胞在第一天更换培养皿和培养基,此后每隔一天更换一次,于培养第5天收集细胞计数并做相关检测。
结果:
结果如图5所示,使用本发明实施案例3培养基培养青年猪胰岛细胞至第5天活率为93.48±1.25%,相比于添加抗坏血酸组活率85.30±1.24%,有显著性差异。表明在长期培养过程中,本发明培养基各配合组分效果较优。
对比案例2
针对已分离纯化的青年猪胰岛细胞在培养基中的接种浓度为5000-10000ieq/25-30ml,培养基(m199培养基中添加谷胱甘肽2mm,谷氨酰胺2mm,its0.06%,尼克酰胺2mm,水溶性维生素e0.1μm,肝素100u/l,4-(2-氨乙基)苯磺酰氟盐酸盐0.2mm,艾塞那肽0.1μm,n-乙酰半胱氨酸3mm以及占培养基体积百分比10%的猪血清)于15cm不贴壁培养皿中,放置于37℃、5%co2、95%空气培养箱内培养,制备的细胞在第一天更换培养皿和培养基,此后每隔一天更换一次,于培养第5天收集细胞计数并做相关检测。
结果:
结果如图6所示,使用本发明实施案例3培养基培养青年猪胰岛细胞至第5天活率为93.48±1.25%,相比于添加n-乙酰半胱氨酸活率76.30±2.62%,有显著性差异。表明在长期培养过程中,本发明培养基各配合组分效果较优。
- 还没有人留言评论。精彩留言会获得点赞!