农药控释包膜材料、纳米载药胶束及其制备方法与流程
本发明属于农业农药制剂技术领域,具体涉及一种农药控释包膜材料、纳米载药胶束及其制备方法。
背景技术:
微胶囊缓释性农药因其具有高效、稳定、省工等优点,成为农药发展的重要方向之一。目前,农药的微球化有两种实现方法:在制备过程中或在微球形成后的负载。大多在制备过程中完成负载,即先使药物与囊壁材料形成均相混合物,然后再制成载药微球,这种方法的好处在于能达到较高的载药量和包封率,但制备过程复杂,得到的载药微球容易团聚;微球形成后的负载即将预制好的微球浸润到药物的高浓度溶液中,使药物吸收并渗透到微球表面或内部,但负载能力低。因此,有必要研究一种制备方法简单、负载率、包埋率高、稳定性好的农药控释制剂,更好地实现科学用药。
欧敏华(壳聚糖空心微胶囊的制备及其负载农药的特性研究[d].绵阳:西南科技大学,2017)使用模板法制备交联壳聚糖空心微胶囊,再以吡虫啉作为模型药物,然后使其通过吸附与渗透的方式进入壳聚糖微胶囊中,以得到吡虫啉-壳聚糖农药微胶囊,同时,壳聚糖空心微胶囊与吡虫啉之间存在氢键作用,氢键键合作用增加吡虫啉与微胶囊的附着力,延长微胶囊的缓释时间。该技术方案利用戊二醛对壳聚糖进行交联,交联后的壳聚糖水溶性如何并不能得知(实验中也并未记录壳聚糖分子量等参数,而低分子量的壳聚糖不具备两亲性特性),而亲水性影响着农药是否能以环保型水性制剂使用,从而影响农药实际使用效果;而且,该壳聚糖空心微胶囊以1~2μmsps微球为模板形成,其粒径大小是否达到纳米级别也不得而知。同时,壳聚糖空心微胶囊为单层空心微胶囊,通过搅拌使农药分子负载到微胶囊表面和内面,该空心微胶囊仅仅依靠氢键实现药物缓释,而对无氢键作用的药物则难以起到缓释作用,因此在载药种类方面较为单一(如对苦参碱载药量极微),对药物的包埋率也不确定;而且空心微胶囊的制备过程复杂、步骤繁琐;此外,该方案制备的吡虫啉-壳聚糖载药微胶囊在弱碱性(ph7.0~8.0)环境中的累积释放率比其在中性环境、弱酸性环境中要高,当使用环境的ph呈酸性或弱酸性时,该载药微胶囊的释药量则会大大受限。
技术实现要素:
本发明的第一个目的在于提供一种农药控释包膜材料,以解决上述技术问题中的至少一个。
本发明的第二个目的在于提供上述农药控释包膜材料的制备方法,以解决上述技术问题中的至少一个。
本发明的第三个目的在于提供一种纳米载药胶束,以解决上述技术问题中的至少一个。
本发明的第四个目的在于提供上述纳米载药胶束的制备方法,以解决上述技术问题中的至少一个。
根据本发明的一个方面,提供了一种农药控释包膜材料,为氨基酸或其衍生物、羧基化聚乙二醇单甲醚与壳聚糖中的氨基进行酰胺化反应从而制备得到由氨基酸单元、羧酸化聚乙二醇单甲醚单元和壳聚糖单元组成的水溶性好的两亲性带正电的壳聚糖衍生物,该壳聚糖衍生物亲水基团接枝率为17.1%,疏水基团接枝率为15.75%,其结构式如式(i)所示:
其中,a、b、c、n均为≥1的自然数;
r1、r2、r3分别为-h、-ch3、-ch2-ch-(ch3)2、-ch2-c6h5、-co-ch3、-ch(ch3)-ch2-ch3、-c8nh6、-ch2-c8nh6、-(ch2)2-s-ch3中的一种。
在一些实施方式中,氨基酸为n-乙酰-d-甲硫氨基酸、n-乙酰-d-苯丙氨酸、n-乙酰-l-亮氨酸、n-乙酰甘氨酸、脯氨酸、n-乙酰-l-色氨酸中的至少一种。
根据本发明的另一个方面,提供了上述农药控释包膜材料的制备方法,具体步骤如下:
(1)将壳聚糖配置成溶度为2.0~5.0mg/ml的壳聚糖乙酸水溶液;
(2)将活化剂、氨基酸或其衍生物、羧基化聚乙二醇单甲醚(opeg)及缩合剂依次加入壳聚糖乙酸水溶液中,室温(25~30℃)下反应24~36h,将反应产物用水透析3~5天,然后冷冻干燥即得。
上述制备方法所制得的农药控释包膜材料的亲水基团接枝率为17.1%,疏水基团接枝率为15.75%,由此,该农药控释包膜材料所形成胶束的粒径大小由亲水基团主导,而且亲水基团分子量越大,所形成的胶束粒径越小;同时,亲水基团作为胶束外壳用于增强胶束水溶性以及保持胶束在水溶液中的稳定性,疏水基团作为胶束的疏水内核,可与疏水性农药分子发生相互作用,进而形成疏水微环境并将农药分子包埋其中;而且,由于包膜材料亲水基团接枝率高于疏水基团接枝率,当载药率为3~30%时,其所形成的胶束仍近似球形,对农药分子的包埋效果好。
上述制备方法的反应过程如下式所示:
其中,a、b、c、n均为≥1的自然数;r1、r2、r3分别为-h、-ch3、-ch(ch3)2、-ch2-c6h5、-co-ch3、-ch(ch3)-ch2-ch3、-c8nh6、-ch2-c6h4-oh、-(ch2)-s-ch3中的一种。
其中,乙酸水溶液的体积浓度为1~2%。
在一些实施方式中,活化剂为1-羟基-苯并三唑(hobt)、苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸盐(hbtu)、o-苯并三氮唑-n,n,n',n'-四甲基脲四氟硼酸(tbtu)中的至少一种,活化剂的用量为壳聚糖乙酸水溶液总质量的1%~2%。本发明中,活化剂的作用是活化羧酸,增强反应速度,并且活化剂可以抑制副反应的发生,提高目标产物的产率。其中,hbtu、tbtu和hobt是脲离子型多肽缩合剂,是一种活化羧酸的多功能试剂。它们一步就可以使氨基酸与胺反应结合,不需要预先活化酸类,它们的优点包括快速的原位活化,较小的副反应,稳定性好,溶解性好等。
在一些实施方式中,缩合剂优选为1-(3-二甲胺基丙基)-3-乙基碳二亚胺(edc)、二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dic)中的至少一种,缩合剂的用量为壳聚糖乙酸水溶液总质量的1%~2%。此处的缩合剂是指缩合反应中所加的反应辅助剂,一般起催化作用。其中,edc、dcc、dic廉价,固体状,方便使用,副产物比较容易被去除,并且edc、dcc、dic适合羧酸和胺的酰胺缩合反应。
在一些实施方式中,氨基酸为n-乙酰-d-甲硫氨基酸、n-乙酰-d-苯丙氨酸、n-乙酰-l-亮氨酸、n-乙酰甘氨酸、脯氨酸、n-乙酰-l-色氨酸中的至少一种,氨基酸或其衍生物与羧基化聚乙二醇单甲醚的摩尔比为1:2~5:2。
本发明中选取的氨基酸都是微溶于水,或者溶于水,基团本身没有α-氨基(-nh2),或者额外的羟基(oh),目的是为了防止氨基酸或其衍生物自身的缩合反应的进行,减少副反应的发生,尽量使氨基酸或其衍生物的羧基和壳聚糖的氨基(-nh2)发生缩合反应。
在一些实施方式中,壳聚糖的粘均分子量为3.0×103~2.5×105、脱乙酰度≥90%。壳聚糖粘均分子量选择3.0×103~2.5×105,是因为分子量过大比较难溶解,制备后容易形成二级胶束或多层囊泡;而分子量过小不易与原料分离。而脱乙酰度过低会导致接枝率下降,壳聚糖的溶解性较差。
在一些实施方式中,步骤(2)中透析时透析截留分子量为2000-15000。截留分子量为2000~15000,目的在于除去未反应的原料,另外透析时透析袋的截留分子量应小于参与反应的壳聚糖的分子量。
在一些实施方式中,羧基化聚乙二醇单甲醚通过如下方法制备而成:将聚乙二醇单甲醚与氧化剂混合配置成水溶液,在冰水浴中反应40~60min,然后调节ph为1~2,用有机溶剂萃取,将萃取液减压蒸馏后,放入乙醇中在-20℃中重结晶12~24h,最后真空干燥即得;该过程反应式如下:
其中,n为≥1的自然数。
其中,聚乙二醇单甲醚的分子当量优选为500、750、1000、2000、5000中的至少一种。
其中,聚乙二醇单甲醚水溶液的溶度为0.05~0.1g/ml。
其中,氧化剂优选为2,2,6,6-四甲基哌啶氮氧化物(tempo)、亚硝酸叔丁酯(hbr/t-buono)、甲基吡啶氮氧化物、重铬酸钾、酸性高锰酸钾中的至少一种,氧化剂的量为壳聚糖乙酸水溶液总质量的1%~2%。
其中,有机溶剂优选为氯仿、乙酸乙酯、四氢呋喃、n,n-二甲基甲酰胺中的至少一种。
本发明的农药控释包膜材料在壳聚糖分子链上接枝疏水基团与亲水基团,通过活化剂1-羟基-苯并三唑(hobt)、苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸盐(hbtu)或o-苯并三氮唑-n,n,n',n'-四甲基脲四氟硼酸(tbtu)活化c2位上的氨基,然后与羧酸反应,通过缩合剂1-(3-二甲胺基丙基)-3-乙基碳二亚胺(edc)、二环己基碳二亚胺(dcc)或二异丙基碳二亚胺(dic)脱去分子水进行接枝;同时,由于疏水基团与亲水基团的引入,可在很大程度上削弱壳聚糖分子间的氢键作用,从而增大改性后壳聚糖的水溶性。
本发明所公开的农药控释包膜材料采用一锅法反应将亲水性基团(即不同分子量的聚乙二醇单甲醚)和疏水性基团(即具有短链烷基的水溶性氨基酸)同时接枝到壳聚糖的分子链上,壳聚糖改性的亲水性侧链及核心组装成纳米胶束,作为纳米胶束外壳,用于增强纳米胶束水溶性以及保持纳米胶束在水溶液中的稳定性;疏水性基团作为胶束的疏水内核,可与疏水性农药分子发生相互作用,进而形成疏水微环境并将农药分子包埋其中,通过疏水作用将疏水性药物自组装成靶向载药纳米粒子,不仅能包埋多种农药、适用性广、提高农药的生物利用率,延长其作用时间以及生物利用率。
此外,本发明所公开的农药控释包膜材料,其形成胶束的粒径由亲水基团主导,并且亲水基团分子量越大,所形成的胶束粒径越小;而且其制备工艺简单、操作方便。本申请研究思路具有创新性,并且对壳聚糖的应用研究也具有重要的科研意义和经济意义。
根据本发明的另一个方面,提供了一种纳米载药胶束,该胶束以本发明的农药控释包膜材料为壁材,以农药为芯材,采用超声波自组装的方法,通过静电吸附作用使芯材包埋于壁材内,即得。
具体地,该自组装纳米载药胶束所形成的颗粒较为规整、近似球形,且分布较为均匀、表面平滑,未发生明显聚集的现象,其壁材与芯材质量比为1:1~5:1,载药率为3~30%、包埋率为40~80%,粒径范围为100nm~2500nm,zeta电位+25.41±3.54,对一些植物致病菌,如香蕉枯萎病致病菌(尖孢镰刀菌)显示出良好的抑菌活性。
在一些实施方式中,农药优选多杀菌素(ssd)、阿维菌素、百里香酚、氟吡菌酰胺、高效氟氯氰菊酯、甲氰菊酯、联苯菊酯、噻虫胺、噻唑膦、吡虫啉、虫螨腈和氯虫苯甲酰胺的至少一种。
根据本发明的另一个方面,提供了上述纳米载药胶束的制备方法:
将农药控释包膜材料溶于去离子水,超声处理(输出功率100w,间歇脉冲工作方式:脉冲宽度2.0s、间歇时间2.0s),得到透明的纳米胶束水溶液,将农药原药溶解后加入上述纳米胶束水溶液中,用去离子水透析,最后超声处理,即得纳米载药胶束。
在纳米载药胶束的制备过程中,胶束水溶液的ph值为中性或弱酸性。由此,ph偏碱性环境会造成壳聚糖的析出,不利于胶束形成;而壳聚糖本身只能在弱酸环境下溶解,强酸性下会发生降解。因此胶束水溶液的ph值选择中性或弱酸性。
具体地,农药控释包膜材料用去离子水溶解,然后用超声波仪超声处理5~10min,连续处理2~4次,每次间隔时长5min,得到透明的纳米胶束水溶液,将农药原药溶解,加入上述纳米胶束水溶液中,以100~150r/min速率搅拌2~4h,搅拌速率为100~150r/min,然后透析(透析截留分子量3000)12~16h,以除去有机溶剂,最后超声处理5~10min(输出功率100w,间歇脉冲工作方式:脉冲宽度2.0s、间歇时间2.0s),连续处理2~4次,即得。
其中,农药质量浓度优选为2~10mg/ml,可选用甲苯、二甲苯、甲醇、乙醇、甲乙酮、丙酮、乙酸乙酯、乙醚中的一种或几种溶解。
本发明中的术语“一锅法”意指:在一个接枝反应过程中,可以同时接枝两个或者多个基团,不需要中间体的分离。一锅法反应中的多步反应可以从相对简单易得的原料出发,不经中间体的分离,直接获得结构复杂的分子,也就是一个步骤就产生多步反应。这样的反应在经济上和环境上较为友好。
本发明所公开的纳米载药胶束以上述农药控释包膜材料为壁材,其载药种类丰富,稳定性好、载药率(可高达30%)、包埋率高(可高达80%),能对所包埋的药物起到很好的保护和屏障作用,对药物能起到很好的缓控释效果,而且在酸性或弱酸性环境下对农药分子的缓释效果好,适用于偏酸性环境。
附图说明
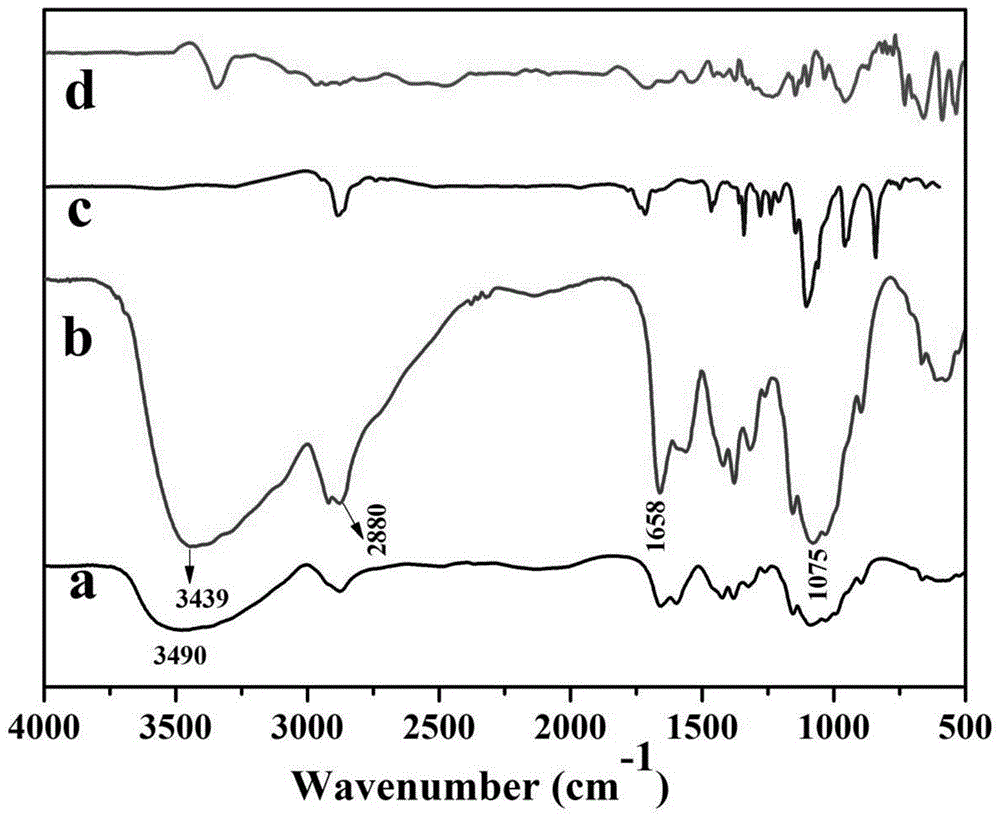
图1为不同物质的红外光谱图,其中a曲线表示壳聚糖,b曲线表示农药控释包膜材料,c曲线表示mpeg,d曲线表示n-乙酰-d-甲硫氨基酸;
图2为纳米载药胶束粒径分布图;
图3(a)为农药原药扫描电镜图;
图3(b)为纳米载药胶束扫描电镜图;
图4为不同分子当量mpeg下纳米载药胶束粒径分布情况;
图5为空白多杀菌素(ssd)和纳米载药胶束(ssd@cip)光稳定性;
图6为不同ph下纳米载药胶束缓释性能图。
具体实施方式
下面结合具体实施例对本发明作进一步详细的说明。除非本发明特别说明外,所用试剂均购自于市售。
实施例1农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的2,2,6,6-四甲基哌啶氮氧化物(tempo)溶解于浓度为0.05g/ml聚乙二醇单甲醚(分子当量为1000)100ml的水溶液中,然后加入46.75ml次氯酸钠溶液,将上述混合物在冰水浴中搅拌反应50min,随后用hcl调节ph为1,用氯仿多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12小时,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为2.5×105的浓度为2.0mg/ml壳聚糖100ml与0.270g活化剂1-羟基苯并三唑(hobt)的混合均匀。将2mmol的n-乙酰-d-甲硫氨基酸与2mmol的opeg及缩合剂1.2g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)加入至上述溶液中,在25℃下反应24h。将得到的反应产物用水透析3天,然后冷冻干燥即得,产率为68.1%。
利用德国tensor27红外光谱(ft-ir)对实施例1所制备的农药控释包膜材料结构官能团的变化进行分析,分析结果如图1所示,其中a曲线代表壳聚糖,b曲线代表农药控释包膜材料,c曲线代表mpeg,d曲线代表n-乙酰-d-甲硫氨基酸的红外光谱图。
如图1中a曲线显示了壳聚糖的基本特征吸收,在3490cm-1为壳聚糖的-nh2和-oh伸缩振动吸收峰,而农药控释包膜材料b曲线在3439cm-1处的-nh2和-oh的伸缩振动吸收峰发生重叠,并且强度有所降低,这主要是由于opeg和n-乙酰-d-甲硫氨基酸与壳聚糖发生了酰胺化反应导致氨基的伸缩振动减弱,同时农药控释包膜材料b曲线在2880cm-1是亚甲基-ch2的伸缩振动吸收峰,1075cm-1是醚键的伸缩振动吸收峰,2880cm-1和1075cm-1附近吸收峰相对强度明显高于壳聚糖a曲线,以上可以证明壳聚糖与opeg发生了接枝反应;另外在农药控释包膜材料中b曲线红外光谱图显示了1658cm-1处出现酰胺的特征吸收,这是由于壳聚糖链上的氨基发生了酰化反应,这表明n-乙酰-d-甲硫氨基酸接枝到壳聚糖上。综上可以证明opeg和n-乙酰-d-甲硫氨基酸改性的壳聚糖已成功制备。
实施例2农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.06g/ml聚乙二醇单甲醚(分子当量为500)100ml的水溶液中,然后加入45.25ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应60min,随后用hcl调节ph为1,用氯仿多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶24小时,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为3.0×103的浓度为2.0mg/ml壳聚糖100ml与0.270g活化剂hbtu的混合均匀;将2mmol的n-乙酰-d-甲硫氨基酸与2mmol的opeg及缩合剂1.2gdcc加入至上述溶液中,在25℃下反应36h。将得到的反应产物用水透析4天,然后冷冻干燥即得,产率为67.5%。
利用德国tensor27红外光谱(ft-ir)对实施例2所制备的农药控释包膜材料结构官能团的变化进行分析,接枝结果与实施例1一致,此处不再赘述。
实施例3农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.07g/ml聚乙二醇单甲醚(分子当量为750)100ml,加入46.75ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应45min,随后用hcl调节ph为1,用乙酸乙酯多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12h,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为2.0×105的浓度为3.0mg/ml壳聚糖100ml与0.270g活化剂hobt混合均匀;将3mmol的n-乙酰-d-苯丙氨酸与2mmol的opeg及缩合剂1.2g二环己基碳二亚胺(dcc)加入至上述溶液中,在25℃下反应30h。将得到的反应产物透析3天,然后冷冻干燥即得,产率为67.8%。
利用德国tensor27红外光谱(ft-ir)对实施例3所制备的农药控释包膜材料结构官能团的变化进行分析,接枝结果与实施例1一致,此处不再赘述。
实施例4农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.08g/ml聚乙二醇单甲醚(分子当量为2000)100ml,加入46.75ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应40min,随后用hcl调节ph为1,用四氢呋喃多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12h,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为1.0×105的浓度为4.0mg/ml壳聚糖100ml与活化剂0.270ghobt的混合均匀。将2mmol的n-乙酰-l-亮氨酸与2mmol的opeg及缩合剂1.2gdic加入至上述溶液中,在25℃下反应24h。将得到的反应产物用水透析4天,然后冷冻干燥即得,产率为68.3%。
利用德国tensor27红外光谱(ft-ir)对实施例4所制备的农药控释包膜材料结构官能团的变化进行分析,接枝结果与实施例1一致,此处不再赘述。
实施例5农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.09g/ml聚乙二醇单甲醚(分子当量为1000)100ml,加入46.75ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应60min,随后用hcl调节ph为1,用n,n-二甲基甲酰胺多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12h,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为5.5×103的浓度为5.0mg/ml壳聚糖100ml与活化剂0.270ghbtu的混合均匀。将1mmol的n-乙酰甘氨酸与2mmol的opeg及缩合剂1.2gedc加入至上述溶液中,在25℃下反应28h。将得到的反应产物用水透析5天,然后冷冻干燥即得,产率为67.5%。
利用德国tensor27红外光谱(ft-ir)对实施例5所制备的农药控释包膜材料结构官能团的变化进行分析,接枝结果与实施例1一致,此处不再赘述。
实施例6农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.10g/ml聚乙二醇单甲醚(分子当量为2000)100ml,加入46.75ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应55min,随后用hcl调节ph为1,用乙酸乙酯多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12h,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为3.5×103的浓度为2.0mg/ml壳聚糖100ml与活化剂0.270gtbtu的混合均匀。将5mmol的脯氨酸与2mmol的opeg及缩合剂1.2gdcc加入至上述溶液中,在25℃下反应36h。将得到的反应产物用水透析3天,然后冷冻干燥即得,产率为67.7%。
利用德国tensor27红外光谱(ft-ir)对实施例6所制备的农药控释包膜材料结构官能团的变化进行分析,接枝结果与实施例1一致,此处不再赘述。
实施例7农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.05g/ml聚乙二醇单甲醚(分子当量为5000)100ml,加入46.75ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应50min,随后用hcl调节ph为1,用四氢呋喃多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12h,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为5.5×104的浓度为3.0mg/ml壳聚糖100ml与活化剂0.270ghbtu的混合均匀。将4mmol的n-乙酰-l-色氨酸与2mmol的opeg及缩合剂1.2gdic加入至上述溶液中,在25℃下反应32h。将得到的反应产物用水透析4天,然后冷冻干燥即得,产率为68.2%。
利用德国tensor27红外光谱(ft-ir)对实施例7所制备的农药控释包膜材料结构官能团的变化进行分析,接枝结果与实施例1一致,此处不再赘述。
实施例8农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.06g/ml聚乙二醇单甲醚(分子当量为500)100ml,加入46.75ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应45min,随后用hcl调节ph为1,用氯仿多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12h,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为2.5×104的浓度为4.0mg/ml壳聚糖100ml与活化剂0.270ghobt的混合均匀;将3mmoln-乙酰-d-甲硫氨基酸与2mmolopeg及缩合剂1.2gedc加入至上述溶液中,在25℃下反应24h。将得到的反应产物用水透析5天,然后冷冻干燥即得,产率为68.4%。
利用德国tensor27红外光谱(ft-ir)对实施例8所制备的农药控释包膜材料结构官能团的变化进行分析,接枝结果与实施例1一致,此处不再赘述。
实施例9农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.08g/ml聚乙二醇单甲醚(分子当量为750)100ml,加入46.75ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应55min,随后用hcl调节ph为1,用四氢呋喃多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12h,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为1.5×105的浓度为5.0mg/ml壳聚糖100ml与活化剂0.270gtbtu的混合均匀。将2mmol的n-乙酰-d-甲硫氨基酸与2mmol的opeg及缩合剂1.2g二环己基碳二亚胺(dcc)加入至上述溶液中,在25℃下反应24h。将得到的反应产物用水透析3天,然后冷冻干燥即得,产率为67.9%。
利用德国tensor27红外光谱(ft-ir)对实施例9所制备的农药控释包膜材料结构官能团的变化进行分析,接枝结果与实施例1一致,此处不再赘述。
实施例10农药控释包膜材料的制备
农药控释包膜材料的制备方法,具体步骤如下:
(1)羧基化聚乙二醇单甲醚(opeg)的制备:
将0.1g的nabr和0.1g的hbr/t-buono溶解于浓度为0.10g/ml聚乙二醇单甲醚(分子当量为2000)100ml,加入46.75ml次氯酸钠溶液,将混合物在冰水浴中搅拌反应60min,随后用hcl调节ph为1,用乙酸乙酯多次萃取,减压蒸馏后,在-20℃的乙醇溶液中重结晶12h,最后真空干燥得到opeg。
(2)农药控释包膜材料的制备:
在25℃下,将粘均分子量为1.0×105的浓度为2.0mg/ml壳聚糖100ml与活化剂0.270ghbtu的混合均匀。将1mmol的n-乙酰-d-苯丙氨酸与2mmol的opeg及缩合剂1.2gdic加入至上述溶液中,在25℃下反应30h。将得到的反应产物用水透析4天,然后冷冻干燥即得,产率为67.6%。
利用德国tensor27红外光谱(ft-ir)对实施例10所制备的农药控释包膜材料结构官能团的变化进行分析,结果与实施例1一致,此处不再赘述。
实施例11负载多杀菌素的纳米载药胶束
负载多杀菌素的纳米载药胶束的制备方法,具体步骤如下:
取50mg实施例1制得的农药控释包膜材料,加入100ml去离子水,搅拌至完全溶解,然后用超声波仪超声处理5min,连续处理3次,得到透明的纳米胶束水溶液;然后取浓度为2mg/ml的多杀菌素甲醇溶液5.0ml,加入100ml纳米载药胶束水溶液中,搅拌2h,最后用去离子水透析12h,以除去甲醇,超声处理10min,连续处理3次,得到负载多杀菌素的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例11所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例11所制备的纳米载药胶束的微观形态进行分析。
分析结果如图2~图3所示,其中:
图2为实施例11中纳米载药胶束粒径分布图,从图2中可以看出该纳米载药胶束粒径分布均匀,主要集中在552.8nm附近。
图3为实施例11中农药原药(3a)和纳米载药胶束(3b)扫描电镜图,从图3可以看出自主装纳米载药胶束形成颗粒较为规整的球形纳米粒子,且分布较为均匀、表面平滑,未发生明显聚集的现象,纳米粒子平均粒径约为541.6nm左右,与图2纳米载药胶束粒径分布相似。
本实施例所制备的纳米载药胶束纳米载药胶束的包埋率为75.4%,载药率为28.1%。
实施例12负载阿维菌素的纳米载药胶束
负载阿维菌素的纳米载药胶束的制备方法,具体步骤如下:
取50mg实施例2制得的农药控释包膜材料,加入100ml的去离子水,搅拌至完全溶解,然后用超声波仪超声处理10min,连续处理4次,得到透明的纳米胶束水溶液。然后取浓度为4mg/ml的阿维菌素甲醇溶液5.0ml,加入100ml纳米载药胶束水溶液中,搅拌3h,最后用去离子水透析14h,以除去甲醇,超声处理5min,连续处理5次,得到负载阿维菌素的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例12所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例12所制备的纳米载药胶束的微观形态进行分析。
实施例12所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述;本实施例所制备的纳米载药胶束的包埋率为52.2%,载药率为10.1%,平均粒径约为2456.3nm。
实施例13负载百里香酚的纳米载药胶束
负载百里香酚的纳米载药胶束的制备方法,具体步骤如下:
取50mg实施例3制得的农药控释包膜材料,加入100ml的去离子水,搅拌至完全溶解,然后用超声波仪超声处理6min,连续处理4次,得到透明的纳米胶束水溶液。然后取浓度为2mg/ml的百里香酚甲醇溶液5.0ml,加入100ml纳米胶束水溶液中,搅拌4h,最后用去离子水透析12h,以除去甲醇,超声处理10min,连续处理2次,得到负载百里香酚的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例13所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例13所制备的纳米载药胶束的微观形态进行分析。
实施例13所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述;本实施例所制备的纳米载药胶束的包埋率为62.3%,载药率为17.7%,平均粒径约为901.5nm。
实施例14负载氟吡菌酰胺的纳米载药胶束
负载氟吡菌酰胺的纳米载药胶束的制备方法,步骤如下:
取50mg实施例4制得的农药控释包膜材料,加入100ml的去离子水,搅拌至完全溶解,然后用超声波仪超声处理7min,连续处理4次,得到透明的纳米胶束水溶液。然后取浓度为2mg/ml的氟吡菌酰胺甲醇溶液5.0ml,加入100ml纳米胶束水溶液中,搅拌2h,最后用去离子水透析14h,以除去甲醇,超声处理8min,连续处理2次,得到负载氟吡菌酰胺的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例14所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例14所制备的纳米载药胶束的微观形态进行分析。
实施例14所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述;本实施例所制备的纳米载药胶束的包埋率为77.2%,载药率为29.3%,平均粒径约为223.1nm。
实施例15负载高效氟氯氰菊酯的纳米载药胶束
负载高效氟氯氰菊酯的纳米载药胶束的制备方法,具体步骤如下:
取50mg实施例5制得的农药控释包膜材料,加入100ml去离子水,搅拌至完全溶解,然后用超声波仪处理8min,连续处理2次,得到透明的纳米胶束水溶液。然后取浓度为2mg/ml的高效氟氯氰菊酯甲醇溶液5.0ml,加入100ml纳米胶束水溶液中,搅拌3h,最后用去离子水透析12h,以除去甲醇,超声处理6min,连续处理3次,得到负载高效氟氯氰菊酯的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例15所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例15所制备的纳米载药胶束的微观形态进行分析。
实施例15所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述。本实施例所制备的纳米载药胶束的包埋率为72.6%,载药率为26.5%,平均粒径约为578.5nm。
实施例16负载甲氰菊酯的纳米载药胶束
负载甲氰菊酯的纳米载药胶束的制备方法,步骤如下:
取50mg实施例6制得的农药控释包膜材料,加入100ml的去离子水,搅拌至完全溶解,然后用超声波仪超声处理9min,连续处理3次,得到透明的纳米胶束水溶液;然后取浓度为2mg/ml的甲氰菊酯甲醇溶液5.0ml,加入100ml纳米胶束水溶液中,搅拌2h,最后用去离子水透析12h,以除去甲醇,超声处理7min,连续处理4次,得到负载甲氰菊酯的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例6所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例16所制备的纳米载药胶束的微观形态进行分析。
实施例16所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述;本实施例所制备的纳米载药胶束的包埋率为75.9%,载药率为28.6%,平均粒径约为245.8nm。
实施例17负载噻虫胺的纳米载药胶束
负载噻虫胺的纳米载药胶束的制备方法,具体步骤如下:
取50mg实施例7制得的农药控释包膜材料,加入100ml的去离子水,搅拌至完全溶解,然后用超声波仪超声处理10min,连续处理2次,得到透明的纳米胶束水溶液。然后取浓度为2mg/ml的噻虫胺甲醇溶液5.0ml,加入100ml纳米胶束水溶液中,搅拌4h,最后用去离子水透析12h,以除去甲醇,超声处理5min,连续处理4次,得负载噻虫胺的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例17所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例17所制备的纳米载药胶束的微观形态进行分析。
实施例17所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述;本实施例所制备的纳米载药胶束的包埋率为76.9%,载药率为28.9%,平均粒径约为213.4nm。
实施例18负载噻唑膦的纳米载药胶束
负载噻唑膦的纳米载药胶束的制备方法,具体步骤如下:
取50mg实施例8制得的农药控释包膜材料,加入100ml的去离子水,搅拌至完全溶解,然后用超声波仪超声处理6min,连续处理3次,得到透明的纳米胶束水溶液;然后取浓度为2mg/ml的噻唑膦甲醇溶液5.0ml,加入100ml纳米胶束水溶液中,搅拌3h,最后用去离子水透析12h,以除去甲醇,超声处理6min,连续处理2次,得负载噻唑膦的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例18所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例18所制备的纳米载药胶束的微观形态进行分析。
实施例18所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述;本实施例所制备的纳米载药胶束的包埋率为45.1%,载药率为3.5%,平均粒径约为2018.6nm。
实施例19负载虫螨腈的纳米载药胶束
负载虫螨腈的纳米载药胶束的制备方法,具体步骤如下:
取50mg实施例9制得的农药控释包膜材料加入100ml的去离子水,搅拌至完全溶解,然后用超声波仪超声处理8min,连续处理4次,得到透明的纳米胶束水溶液。然后取浓度为2mg/ml的虫螨腈甲醇溶液5.0ml,加入100ml纳米胶束水溶液中,搅拌4h,最后用去离子水透析16h,以除去甲醇,超声处理7min,连续处理3次,得到负载虫螨腈的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例19所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例19所制备的纳米载药胶束的微观形态进行分析。
实施例19所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述;本实施例所制备的纳米载药胶束的包埋率为58.6%,载药率为15.7%,平均粒径约为975.3nm。
实施例20负载氯虫苯甲酰胺的纳米载药胶束
负载氯虫苯甲酰胺的纳米载药胶束的制备方法,步骤如下:
取50mg实施例10制得的农药控释包膜材料加入100ml的去离子水,搅拌至完全溶解,然后用超声波仪超声处理6min,连续处理4次,得到透明的纳米胶束水溶液。然后取浓度为2mg/ml的氯虫苯甲酰胺甲醇溶液5.0ml,加入100ml纳米胶束水溶液中,搅拌3h,最后用去离子水透析14h,以除去甲醇,超声处理10min,连续处理3次,得到负载氯虫苯甲酰胺的纳米载药胶束。
利用英国zetasizernanozs马尔文动态光散射仪对实施例20所制备纳米载药胶束的平均粒度和粒度分布进行分析,利用日立s4800的场发射扫描电镜测试实施例20所制备的纳米载药胶束的微观形态进行分析。
实施例20所得纳米载药胶束的扫描电镜图与实施例11相同,此处不再赘述。本实施例所制备的纳米载药胶束的包埋率为76.4%,载药率为27.5%,平均粒径约为234.8nm。
一、不同分子当量mpeg下纳米载药胶束粒径分布情况
按照实施例1的方法,用分子当量为500、750、1000、2000、5000的mpeg分别制备农药控释包膜材料,再以制得的农药控释包膜材料按照实施例11的方法分别制备出不同分子当量mpeg条件下的多杀菌素纳米载药胶束。
然后利用英国zetasizernanozs马尔文动态光散射仪对这些多杀菌素纳米载药胶束的平均粒度和粒度分布进行分析,结果如图4所示,结果表明本申请制备的纳米载药胶束随着亲水基团分子量越大,所形成的胶束粒径越小,这是由于纳米载药胶束外壳包膜材料的亲水基团接枝率大于疏水基团接枝率,胶束的粒径由亲水基团主导所致。
二、纳米载药胶束光稳定性试验
多杀菌素(spinosad,ssd)在环境中极易被光解,尤其在水溶液中的光解半衰期非常短,很大程度上制约了多杀菌素的应用前景。现以实施例11为例,研究多杀菌素纳米载药胶束的稳定性情况。
试验方法如下:分别将多杀菌素纳米载药胶束(ssd@cip)和多杀菌素的甲醇水溶液放入人工模拟光照箱中,采用300w氙弧灯(200-2500nm光谱输出,50w辐射输出)光照24h,通过紫外分光光度计在不同时间测定各样品ssd含量变化。
结果如图5所示,原药ssd在经过12.5h光照后,有效成分百分含量剩余约55%,照射22h后原药有效成分剩余量为42%;而多杀菌素纳米载药胶束在12.5h和22h照射后,有效成分分别剩余63%和52%,一定程度上控制了原药ssd的光解,降低了光解速率,说明农药控释包膜材料对ssd起到了一定保护和屏障作用。
三、纳米载药胶束缓释性能试验
以实施例11所制备的多杀菌素纳米载药胶束为研究对象,缓释性能试验方法如下:取10ml多杀菌素纳米载药胶束(ssd@cip)装至透析袋(截留分子量为3500)内,在磷酸缓冲盐溶液(ph分别为6.5、7.4、9.0)溶液中透析。在不同时间分别取出1ml透析液,采用紫外分光光度计测定药物释放,并用1ml新鲜的pbs代替取出的透析液。
结果如图6所示,在ph为6.5和7.4的环境下,纳米载药胶束都经历了两个阶段:突释期和缓释期;突释期有利于药物迅速作用于害虫、快速见效,缓释期有利于药物逐渐释放以维持一定的浓度范围、对杀灭害虫起到持续性作用。由图中还可看出,随时间变化,纳米载药胶束在不同ph值下缓慢释放,突释药量为4%~11%,在ph值为6.5的酸性环境下,其突释药量最多。突释是由于制备载药微胶囊的过程中,分子间作用力使少许药物以分子状态吸附在胶束外壳,所以先释放出来;而随着胶束的不断降解,包埋在内部的药物才随之释放,胶束的释放速率与ph值成反比,ph值越小,释放速率越快。提示,本申请的纳米载药胶束适用于偏酸性环境。
以上所述的仅是本发明的一些实施方式。对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!