用于检测B族链球菌的引物组及其用途的制作方法
本发明涉及基于crispr技术的基因检测技术领域,特别是涉及一种用于检测b族链球菌的引物组及其用途。
背景技术:
b族链球菌(groupbstreptococcus,b族链球菌)若按种系法分类,则称为无乳链球菌,故学名是无乳链球菌。是一种寄生于人类泌尿生殖道及下呼吸道的条件致病菌,健康人群带菌率可达35%。
自20世纪30年代起,b族链球菌作为人类产后脓毒症的病因被报道。20世纪70年代后,b族链球菌作为产妇和新生儿感染的病原菌更受关注。新生儿b族链球菌感染所引起的新生儿败血症、脑膜炎和肺炎等症致死率极高,并可导致神经系统后遗症。2010年美国疾病预防中心制定了《围产期b族链球菌预防指南》,建议孕妇于妊娠35-37周进行b族链球菌筛查。
目前,国内对b族链球菌的检测方法主要有培养法、免疫学诊断法和分子生物学诊断法等。其中,细菌培养法是b族链球菌的实验室诊断常规方法,是检测b族链球菌的金标准。传统培养法特异性和敏感性高,但临床检测时间长(至少需要24-48h),过程繁琐,且阳性率受到多种因素影响,不适用于大范围检测。血清学方法由于窗口期的存在,诊断存在滞后性,不能准确反映当前是否感染,虽然特异性可高达95%,但是敏感性不够,检测率较低。
目前广泛使用的基于pcr的核酸检则方法诸如普通pcr和qpcr等方法是直接对病原体的核糖核酸或脱氧核糖核酸进行检测,无论是在定性或者定量方法都有一定的优势,但由于该方法需要特殊的仪器设备和专业的操作人员,设备成本高,检测需要分批次,无法随到随检,很大程度限制了该技术的广泛应用。并且在临床实践中,其灵敏度、特异性有时无法满足需求。
技术实现要素:
基于此,有必要针对上述问题,提供一种用于检测b族链球菌的引物组,将此引物组用于基于crispr技术的基因检测中,可快速检测b族链球菌,具有特异高、灵敏高、操作方便的优点。
一种用于检测b族链球菌的引物组,包括扩增引物对和crrna;所述扩增引物对用于扩增b族链球菌如seqidno.1所示序列;所述crrna包括锚定序列和向导序列,所述锚定序列与cas蛋白结合,所述向导序列与所述seqidno.1序列中的靶向序列片段相匹配。
上述引物组,针对b族链球菌的保守序列进行设计,且利用crispr(clusteredregularlyinterspacedshortpalindromicrepeats,成簇规律间隔短回文重复序列)技术进行检测,在crisprcas系统中,cas蛋白在crrna(crispr-derivedrna,其基本构成为:5’-锚定序列-向导序列-3’)的引导下,识别目标序列后启动“附带切割”活性。可以理解的,上述目标序列可以是dna序列,也可以是rna序列,根据待测样本特点和检测系统要求调整即可。在体系中加入荧光报告分子,借用cas酶附带切割活性,实现待检序列信息向荧光信号的转化。通过rpa与cas蛋白的偶联,能够实现“序列扩增”(rpa完成)加上“酶促级联”(cas酶完成)的两级放大,从而超越q-pcr这种单级扩增的灵敏度。此外,因为rpa扩增方式无需复杂的温度改变,从而摆脱了对q-pcr仪等精密仪器的依赖,使得crispr-cas技术在b族链球菌诊断方面具有广阔的应用前景。
在其中一个实施例中,所述锚定序列针对cas12蛋白设计,所述向导序列选自:seqidno.2所示序列或seqidno.3所示序列;所述扩增引物对选自如下引物对:
引物对1:上游引物:5’-aattgaatggaatgaaccatttgcagcgat-3’
下游引物:5’-aataattcctgagcaggcataagggtgtc-3’
引物对2:上游引物:5’-cacattgtagaagtagcaggagatcccaag-3’
下游引物:5’-attaataattcctgagcaggcataagggtgt-3’
引物对3:上游引物:5’-gatcccaagcttagtccagaattggttcac-3’
下游引物:5’-attaataattcctgagcaggcataagggtg-3’
引物对4:上游引物:5’-agatcccaagcttagtccagaattggttca-3’
下游引物:5’-ataagggtgtccgtaagctaatgtccctc-3’
引物对5:上游引物:5’-tgaaccatttgcagcgattgatgctctatt-3’
下游引物:5’-cataagggtgtccgtaagctaatgtccct-3’。
在其中一个实施例中,所述crrna选自:seqidno.4所示序列,所述扩增引物对为引物对5。发明人在前期研究基础上,经过多番筛选和比对,发现以上述crrna和扩增引物对配合,具有较好的检测效果。
在其中一个实施例中,所述锚定序列针对cas13蛋白设计,所述向导序列选自:seqidno.5所示序列;所述扩增引物对选自如下引物对:
引物对6:
上游引物:5’-taatacgactcactatagggacggaaaaactattaacagaaactcatact-3’
下游引物:5’-gtaagctaatgtccctccaaaaatattga-3’
引物对7:
上游引物:5’-taatacgactcactatagggtgaaccatttgcagcgattgatgctctatt-3’
下游引物:5’-cataagggtgtccgtaagctaatgtccct-3’
引物对8:
上游引物:5’-taatacgactcactatagggcggattatgatgcaattgaatggaatgaacc-3’
下游引物:5’-caggcataagggtgtccgtaagctaatgtc-3’
引物对9:
上游引物:5’-taatacgactcactatagggaattgaatggaatgaaccatttgcagcgat-3’
下游引物:5’-aataattcctgagcaggcataagggtgtc-3’。
在其中一个实施例中,所述crrna选自:seqidno.6所示序列,所述扩增引物对为引物对9。发明人在前期研究基础上,经过多番筛选和比对,通过在crrna序列前引入ggg,可使crrna稳定性更好,起到保护crrna的作用,并且发现以上述crrna和带有t7转录启动子序列的rpa扩增引物对配合,通过t7rna转录酶的体外逆转录得到待测靶rna后再进行crispr反应,具有最佳的检测效果。
本发明还公开了上述的用于检测b族链球菌的引物组在开发和/或制备具有b族链球菌感染诊断和/或预后评估用途的产品中的应用。
可以理解的,上述产品可以是试剂盒,也可以是一体化检测设备等。
本发明还公开了一种用于检测b族链球菌的试剂盒,包括上述的用于检测b族链球菌的引物组。
在其中一个实施例中,该试剂盒还包括cas蛋白,信号报告探针。所述cas蛋白可来源于cas12a,如lbcas12a、ascas12a和fncas12a等,也可来源于cas13a,如lshcas13a、lbucas13a和lwcas13a等,但需根据不同来源蛋白调整其锚定序列和其它试剂成分。
信号报告探针又称信号报告试剂,其特点为在序列的5’标记荧光报告基团,3’标记淬灭基团。信号报告试剂的阳性信号有多种选择,包括荧光、吸光值、显色反应等,但信号报告的条件都是基于cas蛋白的酶活性。具体信号报告探针的选择可根据其它试剂进行调整选择。
本发明还公开了一种非诊断治疗目的b族链球菌检测方法,包括以下步骤:
样本提取:取待测样本,提取其中dna;
rpa扩增:以上述扩增引物,通过rpa方法扩增上述提取得到的待测样本dna,得扩增产物;
crispr反应检测:取上述扩增产物,加入信号报告探针、cas12蛋白和上述crrna,进行crispr反应检测,读取检测信号,即得。
上述检测步骤均在恒温条件完成,无需复杂的温度改变,从而摆脱了对q-pcr仪等精密仪器的依赖,具有较为广阔的应用前景。
本发明还公开了一种非诊断治疗目的b族链球菌检测方法,包括以下步骤:
样本提取:取待测样本,提取其中dna;
一步检测:在上述提取得到的样本dna中加入上述的扩增引物对、rna转录酶、crrna、cas13a蛋白和信号报告试剂,同时进行rpa扩增、体外逆转录和crispr反应检测,读取检测信号,即得。
上述反应步骤不仅是在恒温条件完成,无需复杂的温度改变,并且还将rpa扩增、体外逆转录和crispr反应检测步骤融合到一步反应,极大的简化了实验操作,具有极佳的应用前景。
与现有技术相比,本发明具有以下有益效果:
本发明的一种用于检测b族链球菌的引物组,针对b族链球菌的保守序列进行设计,且利用crispr(clusteredregularlyinterspacedshortpalindromicrepeats,成簇规律间隔短回文重复序列)技术进行检测,在crisprcas系统中,cas蛋白在crrna的引导下,识别目标序列后启动“附带切割”活性。在体系中加入荧光报告分子,借用cas酶附带切割活性,实现待检序列信息向荧光信号的转化。通过rpa与cas蛋白的偶联,能够实现“序列扩增”(rpa完成)加上“酶促级联”(cas酶完成)的两级放大,从而超越q-pcr这种单级扩增的灵敏度。此外,因为rpa扩增方式无需复杂的温度改变,从而摆脱了对q-pcr仪等精密仪器的依赖,使得crispr-cas技术在b族链球菌诊断方面具有广阔的应用前景。
并且,本发明人还通过对靶标序列选定、扩增引物对和crrna的设计和筛选,最终得到了具有扩增效率高、灵敏度好且特异性强的可临床实用的引物组,并且还通过将rpa扩增和crispr反应检测步骤融合到一步反应,极大的简化了实验操作。
同时,采用本发明的引物组,对b族链球菌的最低检测限为2copies/μl,且与大肠杆菌、结核分枝杆菌等其他人体常见致病菌均无交叉反应,与人基因组dna也无反应,具有较高的特异性和检测灵敏度。
附图说明
图1为实施例2中扩增引物对扩增效率筛选结果示意图;
图2为实施例2中crrna序列灵敏度筛选结果示意图;
图3为实施例2中一步法检测限结果示意图;
图4为实施例3中扩增引物对扩增效率筛选结果示意图;
图5为实施例3中两步法检测限结果示意图;
图6为实施例3中一步法检测限结果示意图;
图7为实施例4中特异性检测结果示意图。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
以下实施例所用原料,除特别说明外,均为市售购得。
其中:cas12a为lbcas12a,购自:金斯瑞生物科技有限公司,规格型号:c6550dh290s01;
cas13a为lwcas13a,购自:金斯瑞生物科技有限公司,规格型号:u2047dh010s01。
实施例1
b族链球菌crispr检测引物序列的设计。
1、靶标序列选定。
发明人在前期研究基础上,经过多番筛选和比对,选定b族链球菌基因组中特异且无高频snp位点的序列区域atob的保守基因序列(seqidno.1)作为b族链球菌的检测目标序列。seqidno.1序列如下:
atgaagaatagagatgtttatattggttttgggctacgaacacctatcggtataaaagggaagcaatttaaacattaccgtccagaacttttaggagcacaccttttaaatcaaataaaaaaaatagaatcagaatctaacattgatagtattatttgtgggaacacagttggtactgggggcaatattggtcgtttgatgactcttttttctgattatgaatcctatattccagtacaaacgattgatatgcagtgtgcttcatcaagttctgccttgttttttggttatctaaaaatcagtaccggtattaatgaaaaagttcttgttggggggattgaaagtagttctcttcaacctatgagacgttatgctaaagaagataatcgtaacggagaatatacagttgctcagttttctcctgactcttatgctgaaactgtaatgttagaaggggcccagagagtctgtcaaaaatatggttttagaagagaaatgttagataaattggcattcttgagccataaacgcgccttaacagctaaacaaggtggctatttagaagaggtaatcttaccaatggaagggatgcgagatcaaggcgttagaaaactaaaagaaacattttttcaaaaattaccaagattgatggaaaattcacctttgctcactattggaaatgtttgtttaatgcacgatgctgctgcatttctaacgcttcagagtcagaaaacagaattccggattgttcacattgtagaagtagcaggagatcccaagcttagtccagaattggttcacacggctacggaaaaactattaacagaaactcatactaaaatatcggattatgatgcaattgaatggaatgaaccatttgcagcgattgatgctctatttaatcattattatcctgaagagagagaaaaattcaatatttttggagggacattagcttacggacacccttatgcctgctcaggaattattaatatccttcatcttatgcaggcattaaaatataaaaataaacctatgggtctaactgccattgcaggggcaggaggagtcggaatggccatatcaatagagtacttaggagttaagaatgcttga。
以下实施例中的标准待检样本为大肠杆菌工程菌,该大肠杆菌工程菌携带插入了上述b族链球菌基因序列区域atob的质粒(生工生物工程(上海)股份有限公司合成)。
2、扩增引物对和crrna的设计。
针对上述保守序列,设计多条crrna和相应的扩增引物对进行对比,下表列出部分示例性引物序列。
表1.基于cas12a的crrna和扩增引物对
表2.基于cas13a的crrna和扩增引物对
实施例2
基于cas12a的序列筛选。
1、rpa扩增引物对的扩增效率对比
1.1方法(两步法)
以上述实施例1中携带插入了b族链球菌基因序列区域atob质粒的大肠杆菌工程菌作为标准待检样本,其中质粒浓度为102copy/μl,按照常规方法提取得到标准待检样本dna组(即gbs基因组dna),选用raa基础扩增试剂盒(杭州众测生物科技有限公司),通过rpa对靶序列进行扩增,同时以depc处理水(经焦碳酸二乙酯处理过并经高温高压灭菌的miliq纯水,不含杂质rna、dna和蛋白质,生工生物工程(上海)股份有限公司)为阴性参照,按照以下操作进行:
1)rpa扩增
a.扩增体系:
b.扩增程序:恒温37℃反应30min。
2)基于cas12a的crispr反应
a.crispr反应体系:
b.扩增条件为:
37℃、1s1个循环;
37℃、30s(收集荧光)90个循环;
12℃、10s1个循环。
仪器:荧光检测仪abi7500。
判断标准:阴性:荧光量小于或等于阴性对照荧光量的2倍;阳性:荧光量大于阴性对照荧光量的2倍。
本实施例中阳性信号为荧光信号(选用来自生工生物工程(上海)股份有限公司的dnasealert),该探针dna的序列特点为:fam-ttatt-bhq。即在反应体系中加入一条两端分别连接荧光物质和淬灭剂的dna,当cas12a蛋白在crrna的帮助下,识别具有靶向序列的靶向dna后,被激活的cas12a酶可以降解该带有信号的dna,从而释放荧光信号,实现检测。
1.2结果
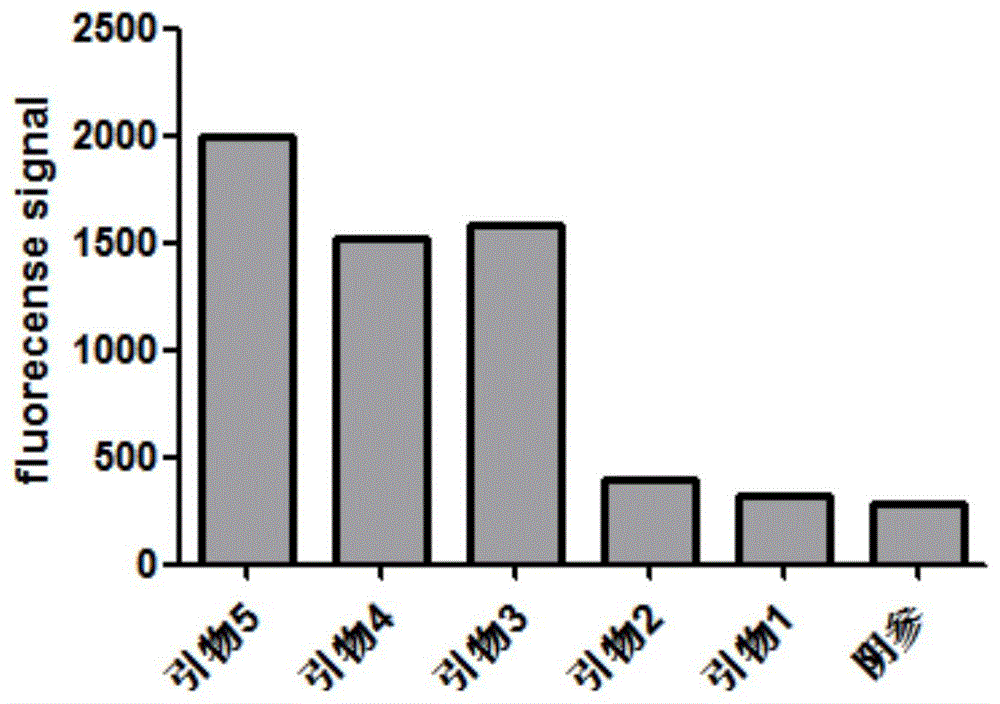
对上表1中引物对1-5所示的引物对组合进行了检测筛选,最终选出一组扩增效率好的引物对5,筛选结果如图1所示,图中纵坐标为荧光信号强度。
结果表示,采用引物对5具有最佳的扩增效率。
2、基于cas12a的crrna检测灵敏度筛选。
2.1方法
首先通过rpa试剂盒和扩增引物对5,对靶序列进行扩增,扩增试剂盒为raa基础扩增试剂盒(杭州众测生物科技有限公司),筛选crrna为表1的crrna-1和crrna-2。
以实施例1中的b族链球菌基因序列区域atob质粒作为标准待检样本,并通过计算稀释质粒浓度为104copy/μl、103copy/μl、102copy/μl、101copy/μl、100copy/μl共5个梯度作为灵敏度检测的模板。
按照上述方法进行rpa扩增和crispr反应检测。
2.2结果
对上表1中crrna1和crrna2进行了检测筛选,最终选出检测灵敏度高的crrna-2,筛选结果如图2所示,图中纵坐标为荧光信号强度。
结果表示,采用crrna-2,检测灵敏度可达2copyies/μl。
3、基于cas12a的一步法检测的灵敏度验证。
3.1方法(一步法)
1)模板
以实施例1中的b族链球菌基因序列区域atob质粒作为标准待检样本,并通过计算稀释质粒浓度为104copy/μl、103copy/μl、102copy/μl、101copy/μl、100copy/μl共5个梯度作为灵敏度检测的模板。
2)反应体系(30μl)
用灭菌的去离子水补齐至30μl。
3)荧光检测
仪器:荧光检测仪abi7500
扩增条件为:
37℃、1s1个循环;
37℃、30s(收集荧光)90个循环;
12℃、10s1个循环。
判断标准:阴性:荧光量小于或等于阴性对照荧光量的2倍;阳性:荧光量大于阴性对照荧光量的2倍。
3.2结果
检测结果如图3所示,从图3中可以看出,采用上述一步法检测限为200copies/μl,而两步法的检测限位2copies,说明一步法的灵敏度不如两步法。
实施例3
基于cas13a的序列筛选。
1、rpa扩增引物的扩增效率筛选
1.1方法(一步法)
以上述实施例1中携带插入了b族链球菌基因序列区域atob质粒的大肠杆菌工程菌作为标准待检样本,其中质粒浓度为102copy/μl,按照常规方法提取得到标准待检样本dna组(即gbs基因组dna),选用raa基础扩增试剂盒(杭州众测生物科技有限公司),通过rpa对靶序列进行扩增,同时以depc处理水(经焦碳酸二乙酯处理过并经高温高压灭菌的miliq纯水,不含杂质rna、dna和蛋白质,生工生物工程(上海)股份有限公司)为阴性参照,按照以下操作进行:
a.反应体系(30μl):
b.仪器:荧光检测仪abi7500
扩增条件为:
37℃、1s1个循环;
37℃、30s(收集荧光)90个循环;
12℃、10s1个循环。
判断标准:阴性:荧光量小于或等于阴性对照荧光量的2倍;阳性:荧光量大于阴性对照荧光量的2倍。
本实施例中阳性信号为荧光信号(选用来自金斯瑞生物科技有限公司的rnasealert),rna探针的序列特点为:fam-uuuuuuuuuuuuuu-bhq。即在反应体系中加入一条两端分别连接荧光物质和淬灭剂的rna,当cas13a蛋白在crrna的帮助下,识别具有靶向序列的靶向rna后,被激活的cas13a酶可以降解该带有信号的rna,从而释放荧光信号,实现检测。
1.2结果
对上表2中引物对6-9所示的引物对组合进行了检测筛选,最终选出一组扩增效率好的引物对9,筛选结果如图4所示,图中纵坐标为荧光信号强度。
结果表示,采用引物对9具有最佳的扩增效率。
2、基于cas13a的两步法灵敏度验证。
2.1方法(两步法)
以实施例1中的b族链球菌基因序列区域atob质粒作为标准待检样本,并通过计算稀释质粒浓度为104copy/μl、103copy/μl、102copy/μl、101copy/μl、100copy/μl共5个梯度作为灵敏度检测的模板。以两步法进行rpa扩增和crispr反应检测,具体如下:
按照常规方法提取得到标准待检样本dna组(即gbs基因组dna),选用raa基础扩增试剂盒(杭州众测生物科技有限公司),以引物对9作为rpa扩增引物对,通过rpa对靶序列进行扩增,同时以depc处理水(经焦碳酸二乙酯处理过并经高温高压灭菌的miliq纯水,不含杂质rna、dna和蛋白质,生工生物工程(上海)股份有限公司)为阴性参照,按照以下操作进行:
1)rpa扩增
a.扩增体系:
b.扩增程序:恒温37℃反应30min。
2)t7转录和crispr反应
a.反应体系:
b.扩增条件为:
37℃、1s1个循环;
37℃、30s(收集荧光)90个循环;
12℃、10s1个循环。
仪器:荧光检测仪abi7500。
判断标准:阴性:荧光量小于或等于阴性对照荧光量的2倍;阳性:荧光量大于阴性对照荧光量的2倍。
本实施例中阳性信号为荧光信号(选用来自生工生物工程(上海)股份有限公司的rnasealert),rna探针的序列特点为:fam-uuuuuuuuuuuuuu-bhq。即在反应体系中加入一条两端分别连接荧光物质和淬灭剂的rna,当cas13a蛋白在crrna的帮助下,识别具有靶向序列的靶向rna后,被激活的cas13a酶可以降解该带有信号的rna,从而释放荧光信号,实现检测。
2.2结果
使用abi7500荧光检测仪,对扩增产物进行荧光检测。基于rpa扩增、t7转录和cas13a,两步法检测的检测限为2copies,结果如图5所示。
3、基于cas13a的一步法灵敏度验证。
3.1方法
以上述实施例1中的b族链球菌基因序列区域atob质粒作为标准待检样本,并通过计算稀释质粒浓度为104copy/μl、103copy/μl、102copy/μl、101copy/μl、100copy/μl共5个梯度作为灵敏度检测的模板。按照常规方法提取得到标准待检样本dna组(即gbs基因组dna),选用raa基础扩增试剂盒(杭州众测生物科技有限公司),通过rpa对靶序列进行扩增、体外逆转录和crispr反应检测,同时以depc处理水(经焦碳酸二乙酯处理过并经高温高压灭菌的miliq纯水,不含杂质rna、dna和蛋白质,生工生物工程(上海)股份有限公司)为阴性参照,按照基于cas13a的序列筛选中rpa扩增引物的扩增效率筛选的操作方法进行。
1.2结果
使用abi7500荧光检测仪,对扩增产物进行荧光检测。结果如图6所示,图中纵坐标为荧光信号强度。结果表示,基于rpa扩增、t7转录和cas13a,一步法检测的检测限为2copies,远优于基于rpa扩增和cas12a的一步法检测(其检测限为200copies)。
实施例4
特异性考察
1、方法(一步法)
以b族链球菌dna、大肠杆菌dna、人基因组dna和结核分枝杆菌dna作为检测模板各样本稀释至104copy/μl,使用t7转录试剂盒(neb)、rpa基础扩增试剂盒(杭州众测生物科技有限公司)、cas13a来配制一步法体系,无核酸酶水代替gbs基因组dna作为阴性质控,检验本方法的特异性。
1.1模板dna的准备
1)b族链球菌dna和大肠杆菌dna通过细菌提取试剂盒,对其进行dna提取;人基因组dna实通过人组织细胞提取试剂盒,进行提取;结核分枝杆菌dna是病原所提供。
2)通过nanodropone/onec微量核酸浓度测定仪来测定,并分别计算并稀释为104copy/μl。
1.2检测。
参照实施例3中的cas13a一步法检测。
2、结果
使用abi7500荧光检测仪,对扩增产物进行荧光检测。结果如图7所示,图中纵坐标为荧光信号强度。实验结果显示,只有b族链球菌dna能够被特异性检出,其他样本没有明显信号,表明该方法特异性好。
实施例5
一种用于检测b族链球菌的试剂盒(基于cas12a),包括:
(1)rpa扩增体系:
rpa扩增引物对:
正向:5’-tgaaccatttgcagcgattgatgctctatt-3’(seqidno:4),浓度为0.4μm;
反向:5’-cataagggtgtccgtaagctaatgtccct-3’(seqidno:5),浓度为0.4μm;
raa基础扩增试剂盒的rpa酶预混液(杭州众测生物科技有限公司);
raa基础扩增试剂盒的bbuffer(杭州众测生物科技有限公司)。
(2)crispr反应体系:
crrna2:5’-uaauuucuacuaaguguagauaucauuauuauccugaagaga-3’(seqidno:3),浓度为67nm;
lbcas12a蛋白:浓度为33nm。
dnasealert:5’6-fam-tttttttttttt-bhq1-3’,浓度为200nm。
采用上述试剂盒进行b族链球菌检测的方法如下:
(1)检测样本的dna提取
检测样本可以是b族链球菌菌株,也可以是临床样本(主要包括组织样本、痰液、脑脊液、胸腹水、尿液、脓液、血液样本等)或是其它科研实验样本。
(2)通过rpa技术对病原体核酸进行扩增
以上述rpa扩增进行扩展,扩增程序为:恒温37℃反应15-60min。
(3)基于cas12a的crispr反应
以上述crispr反应体系进行反应,扩增条件为:
37℃、1s1个循环;
37℃、30s(收集荧光)90个循环;
12℃、10s1个循环。
(4)结果分析:
上述检测过程中,由于在反应体系中加入两端分别连接荧光物质和淬灭剂的信号报告探针,当cas12a蛋白在crrna的帮助下,识别具有靶向序列的靶向dna后,被激活的cas12a酶可以降解该带有信号的信号报告探针,从而释放荧光信号,实现检测。
使用荧光检测仪得到的累积荧光值作为信号强度,按照以下标准进行分析判定:
阴性判断标准:荧光量小于或等于阴性对照荧光量的2倍。
阳性判断标准:荧光量大于阴性对照荧光量的2倍。
其中,阴性对照组为每个实验组对应设置的以加入同时以depc处理水(生工生物工程(上海)股份有限公司)的阴性信号组。
实施例6
一种用于检测b族链球菌的试剂盒(基于cas13a),包括:
一步反应体系:
rpa扩增引物对:
正向:5’-taatacgactcactatagggaattgaatggaatgaaccatttgcagcgat-3’(seqidno:4),浓度为0.4μm;
反向:5’-aataattcctgagcaggcataagggtgtc-3’(seqidno:5),浓度为0.4μm。crispr反应引物:
crrna:5’-ggggauuuagacuaccccaaaaacgaaggggacuaaaacucucucuucaggauaauaaugauuaaau-3’(seqidno:3),浓度为33nm;
lwcas13a蛋白:浓度为67nm;
raa基础扩增试剂盒的rpa酶预混液(杭州众测生物科技有限公司);
raa基础扩增试剂盒的bbuffer;
探针(200nm):fam-uuuuuuuuuuuuuu-bhq(自金斯瑞生物科技有限公司的rnasealer)
ntp混合液(1mm)(neb公司)
rna聚合酶预混液(neb公司)
cas13a蛋白(67nm)
crrna-3(33nm)
rnaseinhibitor(来自neb公司)
gbs基因组dna
采用上述试剂盒进行b族链球菌检测的方法如下:
(1)检测样本的dna提取
检测样本可以是b族链球菌菌株,也可以是临床样本(主要包括组织样本、痰液、脑脊液、胸腹水、尿液、脓液、血液样本等)或是其它科研实验样本。
(2)一步法反应程序
扩增条件为:
37℃、1s1个循环;
37℃、30s(收集荧光)90个循环;
12℃、10s1个循环。
(3)结果分析:
上述检测过程中,由于在反应体系中加入两端分别连接荧光物质和淬灭剂的信号报告探针,当cas13a蛋白在crrna的帮助下,识别具有靶向序列的靶向dna后,被激活的cas13a酶可以降解该带有信号的信号报告探针,从而释放荧光信号,实现检测。
使用荧光检测仪得到的累积荧光值作为信号强度,按照以下标准进行分析判定:
阴性判断标准:荧光量小于或等于阴性对照荧光量的2倍。
阳性判断标准:荧光量大于阴性对照荧光量的2倍。
其中,阴性对照组为每个实验组对应设置的以加入depc处理水的阴性信号组。
实施例7
以上述实施例6的试剂盒进行临床样品的b族链球菌检测。
1.方法
(1)样本来源:南方医科大学珠江医院。
临床样本共50例,用市场上广泛认可达安基因的b族链球菌核酸检测试剂盒(pcr-荧光探针法)及本发明方法进行盲检测。
(2)检测方法:
参照实施例6中的本发明的相关检测步骤对50例样本进行检测。
同时参照达安基因的b族链球菌核酸检测试剂盒(pcr-荧光探针法)相关操作说明书检测步骤对50例样本进行检测。
2.结果
使用两种方法的检测结果如下表所示:
表2不同方法对临床样品检测结果
经过计算可知:
阳性符合率=100%
阴性符合率=100%
总符合率=100%
kappa值=1
上述结果说明本发明检测方法与达安基因的b族链球菌核酸检测试剂盒(pcr-荧光探针法)具有较高的检测效果一致性。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
序列表
<110>广州微远基因科技有限公司
<120>用于检测b族链球菌的引物组及其用途
<160>24
<170>siposequencelisting1.0
<210>1
<211>1116
<212>dna
<213>b族链球菌(groupbstreptococcus)
<400>1
atgaagaatagagatgtttatattggttttgggctacgaacacctatcggtataaaaggg60
aagcaatttaaacattaccgtccagaacttttaggagcacaccttttaaatcaaataaaa120
aaaatagaatcagaatctaacattgatagtattatttgtgggaacacagttggtactggg180
ggcaatattggtcgtttgatgactcttttttctgattatgaatcctatattccagtacaa240
acgattgatatgcagtgtgcttcatcaagttctgccttgttttttggttatctaaaaatc300
agtaccggtattaatgaaaaagttcttgttggggggattgaaagtagttctcttcaacct360
atgagacgttatgctaaagaagataatcgtaacggagaatatacagttgctcagttttct420
cctgactcttatgctgaaactgtaatgttagaaggggcccagagagtctgtcaaaaatat480
ggttttagaagagaaatgttagataaattggcattcttgagccataaacgcgccttaaca540
gctaaacaaggtggctatttagaagaggtaatcttaccaatggaagggatgcgagatcaa600
ggcgttagaaaactaaaagaaacattttttcaaaaattaccaagattgatggaaaattca660
cctttgctcactattggaaatgtttgtttaatgcacgatgctgctgcatttctaacgctt720
cagagtcagaaaacagaattccggattgttcacattgtagaagtagcaggagatcccaag780
cttagtccagaattggttcacacggctacggaaaaactattaacagaaactcatactaaa840
atatcggattatgatgcaattgaatggaatgaaccatttgcagcgattgatgctctattt900
aatcattattatcctgaagagagagaaaaattcaatatttttggagggacattagcttac960
ggacacccttatgcctgctcaggaattattaatatccttcatcttatgcaggcattaaaa1020
tataaaaataaacctatgggtctaactgccattgcaggggcaggaggagtcggaatggcc1080
atatcaatagagtacttaggagttaagaatgcttga1116
<210>2
<211>20
<212>rna
<213>人工序列(artificialsequence)
<400>2
auuauccugaagagagagaa20
<210>3
<211>21
<212>rna
<213>人工序列(artificialsequence)
<400>3
aucauuauuauccugaagaga21
<210>4
<211>41
<212>rna
<213>人工序列(artificialsequence)
<400>4
uaauuucuacuaaguguagauauuauccugaagagagagaa41
<210>5
<211>28
<212>rna
<213>人工序列(artificialsequence)
<400>5
ucucucuucaggauaauaaugauuaaau28
<210>6
<211>67
<212>rna
<213>人工序列(artificialsequence)
<400>6
ggggauuuagacuaccccaaaaacgaaggggacuaaaacucucucuucaggauaauaaug60
auuaaau67
<210>7
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>7
aattgaatggaatgaaccatttgcagcgat30
<210>8
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>8
aataattcctgagcaggcataagggtgtc29
<210>9
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>9
cacattgtagaagtagcaggagatcccaag30
<210>10
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>10
attaataattcctgagcaggcataagggtgt31
<210>11
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>11
gatcccaagcttagtccagaattggttcac30
<210>12
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>12
attaataattcctgagcaggcataagggtg30
<210>13
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>13
agatcccaagcttagtccagaattggttca30
<210>14
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>14
ataagggtgtccgtaagctaatgtccctc29
<210>15
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>15
tgaaccatttgcagcgattgatgctctatt30
<210>16
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>16
cataagggtgtccgtaagctaatgtccct29
<210>17
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>17
taatacgactcactatagggacggaaaaactattaacagaaactcatact50
<210>18
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>18
gtaagctaatgtccctccaaaaatattga29
<210>19
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>19
taatacgactcactatagggtgaaccatttgcagcgattgatgctctatt50
<210>20
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>20
cataagggtgtccgtaagctaatgtccct29
<210>21
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>21
taatacgactcactatagggcggattatgatgcaattgaatggaatgaacc51
<210>22
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>22
caggcataagggtgtccgtaagctaatgtc30
<210>23
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>23
taatacgactcactatagggaattgaatggaatgaaccatttgcagcgat50
<210>24
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>24
aataattcctgagcaggcataagggtgtc29
- 还没有人留言评论。精彩留言会获得点赞!