一种驼乳乳清抗肿瘤活性蛋白及其制备方法和应用与流程
本发明属于医药技术领域,具体地说,本发明涉及。
背景技术:
骆驼是干旱、半干旱地区的主要畜种。分为单峰骆驼和双峰骆驼两种,单峰驼主要集中在东非、北非、印度次大陆地区和整个阿拉伯半岛,双峰驼主要分布在中国的北部和西北部地区以及整个蒙古国的沙漠或半沙漠地区,可产绒毛、泌乳、役用、肉用。
骆驼乳因其独特的物理性质及化学性质在人类营养和疾病治疗中发挥着重要的作用。骆驼乳中总蛋白含量为2.15%-4.90%,其中乳清蛋白占总蛋白的20%-25%。骆驼乳蛋白质属营养学上的优质蛋白质,其中含有α-乳清蛋白、免疫球蛋白、乳铁蛋白、血清白蛋白等保护性蛋白和多种生物活性因子,具有很高的营养价值。
目前,骆驼乳的功效研究多集中在辅助降血糖、调节机体免疫功能、抗菌、抗炎、抑制肿瘤细胞增殖、辅助治疗艾滋病、冠心病等方面。国内研究以双峰驼乳为主,国外尤其是沙特阿拉伯、阿联酋、伊朗、埃及等东亚和北非等地区,对单峰驼研究较多。
技术实现要素:
本发明提供一种驼乳乳清抗肿瘤活性蛋白及其制备方法和应用,通过本发明从双峰驼乳中获得的抗肿瘤活性蛋白含有糖基化依赖性细胞粘附分子1、α-乳白蛋白、乳清酸性蛋白、肽聚糖识别蛋白1、维生素D结合蛋白、乳过氧化物酶、IgG-Fc片段结合蛋白、14-3-3蛋白质、Igγ-3C区域、乳凝集素、Igλ-C亚型19样蛋白、乳铁蛋白、肌动蛋白、胺氧化酶、核连蛋白、泛素-60s核糖体蛋白L4、骨桥蛋白、RAS致癌基因家族成员Rab-18、Rab-11B、Rab-1A等蛋白质,具有明显的抗多种因素所致食管癌的作用,通过体外细胞模型研究,证明抗肿瘤活性蛋白对人肝癌细胞有抑制作用;并且抗肿瘤活性蛋白与化疗药物联用有显著的协同抗人食管癌肿瘤作用,增加肿瘤对化疗药物的敏感性,达到相同抑瘤效果的情况下可以通过减少化疗药物的用量减轻化疗的毒副作用。本发明驼乳乳清活性蛋白具有开发高效、低毒的新型抗肿瘤药物的前景,为临床上肿瘤的治疗提供了一种有效的手段以及药物组合方案。
本发明提供的一种驼乳乳清抗肿瘤活性蛋白CM-1的制备方法,通过包括如下步骤的方法制得:
(1)驼乳样品过滤除杂,脱脂,收集脱脂乳,调节pH至4.6,于30-80℃水浴加热10-45min或放置过夜后,离心去除沉淀,收集上清液,调节pH至初始值,分离乳清蛋白,其中超滤法经截留分子量10KDa-100KDa滤膜过滤,盐析法采用硫酸铵饱和度20%-70%进行分级沉淀,经聚丙烯酰胺凝胶电泳检测,得到分子量大小在10-100KDa范围的抗肿瘤活性蛋白组分CM-1,冻干备用;
(2)聚丙烯酰胺凝胶电泳检测蛋白组分CM-1蛋白质多态性,将步骤(1)获得的冻干组分用12-15%分离胶与5%浓缩胶进行聚丙烯酰胺凝胶电泳检测,考马斯亮蓝R-250染色,通过与已知分子量的蛋白质标准品比对,测定其分子量,保证每批样本蛋白质多态性一致。
本发明提供的通过如上制备方法获得一种驼乳乳清抗肿瘤活性蛋白CM-1。
本发明中,所述的驼乳乳清抗肿瘤活性蛋白CM-1通过分离乳清蛋白采用超滤的方法获得,以新疆双峰驼乳清蛋白为研究对象,通过蛋白提取获得抗肿瘤活性蛋白CM-1。
本发明中,所述分离乳清蛋白采用盐析的方法获得的抗肿瘤活性蛋白CM-1,硫酸铵饱和度在20%-70%范围的活性蛋白,其分子量范围为10-100KDa。
本发明根据上述提供的制备方法获得的抗肿瘤活性蛋白CM-1,共计含有218种蛋白质,其中30种为未知蛋白质,明确的188种如含有糖基化依赖性细胞粘附分子1(GlyCAM-1)、α-乳白蛋白(α-La)、乳清酸性蛋白(WAP)、肽聚糖识别蛋白1(PGRP-S)、维生素D结合蛋白、乳过氧化物酶、IgG-Fc片段结合蛋白样蛋白、14-3-3蛋白质、Igγ-3C、乳凝集素(Mfge8)、Igλ-C亚型19样蛋白、乳铁蛋白(Lf)、肌动蛋白(Actin)、胺氧化酶(SSAO)、核连蛋白(Nucleobindin)、泛素-60s核糖体蛋白L4(Ubiquitin-60S RP L4)、骨桥蛋白(OPN)、RAS致癌基因家族成员(Rab-18、Rab-11B、Rab-1A)等多种蛋白质与肿瘤发生发展密切相关,均与生命过程、细胞组成以及分子功能方面密切相关。
本发明提供的抗肿瘤活性蛋白CM-1中,相对含量大于1%的蛋白质有7种,分别是糖基化依赖性细胞粘附分子1(GlyCAM-1)、α-乳白蛋白(α-La)、乳清酸性蛋白(WAP)、肽聚糖识别蛋白1(PGRP-S)、Igγ-3C、乳凝集素(Mfge8)、Igλ-C亚型19样蛋白。
同时,本发明提供驼乳乳清抗肿瘤活性蛋白CM-1在新型抗肿瘤药物中的应用。通过实验可知,CM-1对人肝癌细胞HepG2细胞和人肝癌细胞BEL-7404细胞的增殖抑制作用呈现剂量和时间依赖性,在当CM-1浓度达到0.5mg/mL时细胞增殖抑制率可达到70%,浓度越高,抑制作用越强,而CM-1对正常细胞生长无明显毒副作用。
进一步,本发明提供驼乳乳清抗肿瘤活性蛋白CM-1与抗癌药物联合给药在抑制人食管癌肿瘤中的应用。通过实验表明活性蛋白CM-1与抗癌药物联合用药能够用较小的剂量达到较高的效应,同时有显著的协同抗肿瘤作用,可以增加肿瘤对化疗药物的敏感性,CM-1与化疗药物联用在达到相同抑瘤效果的情况下可以通过减少化疗药物的用量减轻化疗的毒副作用。
同时,本发明提供驼乳乳清抗肿瘤活性蛋白CM-1在抑制对肝癌、食管癌、宫颈癌、肺癌、结肠癌、前列腺癌等肿瘤细胞有明显抑制增殖作用,同时CM-1与化疗药物联合给药,抑制肿瘤细胞增殖的效果明显优于化疗药物单独给药,为肿瘤治疗提供一种多药联合方案。
通过实施本发明的技术方案,可以达到以下有益效果:
(1)本发明提供一种驼乳乳清抗肿瘤活性蛋白及其制备方法和应用,通过本发明获得的抗肿瘤活性蛋白含有糖基化依赖性细胞粘附分子1、α-乳白蛋白、乳清酸性蛋白、肽聚糖识别蛋白1、Igγ-3C、乳凝集素、Igλ-C亚型19样蛋白、乳铁蛋白、肌动蛋白、胺氧化酶、核连蛋白、泛素-60s核糖体蛋白L4、骨桥蛋白、RAS致癌基因家族成员等蛋白质。
(2)本发明提供一种驼乳乳清抗肿瘤活性蛋白及其制备方法和应用,以新疆双峰驼乳清蛋白为研究对象,通过蛋白质提取获得抗肿瘤活性蛋白CM-1,MTT法检测其对肿瘤细胞增殖的抑制作用,结果显示,CM-1对人肝癌细胞HepG2细胞和人肝癌细胞BEL-7404细胞的增殖抑制作用呈现剂量和时间依赖性,在当CM-1浓度达到0.5mg/mL时细胞增殖抑制率可达到70%左右,浓度越高,抑制作用越强,而CM-1对正常细胞生长无明显毒副作用。该蛋白可以在制备抗肿瘤药物中应用,也可在保健食品中应用。
(3)本发明提供一种驼乳乳清抗肿瘤活性蛋白及其制备方法和应用,体外细胞模型研究表明,CM-1与抗癌药物联合给药,抑制人食管癌肿瘤细胞Eca-109增殖的效果优于化疗药物单独给药,联合用药后,三种化疗药物紫杉醇、5-氟尿嘧啶、顺铂的中效浓度分别降低45.14%、85.71%、92.72%,表明联合用药能够用较小的剂量达到较高的效应,同时有显著的协同抗肿瘤作用,可以增加肿瘤对化疗药物的敏感性,CM-1与化疗药物联用在达到相同抑瘤效果的情况下可以通过减少化疗药物的用量减轻化疗的毒副作用。
(4)本发明提供驼乳乳清抗肿瘤活性蛋白CM-1在抑制对肝癌、食管癌、宫颈癌、肺癌、结肠癌、前列腺癌等肿瘤细胞有明显抑制增殖作用,同时CM-1与化疗药物联合给药,抑制肿瘤细胞增殖的效果明显优于化疗药物单独给药,为肿瘤治疗提供一种多药联合方案。
附图说明
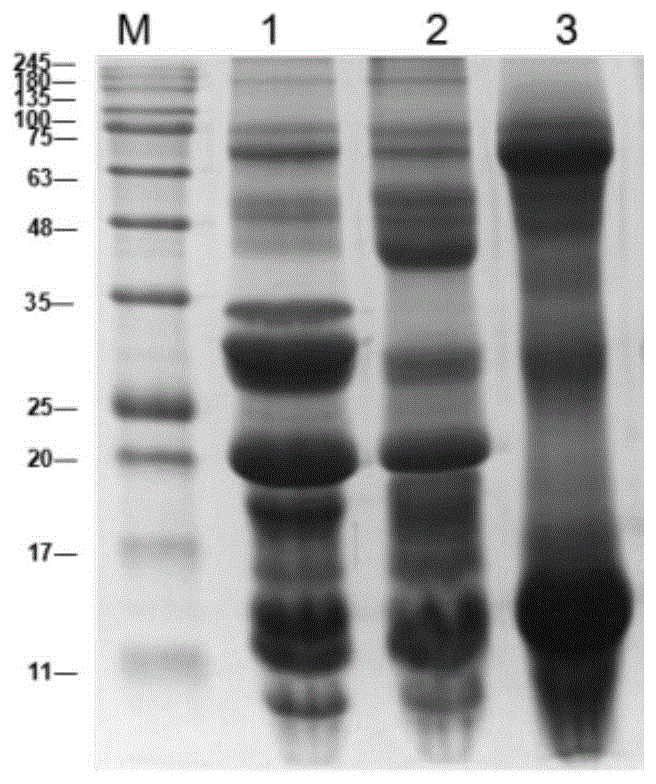
图1显示为驼乳蛋白SDS-PAGE检测凝胶成像图,图中,M为Marker,1表示驼乳蛋白0-20%组分、2表示驼乳蛋白20%-70%组分、3分别表示驼乳蛋白70%-100%组分图。
图2显示为驼乳蛋白组分对HepG-2细胞、BEL-7404细胞、L-02细胞增殖影响图,图中,A表示驼乳蛋白组分对BEL-7404细胞增殖影响图,*表示与5-FU相比差异显著,p<0.05;B表示驼乳蛋白组分对HepG-2细胞增殖影响图,***表示与5-FU相比差异极显著,p<0.01,C表示驼乳蛋白组分对L-02细胞增殖影响图,*表示与5-FU相比差异显著,p<0.05。
图3显示为台盼蓝染色检测不同浓度CM-1对HepG-2增殖的影响图,图中,物镜放大倍数20倍,A表示不添加CM-1的HepG-2增殖,B表示0.5mg/mL CM-1对HepG-2增殖影响图,C表示1mg/mL CM-1对HepG-2增殖影响图,D表示2mg/mL CM-1对HepG-2增殖影响图,E表示4mg/mL CM-1对HepG-2增殖影响图。
图4显示为TUNEL染色法检测不同浓度CM-1引起的HepG-2细胞凋亡图,图中,物镜放大倍数20倍,A表示不添加CM-1的HepG-2凋亡,B表示0.5mg/mL CM-1引起的HepG-2细胞凋亡图,C表示1mg/mL CM-1引起的HepG-2细胞凋亡图。
图5显示为5-FU、DDP、Taxol及CM-1对Eca-109作用48h后通过MTT法测定药物对细胞的抑制率图,图中,A表示Taxol单独作用和与CM-1联用对细胞增殖的影响图,B表示5-FU单独作用和与CM-1联用对细胞增殖的影响图,C表示DDP单独作用和与CM-1联用对细胞增殖的影响图,n=6,平均值±标准误差。
图6显示为Taxol、5-FU、DDP与CM-1联用作用于Eca-109细胞的量效关系曲线图,图中,A为Taxol与CM-1联用作用于Eca-109细胞的量效关系曲线图,B为5-FU与CM-1联用作用于Eca-109细胞的量效关系曲线图,C为DDP与CM-1联用作用于Eca-109细胞的量效关系曲线图,Fa表示作用效应,CI表示联合作用指数,CI<1表示协同作用,CI=1表示相加作用,CI>1表示拮抗作用。
具体实施方式
下面,举实施例说明本发明,但是,本发明并不限于下述的实施例。本发明中选用的所有材料、试剂和仪器、设备都为本领域熟知选用的,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,本发明中涉及到的%都为重量百分比,除非特别指出除外。
实施例一:双峰驼乳乳清蛋白的制备
(1)骆驼乳蛋白质提取
驼乳样品过滤除杂,脱脂,收集脱脂乳,调节pH至4.6,于30-80℃水浴加热10-45min或放置过夜后,离心去除沉淀;收集上清液,调节pH至初始值,分别采用超滤或盐析的方法分离乳清蛋白,其中超滤法经截留分子量10KDa-100KDa滤膜过滤,盐析法采用硫酸铵饱和度20%-70%进行分级沉淀,收集蛋白透析脱盐后冻干备用;
(2)聚丙烯酰胺凝胶电泳检测蛋白组分CM-1蛋白质多态性
将步骤(1)获得的冻干组分用12-15%分离胶与5%浓缩胶进行SDS-PAGE电泳,考马斯亮蓝R-250染色,凝胶成像系统拍照如附图1所示,各组分在组成上存在一定差异,其抑癌活性需要在体外细胞模型中进一步检测。
实施例二:MTT法和台盼蓝染色检测双峰驼乳乳清抑制癌细胞增殖活性
1、细胞培养
细胞培养基为含8%-15%胎牛血清、5%青霉素-链霉素双抗的DMEM完全培养基,于37℃、5%CO2的恒温培养箱中培养细胞,待单层细胞融合至70%以上,胰蛋白酶消化,收集细胞备用。
2、MTT法
血球计数板计数后接种于96孔培养板中,待细胞完全贴壁后,加入不同组分驼乳样品。24h后吸出培养液,加MTT溶液反应,静置培养4h后,DMSO溶解,于酶标仪上测定各孔在490nm处的吸光值(OD490)。细胞增殖抑制率计算按照下列公式:抑制率%=[1-(实验组OD值/空白组OD值)]×100%
以肝癌细胞为例,通过试验得到结果参见附图2所示,相比于驼乳乳清分离得到的三种组分,驼乳20%-70%组分抑制肝癌细胞增殖效果最为明显,且与阳性药物相比差异显著。此外,驼乳乳清分离获得的三种组分均不影响人正常肝细胞增殖,说明驼乳具有抑癌活性且不影响正常细胞增殖,将其中活性最好的组分20%-70%命名为CM-1。
3.台盼蓝染色
CM-1冻干粉用培养待测细胞所用的完全培养基复溶。待冻干粉完全溶解后,用0.22μm滤膜过滤2次,分装,-20℃保存。观察细胞生长状态稳定,融合至70%以上消化、离心、完全培养基重悬,计数后稀释细胞悬液密度至5×104-1×105个/mL,加入24孔板中,待细胞贴壁(过夜)后加入不同浓度蛋白组分进行处理,24h后吸出24孔板中培养液,加入0.5%台盼蓝染色,静置5min后,每组随机取10个视野显微镜下拍照,物镜放大倍数20x,计数被染蓝色细胞。
4.实验结果
如附图3结果显示,随着浓度增加,CM-1抑制细胞增殖效果逐渐明显,在1mg/mL、2mg/mL、4mg/mL时视野内出现大量死亡细胞,表明CM-1抑制细胞增殖效果明显且具有浓度依赖性。
实施例三:LC-MS/MS分析抗肿瘤活性蛋白CM-1
样品抗肿瘤活性蛋白CM-1加入适量SDT裂解液,经超声、沸水浴后,离心取上清。BCA法进行蛋白定量,分装,-80℃保存。
蛋白质溶液经FASP酶解后采用C18Cartridge对肽段进行脱盐,冻干,0.1%甲酸溶液复溶,OD280定量。
按照肽段定量结果取酶解后产物进行LC-MS/MS分析。肽段经色谱分离后使用Q-Exactive质谱仪(Thermo Scientific)进行质谱分析。
实验结果:通过以上LC-MS/MS质谱分析,结果如表1所示,共鉴定出218种蛋白质,其中30种为未知蛋白质,剩余188种均与生命过程、细胞组成以及分子功能方面密切相关,见表1。
相对含量大于1%的蛋白质有7种,分别是糖基化依赖性细胞粘附分子1(GlyCAM-1)、α-乳白蛋白(α-La)、乳清酸性蛋白(WAP)、肽聚糖识别蛋白1(PGRP-S)、Igγ-3C、乳凝集素(Mfge8)、Igλ链C亚型19样蛋白。
CM-1中含有多种与肿瘤发生、发展密切相关的蛋白质,如乳铁蛋白(Lf)、肌动蛋白(Actin)、胺氧化酶(SSAO)、核连蛋白(Nucleobindin)、泛素-60s核糖体蛋白L4(Ubiquitin-60S RP L4)、骨桥蛋白(OPN)、RAS致癌基因家族成员(Rab-18、Rab-11B、Rab-1A等)、糖基化依赖性细胞粘附分子1(GlyCAM-1)等。
表1:CM-1中蛋白质列表
实施例四:TUNEL法检测CM-1引起HepG-2细胞凋亡
细胞凋亡检测按照试剂盒操作说明进行。实验结果如附图4所示,图中箭头表示了部分凋亡细胞。TUNEL染色结果证明,CM-1可能通过诱导HepG-2产生凋亡抑制细胞增殖。
实施例五:CM-1与化疗药物联用对食管癌细胞Eca-109细胞增殖的影响
MTT法检测细胞增殖操作同实施例二一致。实验设计分为对照组(未处理癌细胞组)、实验组(CM-1单用组,抗癌药物单用组,CM-1与抗癌药物联用组),48h后检测各孔在490nm处的吸光值,计算细胞增殖抑制率。
食管癌及常见的肿瘤中,常用的化疗药物为5-氟尿嘧啶(5-FU)、顺铂(DDP)、紫杉醇(Taxol)、甲氨蝶呤(MTX)、复方替加氟(UFT)、阿糖胞苷(CAR)、丝裂霉素(MMC)、博来霉素(BLM)。
如附表2和参见附图5所示,表2中5-FU、DDP、Taxol及CM-1作用于Eca-109的半数致死浓度分别为19.66、92.7、1.71和601.7μg/mL。图5结果显示,抗癌药物与CM-1联合给药抑制肿瘤细胞Eca-109增殖的效果优于化疗药物单独给药。
表2:5-FU、DDP、Taxol及CM-1对Eca-109的半数抑制浓度
实施例六:Chou-Talalay联合指数法判定药物联合作用的效果
根据Chou-Talalay中效方程fa/fu=(D/Dm)m,式中fu=1-fa,fa为有效比值,D为药物剂量,Dm为中效剂量即IC50。方程两边取对数,得到lg(fa/fu)=lg(D/Dm)m=mlogD-mlogDm,设b=m,X=lgD,a=-mlogDm,Y=lg(fa/fu),得到线性回归方程(1):
Y=bX+a (1)
由上述方程式可计算出两种药物单独作用及联合作用的IC50,以及产生不同效应需要的药物剂量。
两种药物的联合作用指数(combination index,CI)的计算公式为:
CI=(D)1/(DX)1+(D)2/(DX)2+α×(D)1×(D)2/(DX)1×(DX)2 (2)
(DX)1和(DX)2为两种药物单独使用产生X抑制率时所需剂量,D1和D2为两种药物联合用药产生相同X抑制率时各自所需浓度,α由线性回归方程(1)确定,方程式的斜率相等,α=0,表示两种相互排斥性药物;斜率不相等,α=1,表示两种相互非排斥性药物。如果CI<1,两种药物作用为协同效应;CI>1,两种药物作用为拮抗作用;CI=1,两种药物作用为相加作用。
以食管癌为例,由附图6可知,Fa在0.3-0.8范围内,Taxol与CM-1具有协同抑制效应;Fa>0.3,5-FU与CM-1具有协同抑制效应;Fa在0.5-0.9范围内,DDP与CM-1能够协同抑制肿瘤细胞增殖。
由附表3可知,抗癌药物与CM-1在体外合用之后,对人食管癌细胞株Eca-109效应增加。联合用药后,三种化疗药物Taxol、5-FU、DDP的中效浓度分别降低45.14%、85.71%、92.72%,表明联合用药能够用较小的剂量达到较高的效应,从而减轻药物不良反应。
表3:5-FU、Taxol、DDP与CM-1单用及联用时中效浓度变化
通过上述系列实验可知,本发明提供的一种驼乳乳清抗肿瘤活性蛋白CM-1,是以新疆双峰驼乳清蛋白为研究对象,通过蛋白提取获得抗肿瘤活性蛋白CM-1,MTT法结果显示,CM-1对人肝癌细胞HepG2细胞和人肝癌细胞BEL-7404细胞的增殖抑制作用呈现剂量和时间依赖性,在当CM-1浓度达到0.5mg/mL时细胞增殖抑制率可达到70%左右,浓度越高,抑制作用越强,而CM-1对正常细胞生长无明显毒副作用。该蛋白可以在制备抗肿瘤药物中应用,也可在保健食品中应用。
上述系列实施例提供的一种驼乳乳清抗肿瘤活性蛋白CM-1,通过系列实验验证驼乳乳清抗肿瘤活性蛋白CM-1与抗癌药物联合给药的效果,通过体外细胞模型研究表明,CM-1与抗癌药物联合给药,抑制人食管癌肿瘤细胞Eca-109增殖的效果优于化疗药物单独给药,联合用药后,三种化疗药物紫杉醇、5-氟尿嘧啶、顺铂的中效浓度分别降低45.14%、85.71%、92.72%,表明联合用药能够用较小的剂量达到较高的效应,同时有显著的协同抗肿瘤作用,可以增加肿瘤对化疗药物的敏感性,CM-1与化疗药物联用在达到相同抑瘤效果的情况下可以通过减少化疗药物的用量减轻化疗的毒副作用。
在上述提供的不是全部的实验基础上,本发明提供驼乳乳清抗肿瘤活性蛋白CM-1在抑制对肝癌、食管癌、宫颈癌、肺癌、结肠癌、前列腺癌等肿瘤细胞有明显抑制增殖作用,同时CM-1与化疗药物联合给药,抑制肿瘤细胞增殖的效果明显优于化疗药物单独给药,为肿瘤治疗提供一种多药联合方案。
上述实施例仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所延伸出的显而易见的变化或变动仍处于本发明的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!