一种来源于羊草与抗冷相关的蛋白质及其编码基因与应用的制作方法
本发明涉及生物
技术领域:
中,一种来源于羊草与抗冷相关的蛋白质及其编码基因与应用。
背景技术:
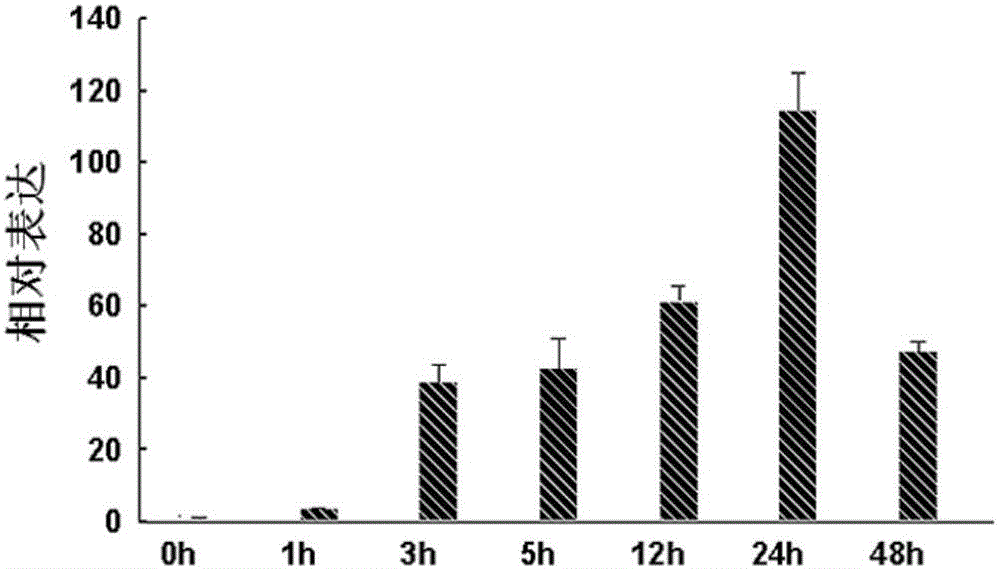
:在植物生长发育过程中,温度作为一个重要的环境因子在植物生长发育过程中发挥着至关重要的作用。很多植物都面临着低温伤害的问题,植物在低温条件下会遭到不同程度的冷伤害,严重时甚至会导致植株死亡。低温胁迫分为冷害(0-15℃)和冻害(<0℃)。而起源于热带、亚热带的许多植物是不能进行冷驯化的,它们对低温很敏感,即使是冷胁迫也会极大降低其存活能力。低温胁迫明显降低植物特别是农作物的产量,全球每年因低温伤害造成的损失高达数千亿元。在高等植物中,迄今研究最清楚的是CBF(CRT/DREbindingfactor,也被称为DREB)低温调控网络。CBF在低温条件下被诱导表达,是低温信号途径中重要的转录因子之一,其主要调控的下游靶基因涉及磷酸肌醇代谢和转录、活性氧清除物、膜转运、激素新陈代谢和信号途径等一系列和低温相关的生物学变化。尽管前人研究中已经分离了一些抗低温胁迫相关的基因,并利用转基因技术开展了功能验证研究。但总体来说,目前可用于植物分子育种并具有重大应用价值的基因仍极为匮乏。首先,植物低温调控网络复杂,对其信号传导和调控机制的研究尚缺乏突破性的研究成果。其次,大多数关于植物响应胁迫相关基因的克隆及功能研究主要集中在拟南芥,水稻等模式植物或一些重要的一年生栽培作物上,这些植物都不能忍受冷环境,0℃~12℃即造成伤害,抗冷冻的能力有限。如果仅仅研究模式植物来揭示植物响应低温的机制这可能限制对重要的多年生作物低温响应机制的揭示及研究的深度。多年生牧草在长期环境压力下,形成对极端环境的抵抗,能够适应冬天寒冷气候(-4℃~-51℃)。因此,对这些多年生牧草关键抗性基因进行克隆及功能研究,并利用转基因技术将优质的抗冷基因资源用于改良重要农作物与畜牧草的抗冻能力,必将加速我国及世界农业与畜牧业转基因抗冻育种进程。近年,随着高通量测序技术的快速发展与广泛应用,加快了优异抗逆植物基因资源的挖掘,通过利用高通量测序技术对特定胁迫处理的植物材料进行测序分析,以得到与特定胁迫处理密切相关的差异表达基因,从而为发现胁迫应途径中的新基因开拓了新的途径。随着对耐低温新基因的持续发掘和进一步的功能验证,人们对于植物耐冷机制的了解得以拓展。随着现代基因工程技术的持续进步,利用转基因技术改良植物的抗冷性,对于维护未来农业与畜牧业的高产稳产和可持续发展具有重要意义。技术实现要素:本发明所要解决的技术问题是如何提高植物的抗冷性。为解决上述技术问题,本发明首先提供了一种来源于羊草(Leymuschinensis(Trin.)Tzvel.)的具有提高植物抗冷性的蛋白质,记为LcFIN2,LcFIN2为如下A1)或A2)或A3):A1)氨基酸序列为序列1的蛋白质;A2)在序列1的氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的具有相同功能的由A1)衍生的蛋白质;A3)在A1)或A2)的N端或/和C端连接标签得到的融合蛋白质。为了使A1)中的蛋白质便于纯化,可在由序列表中序列1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如下表所示的标签。表:标签的序列标签残基序列Poly-Arg5-6(通常为5个)RRRRRPoly-His2-10(通常为6个)HHHHHHFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述A2)中的LcFIN2蛋白质,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。上述A2)中的LcFIN2蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。上述A2)中的LcFIN2蛋白质的编码基因可通过将序列2的第90-821位所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上上表所示的标签的编码序列得到。其中,序列2的第90-821位所示的DNA分子编码序列1所示的LcFIN2蛋白质。本发明还提供了与LcFIN2相关的生物材料,所述生物材料为下述B1)至B14)中的任一种:B1)编码LcFIN2的核酸分子;B2)含有B1)所述核酸分子的表达盒;B3)含有B1)所述核酸分子的重组载体;B4)含有B2)所述表达盒的重组载体;B5)含有B1)所述核酸分子的重组微生物;B6)含有B2)所述表达盒的重组微生物;B7)含有B3)所述重组载体的重组微生物;B8)含有B4)所述重组载体的重组微生物;B9)含有B1)所述核酸分子的转基因植物细胞系;B10)含有B2)所述表达盒的转基因植物细胞系;B11)含有B1)所述核酸分子的转基因植物组织;B12)含有B2)所述表达盒的转基因植物组织;B13)含有B1)所述核酸分子的转基因植物器官;B14)含有B2)所述表达盒的转基因植物器官。上述生物材料中,B1)所述核酸分子可为如下b1)、b2)、b3)、b4)或b5):b1)编码序列是序列表中序列2的第90-821位的cDNA分子或DNA分子;b2)核苷酸序列是序列表中序列2的第90-821位的cDNA分子或DNA分子;b3)核苷酸序列是序列表中序列2的cDNA分子或DNA分子;b4)与b1)或b2)或b3)限定的核苷酸序列具有75%或75%以上同一性,且编码LcFIN2的cDNA分子或基因组DNA分子;b5)在严格条件下与b1)或b2)或b3)限定的核苷酸序列杂交,且编码LcFIN2的cDNA分子或基因组DNA分子。其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码LcFIN2蛋白质的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的LcFIN2蛋白质的核苷酸序列75%或者更高同一性的核苷酸,只要编码LcFIN2蛋白质且具有LcFIN2蛋白质功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列1所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。上述应用中,所述严格条件是在2×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次15min;或,0.1×SSPE(或0.1×SSC)、0.1%SDS的溶液中,65℃条件下杂交并洗膜。上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。上述应用中,B2)所述的含有编码LcFIN2蛋白质的核酸分子的表达盒(LcFIN2基因表达盒),是指能够在宿主细胞中表达LcFIN2蛋白质的DNA,该DNA不但可包括启动LcFIN2基因转录的启动子,还可包括终止LcFIN2基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子,组织、器官和发育特异的启动子,和诱导型启动子。启动子的例子包括但不限于:花椰菜花叶病毒的组成型启动子35S:来自西红柿的创伤诱导型启动子,亮氨酸氨基肽酶("LAP",Chao等人(1999)PlantPhysiol120:979-992);来自烟草的化学诱导型启动子,发病机理相关1(PR1)(由水杨酸和BTH(苯并噻二唑-7-硫代羟酸S-甲酯)诱导);西红柿蛋白酶抑制剂II启动子(PIN2)或LAP启动子(均可用茉莉酮酸甲酯诱导);热休克启动子(美国专利5,187,267);四环素诱导型启动子(美国专利5,057,422);种子特异性启动子,如谷子种子特异性启动子pF128(CN101063139B(中国专利200710099169.7)),种子贮存蛋白质特异的启动子(例如,菜豆球蛋白、napin,oleosin和大豆betaconglycin的启动子(Beachy等人(1985)EMBOJ.4:3047-3053))。它们可单独使用或与其它的植物启动子结合使用。此处引用的所有参考文献均全文引用。合适的转录终止子包括但不限于:农杆菌胭脂碱合成酶终止子(NOS终止子)、花椰菜花叶病毒CaMV35S终止子、tml终止子、豌豆rbcSE9终止子和胭脂氨酸和章鱼氨酸合酶终止子(参见,例如:Odell等人(I985)Nature313:810;Rosenberg等人(1987)Gene,56:125;Guerineau等人(1991)Mol.Gen.Genet,262:141;Proudfoot(1991)Cell,64:671;Sanfacon等人GenesDev.,5:141;Mogen等人(1990)PlantCell,2:1261;Munroe等人(1990)Gene,91:151;Ballad等人(1989)NucleicAcidsRes.17:7891;Joshi等人(1987)NucleicAcidRes.,15:9627)。可用现有的表达载体构建含有所述LcFIN2基因表达盒的重组载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。如pAHC25、pBin438、pCAMBIA1302、pCAMBIA2301、pCAMBIA1301、pCAMBIA1300、pBI121、pCAMBIA1391-Xa、PSN1301或pCAMBIA1391-Xb(CAMBIA公司)等。所述植物表达载体还可包含外源基因的3′端非翻译区域,即包含聚腺苷酸信号和任何其它参与mRNA加工或基因表达的DNA片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mRNA前体的3′端,如农杆菌冠瘿瘤诱导(Ti)质粒基因(如胭脂碱合成酶基因Nos)、植物基因(如大豆贮存蛋白基因)3′端转录的非翻译区均具有类似功能。使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是ATG起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(GUS基因、萤光素酶基因等)、抗生素的标记基因(如赋予对卡那霉素和相关抗生素抗性的nptII基因,赋予对除草剂膦丝菌素抗性的bar基因,赋予对抗生素潮霉素抗性的hph基因,和赋予对氨甲喋呤抗性的dhfr基因,赋予对草甘磷抗性的EPSPS基因)或是抗化学试剂标记基因等(如抗除莠剂基因)、提供代谢甘露糖能力的甘露糖-6-磷酸异构酶基因。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以逆境筛选转化植株。上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。所述质粒具体可为载体pSN1301或pCAMBIA1302载体。所述重组载体具体可为pSN1301-LcFIN2或pCAMBIA1302-LcFIN2,所述pSN1301-LcFIN2为将pSN1301的KpnI和SacI识别序列间的DNA片段替换为序列2的第90-821位所示的DNA片段导得到的重组载体,所述pSN1301-LcFIN2能表达序列1所示的LcFIN2蛋白质;所述pCAMBIA1302-LcFIN2为将pCAMBIA1302载体的BglII和SpeI识别序列间的DNA片段替换为序列2的第90-821位所示的DNA片段得到的重组载体,所述pCAMBIA1302-LcFIN2能表达LcFIN2融合GFP的融合蛋白质。上述应用中,所述微生物可为酵母、细菌、藻或真菌。其中,细菌可为农杆菌,如农杆菌EHA105。上述应用中,所述转基因植物细胞系、转基因植物组织和转基因植物器官均不包括繁殖材料。本发明还提用了植物抗冷产品,所述产品含有LcFIN2或所述生物材料。所述植物抗冷产品可以LcFIN2或所述生物材料作为其活性成分,还可以将LcFIN2或所述生物材料与其他具有植物抗冷作用的物质一起作为其活性成分。本发明还提供了LcFIN2或所述生物材料的下述任一应用:C1)在调控植物抗冷性中的应用;C2)在制备调控植物抗冷性产品中的应用;C3)在提高植物抗冷性中的应用;C4)在制备提高植物抗冷性产品中的应用;C5)在培育抗冷性增强植物中的应用。本发明还提供一种培育抗冷性增强植物的方法,所述方法包括:增加目的植物中LcFIN2的活性、增加目的植物中LcFIN2的含量或促进LcFIN2的编码基因的表达,得到与所述目的植物相比抗冷性增强的抗冷植物。上述方法中,所述抗冷植物是通过向所述目的植物中导入LcFIN2的编码基因得到的植物。上述方法中,LcFIN2的编码基因可为所述核酸分子。上述方法中,其中所述LcFIN2的编码基因可先进行如下修饰,再导入目的植物中,以达到更好的表达效果:1)根据实际需要进行修饰和优化,以使基因高效表达;例如,可根据目的植物所偏爱的密码子,在保持本发明所述LcFIN2的编码基因的氨基酸序列的同时改变其密码子以符合植物偏爱性;优化过程中,最好能使优化后的编码序列中保持一定的GC含量,以最好地实现植物中导入基因的高水平表达,其中GC含量可为35%、多于45%、多于50%或多于约60%;2)修饰邻近起始甲硫氨酸的基因序列,以使翻译有效起始;例如,利用在植物中已知的有效的序列进行修饰;3)与各种植物表达的启动子连接,以利于其在植物中的表达;所述启动子可包括组成型、诱导型、时序调节、发育调节、化学调节、组织优选和组织特异性启动子;启动子的选择将随着表达时间和空间需要而变化,而且也取决于靶物种;例如组织或器官的特异性表达启动子,根据需要受体在发育的什么时期而定;尽管证明了来源于双子叶植物的许多启动子在单子叶植物中是可起作用的,反之亦然,但是理想地,选择双子叶植物启动子用于双子叶植物中的表达,单子叶植物的启动子用于单子叶植物中的表达;4)与适合的转录终止子连接,也可以提高本发明基因的表达效率;例如来源于CaMV的tml,来源于rbcS的E9;任何已知在植物中起作用的可得到的终止子都可以与本发明基因进行连接;5)引入增强子序列,如内含子序列(例如来源于Adhl和bronzel)和病毒前导序列(例如来源于TMV,MCMV和AMV)。所述LcFIN2的编码基因可利用含有所述LcFIN2的编码基因的重组表达载体导入目的植物。所述重组表达载体具体可为所述pSN1301-LcFIN2。所述重组表达载体可通过使用Ti质粒,植物病毒栽体,直接DNA转化,微注射,电穿孔等常规生物技术方法导入植物细胞(Weissbach,1998,MethodforPlantMolecularBiologyVIII,AcademyPress,NewYork,pp.411-463;GeisersonandCorey,1998,PlantMolecularBiology(2ndEdition).)。所述抗冷植物理解为不仅包含将所述LcFIN2的编码基因转化目的植物得到的第一代转基因植物,也包括其子代。对于转基因植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述抗冷植物包括种子、愈伤组织、完整植株和细胞。扩增所述核酸分子的全长或其任一片段的引物对,也属于本发明的保护范围。在本发明的一个实施例中,所述引物对具体如下:F:5’-ATGCCGTGTCTTGGCTCT-3’;R:5’-TCATTTAATCAAAGTAGTGGTACAG-3’。本发明中,所述植物可为双子叶植物(如拟南芥)或单子叶植物;所述目的植物可为双子叶植物(如拟南芥)或单子叶植物。在本发明中,以上的所述抗冷可体现为抗-8℃胁迫处理。所述处理的时间可为12小时。本发明所提供的LcFIN2可以调控植物抗寒冷胁迫能力,受低温胁迫诱导,可以参与羊草对低温胁迫的响应,提高植物的抗冷,LcFIN2及其编码基因对于培育抗冷性提高的羊草及其他植物新品种具有重要实用价性。实验显示,对转基因及野生型植物进行4℃低温驯化处理3d后,进行-8℃,12h低温胁迫后,野生型拟南芥植株存活率为20%,而转LcFIN2基因植株的存活率则为80%左右,是野生型拟南芥存活率的4倍。可见,本发明所提供的Lc5423可用于农作物与重要畜牧草所需的抗冷新品种的培育与鉴定,具有较高的应用价值。本发明在农业、畜牧业及绿色清洁能源等领域具有广阔的应用前景。附图说明图1为LcFIN2基因在低温胁迫(4℃)条件下的相对表达量分析。其中,将0h时LcFIN2基因的表达量设定为1。图2为LcFIN2基因在不同组织中的表达量分析。其中,将穗中LcFIN2基因的表达量设定为1。图3为转入pCAMBIA1302空载体的烟草表皮细胞的激光共聚焦/TIRF显微镜图。其中,A为荧光下的烟草叶片表皮细胞;B为明场下的烟草叶片表皮细胞;C为叶绿体自发荧光,D为A、B和C的叠加。图4为转入重组表达载体pCAMBIA1302-Lc5423的烟草表皮细胞的激光共聚焦/TIRF显微镜图。其中,A为荧光下的烟草叶片表皮细胞;B为明场下的烟草叶片表皮细胞;C为叶绿体自发荧光,D为A、B和C的叠加。图5为含有重组表达载体pSN1301-Lc5423的酶切鉴定结果。其中,泳道M为Trans2KPlusDNAMarker(北京全式金生物技术有限公司);泳道1为pSN1301-Lc5423酶切条带。图6为转LcFIN2基因拟南芥植物的PCR检测结果。其中,泳道WT表示未转基因的野生型拟南芥植株对照,其余泳道表示不同的pSN1301-Lc5423转基因株系。图7为T3代转LcFIN2基因拟南芥的抗冷性检测结果。其中,a为野生型(WT)与转LcFIN2基因拟南芥株系(Line1、Line2和Line4)未进行处理前生长状态;b为野生型与转LcFIN2基因拟南芥株系处理后恢复10d后生长状态。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应DNA的5′末端核苷酸,末位均为相应DNA的3′末端核苷酸。实施例1、羊草抗冷相关蛋白LcFIN2的制备本实施例提供了一种来源于羊草(Leymuschinensis(Trin.)Tzvel.)品种中科1号(记载于“XXLi,SLHou,QGao,etal.LcSAIN1,anovelsalt-inducedgenefromsheepgrass,conferssaltstresstoleranceintransgenicArabidopsisandrice.PlantandCellPhysiology,2013,54(7),1172-1185”一文,公众可从中国科学院植物研究所获得)的抗冷相关蛋白,其名称为LcFIN2,序列为序列表中序列1,该蛋白质在羊草中的全长cDNA序列如序列表中序列2所示,其中,序列2的第90-821位编码LcFIN2。实施例2、LcFIN2基因在胁迫条件下的表达模式及组织特异性分析将正常生长4周的羊草品种中科1号的幼苗进行低温胁迫(4℃)处理。胁迫处理时间分别为0、1、3、5、12、24、48小时。分别提取上述处理羊草幼苗的总RNA,通过qRT-PCR方法分析LcFIN2基因在低温胁迫条件下的表达模式。其中扩增LcFIN2基因引物序列为5’-GCCGTCGTCATCTACTTCGTCT-3’(序列2的第161-182位)和5’-GATTCTCACTCCTTGCTCCCC-3’(与序列2的第308-329位的反向互补序列);以Actin作为内参基因,扩增内参Actin的引物序列为5’-GTGCTTTCCCTCTATGCAAGTGGT-3’和5’-CTGTTCTTGGCAGTCTCCAGCTC-3’;应用两步法PCR扩增标准程序:95℃10s;95℃5s,60℃20s,40个循环;72℃10min。结果如图1所示,LcFIN2基因的转录水平明显受低温胁迫诱导,随着低温处理时间的延长,LcFIN2基因的表达量迅速增加。以2年生羊草品种中科1号为实验材料,分别提取穗、叶、叶鞘、茎、和根共五种组织的总RNA,利用qRT-PCR分析LcFIN2基因的组织特异性表达模式(具体操作上参照上文)。结果如图2所示,LcFIN2基因在羊草的穗、叶、叶鞘、茎、和根五种组织中的表达存在差异,其中在叶中表达量最高。实施例3、LcFIN2基因的亚细胞定位将pCAMBIA1302载体的BglII和SpeI识别序列间的DNA片段替换为序列2的第90-821位所示的LcFIN2基因,将得到的序列正确的重组表达载体命名为pCAMBIA1302-LcFIN2。pCAMBIA1302-LcFIN2能表达LcFIN2融合GFP的融合蛋白质,该融合蛋白的表达由35S启动。将重组表达载体pCAMBIA1302-LcFIN2通过冻融法导入根癌农杆菌EHA105,采用叶脉注射的方法转入幼嫩的烟草叶片细胞,同时以转入pCAMBIA1302空载体的烟草表皮细胞作为对照。转化的烟草在23℃条件下生长2-3d后用激光共聚焦/TIRF显微镜(LeicaTCSSP5)下观察并照相。结果如图3(转入pCAMBIA1302空载体的烟草)和图4(转入重组表达载体pCAMBIA1302-LcFIN2的烟草)所示:转入载体pCAMBIA1302的转基因细胞中表达的蛋白分布在整个细胞内;转入重组表达载体pCAMBIA1302-LcFIN2的转基因细胞中表达的蛋白则特异地定位于叶绿体内。这一结果表明LcFIN2蛋白在烟草表皮细胞的叶绿体中表达。实施例4、转LcFIN2基因拟南芥的获得及其抗冷性检测一、表达载体pSN1301-LcFIN2的构建利用如下引物从羊草品种中科1号的cDNA中扩增得到编码LcFIN2的序列2的第90-821位所示的LcFIN2基因:F:5’-ATGCCGTGTCTTGGCTCT-3’;R:5’-TCATTTAATCAAAGTAGTGGTACAG-3’。将植物表达载体pSN1301(BioVector质粒载体菌种细胞基因保藏中心)的KpnI和SacI识别序列间的DNA片段替换为序列2的第90-821位所示的LcFIN2基因,将得到的序列正确的重组表达载体命名为pSN1301-LcFIN2。构建的载体经酶切鉴定和测序鉴定(图5)。其中,泳道M为DL2000DNA分子量标准(北京全式金生物技术有限公司)的DNA分子量标准,泳道1为pSN1301-LcFIN2质粒条带。将重组载体通过冻融法导入根癌农杆菌EHA105,得到重组农杆菌EHA105/pSN1301-LcFIN2。二、转LcFIN2基因拟南芥的获得将重组载体通过冻融法导入根癌农杆菌EHA105,采用农杆菌花序侵染的方法(参见:BechtoldN等,(1993)InplantaAgrobacterium-mediatedgenetransferbyinfiltrationofadultArabidopsisthalianaplants.C.R.Acad.Sci.316:1194–1199)将上述所得的重组农杆菌EHA105/pSN1301-LcFIN2转化拟南芥品种哥伦比亚(Col-0)(CarolinaBiologicalSupplyCompany公司,Arabidopsis:Columbia(Col-0)Seed,货号:177600)。利用转含pSN1301空载体的农杆菌作为对照。转化后进行潮霉素(原文件步骤1最后的内容为利用潮霉素进行筛选,此处为卡那霉素,请核实)抗性筛选,收集具有潮霉素抗性的转基因拟南芥的种子(T1代),并在含有潮霉素的平板上培养。再次通过潮霉素抗性筛选,获得具有潮霉素抗性的转基因苗,即转入pSN1301-LcFIN2的拟南芥植株。通过PCR鉴定筛选阳性株系(图6),所用引物为F:5’-GCCGTCGTCATCTACTTCGTCT3’;R:5’-GATTCTCACTCCTTGCTCCCC-3’。Line1、2、4、6和7为阳性株系,选取3个纯合体转LcFIN2基因拟南芥株系(T3代)进行抗冷性试验。三、T3代转LcFIN2基因拟南芥的抗冷性检测选取经步骤二鉴定阳性的3个T3代纯合体株系进行抗冷试验(表1),并利用未转基因的哥伦比亚(Col-0)野生型(WT)以及转pSN1301空载体的拟南芥作为对照。具体方法如下:将在土壤中正常生长2-3周的野生型拟南芥、转pSN1301空载体的拟南芥与转LcFIN2基因拟南芥(Col-0/pSN1301-LcFIN2)同时移往已设置特定温度(4℃)的低温培养箱中进行低温驯化3天,后再移入-8℃培养箱中过夜(12小时)冷冻处理后取出,并于22℃正常培养条件下恢复生长7-10天,观察其表型,并统计各组植株的存活率。野生型(WT)与转LcFIN2基因拟南芥株系(Line1、Line2和Line4)未进行处理前生长状态及抗冷处理后的生长状态如图7所示。存活率统计结果显示,经-8℃过夜寒冷胁迫后野生型拟南芥植株存活率仅为20%,而三个转LcFIN2基因株系的存活率分别为75%、70%和80%,约为野生型拟南芥存活率的4倍,转pSN1301空载体的拟南芥的存活率与野生型拟南芥无显著差异。这表明转LcFIN2基因株系和作为空白对照的WT(野生型)拟南芥相比,抗冷能力得到明显提高。表1T3代转LcFIN2基因拟南芥在冷胁迫(-8℃)下的存活率(%)统计拟南芥重复1重复2重复3重复4平均值WT020402020Line180804010075Line2206010010070Line460100808080<110>中国科学院植物研究所<120>一种来源于羊草与抗冷相关的蛋白质及其编码基因与应用<210>1<211>243<212>PRT<213>羊草(Leymuschinensis)<400>1MetProCysLeuGlySerMetProLeuGlyPheGlnProProGluLeu151015AlaSerSerSerArgTrpThrLeuProSerSerSerThrSerSerPro202530TrpTrpArgLysArgGluGlyAlaGlySerAlaGlyIleProProAsn354045LysLeuAlaAlaValProArgValGluAlaAspLeuValLeuPhePro505560LeuSerLeuArgSerArgGlyAspGlyGlyGluGlnGlyValArgIle65707580HisHisGlyPheValProTrpArgCysAlaSerProAspProSerPhe859095ArgArgArgLeuTyrArgProLeuIleTrpArgArgThrSerGlyVal100105110AspLeuGluMetAspAspGlyAspHisGluLeuAsnArgArgTrpPhe115120125GlnArgSerHisGlyAlaHisGlyGlyTrpProValSerSerHisAsp130135140ProSerHisLeuArgAlaGluTrpArgProSerSerPheLeuLeuAla145150155160CysValProAsnGlyArgGlnPheCysThrLysMetGluSerAlaAla165170175SerTyrCysGlyGlyLeuAlaGlyProSerGlyProSerProAlaPro180185190AlaLysIleAlaSerMetAlaLysGlnPheGlyProAspCysValPhe195200205HisPheMetPheGlyValLeuPheValArgSerArgValTrpSerVal210215220IlePheSerPhePheArgValLeuCysValMetLeuCysThrThrThr225230235240LeuIleLys<210>2<211>880<212>DNA<213>羊草(Leymuschinensis)<400>2caggacaggtaggagcccgggatctgcttgtgtatattagcttagctgtcgtggttgtta60gtcttggccttgtgccgtgtcttggctctatgccgtgtcttggctctatgccgttgggat120tccaaccaccggagcttgcgagcagcagccggtggacgctgccgtcgtcatctacttcgt180ctccatggtggaggaaaagggagggcgccggatccgcaggtatcccccctaataagctcg240ctgcggtgcctcgtgttgaagccgatctggtgctctttcctctctctctccgcagtcgtg300gtgacggtggggagcaaggagtgagaatccaccacggcttcgtcccttggcgctgtgcct360cgccggatcccagcttccggcggcggctgtatcgtcccctgatctggagaaggacctccg420gcgtcgatctggagatggacgatggggatcatgagcttaaccgacggtggttccagagga480gccatggcgcccacggtggctggccggtttcctctcacgatccgtcgcatcttcgggccg540aatggcggccatcttcattcctcctggcatgtgtgcctaatgggaggcagttctgcacta600agatggagtctgcagcttcatactgcggaggtctcgccggaccaagtggtccgtccccgg660cgccggcgaagattgcatccatggcgaagcagtttggacccgattgcgttttccacttta720tgttcggggtccttttcgtaagatccagggtctggtctgtaattttcagtttctttaggg780tcctgtgtgtgatgctctgtaccactactttgattaaatgaagcatctggggccttcggg840ctcctacctgtgaaaaaaaaaaaaaaaaaaaaaaaaaaaa880当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1