猪传染性胃肠炎病毒新型基因工程亚单位疫苗的制作方法
本申请涉及动物免疫药物技术领域,具体而言,涉及一种猪传染性胃肠炎病毒新型基因工程亚单位疫苗。
背景技术:
猪传染性胃肠炎(Transmissible Gastroenteritis,TGE)是由猪传染性胃肠炎病毒引起猪的一种高度接触性消化道传染病。该病以呕吐、水样腹泻和脱水为特征,严重可导致死亡,不同品种和年龄的猪对该病都易感,尤其是2周龄以内的小猪死亡率可高达100%。OIE将其列为B类动物疫病。
猪传染性胃肠炎病毒(Transmissible Gastroenteritis virus of Swine,TGEV)属冠状病毒科冠状病毒属成员,TGEV的主要结构蛋白有三种:纤突糖蛋白(S或E2)、膜结构蛋白(M或E1)、核蛋白(N)。其中,S1糖蛋白是唯一能诱导中和抗体产生和提供免疫保护作用的结合蛋白,是TGEV免疫研究的重点。
目前用于预防、控制猪传染性胃肠炎的疫苗较多都是传统的弱毒苗和灭活疫苗,只有少数基因工程亚单位疫苗。但灭活疫苗存在自身免疫保护力较弱,且存在灭活不完全,造成散毒的风险;弱毒活疫苗存在毒株毒力返强的风险。
专利CN 103194471A申请公开了包含猪传染性胃肠炎病毒S1基因的片段和N基因的双基因乳酸菌疫苗,但是免疫原性不佳。专利CN 104740626B公开了一种预防猪传染性胃肠炎的疫苗,该专利使用重组沙门氏菌作为载体,沙门氏菌是原核表达,抗原蛋白缺少必要的糖基化修饰,免疫原性差,免疫沙门氏菌,副反应大,且沙门氏菌存在返强的风险。本发明因此而来。
技术实现要素:
本申请旨在提供一种免疫组合物,以解决现有技术中的问题。
为了实现上述目的,根据本申请的一个方面,提供了一种免疫组合物,包含:
采用SEQ ID NO:1的核酸分子或者与SEQ ID NO:1的核苷酸序列95%以上相同的核酸分子编码的猪传染性胃肠炎病毒S1蛋白。
本发明进一步的技术方案是:所述的猪传染性胃肠炎病毒S1蛋白包含SEQ ID NO:2的氨基酸序列或者与SEQ ID NO:2的全长氨基酸序列95%以上相同的氨基酸序列。
本发明的另一目的在于提供一种所述的免疫组合物用于生产用于在受试动物中诱导针对猪传染性胃肠炎病毒抗原的免疫反应的药剂的用途。
本发明的又一目的在于提供一种所述的免疫组合物用于生产用于预防猪传染性胃肠炎病毒感染的药剂的用途。
本发明的又一目的在于提供一种核酸分子,其可以用于编码猪传染性胃肠炎病毒S1蛋白,包含SEQ ID NO:1的顺序核苷酸序列或者与SEQ ID NO:1的核苷酸序列95%以上相同的顺序核苷酸序列。
本发明的又一目的在于提供一种所述的核酸分子用于生产用于在受试动物中诱导针对猪传染性胃肠炎病毒抗原的免疫反应的药剂的用途。
本发明的又一目的在于提供一种所述的核酸分子用于生产用于预防动物受猪传染性胃肠炎病毒感染的药剂的用途。本发明的又一目的在于提供一种蛋白,其选自由以下组成的组:
SEQ ID NO:2的氨基酸序列与SEQ ID NO:2的全长氨基酸序列95%以上相同的蛋白。
本发明的又一目的在于提供一种适用于在受试动物体内产生针对猪传染性胃肠炎病毒的免疫反应的免疫组合物,包含:
所述的猪传染性胃肠炎病毒S1蛋白和佐剂。
本发明目的在于提供一种免疫效果好、工艺更安全的猪传染性胃肠炎病毒基因工程亚单位疫苗。为达到以上目的,本发明使用CHO细胞表达猪传染性胃肠炎病毒S1蛋白。S1蛋白是猪传染性胃肠炎病毒重要抗原蛋白,能够激发中和抗体。CHO细胞为中国仓鼠卵巢细胞。
本发明目的在于提供一种免疫效果好、工艺更安全的猪传染性胃肠炎病毒基因工程亚单位疫苗,为达到以上目的,本发明使用CHO细胞表达重组猪传染性胃肠炎病毒S1蛋白,S1蛋白是唯一能诱导中和抗体产生和提供免疫保护作用的结合蛋白,是诱导机体保护性免疫的主要抗原,因此更易激发产生抗体。
本发明公开了一种CHO细胞表达的重组猪传染性胃肠炎病毒S1蛋白以及亚单位疫苗的制备方法和应用,并证明该疫苗能够在猪体内产生较强的体液免疫,免疫后的猪能够抵御强毒攻毒,属于动物疫苗与兽用生物制品技术领域,其目的在于提供一种可大规模工业化生产的猪传染性胃肠炎病毒重组亚单位疫苗的制备方法:首先克隆包含S1蛋白编码基因的真核表达载体;然后转染CHO细胞,通过选择,筛选得到悬浮稳定高效表达S1蛋白的CHO细胞株;通过发酵培养高效表达S1蛋白的细胞株,纯化后得到重组S1蛋白;最后将重组S1蛋白与佐剂充分混匀得到重组表达亚单位疫苗。
本发明提供的方法能够从细胞培养上清中收获目的蛋白,且产量高,不仅缩短了蛋白纯化时间和简化疫苗生产步骤,也大大降低了疫苗生产成本。
采用上述方案后,本发明与现有技术相比较具有以下突出的优点和效果:
本发明的免疫组合物生产过程不涉及全病毒,具有天然安全性,本案发明人使用的载体有GS扩增系统,可以增加目的基因拷贝数,通过CHO细胞进行表达,表达量非常高,分泌到上清中,易于纯化,哺乳动物细胞真核表达,表达糖基化修饰完善,最接近原始的分子。悬浮培养,易于大规模生产。
本发明使用CHO细胞表达猪传染性胃肠炎病毒重要抗原蛋白S1蛋白,使用真核表达,蛋白糖基化充分,抗原蛋白免疫原性好,并且表达量非常高,达到2-3g/L,重组细胞能够大规模悬浮培养,大大降低了疫苗制备的复杂程度,降低了生产成本。本发明的亚单位疫苗可以大规模生产,供量充足,质控容易;安全性高,免疫原性好;批次间稳定;生产成本低。
本发明使用了优化的S1蛋白序列,使用悬浮培养CHO细胞进行表达,表达量非常高,蛋白免疫原性好。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
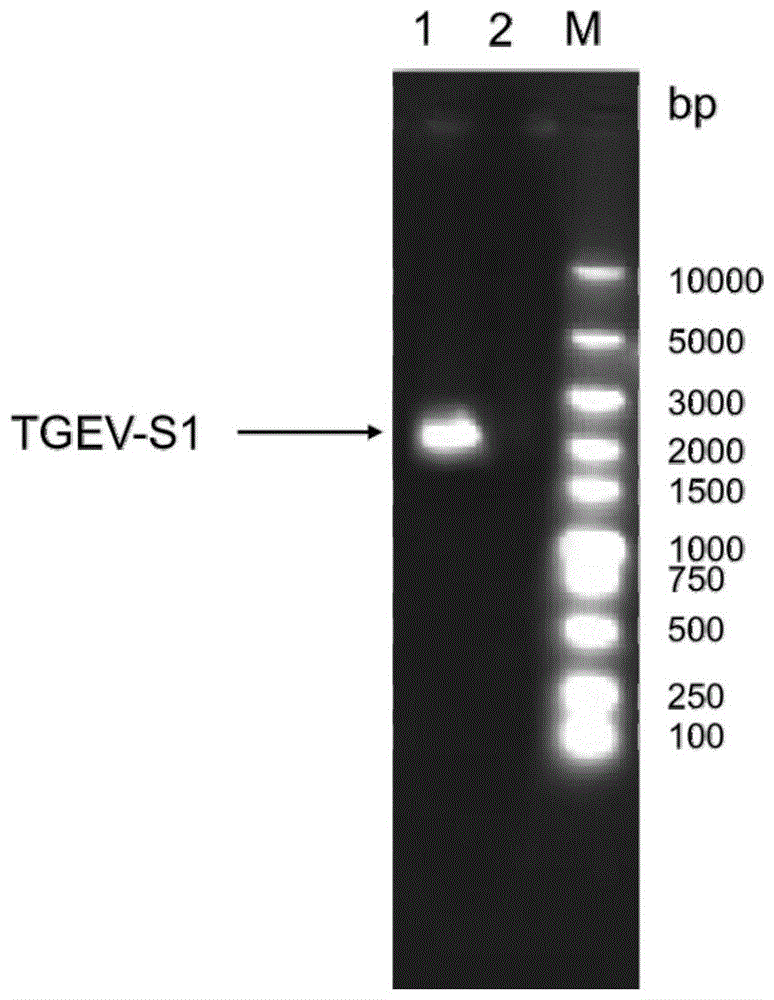
图1为将TGEV-S1基因PCR扩增后PCR产物进行凝胶电泳结果,可以看到一个2.3kbp的条带;其中1为TGEV-S1基因;2为阴性对照;M为分子量标记;
图2为多个TGEV-S1基因转化的菌落样品的PCR扩增后PCR产物进行凝胶电泳的结果,2.3kbp条带出现为阳性样品。其中1~5均为TGEV-S1基因转化的菌落样品PCR扩增后的产物,6为非阳性样品;M为分子量标记;
图3为构建的真核表达载体pCI-S1-GS图谱;
图4为实施例2中收获的细胞培养物上清进行SDS-PAGE凝胶电泳的结果,在分子量约150kDa附近出现条带。其中1为实施例2中收获的细胞培养物上清;2为阴性对照;M为分子量标记;
图5为实施例3中重组CHO上清样品Western Blot检测结果;其中1为重组CHO上清样品;2为阴性对照;M为分子量标记;
图6为蛋白纯化后的结果,其中1为上样,2为流穿,3为洗脱,4-7为不同浓度洗脱后样品,M为分子量标记;
图7为攻毒后对照组猪解剖结果。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
本发明提供了一种免疫组合物,包含:
采用SEQ ID NO:1的核酸分子或者与SEQ ID NO:1的核苷酸序列95%以上相同的核酸分子编码的猪传染性胃肠炎病毒S1蛋白。
本发明也涉及一种诱导针对猪传染性胃肠炎病毒抗原的免疫反应的方法,所述方法包括向受试动物施用本发明的疫苗。
本发明也涉及一种保护受试动物免受猪传染性胃肠炎病毒感染的方法,所述方法包括向所述受试动物施用本发明的疫苗。
本发明还包括适用于诱导针对猪传染性胃肠炎病毒的免疫反应的疫苗。本发明的疫苗可为包含上述核酸分子的质粒。核酸分子可被并入病毒颗粒中。疫苗可还包含佐剂分子。佐剂可为IL-12、IL-15、IL-28、CTACK、TECK、血小板源性生长因子(PDGF)、TNFα、TNFβ、GM-CSF、表皮生长因子(EGF)、IL-1、IL-2、IL-4、IL-5、IL-6、IL-10、IL-18、IL-21、IL-31、IL-33或其组合;并且在一些实施方案中,可为IL-12、IL-15、IL-28或RANTES。
本文提供选自由以下组成的组的蛋白:包含SEQ ID NO:2的蛋白;在SEQ IDNO:2的氨基酸序列的整个长度上95%相同的蛋白;SEQ ID NO:2的片段;与SEQ ID NO:2的片段95%相同的蛋白。
本文还提供一种选自由以下组成的组的蛋白:(a)SEQ ID NO:2;(b)在如SEQ IDNO:2所述的全长序列的整个氨基酸序列长度上95%相同的蛋白;(c)SEQ ID NO:2的包含SEQ ID NO:2的20个或更多个氨基酸的免疫原性片段;以及(d)在SEQ ID NO:2的氨基酸序列的整个长度上95%相同的蛋白的包含20个或更多个氨基酸的免疫原性片段。
还提供包含编码上文所述的一种或多种蛋白分子的序列的核酸分子。在一些实施方案中,所述核酸分子包含选自由以下组成的组的序列:SEQ ID NO:1;在SEQ ID NO:1的核苷酸序列的整个长度上95%相同的核酸序列;SEQ ID NO:1的片段;与SEQ ID NO:1的片段95%相同的核苷酸序列。
本发明一些方面提供诱导针对猪传染性胃肠炎病毒的免疫反应的方法,所述方法包括以下步骤:向个体施用猪传染性胃肠炎病毒抗原和/或其组合物。
本发明另外的方面提供保护个体免受猪传染性胃肠炎病毒感染的方法。所述方法包括以下步骤:向所述个体施用预防有效量的包含此类核酸序列的核酸分子或组合物;其中所述核酸序列在所述个体的细胞中表达,并且针对由所述核酸序列编码的蛋白诱导保护性免疫反应。
本发明的一些方面提供一种诱导针对猪传染性胃肠炎病毒抗原的免疫反应的方法,所述方法包括向受试动物施用本发明的核酸分子。
本发明的一些方面提供一种保护受试动物免受猪传染性胃肠炎病毒感染的方法,所述方法包括向所述受试动物施用本发明的核酸分子。
在另一方面,本发明提供一种选自由以下组成的组的蛋白:(a)SEQ ID NO:2;(b)在SEQ ID NO:2的氨基酸序列的整个长度上98%相同的蛋白;(c)SEQ ID NO:2的包含20个或更多个氨基酸的免疫原性片段;以及(d)在SEQ ID NO:2的氨基酸序列的整个长度上98%相同的蛋白的包含20个或更多个氨基酸的免疫原性片段。
本发明的一些方面提供一种适用于在受试动物中产生针对猪传染性胃肠炎病毒的免疫反应的疫苗,所述疫苗包含:本发明的核酸分子以及佐剂分子。所述佐剂可为IL-12、IL-15、IL-28、CTACK、TECK、血小板源性生长因子(PDGF)、TNFα、TNFβ、GM-CSF、表皮生长因子(EGF)、IL-1、IL-2、IL-4、IL-5、IL-6、IL-10、IL-18、IL-21、IL-31、IL-33或其组合;并且在一些实施方案中,可为IL-12、IL-15、IL-28或RANTES。
本发明的疫苗可还包括一种或多种如上所述的核酸分子和一种或多种由所述核酸分子编码的蛋白。
1.定义.
本文所用的术语仅仅是出于描述具体实施方案的目的而并不旨在限制。如在说明书和所述权利要求中所使用,除上下文另外明确规定之外,单数形式“一个”、“一种”和“所述”包括复数形式。
对于本文所列举的数值范围,明确涵盖了在有相同精密度之间的每个插入的数字。例如,对于6-9的范围,除了6和9外还涵盖数字7和8,并且对于6.0-7.0的范围,明确涵盖了数字6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9以及7.0。
如本文所用的“佐剂”意指被添加到本文所述的DNA质粒疫苗中来增强由下文所述的DNA质粒和编码核酸序列的所编码的抗原的免疫原性的任何分子。
如本文所用的“抗体”意指类型IgG、IgM、IgA、IgD或IgE的抗体,或片段、其片段或衍生物,包括Fab、F(ab')2、Fd以及单链抗体、双链抗体、双特异性抗体、双功能抗体及其衍生物。所述抗体可以是从动物的血清样本中分离出的抗体、多克隆抗体、亲和纯化抗体或其混合物,所述混合物对所需的表位或从其衍生的序列表现足够的结合特异性。
如本文所用的“编码序列”或“编码核酸”意指包含编码蛋白的核苷酸序列的核酸(RNA或DNA分子)。所述编码序列可以进一步包括可操作地连接至调控元件的起始信号和终止信号,所述调控元件包括能够在施用核酸的个体或动物的细胞中指导表达的启动子和多聚腺苷酸化信号。
如本文所用的“互补体”或“互补”意指核酸可以指在核苷酸或核酸分子的核苷酸类似物之间的Watson-Crick(例如,A-T/U和C-G)或者Hoogsteen碱基配对。
如本文所用的“共有”或“共有序列”意指基于分析特定猪传染性胃肠炎病毒抗原的一队列的多个亚型的多肽序列。可制备编码共有多肽序列的核酸序列。包含蛋白的疫苗可以被用来诱导针对特定猪传染性胃肠炎病毒抗原的多种亚型或血清型的广泛免疫,所述疫苗包含编码这些蛋白的共有序列和/或核酸分子。
如本文可互换使用的“电穿孔”、“电-透化作用”或“电动增强”(“EP”)意指使用跨膜电场脉冲来诱导在生物膜中的微观途径(孔隙);它们的存在允许生物分子如质粒、寡核苷酸、siRNA、药物、离子以及水从细胞膜的一侧流动到另一侧。
如本文所用的相对于核酸序列的“片段”意指编码能够在与全长野生型病毒株猪传染性胃肠炎病毒抗原交叉反应的动物中引发免疫反应的多肽的核酸序列或其一部分。所述片段可以是选自编码下文所述的蛋白片段的各种核苷酸序列的至少一种的DNA片段。
就多肽序列来说,“片段”或“免疫原性片段”意指能够在与全长野生型病毒株猪传染性胃肠炎病毒抗原交叉反应的动物中引发免疫反应的多肽。蛋白的片段可以包含蛋白的至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少95%。在一些实施方案中,蛋白的片段可以包含蛋白的至少20个氨基酸或更多、至少30个氨基酸或更多、至少40个氨基酸或更多、至少50个氨基酸或更多、至少60个氨基酸或更多、至少70个氨基酸或更多、至少80个氨基酸或更多、至少90个氨基酸或更多、至少100个氨基酸或更多、至少110个氨基酸或更多、至少120个氨基酸或更多、至少130个氨基酸或更多、至少140个氨基酸或更多、至少150个氨基酸或更多、至少160个氨基酸或更多、至少170个氨基酸或更多、至少180个氨基酸或更多、至少190个氨基酸或更多、至少200个氨基酸或更多、至少210个氨基酸或更多、至少220个氨基酸或更多、至少230个氨基酸或更多或至少240个氨基酸或更多。
如本文所用的术语“遗传构建体”是指包含编码蛋白的核苷酸序列的DNA或RNA分子。所述编码序列包含可操作地连接至调控元件的起始信号和终止信号,所述调控元件包括能够在施用核酸分子的个体的细胞中指导表达的启动子和多聚腺苷酸化信号。如本文所用的术语“表达形式”是指基因构建体,所述基因构建体含有可操作地连接至编码蛋白的编码序列的必须的调控元件,以使得当存在于所述个体的细胞中时,编码序列将表达。
如本文所用的术语“同源性”是指互补性程度。可存在部分同源性或完全同源性(即,同一性)。至少部分抑制完全互补序列杂交于靶标核酸的部分互补序列是使用功能术语“基本上同源”来提及。当关于如cDNA或基因组克隆的双链核酸序列使用时,如本文所用的术语“基本上同源”是指探针可在低严格性条件下杂交于双链核酸序列的链。当关于单链核酸序列使用时,如本文所用的术语“基本上同源”是指探针可在低严格性条件下杂交于单链核酸模板序列(即,是单链核酸模板序列的互补序列)。
在两种或更多种核酸或多肽序列的情况下,如本文所用的“相同”或“同一性”意指在指定区域中序列具有相同残基的指定百分比。可以通过以下来计算所述百分比:最佳地比对两个序列、在指定区域比较两个序列、确定在两个序列中相同的残基的位置的数量以产生匹配位置的数量、以匹配位置的数量除以在指定区域内的位置的总数量,并且将结果乘以100以产生序列同一性的百分比。在两个序列具有不同的长度或者比对产生一个或多个交错的末端并且比较的指定区域仅包括单一序列的情况下,单一序列的残基被包括在计算的分母中而不是分子中。当比较DNA和RNA时,胸腺嘧啶(T)和尿嘧啶(U)可以被认为是等同的。同一性可以手动地或者通过使用计算机序列算法如BLAST或者BLAST 2.0来执行。
如本文所用的“免疫反应”意指响应于抗原如猪传染性胃肠炎病毒共有抗原的引入,宿主的免疫系统(例如动物的免疫系统)的活化。所述免疫反应可以是细胞反应或体液反应或两者的形式。
如本文所用的“核酸”或“寡核苷酸”或“多核苷酸”意指共价连接在一起的至少两个核苷酸。单链的描述还定义了互补链的序列。因此,核酸还涵盖了所描述的单链的互补链。核酸的很多变体可以被用于与给定的核酸相同的目的。因此,核酸还涵盖了基本上相同的核酸和其互补体。单链提供可以与靶序列在严格的杂交条件下杂交的探针。因此,核酸还涵盖了在严格杂交条件下杂交的探针。
核酸可以是单链的或者双链的或可以含有双链或者单链序列两者的部分。所述核酸可以是DNA、基因组和cDNA两者、RNA或杂合体,其中所述核酸可以含有脱氧核糖核苷酸和核糖核苷酸的组合,以及包括尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶、鸟嘌啉、肌苷、黄嘌呤次黄嘌呤、异胞嘧啶以及异鸟嘌呤的碱基的组合。核酸可以通过化学合成方法或者通过重组方法来获得。
如本文所用的“可操作地连接”意指基因的表达是在空间上与之连接的启动子的控制下进行的。在其控制下,启动子可以被定位在基因的5'(上游)或者3'(下游)。所述启动子和基因之间的距离可以大约与所述启动子和其在启动子从中衍化的基因中所控制的基因之间的距离相同。如本领域所已知,这个距离的变化可以在没有失去启动子功能的情况下进行调整。
如本文所用的“启动子”意指合成的或自然来源的分子,所述分子能够赋予、活化或增强细胞中的核酸的表达。启动子可包含一个或多个特定的转录调控序列以便进一步增强表达和/或改变其空间的表达和/或时间的表达。启动子还可以包含远端增强子或阻遏元件,它们可以位于从转录的起始点开始的差不多几千对碱基对处。启动子可以从包括病毒、细菌、真菌、植物、昆虫以及动物的来源中获得。启动子可以相对于其中发生表达的细胞、组织或器官或相对于发生表达的发育阶段或响应于外部刺激如生理应激、病原体、金属离子或诱导剂而基本地或区别地调控基因组分的表达。启动子的代表性实例包括噬菌体T7启动子、噬菌体T3启动子、SP6启动子、乳糖操纵子-启动子、tac启动子、SV40后期启动子、SV40早期启动子、RSV-LTR启动子、CMV IE启动子、SV40早期启动子或者SV40后期启动子以及CMVIE启动子。
“信号肽”和“前导序列”在本文可互换使用并且是指可以被连接在本文所述的猪传染性胃肠炎病毒蛋白的氨基末端的氨基酸序列。信号肽/前导序列通常指示蛋白的位置。本文所用的信号肽/前导序列优选地促进蛋白从产生其的细胞中分泌。信号肽/前导序列常常从蛋白的剩余部分裂解,所述蛋白在从细胞分泌后经常被称为成熟蛋白。信号肽/前导序列连接在所述蛋白的N端。
如本文所用的“严格的杂交条件”意指这样的条件,即在所述条件下如在核酸的复杂混合物中第一核酸序列(例如,探针)将与第二核酸序列(例如,靶标)进行杂交。严格的条件是序列依赖性的并且在不同的环境中将是不同的。严格的条件在限定的离子强度pH下可以被选择为比特定序列的热力学熔点(Tm)低约5-10℃。所述Tm可以是这样的温度(在限定的离子强度、pH以及核酸浓度下),在所述温度下与靶标互补的50%的探针与靶序列在平衡状态下进行杂交(因为靶序列过量存在,在Tm下,50%的探针在平衡状态下被占用)。严格条件可以是那些条件,即其中盐浓度小于约1.0M的钠离子,如在pH 7.0至8.3下约0.01-1.0M的钠离子浓度(或其它盐),并且温度对于短的探针(例如,约10-50个核苷酸)为至少约30℃且对于长的探针(例如,大于约50个核苷酸)为至少约60℃。严格的条件还可以通过添加去稳定剂如甲酰胺来实现。对于选择的或特定的杂交,阳性信号可以是背景杂交的至少2至10倍。示例性的严格的杂交条件包括以下:50%甲酰胺、5x SSC以及1%SDS、在42℃下孵育,或者5x SSC、1%SDS、在65℃下孵育、在65℃下用0.2x SSC和0.1%SDS洗涤。
如本文所用的“基本上互补”意指第一序列在8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、180、270、360、450、540或更多个核苷酸或氨基酸的区域内与第二序列的互补体至少60%、65%、70%、75%、80%、85%、90%、95%、97%、98%或99%相同,或者意指两个序列在严格的杂交条件下进行杂交。
如本文所用的“基本上相同”意指第一序列和第二序列在8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、180、270、360、450、540或更多个核苷酸或氨基酸区域内是至少60%、65%、70%、75%、80%、85%、90%、95%、97%、98%或99%相同的,或者就核酸而言,如果第一序列与第二序列的互补体基本上互补,则第一序列和第二序列也这样相同。
“亚型”或“血清型”:如本文交换使用的并且关于猪传染性胃肠炎病毒,意指猪传染性胃肠炎病毒的基因变体,以使得一个亚型被免疫系统识别而从不同的亚型中分离。
本文就核酸而言所用的“变体”意指(i)参考核苷酸序列的一部分或片段;(ii)参考核苷酸序列或其部分的互补体;(iii)与参考核酸或其互补体基本上相同的核酸;或者(iv)在严格的条件下与参考核酸、其互补体或与其基本上相同的序列杂交的核酸。
就肽或多肽而言的“变体”通过氨基酸的插入、缺失或保守性取代而在氨基酸序列上不同,但是保留至少一种生物活性。变体还意指具有与参考蛋白基本上相同的氨基酸序列的蛋白,所述参考蛋白具有保留至少一种生物活性的氨基酸序列。氨基酸的保守性取代,即以相似特性(例如,亲水性、带电区域的程度和分布)的不同氨基酸来替换氨基酸,在本领域中被认为通常涉及微小变化。如本领域所理解的,这些微小变化可以部分通过考虑氨基酸的亲疏水性指数来识别。凯特(Kyte)等,分子生物学杂志(J.Mol.Biol.)157:105-132(1982)。所述氨基酸的亲疏水性指数是基于其疏水性和电荷的考虑。本领域已知的是相似的亲疏水性指数的氨基酸可以被取代并仍然保留蛋白功能。在一个方面,亲疏水性指数为±2的氨基酸被取代。氨基酸的亲水性还可以被用来揭示会产生保留生物功能的蛋白的取代。在肽的情形下考虑氨基酸的亲水性允许计算所述肽最大的局部平均亲水性,这是已经被报道来与抗原性和免疫原性良好关联的有用测量。如本领域所了解的,具有相似亲水性值的氨基酸的取代可以产生保留生物活性(例如免疫原性)的肽。可用具有彼此在±2内的亲水性值的氨基酸进行取代。氨基酸的亲疏水性指数和亲水性值两者都受所述氨基酸的特定侧链影响。与所述观察一致的是,与生物功能相容的氨基酸取代被理解为取决于这些氨基酸相对的相似性,并且特别是那些氨基酸的侧链,如通过疏水性、亲水性、电荷、大小以及其它特性所揭示的。
如本文所用的“载体”意指含有复制起点的核酸序列。载体可以是病毒载体、噬菌体、细菌人工染色体或酵母人工染色体。载体可以是DNA或RNA载体。载体可以是自我复制的染色体外载体,并优选地是DNA质粒。
2.疫苗
本发明涉及一种猪传染性胃肠炎病毒疫苗。
疫苗可包含抑制它整合至染色体中的元件或试剂。疫苗可为编码猪传染性胃肠炎病毒S1蛋白的RNA。可将RNA疫苗引入细胞中。本发明的疫苗可包含猪传染性胃肠炎病毒S1蛋白。猪传染性胃肠炎病毒S1蛋白是通过诱导1)细胞毒性T淋巴细胞(CTL)反应、2)T辅助细胞反应以及/或3)B细胞反应,或优选所有以上提及的反应,以达成交叉递呈来进行的免疫介导的病毒清除的靶标。
所述抗原可以包含使它们特别有效地作为免疫原的蛋白表位,可针对所述免疫原诱导抗猪传染性胃肠炎病毒免疫反应。猪传染性胃肠炎病毒抗原可以包括全长翻译产物、其变体、其片段或其组合。
一些实施方案涉及编码免疫原性蛋白的与本文核酸编码序列具有95%同源性的核酸分子。一些实施方案涉及编码免疫原性蛋白的与本文核酸编码序列具有96%同源性的核酸分子。一些实施方案涉及编码免疫原性蛋白的与本文核酸编码序列具有97%同源性的核酸分子。一些实施方案涉及编码免疫原性蛋白的与本文核酸编码序列具有98%同源性的核酸分子。一些实施方案涉及编码免疫原性蛋白的与本文核酸编码序列具有99%同源性的核酸分子。在一些实施方案中,具有与本文所公开的蛋白的编码序列同源的本文所公开的编码序列的核酸分子包含编码IgE前导序列的连接至编码本文所公开的同源蛋白序列的编码序列的5’末端的序列。
在一些实施方案中,所述核酸序列不含编码前导序列的编码序列。在一些实施方案中,所述核酸序列不含编码IgE前导物的编码序列。
一些实施方案涉及SEQ ID NO:1的片段。片段可以是至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%或至少55%至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或者至少99%的SEQ ID NO:1。片段可与SEQ ID NO:1的片段至少95%、至少96%、至少97%、至少98%或至少99%相同。片段可与SEQ ID NO:1的片段至少80%、至少85%、至少90%至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同。在一些实施方案中,片段包含编码前导序列的序列,例如免疫球蛋白前导物,如IgE前导物。在一些实施方案中,片段不含编码前导序列的编码序列。在一些实施方案中,片段不含编码前导序列,例如像IgE前导物的编码序列。
一些实施方案涉及与SEQ ID NO:2同源的蛋白。一些实施方案涉及与如SEQ ID NO:2中所述的蛋白序列具有95%同源性的免疫原性蛋白。一些实施方案涉及与如SEQ ID NO:2中所述的蛋白序列具有96%同源性的免疫原性蛋白。一些实施方案涉及与如SEQ ID NO:2中所述的蛋白序列具有97%同源性的免疫原性蛋白。一些实施方案涉及与如SEQ ID NO:2中所述的蛋白序列具有98%同源性的免疫原性蛋白。一些实施方案涉及与如SEQID NO:2中所述的蛋白序列具有99%同源性的免疫原性蛋白。
一些实施方案涉及与SEQ ID NO:2相同的蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上80%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上85%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上90%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上91%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ IDNO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上92%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上93%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上94%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上95%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上96%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上97%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上98%相同的氨基酸序列的免疫原性蛋白。一些实施方案涉及具有在如SEQ ID NO:2中所述的全长共有氨基酸序列的整个氨基酸序列长度上99%相同的氨基酸序列的免疫原性蛋白。
在一些实施方案中,蛋白不含前导序列。在一些实施方案中,蛋白不含IgE前导物。蛋白的片段可包含至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%或至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的蛋白。可提供SEQ ID NO:2的免疫原性片段。免疫原性片段可包含至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%或至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的SEQ ID NO:2。在一些实施方案中,片段包括前导序列,例如像免疫球蛋白前导物,如IgE前导物。在一些实施方案中,片段不含前导序列。在一些实施方案中,片段不含前导序列,例如像IgE前导物。
可提供氨基酸序列与SEQ ID NO:2的免疫原性片段同源的蛋白的免疫原性片段。所述免疫原性片段可包含至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%或至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的与SEQ ID NO:295%同源的蛋白。一些实施方案涉及与本文蛋白序列的免疫原性片段具有96%同源性的免疫原性片段。一些实施方案涉及与本文蛋白序列的免疫原性片段具有97%同源性的免疫原性片段。一些实施方案涉及与本文蛋白序列的免疫原性片段具有98%同源性的免疫原性片段。一些实施方案涉及与本文蛋白序列的免疫原性片段具有99%同源性的免疫原性片段。在一些实施方案中,片段包括前导序列,例如像免疫球蛋白前导序列,如IgE前导物。在一些实施方案中,片段不含前导序列。在一些实施方案中,片段不含前导序列,例如像IgE前导物。
可提供氨基酸序列与SEQ ID NO:2的免疫原性片段相同的蛋白的免疫原性片段。所述免疫原性片段可包含至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%或至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的在SEQ ID NO:2中所述的氨基酸序列的整个长度上80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的蛋白。在一些实施方案中,片段包括前导序列,例如像免疫球蛋白前导物,如IgE前导物。在一些实施方案中,片段不含前导序列。在一些实施方案中,片段不含前导序列,例如像IgE前导物。
3.疫苗构建体和质粒
疫苗可包括编码猪传染性胃肠炎病毒S1蛋白、猪传染性胃肠炎病毒抗原以及猪传染性胃肠炎病毒S1蛋白/抗原的组合的核酸构建体或质粒。本文提供可以包含编码本文所公开的猪传染性胃肠炎病毒抗原的核酸序列的遗传构建体,所述核心抗原包括蛋白序列、与蛋白序列同源的序列、蛋白序列的片段以及与蛋白序列的片段同源的序列。另外,本文提供可包含编码本文公开的猪传染性胃肠炎病毒表面抗原(包括蛋白序列、与蛋白序列同源的序列、蛋白序列的片段以及与蛋白序列的片段同源的序列)的核酸序列的遗传构建体。所述遗传构建体可以作为功能性染色体外的分子而存在。所述遗传构建体可以是包括着丝粒、端粒或质粒或粘粒的线性微型染色体。
所述遗传构建体还可以是重组病毒载体的基因组的一部分,所述重组病毒载体包括重组腺病毒、重组腺病毒伴随病毒以及重组牛痘。遗传构建体可以是在减毒的活微生物或活在细胞中的重组微生物载体中的遗传物质的部分。
遗传构建体可以包含用于核酸的编码序列的基因表达的调控元件。调控元件可以是启动子、增强子、起始密码子、终止密码子或多聚腺苷酸化信号。
核酸序列可组成可以是载体的遗传构建体。所述载体能够以在动物中有效引发免疫反应的量在动物的细胞中表达抗原。所+述载体可以是重组体。所述载体可以包含编码抗原的异源核酸。所述载体可以是质粒。所述载体可以适用于用编码抗原的核酸来转染细胞,所述转化的宿主细胞在其中发生抗原表达的条件下培养并维持。
编码序列可以被优化来用于表达的稳定性和高水平。在一些情况下,选择密码子来减少RNA二级结构的形成,如由于分子内键而形成的二级结构。
所述载体可以包含编码抗原的异源核酸,并且可以进一步包含可以在抗原编码序列的上游的起始密码子和可以在抗原编码序列的下游的终止密码子。起始密码子和终止密码子可以与抗原编码序列在框中。所述载体还包含可操作地连接至抗原编码序列的启动子。可操作地连接至抗原编码序列的启动子可以是来自猿猴病毒40(SV40)的启动子、小鼠乳腺瘤病毒(MMTV)启动子、人免疫缺陷病毒(HIV)启动子如牛免疫缺陷病毒(BIV)长末端重复(LTR)启动子、莫洛尼(Moloney)病毒启动子、鸟类白血病病毒(ALV)启动子、巨细胞病毒(CMV)启动子如CMV立即早期启动子、爱巴二氏(Epstein Barr)病毒(EBV)启动子或劳氏肉瘤病毒(RSV)启动子。所述启动子还可以是来自人基因的启动子,所述人基因如人肌动蛋白、人肌凝蛋白、人血红素、人肌肉肌酸或人金属硫蛋白。所述启动子还可以是组织特异性启动子,如天然或合成的肌肉或皮肤特异性启动子。
所述载体还可以包含多聚腺苷酸化信号,所述多聚腺苷酸化信号可以在猪传染性胃肠炎病毒核心蛋白编码序列的下游。所述多聚腺苷酸化信号可以是SV40多聚腺苷酸化信号、LTR多聚腺苷酸化信号、牛生长激素(bGH)多聚腺苷酸化信号、人生长激素(hGH)多聚腺苷酸化信号或人β-球蛋白多聚腺苷酸化信号。所述SV40多聚腺苷酸化信号可以是来自pCEP4载体(Invitrogen,San Diego,CA)的多聚腺苷酸化信号。
载体也可包含在共有猪传染性胃肠炎病毒核心蛋白编码序列或共有猪传染性胃肠炎病毒表面抗原蛋白编码序列的上游的增强子。所述增强子对于DNA表达是必须的。所述增强子可以是人肌动蛋白、人肌凝蛋白、人血红素、人肌肉肌酸或病毒增强子,如来自CMV、HA、RSV或者EBV的一种增强子。
载体还可以包含动物的复制起点,以便将载体维持在染色体外并在细胞中产生载体的多个拷贝。所述载体可以是来自Invitrogen(San Diego,CA)的pVAX1、pCEP4或者pREP4,其可以包含爱巴二氏病毒的复制起点和核抗原EBNA-1编码区域,这可以在没有整合的情况下产生高拷贝附加型复制。所述载体可以是具有变化的pVAX1或者pVax1变体,如本文所述的变体质粒。所述变体pVax1质粒是主链载体质粒pVAX1(Invitrogen,Carlsbad CA)的2998碱基对变体。所述CMV启动子位于碱基137-724处。T7启动子/引发位点位于碱基664-683处。多克隆位点位于碱基696-811处。牛GH多聚腺苷酸化信号是在碱基829-1053处。卡那霉素(Kanamycin)抗性基因是在碱基1226-2020处。pUC起点是在碱基2320-2993处。
所述载体可以是pSE420(Invitrogen,San Diego,Calif.),其可用于在大肠杆菌(E.coli)中产生蛋白。所述载体可以是pYES2(Invitrogen,San Diego,Calif.),其可用于在酵母的酿酒酵母菌株(Saccharomyces cerevisiae strain)中产生蛋白。所述载体还可以具有MAXBACTM完整的杆状病毒表达系统(Invitrogen,San Diego,Calif.),其可用于在昆虫细胞中产生蛋白。所述载体还可以是pcDNA I或者pcDNA3(Invitrogen,SanDiego,Calif.),其可用于在动物细胞如中国仓鼠卵巢(CHO)细胞中产生蛋白。所述载体可以是通过常规技术和容易可得的起始物质来产生蛋白的表达载体或系统,所述技术和物质包括Sambrook等,Molecular Cloning and Laboratory Manual,第2版,ColdSpring Harbor(1989)。
本发明用于编码猪传染性胃肠炎病毒重要抗原蛋白S1蛋白的核苷酸序列优选是原始序列,增加以及截短的序列,使用载体pSV2-GS,pCI-GS,pcDNA4-GS,优选的用pCI-GS。CHO细胞系可以是为DG44,DXB11,CHO-K1,CHO-S细胞株,优选的CHO-S。
实施例1重组真核表达载体pCI-S1-GS的构建
1.密码子优化的S1基因来自南京金斯瑞生物科技有限公司,并克隆到pUC-57载体上,构建了pUC-S1质粒载体。优化后的S1基因序列如SEQ ID NO:1所示。
2.S1基因扩增以pUC-S1作为模板,S1-F、S1-R作为引物进行PCR扩增(S1-F、S1-R的基因序列如SEQ ID NO.3、4所示),扩增体系见表1。反应条件为:94℃预变性5分钟;95℃变性45秒,60℃复性45秒,72℃延伸2分钟,30个循环;72℃延伸10分钟,4℃保藏。
表1 S1基因扩增体系
将PCR产物进行凝胶电泳鉴定目的基因大小,如图1所示,在2.3kbp的位置出现条带,目的基因扩增成功,用凝胶回收纯化试剂盒进行回收纯化。
3.酶切将pCI-GS质粒和纯化后的S1基因PCR产物分别使用XhoⅠ、KpnⅠ37℃酶切3小时,反应体系见表2、表3。酶切产物凝胶电泳后分别回收,用凝胶回收纯化试剂盒进行纯化。
表2 S1基因酶切反应体系
表3 pCI-GS质粒酶切反应体系
4.连接将酶切过的pCI-GS质粒和S1基因酶切产物使用T4DNA连接酶16℃水浴连接过夜,连接体系见表4。
表4 S1基因与pCI-GS质粒连接体系
5.转化取10μl连接产物加入100μl的DH5α感受态细胞,混匀,42℃热休克90秒,冰浴2分钟,加入900μl不含Amp的LB培养基,37℃培养1小时。取1.0ml菌液离心浓缩成100μl涂布于含有Amp的LB固体培养基上,37℃培养16小时。
6.菌落PCR和测序鉴定挑取平板上的单菌落分别接种LB液体培养基,37℃培养2小时,以菌液作为模板,S1-F和S1-R作为引物进行菌落PCR。将PCR产物进行凝胶电泳验证目的基因大小,如图2所示,出现2.3kbp条带的样品为阳性样品。将菌落PCR鉴定阳性的菌液送测序公司测序,选择测序正确的菌液进行保存,得到真核表达载体pCI-S1-GS。构建好的载体图谱如图3所示。
实施例2:重组CHO细胞的构建与筛选
1.细胞转染
1.1准备细胞取对数生长期的CHO细胞,取样计数,以1×106cells/ml的细胞密度继续传代,维持种子,剩余细胞离心,1000rpm离心4分钟后,弃上清,用20ml左右的新鲜CHO-WM培养基重悬,再次离心,1000rpm离心4分钟,弃上清后用少量培养基重悬计数,最终将细胞密度调整为1.43×107cells/ml。
1.2质粒与细胞混合取实施例1中pCI-S1-GS质粒载体5ug,加入至EP管中,添加0.7ml细胞,混合均匀后,静置15分钟。
1.3电转280V 20ms电击2个脉冲,电击完成后,立刻将细胞转入至摇瓶中,悬浮培养,48h后观察细胞状态,换液培养,等细胞密度生长到0.6×106cells/ml时,添加50uM MSX(L-methionine sulphoximine)加压筛选。
2.单克隆筛选
2.1用苏州沃美生物技术有限公司的CHO细胞无血清无蛋白培养基CHO-WM细胞培养基+50uM MSX重新悬浮细胞,计数。
2.2铺板稀释细胞至5个/mL,取200ul混匀的细胞加入到96孔板中,放置到37℃,5%CO2细胞培养箱中孵育4-6h。记录单个细胞的孔。
2.3待96孔板中单个细胞的孔长起来时,弃掉培养基,PBS洗一次,100ul 0.25%trypsin-EDTA,室温消化2min左右,加入2mL CHO-WM培养基(含10%FBS+50uM MSX)终止消化反应,并用移液器将细胞吹散。将细胞转移至12孔板,待12孔板长满时,取上清,Elisa检测克隆是否为阳性,高效表达的阳性克隆继续扩大培养,冻存。
3.细胞摇瓶发酵
3.1传代培养基的配置:使用CHO-WM培养基添加50uM MSX作为传代培养基,置于37℃水浴锅总预热至37℃。
3.2从CO2恒温摇床取出摇瓶细胞,进行计数。
3.3稀释细胞至2.5-3.5×105个细胞/mL接种30mL培养基于一个125mL摇瓶中。细胞培养瓶放置到37℃,5%CO2恒温摇床中100rpm/min孵育过夜。
3.4每隔24h计数细胞密度以及活力,测葡萄糖,当糖低于2g/L的时候,添加葡萄糖到4g/L;每天取1mL样品,上清用于检测蛋白表达情况。
实施例3 SDS-PAGE检测
将实施例2中收获的细胞培养物上清进行SDS-PAGE检测,同时使用空的CHO细胞作为阴性对照。具体操作如下:取40μl收获的细胞培养物,加入10μl的5×loading buffer,沸水浴5分钟,12000r/min离心1分钟,取上清进行SDS-PAGE凝胶(12%浓度凝胶)电泳,电泳后取凝胶经染色、脱色后观察目的条带。如图4所示,在分子量约150kDa附近出现目的条带,因为S1蛋白有较多的糖基化修饰,所以其分子量较通过氨基酸序列理论计算的分子量高约66kDa,阴性对照在对应位置没有条带。
实施例4 Western Blot检测
将实施例3中SDS-PAGE电泳后的产物转印到NC(硝酸纤维素)膜上,用5%脱脂牛奶封闭2小时,猪源抗TGEV多抗血清孵育2小时,漂洗,HRP标记的羊抗猪多克隆抗体二抗孵育2小时,漂洗,然后滴加增强型化学发光荧光底物,使用化学发光成像仪拍照。如图5所示,图中重组CHO上清样品有细胞条带,阴性对照没有目的条带,说明目的抗原蛋白在重组CHO细胞中得到正确表达。
实施例5蛋白纯化
目的蛋白含有his标签,使用镍柱亲和层析纯化目的蛋白。
1.Ni柱的再生和平衡:
1.1 0.5mol/L的NaOH反向冲洗Ni柱10min,冲洗结束后,用超纯水正向冲洗。
1.2 50mol/L的NiSO4冲洗5柱体积。结束后,用超纯水正向冲洗。
1.3用含有300mM咪唑PBS(pH=7.4)缓冲液冲洗3个柱体积后继续用PBS缓冲液冲洗平衡5个柱体积。
2.Ni纯化过程:
PBS平衡Ni柱后,取培养的上清上样,上样结束后用PBS洗涤5个柱体积至基线平衡。然后分别使用含有30mM,150mM,300mM以及500mM咪唑的PBS进行洗脱。结果如图6所示。在150mM咪唑浓度的PBS溶液中洗脱出目的蛋白。
实施例6亚单位疫苗制备
将适量纯化的猪传染性胃肠炎病毒S1蛋白加入到MONTANIDE ISA 206 VG佐剂中(体积比为1:1),使蛋白终浓度为100ug/mL,乳化,质检合格后置于4℃保存。
实施例7免疫实验
1.取TGEV中和抗体效价≤1:4的仔猪16头,疫苗组接种成品亚单位疫苗2mL,阴性对照组注射同样体积的生理盐水,于免疫后14日采血,用中和试验法检测血清中和抗体。疫苗组8头仔猪有8头血清阳转,猪传染性胃肠炎中和抗体效价≥1:32。阴性对照组8头仔猪都为TGEV抗体阴性,猪传染性胃肠炎中和抗体效价≤1:4。
2.免疫攻毒上述两组16头免疫仔猪,于免疫后14日,分别每头口服猪传染性胃肠炎强毒1mL(含1000个最小全数发病量),观察7日。对照组7头发病,可观察到厌食以及黄色或者浅黄色水样腹泻,其中有6头能观察到呕吐、寒颤以及脱水症状,观察7天内有4头仔猪死亡。免疫组全部存活,未观察到腹泻症状,仔猪生长正常,说明产品合格。解剖对照组和免疫组猪,可以发现对照组猪肠壁变薄有透明感、肠绒毛变平(图7),免疫组猪解剖正常。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
序列表
<110> 苏州世诺生物技术有限公司
<120> 猪传染性胃肠炎病毒新型基因工程亚单位疫苗
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 2292
<212> DNA
<213> 人工序列(人工序列)
<400> 1
aagcttgccg ccaccatgga aacagataca ctcctcctct gggtgctgct cctctgggtg 60
ccaggatcta caggacacca tcatcaccac catgacaact ttccttgcag caagctgacc 120
aatcgtacaa tcggcaatca gtggaattta atcgagacct ttctgctgaa ctattccagc 180
cggctgcctc ccaacagcga cgtcgtttta ggcgactact ttcctaccgt ccagccttgg 240
ttcaactgta tccggaacga cagcaacgat ttatacgtga ctttagagaa tttaaaagct 300
ctgtattggg actatgccac cgaaaacatc acttggaacc accggcagag gctcaacgtg 360
gtcgtgaatg gctaccctta cagcatcacc gtcacaacaa cccggaactt caactccgcc 420
gagggcgcta tcatctgtat ctgcaagggc agccccccca caaccaccac agaaagctct 480
ttaacttgta actggggctc cgagtgtagg ctgaaccaca agttccccat ttgcccttcc 540
aactccgaag ccaactgcgg caacatgctg tacggtttac agtggttcgc tgatgaggtg 600
gtggcctatc tgcacggagc tagctatcgt atcagctttg aaaaccagtg gtccggcacc 660
gtgacctttg gagacatgag ggccacaaca ctggaggtgg ccggcacttt agtggatctg 720
tggtggttta accccgtgta tgatgtcagc tactaccggg tcaacaacaa gaacggcaca 780
accgtggtga gcaactgcac agaccaatgt gcctcctacg tggctaacgt gttcaccacc 840
cagcccggtg gcttcatccc tagcgacttc tccttcaaca actggttttt actgaccaac 900
tcctccactt tagtgagcgg caagctcgtg accaagcagc ccctcctcgt caactgtctg 960
tggcccgttc cttccttcga ggaggccgcc agcacctttt gttttgaggg cgccggcttt 1020
gatcaatgca acggcgccgt tttaaacaat accgtggacg tgatccggtt caatttaaac 1080
ttcacaacca acgtgcagag cggaaaggga gccaccgtgt tttctttaaa caccactggt 1140
ggcgtgacct tagaaattag ctgctacacc gtgagcgaca gctccttttt ctcctacgga 1200
gagatcccct ttggcgtgac agatggccct cggtactgct acgtgcatta caacggcacc 1260
gctttaaaat atttaggcac tttacccccc agcgtgaaag agatcgctat ctccaagtgg 1320
ggccacttct acattaacgg ctataacttc ttctccacct tccccattga ctgtatcagc 1380
ttcaacctca caaccggcga ctccgacgtc ttctggacca ttgcctacac cagctacacc 1440
gaggctttag tgcaagttga gaataccgct atcaccaagg tgacctactg caattcccac 1500
gtgaacaaca tcaagtgctc ccaaattaca gctaatctga acaacggctt ctaccccgtt 1560
agcagcagcg aggtgggttt agtgaacaaa agcgtggtgt tattaccttc cttttacacc 1620
cataccatcg tgaacatcac catcggttta ggcatgaaga ggtccggata cggccagccc 1680
atcgccagca cactcagcaa catcacttta cccatgcaag atcataatac cgatgtgtat 1740
tgcattcgtt ccgaccagtt cagcgtctac gtgcactcca cttgtaagag cgctttatgg 1800
gacaacatct tcaagcggaa ctgcaccgat gtgctggacg ctaccgccgt gattaagacc 1860
ggaacttgtc cttttagctt tgataaactg aataattatt taacctttaa caagttttgt 1920
ttatctttat cccccgtggg cgctaactgc aagttcgacg tcgctgctcg tacaaggacc 1980
aatgagcaag ttgtgcggtc tttatatgtc atctacgagg agggcgacaa catcgtcgga 2040
gtgccctccg acaatagcgg cgtgcatgat ctgagcgtgc tgcatctcga ctcttgtacc 2100
gattacaaca tctatggtcg taccggcgtg ggcatcattc ggcagacaaa tcgtacttta 2160
ctgagcggac tctactatac atctttatcc ggcgacctcc tcggcttcaa gaatgtctcc 2220
gatggcgtca tctacagcgt gacaccttgc gacgtgagcg cccatcacca tcaccatcac 2280
tgatgagaat tc 2292
<210> 2
<211> 755
<212> PRT
<213> 猪传染性胃肠炎病毒(Transmissible Gastroenteritis virus of Swine)
<400> 2
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly His His His His His His Asp Asn Phe Pro Cys Ser
20 25 30
Lys Leu Thr Asn Arg Thr Ile Gly Asn Gln Trp Asn Leu Ile Glu Thr
35 40 45
Phe Leu Leu Asn Tyr Ser Ser Arg Leu Pro Pro Asn Ser Asp Val Val
50 55 60
Leu Gly Asp Tyr Phe Pro Thr Val Gln Pro Trp Phe Asn Cys Ile Arg
65 70 75 80
Asn Asp Ser Asn Asp Leu Tyr Val Thr Leu Glu Asn Leu Lys Ala Leu
85 90 95
Tyr Trp Asp Tyr Ala Thr Glu Asn Ile Thr Trp Asn His Arg Gln Arg
100 105 110
Leu Asn Val Val Val Asn Gly Tyr Pro Tyr Ser Ile Thr Val Thr Thr
115 120 125
Thr Arg Asn Phe Asn Ser Ala Glu Gly Ala Ile Ile Cys Ile Cys Lys
130 135 140
Gly Ser Pro Pro Thr Thr Thr Thr Glu Ser Ser Leu Thr Cys Asn Trp
145 150 155 160
Gly Ser Glu Cys Arg Leu Asn His Lys Phe Pro Ile Cys Pro Ser Asn
165 170 175
Ser Glu Ala Asn Cys Gly Asn Met Leu Tyr Gly Leu Gln Trp Phe Ala
180 185 190
Asp Glu Val Val Ala Tyr Leu His Gly Ala Ser Tyr Arg Ile Ser Phe
195 200 205
Glu Asn Gln Trp Ser Gly Thr Val Thr Phe Gly Asp Met Arg Ala Thr
210 215 220
Thr Leu Glu Val Ala Gly Thr Leu Val Asp Leu Trp Trp Phe Asn Pro
225 230 235 240
Val Tyr Asp Val Ser Tyr Tyr Arg Val Asn Asn Lys Asn Gly Thr Thr
245 250 255
Val Val Ser Asn Cys Thr Asp Gln Cys Ala Ser Tyr Val Ala Asn Val
260 265 270
Phe Thr Thr Gln Pro Gly Gly Phe Ile Pro Ser Asp Phe Ser Phe Asn
275 280 285
Asn Trp Phe Leu Leu Thr Asn Ser Ser Thr Leu Val Ser Gly Lys Leu
290 295 300
Val Thr Lys Gln Pro Leu Leu Val Asn Cys Leu Trp Pro Val Pro Ser
305 310 315 320
Phe Glu Glu Ala Ala Ser Thr Phe Cys Phe Glu Gly Ala Gly Phe Asp
325 330 335
Gln Cys Asn Gly Ala Val Leu Asn Asn Thr Val Asp Val Ile Arg Phe
340 345 350
Asn Leu Asn Phe Thr Thr Asn Val Gln Ser Gly Lys Gly Ala Thr Val
355 360 365
Phe Ser Leu Asn Thr Thr Gly Gly Val Thr Leu Glu Ile Ser Cys Tyr
370 375 380
Thr Val Ser Asp Ser Ser Phe Phe Ser Tyr Gly Glu Ile Pro Phe Gly
385 390 395 400
Val Thr Asp Gly Pro Arg Tyr Cys Tyr Val His Tyr Asn Gly Thr Ala
405 410 415
Leu Lys Tyr Leu Gly Thr Leu Pro Pro Ser Val Lys Glu Ile Ala Ile
420 425 430
Ser Lys Trp Gly His Phe Tyr Ile Asn Gly Tyr Asn Phe Phe Ser Thr
435 440 445
Phe Pro Ile Asp Cys Ile Ser Phe Asn Leu Thr Thr Gly Asp Ser Asp
450 455 460
Val Phe Trp Thr Ile Ala Tyr Thr Ser Tyr Thr Glu Ala Leu Val Gln
465 470 475 480
Val Glu Asn Thr Ala Ile Thr Lys Val Thr Tyr Cys Asn Ser His Val
485 490 495
Asn Asn Ile Lys Cys Ser Gln Ile Thr Ala Asn Leu Asn Asn Gly Phe
500 505 510
Tyr Pro Val Ser Ser Ser Glu Val Gly Leu Val Asn Lys Ser Val Val
515 520 525
Leu Leu Pro Ser Phe Tyr Thr His Thr Ile Val Asn Ile Thr Ile Gly
530 535 540
Leu Gly Met Lys Arg Ser Gly Tyr Gly Gln Pro Ile Ala Ser Thr Leu
545 550 555 560
Ser Asn Ile Thr Leu Pro Met Gln Asp His Asn Thr Asp Val Tyr Cys
565 570 575
Ile Arg Ser Asp Gln Phe Ser Val Tyr Val His Ser Thr Cys Lys Ser
580 585 590
Ala Leu Trp Asp Asn Ile Phe Lys Arg Asn Cys Thr Asp Val Leu Asp
595 600 605
Ala Thr Ala Val Ile Lys Thr Gly Thr Cys Pro Phe Ser Phe Asp Lys
610 615 620
Leu Asn Asn Tyr Leu Thr Phe Asn Lys Phe Cys Leu Ser Leu Ser Pro
625 630 635 640
Val Gly Ala Asn Cys Lys Phe Asp Val Ala Ala Arg Thr Arg Thr Asn
645 650 655
Glu Gln Val Val Arg Ser Leu Tyr Val Ile Tyr Glu Glu Gly Asp Asn
660 665 670
Ile Val Gly Val Pro Ser Asp Asn Ser Gly Val His Asp Leu Ser Val
675 680 685
Leu His Leu Asp Ser Cys Thr Asp Tyr Asn Ile Tyr Gly Arg Thr Gly
690 695 700
Val Gly Ile Ile Arg Gln Thr Asn Arg Thr Leu Leu Ser Gly Leu Tyr
705 710 715 720
Tyr Thr Ser Leu Ser Gly Asp Leu Leu Gly Phe Lys Asn Val Ser Asp
725 730 735
Gly Val Ile Tyr Ser Val Thr Pro Cys Asp Val Ser Ala His His His
740 745 750
His His His
755
<210> 3
<211> 32
<212> DNA
<213> 人工引物(人工序列)
<400> 3
ataaagcttg ccgccaccat ggaaacagat ac 32
<210> 4
<211> 35
<212> DNA
<213> 人工引物(人工序列)
<400> 4
atagaattct catcagtgat ggtgatggtg atggg 35
- 还没有人留言评论。精彩留言会获得点赞!