雌激素调节剂化合物及其药用组合物与应用的制作方法
本发明涉及激素受体调节剂技术领域,尤其公开了一种雌激素调节剂化合物及其药用组合物与应用。
背景技术:
随着经济和社会的发展,人民生活水平不断提高,但随之而来的是各种代谢性疾病如糖尿病、高血压、高血脂等发病率持续升高,这些代谢性疾病可造成患者人体器官、多个部位不适和病变,严重影响人们的身体健康和生活质量,也给各国医疗卫生系统带带来沉重的负担。
糖尿病可分为i型糖尿病(胰岛素依赖性)和ii型糖尿病(非胰岛素依赖性)两种。但它们都具有在禁食或在进食葡萄糖(葡萄糖抵抗测试时)的状态下持续性提升血糖浓度的特性。胰岛素是一种有效调节肌肉、肝和脂肪组织等胰岛素敏感组织内进行葡萄糖和脂质代谢的激素。肌肉、肝和脂肪组织等内的能量代谢调节失常是ii型糖尿病病人血糖浓度失常的最重要原因之一。而许多ii型糖尿病病人同时伴随着高胰岛素血症。胰岛素抵抗是ii型糖尿病的重要发病机制。
骨骼肌和肝脏是维持正常血糖平衡的重要的胰岛素效应器官。相关研究已经表明,线粒体功能失常与骨骼肌内胰岛素抵抗密切相关。在ii型糖尿病病人的骨骼肌中,线粒体氧化磷酸化基因(oxphos)功能明显下调。线粒体氧化磷酸化基因(oxphos)则主要通过过氧化物酶体生长活化受体γ.共激活因子pgc1α(peroxisomeproliferat以及-activatedrecept以及γ.coactivat以及-1α.(pgc-1α))转录调控。pgc-1α水平的降低理论上应当可以引发oxphos基因表达的下调,减少脂肪酸的氧化,进而引起骨骼肌中的脂质蓄积,最终诱发胰岛素抵抗和ii型糖尿病。事实上,pgc-1α失调是潜在糖尿病患者的常见现象。这进一步说明了pgc-1α水平降低是糖尿病发病的重要诱因。
雌激素相关受体(estrogen-relatedrecept以及s,errs)是一类与雌激素受体α(estrogenrecept以及α)密切相关的核激素受体。errs在与其共活因子(co-activat以及)结合时不需要与任何内、外源配体的参与,被认为是构成活化的孤儿核激素受体(constitutivelyactive以及phannuclearh以及monerecept以及s)。研究表明,errs包含3种不同的亚型,errα、errβ和errγ。errβ主要与生物体发育相关,它的表达在出生后受到严格的控制,仅在肝、胃、骨骼肌、心脏和肾中有少量表达。errγ的表达则集中在脊髓和中枢神经系统。errα则主要分布在骨骼肌、心脏、肾、肝和脂肪组织等代谢活跃的组织器官中。线粒体氧化磷酸化(mitocl3ondrialoxidativephosph以及ylation,oxphos)是葡萄糖、脂肪等物质代谢产生atp能量过程中最为关键的步骤。pgc-1是oxphos的一个重要调节因子,对骨骼肌和棕色脂肪等组织中热量生成、肌肉细胞中线粒体生物合成和呼吸作用以及骨骼肌纤维类型转变等过程起着重要的调节作用。此外,pgc-1还控制可以编码多种糖异生酶的基因的表达。研究表明,pgc-1水平的降低可以影响葡萄糖和脂肪等能量物质的代谢利用,引起骨骼肌中的脂质蓄积和血糖过剩,最终诱发胰岛素抵抗和ii型糖尿病。
errα是pgc-1α的直接下游靶基因。pgc-1α主要通过与errα的直接相互作用,有效调控线粒体氧化磷酸化(oxphos)和脂肪酸氧化酶等基因的转录来对oxphos过程进行调节。(mootha,v.k.procnatlacadsciu.sa2004,101,6570-6575)研究表明,在外界信号如禁食、体育锻炼或寒冷等的刺激下,pgc-1α可以促进errα表达,并通过与errα的结合,诱导errα与其自身的基因启动子特定结合位点相结合,进一步促进errα的转录。pgc-1α与errα的相互作用还可以促进errα与pgc-1α其它下游基因启动子特定结合位点相结合,促进这些下游功能基因(如磷酸烯醇丙酮酸酯羧基激酶(phosphoenolpyruvatecarboxykinase(pepck))、介质链酰基脱氢酶(mediumcl3ainacyldehydrogenase(mcad))和丙酮酸脱氢酶激酶4(pyruvatedehydrogenasekinase4(pdk4))等基因)的转录,进而对线粒体氧化磷酸化(oxphos)及脂肪酸氧化进行有效地调控,促进脂肪酸和葡萄糖的代谢利用。
通过小分子化合物选择性地调节errα和pgc-1α的功能,特别是利用errα小分子激动剂,有效地提高线粒体氧化磷酸化基因(oxphos)的功能,促进脂肪酸的氧化或减少葡萄糖的利用,可作为治疗糖尿病及相关的肥胖症,高血糖症,低血糖耐受,胰岛素抵抗、高血脂、脂肪肝等代谢性疾病的有效策略。此外,由于errα小分子激动剂可以有效的提高pgc-1α基因的表达,增强细胞对胰岛素的敏感性,因此,它们也可以与其它胰岛素增敏剂或胰岛素分泌促进剂类药物联合给药,提高临床效果。
通过研究发现,妇女绝经后雌激素水平的降低是其发生骨质疏松的主要诱因。研究表明,造骨细胞中err的高表达可以促进骨结节的形成,而利用anti-sense降低errα的表达则引起骨结节形成的减少。以此,雌激素相关受体(errα、errβ和errγ等)的小分子激动剂也有可能用于骨质的再生。相反地,对于与骨质生长过快相关的疾病,则也有可能利用雌激素相关受体((errα、errβ和errγ等的小分子抑制剂来治疗。尽管雌激素相关受体((errα、errβ和errγ等)归类为孤儿核激素受体,并持续保持较高活性,近来研究表明,酚基酰基腙类小分子化合物可以有效地与errβ和errγ的c-端配体结合域结合并上调其功能。而对于可以通过增强pgc1的功能进而提高胰岛素敏感性的errα,因此开发小分子雌激素受体调节剂,对提高糖尿病以及与2型糖尿病相关的高血脂、高胆固醇血症、高甘油三酯血症的治疗效果具有十分重要的意义。
技术实现要素:
为了克服现有技术中存在的缺点和不足,本发明的目的在于提供可以有效激动雌激素相关受体的化合物,该化合物可有效激动如errα,β,γ等雌激素相关受体,并使用于治疗代谢性疾病如糖尿病以及与2型糖尿病相关的高血脂、高胆固醇血症、高甘油三酯血症等疾病或症状。
本发明的目的通过下述技术方案实现:一种雌激素调节剂化合物,该化合物结构式如下:
其中,所述r1选自
1)h;
2)甲基、乙基、异丙基、叔丁基;
3)芳基;
其中,所述r2选自
1)h;
2)甲基、乙基、异丙基、叔丁基;
3)芳基;
4)c1-c6含氟烷基;
其中,所述r3选自
1)h;
2)甲基、乙基、异丙基、叔丁基;
3)甲氧基;
4)卤素
其中,所述r4选自
1)h;
2)甲基、乙基、异丙基、叔丁基;
3)卤素;
4)c3-c8环氧基;
5)羟基
进一步的,所述的雌激素调节剂化合物中,r1为甲基,r2为苯基,r3为甲氧基,r4为h。
进一步的,所述的雌激素调节剂化合物中,r1为甲基,r2为-(4-氯苯基),r3为甲基,r4为h。
进一步的,所述的雌激素调节剂化合物中,r1为h,r2为-(2-氯苯基),r3为h,r4为甲基。
进一步的,所述的雌激素调节剂化合物中,r1为乙基,r2为-cl32cf3,r3为甲基,r4为羟基。
本发明还提供一种药用组合物,所述药用组合物包含有效量的上述雌激素调节剂化合物以及在药学上可接受的载体或赋形剂。所述雌激素受体调节剂应用于制备治疗糖尿病的药品。
本发明的有益效果:本发明提供了一类可以有效激动雌激素相关受体的化合物,该化合物可有效激动如errα,β,γ等雌激素相关受体,并使用于治疗代谢性疾病如糖尿病以及与2型糖尿病相关的高血脂、高胆固醇血症、高甘油三酯血症等疾病或症状。本发明上述化合物可以上调errα和pgc-1α的功能,可以有效地应用于缓解胰岛素抵抗或恢复胰岛素敏感性,改善糖尿病患者的葡萄糖平衡,并可以有效地降低患者血糖浓度以及糖尿病血清标记物血红蛋白a1c糖基化水平。
本发明采用有效量的上述雌激素调节剂化合物以及在药学上可接受的载体或赋形剂制得的组合物,治疗代谢性疾病如糖尿病以及与2型糖尿病相关的高血脂、高胆固醇血症、高甘油三酯血症等疾病或症状,并与胰岛素增敏剂或胰岛素分泌促进剂类药物提高对上述疾病的治疗效果。
附图说明
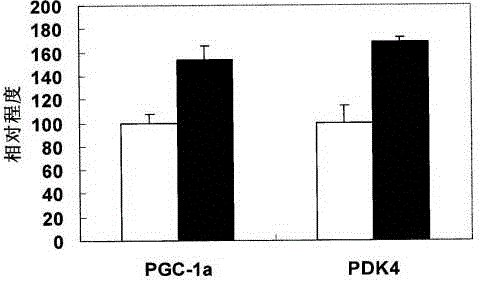
图1是化合物d1对errα驱动pgc1α和pdk4启动子报告基因表达影响的示意
图2是化合物d1对口服葡萄糖耐量影响的示意图;
图3是化合物d1对血糖水平(不禁食)影响的示意图;
图4是化合物d1对胰岛素耐量影响的示意图;
图5是化合物d1对血液胰岛素水平影响的示意图;
图6是化合物d1对血液脂肪酸水平影响的示意图;
图7是化合物d1对血液总胆固醇平影响的示意图;
图8是化合物d1对血液甘油三脂水平影响的示意图。
具体实施方式
为了便于本领域技术人员的理解,下面结合实施例及附图对本发明作进一步的说明,实施方式提及的内容并非对本发明的限定。
实施例1
一种雌激素调节剂化合物,该化合物结构式如下:
r1为甲基,r2为苯基,r3为甲氧基,r4为h。
该化合物记作化合物d1,所述化合物d1的制备方法包括以下步骤:
取2-吡啶甲酸中加入催化量(5%mol)的nabr在socl2中回流24h,蒸馏除去剩余的socl2得化合物b。化合物b在0℃慢慢滴加meoh,再回流24h,蒸馏除去剩余的meoh,饱和nahco3洗涤,ea萃取后过柱分离得c。化合物c与肼(1.5eqiv)在meoh中回流4h后冷却至室温,析出固体,过滤得化合物d。化合物d溶于无水四氢呋喃,0℃下滴加三氟乙酸(1.0eqiv),再慢慢滴加t-buono(3.0eqiv),冰浴条件下反应30min,旋除四氢呋喃得化合物e粗品。化合物e在无水甲苯中回流过夜,旋除甲苯后,溶于thf,加入koh(5eqiv,10n),室温条件下搅拌5h,dcm萃取,过柱分离得化合物g。化合物g和h(1.2eqiv)在多聚磷酸(ppa)中130℃加热4h后冷却至室温,用naoh(aq)调ph>7,dcm萃取,无水naso4干燥后过柱分离得化合物d1
1hnmr(400mhz,cdcl3),δ8.94(d,j=8.0hz,1h),8.03~8.06(m,2h),7.46~7.48(m,3h),6.97(d,j=2.8hz,1h),6.76(dd,j=8.0,2.8hz,1h),6.71(s,1h),3.95(s,3h);ms(esi),m/z:253(m+h)+.
实施例2
一种雌激素受体调节剂,该化合物结构式如下:
其中,r1为甲基,r2为-(4-氯苯基),r3为甲基,r4为h。
该化合物记作化合物d2,所述化合物d2的制备方法参照化合物d1。
1hnmr(400mhz,cdcl3),δ8.91(d,j=8.0hz,1h),7.98(d,j=8.4hz,2h),7.44(d,j=8.4hz,2h),6.99(s,1h),6.79(dd,j=8.0,2.0hz,1h),6.66(s,1h),3.98(s,3h);ms(esi),m/z:290(m+h)+.
实施例3
一种雌激素受体调节剂,该化合物结构式如下:
其中,r1为h,r2为-(2-氯苯基),r3为h,r4为甲基。
该化合物记作化合物d3,所述化合物d3的制备方法参照化合物d1。
1hnmr(400mhz,cdcl3,88.91(d,j=8.0hz,1h),7.98(d,j=8.4hz,2h),7.44(d,j=8.4hz,2h),6.99(s,1h),6.79(dd,j=8.0,2.0hz,1h),6.66(s,1h),3.98(s,3h);ms(esi),m/z:288(m+h)+.
实施例4
本实施用于证实本发明所涉及的化合物d1-d3可以有效地增强293ft细胞中errα所调控的报告基因的表达,说明本发明所涉及的化合物可有效激动errα的功能。
为了检测所述化合物对err及其它核激素受体的调节活性,我们利用同时含有合适报告基因的这些受体的表达载体对293ft细胞进行瞬时转染。所采用方法以及合适的报告基因为本领域熟练工作人员所熟知。其它已知的载体也可运用于本发明的检测方法。
首先,将人类errα、errβ,或鼠科errγ的配体结合域序列与酵母gal4dna结合域(氨基酸1-147accessionx85976)融合,形成含有errα、errβ,errγ受体配体结合域的gal4融合体。这样就构建了选择性gal-herrα、gal-l-herrβ和gal-merrγ表达载体。pgal为仅含有酵母gal4dna结合域而不含errα、errβ或errγ的对照。而cmv-pgc-1α则含有并表达由pgc-1α(accessionnm.sub.--008904)衍生的pgc-1α编码序列。
将处于对数生长期的293ft细胞以104/孔传代于96孔细胞培养板中,培养过夜,长到80~90%满时用于转染。用优化培养液mem稀释lipofectamine2000试剂(0.5ul/100ul)和质粒dna。优化培养液稀释后质粒浓度分别为:pcmv-gal4herrlbd或pcmv-gal4herrlbd,25ng/孔;pfr-luci,50ng/孔;pfrtlaczeoplasmid,50ng/孔。lipofectamine2000稀释5分钟后,将稀释后的脂质体和质粒dna等体积混合,于室温放置20min。迅速将细胞换液成含有10%charcoal-strip胎牛血清的无酚红dmem100ul。再加入脂质体/dna混合物,将枪头深入液面下,逐滴加入,并轻轻摇晃混匀。
将化合物溶于dmso中,在细胞瞬时转染质粒6个小时后,分别加入10m不同的化合物,dmso为对照。放于5%co2培养箱中继续培养24个小时,之后根据promega公司steady-glokit说明书利用veritastmmicroplate
luminometer(turnerbiosystems)测定细胞的荧光值,荧光值反应err活性,并以-gal作为内标进行校正。取20μl细胞裂解物置于96孔板中,加入:100×mg溶液1.5μl,1×onpg溶液33μl,0.1mol/l磷酸钠(ph7.5)95.5μl。37℃温浴至出现黄色,加入50μl,0.1mol/lna2co3终止反应读取od405。
化合物d1-d3可以剂量依赖性地增强gal-herr在cmv-pgc-1存在下对报告基因uasgx4-tk-luc的控制,通过试验测得,以对照组的相对活性为100,化合物d1-d3的相对活性分别为170-180、150-160、150-160。说明这些化合物对errα具有激动活性。
实施例5
本实施例用于证实本发明所涉及的化合物可以有效地增强hela细胞中pgc-1α或pdk4启动子所调控的报告基因的表达。
利用pgl3启动子衍生的pgl3-pgc-1α或pdk4-启动子(promega)和errα表达载体对hela进行瞬时转染,同时以renillaprl-cmv荧光素酶载体作为对照载体确定转染效率。人类全长errα序列被克隆至pcmv表达载体中。根据pgc-1α或pdk4转录起始位点上游2.6kb处的序列涉及引物,并以人类gdna为模板通过pcr的方法获得了pgc-1α或pdk4启动子。
用于活性分析的hela细胞用含有10%胎牛血清的dmem培养基于37℃,5%co2中培养。转染前一天,将细胞接种至50-80%汇合度,dmem-fbs培养。在本实验中我们采用的是脂质体的转染方式。pgl3-pgc1α或pdk4荧光素酶表达载体及pcmv载体或pcmv-herrα载体被用于转染细胞。将转染载体的细胞用含有0.01%dmso或10m化合物d1化合物的dmem-fbs培养基处理约24小时。可以观察到化合物d1处理组中errα驱动pgc-1α或pdk4启动子报告基因表达增高(请参阅图1,白色柱体为对照组)。
实施例6
本实施例用于证实本发明所涉及的化合物可以有效地改善高脂喂养诱导小鼠对葡萄糖的耐受。
50天大小的c57bl/j6雄性小鼠分别分别用正常饮食(chowdiet)或含有猪油的60%卡路里的高脂饮食喂养10周。20只动物分为4组(每组5只),分别用添喂法,服用药物赋形剂(空白对照),5mg/kg/day罗格列酮(阳性对照),5mg/kg/day化合物d1,连续给药30天。首先对动物进行禁食5小时,随后给动物口服葡萄糖,分别在服葡萄糖后的0,15,30,60和120分钟抽取血样。利用监测仪(accu-chekadvantage,roche)测量血糖水平;分别以血糖水平和时间为纵、横坐标作图,计算不同动物组的曲线下面积(auc)。
研究表明,与阳性对照试验(罗格列酮,5mg/kg/day)相似,化合物d1可以在5mg/kg/day的剂量下降低口服葡萄糖耐受试验的曲线下面积(auc),说明err激动剂(化合物d1)在动物体内试验中改善葡萄糖耐受,请参阅图2,从左至右依次是阴性对照组(正常饲料)、阴性对照组、罗格列酮(高脂肪饲料)、化合物d1)。同时测试不禁食血糖水平,发现化合物d1(实施例10)可以在5mg/kg/day的剂量下降低不禁食血糖水平(请参阅图3,各试验组排列同图2)。
另外又对动物作胰岛素耐受测试,首先对动物进行禁食5小时,随后以0.75iu/kg的量注射胰岛素,在0,15,30,60和120分钟抽取血样。利用监测仪(accu-chekadvantage,roche)测量血糖水平;分别以血糖水平和时间为纵、横坐标作图,计算不同动物组的曲线下面积(auc)。
研究表明,与阳性对照试验(罗格列酮,5mg/kg/day)相似,化合物d1可以在5mg/kg/day的剂量下降低胰岛素耐受测试的曲线下面积(auc),说明err激动剂(化合物d1)在动物体内试验中增强胰岛素灵敏度(请参阅图4)。另外,测试禁食和非禁食血液胰岛素水平,发现化合物d1可以在5mg/kg/day的剂量降低非禁食血液胰岛素水平(请参阅图5,从左至右依次是阴性对照组、阳性对照组、化合物d1)。
进一步的,测试禁食和非禁食血液脂肪酸水平,发现化合物d1可以在5mg/kg/day的剂量降低非禁食血液脂肪酸水平(请参阅图6,从左至右依次是阴性对照组、阳性对照组、化合物d1)。
进一步的,测试禁食和非禁食血液总胆固醇水平,发现化合物d1可以在5mg/kg/day的剂量降低非禁食血液总胆固醇水平(请参阅图7,从左至右依次是阴性对照组、阳性对照组、化合物d1)。
进一步的,测试禁食和非禁食血液甘油三酯水平,发现化合物d1可以在5mg/kg/day的剂量降低非禁食血液甘油三酯水平(请参阅图8,从左至右依次是阴性对照组、阳性对照组、化合物d1)。
本发明还提供一种药用组合物,包含有效量的雌激素受体调节剂以及在药学上可接受的载体或赋形剂。本发明的雌激素受体调节剂干细胞可以单独或以药物组合物的形式给药。其制剂形式取决于所选择的给药途径,可以按照本领域熟知的常识进行制造。
以上内容仅为本发明的较佳实施例,对于本领域的普通技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,本说明书内容不应理解为对本发明的限制。
- 还没有人留言评论。精彩留言会获得点赞!