高通量微流控芯片及其用于分选癌细胞的方法与流程
本发明属于微流控芯片技术领域,具体涉及一种高通量微流控芯片及其用于分选癌细胞的方法。
背景技术:
癌症是严重威胁人类生命健康和阻碍社会发展的一种疾病。根据分子生物学和临床研究的结果表明,部分诊断为早期的癌症实际上已经发生远处转移,即肿瘤微转移,而常规的影像学、组织学或细胞学方法难以发现。肿瘤微转移可通过血行及淋巴途径在全身组织和器官中形成微小转移病灶,而淋巴结转移发展最终也要进入血液循环中形成循环肿瘤细胞(circulatingtumorcells,简称ctcs),从而导致原发肿瘤转移的全身化倾向。因此,ctcs的检测有助于早期发现肿瘤微转移、监测术后复发、评估疗效及预后或选择合适的个体化治疗。
目前常见的循环肿瘤细胞捕获方法主要是基于微流控技术,然而新的ctcs标志物的发现和验证还处在初级阶段。理想的ctcs标志物将在所有的ctcs上表达,但不会在自身血细胞(白细胞、内皮细胞、造血干细胞hscs和骨髓间充质干细胞)上表达,且在入侵和循环过程中不会被抑制。基于细胞表面蛋白标记物的ctcs富集技术会运用到微柱或者磁性材料的设备上,在芯片或设备内部结构表面上连接癌细胞表面抗原靶向捕获ctcs,并且富集的ctcs都可以被用于后续的检测和表征的步骤。为了对ctcs进行精准的检测,通过免疫染色或反转录pcr(rt-pcr)的方法进行表型分析是对基因组分析的额外补充(如,荧光原位杂交fish或单个细胞分析),这样有助于避免假阳性的出现。通过使用抗体组合来对抗各种不同的标记,以减少ctcs的复杂异质性的影响,这样可以避免假阴性结果。基于rt-pcr的特定转录本检测与完整ctcs的捕获和可视化有很大的不同,而目标转录本的低水平不合理表达可能导致假阳性结果。
微流控筛选细胞的方法主要包括基于ctcs表面蛋白标记物的免疫荧光技术和基于物理性质的技术。其中,基于ctcs表面蛋白标记的免疫荧光法主要依赖能被抗体检测到的特定标记物来实现,如上皮细胞标志物在正常上皮细胞和上皮肿瘤(即癌组织)上表达,但在间充质白细胞上不表达,因此常常被用于区分癌细胞和正常细胞。上皮细胞粘附分子(epcam)是最常用于富集的阳性上皮循环肿瘤ctc细胞的细胞表面标志物,并且是细胞角蛋白(即ck8、ck18和ck19)-细胞支架蛋白质类家族的成员,这是上皮细胞所特有的。这种上皮细胞特异性蛋白标记物已经成为检测癌症患者循环上皮细胞表现型的“金标”的标记物。然而,目前已经有研究报道了在两性结肠疾病患者中可检测到循环上皮细胞的存在,而这些细胞可能是假阳性结果的来源。而基于物理性质的技术是利用其物理特性将其与正常血细胞区分开来。例如,最初认为肿瘤细胞比造血细胞更大(>8μm大小)并且更不易变形;因此,在过去几年里已经开发了基于细胞过滤和离心力的不同装置。然而,
上述现有技术主要针对单个ctcs,并且对于捕获细胞簇具有较低的灵敏度和特异性。大多数方法都是使用诸如抗epcam的抗体来捕获基于特定表面标记的ctcs,对于部分表面无表达相应标志物的ctcs无法捕获,而且使用抗体提高了成本。而使用离心、过滤等方法则效率较低且筛查准确度不高。由此可见虽然目前已经有多种方法实现ctcs的筛选,但每种方法均存在一定的缺点与不足,直接影响了细胞筛选的效率和细胞的活性,并且降低了筛查结果的准确度,难以达到对癌症转移的早期诊断。
技术实现要素:
针对目前循环肿瘤细胞等筛查存在的数据不可靠、假阳性、效率低下等问题,本发明提供一种高通量微流控芯片及其用于分选癌细胞的方法。
为实现上述发明目的,本发明的技术方案如下:
一种高通量微流控芯片,该高通量微流控芯片包括样品进样通道、缓冲液进液通道、主通道、第一出液通道和第二出液通道;
所述主通道包括曲率半径逐渐增大的弧形通道和连接于所述弧形通道一端的直线通道;
所述样品进样通道和缓冲液进液通道分别与所述弧形通道的另一端连通,所述第一出液通道和第二出液通道分别与所述直线通道连通。
相应地,一种如上所述的高通量微流控芯片用于分选癌细胞的方法,包括以下步骤:
提供洁净的高通量微流控芯片;
将待分选的样品以(100~1400)μl/min的流速自样品进样通道通入,同时将缓冲液以(750~13070)μl/min的流速自缓冲液进液通道通入;
待第一出液通道和第二出液通道出液稳定时,同时分别回收第一出液通道和第二出液通道排出的液体,并分别统计第一出液通道和第二出液通道回收的所述液体中含有的癌细胞的数量。
本发明的技术效果为:
相对于现有技术,本发明上述提供的高通量微流控芯片,具有筛分周期短、效率高等特点,且筛分的肿瘤细胞和其他细胞分离效果好,筛分过程中不会导致筛出的细胞变形,使得肿瘤细胞筛查准确度高,另外还避免了抗体的使用,操作简单快捷,降低了成本。
本发明高通量微流控芯片用于分选癌细胞的方法,筛分周期短、筛分的肿瘤细胞和其他细胞分离效果好,并且不出现细胞变形,有利于进一步研究分析肿瘤细胞。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
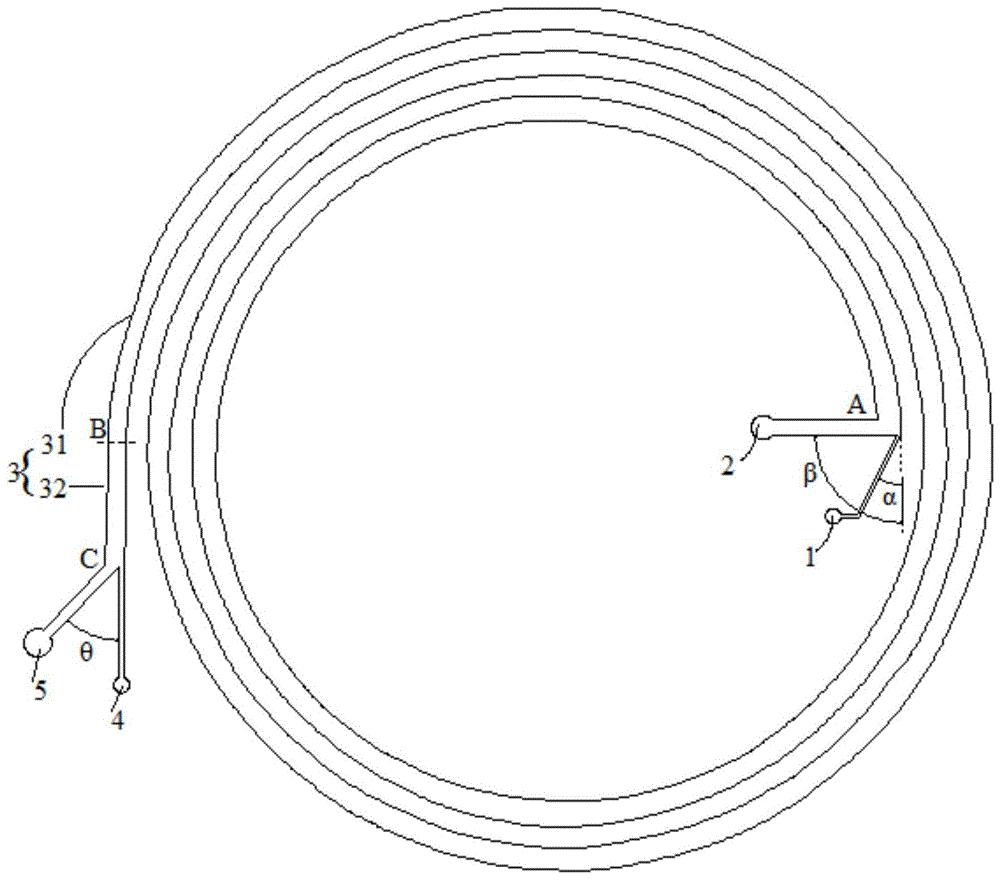
图1为本发明提供的高通量微流控芯片结构示意图;
图2为本发明提供的高通量微流控芯片另一结构示意图;
图3为本发明图2的m部分放大示意图;
其中,1-样品进样通道;2-缓冲液进液通道;3-主通道;31-弧形通道,32-直线通道,33-辅助直线通道;4-第一出液通道;5第二出液通道;ab表示圆弧通道部分(图2中ad、ef、gh、ib表示分成的若干段圆弧部分);bc表示直线通道部分;de、fg、hi、ba表示辅助直线通道部分。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
请参阅图1、图2、图3,本发明提供一种高通量微流控芯片。
请参阅图1,本发明高通量微流控芯片包括样品进样通道1、缓冲液进液通道2、主通道3、第一出液通道4、第二出液通道5。主通道3包括曲率半径逐渐增大的弧形通道31和直线通道32,弧形通道31和直线通道32连通,自然过渡。
其中,样品进样通道1和缓冲液进液通道2分别与主通道3连通,即样品进样通道1和缓冲液进液通道2在主通道3的弧形通道32端部实现与主通道3连通,通过与主通道3连通,使得样品、缓冲液能够同时通入主通道3里,因而样品进样通道1与主通道3的连通部位以及缓冲液进液通道2与主通道3的连通部位为相同部位,均在主通道3的同一端部,而第一出液通道4和第二出液通道5则在主通道3的另一端与主通道3连通,即第一出液通道4和第二出液通道5在主通道3的直线通道32端部实现与主通道3连通,由此实现自样品进样通道1进入的样品与从缓冲液进液通道2进入的缓冲液混合并经在主通道3中流动之后,分别由第一出液通道4和第二出液通道5排出。
作为一个优选的方式,以弧形通道31与样品进样通道1相接的部位(也就是弧形通道31的端部)为切点,该切点处形成的切线与样品进样通道1之间的夹角为α,且0°≤α≤45°,而该切线与缓冲液进液通道2之间的夹角为β,且45°≤β≤90°,样品进样通道1和切线的夹角在α范围内以及缓冲液进液通道2和切线的夹角在β范围内时,进入主通道3的样品能靠着主通道3的外壁,同时缓冲液进液通道2中的缓冲液进入主通道3时能将从样品进样通道1进入的颗粒往主通道3的外壁挤压,使颗粒靠近主通道3外壁,以利于颗粒进行迪恩循环。
优选地,样品进样通道1的宽度为(75~300)μm,缓冲液进液通道2的宽度为(425~1700)μm,主通道3的宽度为样品进样通道1宽度和缓冲液进液通道2宽度的总和,主通道3的高度(简称:h)为(50~250)μm,样品进样通道1的宽度和缓冲液进液通道2的宽度与主通道3的宽度相同,主要是避免因为宽度不相同而容易导致样品、缓冲液有滞留,不利于分离,而在该高度下,可以实现高通量、快速分离。
主通道3的长度lc满足:
作为一个优选的方式,第一出液通道4的宽度和第二出液通道5的宽度之和与直线通道32的宽度相同,确保经过主通道3筛分后的样品不发生滞留。第一出液通道4的宽度和第二出液通道5的宽度的比值为0.37~2.06;第一出液通道4的长度和第二出液通道5的长度相同。同时第一出液通道4和第二出液通道5之间的夹角为θ,且10°≤θ≤60°,第一出液通道4出口和第二出液通道5出口的距离不小于2mm,以确保由第一出液通道4和第二出液通道5排出的样品不相互污染,同时该角度θ有利于白细胞产生与肿瘤细胞向不同的偏移方向偏移,防止白细胞跑进第一出液通道4。
请参阅图2,作为本发明的一个优选实施例,高通量微流控芯片的主通道3除了包括弧形通道31、直线通道32之外,还包括若干段辅助直线通道33,不同曲率半径的弧形通道31同样被分割成若干段,通过辅助直线通道33将相邻两段弧形通道31进行连通,由此使得待筛分的样品分离效果更为彻底。
具体来说,图2的虚线将高通量微流控芯片分割成若干段弧形通道31和若干段辅助直线通道33,其中,ad、ef、gh、ib虚线区间对应的通道为弧形通道31,而de、fg、hi、ba虚线区间对应的通道部分为辅助直线通道33,于是主通道3的结构可以描述如下“第一弧形通道31-第一辅助直线通道33-第二弧形通道31-第二辅助直线通道33-第三弧形通道31-第三辅助直线通道33-第四弧形通道31-第四辅助直线通道33-第五弧形通道31-……-第(n-1)弧形通道31-第(n-1)辅助直线通道33-第n弧形通道31-第n辅助直线通道33-直线通道32”,其中,n≥4,且n取整数,前述涉及的“第一”、“第二”、……“第(n-1)”、“第n”,均是为了方便描述主通道3的结构,其不做特别的意思,这些序号对应的弧形通道的曲率半径应当是逐渐增大。
本发明的高通量微流控芯片中,一块芯片可以包括若干个具有相同结构的通道,这些通道均包括样品进样通道1、缓冲液进液通道2、主通道3、第一出液通道4、第二出液通道5,主通道3包括曲率半径逐渐增大的弧形通道31和直线通道32,弧形通道31和直线通道32连通。
本发明高通量微流控芯片可以用于对不同大小微珠、白细胞、血液中癌细胞、细胞团等颗粒物的筛分,适用于目标颗粒物的粒径ac和主通道高度h的比值ac/h范围为0.05~0.3的颗粒物的筛分。在筛分过程中,能够使得粒径范围为5~50μm的颗粒发生聚焦,经过筛分,筛分后的颗粒物达到第一出液通道4和第二出液通道5附近时颗粒物的流动路线详见图3,其中目标颗粒物与主通道3内壁的间距为a,目标颗粒物(如癌细胞)沿着图3中点划线的方向流动,经由第一出液通道4排出,而其他颗粒物(非目标颗粒物)与主通道3内壁的间距为b,其他颗粒物沿着图3中虚线的方向流动,经由第二出液通道5排出,从而实现目标颗粒物和非目标颗粒物的筛分,其中,a和b满足
将上述高通量微流控芯片用于分选癌细胞时,其包括以下步骤:
将本发明的高通量微流控芯片进行清洗和检查处理,确保高通量微流控芯片洁净、通道通畅;
将待分选的样品以(100~1400)μl/min的流速自样品进样通道1通入,同时将缓冲液以(750~13070)μl/min的流速自缓冲液进液通道2通入;
待第一出液通道4和第二出液通道5出液稳定时,同时分别回收第一出液通道4和第二出液通道5排出的液体,并分别统计第一出液通道4和第二出液通道5回收的液体中含有的癌细胞的数量。
该筛分步骤也适用于其他颗粒物的筛分,筛分得到的目标颗粒物回收率达到90%以上,并且目标颗粒物不发生变形。
为更有效的说明本发明的技术方案,下面通过多个具体实施例说明本发明的技术方案。
实施例1
一种高通量微流控芯片及其用于筛分白细胞的方法。
该高通量微流控芯片具有如图1所示的结构,包括样品进样通道1、缓冲液进液通道2、主通道3、第一出液通道4、第二出液通道5,主通道3包括曲率半径逐渐增大的弧形通道31和直线通道32,弧形通道31和直线通道32连通,自然过渡;其中,样品进样通道1与弧形通道31切线的夹角α=30°、宽度为150μm、高度为196μm;缓冲液进液通道2与弧形通道31切线的夹角β=90°、宽度为850μm、高度为196μm;主通道3的宽度为1000μm,高度为196μm,以样品进样通道1端部为起点的弧形通道31的曲率半径为15mm,并且弧形通道31的曲率半径依次增大,后一个曲率半径比前一个曲率半径增大0.5mm,直线通道32的长度是10mm,主通道3的总长度为270.825mm,第一出液通道4的长度为10mm、宽度为400μm,第二出液通道5的长度为10mm、宽度为600μm,第一出液通道4和直线通道32在同一直线上,第一出液通道4和第二出液通道5之间的夹角θ=14°。
将该高通量微流控芯片用于筛分白细胞的方法,包括以下步骤:
(a).使用微量注射泵将白细胞样品自样品进样通道1注入,控制白细胞样品的进液流速为600μl/min,同一时间使用微量注射泵将pbs缓冲液自缓冲液进液通道2,控制pbs缓冲液的进液流速为4500μl/min。
(b).观察第一出液通道4和第二出液通道5的出液情况,待出液均稳定后,同时分别对第一出液通道4排出的液体和第二出液通道5排出的液体进行收集,收集时间长度为10s。
(c).统计步骤(b)中第一出液通道4和第二出液通道5收集到的白细胞的数量,发现第一出液通道4收集到的白细胞回收率达到1%以下。
实施例2
一种高通量微流控芯片及其用于筛分微珠的方法(本方法中涉及的微珠是粒径大小为10μm左右的颗粒,用来模拟白细胞)。
该高通量微流控芯片具有如图1所示的结构,包括样品进样通道1、缓冲液进液通道2、主通道3、第一出液通道4、第二出液通道5,主通道3包括曲率半径逐渐增大的弧形通道31和直线通道32,弧形通道31和直线通道32连通,自然过渡;其中,样品进样通道1与弧形通道31切线的夹角α=45°、宽度为150μm、高度为190μm;缓冲液进液通道2与弧形通道31切线的夹角β=90°、宽度为850μm、高度为190μm;主通道3的宽度为1000μm,高度为190μm,以样品进样通道1端部为起点的弧形通道31的曲率半径为15mm,并且弧形通道31的曲率半径依次增大,后一个曲率半径比前一个曲率半径增大0.5mm,直线通道32的长度是10mm,主通道3的总长度为270.825mm,第一出液通道4的长度为10mm、宽度为250μm,第二出液通道5的长度为10mm、宽度为750μm,第一出液通道4和直线通道32在同一直线上,第一出液通道4和第二出液通道5之间的夹角θ=45°。
将该高通量微流控芯片用于筛分微珠的方法,包括以下步骤:
(a).使用微量注射泵将微珠悬浮液样品自样品进样通道1注入,控制微珠悬浮液样品的进液流速为500μl/min,同一时间使用微量注射泵将pbs缓冲液自缓冲液进液通道2,控制pbs缓冲液的进液流速为1200μl/min。
(b).观察第一出液通道4和第二出液通道5的出液情况,待出液均稳定后,同时分别对第一出液通道4排出的液体和第二出液通道5排出的液体进行收集,收集时间长度为15s。
(c).统计步骤(b)中第一出液通道4和第二出液通道5收集到的微珠的数量,发现第一出液通道4收集到的微珠回收率达到1%以下。
实施例3
一种高通量微流控芯片及其用于筛分癌细胞的方法。
该高通量微流控芯片具有如图1所示的结构,包括样品进样通道1、缓冲液进液通道2、主通道3、第一出液通道4、第二出液通道5,主通道3包括曲率半径逐渐增大的弧形通道31和直线通道32,弧形通道31和直线通道32连通,自然过渡;其中,样品进样通道1与弧形通道31切线的夹角α=30°、宽度为150μm、高度为192μm;缓冲液进液通道2与弧形通道31切线的夹角β=90°、宽度为850μm、高度为192μm;主通道3的宽度为1000μm,高度为192μm,以样品进样通道1端部为起点的弧形通道31的曲率半径为15mm,并且弧形通道31的曲率半径依次增大,后一个曲率半径比前一个曲率半径增大0.5mm,直线通道32的长度是10mm,主通道3的总长度为270.825mm,第一出液通道4的长度为10mm、宽度为250μm,第二出液通道5的长度为10mm、宽度为750μm,第一出液通道4和直线通道32在同一直线上,第一出液通道4和第二出液通道5之间的夹角θ=14°。
将该高通量微流控芯片用于筛分癌细胞的方法,包括以下步骤:
(a).使用微量注射泵将癌细胞悬浮液样品自样品进样通道1注入,控制癌细胞悬浮液样品的进液流速为600μl/min,同一时间使用微量注射泵将pbs缓冲液自缓冲液进液通道2,控制pbs缓冲液的进液流速为4500μl/min。
(b).观察第一出液通道4和第二出液通道5的出液情况,待出液均稳定后,同时分别对第一出液通道4排出的液体和第二出液通道5排出的液体进行收集,收集时间长度为10s。
(c).统计步骤(b)中第一出液通道4和第二出液通道5收集到的癌细胞的数量,发现第一出液通道4收集到的癌细胞回收率达到95%,并且收集到的癌细胞与未筛分前相比,外观形貌没有发生变化。
实施例4
一种高通量微流控芯片及其用于筛分癌细胞的方法。
该高通量微流控芯片具有如图2所示的结构,包括样品进样通道1、缓冲液进液通道2、主通道3、第一出液通道4、第二出液通道5,主通道3包括曲率半径逐渐增大的若干弧形通道31、直线通道32和若干辅助直线通道33,若干弧形通道31和若干辅助直线通道33交替连通之后,与直线通道32连通,自然过渡;其中,样品进样通道1与弧形通道31切线的夹角α=30°、宽度为150μm、高度为196μm;缓冲液进液通道2与弧形通道31切线的夹角β=90°、宽度为850μm、高度为196μm;主通道3的宽度为1000μm,高度为196μm,以样品进样通道1端部为起点的弧形通道31的曲率半径为15mm,并且弧形通道31的曲率半径依次增大,后一个曲率半径比前一个曲率半径增大0.5mm,直线通道32的长度是10mm,第一出液通道4的长度为10mm、宽度为400μm,第二出液通道5的长度为10mm、宽度为600μm,第一出液通道4和直线通道32在同一直线上,第一出液通道4和第二出液通道5之间的夹角θ=14°。
将该高通量微流控芯片用于筛分癌细胞的方法,包括以下步骤:
(a).使用微量注射泵将癌细胞悬浮液样品自样品进样通道1注入,控制癌细胞悬浮液的进液流速为500μl/min,同一时间使用微量注射泵将pbs缓冲液自缓冲液进液通道2,控制pbs缓冲液的进液流速为4500μl/min。
(b).观察第一出液通道4和第二出液通道5的出液情况,待出液均稳定后,同时分别对第一出液通道4排出的液体和第二出液通道5排出的液体进行收集,收集时间长度为10s。
(c).统计步骤(b)中第一出液通道4和第二出液通道5收集到的癌细胞的数量,发现第一出液通道4收集到的癌细胞回收率达到99%,并且收集到的癌细胞与未筛分前相比,外观形貌没有发生变化。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包括在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!