一种重组人酸性成纤维细胞生长因子大规模制备方法与流程
本发明属于细胞生长因子领域,特别涉及一种重组人酸性成纤维细胞生长因子大规模制备方法。
背景技术:
人酸性成纤维细胞生长因子(humanacidicfibroblastgrowthfactor,hfgf-1)是一种介导细胞间传递的多肽类物质,主要对源于中胚层和神经外胚层类细胞具有强烈的促分裂和增殖的作用。研究表明,hfgf-1具有广泛的生物学功能,其不仅在胚胎发生、发育、血管生成、创伤修复、骨骼生长等方面有重要的促进作用,还在血管舒张、缺血保护、脑损伤及神经保护等方面有至关重要的作用,甚至还能改善糖脂代谢,治疗糖尿病慢性并发症。因此,hfgf-1表现出巨大的临床应用价值,使人们对hfgf-1的需求量也日益增加,迫切需要一种安全、高效、经济的方法用于hfgf-1的大规模生产,以满足hfgf-1的临床需求。
然而,hfgf-1是人体内源性的,微量高效的多肽类物质,就像胰岛素一样,很难从体液或组织中大量提取以满足临床所需,而基因工程技术的发展使这一难题得到了解决。目前,hfgf-1已经通过重组dna技术在多种宿主中成功表达,包括大肠杆菌、酵母、家蚕、哺乳动物细胞等。与此同时,近几年高密度细胞发酵技术的发展也十分迅猛,已经成为发酵工业生产的最有效的方法之一。因此,可以通过重组dna技术与高密度细胞发酵技术相结合来大规模生产hfgf-1,可以实现hfgf-1的工业化生产,满足其在基础研究和临床应用中的需求。
虽然hfgf-1已经在多种宿主中成功表达,但是大肠杆菌(e.coli)表达系统仍然是基因工程菌产业化的理想表达系统,因为其具有易于培养、发酵周期短、成本廉价等优点,但是hfgf-1在大肠杆菌表达系统中能否高度表达受诸多因素的影响。研究发现,全长hfgf-1的n端容易形成发夹结构影响产物的表达效率;另外,其n端也容易出现缺失6、8、12和19个氨基酸残基不等的多种形式的截短的hfgf-1分子影响产物的稳定性。除了重组工程菌本身的表达性能外,其生长和产物表达的最适环境条件都会影响rhfgf-1最终的获得量。
因此,本发明为了能实现rhfgf-1的大规模稳定生产并降低生产成本,构建了n端缺失19个氨基酸(不包括n末端起始氨基酸甲硫氨酸m)的rhfgf-1高效表达的工程菌株即bl21(de3)plyss-pet3c/rhfgf-1;对其发酵工艺进行优化,并在30l发酵罐上进行放大培养,最终确定高密度发酵工艺;进行层析条件的放大及进一步优化,确定最终rhfgf-1纯化工艺路线。
技术实现要素:
为解决现有技术的不足,本发明提供了一种重组人酸性成纤维细胞生长因子(rhfgf-1)大规模制备方法,包括以下步骤:
(1)人酸性成纤维细胞生长因子(hfgf-1)基因序列的优化,所述优化包括对hfgf-1基因序列进行适合大肠杆菌偏好性的密码子优化;
(2)重组质粒pet3c/rhfgf-1的构建及转化:以优化后的hfgf-1序列为模板进行pcr扩增,将pcr扩增产物鉴定正确后利用限制性内切酶酶切pcr扩增产物和pet3c空载体,利用t4dna连接酶连接,连接产物经琼脂糖凝胶电泳鉴定后转化入感受态大肠杆菌bl21(de3)plyss,并进行阳性克隆筛选获得阳性克隆bl21(de3)plyss-pet3c/rhfgf-1;
(3)rhfgf-1大规模发酵生产:首先进行rhfgf-1小规模发酵因素研究与验证,即对rhfgf-1摇瓶发酵过程中的因素和参数进行摸索,以确定优化的发酵条件;然后根据摇瓶发酵工艺参数的实验结果,将其扩大至2l三角摇瓶进行初步放大验证;最后,根据摇瓶实验得到的实验数据,结合罐发酵的实际,对培养基及控制参数进行适当调整,在30l发酵罐中对rhfgf-1进行大规模发酵生产;
(4)rhfgf-1的纯化:利用高压均质破碎发酵菌体,离心取上清,利用两步柱层析法纯化获得高纯度的rhfgf-1蛋白。
进一步地,所hfgf-1基因序列的优化还包括切除其n端1-13位信号肽氨基酸和成熟蛋白n末端的6个氨基酸。
进一步地,所述摇瓶发酵的优化的发酵条件包括:工程菌培养阶段的最适温度为35-39℃,优选为37℃;最适ph为6.5-7.5,优选为6.8-7.2;最适溶氧量为≥15%,优选为≥30%;最适葡萄糖浓度为4-8g/l,优选为5g/l;最适氯化铵浓度为3-6g/l,优选为4g/l;工程菌诱导阶段的最适温度为33-37℃,优选为35℃;最适ph为6.8-7.8,优选为7.0-7.2;最适溶氧量为≥15%,优选为≥30%;最适葡萄糖浓度为1-8g/l,优选为2-5g/l;最适氯化铵浓度为3-6g/l,优选为4g/l。
进一步地,所述pcr扩增引物对的核苷酸序列如下:上游引物pi:5'ttaactttaagaaggagatatacatatggctaactataaaaaacc3';下游引物pⅱ:5'ctttcgggctttgttagcagccggatccttagtccgacgacac3'。
更进一步地,所述30l发酵罐发酵参数为:诱导剂iptg的最佳诱导时间是4h、最佳诱导时机是对数生长中期、iptg最佳诱导浓度是0.5mmol/l-0.8mmol/l;工程菌培养阶段的最适温度为35-39℃,优选为37℃;最适ph为6.5-7.5,优选为6.8-7.2;最适溶氧量为≥15%,优选为≥30%;最适葡萄糖浓度为4-8g/l,优选为5g/l;最适氯化铵浓度为3-6g/l,优选为4g/l;工程菌诱导阶段的最适温度为33-37℃,优选为35℃;最适ph为6.8-7.8,优选为7.0-7.2;最适溶氧量为≥15%,优选为≥30%;最适葡萄糖浓度为1-8g/l,优选为2-5g/l;最适氯化铵浓度为3-6g/l,优选为4g/l。
更进一步地,取二代种子液以一定比例接种于30l发酵罐进行发酵,所述二代种子液制备方法为:将步骤(2)获得的工程菌bl21(de3)plyss-pet3c/rhfgf-1,以1:100(v/v)接种到液体培养基中进行活化,以200rpm、37℃振荡培养3-4h至a600达到0.8-1.2,镜检合格即为一代种子液;取一代种子液以1:10的比例接种于二代种子培养基中进行扩增,以150rpm、37℃振荡培养10-12h至a600达到3.0-5.0,镜检合格即为二代种子液。
所述二代种子培养基包括胰蛋白胨10.0g/l、酵母粉10.0g/l、氯化钠4.0g/l、磷酸二氢钾1.0g/l、磷酸氢二钾(k2hpo4.3h2o)3.0g/l。
更进一步地,所述两步柱层析法为:第一步选用处理量较大的阳离子交换柱层析(cmsepharose)进行捕获和粗提;第二步选用肝素亲和柱层析(heparinsepharose)进行精制纯化。
更进一步地,rhfgf-1原液的hplc纯度大于99%,发酵液的蛋白回收率为1.9±0.2mg/ml,比活性为6.8±0.6×105au/mg,适用于产业化生产。
有益效果
本发明设计构建的工程菌bl21(de3)plyss-pet3c/rhfgf-1具有良好的遗传稳定性,在抗性培养基中传代50次,质粒稳定性高于95%,质粒结构没有发生变化,rhfgf-1的表达水平稳定,可以保证稳定生产。
本发明的重组人酸性成纤维细胞生长因子(rhfgf-1)大规模发酵工艺具有生产稳定性和适用性,适用于rhfgf-1的工业化生产。
本发明的rhfgf-1的纯化方法获得的rhfgf-1原液的hplc纯度大于99%,发酵液的蛋白收率为1.9±0.2mg/ml,比活性6.8±0.6×105au/mg,满足产业化生产要求。
附图说明
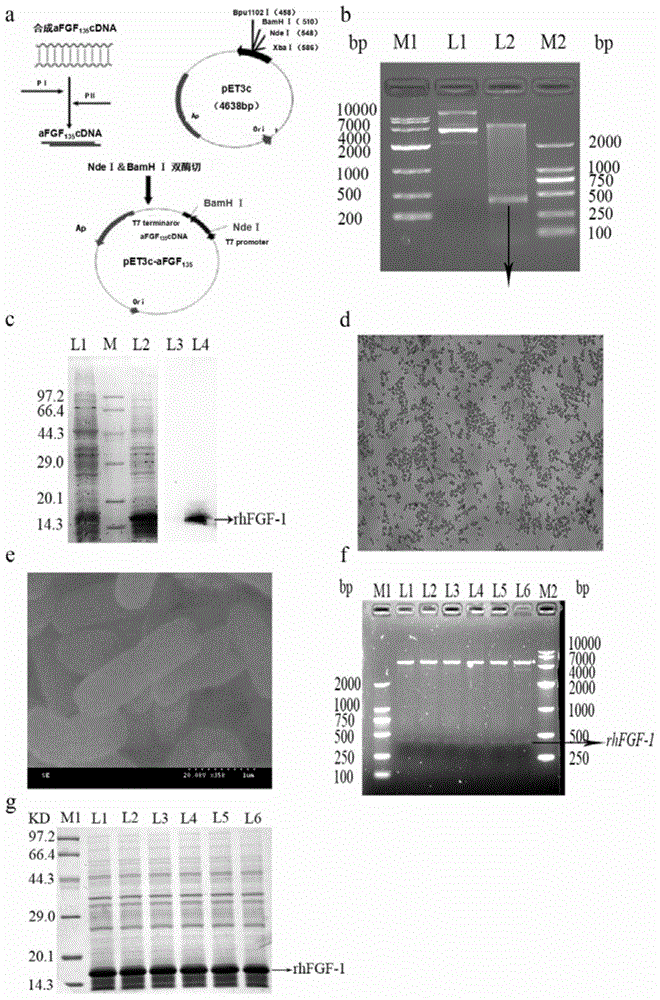
图1:图1a为重组质粒pet3c/rhfgf-1构建过程;
图1b为酶切电泳图,其中m1为1wmarker,l1为未酶切质粒,l2为酶切片段,m2为2qmarker,黑色箭头表明hfgf-1基因正确插入治疗pet3c中;
图1c为蛋白电泳图和蛋白质免疫印迹图,l1为诱导前,m为marker,l2为诱导后,l3为诱导前的蛋白质免疫印迹,l4为诱导后的蛋白质免疫印迹;
图1d为革兰氏染色结果;
图1e为扫描电镜图;
图1f为工程菌质粒酶切图,m1为2qmarker,l1为0代酶切,l2为10代酶切,l3为20代酶切,l4为30代酶切,l5为40代酶切,l6为50代酶切,m2为1wmarker;
图1g为蛋白电泳图,m1为marker,l1为0代蛋白表达,l2为10代蛋白表达,l3为20代蛋白表达,l4为30代蛋白表达,l5为40代蛋白表达,l6为50代蛋白表达。
图2:图2a为小试蛋白电泳图,l1为诱导前,m为marker,l2为诱导后1h,l3为诱导后2h,l4为诱导后3h,l5为诱导后4h;
图2b为中试蛋白电泳图,l1为诱导前,m为marker,l2为诱导后1h,l3为诱导后2h,l4为诱导后3h,l5为诱导后4h;
图2c为小试和中试发酵蛋白表达量统计差异结果;
图2d为三批中试发酵表达量;
图2e为发酵罐生长曲线。
图3:图3a为可溶性实验验证蛋白电泳图,m为marker,l1为上清,l2为沉淀;
图3b为cm柱蛋白电泳图,m为marker,l1为上样,l2为洗脱;
图3c为肝素柱蛋白电泳图,m为marker,l1为上样,l2为洗脱;
图3d为中试纯化蛋白电泳图,图l1为上样,l2为洗脱,m为marker,l3为上样,l4为洗脱,m为marker;
图3e为三批中试纯化蛋白含量;
图3f为三批中试纯化蛋白纯度;
图3g为高效液相峰图。
具体实施方式
在下文中更详细地描述了本发明以有助于对本发明的理解。
应当理解的是,在说明书和权利要求书中使用的术语或词语不应当理解为具有在字典中限定的含义,而应理解为在以下原则的基础上具有与其在本发明上下文中的含义一致的含义:术语的概念可以适当地由发明人为了对本发明的最佳说明而限定。
下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册中所述的条件,或按照制造厂商所建议的条件。
以下实施方式部分采用的材料及统计方法如下:胰蛋白胨和酵母粉购自oxoidco.,ltd(hampshire,england),凝胶提取试剂盒、pcr纯化试剂盒和质粒微量制备试剂盒购自大连takara公司(大连,中国),异丙基-β-d-硫代半乳糖苷(iptg)购自北京鼎国昌盛生物技术有限公司,氨苄西林钠购自石药集团中诺药业(石家庄)有限公司。
阳离子交换介质cmsepharose、肝素亲和层析介质heparinsepharose购自gehealthcare公司(美国),ф1.6×20cm中压玻璃柱购自上海厦美生物工程有限公司。
实验结果以平均值±标准差的形式表示,使用graphpadprism5.0进行统计学分析,包括studentt检验,单向和双向anova,p值<0.05被认为是显著差异。
实施例1:含pet3c/rhfgf-1工程菌的建立与鉴定
1.1重组质粒pet3c/rhfgf-1的构建及转化
本实施例对hfgf-1(genbank,nm_001144892.2)的基因序列进行密码子优化,主要包括切除其n端1-13个信号肽氨基酸和成熟蛋白n末端的6个氨基酸(不包括n末端起始氨基酸甲硫氨酸m)共19个氨基酸以获得hfgf-1135,其氨基酸序列如seqidno:1所示。以hfgf-1135为模板在两端引入ndeⅰ和bamhⅰ限制性酶酶切位点(以斜体及下划线标示),并设计上下游引物:上游引物pⅰ:
重组质粒pet3c/rhfgf-1构建详细过程如(图1a)所示;经ndei+bamhi双酶切鉴定后可以看到在420bp附近有目的基因的片段,说明hfgf-1基因已正确插入质粒pet3c中(图1b);经测序对重组质粒基因序列分析后结果与设计的n-端缺失19个氨基酸的天然hfgf-1基因序列一致。
1.2表达rhfgf-1的工程菌鉴定
为了鉴定上述转化的工程菌是否表达rhfgf-1蛋白,挑选阳性克隆菌,置于5ml液体lb培养基中(氨苄西林钠浓度为100μg/ml),在37℃,200rpm条件下培养,至a600为0.8~1.2;加入iptg至其终浓度1mmol/l,37℃,200rpm条件下诱导表达4h后取样,进行sds-page,采用考马斯亮蓝染色法和westernblot进行鉴定。
结果表明工程菌在1mmol/l的iptg诱导后能在16.0kd附近有rhfgf-1表达条带,而且免疫印迹结果呈阳性,与预期结果一致,鉴定结果见(图1c)。
在工程菌形态方面,工程菌bl21(de3)pet3c/rhfgf-1被涂布于固体lb平板上,37℃培养过夜,次日观察菌落形态,经革兰氏染色后在光学显微镜下观察菌体形态;然后对该工程菌冷冻干燥后进行扫描电镜检查(hitachi,h-7500,japan)。
结果显示,在光学显微镜下观察到典型的大肠杆菌形态,且无杂菌污染如(图1d);在扫描电镜下,我们也观察到典型的大肠杆菌形态,且无支原体、病毒样颗粒及其它微生物污染(图1e)。
实施例2:工程菌稳定性试验
为了研究工程菌的稳定性,本实施例鉴定了在繁殖过程中第10,20,30,40,50代工程菌的质粒稳定性及rhfgf-1的表达稳定性。
从含氨苄西林钠的固体lb平板上挑取单菌落接种于含氨苄西林钠的lb试管斜面上,37℃培养12h为一代,挑取少许菌苔继续划线传代培养至第50代为止。在此过程中,每隔10代取菌液适量稀释,涂布于不含氨苄西林钠的lb平板上,待长出菌落后,随机挑取100个单菌落,转到含氨苄西林钠的lb固体平板上,37℃培养过夜并计数。
将原代和第10,20,30,40,50代工程菌分别接种到含有100μg/ml氨苄西林钠的lb液体培养基中,37℃培养至生长对数期,离心收集菌体抽提质粒,利用限制性内切酶进行酶切,酶切片段进行琼脂糖凝胶电泳分析。
将原代和第10,20,30,40,50代工程菌分别接种到含有100μg/ml氨苄西林钠的lb液体培养基中,37℃振荡培养至生长对数期,加异丙基-β-d-硫代半乳糖苷(iptg)至其终浓度1mmol/l诱导4h,离心收集菌体,进行sds-page,采用考马斯亮蓝染色法分析rhfgf-1表达水平。
结果显示,工程菌bl21(de3)pet3c/rhfgf-1在连续传代培养50代时,工程菌的稳定率仍能达到95%(结果见表1);另外,原代和第10,20,30,40,50代在对数生长期时的酶切图谱表明工程菌在传代过程中,质粒结构没有发生变化(图1f);最后用sds-page电泳分析了原代和第10,20,30,40,50代工程菌的rhfgf-1表达水平,结果表明工程菌在连续传代过程中,rhfgf-1占菌体总蛋白比例没有降低(图1g)。
表1:工程菌质粒遗传稳定性
实施例3:rhfgf-1发酵工艺的优化
3.1rhfgf-1小试规模发酵因素的研究与验证
本实施例首先对rhfgf-1摇瓶发酵过程中的因素和参数先后进行了摸索,包括诱导时间、诱导剂浓度、诱导时机、培养和诱导温度、ph值、溶氧量、葡萄糖浓度、氯化铵浓度,重复三次实验,确定优化的发酵条件。
具体为:将工程菌bl21(de3)plyss-pet3c/rhfgf-1,以1:100(v/v),接种到含有氨苄西林钠(终浓度100μg/ml)的30ml液体lb培养基中,37℃,150rpm振荡培养过夜;再以1:100转种于30ml液体lb培养基的250ml三角瓶中,37℃,200rpm振荡培养12h;将处于对数生长期的菌液以30ml每瓶,装至250ml三角瓶中,添加iptg至终浓度为1mmol/l诱导至蛋白表达量基本稳定。
通过控制单因素变量先后进行以下实验,包括诱导时间(1、2、3、4、5、6h);诱导剂iptg浓度(0.01、0.05、0.1、0.3、0.5、0.8、1.0mmol/l);诱导时机(a600=0.2、0.4、0.8、1.2、1.8、2.5);培养或诱导阶段温度(30、33、35、37℃);培养阶段lb培养基或诱导阶段菌液ph值(ph=6.6、6.8、7.0、7.2、7.4)、溶氧量以250ml三角瓶中液体容量来代替,培养阶段的lb培养基体积或诱导阶段菌液体积(30、50、75、100ml);培养阶段的lb培养基或诱导阶段菌液葡萄糖浓度(0.5、1、2、5、10、20g/l)和氯化铵浓度(0.5、1、2、4、10g/l)。发酵全过程中每1h取样测a600值,以a600平均值为纵坐标绘出菌体生长曲线;诱导后每1h留样进行sds-page,采用考马斯亮蓝染色法分析rhfgf-1表达水平。
结果表明该菌对数生长中期4.0-8.0h,所对应的a600值为0.8~1.2;在终浓度1mmol/l的iptg诱导4h后,rhfgf-1表达量达到最大值,其后菌体密度和rhfgf-1表达量基本稳定;低浓度的iptg几乎不会抑制菌体生长,但rhfgf-1表达量较低;高浓度iptg抑制菌体生长,但rhfgf-1表达量高,当iptg终浓度大于0.5mmol/l时,rhfgf-1的表达量基本没有变化,且能达到一定的菌体密度,综合考虑产率与成本后,确定诱导剂iptg终浓度为0.5mmol/l-0.8mmol/l;与对数生长初、后期开始诱导相比,对数生长中期(a600为0.8~1.2)开始诱导的rhfgf-1表达量和菌体密度相对较高;在摸索该菌种最适生长与表达温度、ph值、溶氧量、葡萄糖浓度、氯化铵浓度中,分别在培养或诱导阶段控制单因素变量进行培养,分别以每小时a600均值为纵坐标绘制生长曲线并取诱导前、不同诱导温度4h样品进行sds-page检测,分析rhfgf-1的表达量,结果表明,该工程菌培养阶段的最适温度为37℃、最适ph为6.8~7.2、最适溶氧量为≥30%、最适葡萄糖浓度为5g/l、最适氯化铵浓度为4g/l,另外,该菌诱导阶段的最适温度为35℃、最适ph为7.0-7.2、最适溶氧量为≥30%、最适葡萄糖浓度为2g/l-5g/l、最适氯化铵浓度为4g/l。
根据上述摇瓶发酵工艺参数的实验结果,将其扩大至2l三角摇瓶中进行初步放大验证。
将工程菌bl21(de3)plyss-pet3c/rhfgf-1,以1:100(v/v),接种到含有氨苄西林钠的lb培养基(胰蛋白胨10.0g/l、酵母粉5.0g/l、氯化钠10.0g/l)中(4×30ml)进行活化,以200rpm、37℃振荡培养3~4h至a600达到0.8~1.2,镜检合格即为一代种子液。取一代种子液以1:10的比例接种于二代种子培养基(胰蛋白胨10.0g/l、酵母粉10.0g/l、氯化钠4.0g/l、磷酸二氢钾1.0g/l、磷酸氢二钾(k2hpo4.3h2o)3.0g/l)(4×300ml)中进行扩增,以150rpm、37℃振荡培养10-12h至a600达到3.0-5.0,镜检合格即为二代种子液。取二代种子按1:10(v/v)的比例接种于300ml液体发酵培养基中(2l三角瓶,共8瓶),发酵培养基采用含磷酸盐的液体lb培养基并添加葡萄糖至终浓度为5g/l、氯化铵终浓度为4g/l,37℃,ph7.0,200rpm振荡培养至a600达到0.8~1.2,加入终浓度为0.8mmol/liptg进行诱导,35℃,ph7.2,200rpm振荡诱导4h。取诱导前、诱导4h样品进行sds-page,采用考马斯亮蓝染色法分析rhfgf-1表达水平。
结果表明三批摇瓶发酵rhfgf-1的表达量占菌体总蛋白33.3±1.8%,菌体密度为7.1±0.1g/l,三批表达量和菌体密度结果无统计学差异(参见表2和(图2a,c)),因此,可以为后续中试放大发酵提供数据参考。
表2:三批小试、中试发酵数据
2.2三批rhfgf-1中试放大发酵工艺
根据摇瓶实验得到实验数据,并结合罐发酵的实际,对培养基及控制参数进行适当调整,并在30l发酵罐(biotech-30js,shanghaibaoxingbio-engineeringequipmentco.,ltd)上进行放大与验证,考察该工艺的稳定性和适用性。
罐内培养基(胰蛋白胨17.0g/l、酵母粉23.0g/l、氯化钠4.0g/l、磷酸二氢钾1.0g/l、磷酸氢二钾3.0g/l、氯化铵2.0g/l、葡萄糖5.0g/l)在线灭菌并降温至37℃,加入无机盐(硫酸镁(mgso4.7h2o)1.0g/l;氯化钙0.013g/l)及生长因子(维生素b10.005g/l)。在火焰条件下,取二代种子液(获取方法同小试发酵)以1:10的比例接种于30l发酵罐中,37℃发酵培养,通过流加25%氨水控制ph6.8-7.0,通过转数、通气量、罐压(表3)及流加20%葡萄糖溶液(控制do2≥25%),每小时分别取样测定a600值,培养12h,以a600平均值为纵坐标绘出菌体生长曲线。在30l罐发酵三批放大生产中,按此方法培养至a600为22~25,流加iptg,35℃进行诱导培养,通过流加25%氨水或磷酸盐溶液控制发酵液ph7.0-7.2,流加新鲜营养成分如氮源(胰蛋白胨17.0g/l,酵母粉23.0g/l、氯化钠4.0g/l、磷酸二氢钾1.0g/l、磷酸氢二钾(k2hpo4.3h2o)3.0g/l)、无机盐类物质,诱导4h,取诱导前、诱导4h样品进行sds-page,采用考马斯亮蓝染色法分析rhfgf-1表达水平。发酵结束后,立即用管式离心机将发酵液进行分离。离心结束后收集菌体,称量湿重,放-20℃冻存。
结果表明,工程菌bl21(de3)pet3c/rhfgf-1在30l罐发酵时的对数生长中期a600值为22~25(图2e)。连续三批发酵周期为8-9h,发酵液的菌体密度为80.4±2.7g/l,rhfgf-1表达量为37.8±1.8%(见表2),与三批小试发酵相比产量更高且有统计学差异图(图2b,c),但是三批中试的各批次间无统计学差异,说明该工艺能在30l规模发酵罐稳定高效生产rhfgf-1,适用于工业化生产(图2d)。发酵过程中参数控制与优化简要参数见表3
表3:发酵过程中参数控制与优化简要参数
实施例4:rhfgf-1的纯化
4.1三批rhfgf-1小试纯化工艺研究
由于rhfgf-1主要在细胞周质表达,所以需要破菌。本实施例采用高压均质机破碎菌体,控温的循化介质采用乙醇,设定温度低于15℃。
菌体以1:10(w/v)比例悬浮于20mmol/lpb(ph7.4)缓冲溶液中(nacl0.1mol/l、edta-2na5mmol/l、tween-800.05%),充分搅匀,调节压力至200bar-300bar,对混悬液进行循化均质1次,再逐渐升高压力至设备推荐的大肠杆菌高压均质压力800bar~900bar,高压均质2次,进行革兰氏染色后镜检,观察在可见视野范围内有无完整大肠杆菌。高压均质后用高速冷冻离心机4℃、20000rpm,离心30min,收集上清置4℃备用;取部分上清和菌体破碎后沉淀进行sds-page,采用考马斯亮蓝染色法分析rhfgf-1表达水平。
工程菌经高压均质后离心得到的上清与破菌沉淀进行sds-page检测,结果表明rhfgf-1主要以可溶性形式表达(图3a);
三批小试纯化相关数据见表4。
我们采用两步柱层析方法,第一步选用处理量较大的阳离子交换柱层析(cmsepharose)(柱体积均为20ml)作为捕获和粗提步骤,具体步骤如下:用平衡缓冲液ⅰ(20mmol/lpb、5mmol/ledta-2na、0.1mol/lnacl(ph7.0))以3ml/min的流速平衡3~5个柱体积至基线平稳;将粗体液以2ml/min的速率上样,收集穿出峰,并留样检测;用平衡缓冲液ⅰ以3ml/min的流速平衡至基线平稳;用洗脱缓冲液ⅰ(20mmol/lpb、5mmol/ledta-2na、0.6mol/lnacl(ph7.0))以3ml/min的流速进行洗脱,收集洗脱峰,并留样检测;用再生缓冲液(20mmol/lpb、2.0mol/lnacl(ph7.0))洗脱3~5个柱体积,收集穿出峰,并留样检测,用0.5mol/lnaoh进行清洗后,20%乙醇封柱。第二步根据fgf-1蛋白与肝素特异性结合的亲和特性,选用heparinsepharose作为精制纯化步骤。用平衡缓冲液ⅱ(20mmol/lpb、5mmol/ledta-2na、0.6mol/lnacl(ph7.0))以3ml/min的流速平衡3~5个柱体积至基线平稳;将离子交换柱层析收集的蛋白溶液,以流速2ml/min上样,收集穿出峰,并留样检测;用平衡缓冲液ⅱ以3ml/min的流速平衡至基线平稳;用洗涤缓冲液(20mmol/lpb、5mmol/ledta-2na、0.9mol/lnacl(ph7.0))以3ml/min的流速洗涤杂质;用洗脱缓冲液ⅱ(20mmol/lpb、5mmol/ledta-2na、1.3mol/lnacl(ph7.0))以3ml/min的流速进行洗脱,收集洗脱峰,并留样检测;用再生缓冲液洗脱3~5个柱体积,收集穿出峰,并留样检测,用0.5mol/lnaoh进行清洗后,20%乙醇封柱。以上纯化操作均在4℃下进行。两步柱层析收集的样品均进行sds-page,采用考马斯亮蓝染色法分析纯化结果;使用lowry法测定纯化后rhfgf-1的蛋白浓度。
3.2三批rhfgf-1中试纯化与鉴定
为了考察小试纯化工艺的稳定性与适用性,在根据三批小试纯化结果的基础上进了三批中试放大纯化。菌体在高压均质破菌后用大容量高速冷冻离心机4℃,8000rpm,离心40min后收集上清置4℃备用。按小试纯化方法进行粗体液为2100ml的三批中试规模纯化。通过sds-page和rpc-hplc进一步分析30l规模发酵纯化后的rhfgf-1的分子量与纯度,并采用lowry法测定蛋白浓度;使用等电聚焦电泳仪分析rhfgf-1的等电点;为确定纯化后rhfgf-1的二级蛋白结构,使用cd光谱(jasco715,jasco);并通过nih-3t3细胞系进行mtt法来检测纯化后rhfgf-1的生物活性。最后,rhfgf-1原液的n末端测序和分子肽图谱由上海中科新生命生物技术有限公司进行检测。
结果显示,在三批中试放大纯化后得到rhfgf-1的分子量约16kd,符合理论值结果如图(3d)所示;三批中试放大纯化相关数据见表5,每升发酵液所获得rhfgf-1的蛋白量为158.6±6.8mg/l,且三批中试纯化各批次间的蛋白收率无统计学差异,p>0.05如图(3e);经rp-hplc分析其纯度为99.5±0.1%,且保留时间为10.135±0.021min图(3f、3g)。经过等电聚焦电泳仪分析得到rhfgf-1的等电点约为5.3,符合理论值。经连续三批rhfgf-1原液检定得到rhfgf-1的蛋白含量为1.9±0.2mg/ml,效价为1.32±0.1×106au/ml,比活性为6.8±0.6×105au/mg,蛋白质肽段覆盖率采用chymatrypsin、glu-c、trypsin三种酶联用的方法对rhfgf-1原液进行酶切,得到的数据经整合后发现肽段的覆盖率为100%;三批中试纯化各批次间各指标均符合最新版中国药典的规定。三批rhfgf-1原液检定结果见表6。
表4:小试纯化相关数据表
表5:三批中试放大纯化相关数据表
表6:三批rhfgf-1原液检定结果
由上述实施例可知,本发明构建的工程菌bl21(de3)pet3c/rhfgf-1具有良好的遗传稳定性,在抗性培养基中传代50次,质粒稳定性高于95%,质粒结构没有发生变化,而且rhfgf-1的表达水平稳定,可以保证稳定生产。
通过对工程菌bl21(de3)pet3c/rhfgf-1在小试摇瓶水平发酵工艺的摸索,初步确定发酵生产工艺为:诱导剂iptg的最佳诱导时间是4h、最佳诱导时机是对数生长中期、最佳诱导浓度是0.5mmol/l-0.8mmol/l;培养阶段的最佳温度是37℃、最佳ph值是6.8-7.0、最佳葡萄糖浓度是5g/l;诱导阶段的最佳温度35℃、最佳ph值是ph为7.0-7.2、最佳葡萄糖浓度2g/l~5g/l;培养与诱导阶段的最佳氯化铵浓度是4g/l、最佳溶氧度是≥25%;三批小试摇瓶发酵得到rhfgf-1的表达量为33.3±1.8%,菌体密度为7.1±0.1g/l,为后续中试30l放大发酵提供了可靠的实验参数。三批中试放大发酵结果显示rhfgf-1的表达量为37.8±1.8%,菌体密度为80.4±2.7g/l,罐发酵时间为8h-9h,说明该工艺具有生产稳定性和适用性,适用于rhfgf-1的工业化生产。
最后建立了高压均质破碎、阳离子交换柱层析、肝素亲和柱层析的中试放大纯化生产工艺路线,得到的连续三批rhfgf-1原液的hplc纯度为99.5±0.1%,发酵液的蛋白收率为1.9±0.2mg/ml,比活性6.8±0.6×105au/mg,满足了产业化生产的要求。
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>温州医科大学
<120>一种重组人酸性成纤维细胞生长因子大规模制备方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>135
<212>prt
<213>人(homosapiens)
<400>1
alaasntyrlyslysprolysleuleutyrcysserasnglyglyhis
151015
pheleuargileleuproaspglythrvalaspglythrargasparg
202530
seraspglnhisileglnleuglnleuseralagluservalglyglu
354045
valtyrilelysserthrgluthrglyglntyrleualametaspthr
505560
aspglyleuleutyrglyserglnthrproasngluglucysleuphe
65707580
leugluargleuglugluasnhistyrasnthrtyrileserlyslys
859095
hisalaglulysasntrpphevalglyleulyslysasnglysercys
100105110
lysargglyproargthrhistyrglyglnlysalaileleupheleu
115120125
proleuprovalserserasp
130135
- 还没有人留言评论。精彩留言会获得点赞!