一种苯并二噻吩和吡嗪共聚物、制备方法和应用与流程
本发明涉及聚合物光伏材料技术领域,具体涉及一种苯并二噻吩和吡嗪共聚物、制备方法和应用。
背景技术:
随着地球变暖现象的日益严重和化石能源(煤、石油和天然气等)面临枯竭,世界各国对二氧化碳的排放量均采取严格的管制。因此,太阳能作为一种可再生清洁能源越来越得到全球科学界和产业界的重视。聚合物太阳电池作为新型太阳电池的一类,近二十年来以其特有的器件质量轻和可使用印刷的方式制备成大面积柔性器件等优势取得了快速的发展,成为当前全球能源领域研究的热点之一。
聚合物太阳能电池材料的研究进展,李永玺等,功能高分子学报,2014年12月,描述了d-a体系的各种典型的材料的结构式,还描述了给体聚合物材料的设计主要包括以下几个方面:(1)通过调控聚合物材料的能级和带隙来获得较高的开路电压和短路电流;(2)提高聚合物材料的平面性来增加其电荷迁移率,但是在该过程中,要确保材料的溶解性和稳定性。这些因素相互关联,理想状态下,应该对这些因素同时优化,但是实际上这是十分困难的。因此,找到一个平衡点使电池取得最大光电转化效率,是材料化学家设计聚合物给体材料的关键。在设计有机太阳能电池聚合物材料的过程中,要遵循以下几个原则:(1)聚合物应具有较窄的能带间隙;(2)较高的摩尔消光系数;(3)良好的平面性;(4)高的电荷迁移率;(5)较好的光稳定性。同时,较高的分子量、较高的电荷迁移率、最优化的形貌、填充因子等等都可以影响材料的性能。通常来说,共轭聚合物的结构可以被分为以下3个部分:共轭聚合物主链、侧链和取代基团。还公开了不同能带间隙的聚合物电池材料的常见化合物。
当前阻碍双结电池的发展最重要的问题之一是缺少高性能、低带隙的优良聚合物材料。为了解决这个问题,一种方法是增加聚合物主链的醌式结构,来获得窄带隙聚合物。醌式聚合物通常是由2个或2个以上的不同芳香性化合物并联在同一个结构单元上所组成的。它将采用共振能较大的芳香性结构,从而使另一芳香性结构采用醌式结构。由于苯环的共振能(1.56ev)大于噻吩的共振能(1.26ev),噻吩单元将采用醌式结构。因为醌式结构的共振能较芳香性结构低,所以采用醌式结构可以有效降低聚合物的能带间隙。聚苯并噻吩的能带间隙只有1.1ev,聚噻吩并哌嗪的能带间隙为0.95ev,而聚噻吩并噻吩的能带间隙只有0.8-0.9ev。虽然这类聚合物能带间隙极小,但是这种方法在制备窄带隙聚合物太阳能电池材料的过程中有其局限性,因为这类聚合物的homo能级通常较高,因此基于它们的太阳能电池器件的开路电压很小,极大地限制了光电转化效率的提高。
中国专利申请号为201510807862.x的专利公开了光伏薄膜材料,其为吲哚衍生物与苯并二噻吩双锡共聚物,结构式如下:
技术实现要素:
本发明要解决的技术问题是提供一种苯并二噻吩和吡嗪共聚物、制备方法和应用,其具有宽的可见光区吸收,较低的homo能级,相对较窄的带隙,以及较高的光电转换效率。
本发明的内容结构式如下:
优选的,所述二维共轭苯并二噻吩和吡嗪共聚物的数均分子量为13000-23000,重均分子量为27000-53000,pdi(聚合物分散性指数)为1.8-2.5。
优选的,所述r为8~20个碳原子的直链或支链烷烃。
优选的,所述r为取代基:
一种苯并二噻吩和吡嗪共聚物的制备方法,包括以下步骤:
1)1,4-二乙酰基哌嗪-2,5-二酮、5-溴-2-呋喃甲醛和有机溶剂混合,加入三乙胺,反应,冷却,沉析,过滤,洗涤,得到3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮;
2)3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮、碳酸钾与溴代烷烃在有机溶剂混合,升温,反应后冷却,将混合物进行萃取,干燥,分离,得到2,5-二烷氧基-3,6-双((5-溴呋喃-2-)亚甲基)吡嗪;
3)将2,6-二(三甲基锡)-4,8-二(2-乙基己氧基)-苯并(1,2-b;4,5-b’)二噻吩与2,5-二烷氧基-3,6-双((5-溴呋喃-2-)亚甲基)吡嗪加入到无水甲苯中,再加入四(三苯基膦)钯,反应后冷却,沉析,过滤,提取,得到苯并二噻吩和吡嗪共聚物。
优选的,步骤1)中1,4-二乙酰基哌嗪-2,5-二酮与5-溴-2-呋喃甲醛的摩尔比为1:2~3。
优选的,步骤2)中所述溴代烷烃为溴代异辛烷、溴代辛烷或溴代2-辛基-十二烷,3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮与溴代烷烃的摩尔比为1:3~4。
优选的,步骤3)中反应温度为100~110℃。
本发明还提供一种苯并二噻吩和吡嗪共聚物在太阳能电池中的应用,所述苯并二噻吩和吡嗪共聚物用作太阳能电池中作为电子给体材料。
在本发明中,当r为
当r为
当r为
本发明的共聚物具有良好的可加工性,并且经过初步尝试证明具有较好的光电转换特性,作为聚合物太阳能电池的工作介质有着广阔的应用前景。
具体的,本发明的制备方法,包括以下步骤:
1)氩气保护下,1,4-二乙酰基哌嗪-2,5-二酮与5-溴-2-呋喃甲醛混合在dmf中,在120℃下加入三乙胺,反应12小时,冷却至室温,沉析,过滤,洗涤,得到3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮;
2)氩气保护下,3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮、碳酸钾与溴代烷烃在dmf中升温至100℃下反应2小时,冷却至室温,将混合物倒入水中,萃取,干燥,旋干溶剂,过硅胶柱,得到2,5-二烷氧基-3,6-双((5-溴呋喃-2-)亚甲基)吡嗪;
3)氮气保护下,将2,6-二(三甲基锡)-4,8-二(2-乙基己氧基)-苯并(1,2-b;4,5-b’)二噻吩与2,5-二烷氧基-3,6-双((5-溴呋喃-2-)亚甲基)吡嗪加入到无水甲苯中,再加入pd(pph3)4(四(三苯基膦)钯),110℃下反应24小时,冷却至室温,沉析,过滤,索氏提取,得到聚合物。
其中,3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮的结构式如下式(1)所示:
2,5-二烷氧基-3,6-双((5-溴呋喃-2-)亚甲基)吡嗪的结构式如下式(2)所示:
2,6-二(三甲基锡)-4,8-二(2-乙基己氧基)-苯并(1,2-b;4,5-b’)二噻吩的结构式如下式所示:
本发明的共聚物的合成路线如下:
i)net3,dmf,120℃,12h;ii)rbr,k2co3,dmf,100℃,2h;iii)pd(pph3)4,toluene,115℃,48h。
本发明的苯并二噻吩和吡嗪共聚物的制备方法是采用stille偶联的方法,将aqm电子受体单元与bdt电子给体单元直接偶联而成。
本发明合成了一种含有不同烷氧基侧链的aqm电子受体单元,通过stille偶联的方法,将aqm单元通过碳-碳单键与另一个电子给体单元bdt相连接,得到苯并二噻吩和吡嗪共聚物。它们在常见的有机溶剂(如甲苯、氯苯、四氢呋喃等)中有良好的溶解性,可以用溶液旋涂的方法制备高质量的聚合物薄膜。同时,这些聚合物光伏材料具有宽的可见光-近红外区吸收,合适的homo以及lumo能级和相对较窄的带隙。以此类聚合物为电子给体、pc61bm或有机小分子为电子受体制备了聚合物太阳能电池,其最高能量转换效率可达到4.7%,具有良好的光电转换效率。
本发明用上述苯并二噻吩和吡嗪共聚物为电子给体材料,应用于聚合物太阳能电池,其制备方法如下:
将本发明的苯并二噻吩和哌嗪类共聚物电子给体材料与电子受体(pc61bm)或有机小分子)物质共混,加入氯苯,使混合物充分溶解,旋涂在导电玻璃ito上制备出导电薄膜,然后在薄膜上蒸镀金属铝电极。
本发明提供的苯并二噻吩和吡嗪共聚物具有宽的吸收光谱和合适的电化学能级,并用核磁共振谱、质谱和元素分析的方法表征了各步合成产物的分子结构。用紫外-可见吸收光谱研究了苯并二噻吩和吡嗪类共聚物光伏材料的光学性能。用循环伏安法研究了苯并二噻吩和吡嗪共聚物的电化学性能,并以其作为电子给体做成了太阳能电池器件,获得了良好的光电转换效率。
与现有技术相比,本发明具有以下有益效果:
(1)本发明合成的路线简单,成本低,且合成方法具有普适性,可以较好的推广应用到其他的aqm类光伏材料的合成。
(2)本发明的aqm类聚合物光伏材料具宽的紫外-可见吸收光谱,能够保障吸收足够多的太阳光子,获得高的光电流。
(3)本发明的aqm类聚合物光伏材料具有较低的homo能级,对氧的稳定性高,有利于制备性能更加稳定的太阳能电池器件。
(4)本发明用苯并二噻吩和吡嗪共聚物光伏材料为电子给体材料,应用于聚合物太阳能电池获得的能量转换效率(pce=4.7%),具有良好的应用前景。
附图说明
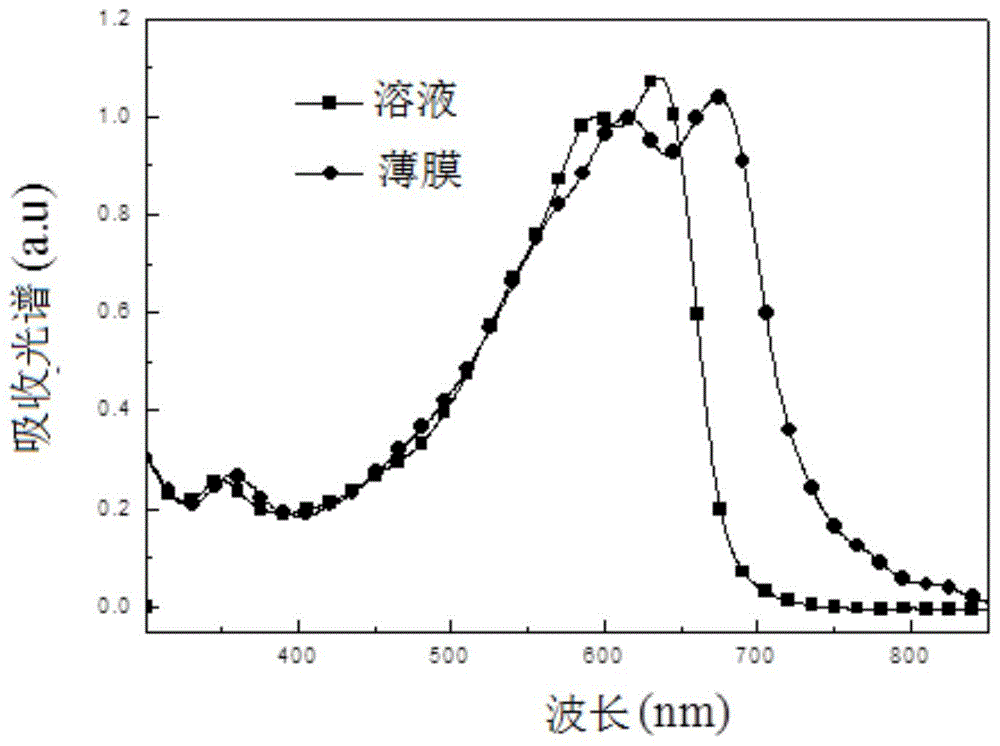
图1为本发明苯并二噻吩和吡嗪共聚物的吸收光谱。
图2为本发明苯并二噻吩和吡嗪共聚物的循环伏安曲线。
图3为本发明苯并二噻吩和吡嗪共聚物的光电转换效率图。
具体实施方式
实施例1
4,8-二异辛氧基-苯并(1,2-b;4,5-b′)-二噻吩-2,5-二异辛氧基-3,6-双(呋喃-2-亚甲基)吡嗪(p1)的制备。
①化合物1的合成
将1,4-二乙酰基哌嗪-2,5-二酮(1.19g,6mmol)与5-溴-2呋喃甲醛(2.63g,15mmol)放置在50ml的单口圆底烧瓶中,然后加入28mldmf,氮气保护下,加热搅拌,升温至120℃,通过注射器加入三乙胺3.32ml,完毕后,反应体系由无色立马变为红色,继续反应12小时,反应完成后,冷却至室温,产生黄色沉淀,过滤收集沉淀,用丙酮洗涤,收集产物,得到目标产物(2.16g,产率:84%)不需要进一步纯化直接进行下一步反应。
化合物1的核磁共振谱、质谱如下所示:
1hnmr(400mhz,d-dmso,ppm):δ=9.83(s,2h),7.23(d,2h),6.74(s,2h),6.45(d,2h).
gc-ms:m/z=428。
②化合物2的合成
将上一步反应得到的3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮(1.4g,3.26mmol)、碳酸钾(2.25g,16.3mmol)和溴代异辛烷(2.51g,13mmol)混合到30mldmf中,氮气保护下,升温至120℃,搅拌反应2h,反应完毕后,冷却至室温,过滤掉固体,收集滤液,用二氯甲烷萃取,水洗除掉多余的dmf,粗产物使用柱层析的方法纯化,石油醚:二氯甲烷=5:1为淋洗液,得到橙色固体2,5-二异辛氧基-3,6-双((5-溴呋喃-2-)亚甲基)吡嗪(1.1g,产率:53%)。
化合物2的核磁共振谱、质谱如下所示:
1hnmr(400mhz,cdcl3,ppm):δ=7.20(d,2h),6.76(s,2h),6.46(d,2h),4.27(t,4h),1.80(m,2h),1.53-1.36(m,16h),0.98-0.89(m,12h).
gc-ms:m/z=652.
③聚合物p1的合成
氮气保护下,将等摩尔量的化合物2和2,6-二(三甲基锡)-4,8-二(2-乙基己氧基)-苯并(1,2-b;4,5-b’)二噻吩(0.1mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(10mg),110℃下搅拌反应24小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物经过甲醇、正己烷和三氯甲烷一次抽提,得到蓝色固体p1(65mg,产率69%);其中聚合物p1中r基团如下所示:
聚合物p1的凝胶渗透色谱分析如下所示:
mn=14,200,mw=27,000,pdi=1.9。
实施例24,8-二异辛氧基-苯并(1,2-b;4,5-b′)-二噻吩-2,5-二辛氧基-3,6-双(呋喃-2-亚甲基)吡嗪(p2)的制备
化合物2的合成方法与实施例1中化合物2的合成方法相同,溴代烷烃采用溴代正辛烷,具体步骤如下:
①化合物1的合成
将1,4-二乙酰基哌嗪-2,5-二酮(1.19g,6mmol)与5-溴-2呋喃甲醛(2.63g,15mmol)放置在50ml的单口圆底烧瓶中,然后加入28mldmf,氮气保护下,加热搅拌,升温至120℃,通过注射器加入三乙胺3.32ml,完毕后,反应体系由无色立马变为红色,继续反应12h,反应完成后,冷却至室温,产生黄色沉淀,过滤收集沉淀,用丙酮洗涤,收集产物,得到目标产物(2.16g,产率:84%)不需要进一步纯化直接进行下一步反应。
化合物1的核磁共振谱、质谱如下所示:
1hnmr(400mhz,d-dmso,ppm):δ=9.83(s,2h),7.23(d,2h),6.74(s,2h),6.45(d,2h).
gc-ms:m/z=428。
②化合物2的合成
将上一步反应得到的3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮(1.4g,3.26mmol)、碳酸钾(2.25g,16.3mmol)和溴代辛烷(2.51g,13mmol)混合到30mldmf中,氮气保护下,升温至120℃,搅拌反应2h,反应完毕后,冷却至室温,过滤掉固体,收集滤液,用二氯甲烷萃取,水洗除掉多余的dmf,粗产物使用柱层析的方法纯化,石油醚:二氯甲烷=5:1为淋洗液,得到橙色固体2,5-二辛氧基-3,6-双((5-溴呋喃-2-)亚甲基)吡嗪(0.79g,产率:37%)。
化合物2的核磁共振谱、质谱如下所示:
1hnmr(400mhz,cdcl3,ppm):δ=7.19(d,2h),6.77(s,2h),6.48(d,2h),4.26(t,4h),1.55-1.38(m,26h),0.98-0.89(m,6h).
gc-ms:m/z=652。
③聚合物p2的合成
氮气保护下,将等摩尔量的化合物2和2,6-二(三甲基锡)-4,8-二(2-乙基己氧基)-苯并(1,2-b;4,5-b’)二噻吩(0.1mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(10mg),110℃下搅拌反应24小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物经过甲醇、正己烷和三氯甲烷一次抽提,得到蓝色固体p2(81mg,产率86%);其中聚合物p2中r基团如下所示:
聚合物p2的凝胶渗透色谱分析如下所示:
mn=13,700,mw=28,400,pdi=2.1。
实施例34,8-二异辛氧基-苯并(1,2-b;4,5-b′)-二噻吩-2,5-二(2-辛基十二烷氧基)-3,6-双(呋喃-2-亚甲基)吡嗪(p3)的制备
化合物2的合成方法与实施例1中化合物2的合成方法相同,溴代烷烃采用溴代2-辛基-十二烷,具体步骤如下:
①化合物1的合成
将1,4-二乙酰基哌嗪-2,5-二酮(1.19g,6mmol)与5-溴-2呋喃甲醛(2.63g,15mmol)放置在50ml的单口圆底烧瓶中,然后加入28mldmf,氮气保护下,加热搅拌,升温至120℃,通过注射器加入三乙胺3.32ml,完毕后,反应体系由无色立马变为红色,继续反应12h,反应完成后,冷却至室温,产生黄色沉淀,过滤收集沉淀,用丙酮洗涤,收集产物,得到目标产物(2.16g,产率:84%)不需要进一步纯化直接进行下一步反应。
化合物1的核磁共振谱、质谱如下所示:
1hnmr(400mhz,d-dmso,ppm):δ=9.83(s,2h),7.23(d,2h),6.74(s,2h),6.45(d,2h).
gc-ms:m/z=428。
②化合物2的合成
将上一步反应得到的3,6-双((5-溴呋喃-2-)亚甲基)哌嗪-2,5-二酮(1.4g,3.26mmol)、碳酸钾(2.25g,16.3mmol)和溴代2-辛基-十二烷(4.69g,13mmol)混合到30mldmf中,氮气保护下,升温至120℃,搅拌反应2小时,反应完毕后,冷却至室温,过滤掉固体,收集滤液,用二氯甲烷萃取,水洗除掉多余的dmf,粗产物使用柱层析的方法纯化,石油醚:二氯甲烷=5:1为淋洗液,得到橙色固体2,5-二(2-辛基-十二烷氧基)-3,6-双((5-溴呋喃-2-)亚甲基)吡嗪(0.81g,产率:25%)。
化合物2的核磁共振谱、质谱如下所示:
1hnmr(400mhz,cdcl3,ppm):δ=7.25(d,2h),6.79(s,2h),6.49(d,2h),4.28(t,4h),1.85(m,2h),1.57-1.34(m,64h),0.97-0.88(m,12h).
gc-ms:m/z=652.
③聚合物p3的合成
氮气保护下,将等摩尔量的化合物2和2,6-二(三甲基锡)-4,8-二(2-乙基己氧基)-苯并(1,2-b;4,5-b’)二噻吩(0.1mmol,购买于苏州纳凯科技有限公司)加入到10ml无水甲苯中,再加入pd(pph3)4(10mg),110℃下搅拌反应24小时后,冷却至室温,倒入100ml甲醇中沉析,过滤,粗产物经过甲醇、正己烷和三氯甲烷一次抽提,得到蓝色固体p3(99mg,产率77%);其中聚合物p3中r基团如下所示:
聚合物p3的凝胶渗透色谱分析如下所示:
mn=23000,mw=52500,pdi=2.3。
实施例4聚合物太阳能电池的制备
本发明以苯并二噻吩和吡嗪共聚物作为工作介质,制备太阳能电池的方法是:将上述苯并二噻吩和吡嗪共聚物材料与适量的pc61bm或其它的可以作为电子受体的物质混合,加入适量的溶剂溶解,通过常规的旋涂在ito(氧化铟锡)导电玻璃上制备出一层半透明的薄膜,然后通过真空蒸镀的方式在光伏活性层上制备金属电极。
具体步骤为:1.5mg的聚合物p1与3.0mg的pc61bm混合,加入0.3ml氯苯溶解,通过旋涂方式在经pedot:pss修饰过的导电玻璃上制备出一层约110nm厚的薄膜,然后通过真空蒸镀的方式用铝/氟化锂在光伏活性层上制备金属电极。其聚合物太阳能电池器件性能表现为:
短路电流=9.6ma/cm2;开路电压=0.80v;填充因子=61%;
模拟太阳光(a.m.1.5,100mw/cm2)下的能量转换效率=4.7%。
实施例5聚合物太阳能电池的制备
1.5mg的聚合物p2与3.0mg的pc61bm混合,加入0.3ml氯苯溶解,通过旋涂方式在经pedot:pss修饰过的导电玻璃上制备出一层约110nm厚的薄膜,然后通过真空蒸镀的方式用铝/氟化锂在光伏活性层上制备金属电极。其聚合物太阳能电池器件性能表现为:
短路电流=8.6ma/cm2;开路电压=0.80v;填充因子=59%;
模拟太阳光(a.m.1.5,100mw/cm2)下的能量转换效率=4.1%。
实施例6聚合物太阳能电池的制备
1.5mg的聚合物p3与3.0mg的pc61bm混合,加入0.3ml氯苯溶解,通过旋涂方式在经pedot:pss修饰过的导电玻璃上制备出一层约110nm厚的薄膜,然后通过真空蒸镀的方式用铝/氟化锂在光伏活性层上制备金属电极。其聚合物太阳能电池器件性能表现为:
短路电流=6.7ma/cm2;开路电压=0.82v;填充因子=55%;
模拟太阳光(a.m.1.5,100mw/cm2)下的能量转换效率=3.0%。
实施例7
以聚合物p1为例,对其进行吸收光谱分析、光伏性能分析。
①聚合物p1的光谱分析
聚合物p1在三氯甲烷溶液和薄膜状态下的吸收光谱如图1所示,在实施例7所制备的薄膜状态下,聚合物p1在300-800nm范围内对光有明显吸收,光学帯隙为1.55ev,说明聚合物p1是窄帯隙光伏材料,可以吸收更多的太阳光,获得高的短路电流。较窄的能隙主要归因于苯并二噻吩引入到给-受型聚合物中,形成了分子内电荷转移态,从而降低带隙,达到更宽的吸光范围。这类aqm类聚合物光伏材料在太阳能电池的制备中有着广阔的应用前景。
②聚合物p1的电化学性能
在电化学中,循环伏安法通常被用来测定物质的电化学能级,图2是聚合物p1在0.1mol/l的bu4nbf4/ch3cn溶液中测得的循环伏安曲线,可以从氧化曲线部分看出聚合物p1的起始氧化电位是0.81v,对应的homo能级为-5.11ev,从还原曲线部分可以得到聚合物p1的起始还原电位是-0.60v,对应的lumo能级为-3.70ev,电化学能隙为1.41ev,参见表1。低的homo能级表明聚合物p1有良好的空气稳定性,非常适合制备长使用寿命的太阳能电池器件。
表1聚合物p1的光学与电化学结果
③聚合物p1的光伏性能分析
聚合物p1的光伏性能如图3所示,结果表明聚合物p1具有良好的光伏性能。如聚合物p1与pc61bm=1:1共混时,短路电流=9.6ma/cm2;开路电压=0.80v;填充因子=61%;模拟太阳光(a.m.1.5,100mw/cm2)下的能量转换效率=4.7%。我们相信太阳能电池的转换效率可以通过器件条件的优化得到进一步提升。
由实施例1-7可知,本发明合成的路线简单,成本低,且合成方法具有普适性,可以较好的推广应用到其他的aqm类材料的合成;本发明的aqm类聚合物光伏材料具有强推拉电子作用而产生共振能量传递,有望获得更宽的紫外-可见吸收光谱;本发明的aqm类聚合物光伏材料具有较低的homo能级,对氧的稳定性高,有利于制备性能更加稳定的太阳能电池器件;本发明用aqm类有机小分子光伏材料为电子给体材料,应用于有机小分子太阳能电池获得了较高的能量转换效率(pce=4.7%),具有良好的应用前景。
综上所述,本发明合成了一种含有不同烷氧基侧链的aqm有机电子受体单元,通过stille偶联的方法,将aqm受体单元通过碳-碳单键与另一个电子给体单元bdt相连接,得到aqm类聚合物光伏材料。它们在常见的有机溶剂(如二氯甲烷、三氯甲烷、四氢呋喃等)中有良好的溶解性,可以用溶液方法制备高质量的薄膜。同时,这些聚合物光伏材料具有宽的可见光区吸收,合适的homo以及lumo能级和相对较窄的带隙。以此类聚合物为电子给体、pc61bm或有机物电子受体为电子受体制备了有机太阳能电池,其最高能量转换效率可达到4.7%,具有良好的光电转换效率。
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 6,7,8,9‑四氢‑5H‑苯并[7]轮烯‑2‑烷基胺类化合物及其用途的制造方法与工艺
- 用于PHOLED的具有氮杂‑二苯并噻吩或氮杂‑二苯并呋喃核的新材料的制造方法与工艺
- 多孔ZSM‑5沸石与γ‑Al2O3复合材料的合成及制备加氢脱硫催化剂的制造方法与工艺
- 一种含有氟噻虫砜和五氟虫腙的杀虫组合物的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 苯并噻二唑胺的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺