有机电致发光材料和装置的制作方法
相关申请的交叉引用
本申请是2014年1月8日提交的美国专利申请第61/924,752号的非临时申请,所述专利申请的全部内容以引用的方式并入本文中。
联合研究协议的各方
所要求的本发明是由达成联合大学公司研究协议的以下各方中的一或多者,以以下各方中的一或多者的名义和/或结合以下各方中的一或多者而作出:密歇根大学董事会、普林斯顿大学、南加州大学和环宇显示器公司(universaldisplaycorporation)。所述协议在作出所要求的本发明的日期当天和之前就生效,并且所要求的本发明是因在所述协议的范围内进行的活动而作出。
本发明涉及适用作发射体的化合物;和包括其的装置,例如有机发光二极管。
背景技术:
出于若干原因,利用有机材料的光学电子装置变得越来越受欢迎。用以制造这样的装置的材料中的许多材料相对便宜,因此有机光学电子装置具有获得相对于无机装置的成本优势的潜力。另外,有机材料的固有性质(例如其柔性)可以使其非常适合具体应用,例如在柔性衬底上的制造。有机光学电子装置的实例包括有机发光装置(oled)、有机光电晶体管、有机光伏打电池和有机光检测器。对于oled,有机材料可以具有相对于常规材料的性能优点。举例来说,有机发射层发射光的波长通常可以容易地用适当的掺杂剂来调整。
oled利用有机薄膜,其在电压施加于装置上时发射光。oled正变为用于例如平板显示器、照明和背光应用中的越来越引人注目的技术。美国专利第5,844,363号、第6,303,238号和第5,707,745号中描述若干oled材料和配置,所述专利以全文引用的方式并入本文中。
磷光性发射分子的一个应用是全色显示器。用于这种显示器的行业标准需要适于发射具体色彩(称为“饱和”色彩)的像素。具体地说,这些标准需要饱和的红色、绿色和蓝色像素。可以使用本领域中所熟知的cie坐标来测量色彩。
绿色发射分子的一个实例是三(2-苯基吡啶)铱、表示为ir(ppy)3,其具有以下结构:
在此图和本文后面的图中,将从氮到金属(此处,ir)的配价键描绘为直线。
如本文所用,术语“有机”包括聚合材料以及小分子有机材料,其可以用以制造有机光学电子装置。“小分子”是指不是聚合物的任何有机材料,并且“小分子”可能实际上相当大。在一些情况下,小分子可以包括重复单元。举例来说,使用长链烷基作为取代基不会将分子从“小分子”类别中去除。小分子还可以并入到聚合物中,例如作为聚合物主链上的侧基或作为主链的一部分。小分子还可以充当树枝状聚合物的核心部分,所述树枝状聚合物由建立在核心部分上的一系列化学壳层组成。树枝状聚合物的核心部分可以是荧光或磷光小分子发射体。树枝状聚合物可以是“小分子”,并且据信当前在oled领域中使用的所有树枝状聚合物都是小分子。
如本文所用,“顶部”意指离衬底最远,而“底部”意指离衬底最近。在将第一层描述为“安置”在第二层“上”的情况下,第一层被安置为距衬底较远。除非规定第一层“与”第二层“接触”,否则第一与第二层之间可以存在其它层。举例来说,即使阴极和阳极之间存在各种有机层,仍可以将阴极描述为“安置在”阳极“上”。
如本文所用,“溶液可处理”意指能够以溶液或悬浮液的形式在液体介质中溶解、分散或输送和/或从液体介质沉积。
当据信配位体直接促成发射材料的光敏性质时,配位体可以称为“光敏性的”。当据信配位体并不促成发射材料的光敏性质时,配位体可以称为“辅助性的”,但辅助性的配位体可以改变光敏性的配位体的性质。
如本文所用,并且如本领域技术人员一般将理解,如果第一能级较接近真空能级,那么第一“最高占用分子轨道”(homo)或“最低未占用分子轨道”(lumo)能级“大于”或“高于”第二homo或lumo能级。由于将电离电位(ip)测量为相对于真空能级的负能量,因此较高homo能级对应于具有较小绝对值的ip(负得较少的ip)。类似地,较高lumo能级对应于具有较小绝对值的电子亲和性(ea)(负得较少的ea)。在常规能级图上,真空能级在顶部,材料的lumo能级高于同一材料的homo能级。“较高”homo或lumo能级表现为比“较低”homo或lumo能级靠近这个图的顶部。
如本文所用,并且如本领域技术人员一般将理解,如果第一功函数具有较高绝对值,那么第一功函数“大于”或“高于”第二功函数。因为通常将功函数测量为相对于真空能级的负数,因此这意指“较高”功函数负得较多。在常规能级图上,真空能级在顶部,将“较高”功函数说明为在向下方向上距真空能级较远。因此,homo和lumo能级的定义遵循与功函数不同的惯例。
可以在以全文引用的方式并入本文中的美国专利第7,279,704号中找到关于oled和上文所述的定义的更多细节。
技术实现要素:
根据一个实施例,公开一种化合物,其包含式i的配位体la:
以及含有所述式i化合物的装置和调配物。在具有式i的配位体la的所述化合物中:
其中r1表示单取代基或二取代基或无取代基;
其中r2表示单取代基、二取代基、三取代基或四取代基或无取代基;
其中r选自由以下组成的群组:氢、氘、烷基、环烷基和其组合;
其中r1和r2各自独立地选自由以下组成的群组:氢、氘、烷基、环烷基、芳基和其组合;
其中r2的任何相邻取代基任选地接合以形成稠合环;
其中所述配位体la配位到金属m;并且
其中所述配位体la任选地与其它配位体键联以构成三齿、四齿、五齿或六齿配位体。
根据另一实施例,还提供一种第一装置,其包含第一有机发光装置。所述第一有机发光装置可以包括阳极、阴极和安置在所述阳极与所述阴极之间的有机层。所述有机层可以包括具有具备式i结构的配位体la的化合物。所述第一装置可以是消费型产品、有机发光装置和/或照明面板。
还描述调配物,其含有具有具备式i结构的配位体la的化合物。
附图说明
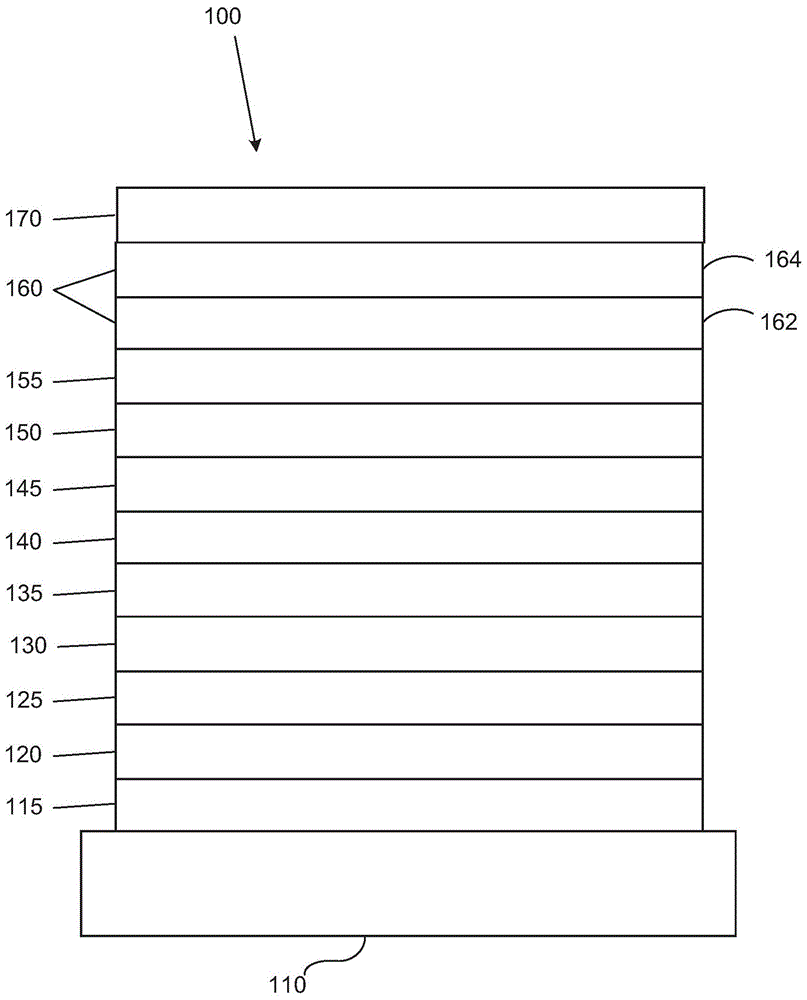
图1展示了有机发光装置。
图2展示了不具有单独电子输送层的倒转的有机发光装置。
图3展示了如本文中所公开的式i的配位体la。
图4展示了化合物1-3于2-甲基四氢呋喃溶剂中的室温发射光谱。
图5展示了化合物1-3于2-甲基四氢呋喃溶剂中的77k发射光谱。
图6展示了以5重量%掺杂到主体1中的化合物1-4在石英衬底上的薄膜发射光谱。
图7展示了化合物1、5和11的77k发射光谱。在2-甲基四氢呋喃溶剂中测量发射光谱。
图8展示了化合物1、5和11的室温发射光谱。在2-甲基四氢呋喃溶剂中测量发射光谱。
图9展示了以5重量%掺杂于主体1中的化合物1、5和11在石英衬底上的发射光谱。
图10展示了比较实例1在室温(rt)和77k下于2-甲基四氢呋喃溶剂中以及在5重量%掺杂下在聚甲基丙烯酸甲酯(pmma)基质中的光谱数据。
具体实施方式
一般来说,oled包含安置在阳极与阴极之间并且电连接到阳极和阴极的至少一个有机层。当施加电流时,阳极注入空穴并且阴极注入电子到有机层中。所注入的空穴和电子各自朝带相反电荷的电极迁移。当电子和空穴局限于同一分子上时,形成“激子”,其为具有激发能量状态的局部化电子-空穴对。当激子经由光电发射机制弛豫时,发射光。在一些情况下,激子可以局限于激元或激态复合物上。非辐射机制(例如热弛豫)也可能发生,但通常被视为不合需要的。
最初的oled使用从单态发射光(“荧光”)的发射分子,如例如美国专利第4,769,292号中所公开,所述专利以全文引用的方式并入。荧光发射通常在小于10纳秒的时间范围中发生。
最近,已经论证了具有从三重态发射光(“磷光”)的发射材料的oled。巴尔多(baldo)等人的“从有机电致发光装置的高效磷光发射(highlyefficientphosphorescentemissionfromorganicelectroluminescentdevices)”,自然(nature),第395卷,第151-154页,1998;(“巴尔多-i”)和巴尔多等人的“基于电致磷光的非常高效绿色有机发光装置(veryhigh-efficiencygreenorganiclight-emittingdevicesbasedonelectrophosphorescence)”,应用物理学快报(appl.phys.lett.),第75卷,第3期,第4-6页(1999)(“巴尔多-ii”),其以全文引用的方式并入。以引用的方式并入的美国专利第7,279,704号第5-6列中更详细地描述磷光。
图1展示了有机发光装置100。图不一定按比例绘制。装置100可以包括衬底110、阳极115、空穴注入层120、空穴输送层125、电子阻挡层130、发射层135、空穴阻挡层140、电子输送层145、电子注入层150、保护层155、阴极160和屏障层170。阴极160是具有第一导电层162和第二导电层164的复合阴极。装置100可以通过依序沉积所描述的层来制造。在以引用的方式并入的us7,279,704的第6-10列中更详细地描述这些各种层以及实例材料的性质和功能。
这些层中的每一者有更多实例。举例来说,以全文引用的方式并入的美国专利第5,844,363号中公开柔性并且透明的衬底-阳极组合。经p掺杂的空穴输送层的实例是以50:1的摩尔比率掺杂有f4-tcnq的m-mtdata,如以全文引用的方式并入的美国专利申请公开案第2003/0230980号中所公开。以全文引用的方式并入的颁予汤普森(thompson)等人的美国专利第6,303,238号中公开发射材料和主体材料的实例。经n掺杂的电子输送层的实例是以1:1的摩尔比率掺杂有li的bphen,如以全文引用的方式并入的美国专利申请公开案第2003/0230980号中所公开。以全文引用的方式并入的美国专利第5,703,436号和第5,707,745号公开了阴极的实例,其包括具有例如mg:ag等金属薄层与上覆的透明、导电、经溅镀沉积的ito层的复合阴极。以全文引用的方式并入的美国专利第6,097,147号和美国专利申请公开案第2003/0230980号中更详细地描述阻挡层的原理和使用。以全文引用的方式并入的美国专利申请公开案第2004/0174116号中提供注入层的实例。可以在以全文引用的方式并入的美国专利申请公开案第2004/0174116号中找到保护层的描述。
图2展示了倒转的oled200。所述装置包括衬底210、阴极215、发射层220、空穴输送层225和阳极230。装置200可以通过依序沉积所描述的层来制造。因为最常见oled配置具有安置在阳极上的阴极,并且装置200具有安置在阳极230下的阴极215,所以装置200可以称为“倒转”oled。在装置200的对应层中,可以使用与关于装置100所描述的材料类似的材料。图2提供了可以如何从装置100的结构省略一些层的一个实例。
图1和2中所说明的简单分层结构是作为非限制实例而提供,并且应理解,可以结合各种各样的其它结构使用本发明的实施例。所描述的具体材料和结构本质上是示范性的,并且可以使用其它材料和结构。可以基于设计、性能和成本因素,通过以不同方式组合所描述的各个层来实现功能性oled,或可以完全省略若干层。还可以包括未具体描述的其它层。可以使用不同于具体描述的材料的材料。尽管本文所提供的实例中的许多实例将各种层描述为包含单一材料,但应理解,可以使用材料的组合(例如主体与掺杂剂的混合物)或更一般来说,混合物。并且,所述层可以具有各种子层。本文中给予各个层的名称不意欲具有严格限制性。举例来说,在装置200中,空穴输送层225输送空穴并且将空穴注入到发射层220中,并且可以被描述为空穴输送层或空穴注入层。在一个实施例中,可以将oled描述为具有安置在阴极与阳极之间的“有机层”。此有机层可以包含单个层,或可以进一步包含如例如关于图1和2所描述的不同有机材料的多个层。
还可以使用未具体描述的结构和材料,例如包含聚合材料的oled(pled),例如以全文引用的方式并入的颁予弗兰德(friend)等人的美国专利第5,247,190号中所公开。作为另一实例,可以使用具有单个有机层的oled。oled可以堆叠,例如如以全文引用的方式并入的颁予福利斯特(forrest)等人的第5,707,745号中所描述。oled结构可以脱离图1和2中所说明的简单分层结构。举例来说,衬底可以包括有角度的反射表面以改进出耦(out-coupling),例如如颁予福利斯特等人的美国专利第6,091,195号中所述的台式结构,和/或如颁予布利维克(bulovic)等人的美国专利第5,834,893号中所述的凹点结构,所述专利以全文引用的方式并入。
除非另外规定,否则可以通过任何合适方法来沉积各种实施例的层中的任一者。对于有机层,优选方法包括热蒸发、喷墨(例如以全文引用的方式并入的美国专利第6,013,982号和第6,087,196号中所述)、有机气相沉积(ovpd)(例如以全文引用的方式并入的颁予福利斯特等人的美国专利第6,337,102号中所述)和通过有机蒸气喷射印刷(ovjp)的沉积(例如以全文引用的方式并入的美国专利第7,431,968号中所述)。其它合适沉积方法包括旋涂和其它基于溶液的工艺。基于溶液的工艺优选在氮或惰性气氛中进行。对于其它层,优选方法包括热蒸发。优选的图案化方法包括通过掩模的沉积、冷焊(例如以全文引用的方式并入的美国专利第6,294,398号和第6,468,819号中所述)和与例如喷墨和ovjd等沉积方法中的一些方法相关联的图案化。还可以使用其它方法。可以修改待沉积的材料,以使其与具体沉积方法相容。举例来说,可以在小分子中使用具支链或无支链并且优选含有至少3个碳的例如烷基和芳基等取代基,来增强其经受溶液处理的能力。可以使用具有20个或更多个碳的取代基,并且3-20个碳是优选范围。具有不对称结构的材料可以比具有对称结构的材料具有更好的溶液可处理性,因为不对称材料可以具有更低的再结晶倾向性。可以使用树枝状聚合物取代基来增强小分子经受溶液处理的能力。
根据本发明实施例制造的装置可以进一步任选地包含屏障层。屏障层的一个用途是保护电极和有机层免于因暴露于环境中的有害物质(包括水分、蒸气和/或气体等)而受损。屏障层可以沉积在衬底、电极上,沉积在衬底、电极下或沉积在衬底、电极旁,或沉积在装置的任何其它部分(包括边缘)上。屏障层可以包含单个层或多个层。屏障层可以通过各种已知的化学气相沉积技术形成,并且可以包括具有单一相的组合物以及具有多个相的组合物。任何合适材料或材料组合都可以用于屏障层。屏障层可以并入有无机化合物或有机化合物或两者。优选的屏障层包含聚合材料与非聚合材料的混合物,如以全文引用的方式并入本文中的美国专利第7,968,146号、pct专利申请第pct/us2007/023098号和第pct/us2009/042829号中所述。为了被视为“混合物”,构成屏障层的前述聚合材料和非聚合材料应在相同反应条件下和/或同时沉积。聚合材料对非聚合材料的重量比率可以在95:5到5:95的范围内。聚合材料和非聚合材料可以由同一前体材料产生。在一个实例中,聚合材料与非聚合材料的混合物基本上由聚合硅和无机硅组成。
根据本发明的实施例而制造的装置可以并入到各种各样的消费型产品中,包括平板显示器、计算机监视器、医疗监视器、电视机、告示牌、用于内部或外部照明和/或发信号的灯、平视显示器、全透明显示器、柔性显示器、激光印刷机、电话、手机、个人数字助理(pda)、膝上型计算机、数码相机、摄录像机、取景器、微显示器、3-d显示器、运载工具、大面积墙壁、剧院或体育馆屏幕,或指示牌。可以使用各种控制机制来控制根据本发明制造的装置,包括无源矩阵和有源矩阵。打算将许多所述装置中用于对人类来说舒适的温度范围中,例如18摄氏度到30摄氏度,并且更优选在室温下(20-25摄氏度),但可以在此温度范围外(例如-40摄氏度到+80摄氏度)使用。
本文所述的材料和结构可以应用于不同于oled的装置中。举例来说,例如有机太阳能电池和有机光检测器等其它光电子装置可以使用所述材料和结构。更一般来说,例如有机晶体管等有机装置可以使用所述材料和结构。
如本文所用,术语“卤基”或“卤素”包括氟、氯、溴和碘。
如本文所用,术语“烷基”涵盖直链和支链烷基。优选的烷基是含有一到十五个碳原子的烷基,并且包括甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基等。另外,烷基可以是任选地被取代的。
如本文所用,术语“环烷基”涵盖环状烷基。优选的环烷基是含有3到7个碳原子的环烷基,并且包括环丙基、环戊基、环己基等。另外,环烷基可以任选地被取代。
如本文所用,术语“烯基”涵盖直链和支链烯基。优选的烯基是含有二到十五个碳原子的烯基。另外,烯基可以是任选地被取代的。
如本文所用,术语“炔基”涵盖直链和支链炔基。优选的炔基是含有二到十五个碳原子的烷基。另外,炔基可以是任选地被取代的。
如本文所用,术语“芳烷基”或“芳基烷基”可互换地使用并且涵盖具有芳香族基团作为取代基的烷基。另外,芳烷基可以是任选地被取代的。
如本文所用,术语“杂环基”涵盖芳香族和非芳香族环状自由基。杂芳香族环状自由基还意指杂芳基。优选的杂非芳香族环基是含有包括至少一个杂原子的3或7个环原子的杂环基,并且包括环胺,例如吗啉基、哌啶基、吡咯烷基等,和环醚,例如四氢呋喃、四氢吡喃等。另外,杂环基可以是任选地被取代的。
如本文所用,术语“芳基”或“芳香族基团”涵盖单环基团和多环系统。多环可以具有其中两个碳为两个邻接环(所述环是“稠合的”)共用的两个或更多个环,其中所述环中的至少一者是芳香族的,例如其它环可以是环烷基、环烯基、芳基、杂环和/或杂芳基。另外,芳基可以是任选地被取代的。
如本文所用,术语“杂芳基”涵盖可以包括一到三个杂原子的单环杂芳香族基团,例如吡咯、呋喃、噻吩、咪唑、噁唑、噻唑、三唑、吡唑、吡啶、吡嗪和嘧啶等。术语杂芳基还包括具有其中两个原子为两个邻接环(所述环是“稠合的”)共用的两个或更多个环的多环杂芳香族系统,其中所述环中的至少一者是杂芳基,例如其它环可以是环烷基、环烯基、芳基、杂环和/或杂芳基。另外,杂芳基可以是任选地被取代的。
烷基、环烷基、烯基、炔基、芳烷基、杂环基、芳基和杂芳基可以任选地被一或多个选自由以下组成的群组的取代基取代:氢、氘、卤素、烷基、环烷基、杂烷基、芳烷基、烷氧基、芳氧基、氨基、环氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸基、醚基、酯基、腈基、异腈基、硫基、亚磺酰基、磺酰基、膦基和其组合。
如本文所用,“被取代的”表示,不是h的取代基键结到相关位置,例如碳。因此,举例来说,在r1被单取代时,则一个r1必须不是h。类似地,在r1被二取代时,则两个r1必须不是h。类似地,在r1未被取代时,r1对于所有可用位置来说都是氢。
本文所述的片段(即氮杂-二苯并呋喃、氮杂-二苯并噻吩等)中的“氮杂”名称意指各别片段中的一或多个c-h基团可以被氮原子置换,例如并且无任何限制性地,氮杂三亚苯涵盖二苯并[f,h]喹喔啉和二苯并[f,h]喹啉。本领域的普通技术人员可以容易地预想上文所述的氮杂-衍生物的其它氮类似物,并且所有这些类似物都旨在由如本文中阐述的术语涵盖。
应理解,当将分子片段描述为取代基或另外连接到另一部分时,其名称可以如同其是片段(例如萘基、二苯并呋喃基)一般或如同其是整个分子(例如萘、二苯并呋喃)一般书写。如本文所用,这些不同的命名取代基或连接的片段的方式被视为等效的。
根据一个实施例,公开一种化合物,其包括式i的配位体la:
在式i的配位体la中:
r1表示单取代基或二取代基或无取代基;
r2表示单取代基、二取代基、三取代基或四取代基或无取代基;
r选自由以下组成的群组:氢、氘、烷基、环烷基和其组合;
r1和r2各自独立地选自由以下组成的群组:氢、氘、烷基、环烷基、芳基和其组合;
其中r2的任何相邻取代基任选地接合以形成稠合环;
所述配位体la配位到金属m;并且
所述配位体la任选地与其它配位体键联以构成三齿、四齿、五齿或六齿配位体。
在一些实施例中,r1和r2中的至少一者是芳基,其可以进一步被烷基取代。在一些实施例中,r1包括至少一个芳基,其可以进一步被烷基取代。在一些实施例中,r1包括恰好一个芳基,其可以进一步被烷基取代。在一些实施例中,r2包括至少一个芳基,其可以进一步被烷基取代。在一些实施例中,r2包括恰好一个芳基,其可以进一步被烷基取代。
在一些实施例中,r是氢。在一些实施例中,r是烷基。
在一些实施例中,m选自由以下组成的群组:ir、rh、re、ru、os、pt、au和cu。在一些实施例中,m是ir。
在一些实施例中,la是双齿的。换句话说,la是恰好双齿的,并且不与其它配位体键联而形成三齿或三齿以上配位体。
在一些实施例中,la选自由以下组成的群组:
在一些实施例中,化合物具有式m(la)m(lb)n,其具有以下结构:
在式ii化合物中:
lb是与la不同的配位体;
m是1到可以配位到所述金属m的配位体的最大数目的整数;并且
m+n是可以配位到所述金属m的配位体的所述最大数目。
在具有式ii结构的一些实施例中,m是1或2;并且lb选自由以下组成的群组:
其中ra、rb、rc和rd可以表示单取代基、二取代基、三取代基或四取代基或无取代基;
其中ra、rb、rc和rd独立地选自由以下组成的群组:氢、氘、卤基、烷基、环烷基、杂烷基、芳烷基、烷氧基、芳氧基、氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸基、酯基、腈基、异腈基、硫基、亚磺酰基、磺酰基、膦基和其组合;并且
其中ra、rb、rc和rd中的两个相邻取代基任选地接合以形成稠合环或形成多齿配位体。
在一些实施例中,化合物是杂配的。在一些实施例中,化合物是均配的。在一些实施例中,化合物具有面式构型。在一些实施例中,化合物具有经式构型。
在一些实施例中,化合物具有式iii的结构:
在一些更具体实施例中,化合物选自由以下组成的群组:
根据本发明的另一方面,还提供一种第一装置。第一装置包括第一有机发光装置,所述第一有机发光装置包括阳极、阴极和安置在阳极与阴极之间的有机层。有机层可以包括主体和磷光掺杂剂。发射层可以包括包含符合式i的配位体la的化合物,和如本文中所描述的化合物的变化形式。
第一装置可以是消费型产品、有机发光装置和照明面板中的一者或一者以上。有机层可以是发射层,并且化合物在一些实施例中可以是发射掺杂剂,而化合物在其它实施例中可以是非发射掺杂剂。
有机层还可以包括主体。在一些实施例中,主体可以包括金属络合物。主体可以是含有苯并稠合噻吩或苯并稠合呋喃的三亚苯。主体中的任何取代基可以是独立地选自由以下组成的群组的非稠合取代基:cnh2n+1、ocnh2n+1、oar1、n(cnh2n+1)2、n(ar1)(ar2)、ch=ch-cnh2n+1、c≡c-cnh2n+1、ar1、ar1-ar2、cnh2n-ar1,或无取代基。在前述取代基中,n可以在1到10范围内;并且ar1和ar2可以独立地选自由以下组成的群组:苯、联苯、萘、三亚苯、咔唑和其杂芳香族类似物。
主体可以是选自由以下组成的群组的化合物:咔唑、二苯并噻吩、二苯并呋喃、二苯并硒吩、氮杂咔唑、氮杂-二苯并噻吩、氮杂-二苯并呋喃和氮杂-二苯并硒吩。主体可以包括金属络合物。主体可以是选自由以下组成的群组的特定化合物:
在本发明的另一方面,调配物包含包括符合式i的配位体la的化合物,和如本文中所描述的化合物的变化形式。调配物可以包括一或多种本文中所公开的选自由以下组成的群组的组分:溶剂、主体、空穴注入材料、空穴输送材料和电子输送层材料。
与其它材料的组合
本文描述为可用于有机发光装置中的具体层的材料可以与存在于所述装置中的多种其它材料组合使用。举例来说,本文所公开的发射掺杂剂可以与多种主体、输送层、阻挡层、注入层、电极和其它可能存在的层结合使用。下文描述或提及的材料是可以与本文所公开的化合物组合使用的材料的非限制性实例,并且本领域技术人员可以容易地查阅文献以鉴别可以组合使用的其它材料。
hil/htl:
本发明中所用的空穴注入/输送材料不受特别限制,并且可以使用任何化合物,只要化合物典型地用作空穴注入/输送材料即可。所述材料的实例包括(但不限于):酞菁或卟啉衍生物;芳香族胺衍生物;吲哚并咔唑衍生物;含有氟烃的聚合物;具有导电性掺杂剂的聚合物;导电聚合物,例如pedot/pss;衍生自例如膦酸和硅烷衍生物的化合物的自组装单体;金属氧化物衍生物,例如moox;p型半导体有机化合物,例如1,4,5,8,9,12-六氮杂三亚苯六甲腈;金属络合物,和可交联化合物。
hil或htl中所用的芳香族胺衍生物的实例包括(但不限于)以下通式结构:
ar1到ar9中的每一者选自由芳香族烃环化合物组成的群组,所述化合物例如为苯、联苯、联三苯、三亚苯、萘、蒽、萉、菲、芴、芘、苣、苝、薁;由芳香族杂环化合物组成的群组,所述化合物例如为二苯并噻吩、二苯并呋喃、二苯并硒吩、呋喃、噻吩、苯并呋喃、苯并噻吩、苯并硒吩、咔唑、吲哚并咔唑、吡啶基吲哚、吡咯并二吡啶、吡唑、咪唑、三唑、噁唑、噻唑、噁二唑、噁三唑、二噁唑、噻二唑、吡啶、哒嗪、嘧啶、吡嗪、三嗪、噁嗪、噁噻嗪、噁二嗪、吲哚、苯并咪唑、吲唑、吲哚并噁嗪、苯并噁唑、苯并异噁唑、苯并噻唑、喹啉、异喹啉、噌啉、喹唑啉、喹喔啉、萘啶、酞嗪、喋啶、二苯并哌喃、吖啶、吩嗪、吩噻嗪、吩噁嗪、苯并呋喃并吡啶、呋喃并二吡啶、苯并噻吩并吡啶、噻吩并二吡啶、苯并硒吩并吡啶和硒吩并二吡啶;和由2到10个环状结构单元组成的群组,所述结构单元为选自芳香族烃环基和芳香族杂环基的相同类型或不同类型的基团,并且直接或经由氧原子、氮原子、硫原子、硅原子、磷原子、硼原子、链结构单元和脂族环基中的至少一者彼此键结。其中每个ar进一步被选自由以下组成的群组的取代基取代:氢、氘、卤基、烷基、环烷基、杂烷基、芳烷基、烷氧基、芳氧基、氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸基、酯基、腈基、异腈基、硫基、亚磺酰基、磺酰基、膦基和其组合。
在一个方面,ar1到ar9独立地选自由以下组成的群组:
其中k是1到20的整数;x101到x108是c(包括ch)或n;z101是nar1、o或s;ar1具有以上定义的相同基团。
hil或htl中所用的金属络合物的实例包括(但不限于)以下通式:
其中met是金属,其可以具有大于40的原子量;(y101-y102)是双齿配位体,y101和y102独立地选自c、n、o、p和s;l101是辅助性配位体;k'是1到可以与金属连接的最大配位体数的整数值;并且k'+k"是可以与金属连接的最大配位体数。
在一个方面,(y101-y102)是2-苯基吡啶衍生物。在另一方面,(y101-y102)是碳烯配位体。在另一方面,met选自ir、pt、os和zn。在另一方面,金属络合物具有小于约0.6v的相对于fc+/fc对的溶液态最小氧化电位。
主体:
本发明的有机el装置的发光层优选地至少含有金属络合物作为发光材料,并且可以含有使用金属络合物作为掺杂剂材料的主体材料。主体材料的实例不受特别限制,并且可以使用任何金属络合物或有机化合物,只要主体的三重态能量大于掺杂剂的三重态能量即可。虽然下表将优选用于发射各种颜色的装置的主体材料加以分类,但可以与任何掺杂剂一起使用任何主体材料,只要三重态准则满足即可。
用作主体的金属络合物的实例优选具有以下通式:
其中met是金属;(y103-y104)是双齿配位体,y103和y104独立地选自c、n、o、p和s;l101是另一配位体;k'是1到可以与金属连接的最大配位体数的整数值;并且k'+k"是可以与金属连接的最大配位体数。
在一个方面,金属络合物是:
其中(o-n)是具有与o和n原子配位的金属的双齿配位体。
在另一方面,met选自ir和pt。在另一方面,(y103-y104)是碳烯配位体。
用作主体的有机化合物的实例选自由芳香族烃环化合物组成的群组,所述化合物例如为苯、联苯、联三苯、三亚苯、萘、蒽、萉、菲、芴、芘、苣、苝、薁;由芳香族杂环化合物组成的群组,所述化合物例如为二苯并噻吩、二苯并呋喃、二苯并硒吩、呋喃、噻吩、苯并呋喃、苯并噻吩、苯并硒吩、咔唑、吲哚并咔唑、吡啶基吲哚、吡咯并二吡啶、吡唑、咪唑、三唑、噁唑、噻唑、噁二唑、噁三唑、二噁唑、噻二唑、吡啶、哒嗪、嘧啶、吡嗪、三嗪、噁嗪、噁噻嗪、噁二嗪、吲哚、苯并咪唑、吲唑、吲哚并噁嗪、苯并噁唑、苯并异噁唑、苯并噻唑、喹啉、异喹啉、噌啉、喹唑啉、喹喔啉、萘啶、酞嗪、喋啶、二苯并哌喃、吖啶、吩嗪、吩噻嗪、吩噁嗪、苯并呋喃并吡啶、呋喃并二吡啶、苯并噻吩并吡啶、噻吩并二吡啶、苯并硒吩并吡啶和硒吩并二吡啶;和由2到10个环状结构单元组成的群组,所述结构单元为选自芳香族烃环基和芳香族杂环基的相同类型或不同类型的基团,并且直接或经由氧原子、氮原子、硫原子、硅原子、磷原子、硼原子、链结构单元和脂族环基中的至少一者彼此键结。其中每个基团进一步被选自由以下组成的群组的取代基取代:氢、氘、卤基、烷基、环烷基、杂烷基、芳烷基、烷氧基、芳氧基、氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸基、酯基、腈基、异腈基、硫基、亚磺酰基、磺酰基、膦基和其组合。
在一个方面,主体化合物在分子中含有以下基团中的至少一者:
其中r101到r107独立地选自由以下组成的群组:氢、氘、卤基、烷基、环烷基、杂烷基、芳烷基、烷氧基、芳氧基、氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸基、酯基、腈基、异腈基、硫基、亚磺酰基、磺酰基、膦基和其组合,当其是芳基或杂芳基时,其具有与上述ar类似的定义。k是0到20或1到20的整数;k'"是0到20的整数。x101到x108选自c(包括ch)或n。
z101和z102选自nr101、o或s。
hbl:
空穴阻挡层(hbl)可以用以减少离开发射层的空穴和/或激子的数目。与缺乏阻挡层的类似装置相比,这种阻挡层在装置中的存在可以产生实质上较高的效率。此外,阻挡层可以用以将发射限于oled的所要区域。
在一个方面,hbl中所用的化合物含有用作上述主体的相同分子或相同官能团。
在另一方面,hbl中所用的化合物在分子中含有以下基团中的至少一者:
其中k是1到20的整数;l101是另一配位体,k'是1到3的整数。
etl:
电子输送层(etl)可以包括能够输送电子的材料。电子输送层可以是本质的(未掺杂)或经掺杂的。掺杂可以用以增强导电性。etl材料的实例不受特别限制,并且可以使用任何金属络合物或有机化合物,只要其典型地用以输送电子即可。
在一个方面,etl中所用的化合物在分子中含有以下基团中的至少一者:
其中r101选自由以下组成的群组:氢、氘、卤基、烷基、环烷基、杂烷基、芳烷基、烷氧基、芳氧基、氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸基、酯基、腈基、异腈基、硫基、亚磺酰基、磺酰基、膦基和其组合,当其是芳基或杂芳基时,其具有与上述ar类似的定义。ar1到ar3具有与上述ar类似的定义。k是1到20的整数。x101到x108选自c(包括ch)或n。
在另一方面,etl中所用的金属络合物含有(但不限于)以下通式:
其中(o-n)或(n-n)是具有与原子o、n或n,n配位的金属的双齿配位体;l101是另一配位体;k'是1到可以与金属连接的最大配位体数的整数值。
在oled装置的每个层中所用的任何上述化合物中,氢原子可以部分或完全氘化。因此,任何具体列出的取代基(例如(但不限于)甲基、苯基、吡啶基等)涵盖其非氘化、部分氘化和完全氘化形式。类似地,取代基类别(例如(但不限于)烷基、芳基、环烷基、杂芳基等)也涵盖其非氘化、部分氘化和完全氘化形式。
除本文所公开的材料外和/或与本文所公开的材料组合,oled中还可以使用许多空穴注入材料、空穴输送材料、主体材料、掺杂剂材料、激子/空穴阻挡层材料、电子输送材料和电子注入材料。可以与本文所公开的材料组合用于oled中的材料的非限制性实例在下表a中列出。表a列出材料的非限制性类别、每种类别的化合物的非限制性实例和公开所述材料的参考文献。
表a
实验
已知具有氟取代基的蓝色磷光化合物,如双[2-(4,6-二氟苯基)吡啶根基-c2,n](吡啶甲酰合)铱(iii)(firpic)或三[2-(4,6-二氟苯基)吡啶根基-c2,n]铱(iii)在电致发光装置中是不稳定的。因此,氟取代基是蓝色发射体上的不合需要的特征。此外,针对本文中所描述的化合物的研究显示,非阻挡三(吡啶基吡啶)铱化合物当与烷基阻挡类似物相比时在室温溶液和固态薄膜中合乎需要地蓝移。因此,相信蓝移可以归因于吡啶基-吡啶配位体的较小空间扭转,导致较小的激发态失真。
已经得知,其中未配位的氮对位取代到金属的具有环金属化吡啶基-吡啶(pypy)配位体的铱三面式异构体具有光致发光量子产率高并且激发态寿命短的高度需要的蓝色磷光发射。此异构体的合成因两个因素而复杂,即合成中游离吡啶的配位和金属化位点的非选择性。因为三个金属化事件必须以正确构型发生以便得到所要蓝色发射异构体,所以寻找用以改进合成产率的方法是重要的。
用以开发本文中所描述的化合物的计算显示,其中未配位的氮在金属邻位的非所要异构体的三重态从所要异构体显著红移。此效应经比较实例2展示于表1中。
本文中所描述的化合物包括蓝色磷光发射三面式络合物,其可以在吡啶基吡啶配位体上在非所要位点处采用烷基取代来阻挡金属化。使用b3lyp/cep-31g泛函和基组、使用高斯(gaussian)软件包执行的密度泛函计算(df)计算显示,如表1中所示,甲基取代对三重态能量具有最小效应。
表1:将所要和非所要面式异构体与本发明化合物1比较的dft计算.
还将本文中所描述的化合物与比较实例1二氟吡啶基吡啶类似物比较:
比较实例1的光谱展示于图10中。在2-甲基四氢呋喃溶剂中在室温(rt)和77k下,以及在5重量%下在聚甲基丙烯酸甲酯(pmma)(一种光学惰性聚合物主体基质)中,测量光谱数据。在77k下,最高能量峰值在430nm下,并且在室温下和在pmma基质中,最高能量峰值在437nm下。将pmma:比较实例1(5重量%)样品的光致发光量子产率(plqy)与pmma:主体3:比较实例1(5重量%)比较,其中pmma和主体3比率约是50:50并且比较实例1构成了全部的5重量%。在配备有氙气灯、积分球和型号c10027光子多道分析仪的滨松(hamamatsu)c9920系统上进行plqy测量。主体3是包含标准oled架构基块(例如咔唑和二苯并呋喃)的代表性高三重态主体。主体3的77k溶液三重态是约420nm。发现,pmma:比较实例1的plqy非常高,是95%。然而,在包括主体3的基质中,效率下降到仅9%。因此,比较实例1的三重态容易通过含有咔唑的oled主体材料猝灭,并且因此在用于本文中所描述的具有式i的配位体la的化合物情况的标准oled装置中无法进行测试和研究。
表1还将化合物1和13的计算值与比较实例3到5比较。本领域中已知,具有ome基团的化合物,例如比较实例3到5中的那些可以具有高三重态能量。在此情况下,ome具有正哈米特常数(hammettconstant)(σm=0.12,c.汉施(c.hansch)等人化学评论(chem.rev.)1991,91,165-195),其实际上向ir原子提供拉电子效应。同时,具有具备负哈米特常数的取代基,即推电子基团,例如比较实例6-8中的nme2(σm=-0.16),化合物应展示三重态能量的红移。如表1中所示,这符合于比较实例6到8。然而,化合物1和化合物13出乎意料地显示,具有具备哈米特常数小负值或零值的取代基,例如氢(σm=0)或甲基(σm=-0.07)以及其它烷基类似物,化合物仍可以具有与具有具备更正或负哈米特常数的取代基的那些相比相同或甚至更高的三重态能量。
合成化合物1
步骤1:
合成2',6'-二甲基-2,3'-联吡啶.将2,6-二甲基-3-溴吡啶(44.54g,240mmol)、2-三丁基锡-吡啶(82.83g,225mmol)和四(三苯基膦)钯(0)(6.516g,5.62mmol)馈入到具有720ml间二甲苯的反应烧瓶中。将此混合物脱气,然后加热到130℃后持续35小时。将反应混合物冷却到室温。将反应混合物用15%hcl水溶液萃取。将水相首先用乙醚洗涤,然后通过50%naoh水溶液中和。然后将水相通过氯仿萃取。将有机层分离,并且经硫酸镁干燥。然后将有机物过滤,并且在真空下浓缩。然后使残余物经历库格尔罗尔(kugelrohr)蒸馏,并且产生2',6'-二甲基-2,3'-联吡啶(34.52g,187mmol,83%产率)。
步骤2:
合成铱氯桥式二聚体.以2',6'-二甲基-2,3'-联吡啶(5g,27.1mmol)、ircl3水合物(5.032g,13.5mmol)和2-乙氧基乙醇(60ml)馈入100ml圆底烧瓶。将反应混合物加热到70℃后持续64小时。将所要产物通过过滤分离,并且用异丙醇洗涤。(6.94g,86%产率)
步骤3:
合成铱acac络合物.以来自前一步骤的铱氯桥式二聚体(2g,1.684mmol)、2,2,6,6-四甲基庚烷-3,5-二酮(1.86g,10.1mmol)、碳酸钠(2.14g,20.2mmol)和2-乙氧基乙醇(10ml)馈入500ml圆底烧瓶。将反应混合物在室温下搅拌64小时。将反应混合物用水稀释,并且用二氯甲烷萃取。将有机层分离,并且经硫酸镁干燥。然后将有机物过滤,并且在真空下浓缩,并且产生所要化合物。(1.88g,2.53mmol,75%产率)
步骤4:
合成化合物1.以来自前一步骤的铱acac络合物(11.74g,15.8mmol)、2',6'-二甲基-2,3'-联吡啶(8.74g,47.5mmol)和甘油(10ml)馈入100ml圆底烧瓶。将反应物加热到115℃后持续89小时。将反应混合物倾入到10%licl水溶液中,并且用二氯甲烷萃取。将有机部分在et3n预处理的硅胶柱上用99/1dcm/meoh到80/20dcm/meoh进行色谱分析,得到1.0g金色固体。(8.5%产率)
合成化合物2
合成2',4-二甲基-2,3'-联吡啶.将异丙基氯化镁(61.5ml,123mmol)馈入到反应烧瓶中。经30分钟时间段逐滴添加2-溴-4-甲基吡啶(16.8g,98mmol)到此反应混合物中,同时维持内部温度低于30℃。将此混合物在室温下搅拌2小时。经30分钟时间段逐滴添加于四氢呋喃(thf)中的氯化锌(240ml,120mmol)到此反应混合物中,同时维持内部温度低于30℃。继续在室温下搅拌过夜。将三(二苯亚甲基丙酮)钯(0)(1.2g,1.311mmol)和2-二环己基膦基-2',4',6'-三异丙基联苯(2.4g,5.03mmol)馈入到具有75mlthf的反应容器中。将此混合物回流45分钟,然后冷却到室温。添加3-溴-2-甲基吡啶(11.4g,66.3mmol)到反应混合物中。将所形成的有机锌溶液转移到加料漏斗,并且经15分钟逐滴添加到反应混合物中。将混合物使用氮气脱气,然后在回流下加热18小时。将所得反应混合物冷却到室温,然后用氯化铵水溶液淬灭。将此混合物使用300ml乙酸乙酯萃取2次。将这些萃取物经硫酸镁干燥,然后过滤,并且在真空下浓缩。使粗残余物通过使用10-20%乙酸乙酯/二氯甲烷(dcm)的中性氧化铝柱。分离呈灰白色固体状的2',4-二甲基-2,3'-联吡啶(2.2g,11.94mmol,12%产率)。
合成化合物2.添加2',4-二甲基-2,3'-联吡啶(2.7g,14.66mmol)和ir(acac)3(1.4g,2.9mmol)到舒伦克(schlenk)烧瓶中的十三烷(0.5ml)中,并且将内含物抽空,并且用氮气回填五(5)次。将反应物加热到235℃后持续60小时。将反应物冷却到室温,并且在et3n预处理的硅胶柱上用99/1dcm/meoh到80/20dcm/meoh进行色谱分析,得到1.0g金色固体。将固体相继用甲苯和乙醚沥滤,得到0.93g呈黄色固体状的化合物2。产物通过nmr和lc/ms确认。
合成化合物3
合成2,6-二甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼戊-2-基)吡啶.将3-溴-2,6-二甲基吡啶(11g,59.1mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼戊烷)(19.52g,77mmol)、乙酸钾(6.95g,70.9mmol)、三(二苯亚甲基丙酮)钯(0)(1.082g,1.182mmol)和2-二环己基膦基-2',6'二甲氧基联苯(1.939g,4.73mmol)馈入到具有200ml二噁烷的反应烧瓶中。将混合物用氮气脱气,然后在回流下加热过夜。将反应混合物冷却到室温,然后用300ml水稀释。将此混合物用300ml乙酸乙酯萃取两次。将有机物合并,并且然后用盐水洗涤。将有机物合并,经硫酸镁干燥,然后过滤,并且在真空下浓缩。使此粗残余物通过使用1-20%甲醇/dcm作为洗脱剂的硅胶柱,产生2,6-二甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼戊-2-基)吡啶(1.2g,5.15mmol,9%产率)。
合成2',4,6'-三甲基-2,3'-联吡啶.将2,6-二甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼戊-2-基)吡啶(1.2g,5.15mmol)、2-溴-4-甲基吡啶(0.974g,5.66mmol)和四(三苯基膦)钯(0)(0.238g,0.206mmol)馈入到具有50ml二甲氧基乙烷(dme)的反应烧瓶中。将碳酸钾(2.131g,15.44mmol)溶解于10ml水中,并且然后馈入到反应烧瓶中。将此混合物脱气,然后在回流下加热过夜。将反应混合物冷却到室温。将反应混合物用100ml水和200ml乙酸乙酯稀释。将有机层分离,并且经硫酸镁干燥。然后将有机物过滤,并且在真空下浓缩。将粗残余物经由硅胶色谱使用1-5%甲醇/dcm纯化,产生2',4,6'-三甲基-2,3'-联吡啶(0.55g,2.77mmol,54%产率)。
合成化合物3.添加2',4,6'-三甲基-2,3'-联吡啶(2.8g,13.8mmol)和ir(acac)3(1.4g,2.8mmol)到舒伦克烧瓶中的十三烷(1ml)中,并且将内含物抽空,并且用氮气回填五(5)次。将反应混合物加热到235℃后持续16小时。将反应混合物冷却到室温,并且添加dcm。将不溶性物质过滤,并且用dcm洗涤,得到0.70g(32%)呈金色固体状的化合物3。产物通过nmr确认。
合成化合物4
合成2',4,5-三甲基-2,3'-联吡啶.将2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼戊-2-基)吡啶(1.178g,5.37mmol)、2-溴-4,5-二甲基吡啶(1g,5.37mmol)和四(三苯基膦)钯(0)(0.249g,0.215mmol)馈入到具有75ml甲苯的反应容器中。将碳酸钾(2.225g,16.12mmol)溶解于15ml水中,并且馈入到反应容器中。将反应混合物用氮气脱气,然后在回流下加热。将反应混合物在回流下加热3天。然后将反应混合物用100ml乙酸乙酯和50ml水稀释。将有机层分离,并且经硫酸镁干燥。然后将有机物过滤,并且在真空下浓缩。将粗产物使用硅胶色谱使用1-5%甲醇/dcm作为洗脱剂纯化。分离呈茶色固体状的2',4,5-三甲基-2,3'-联吡啶(0.35g,1.765mmol,32.8%产率)。
合成化合物4.添加2',4,5-三甲基-2,3'-联吡啶(4.0g,20.2mmol)和ir(acac)3(2.0g,4.0mmol)到舒伦克烧瓶中的十三烷(1ml)中,并且将内含物抽空,并且用氮气回填五(5)次。将反应物加热到255℃后持续96小时。将反应物冷却到室温,并且在et3n预处理的硅胶柱上用99/1dcm/meoh到70/30dcm/meoh进行色谱分析,得到1.7g金褐色固体。将固体相继用甲苯和乙醚沥滤,得到1.5g呈淡金色固体状的化合物4。产物通过nmr和lc/ms确认。
合成化合物5
合成2'-甲基-2,3'-联吡啶.将三(二苯亚甲基丙酮)钯(0)(0.798g,0.872mmol)和2-二环己基膦基-2',4',6-三异丙基联苯(1.664g,3.49mmol)馈入到具有50mlthf的反应混合物中。将此反应混合物回流45分钟。将反应混合物冷却到室温。将3-溴-2-甲基吡啶(7.5g,43.6mmol)馈入到反应混合物中,接着逐滴添加吡啶-2-基溴化锌(ii)(100ml,50.0mmol)。在完成添加之后,将反应混合物加热到回流过夜。将反应混合物倾入到氯化铵水溶液中,然后使用300ml乙酸乙酯萃取两次。将萃取物经硫酸镁干燥,然后过滤,并且在真空下浓缩。使此粗残余物通过使用10-25%乙酸乙酯/dcm的中性氧化铝柱。将经清洁的产物洗脱份合并,并且在真空下浓缩,产生2'-甲基-2,3'-联吡啶(1.800g,10.58mmol,14%产率)。
合成化合物5.添加2'-甲基-2,3'-联吡啶(1.5g,8.8mmol)和ir(acac)3(0.86g,1.8mmol)到舒伦克烧瓶中的十三烷(0.5ml)中,并且将内含物抽空,并且用氮气回填五(5)次。将反应物加热到235℃后持续60小时。将反应物冷却到室温,并且在et3n预处理的硅胶柱上用99/1dcm/meoh到80/20dcm/meoh进行色谱分析,得到0.71g金色固体。将固体用乙醚沥滤,得到0.70g呈黄色固体状的化合物5。产物通过nmr和lc/ms确认。
合成化合物11
合成5-氯-2-异丙基吡啶.将2,5-二氯吡啶(15.0g,101mmol)和(dppe)nicl2(0.268g,0.507mmol)在氮气下溶解于无水thf(338ml)中,通过冰浴冷却,并且经半小时逐滴添加异丙基氯化镁于thf中的溶液(2m,62ml,124mmol),导致混合物变成深褐色。将混合物冷搅拌1小时,然后在室温下搅拌过夜。将混合物用nh4cl水溶液淬灭,然后添加盐水和水。将混合物用乙醚萃取两次,然后将有机物用盐水洗涤,干燥,降低真空度,并且涂布于硅藻土上。将混合物通过柱色谱法纯化,得到12.61g(80%)微黄色液体。
合成6'-异丙基-2,3'-联吡啶.将pd2(dba)3(0.944g,1.031mmol)和x-phos(1.965g,4.12mmol)在氮气下溶解于thf(150ml)中,加热到回流直到橙色,然后经由套管添加到5-氯-2-异丙基吡啶(8.02g,51.5mmol)于thf(50ml)中的溶液中。使混合物升温到65℃后持续约5分钟,然后经由注射器缓慢添加吡啶-2-基溴化锌(ii)于thf中的溶液(0.5m,113ml,56.7mmol)。将褐色混合物在非常温和的回流下加热4小时,导致形成固体。将反应溶液用250mletoac稀释,并且通过硅藻土过滤。在真空下去除溶剂。将残余物分配在etoac与水之间,并且使用k2co3使ph达到约9。将厚乳液通过硅藻土过滤,分离,并且再将水层用etoac萃取几次。将有机物用盐水洗涤,干燥,降低真空度,并且涂布于硅藻土上。将产物通过柱色谱法纯化,得到黄色/褐色油,将其经由库格尔罗尔法蒸馏,得到8.06g(79%)无色油。
合成化合物11.将6'-异丙基-2,3'-联吡啶(8.00g,40.3mmol)、ir(acac)3(3.95g,8.07mmol)和十三烷(1ml)组合于舒伦克管中,并且将混合物通过循环真空/氮气几次来脱气。将混合物在约260℃下在氮气下加热4天,然后施加温缓真空同时溶液仍是热的以便去除十三烷。将残余混合物在270℃下加热过夜,导致蓝色发光。在冷却到室温之后,将反应混合物溶解于dcm中,转移到库格尔罗尔烧瓶中,并且将过量配位体蒸馏出。将残余物通过柱色谱法纯化,并且将来自最清洁洗脱份的残余物于约100ml热etoac中湿磨,冷却到室温,并且过滤,并且用多批etoac洗涤。将产物干燥,得到0.936g深黄色粉末。将此物质于约100mletoac中沸腾,冷却到室温,并且将不溶性米色固体过滤出。将黄色滤液冷凝,再次溶解于100ml热etoac中,冷却到室温,然后添加约100ml庚烷,并且将所得溶液在室温下搅拌。所收集的所得物质是0.550g黄色固体。
合成化合物12
合成5-氯-2-(2,6-二甲基苯基)吡啶.将2,5-二氯吡啶(10g,67.6mmol)、(2,6-二甲基苯基)硼酸(11.15g,74.3mmol)和碳酸钾(14.01g,101mmol)组合于二噁烷(113ml)和水(113ml)中,脱气30分钟,然后添加pd(pph3)4(3.90g,3.38mmol)。再继续脱气10分钟,然后将混合物在氮气下在搅拌下加热到回流,产生均质反应混合物。将反应物加热过夜,然后分配在水与etoac之间。将有机物用盐水洗涤,干燥,并且涂布于硅藻土上。柱色谱法得到10.99g(75%)接近无色的油。
合成6'-(2,6-二甲基苯基)-2,3'-联吡啶.将pd2(dba)3(0.925g,1.010mmol)和x-phos(1.925g,4.04mmol)在氮气下于thf(150ml)中搅拌,加热到回流直到橙色(10分钟),冷却到室温,然后经由套管添加到5-氯-2-(2,6-二甲基苯基)吡啶(10.99g,50.5mmol)于thf(50ml)中的溶液中。经由注射器添加吡啶-2-基溴化锌(ii)于thf中的溶液(0.5m,111ml,55.5mmol),并且将所得褐色混合物在温缓回流下加热4小时,然后冷却到室温。在真空下去除大部分thf,并且将残余物用etoac稀释,并且通过硅藻土过滤。然后添加水,用na2co3使ph达到约9。将悬浮液通过硅藻土过滤,分配,并且将水层用2×etoac萃取。将有机物用盐水洗涤,干燥,降低真空度,并且涂布于硅藻土上。柱色谱法得到黄色/褐色油,将其使用库格尔罗尔法蒸馏,得到无色粘性油。使用于二噁烷中的hcl酸化,接着于热丙酮中湿磨hcl盐三次,得到更纯的固体,将其使用naoh碱化,并且萃取到乙醚中,得到6.09g(46%)约99%纯度的无色油。
合成化合物12.将6'-(2,6-二甲基苯基)-2,3'-联吡啶(6.07g,23.32mmol)、ir(acac)3(2.24g,4.58mmol)和10滴十三烷组合于舒伦克管中,将其通过真空/氮气回填循环几次,然后在270℃下在氮气下加热。反应溶液变为深褐色过夜。在早晨,将混合物冷却到160℃,并且保持在真空下直到大部分起泡消退。将混合物再在270℃下加热五天,然后冷却,并且涂布于硅藻土上。进行柱色谱法,接着于沸腾etoac中湿磨,得到0.865g亮黄色固体。
合成化合物13
合成2,3'-联吡啶.将pd2(dba)3(1.129g,1.233mmol)、s-phos(2.025g,4.93mmol)、吡啶-3-基硼酸(8.34g,67.8mmol)和磷酸钾(26.2g,123mmol)组合于烧瓶中,通过真空/回填脱气,然后经由套管添加二噁烷(205ml)和水(103ml)的脱气混合物,并且经由注射器添加2-氯吡啶(5.79ml,61.6mmol)。将混合物在100℃下加热3小时,并且冷却到室温。添加盐水和etoac,并且在分离之后,将水层用etoac萃取三次。将经合并的有机层用盐水洗涤,干燥,去除溶剂,并且将残余物涂布于硅藻土上。柱色谱法得到黄色油,将其在真空下蒸馏(浴:200℃;蒸气:162℃),得到8.50g(88%)无色油。
合成化合物13.将2,3'-联吡啶(6.99g,44.7mmol)、ir(acac)3(4.38g,8.95mmol)和10滴十三烷组合于舒伦克管中,用真空/氮气循环几次,然后在氮气下加热到约275℃(活动性回流)。一旦到达温度,反应溶液快速变为均质并且褐色。在早晨,将混合物在160℃下在活动性真空下加热几小时,然后在275℃下在氮气下继续加热过周末。在冷却到室温之后,将反应混合物溶解于约50mldcm中,用庚烷稀释,并且通过硅藻土垫过滤,并且用多批庚烷洗涤。将滤液降低真空度,然后再次溶解于几mldcm中,用庚烷稀释,并且再次通过同一硅藻土垫洗涤,用庚烷洗涤。将硅藻土滤饼负载到硅胶柱上,并且后续色谱法得到0.87g物质,将其于250ml热etoac中湿磨,得到0.84g黄色粉末。
合成化合物14
合成4-甲基-2,3'-联吡啶.将pd2(dba)3(1.279g,1.396mmol)、s-phos(2.293g,5.59mmol)、吡啶-3-基硼酸(9.44g,77mmol)和磷酸钾(29.6g,140mmol)组合于烧瓶中,通过真空/回填脱气,然后经由套管添加二噁烷(233ml)和水(116ml)的脱气混合物,并且经由注射器添加2-氯-4-甲基吡啶(7.8ml,69.8mmol)。将混合物在100℃下加热过夜。在冷却到室温之后,添加盐水和etoac。在分离之后,将水层用etoac萃取三次,将经合并的有机层用盐水洗涤,干燥,降低真空度,并且涂布于硅藻土上。柱色谱法得到黄色油,将其在真空下蒸馏(砂浴:270℃;蒸气:约190℃),得到10.98g(92%)无色油。
合成化合物14.将4-甲基-2,3'-联吡啶(8.28g,48.6mmol)、ir(acac)3(4.76g,9.72mmol)和10滴十三烷组合于舒伦克管中,用几次长真空/氮气回填循环脱气。将混合物加热到100℃,同时在真空下搅拌以便进行最后一次脱气,然后用氮气回填,并且在270℃下加热过夜。一天之后,将混合物在160℃下在真空下加热几小时,然后再次在275℃下加热额外5天。将混合物冷却到室温,并且使用dcm/meoh涂布于硅藻土上。进行柱色谱法,接着于etoac中湿磨,得到0.71g黄色固体。
光致发光(pl)光谱
化合物1-3的发射光谱展示于图4和5中。图4中可以看出,化合物在室温下以蓝绿色彩发射,最高能量发射峰值是约475nm。图5展示了在77k下的发射。此处,发射最大值在452-456nm之间的此家族化合物展示固有深蓝色三重态能量。
化合物还在77k下以非常短的激发态寿命发射。举例来说,化合物1和3的激发态寿命分别是2.95和2.52微秒。为了比较,测量三面式铱苯基吡啶绿色发射化合物fac-ir(ppy)3,其在77k2-甲基四氢呋喃中的寿命是4.03微秒。短激发态寿命可以是改进的稳定性的所要特征,因为化合物在高能的激发态中耗费较少时间。
当掺杂于主体基质中时,化合物还测量为具有非常高的光致发光量子产率。制备化合物1-4的薄膜样品,其中在石英衬底上将化合物1-4以5重量%掺杂到主体1中。化合物1-5的薄膜光致发光量子产率分别是92%、87%、69%、90%和94%,证实这些化合物是非常高效的发射体。经掺杂的膜的发射光谱展示于图6中。可以看出,与图4中所示的室温溶液光谱相比,在经掺杂的膜中蓝色发射性质有所改进。此处,最高能量峰值现是最高强度峰值,产生更蓝色的发射色彩。
装置实例
通过高真空(<10-7托)热蒸发制造装置。阳极电极是
表2:vte装置架构.
表3vte装置数据
制造装置1-7,以便证实oled装置中来自吡啶基-吡啶掺杂剂的饱和蓝色发射。所有装置都采用两个主体发射层,其包含电子输送主体1和空穴输送主体2。装置1-4掺杂有化合物4,其在共价连接的吡啶环上具有甲基阻挡取代基。发现装置1具有最高效率,在1000尼特下外部量子效率是16.2%,并且在20ma/cm2下亮度是6910cd/m2。用于装置5-7中的化合物12-14不具有甲基阻挡取代基,并且发现其在装置中具有蓝移的发射色彩。在这些实例中,发现装置7(化合物14)具有最蓝的电致发光光谱,cie坐标是(0.160,0.334),并且λ最大是468nm。
应理解,本文所述的各种实施例仅作为实例,并且无意限制本发明的范围。举例来说,本文所述的材料和结构中的许多可以用其它材料和结构来取代,而不脱离本发明的精神。如所要求的本发明因此可以包括本文所述的具体实例和优选实施例的变化,如本领域技术人员将明白。应理解,关于本发明为何起作用的各种理论无意为限制性的。
- 还没有人留言评论。精彩留言会获得点赞!