马齿苋中一种二氢吲哚羧酸类生物碱及其提取分离方法与用途与流程
本发明涉及中药提取、分离领域,尤其涉及从马齿苋药材中提取、分离和鉴别出的一种生物碱化合物及其提取分离方法,特别是马齿苋中一种二氢吲哚羧酸类生物碱及其提取分离方法。
背景技术:
马齿苋(Portulaca oleracea L.),又名长命菜、马苋菜,为马齿苋科植物。马齿苋性喜肥沃土壤,耐旱亦耐涝,生命力强,分布广泛,资源丰富,而以我国东北部的更为常见。马齿苋既可入药,又可食用,是我国卫生部划定的药食同源的野生植物之一。2015版《中华人民共和国药典》中收载马齿苋的干燥地上部分入药,具有清热解毒、凉血止血、止痢等功效,用于热毒血痢、痈肿疔疮、湿疹、丹毒、蛇虫咬伤、便血、痔血、崩漏下血等。
现代药理学研究表明,马齿苋具有降血脂、降血糖、抗炎、抗氧化、抗肿瘤、抗动脉粥样硬化、松弛或兴奋平滑肌及增强免疫力等功效。研究表明马齿苋中所含多种化学成分与其多样的药理作用息息相关,其主要化学成分包括:黄酮类、生物碱类、萜类、香豆素类、有机酸类、挥发油、多糖、氨基酸、各种色素类和矿物质类等。其中生物碱是马齿苋中的一大类活性成分,而酰胺类生物碱又占绝大多数。目前已报道的生物碱类成分有去甲肾上腺素、多巴胺、少量多巴、腺苷、尿嘧啶、腺嘌呤、N,N-二环己基脲、尿囊素、N-反式-阿魏酰基酪胺;还有环二肽生物碱和酰胺类生物碱:马齿苋酰胺A-I、K、L、N-S。
目前从马齿苋中分离出的化学成分大多数是已知的,且结构一种性较低,因此,对马齿苋中新化合物的开发和分离是亟待需要的。
技术实现要素:
针对上述问题,本发明提供从马齿苋中提取的一种生物碱化合物,经研究发现本发明的一种生物碱具有抗肿瘤、神经保护的作用,同时提供一种针对本发明一种生物碱化合物的简便、快速、环保、纯度高的提取分离方法。
为实现本发明的上述目的,本发明提供一种马齿苋中二氢吲哚羧酸类生物碱,分子式分别为C9H9NO4,化学名为4,5-dihydroxyindoline-1-carboxylic acid,化学结构式为。
为实现本发明的上述目的,本发明还提供马齿苋中一种二氢吲哚羧酸类生物碱的提取分离方法,具体步骤为。
步骤1、取马齿苋干燥药材,采用水提取(水用量为药材的8~16倍)两次,水提液滤过,合并滤液直接加热浓缩,放凉至室温,得药液备用。
步骤2、将步骤1中药液蒸干后上硅胶柱,用乙酸乙酯洗脱,减压回收乙酸乙酯至浸膏,得到乙酸乙酯提取物;
步骤3、将步骤2中乙酸乙酯提取物经聚酰胺柱分离,采用乙醇-水梯度洗脱,水和30%醇部蒸干后上硅胶柱,依次用乙酸乙酯,乙酸乙酯-甲醇梯度洗脱得到若干洗脱部位,经薄层色谱进行检测,显色,合并显色的洗脱部位,将合并后的洗脱部位经减压浓缩至干,备用;
步骤4、将步骤3中所得物经聚酰胺柱分离,采用乙醇-水梯度洗脱,30%乙醇部蒸干,备用;
步骤5、将步骤4中所得物经预处理的ODS柱(Octadecylsilyl,十八烷基硅烷键合硅胶填料)层析分离,用甲醇-水梯度洗脱,得到若干洗脱部位,经薄层色谱进行检测,显色,将各显色的洗脱部位分别减压浓缩至干,得到浓缩物备用;
步骤6、将步骤5中所得物再经预处理的葡聚糖凝胶柱(Sephadex LH-20)层析分离,用甲醇洗脱,得到若干洗脱部位,经薄层色谱进行检测,显色,合并显色的洗脱部位,将合并后的洗脱部位经减压浓缩至干,备用;
步骤7、对步骤6中所得浓缩物进行HPLC(高效液相)分离制备,以乙腈和0.1%甲酸作为流动相,制备得到一种二氢吲哚羧酸类生物碱化合物。
所述ODS和Sephadex LH-20凝胶的预处理过程为甲醇浸泡过24小时,上柱,用甲醇洗至滴入水中无混浊,再以初始流动相平衡。
与现有技术相比本发明的有益效果。
本发明中所述马齿苋中的二氢吲哚羧酸类生物碱的分离和药理活性研究未被现有论文期刊所报道;本发明提供来源于马齿苋的新生物碱类化合物及一种针对本发明新化合物的提取分离方法,依次采用水煎煮提取、硅胶柱层析、聚酰胺柱、ODS中压柱、Sephadex LH-20及高效液相色谱仪进行分离纯化与制备,成功提取分离出新化合物,该方法操作步骤仅为七步,操作方法简便及快速,提取分离过程主要采用水提取及乙酸乙酯洗脱,工艺方法环保,且经该方法分离得到的化合物纯度较高均大于90%,此外经研究表明此化合物具有抗肿瘤、神经保护作用,因此本发明新化合物及其盐和衍生物可以作为其他化合物合成先导物,以及新药开发和药理活性研究的原料,亦可用于制备抗肿瘤、神经保护的药物。
附图说明
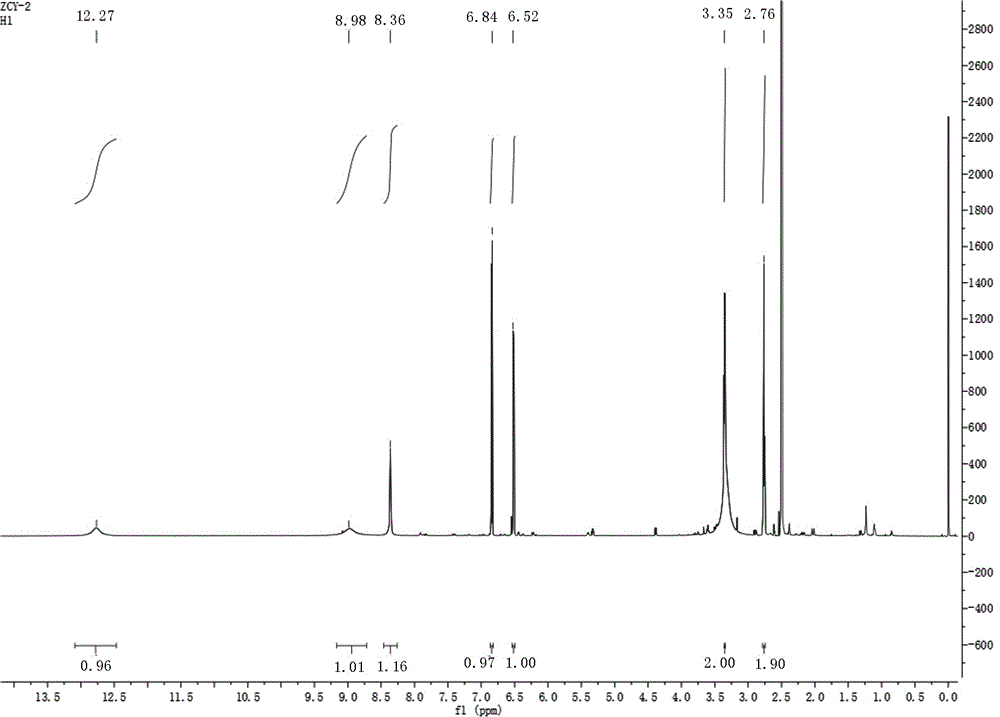
图1为本发明新生物碱化合物的1H-NMR光谱图。
图2为本发明新生物碱化合物的13C-NMR光谱图。
图3为本发明新生物碱化合物的核磁共振碳谱(DEPT)光谱图。
图4为本发明新生物碱化合物的核磁共振1H-1HCOSY光谱图。
图5为本发明新生物碱化合物的核磁共振HMBC光谱图。
图6为本发明新生物碱化合物的核磁共振HSQC光谱图。
图7为本发明新生物碱化合物的核磁共振ROESY光谱图。
图8为本发明新生物碱化合物的高分辨质谱图。
具体实施方式
下面结合具体实施例对本发明做详细的说明。
实施例1。
本发明提供马齿苋中一种二氢吲哚羧酸类生物碱,分子式为C9H9NO4,化学名为4,5-dihydroxyindoline-1-carboxylic acid,化学结构式为。
表1为该一种生物碱化合物的核磁数据:1H-NMR与13C-NMR在氘代DMSO中。
表1本发明新生物碱化合物的核磁数据
本发明马齿苋中一种二氢吲哚羧酸类生物碱的结构鉴定与推导。
4,5-dihydroxyindoline-1-carboxylic acid:棕褐色粉末状物,易溶于甲醇,不溶、微溶于水。点样于硅胶薄层板后,喷稀碘化铋钾试液斑点显橘黄色,提示该化合物为生物碱成分。HR-ESI(-)-TOF-MS给出m/z:194.0465的[M-H]-的准分子离子峰,分子量为195.0532,结合1H-NMR,13C-NMR以及DEPT数据,推测该化合物可能的分子式为C9H9NO4,不饱和度为6。13C-NMR谱和DEPT谱显示9个碳信号,分别为2个CH2(δ:26.48,39.60)、2个CH(δ:116.63,119.35)、5个季碳(1个羰基碳,δ:170.00;4个烯烃碳,δ:111.18,128.96,144.03,149.78)
1H-NMR谱显示化合物具有2个CH2信号分别为δ2.76(2H,t,J=6.72Hz),δ3.35(2H,td,J=6.82,2.34Hz);2个CH信号δ6.52(1H,d,J=7.92Hz),δ6.84(1H,d,J=7.86Hz)。根据1H-1H COSY谱可知,2个CH2中的δ2.76和δ3.35相耦合,2个CH中δ6.52和δ6.84相耦合;HMBC谱显示芳香质子H-6与烯季碳C-3a,C-4,C-5,C-7a相耦合,芳香质子H-7与烯季碳C-3a,C-4,C-5,C-6,C-7a相耦合,可以确定存在四取代苯环,且C4(δ149.78),C5(δ144.03)位于低场,以及活泼氢δ8.36,δ8.98的存在,证明C-4,C-5分别与羟基相连。此外,HMBC谱显示H-2与C-2,C-3a,C-7a相耦合,H-3与C-2,C-3,C-3a,C-4,C-7a相耦合,H-7与C-3,C-3a,C-7a相耦合,同时DEPT谱图证明C-2(39.60)是一个典型与N相连的碳,说明四取代苯环通过C-3a,C-7a与一个含N五元环相稠和组成一个二氢吲哚环结构。C-1’(δ170.00)位于低场,以及活泼氢δ12.77,证明化合物中共含有一个羧基。H-2,H-7与C-1’相耦合,推测N-1与C-1’相连。最终根据以上信息,可确定马齿苋中一种二氢吲哚羧酸类生物碱为上述结构。
本发明还提供上述化合物的提取分离方法,具体步骤为。
步骤1:称取马齿苋干燥药材150kg,采用水回流提取,水用量(v/v)为药材的10倍,回流提取两次,每次2h,在90-100℃下加热浓缩,放凉至室温,得药液备用。
步骤2:将步骤1中所得药液蒸干后经硅胶柱层析分离,用乙酸乙酯(115L)等度洗脱,其中硅胶为100-200目,40℃以下减压回收乙酸乙酯至浸膏,得到乙酸乙酯提取物。
步骤3:将步骤2中乙酸乙酯提取物经聚酰胺柱分离,采用乙醇-水(0/100,30/70,50/50,70/30,100/0,v/v)梯度洗脱,将水部与30%乙醇部在90-100℃下蒸干后经硅胶柱层析分离,其中硅胶为200~300目,依次用乙酸乙酯,乙酸乙酯-甲醇(5:1、2:1、1:2,v:v)梯度洗脱,共得到30个部位(即共得到30个瓶,每瓶300mL),经薄层色谱进行检测,显色,合并显色的1~15洗脱部位,将合并后的1~15部位经40℃以下减压浓缩至干,备用。
步骤4:将步骤3中所得物再经聚酰胺柱分离,采用乙醇-水(0/100,30/70,50/50,70/30,100/0,v/v)梯度洗脱,将30%乙醇部在90-100℃下蒸干,备用。
步骤5:将步骤4中所得物再经预处理的ODS中压柱层析分离(Octadecylsilyl,十八烷基硅烷键合硅胶填料),其中填料粒度为20~40μm,用甲醇-水(30/70,40/60,50/50,60/40,70/30,100/0,v/v)梯度洗脱(加压,使流速为1mL/min,温度为室温),得到12个部位(即梯度洗脱得12个瓶,每瓶100mL),经薄层色谱进行检测,显色,将显色的3~4部位保留,50℃以下减压浓缩至干,备用。
步骤6:将步骤5中所得物再经预处理的葡聚糖凝胶柱层析分离(Sephadex LH-20),用甲醇洗脱,得到17洗脱部位(即共得到17个瓶,每瓶50mL),经薄层色谱进行检测,显色,将显色的10-17部位保留,50℃以下减压浓缩至干,备用,得到新化合物。所述ODS与葡聚糖凝胶的预处理过程为甲醇浸泡过24h,上柱,用甲醇洗至滴入水中无混浊,再以初始流动相平衡。
步骤7:将步骤6中所得新化合物经HPLC分离制备,以乙腈:0.1%甲酸(13:87,v/v)作为流动相,检测波长为210nm,280nm,分离制备得到本发明新化合物,归一法测定纯度均为90~99%。
本发明马齿苋中一种二氢吲哚羧酸类生物碱的抗肿瘤作用。
1主要材料。
1.1药品和试剂:实验所用新生物碱化合物由上述方法制备,纯度为90~99%,精密称取,用DMSO稀释至下述各剂量组所需溶液。DMEM高糖培养基、胎牛血清(美国Hyclone公司);青霉素、链霉素(杭州四季青公司)。
1.2细胞株:人结肠癌细胞Caco-2、人乳腺癌细胞MCF-7、人胃癌细胞BGC-823、人肺腺癌细胞SPC-A1、人肝癌细胞BEL-7402、人宫颈癌细胞Hela-229、卵巢癌细胞Ho-8910、人类口腔表皮样癌细胞KB(中科院上海细胞库)。
1.3分组:分为对照组、实验组和调零组(含DMSO溶媒的培养液)。
2实验方法。
2.1细胞培养,DMEM高糖培养基,加入l0%的胎牛血清,l%抗菌素(100U/mL青霉素和100μg/mL链霉素),置于37℃、5%CO2培养箱中培养。
2.2MTT法检测细胞增殖,取对数生长期细胞接种于96孔培养板中,细胞密度为1×104个/mL,每孔100μL,温度37℃,5%的CO2条件下培养过夜后,实验组加入不同浓度的本发明新生物碱化合物,每组设3个复孔,加药后置于37℃,5%CO2培养箱中培养48h。将含药培养液吸去,加入体积比为4:1的无血清培养液和MTT(终质量浓度为5mg/mL)共100mL,继续孵育4h,小心吸去上清液后,每孔加入DMSO 150μL,放于震荡器上震荡以使结晶完全溶解(5min),酶标仪在570nm波长下检测各孔的吸光度(A)值。然后,计算各浓度化合物对细胞生长的抑制率,抑制率公式:细胞生长抑制率=(1-A加药孔/A对照孔)×100%,再应用SPSS软件处理数据,将抑制率对药物浓度作曲线,计算IC50值。
3实验结果。
实验结果表明本发明新生物碱化合物对人结肠癌细胞Caco-2、人乳腺癌细胞MCF-7、人胃癌细胞BGC-823、人肺腺癌细胞SPC-A1、人肝癌细胞BEL-7402、人宫颈癌细胞Hela-229、卵巢癌细胞Ho-8910、人类口腔表皮样癌细胞KB的增殖具有抑制作用,且随药物浓度增大,抑制率也明显升高,即呈浓度依赖。本发明新化合物对上述八种肿瘤细胞IC50值见表5。
表2本发明新化合物对肿瘤细胞的抑制作用。
本发明新化合物的神经保护作用。
1主要材料。
1.1药品和试剂:实验所用新生物碱化合物由上述方法制备,纯度为90~99%,精密称取,用DMSO稀释至下述各剂量组所需溶液。DMEM高糖培养基、胎牛血清(美国Hyclone公司);青霉素、链霉素(杭州四季青公司),磷酸盐缓冲液(PBS),(武汉博士德有限公司),ROS检测试剂盒(海门碧云天试剂公司)
1.2细胞株:人神经母细胞瘤细胞株(SH-SY5Y、IMR-32)(中科院上海细胞
1.3分组:分为对照组、H2O2损伤模型组和实验组。
2实验方法。
2.1细胞培养,DMEM高糖培养基,加入l0%的胎牛血清,l%抗菌素(100U/mL青霉素和100μg/mL链霉素),置于37℃、5%CO2培养箱中培养。
2.2MTT比色法测定细胞活力,上述三组分别取对数生长期SH-SY5Y细胞和IMR-32细胞接种于96孔培养板中,细胞密度为1×104个/mL,每孔100μL,温度37℃,5%CO2条件下培养过夜后,实验组加入不同浓度的本发明新生物碱化合物(5-40μM),孵育1h后向H2O2组和实验组分别加入终浓度为800μM/L的H2O2,另设调零组(含DMSO溶媒的培养液),每组设3个复孔,考察加入药物后对细胞的影响。上述各组细胞培养24h后,在各孔细胞中加入5mg/mLMTT 20μL,温度37℃,5%CO2条件下继续孵育4h后,终止培养,吸弃孔内液体,每孔加入100μL二甲基亚砜(DMSO),振荡10min,使细胞内结晶充分溶解,酶标仪450nm波长处测定各孔吸光值(A)值,计算细胞存活率,细胞存活率=(AH2O2损伤-A空白)/(A对照-A空白)。
2.3DCFH-DA法检测SH-SY5Y细胞和IMR-32细胞内ROS,各组细胞给予相应物质后孵育24h,孵育结束前30min,各孔加入DCFH-DA,使终浓度为10μmol/L,于37℃继续孵育30min,收集细胞,PBS洗2次,细胞计数,将各组细胞制成相同浓度的细胞悬液。取100μL细胞悬液检测荧光强度,激发波长485nm,发射波长538nm。以对照组荧光强度为100%,其余各组与对照组荧光强度相比较,计算胞内ROS变化。
2.4INT显色反应法测定LDH的释放量,除上述对照组、H2O2损伤模型组和实验组外,另设立空白对照组(空白对照组不接种细胞),各组细胞加入相应物质培养24h,取各孔上清120μL至新的96孔板中,加60μL配好的LDH检测工作液,避光室温孵育30min,在490nm处用多功能酶标仪测定A值,计算相对于对照管的LDH释放量百分率。LDH释放率=(A给药-A空白)/(A对照-A空白)
3实验结果。
细胞相对存活率实验结果如表3所示。
表3本发明对人神经母细胞瘤细胞株SH-SY5Y和IMR-32细胞相对存活率的影响
注:*P<0.05与H2O2损伤模型组比较。
SH-SY5Y细胞和IMR-32细胞内ROS量检测结果如表4所示。
表4本发明对人神经母细胞瘤细胞株SH-SY5Y和IMR-32细胞内ROS量的影响
注:*P<0.05与对照组比较,#P<0.05与H2O2损伤模型组比较SH-SY5Y细胞和IMR-32细胞内LDH释放的影响结果如表5所示。
表5本发明对人神经母细胞瘤细胞株SH-SY5Y和IMR-32细胞内LDH释放的影响
注:*P<0.05与对照组比较,#P<0.05与H2O2损伤模型组比较。
综上所述,本发明提供一种生物碱化合物及其提取分离方法,依次采用水回流提取、硅胶柱层析、聚酰胺柱层析、ODS中压柱、葡聚糖凝胶柱层析分离纯化,HPLC分离制备,成功的分离得到新生物碱化合物,该方法简便,快速,环保,且经该方法分离得到的化合物纯度较高,由于所得化合物化学结构独特,从常用中药马齿苋中提取出来,其具有抗肿瘤和神经保护作用,因此本发明新生物碱及其盐和衍生物可以作为天然产物开发中药新药,具有广阔的前景。
- 还没有人留言评论。精彩留言会获得点赞!