一种3-菲啶基甲酸丙酯类化合物的绿色合成方法与流程
本发明涉及一种菲啶及其衍生物的合成方法,尤其涉及一种3-菲啶基甲酸丙酯类化合物的绿色合成方法。
背景技术:
菲啶及其衍生物是一类十分重要的杂环化合物,具有抗菌、抗肿瘤等生物活性以及光电特性,其结构单元广泛存在于一些天然产物、药物和功能材料分子中。近年来,菲啶及其衍生物的合成受到了化学家们越来越多的关注。因此,探索菲啶类化合物的高效选择性合成方法在医药化学和材料科学领域中具有重要意义。最近,经由自由基加成到2-联芳基异腈生成亚胺自由基、再经过分子内环化过程合成菲啶衍生物的方法已被多次报道。这一发现,极大地拓展了菲啶衍生物的种类。然而,在这些方法中,仍存在一定的局限性:如需要外加催化剂、氧化剂,反应原料不易获得,反应条件苛刻,步骤较多,产率不高,不具有普遍应用性等。而对于3-菲啶基甲酸丙酯类化合物还没有合成的报道。因此,探索高效、简便、条件温和的合成3-菲啶基甲酸丙酯类化合物的新方法具有重要的意义。
技术实现要素:
为了解决现有技术中存在的问题,本发明的目的在于提供一种简单、绿色的光诱导的方法实现3-菲啶基甲酸丙酯类化合物的合成,在无外加光催化剂和添加物的条件下、光诱导廉价易得的2-联苯基异腈与四氢呋喃发应,具有操作简单,反应条件温和,产物易分离,官能团兼容性较好等优点。
为实现上述目的,本发明所采取的技术手段是,一种3-菲啶基甲酸丙酯类化合物的绿色合成方法,其步骤如下:
(1)准确称取2-联芳基异腈,然后加入盛有四氢呋喃和水混合溶液的反应管中;
(2)将步骤(1)中的反应管放在w380nmled灯上,室温条件下,照射反应若干时间;
(3)反应结束后,将反应混合液倒入盛有去离子水的分液漏斗中,乙酸乙酯萃取洗涤三次,合并有机相;
(4)将步骤(3)中得到的有机相用硫酸镁干燥,抽滤、除去硫酸镁,有机相用旋转蒸发仪浓缩,得到残留物;
(5)残留物用柱层析分离,得到目标产物3-菲啶基甲酸丙酯类化合物。
进一步的,所述步骤(1)中,四氢呋喃和水的体积比为10:1,2-联芳基异腈与混合溶液的添加量比为0.125mol/l。
进一步的,所述步骤(2)中,照射时间为30小时。
进一步的,所述步骤(5)中用柱层析分离是指硅胶和流动相,其中流动相为石油醚和乙酸乙酯按9:1的体积比构成。
本发明的有益效果是:采用简单、绿色的光诱导方法实现了四氢呋喃的选择性碳碳键断裂,一部分被氧化,一部分有2-联芳基异腈发生加成环化,得到新颖的3-菲啶基甲酸丙酯类化合物;避免了催化剂和添加剂的使用,以廉价易得的2-联芳基异腈和四氢呋喃为反应试剂,具有操作简单,反应条件温和,产物易分离,官能团兼容性较好等优点,为3-菲啶基甲酸丙酯类化合物在医药化学和材料科学等领域进一步的应用奠定基础。
附图说明
下面结合视图和实施例对本发明做详细的描述。
图1本发明的化学反应方程式;
图2本发明实施例1的化合物3a的氢谱图;
图3本发明实施例1的化合物3a的碳谱图;
图4本发明实施例2的化合物3b的氢谱图;
图5本发明实施例2的化合物3b的碳谱图;
图6本发明实施例3的化合物3c的氢谱图;
图7本发明实施例3的化合物3c的碳谱图;
图8本发明实施例4的化合物3d的氢谱图;
图9本发明实施例4的化合物3d的碳谱图;
图10本发明实施例5的化合物3e的氢谱图;
图11本发明实施例5的化合物3e的碳谱图;
图12本发明实施例6的化合物3f的氢谱图;
图13本发明实施例6的化合物3f的碳谱图;
图14本发明实施例7的化合物3g的氢谱图;
图15本发明实施例7的化合物3g的碳谱图;
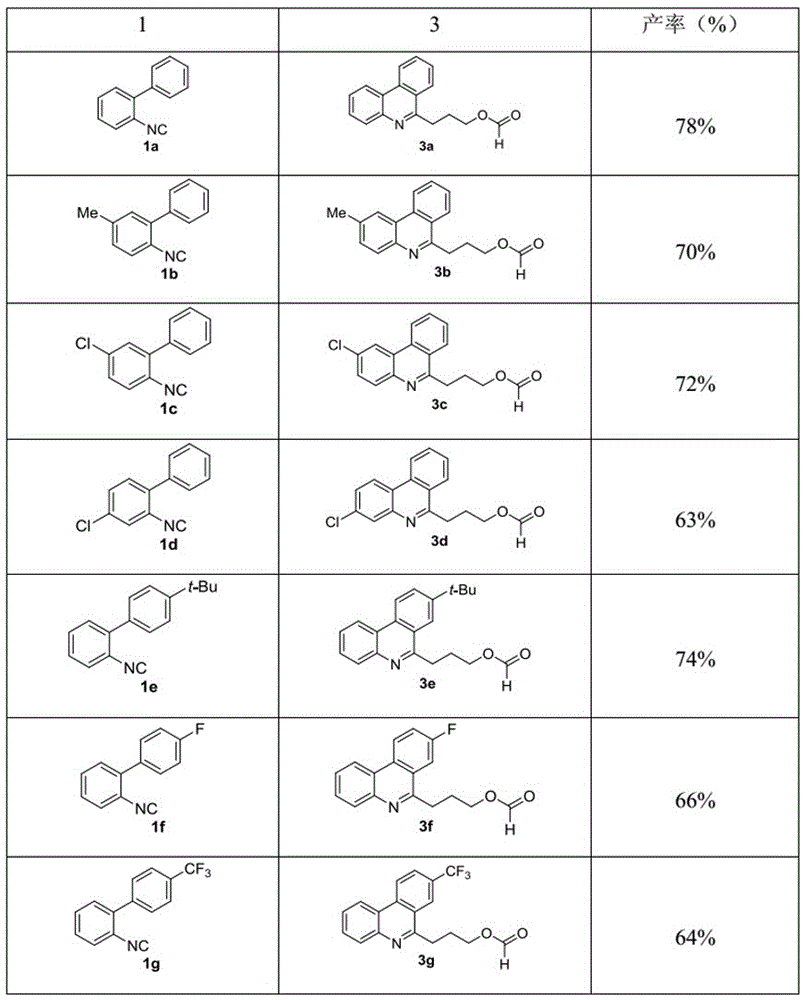
图16本发明实施例的得率对照表。
具体实施方式
实施例1
如图1所示的一种3-菲啶基甲酸丙酯类化合物的绿色合成方法,该方法包括以下步骤:
(1)准确称取2-联苯基异腈(1a,44.5mg),然后加入盛有2.0ml的四氢呋喃和水(10:1)的反应管中;
(2)将步骤(1)中的反应管放在3w380nmled灯上,室温条件下,照射反应30小时,光照射条件下,发生四氢呋喃选择性碳碳键的断裂;
(3)反应结束后,将反应混合液倒入盛有10.0ml去离子水的分液漏斗中,乙酸乙酯萃取洗涤三次,每次5.0ml,合并有机相;
(4)将步骤(3)中得到的有机相用硫酸镁干燥,抽滤、除去硫酸镁,有机相用旋转蒸发仪浓缩,得到残留物;
(5)残留物用柱层析分离(硅胶,流动相:石油醚/乙酸乙酯=9:1),得到目标产物3-菲啶基甲酸丙酯(3a,51.7mg,产率:78%)为无色油状液体,得到的目标产物粗产品易于通过柱层析分离。
四氢呋喃选择性碳碳键的断裂后,一部分被氧化,一部分与2-联苯基异腈加成环化反应,最终,得到目标产物。
如图2、3所示,化合物3a表征如下:1hnmr(400mhz,cdcl3)δ:8.60(d,j=8.4hz,1h),8.50(d,j=8.4hz,1h),8.19(d,j=8.0hz,1h),8.11-8.09(m,2h),7.80(td,j=7.6,1.2hz,1h),7.72-7.65(m,2h),7.60(td,j=7.8,1.6hz,1h),4.39(t,j=6.4hz,2h),3.44(t,j=9.6hz,2h),2.40-2.33(m,2h);13cnmr(100mhz,cdcl3)δ:161.1,160.1,143.6,132.8,130.3,129.6,128.5,127.3,126.4,125.7,125.1,123.6,122.5,121.8,63.8,31.7,27.2.hrms(esi)([m+h]+)calculatedforc17h16no2:266.1176,found:266.1177。
实施例2
与实施例1制备方法中不同之处在于,改变反应原料1a为1b(2-异腈基-5-甲基-1,1’联苯,48.3mg),其他条件和实施例1相同。
柱层析分离(硅胶,流动相:石油醚/乙酸乙酯(9:1)),得到目标产物3b(48.9mg,产率:70%)为无色固体。
如图4、5所示,化合物3b表征如下:1hnmr(400mhz,cdcl3)δ:8.58(d,j=8.0hz,1h),8.28(s,1h),8.17(d,j=8.0hz,1h),8.11(s,1h),7.98(d,j=8.4hz,1h),7.78(td,j=8.0,1.2hz,1h),7.64(td,j=8.0,0.8hz,1h),7.51(dd,j=8.4,1.6hz,1h),4.38(t,j=6.4hz,2h),3.41(t,j=7.6hz,2h),2.59(s,3h),2.38-2.31(m,2h);13cnmr(100mhz,cdcl3)δ:161.1,159.1,141.9,136.2,132.6,130.2,130.1,129.3,127.1,125.6,125.1,123.4,122.4,121.5,63.8,31.7,27.3,21.8。hrms(esi)([m+h]+)calculatedforc18h17no2:280.1332,found:280.1330。
实施例3
与实施例1制备方法中不同之处在于,改变反应原料1a为1c(2-异腈基-5-氯-1,1’联苯,53.3mg),其他条件和实施例1相同。
柱层析分离(硅胶,流动相:石油醚/乙酸乙酯(9:1)),得到目标产物3c(53.8mg,产率:72%)为无色固体。
如图6、7所示,化合物3c表征如下:1hnmr(400mhz,cdcl3)δ:8.44(d,j=8.0hz,1h),8.38(s,1h),8.16(d,j=8.0hz,1h),8.12(s,1h),7.97(d,j=8.4hz,1h),7.79(t,j=7.2hz,1h),7.68(t,j=7.6hz,1h),7.60(d,j=8.8hz,1h),4.39(t,j=6.0hz,2h),3.39(t,j=7.6hz,2h),2.38-2.31(m,2h);13cnmr(100mhz,cdcl3)δ:161.1,160.3,141.9,132.2,131.7,131.1,130.5,129.0,127.9,125.7,125.2,124.6,122.5,121.5,63.7,31.6,26.9.hrms(esi)([m+h]+)calculatedforc17h15clno2:300.0786,found:300.0788。
实施例4
与实施例1制备方法中不同之处在于,改变反应原料1a为1d(2-异腈基-4-氯-1,1’联苯,53.3mg),其他条件和实施例1相同。
柱层析分离(硅胶,流动相:石油醚/乙酸乙酯(9:1)),得到目标产物3d(47.1mg,产率:63%)为无色固体。
如图8、9所示,化合物3d表征如下:1hnmr(400mhz,cdcl3)δ:8.46(d,j=8.0hz,1h),8.32(d,j=8.4hz,1h),8.15(d,j=8.4hz,1h),8.12(s,1h),8.04(d,j=2.4hz,1h),7.78(t,j=8.0hz,1h),7.66(t,j=7.6hz,1h),7.49(dd,j=8.8,2.4hz,1h),4.38(t,j=6.4hz,2h),3.38(t,j=7.6hz,2h),2.37-2.30(m,2h);13cnmr(100mhz,cdcl3)δ:161.3,161.1,144.1,134.0,132.2,130.6,128.8,127.5,126.8,125.7,124.9,123.1,122.3,121.9,63.7,31.5,26.8.hrms(esi)([m+h]+)calculatedforc17h15clno2:300.0786,found:300.0789。
实施例5
与实施例1制备方法中不同之处在于,改变反应原料1a为1e(4’-叔丁基-2-异腈基-1,1’联苯,58.8mg),其他条件和实施例1相同。
柱层析分离(硅胶,流动相:石油醚/乙酸乙酯(9:1)),得到目标产物(3e,59.4mg,产率:74%)为无色固体。
如图10、11所示,化合物3e表征如下:1hnmr(400mhz,cdcl3)δ:8.56(d,j=8.8hz,1h),8.50(d,j=8.0hz,1h),8.19-8.14(m,2h),8.09(d,j=8.0hz,1h),7.91(dd,j=8.8,1.6hz,1h),7.68(t,j=8.0hz,1h),7.60(t,j=7.6hz,1h),4.41(t,j=6.4hz,2h),3.49(t,j=6.4hz,2h),2.42-2.35(m,2h),1.47(s,9h);13cnmr(100mhz,cdcl3)δ:161.2,160.3,150.3,143.3,130.6,129.4,128.7,128.2,126.3,124.9,123.6,122.3,121.7,121.2,63.8,35.1,31.9,31.3,27.3.hrms(esi)([m+h]+)calculatedforc21h24no2:322.1802,found:322.1803。
实施例6
与实施例1制备方法中不同之处在于,改变反应原料1a为1f(4’-氟-2-异腈基-1,1’联苯,49.3mg),其他条件和实施例1相同。
柱层析分离(硅胶,流动相:石油醚/乙酸乙酯(9:1)),得到目标产物3f(46.7mg,产率:66%)为无色固体。
如图12、13所示,化合物3f表征如下:1hnmr(400mhz,cdcl3)δ:8.54-8.50(m,1h),8.39(d,j=7.6hz,1h),8.13(s,1h),8.07(d,j=8.4hz,1h),7.75(dd,j=9.6,2.4hz,1h),7.68(t,j=7.2hz,1h),7.59(t,j=7.2hz,1h),7.53-7.48(m,1h),4.38(t,j=6.4hz,2h),3.34-3.30(m,2h),2.37-2.30(m,2h);13cnmr(100mhz,cdcl3)δ:161.2(q,j=246.9hz),161.1,159.0,143.1,129.7,129.3,128.4,126.7,126.2(q,j=7.4hz),124.9(q,j=8.7hz),123.0,121.5,119.3(q,j=23.5hz),110.2(q,j=21.4hz),63.6,31.6,26.7.hrms(esi)([m+h]+)calculatedforc17h15fno2:284.1081,found:284.1079。
实施例7
与实施例1制备方法中不同之处在于,改变反应原料1a为1g(2-异腈基-4’-三氟甲基-1,1’联苯,61.8mg),其他条件和实施例1相同。
柱层析分离(硅胶,流动相:石油醚/乙酸乙酯(9:1)),得到目标产物3g(53.4mg,产率:64%)为无色固体。
如图14、15所示,化合物3g表征如下:1hnmr(400mhz,cdcl3)δ:8.63(d,j=8.8hz,1h),8.46-8.42(m,2h),8.13(s,1h),8.10(d,j=8.0hz,1h),7.96(d,j=8.4hz,1h),7.75(td,j=8.0,1.2hz,1h),7.63(t,j=7.6hz,1h),4.40(t,j=6.0hz,2h),3.42(t,j=7.2hz,2h),2.41-2.34(m,2h);13cnmr(100mhz,cdcl3)δ:161.0,159.7,144.2,134.9,129.9,129.7,129.0(q,j=32.7hz),127.0,126.0(q,j=3.1hz),124.0(q,j=270.8hz),124.4,123.5,123.0(q,j=4.1hz),122.5,122.2,63.5,31.3,26.7.hrms(esi)([m+h]+)calculatedforc18h15f3no2:334.1049,found:334.1046。
以上实施例只是我们列举的部分实施例,用于验证该方法对不同反应底物的适用性,该方法可以实现含有不同取代基的2-联苯基异腈与四氢呋喃反应,得到不同的3-菲啶基甲酸丙酯类化合物。
实施例的产率对比表如图16所示。
从上述实施例中不难看出,本发明与现有技术比较具有以下优点:
1.采用简单、绿色的光诱导的方法实现了含有不同取代基(甲基、叔丁基、氟、氯、三氟甲基)的2-芳基异腈与四氢呋喃的反应,无需其它金属催化剂以及外加光催化剂、添加物,得到了新颖的3-菲啶基甲酸丙酯类化合物,该类化合通过核磁、高分辨质谱予以确认。
2.本发明原料易得、价格成本低廉,反应条件温和,产物容易分离,制备过程及工艺简单,易于操作。
3.本发明制备的3-菲啶基甲酸丙酯类化合物为药物活性分子的筛选提供原料来源,也为在药物和材料等方面的进一步转化奠定基础。
本发明所公开的实施例只为了解释本发明的工作过程,不是对本发明技术的限定,本领域技术人员在本发明上无创造性的改变,都在本申请的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!